-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Primárny imunodeficit v praxi pediatrického pneumológa
Primary imunodeficiency in the practice of pediatric pneumology
BCG vaccine provides the protectivity mainly against the serious disseminated forms of tuberculosis, not against the most frequent pulmonary tuberculosis. One of the reasons of canceling the BCG vaccination were complications connected with vaccination. They are divided in local, regional and disseminated and are not serious in immunocompetent people, but could be fatal in people with serious immunodeficiency. The authors observed 178 patients with BCG lymphadenitis, abscess in the vaccination site and disseminated BCG-itis.
Results:
Ther were 160 patients with BCG lymphadenitis, 17 patients with the absces in th vaccination site and 1 patient with disseminated complication. The more frequent were lymphadenitis axillaris – 85%, 74.4% had 1 or 2 enlarged or suppurative lymph nodes. Authors didn´t confirm the serious disorder in phagocytosis, in the immunoglobulins levels there were significantly lower levels of IgA in patients with complications against the healthy children. The markers of cellular imunity didn´t confirmed the serious cellular imunodeficiency, but in comparison with healthy group we found out the significantly lower levels of CD19 B-lymphocytes. In all the examinated group we had one patients with extremely high levels of IFNγ, in this patients was the homozygous mutation 523delT of the gene for IFNGR1 confirmed.Conclusion:
Most of the children with local BCG complications has no immunodeficiency, but in children with primary immunodeficiency the complication after BCG vaccination could have a fatal progression. Since we are now able to diagnose the IFNGR1 deficiency, we know to prevent one of the most serious complications..Key words:
BCG vaccination, complication after BCG vaccination, mycobacterium, primary imunodeficiency, Mendelian susceptibility to mycobacterial diseases
Autoři: M. Miškovská 1; E. Mindžáková 1; J. Fábry 1; J. Melter 1; P. Ferenc 1; T. Strachan 1; Peter Bánovčin 2
Působiště autorů: Šrobárov ústav detskej tuberkulózy a respiračných chorôb, n. o., Dolný Smokovec a Klinika detskej tuberkulózy a respiračných chorôb JLF UK a ŠÚDTaRCH, n. o., Dolný Smokovec riaditeľ MUDr. J. Fábry, PhD. 1; Klinika detí a dorastu JLF a UNM, Martin prednosta prof. MUDr. P. Bánovčin, CSc. 2
Vyšlo v časopise: Čes-slov Pediat 2015; 70 (3): 146-151.
Kategorie: Původní práce
Souhrn
BCG vakcína poskytuje ochranu najmä proti závažným hematogénne diseminovaným formám tuberkulózy, ale nie proti najčastejšie sa vyskytujúcej pľúcnej forme ochorenia. Jedným z dôvodov ukončenia BCG vakcinácie boli aj komplikácie po tomto očkovaní. Rozdeľujú sa na lokálne, regionálne a diseminované, vyskytujú sa v menej závažnej forme u imunokompetentných a v závažnej až letálnej forme u pacientov s imunodeficitom. Autori vo svojej práci sledovali 178 pacientov s BCG lymfadenitídou, s abscesom v mieste očkovania a s diseminovanou BCG-itídou.
Výsledky:
V súbore bolo 160 pacientov s lymfadenitídami, 17 pacientov s abscesmi a 1 pacient s diseminovanou BCG-itídou. V skupine lymfadenitíd najväčšie zastúpenie mali lymfadenitídy axilárne – 85 % pacientov, až 74,4 % pacientov malo postihnutú 1 alebo 2 LU. Pri sledovaní jednotlivých markerov imunity autori nepotvrdili poruchu fagocytárnej aktivity, v hodnotách imunoglobulínov bol signifikantne významný pokles IgA u pacientov s komplikáciou po očkovaní oproti zdravej kohorte. Markery celulárnej imunity nepreukázali závažný celulárny imunodeficit, ale pri porovnávaní so zdravou kohortou sme zistili signifikantne nižšie hodnoty CD19 B-lymfocytov. U jedného pacienta sme potvrdili 100-násobne zvýšené hodnoty IFNγ, následne bola potvrdená homozygotná mutácia 523delT génu IFNGR1.Záver:
Väčšina detí s lokálnou komplikáciou po BCG vakcinácii nemá potvrdenú poruchu imunity, ale u detí s primárnym imunodeficitom môže mať komplikácia po BCG vakcinácii fatálny priebeh. Nakoľko vieme diagnostikovať deficit IFNGR1, vieme predísť jednej z najťažších komplikácií.Kľúčové slová:
BCG vakcinácia, komplikácie po BCG vakcinácii, mykobaktérie, primárny imunodeficit, Mendeliánska vnímavosť voči mykobakteriálnym ochoreniamÚVOD
Tuberkulóza je chronické infekčné granulomatózne ochorenie, ktoré sa napriek celosvetovým snahám dodnes nepodarilo eradikovať v žiadnej krajine sveta. Jednou z preventívnych možností, ako bojovať proti infekčným ochoreniam, je očkovanie. Na očkovanie proti tuberkulóze sa používa vakcína vyrobená z avirulentného kmeňa Mycobacterium bovis, ktorá sa na počesť jej autorov Alberta Calmetta a Camilla Guérina označuje ako BCG vakcína.
Tak ako očkovania inými vakcínami, aj očkovanie BCG vakcínou môže byť sprevádzané komplikáciami. Rozdeľujeme ich na 2 hlavné skupiny, a to na komplikácie miestne, tie sa ďalej rozdeľujú na lokálne a regionálne, a komplikácie vzdialené, ktoré vzniknú hematogénnou disemináciou. Za komplikácie po BCG vakcinácii považujeme: absces a ulceráciu v mieste aplikácie vakcíny väčšiu ako 10 mm u novorodencov a väčšiu ako 20 mm u starších detí, zväčšené regionálne lymfatické uzliny so sklonom ku kolikvácii (1 : 200 až 1 : 2000) alebo fistulácii, keloid a podkožné granulómy v mieste aplikácie vakcíny, kožné komplikácie v mieste aplikácie vakcíny, ale aj na vzdialenejšom mieste – lupoidná reakcia a ostatné závažné menej časté komplikácie – BCG osteitída (1 : 5000 až 1 : 100 000), meningitídy, očné postihnutie, hepatosplenomegália, generalizovaná BCG-itída [1, 2, 3].
O klasifikáciu komplikácií sa pokúšalo viacero autorov, v súčasnosti sa používa klasifikácia podľa Talbota a jeho revidovaná pediatrická verzia podľa Hesselinga (tab. 1) [4]. Ako najčastejšie sa udávajú regionálne lymfadenitídy, ich incidencia je 0,5–5 %. Väčšinou bývajú postihnuté LU axilárne (85 %), supraklavikulárne (10 %) a krčné (5 %). Časový interval od BCG vakcinácie do vývoja lymfadenitídy je variabilný a pohybuje sa od 6 do 40 týždňov [5]. Osobitnú skupinu predstavujú závažné, hematogénne diseminované komplikácie po BCG vakcinácii. Sú definované prítomnosťou systémových príznakov, ktoré sú kompatibilné s mykobakteriálnou infekciou, ako horúčka ev. subfebrility, neprospievanie, a prítomnosťou infekcie na 2 alebo viacerých anatomických miestach okrem miesta vakcinácie, ako lymfatické uzliny, koža, mäkké tkanivá, pľúca, slezina, pečeň alebo kosti a kostná dreň, v prípade postihnutia hrudných LU obštrukcia dýchacích ciest [6]. Väčšinou postihuje deti do dvoch rokov veku, ale môže sa objaviť aj niekoľko rokov po BCG vakcinácii [7]. Vyžaduje sa identifikácia Mycobacterium bovis BCG kultivačne a/alebo PCR metódou, rovnako prítomnosť typických histopatologických zmien s granulomatóznym zápalom. Sú síce zriedkavé, ale môžu mať dramatický až fatálny priebeh. U týchto pacientov je nutné myslieť na možný závažný primárny imunodeficit. Ku závažným formám primárnych vrodených porúch imunitného systému patrí ťažký kombinovaný imunodeficit (SCID), kompletný Di-Georgeov syndróm, X-viazaný hyper IgM syndróm, imunodeficit kombinovaný s alebo bez anhidrotickej ektodermálnej dysplázie (NEMO), chronická granulomatóza (CGD) a hyper-IgE syndróm s rekurentnými infekciami (HIES). Títo pacienti majú vo väčšine prípadov sklon ku širokej škále rôznych infekcií. Naproti tomu stoja pacienti s izolovanou vrodenou poruchou na osi IL-12/23 – IFN γ, ktorí sú takmer výlučne náchylní ku infekciám nízko-virulentnými mykobaktériami a netyfoidnými salmonelami [8].
Tab. 1. Klasifikácia komplikácií po BCG vakcinácii – pediatrická klasifikácia navrhnutá Hesselingom. 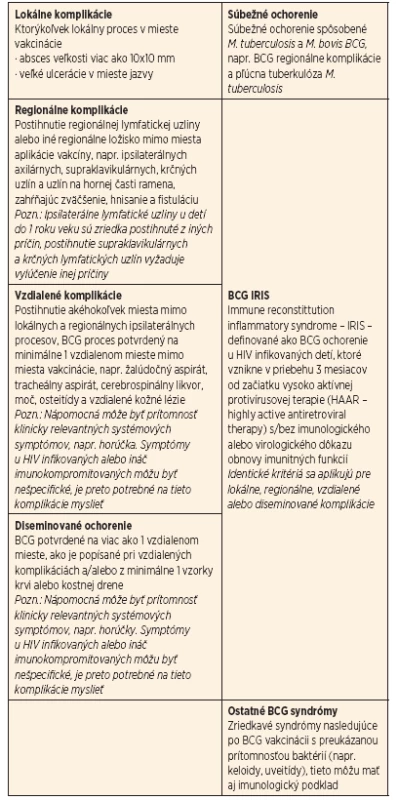
MENDELIAN SUSCEPTIBILITY TO MYCOBACTERIAL DISEASE – MSMD
Pacienti s tzv. idiopatickou BCG a infekciou environmentálnymi atypickými mykobaktériami (NTM) vo vše-obecnosti nebývajú náchylní na iné mikrobiálne infekcie okrem salmonelózy, ale objavujú sa u nich ojedinelé infekcie spôsobené intracelulárnymi patogénmi, ako sú baktérie Nocardia či Listeria, huby Paracoccidomyces či Histoplasma, parazity ako Leishmania a niektoré vírusy ako ľudský herpes virus 8 [9]. Často je pozorovaná konsangvinita rodičov a familiárne formy, preto je tento syndróm označovaný ako mendelovská vnímavosť na mykobakteriálne infekcie. Základnou príčinou ochorenia je porucha na osi IL-12/INF γ, ktorá je kritická pre obranu organizmu pred mykobakteriálnymi infekciami. Rôzne sú formy dedičnosti, najčastejší je autozomálny recesívny typ, ale pozorované sú aj autozomálny dominantný a X-viazaný typ dedičnosti [10, 11]. Vzhľadom na ich väčšinou letálny priebeh je frekvencia týchto mutácií extrémne zriedkavá – menej ako 1/1 000 000 [12]. Prvé symptómy sa vo všeobecnosti objavujú v detstve, hoci ochorenie môže progredovať až do dospelosti. Problémom je veľká zriedkavosť a veľká heterogenita ochorenia, čo sú hlavné výzvy pre správnu diagnózu, liečbu a následnú prognózu. Vo všeobecnosti môžeme povedať, že deti s tvorbou lepromatóznych granulómov – neostro ohraničených, s množstvom baktérií, bez prítomnosti epiteloidných alebo obrovských buniek – majú horšiu prognózu a umierajú na masívnu infekciu, kým deti s tuberkuloidnými granulómami – dobre ohraničenými, paucibacilárnymi s epiteloidnými a obrovskými bunkami – majú prognózu priaznivú [11]. Príčinou sú rôzne typy mutácií v piatich autozomálnych génoch: IFNGR1 a IFNGR2, ktoré kódujú 2 reťazce receptora pre interferón γ, STAT1 – signálny transduktor a aktivátor transkripcie 1, IL12B p40 a IL12RΒ1 a v jednom X-viazanom géne NEMO – nuclear factor-kB - essential modulator, ktorých výsledkom je 13 rôznych ochorení vedúcich ku narušenej interferón γ mediovanej imunite. Zastúpenie mutácií týchto génov je v poradí: IL12RB1 – 40 %, IFNGR1 – 39 %, IL12p40 – 9 %, STAT1 – 5 %, IFNGR2 – 4 %, NEMO – 3 % [8]. Podľa najnovších štúdií sa do skupiny MSMD zaraďuje aj mutácia génu IRF8 [13].
Závažnosť klinických fenotypov je závislá od genotypu. Môžeme ich rozdeliť na poruchy autozomálne recesívne (AR) a autozomálne dominantné (AD), tieto ďalej na parciálne a kompletné a na X-viazané. Parciálne autozomálne recesívne poruchy IFNGR1 a IFNGR2, kompletné autozomálne recesívne poruchy IL12RΒ1 a IL12p40 sú dobre liečiteľné antibiotikami ev. antituberkulotikami a IFNγ, kým kompletné autozomálne recesívne poruchy IFNGR1 a IFNGR2 sú veľmi ťažko liečiteľné a sú spojené s vysokou mortalitou. Hoci po antibiotickej liečbe môže dôjsť ku dobrej odpovedi, po prerušení liečby dochádza ku rýchlemu relapsu [8, 9, 10]. V súvislosti s komplikáciami po BCG vakcinácii si teda najväčšiu pozornosť zaslúži deficit receptora pre interferón γ, nakoľko u pacientov s touto poruchou je vysoké riziko mykobakteriálnych infekcií – ich prevalencia sa v tejto skupine imunodeficitov udáva až okolo 95 % [14]. Mutácie v géne pre interferón γ receptor majú vysokú (hoci nie exkluzívnu) špecificitu práve pre infekcie mykobaktériami [12]. Pacienti s kompletným AR deficitom receptora 1 a receptora 2 pre interferón γ majú ťažký klinický fenotyp s rýchlym nástupom mykobakteriálnej infekcie veľmi ťažkého priebehu, zriedkavo (menej ako 5 %) sú postihnutí salmonelovou infekciou [14]. Histologicky sú pre nich typické zle diferencované, tzv. lepromatoid-like multibacilárne granulómy s ojedinelými až žiadnymi obrovskými bunkami a lymfocytmi, ale v okolí sú početné makrofágy vyplnené acido-rezistentnými baktériami. Plazma týchto pacientov obsahuje vysoké množstvo IFNγ a ich leukocyty a fibroblasty in vitro neodpovedajú na liečbu IFNγ, nakoľko na povrchu buniek sú exprimované nefunkčné receptory [14]. V dôsledku poruchy receptora pre IFNγ vykazujú dostatočnú sekréciu IFGγ po stimulácii IL-12, ale nedostatočnú sekréciu IL-12 po stimulácii IFNγ [15]. Len zriedka dosahujú remisiu antituberkulotickou liečbou a neodpovedajú ani na exogénny IFNγ [16]. Ich prognóza je zlá a jedinou liečebnou možnosťou je transplantácia kostnej drene. Problematickými sú ale ich vysoké hodnoty IFNγ a preto si vyžadujú ich predtransplantačné zníženie, napr. liečbou interferónovými protilátkami. Z doteraz referovaných 22 pacientov s deficitom receptora 1 sa len 4 dožili 10 rokov veku, najstarší pacient mal v r. 2008 20 rokov a za sebou niekoľko mykobakteriálnych infekcií [9]. Etiologicky je kompletný autozómovo recesívny deficit receptora 1 pre interferón gamma zapríčinený mutáciami v géne IFNGR1 lokalizovanom na chromozóme 6q23-q24 a doteraz bolo popísaných 21 mutácií súvisiacich s AR deficitom IFNGR1. Jednou z nich je homozygotná delécia 523delT, ktorá zapríčiňuje poruchu v expresii receptora 1 pre IFNγ [17, 18].
Obr. 1. Rodokmeň – genealógia rodiny pacienta s potvrdeným MSMD. 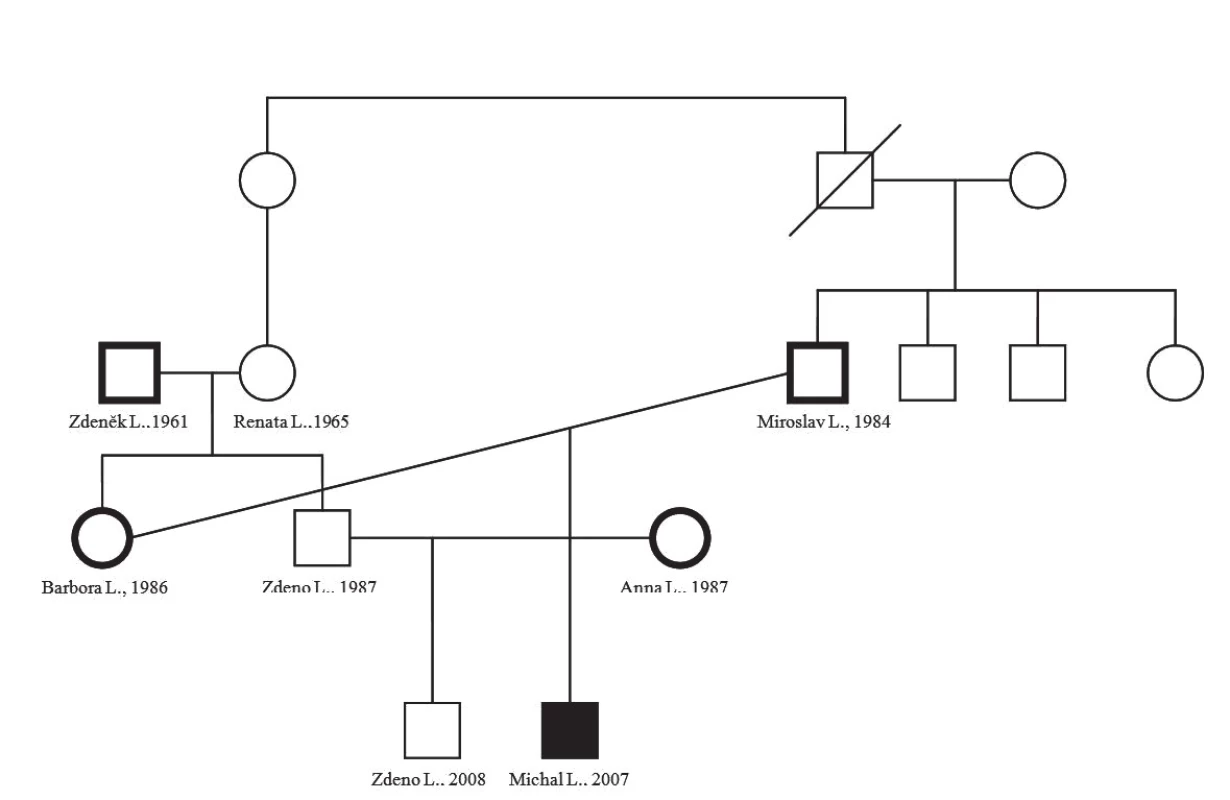
SÚBOR PACIENTOV
V našom zdravotníckom zariadení sme v čase od októbra r. 2007 do decembra r. 2013 sledovali 178 pacientov, z toho 106 chlapcov a 72 dievčat s komplikáciou, ktorá vznikla po primovakcinácii BCG vakcínou podanou v čase od 4. dňa do ukončeného 6. týždňa po narodení. Za komplikáciu bol považovaný absces v mieste očkovania väčší ako 10 mm, regionálna ipsilaterálna lymfadenitída s lymfatickými uzlinami (LU) väčšími ako 10 mm, alebo LU kolikvujúcimi bez ohľadu na ich rozmer a diseminovaná BCG-itída. Kontrolnú skupinu tvorilo 24 zdravých detí očkovaných BCG vakcínou v novorodeneckom veku bez vývoja komplikácie po očkovaní.
Po rozdelení podľa typu komplikácie bolo v súbore 160 pacientov s BCG lymfadenitídou, 17 s abscesom v mieste očkovania a u 1 pacienta bola potvrdená diseminovaná BCG-itída, priemerný vek pacienta bol 163,5 dňa. Až 85 % pacientov s post BCG lymfadenitídou malo postihnuté ľavostranné axilárne LU, 4,38 % malo postihnutie supraklavikulárnych LU, v 10 % sme pozorovali kombinované postihnutie axilárnych aj supraklavikulárnych LU. Len u 1 pacienta boli postihnuté krčné LU. Najčastejšie boli prítomné 2 zväčšené LU – u 63 pacientov (39,4 %), druhú najčastejšiu skupinu tvorili pacienti s 1 zväčšenou LU – 56 (35 %) detí. Laboratórne sme zisťovali prítomnosť porúch imunity. Poruchu fagocytárnej aktivity sme nepotvrdili ani u jedného z našich pacientov. Vyšetrením humorálnej imunity meraním IgA, IgM a IgG sme zistili, že vo všetkých triedach imunoglobulínov u približne jednej tretiny pacientov boli pozorované znížené hodnoty v porovnaní s referenčným rozmedzím. Štatistickým rozborom sme však nepotvrdili signifikantné rozdiely medzi jednotlivými skupinami pacientov, ale v porovnaní s kohortou zdravých detí bol potvrdený významne signifikantný rozdiel v zmysle znížených hodnôt IgA v skupine pacientov s komplikáciou po BCG vakcinácii (p = 0,0001).
Ďalšími zisťovanými parametrami boli hodnoty CD markerov lymfocytov – CD3, CD4 a CD 8 T-lymfocytov, CD16 NK buniek a CD19 B-lymfocytov ako základných parametrov celulárnej imunity. U prevažnej väčšiny pacientov sme pozorovali tieto hodnoty v medziach normy alebo mierne zvýšené, len v malej skupine pacientov boli pozorované mierne poklesy v jednotlivých mar-kerov – išlo o ľahké poruchy celulárnej imunity, ktoré si nevyžiadali imunomodulačnú liečbu a pacienti nemali iné klinické príznaky, ako napr. častejšie infekty dýchacích ciest. Pri porovnaní so zdravou kohortou sme však zistili signifikantne nižšie hodnoty CD19 B-lymfocytov s p = 0,0089 oproti kohorte zdravých. Najzávažnejšie, život ohrozujúce komplikácie sa vyskytujú u pacientov s poruchami na úrovni IFNγ. Priemerná hodnota celého súboru bola 15,85 pg/ml (referenčné hodnoty 3,40–22,70 pg/ml), v skupine pacientov s BCG lymfadenitídou 16,36 pg/ml a v skupine pacientov s abscemi v mieste očkovania 11,05 pg/ml. Očakávali sme štatisticky signifikantne vyššie zastúpenie pacientov so zvýšenými hodnotami IFNγ, čo sa však nepotvrdilo.
V rámci tohto súboru sme zachytili jedného pacienta s klinickým obrazom diseminovanej BCG-itídy. Dieťa bolo zaočkované BCG vakcínou 4. deň po narodení, pričom v priebehu 2 mesiacov došlo ku rozvoju ipsilaterálnej axilárnej lymfadenitídy s kolikváciou LU a exstirpáciou LU – kultivačne potvrdený Mycobacterium bovis BCG. Dieťa bolo ešte mesiac po operačnom výkone liečené izoniazidom, po ukončení tejto liečby sa objavili výrazné bolesti bruška a febrility. Potvrdené boli mnohopočetné cysty sleziny. Ochorenie postupne progredovalo – napriek širokospektrálnej a opakovane revidovanej antibiotickej liečbe pretrvávali všetky klinické aj laboratórne známky sepsy, gamagrafia skeletu bez patologického nálezu, punkcia kostnej drene bez nálezu svedčiaceho pre nádorové ochorenie, preto bola zrealizovaná splenektómia. Histologicky nález hodnotený ako akútne hnisavé zápalové absedujúce zmeny, výraznejšia aktivácia červenej pulpy, v híle chronické hnisavé a fibroproduktívne zápalové zmeny bez nálezu granulomatózneho procesu. Napriek splenektómii nedošlo ku očakávanému zlepšeniu klinického stavu a následne došlo ku recidíve ľavostrannej axilárnej lymfadenopatie s kolikváciou LU. Prítomný bol aj obraz uveitídy, kožný bližšie nešpecifikovaný exantém. Ordinovaná bola liečba antituberkulotikami, ktorá viedla v krátkom čase ku výraznému zlepšeniu klinického stavu a poklesu zápalových parametrov. Laboratórne v úvodných výsledkoch dieťaťa boli výsledky typické pre septické ochorenie, aj po úprave klinického stavu a splenektómii však laboratórne pretrváva výrazná leukocytóza od 17,40 do 33,70 tis/µl, eozinofília až leukemoidného charakteru od 1949 do 9241 abs. poc./µl, trombocytóza od 694 do 1182 tis/µl. Hodnoty celulárnej imunity s aktiváciou jednotlivých CD markerov, vyšetrením imunoglobulínov zvýšené hodnoty IgG ale bez preukázaného očakávaného imunodeficitu. Hodnoty fagocytárnej aktivity, fagocytárneho indexu či NBT testu boli v norme. Na základe priebehu ochorenia bola suponovaná porucha receptora pre IFNγ, preto bol realizovaný odber s nálezom stonásobne vyšších hodnôt IFNγ – 2393,40 pg/ml. Pre vysoké podozrenie na MSMD sme pokračovali v liečbe antituberkulotikami do celkovej doby 18 mesiacov pri veľmi dobrom klinickom stave pacienta a poklese hodnôt IFNγ. Po ukončení liečby došlo v priebehu 3 týždňov ku relapsu ochorenia s klinickým obrazom osteomyelitídy sánky, po opätovnom nasadení liečby došlo ku promptnej úprave stavu v priebehu 7 dní. Pacient pokračoval v liečbe 3-kombináciou antituberkulotík a prekonával len ľahké ochorenia dýchacích ciest typické pre predškolský vek. Po 2 rokoch došlo napriek pokračujúcej liečbe ku bolestiam v kolenných kĺboch a driekovej časti chrbtice, k rozvoju septického stavu s potvrdením mnohopočetnej osteomyelitídy na kostiach dolných končatín aj chrbtice pozitrónovou emisnou tomografiou (PET). Až po nasadení 6-kombinácie antituberkulotík a antibiotík v ma-ximálnych možných dávkach došlo ku úprave stavu, po 7 mesiacoch ku normalizácii CRP, po 10 mesiacoch ku regresii zmien na PET.
U pacienta bola vo februári 2010 v Laboratory of Human Genetics of Infectious Diseases v Paríži prof. Jean-Laurent Casanovom, MD, PhD, prezidentom European Society for Immunodeficiencies, potvrdená homozygotná mutácia v exóne 4 pre IFNGR1, 523delT, potvrdzujúca kompletnú deficienciu ligand viažúcej časti receptora pre IFNγ a tým diagnostikovaná MSMD – autozómovo recesívna kompletná deficiencia IFNGR1 receptoru pre INFγ. Na základe tohto výsledku a vďaka možnosti odobrať vzorku biologického materiálu probandovi bola v našom laboratóriu nastavená diagnostika tejto mutácie a následne realizovaná analýza 88 pacientov súboru, pričom u žiadneho sa nám nepodarilo potvrdiť prítomnosť tejto mutácie. Je známe, že MSMD sú ochorenia vyskytujúce sa často v konsangvinných vzťahoch, čo sa potvrdilo aj v tejto rodine – matkina stará matka a otcov otec boli súrodenci. V oboch rodinách boli potvrdené viacpočetné úmrtia malých detí z neznámych príčin. Z rodiny sa nám podarilo vyšetriť pacienta, u ktorého sme potvrdili homozygotnú mutáciu 523delT, oboch rodičov, ktorí sú nositeľmi mutácie, ďalším nositeľom je aj otec pacientovej matky a zaujímavým zistením bolo potvrdenie homozygotnej mutácie u manželky matkinho brata, u ktorej sa nám zatiaľ nepodarilo potvrdiť konsangvinný vzťah ku probandovej rodine a pravdepodobne pôjde o ďalšiu rodinu s nosičstvom tejto mutácie (obr. 1).
Vyšetrení rodinní príslušníci, ktorí sú nosičmi heterozygotnej mutácie, sú všetci zdraví, boli očkovaní proti tuberkulóze BCG vakcínou bez toho, aby u nich vznikli akékoľvek postvakcinačné komplikácie.
DISKUSIA
BCG vakcína sa začala rutinne používať od 60. rokov minulého storočia takmer vo všetkých krajinách sveta a doteraz boli zaočkované cca 4 bilióny ľudí. Považuje sa za pomerne bezpečnú, lokálne abscesy, ulcerácie a lymfadenitídy majú vo všeobecnosti nízky výskyt, ktorý sa udáva v 0,4/1000 podaných vakcín. Diseminované BCG-itídy sú ešte zriedkavejšie a ich výskyt sa odhaduje na 1–3,4/1 000 000 podaných vakcín [19]. Najčastejšie sú regionálne a miestne komplikácie, ktoré tvorili aj takmer celú časť nášho súboru a v súlade s literárnymi údajmi [5] aj u nás boli najfrekventnejšie axilárne lymfadenitídy – 85 %. Komplikácie po BCG vakcinácii charakteru závažných vzdialených a diseminovaných foriem sa vyskytujú hlavne u pacientov s poruchami imunity.
V našom súbore sme v skupine pacientov s BCG lymfadenitídami a abscesmi nepotvrdili poruchu v oblasti fagocytárnej aktivity a humorálnej imunity. Samileh vo svojom pozorovaní udáva výskyt ľahkej lymfopénie a signifikantne nižšie hodnoty CD3 T-lymfocytov, CD8 T-supresorov, CD19 B-lymfocytov a CD16 NK buniek. Hodnoty lymfocytov detí v našom súbore boli v referenčnom rozmedzí, rozborom CD markerov v porovnaní so zdravou kohortou sme však zistili signifikantne nižšie hodnoty CD19 B-lymfocytov s p = 0,0089 a hranične signifikantne nižšie hodnoty CD16 NK buniek s p = 0,051. Deficit NK buniek doteraz nebol popisovaný ako rizikový faktor pre rozvoj komplikácie po BCG vakcinácii, ale faktom je, že NK bunky spolu s Th1-lymfocytmi regulované IL 12 v obrane proti tuberkulóze produkujú IFNγ. IFNγ sa zdá byť kľúčovým momentom v obranyschopnosti proti mykobaktériám. V našom súbore pacientov malo len 21,47 % mierne zvýšené hodnoty IFNγ, u nich išlo o nekomplikovaný priebeh lokálnej komplikácie, u jedného pacienta boli zachytené stonásobne zvýšené hodnoty, pričom klinicky išlo o diseminovanú BCG-itídu a bol u neho potvrdený primárny imunodeficit typu MSMD – deficit ligand viažúcej časti receptora 1 pre IFNγ – mutácia 523delT. Diagnostika bola realizovaná v laboratóriu profesora Casanovu vo Francúzku a my sme na základe výsledku a materiálu od probanda na-stavili diagnostiku a začali s diagnostikou tohto vzácneho imunodeficitu ako jediní na Slovensku a pokiaľ máme správne informácie, takáto diagnostika sa nerealizuje ani v Čechách či susednom Poľsku.
ZÁVER
Denným problémom v našej ambulancii boli v čase plošného používania BCG vakcíny aj komplikácie po očkovaní. Našťastie vo väčšine prípadov išlo o komplikácie lokálne, neohrozujúce pacientov na živote. Avšak u pacienta s primárnym imonodeficitom mal priebeh post BCG-komplikácie podstatne závažnejší a komplikovanejší charakter. Náš malý pacient je v trvalej antituberkulotickej liečbe, má 6,5 roka a prognózu nepriaznivú. Transplantácia kostnej drene je v jeho prípade pre stálu prítomnosť pomerne vysokých hodnôt IFNγ v sére komplikovaná a pre jej neistý výsledok s ňou rodičia nesúhlasia. V anamnéze rodiny je viacero úmrtí malých detí z neznámej príčiny. Ak by bola táto diagnostika u nás dostupná v čase narodenia nášho pacienta a na možnosť primárneho imunodeficitu by sa pred jeho zaočkovaním myslelo, možno by jeho šance na život boli podstatne vyššie.
Došlo: 26.2. 2015
Přijato: 3.3. 2015
MUDr. Martina Miškovská
Šrobárov ústav DTaRCH, n.o.
Klinika detskej tuberkulózy a respiračných chorôb JLF UK a ŠÚDTaRCH
059 81 Dolný Smokovec
Slovenská republika
e-mail: miskovska@sudtarch.sk
Zdroje
1. Křepela K. BCG vakcinace a tuberkulinový test. Indikace, kontraindikace, komplikace. Čes-slov Pediat 2002; 5 : 223–228.
2. Křepela K. Problematika dětské tuberkulózy a BCG vakcinace. Pediatrie po promoci 2004; 3-4 : 55–59.
3. Muntau AC. Očkování. In: Pediatrie. 4. dopl. vyd. Praha: Grada, 2009.
4. Hesseling AC, Rabie H, Marais BJ, et al. Bacille Calmette-Guérin vaccine-induced disease in HIV–infected and HIV–uninfected children. Clin Infect Dis 2006; 4 : 548–558. doi:10.1086/499953.
5. Mihál V, Michálková K, Dušková M, et al. Mnohočetná axilární lymfadenopatie jako projev BCG vakcinace. Pediatrie pro praxi 2003; 3 : 137–139.
6. Nosáľ S, Šutovská M, Nosáľová G, et al. Age-dependent changes of airway obstruction parameters. J Physiol Pharmacol 2007; Suppl 5 : 493–500.
7. Alborzi A, Mostafavi N. Retroperitoneal abscess due to disseminated bacille Calmette-Guérin infection. Jpn J Infect Dis 2007; 60 : 392–393.
8. Lee WI, Huang JL, Yeh KW, et al. Immune defects in active mycobacterial diseases in patient with primary immunodeficiency diseases (PIDs). J Formos Med Assoc 2011; 12 : 750–758. [online]. Dostupné na internete: http://www.jfma-online.com/article/S0929-6646(11)00129-X/fulltext.
9. Al-Muhsen S, Casanova JL. The genetic heterogeneity of mendelian susceptibility to mycobacterial disease. J Allergy Clin Immunol 2008; 6 : 1043–1051.
10. Casanova JL. Mendelian susceptibility to mycobacterial infection in man. Swiss Med Wkly 2001; 131 : 445–454.
11. Casanova JL. Mendelian Susceptibility to Mycobacterial Infection. Orphanet Encyclopedia. September 2003. [online]. Dostupné na internete: http://www.orpha.net/data/patho/GB/uk-bcgite.pdf.
12. Qu HQ, Fischer-Hoch SP, McCormick JB. Molecular immunity to mycobacteria: knowledge from the mutation and phenotype spectrum analysis of Mendelian susceptibility to mycobacterial diseases. Int J Infect Dis 2011; 5 : 305–313.
13. Salem S, Gros P. Genetic determinants of susceptibility to mycobacterial infections: IRF8, a new kid on the block. Adv Exp Med Biol 2013; 783 : 45–80.
14. Glosli H, Stray-Pedersen A, Brun AC, et al. Infections due to various atypical mycobacteriain a Norvegian multiplex family with dominant interferon-gamma receptor deficiency. Clin Infect Dis 2008; 3: C23–C27.
15. Wang LH, Yen CL, Chang TC, et al. Impact of molecular diagnosis on treating Mendelian susceptibility to mycobacterial diseases. J Microbiol Immunol Infect 2012; 6 : 411–417.
16. Fieschi C, Bosticardo M, De Beaucoudrey L, et al. A novel form of complete IL-12/IL-23 receptor {beta}1 deficiency with cell surface-expressed nonfunctional receptors. Blood 2004; 104 : 2095–2101.
17. Filipe-Santos O, Bustamante J, Chapgier A, et al. Inborn errors of IL-12/23 - and IFN-gamma-mediated immunity: molecular, cellular, and clinical features. Semin Immunol 2006; 18 : 347–361.
18. Koscielnak E, de Boer T, Naumann L, et al. Disseminated Mycobacterium peregrinum infection in a child with complete IFNgR1 deficiency. Pediatr Infect Dis J. 2003; 2 : 378–380.
19. Huang LH, Shyur SD, Weng JD, et al. Disseminated bacille Calmette Guérin disease as the initial presentation of X-linked severe combinde immunodeficiency – A case report. Asian Pacific Journal Allergy Immunology 2005; 23 : 221–226.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2015 Číslo 3- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficitmi v reálnej praxi
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
-
Všetky články tohto čísla
- Přínos sonografického vyšetření v diagnostice akutní apendicitidy
- Segmentální dilatace střeva – prezentace souboru novorozenců se segmentální dilatací tenkého střeva a přehled literatury
- Primárny imunodeficit v praxi pediatrického pneumológa
- Lehká mentální retardace v ambulanci dětského lékaře – poznáte ji?
- Pozdní záchyt syndromu kaudální regrese u dítěte s extrémně nízkou porodní hmotností
- Preventivní vyšetření sportovců se zaměřením na klidové EKG
- Krční uzlinový syndrom z pohledu otorinolaryngologa
- Současné možnosti terapie juvenilní recidivující respirační papilomatózy
- Jednofotonová emisní tomografie při diagnostice lingvální ektopie štítné žlázy. Užití u novorozence s kongenitální hypotyreózou
- Diferenciální diagnostika proteinurie
- Diferenciální diagnostika hematurie
- Cushingův syndrom v dětském věku
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Krční uzlinový syndrom z pohledu otorinolaryngologa
- Diferenciální diagnostika proteinurie
- Diferenciální diagnostika hematurie
- Lehká mentální retardace v ambulanci dětského lékaře – poznáte ji?
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



