-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Zevně sekretorická insuficience pankreatu u dětí se syndromem horní mezenteriální arterie – Wilkieho syndrom: následné ovlivnění metodou chirurgického zákroku
Pancreatic exocrine insufficiency in superior artery mesenteric syndrome – Wilkie syndrome: rationale and practical considerations on exocrine dysfunction after surgical attacks
Superior mesenteric artery (SMA) syndrome is an uncommon cause of upper bowel obstruction. SMA syndrome is linked to unspecific upper digestive symptomps. The main point of this research is the presence of exocrine pancreatic insufficiency (EPI) linked to SMA syndrome assessed by fecal elastase-1. EPI was proposed as the underlying pathogenesis, thus this group of children necessitates routine screening for pancreatic dysfunction.
There are several types of appropriate therapeutic options and the patophysiological aspects of the changes on EPI after surgical approaches were discussed. We suggest that SMA syndrome must be considerd as a new cause of exocrine pancreatic dysfunction.Key words:
superior mesenteric artery syndrome, exocrine pancreatic dysfunction, fecal elastase-1, operation
Autoři: R. Petro 1; T. Malý 2; S. Kupková 3; K. Veselská 4; J. Schwarz 5; R. Pomahačová 5; M. Kreslová 5; A. Masopustová 5; M. Huml 5; J. Sýkora 5
Působiště autorů: Ambulance pro dětskou gastroenterologii, Nemocnice Karviná 1; Chirurgická klinika FN, Lékařská fakulta Univerzity Palackého, Olomouc 2; Radiologické oddělení, Nemocnice Karviná-Ráj 3; Ordinace praktického lékaře pro děti a dorost, Petrovice u Karviné 4; Dětská klinika, Univerzita Karlova, Lékařská fakulta v Plzni, Fakultní nemocnice, Plzeň 5
Vyšlo v časopise: Čes-slov Pediat 2017; 72 (8): 478-488.
Kategorie: Kazuistika
Souhrn
Syndrom horní mezenteriální arterie je vzácné onemocnění charakterizované horní střevní obstrukcí v důsledku komprese duodena aortou a horní mezenteriální arterií. Symptomy jsou netypické a diagnostika je založena převážně na zobrazovacích metodách. U obou pacientů byla zcela poprvé prokázána pomocí elastázy-1 ve stolici také exokrinní insuficience pankreatu.
Autoři diskutují různé typy chirurgických zákroků a pankreatické substituce ve vztahu k exokrinní dysfunkci. V případě chirurgické terapie je žádoucí zvolit operační postup co nejméně zasahující do kontinuity duodena a integrity mezoduodena. Syndrom horní mezenteriální arterie představuje diferenciálně diagnosticky novou dosud nepopsanou příčinu exokrinní nedostatečnosti pankreatu.Klíčová slova:
syndrom horní mezenteriální arterie, exokrinní insuficience pankreatu, fekální elastáza-1, operaceÚVOD
Syndrom horní mezenteriální arterie (SMAS, Wilkieho syndrom) [1] je vzácný syndrom charakterizovaný kompresí duodena mezi břišní aortou a horní mezenterickou arterií (SMA) projevující se klinickými známkami horní střevní obstrukce [2] (obr. 1). SMAS byl poprvé popsán rakouským profesorem českého původu Rokitanským v roce 1842 [1, 3], několik případů bylo popsáno i v českém písemnictví [4–7]. Nejčastěji se vyskytuje u dospívajících a mladých dospělých [8], ale může se objevit v kterémkoliv věku včetně kojenců [9]. Prevalence se pouze odhaduje od 0,13 do 0,3 % [8], v České republice však data u dětí nejsou dostupná.
Obr. 1. Schematické znázornění abnormální morfologie syndromu horní mezenteriální arterie. Fig. 1. Abnormal morphology in superior mesenteric artery syndrome. 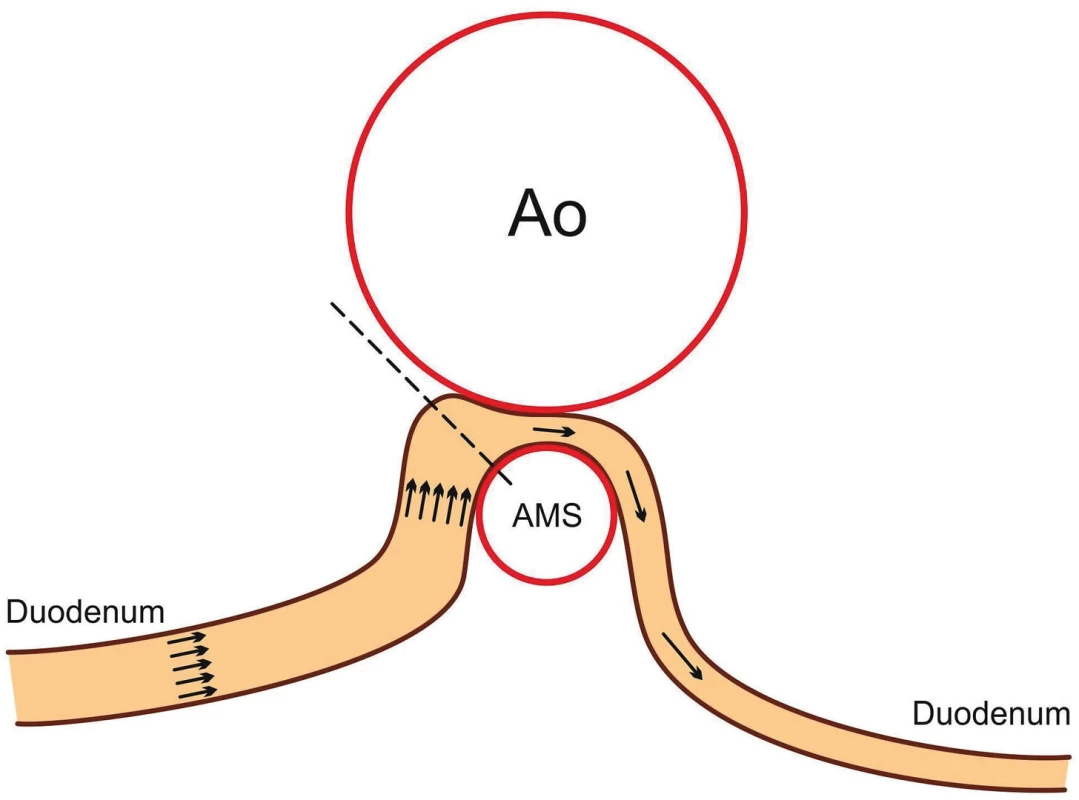
Etiologické faktory mohou být získané, nebo vrozené. SMAS byl popsán v souvislosti s mentální anorexií [10], rychlým růstem do výšky bez současného vzestupu hmotnosti [11], ortopedickými korekcemi spinálních deformit (aplikace tělových korzetů) [12], velkými nitrobřišními operacemi (kolektomie s ileorektální anastomózou), cerebrálními poraněními [13], kachexií různého původu (popáleniny, kardiální choroby) a závažnými poruchami příjmu stravy a váhovým úbytkem. SMAS byl nalezen u různých forem plegie (paraplegie, tetraplegie) po traumatu míchy bud časně po poranění, nebo během intenzivního rehabilitačního programu [14, 15]. Predisponujícím faktorem také může být vaskulární kalcifikace SMA a aorty u pacientů v hemodialyzačním programu [16]. Rizikovým faktorem je také rychlý růst u adolescentů [5]. SMAS byl nedávno popsán u 15letého hocha s rychlým poklesem hmotnosti, který se poprvé zúčastnil postního měsíce ramadánu [17]. Vrozené anomálie zahrnují abnormálně nízký odstup SMA a/nebo vysokou polohu Treitzova ligamenta dislokující duodenum proximálně [18].
Cílem sdělení je prezentovat dvě děti se SMAS a současnou exokrinní insuficiencí pankreatu (EIP), v literatuře dosud nikdy nepopsanou, operované dvěma odlišnými chirurgickými přístupy, z nichž oba byly klinicky úspěšné. Současně diskutujeme léčebné možnosti a principy zvolené operační techniky ve vztahu k exokrinní dysfunkci.
KAZUISTIKA 1
První pacient je 9letý chlapec, narozený z fyziologické gravidity ve 38. týdnu, porodní hmotnost 2700 g, délka 48 cm, porod císařským řezem pro patologickou polohu plodu, poporodní adaptace normální. Od listopadu 2012 se objevily opakovaně závažné bolesti břicha po jídle a nechutenství. Od listopadu 2012 do srpna 2013 byla zaznamenána ztráta tělesné hmotnosti o 15 kg. Mikrobiologické, parazitologické a virologické vyšetření stolice bylo negativní včetně klostridiového toxinu. Negativní jsou i testy na Coxsackie viry, EB virus a CMV, enteroviry, skupinu herpes simplex viry a virus varicella-zoster. Biochemické vyšetření včetně pankreatických enzymů bylo normální. Sérologické parametry idiopatických střevních zánětů (ISZ) byly negativní. Molekulárně genetické vyšetření prokázalo mutaci 13910 TC a 22018 AG v LCT genu svědčící pro adultní formu intolerance laktózy.
Gastrofibroskopie (2013) zjistila ezofagitidu prvého stupně a Helicobacter pylori (H. pylori) negativní chronickou gastritidu. Stanovení aktivity pankreatické elastázy-1 ve stolici (FE-1) (ELISA, monoklonální protilátky) opakovaně prokázalo nízké hodnoty od 8 do 37 µg/g stolice (normální funkce >200 µg/g stolice) svědčící pro těžkou EIP. Stanovení chloridů v potu bylo v mezích normy a současně bylo vyloučeno 36 nejčastějších mutací asociovaných s cystickou fibrózou (CF). Genetické vyšetření vyloučilo mutace v genech SPINK1 a PRSS1 typické pro hereditární pankreatitidy. Klinický genetik nezjistil symptomy Shwachmanova-Diamondova a Johanssonova-Blizzardova syndromu. Symptomatická antisekreční a prokinetická léčba včetně vyloučení výrobků obsahujících laktózu vedla pouze k přechodnému ústupu obtíží. Pankreatická substituce nevedla ke zlepšení a byla pacientem špatně tolerována. 24hodinová pH-metrie prokázala signifikantně zvýšenou kyselou refluxní aktivitu významně korelující se subjektivními příznaky. Dynamická scintigrafie evakuace žaludku (99mTc-DTPA) zobrazila extrémně zpomalenou evakuaci žaludku. CT angiografie potvrzuje kompresi duodena horní mezenteriální arterií plně ve shodě se SMAS (úhel odstupu SMA jen 19,8° a prostor pro duodenum v aorto-mezenterickém úhlu je pod 6 mm) (obr. 2, 3).
Obr. 2. CT angiografie ukazující nápadné snížení úhlu mezi aortou a horní mezenteriální arterií u pacienta 1 (19,8°). (Obrazový materiál Oddělení radiologie Nemocnice Karviná, MUDr. Kupková). Fig. 2. CT angiography showing signifiant narrowing of the angle between the abdominal aorta and the superior mesenteric artery (measuring 19.8°) (case report one). 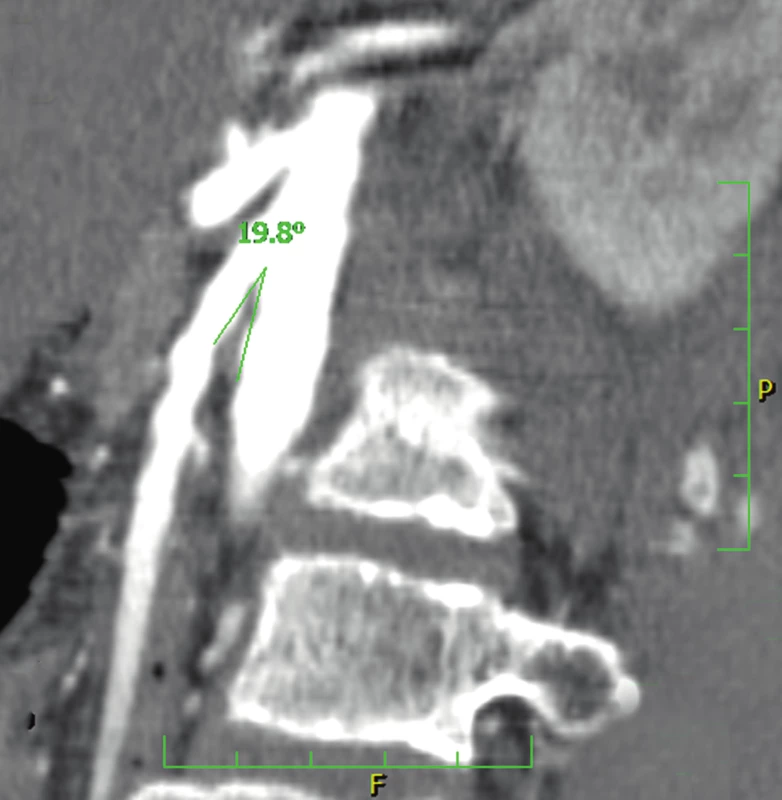
Obr. 3. CT angiografie ukazující nápadné snížení vzdálenosti mezi aortou a horní mezenteriální arterií asi 6 mm u pacienta 1. (Obrazový materiál Oddělení radiologie Nemocnice Karviná, MUDr. Kupková). Fig. 3. CT angiography showing the reduction of aortomesenteric distance measuring about 6 mm (case report one). 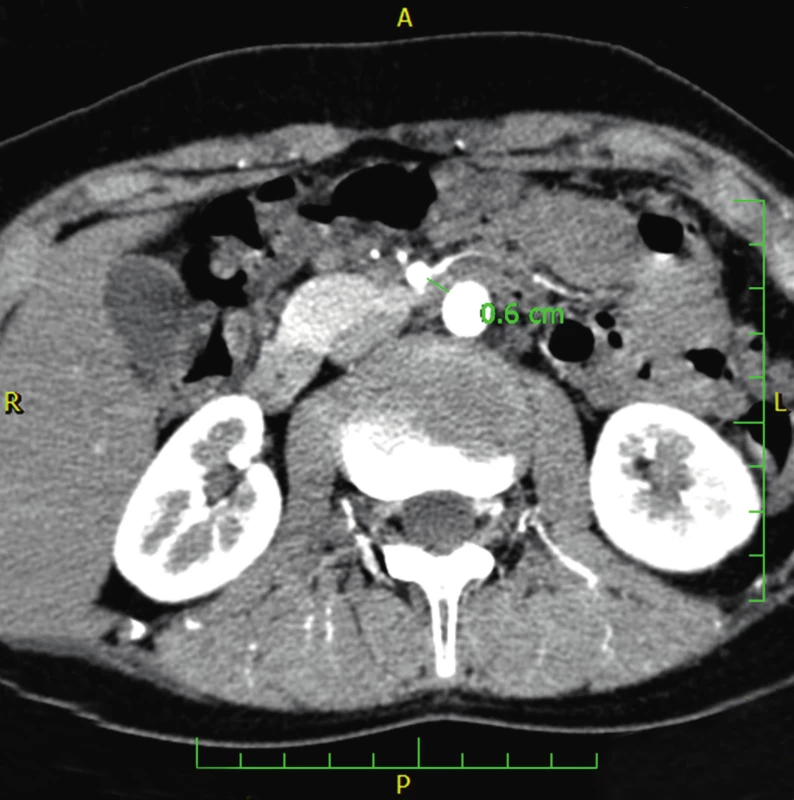
Operační zákrok byl proveden (1/2014) pomocí duodeno-duodeno anastomózy (DDA) side-to-side bez přerušení longitudinální kontinuity duodena (obr. 4). Pooperační průběh byl bez komplikací a během následných 7 měsíců došlo k vzestupu tělesné hmotnosti cca o 13 kg. Hodnoty FE-1 v pooperačním období porovnávané s hodnotami před operací se již plně normalizovaly (331 – opakovaně přes 500 µg/g stolice, naposledy v květnu 2017). Kontrolní endoskopie v červenci 2017 prokazuje plně prostornou anastomózu bez známek zánětu či stagnace.
Obr. 4. Schematické znázornění – duodeno-duodeno anastomóza side-to-side. Fig. 4. Morphology of duodeno-duodeno anastomosis side-to-side. 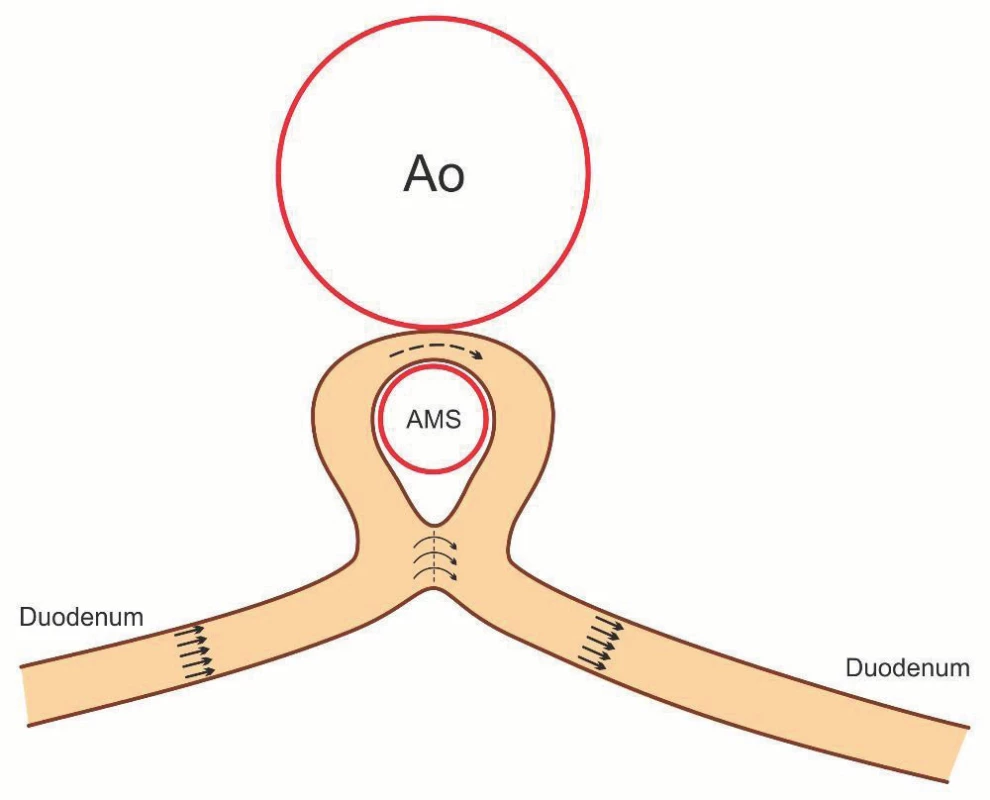
KAZUISTIKA 2
Jde o 16letou pacientku – narozena z fyziologické gravidity ve 38. týdnu, porod vaginální, záhlavím, normální poporodní adaptace, porodní hmotnost 3500 g, délka 51 cm. V lednu 2014 se objevují obtíže typu bolestí břicha v epigastriu a zvracení hlavně po jídle. Začátkem října 2014 se bolesti břicha znovu manifestují při současně dobré chuti k jídlu, pacientka však opakovaně po každém jídle zvrací. Biochemické parametry včetně protilátek proti tkáňové transglutamináze byly negativní. Gastrofibroskopie prokazuje chronickou H. pylori pozitivní gastritidu bez dalších makroskopických patologických změn, bez patologie je rovněž abdominální ultrasonografie. Pacientka prodělala standardní eradikační léčbu (trojkombinace inhibitory protonové pumpy, ampicilin a klaritromycin), po které došlo k přechodnému vymizení symptomů. CT angiografie horní mezenterické arterie zobrazuje úhel odstupu arterie od aorty 40°, prostor pro duodenum v aorto-mezenterickém úhlu byl však významně snížen na 7 mm. Pasáž horní etáží GIT prokazuje stagnaci kontrastní látky v oblasti D3. Následné ultrazvukové vyšetření břicha prokazuje úhel odstupu SMA od aorty 20–21 stupňů a prostor pro duodenum v aorto-mezenterickém úhlu je široký 6 mm. Kontrolní endoskopie horní části GIT neprokázala známky svědčící pro zevní kompresi duodena. Kontrolní kontrastní vyšetření GIT neprokazuje v tomto období stagnaci kontrastní látky, duodenum se plní obvyklým způsobem a má přiměřený reliéf a peristaltiku.
Po 13 měsících se opět objevuje zvracení po jídle a bolesti břicha. CT angiografie zobrazuje úhel odstupu SMA již jen 15° a prostor pro duodenum v aorto-mezenterickém úhlu 6–7 mm (obr. 5, 6). Dynamická scintigrafie evakuace žaludku prokazuje překvapivě zrychlené vyprazdňování. CT angiografické vyšetření již jednoznačně splňuje kritéria pro SMAS. FE-1 má také opakovaně velmi nízkou aktivitu (od 56 do 146 µg/g stolice), současně byly vyloučeny analogicky jako v prvém případě obvyklé příčiny zevní insuficience pankreatu.
Obr. 5. CT angiografie ukazující zjevné snížení úhlu mezi aortou a horní mezenteriální arterií u pacienta 2 (15°). (Obrazový materiál Oddělení radiologie Nemocnice Karviná, MUDr. Kupková). Fig. 5. CT angiography showing signifiant narrowing of the angle between the abdominal aorta and the superior mesenteric artery (measuring 15°) (case report two). 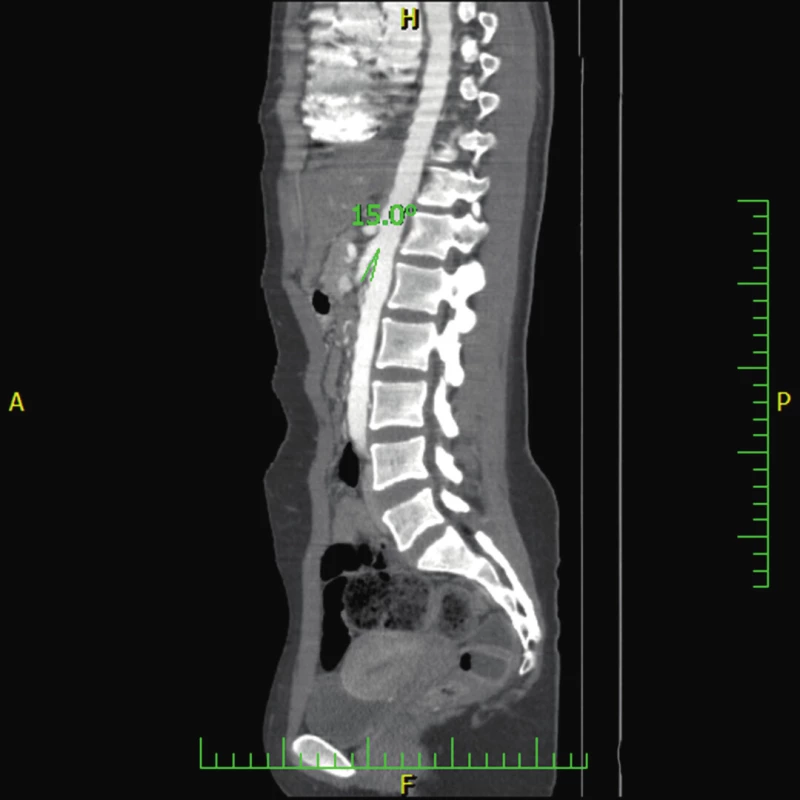
Obr. 6. CT angiografie ukazující zjevné snížení vzdálenosti mezi aortou a horní mezenteriální arterií pod 7 mm u pacienta 2. (Obrazový materiál Oddělení radiologie Nemocnice Karviná, MUDr. Kupková). Fig. 6. CT angiography showing the reduction of aortomesenteric distance measuring about 7 mm (case report two). 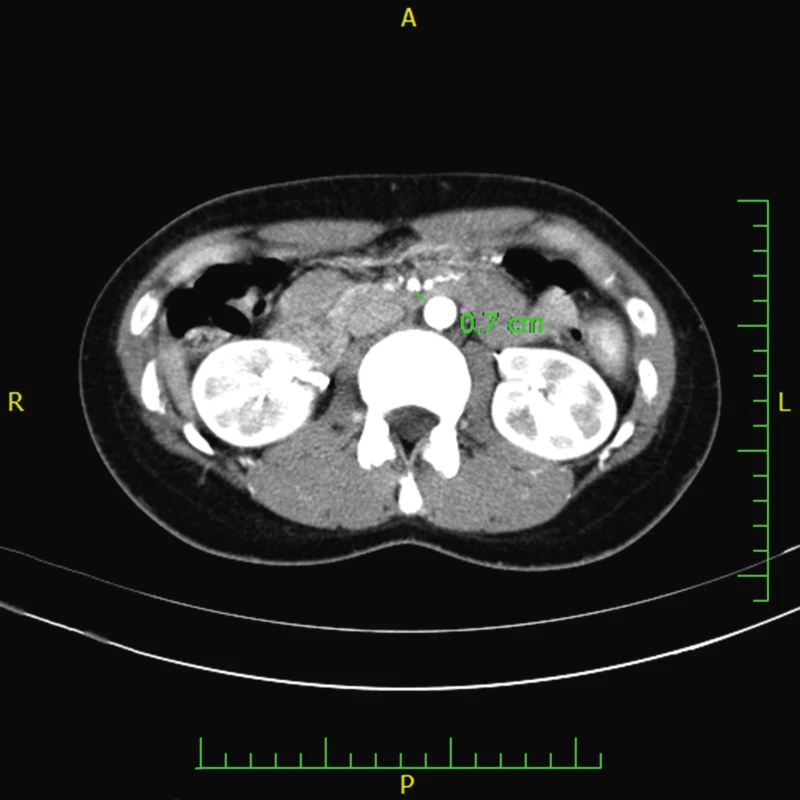
Byl proveden operační zákrok (3/2016), byla opět zvolena DDA, tentokrát však typu end-to-end s protětím duodena, s jeho deliberací v rozsahu D3–D4 a antepozicí před SMA (obr. 7). Peroperační gastrofibroskopie prokázala zúžení lumen duodena v místě křížení se SMA a dilataci duodena orálně od komprimovaného místa. Operatér potvrzuje shodné nálezy v průběhu chirurgického zákroku. V následném pooperačním období je pacientka bez obtíží, dochází k vzestupu hmotnosti s výbornou chutí k jídlu. V hodnotách FE-1 v pooperačním období došlo k dalšímu poklesu a hodnoty jsou opakovaně překvapivě stále extrémně nízké (11–26 µg/g stolice) v období sedmi měsíců po operaci. Pasáž horní částí GIT je 2 týdny po operaci zcela normální bez známek obstrukce. Souhrnně jsou údaje obou pacientů uvedeny v tabulce 1.
Tab. 1. Demografická a klinická charakteristika souboru dětí se syndromem horní mezenteriální arterie. 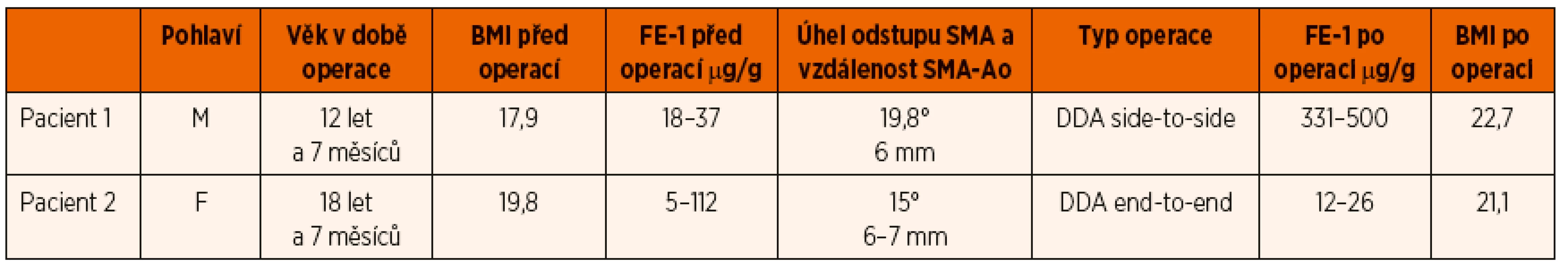
Vysvětlivky zkratek: BMI – body mass index, FE-1 – stanovení aktivity elastázy-1 ve stolici, SMA – horní mezenteriální arterie, Ao – aorta, DDA – duodeno-duodeno anastomóza Obr. 7. Schematické znázornění – duodeno-duodeno anastomóza end-to-end. Fig. 7. Morphology of duodeno-duodeno anastomosis end-to-end. 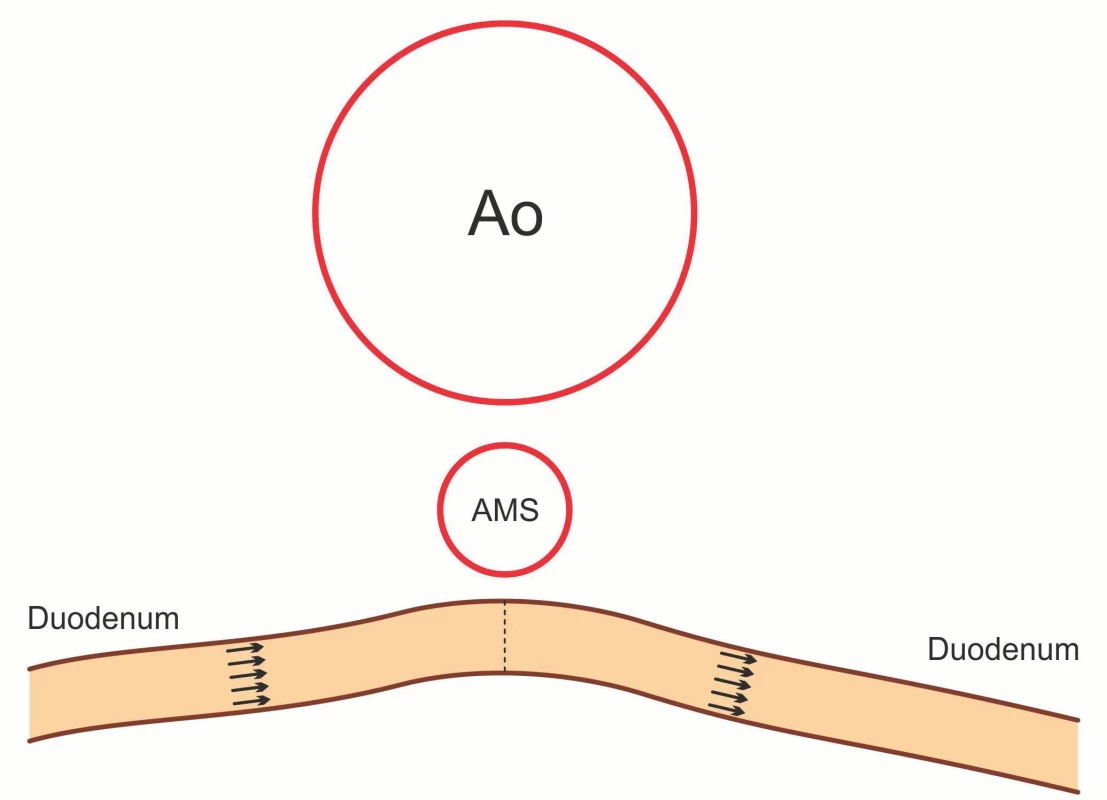
DISKUSE
V prezentované práci popisujeme vzácný syndrom horní střevní obstrukce spojený s neočekávanou pankreatickou dysfunkcí a zásadním ovlivněním terapeutickým operačním zákrokem na duodenu. Takové poznatky považujeme za prioritní, poněvadž EIP u SMAS dosud nebyla podle našich znalostí v domácím ani ve světovém písemnictví nikdy popsána, potažmo její ovlivnění chirurgickým zákrokem. Je nutno poukázat na fakt, že SMAS může být i v éře moderní medicíny tvrdým klinickým oříškem, může být spojen s řadou diagnostických rozporů i léčebných problémů a je nezbytné na něj myslet v případě symptomů horní střevní obstrukce.
SMAS je charakterizován obstrukcí D3 a obvykle vznikne u dětí a adolescentů po rychlém poklesu hmotnosti [17]. Anatomicky je tato část duodena lokalizována mezi dorzálně uloženou aortu a ventrálně SMA. Normální inter-arteriální aorto-mezenterický úhel mezi těmito cévami se pohybuje mezi 38–65° a vzdálenost mezi nimi je 10–28 mm [19, 20] (obr. 1). Základním pilířem diagnostiky pomocí zobrazovacích metod je zúžení úhlu mezi SMA a abdominální aortou (<25°) způsobující chronickou, intermitentní nebo akutní úplnou nebo částečnou obstrukci duodena. U SMAS je vzdálenost mezi oběma cévami zkrácena (<8 až 2 mm) v místech křížení duodena s aortou. Teorie o tukovém polštáři vysvětluje, proč ztráta hmotnosti představuje rizikový faktor. Předpokládá se, že komprese je způsobena většinovou ztrátou mezenteriálního tuku umožňující útlak D3 mezi ventrálně orientovanou arterií a dorzálně aortou [12]. Vzdálenost mezi oběma cévami se snižuje se snižujícím se BMI (body mass index), proto je SMAS často diagnostikován u různých patologických stavů spojených s rychlou ztrátou mezenteriálního tuku při jeho zvýšeném výdeji nebo sníženém příjmu, thyroideální dysfunkci nebo malignitách [8, 17].
Symptomatologie SMAS je dobře dokumentována v literatuře [21], přesto však může být obtížné SMAS v běžné praxi diagnostikovat. SMAS vykazuje klinicky velmi různorodé příznaky chronických bolestí břicha (podobně jako u našich 2 pacientů) provázené zvracením (často biliárním) po jídle, nauzeou a abdominální distenzí následkem horní střevní obstrukce [13]. Průběh může být i akutní [22]. Někteří pacienti mohou být nesprávně diagnostikováni po dlouhou dobu a diagnóza je následkem toho často opožděná o několik roků (13), čemuž odpovídá i naše popisovaná klinická zkušenost. SMAS může vést ke komplikacím, jako je elektrolytový rozvrat, těžký katabolismus, peritonitida a perforace žaludku [14]. Tíže symptomů je převážně závislá na stupni komprese a obstrukci v souvislosti s velikostí aorto-mezenteriálního úhlu [18]. Diagnostika je primárně založena na CT angiografii [23]. Naše prezentované případy dokladují, že identifikace tohoto syndromu může představovat diagnostické dilema a ani cílená vyšetření (endoskopie, kontrastní rentgenové či scintigrafické vyšetření horní části GIT, CT angiografie, ultrasonografie) nemusejí poskytnout prokazatelné, jednotné a kompatibilní závěry nutné pro včasnou diagnostiku. To je dobře patrné hlavně u pacienta č. 2. Pulzatilní zevní komprese při gastrofibroskopii může také upozornit na SMAS [24]. Senzitivita a specificita různých zobrazovacích technik není dosud dobře známa, za nejdůležitější stále považujeme nutnost na tento syndrom myslet v kontextu klinických symptomů.
U našich pacientů se SMAS jsme současně zjistili těžkou, v literatuře dosud nikdy nepopsanou EIP. Otázkou však zůstává, jakým způsobem se může podílet na symptomatologii SMAS. Sekrece enzymů je specifická pro pankreatickou exokrinní funkci, která je řízena komplexem neurohormonálních mechanismů v závislosti na požití potravy. Velmi složitý proces řízení sekrece pankreatických enzymů má čtyři fáze: nervovou, gastrickou, intestinální a absorpci ve stěně tenkého střeva. Hlavní živiny v duodenu působí jako stimul pro intestinální fázi pankreatické sekrece, která má na produkci enzymů největší vliv [25]. Parasympatikus prostřednictvím acetylcholinu ovlivňuje peristaltiku a sekreci enzymů. V průběhu této nejvýznamnější intestinální fáze se řízení sekrece uskutečňuje prostřednictvím vago-vagálních a entero-pankreatických reflexů a prostřednictvím řady GIT hormonů (např. sekretin, cholecystokinin – CCK). Postprandiálně dochází k sekreci CCK, který mimo stimulace tvorby enzymů aktivuje aferentní vagové nervy. Ty stimulují centra v CNS a eferentní vlákna zvyšují pankreatickou sekreci. Významnou úlohu v tomto procesu mají také baroreceptory, volumoreceptory a dále mechanické, chemické a osmotické receptory rozmístěné ve stěně duodena [26]. Složitost neurálně-humorálních mechanismů řízení pankreatické sekrece popisují práce řady autorů [32–35]. Dosud známá onemocnění způsobující EIP nebo neadekvátní mísení potravy s enzymy zahrnují CF, chronickou pankreatitidu včetně hereditární formy, tumory pankreatu, operace pankreatu a žaludku a střevní dysmikrobie [27].
Podstata možné souvislosti mezi EIP a SMAS není doposud objasněna. Gastroduodenum tvoří funkční celek a zobecnění známých údajů o pankreatické sekreci umožní uvažovat o komplexu příčin. Vzhledem k dobře fyziologicky regulovanému procesu digesce a absorpce všechny poruchy postihující jednotlivé kroky nutné pro optimální trávení a přiměřenou tvorbu pankreatických enzymů (vstup potravy do střevního lumen včetně patologických procesů uvnitř lumen duodena a orálního jejuna a smíšení potravy) se mohou podílet na vzniku EIP u SMAS. Následně pak jsou na místě úvahy, jak jsou tyto mechanismy ovlivněny zvoleným způsobem léčby a operační metodou.
Názory na léčbu nejsou jednotné. Nazojejunální sonda a adekvátní zlepšení nutričního stavu (enterální, parenterální výživa) s cílem zvýšit obsah mezenteriálního tuku a upravit aorto-mezenteriální úhel je obvykle první volbou v léčbě, nabízí však pouze u části pacientů trvalou alternativu bez operačního řešení [28]. Pokud konzervativní postup v léčení SMAS selže, pak přichází v úvahu chirurgická léčba, jež má v současnosti více možností. Léčba pomocí gastro-entero(jejuno) anastomózy má dnes pouze historické místo.
Další alternativou je provedení duodeno-jejunální anastomózy (DJA) side-to-side. Tato operace je od roku 1995 (Massoud) prováděna i laparoskopicky. Nicméně tento typ operačního řešení má svá úskali, zejména v dlouhodobém pooperačním dyskomfortu. Jeho příčinou u DJA může být větší či menší stagnace obsahu, jakož i antiperistaltická motilita v relativně slepém pahýlu duodena po místo neodstraněné komprese. Tato operace je nejjednodušší, a proto je i laparoskopicky relativně snadno proveditelná, ale s výše uvedenými výhradami.
Další možností operační léčby je přímá DDA, kdy se musí otevřít omentální bursa, uvolnit D3 před a D4 za kompresí a nad SMA se našije side-to-side DDA. Je možné také kompletní protětí D3 duodena, mobilizace D3 a D4 duodena a antepozice duodena před kompresi s anastomózou DDA koncem ke konci (end-to-end). Tento typ DDA je ale pracnější a s větším rizikem možné pooperační iritace pankreatu.
Jinou možností chirurgické léčby SMAS je Strongova operace [29]. Jejím principem je uvolnění pravého kolon a poloviny transversa, protětí Treitzova ligamenta a mobilizace D3, 4. Poté se provede derotace celého tenkého střeva ve směru hodinových ručiček o 180° a tenké i tlusté střevo se uloží do pozice „non-rotace“. V tomto případě pak celá tenká klička je uložena vpravo kolem osy a tlusté střevo-cékum a ascendens jsou v levé části břicha – mediálně a paralelně k průběhu sestupného tračníku. Proto je vždy vhodné provést současně i apendektomii. Strongova operace má výhodu v tom, že se neprovádí žádné otevření lumen střeva, tedy nešije se žádná anastomóza a nehrozí možná obecná komplikace ve smyslu případné insuficience střevní anastomózy. Časově je Strongova operace shodná s operací typu DDA.
Cévní rekonstrukce z indikace SMAS jsou sice možné a velmi zřídka i prováděné [30], ale považujeme je přes veškerou vysokou kvalitu a um cévních chirurgů za extrémně rizikové. V případě komplikace v cévní anastomóze (ať již s použitím cévní protézy či bez ní) je ohrožena vitalita celého středního střeva s možnými fatálními následky.
Naše zkušenosti a literární údaje ukazují, že terapie a z chirurgického hlediska operační metoda u každého pacienta by měla být individualizována a personalizována a zvolena podle jejich předností bez ohledu na obecné standardy a doporučení léčby [31]. Oběma našim pacientům byla provedena DDA s uspokojivým dlouhodobým pooperačním průběhem ve shodě s literaturou, která uvádí velmi dobrou prognózu, incidence relapsu není známa [17]. Z klinického hlediska naprosto překvapivým a důležitým zjištěním však bylo, že přestože operace vedla u obou pacientů k plné normalizaci intraluminálních poměrů v duodenu, byla u pacienta č. 1 zjištěna rychlá a kompletní normalizace FE-1, kdežto u pacienta č. 2 vedla DDA k dalšímu výraznému prohloubení insuficience pankreatu.
To nás přivádí k hypotetické patofyziologické interpretaci, jejíž podstatu spatřujeme v odlišném ovlivnění regulace exokrinní sekrece pankreatu, převážně intestinální fáze, podle typu operace a následných anatomických změn. U pacienta č. 1 byla provedena DDA side-to-side se zachováním longitudinální kontinuity stěny střeva (obr. 4). Po deliberaci duodena je plně zachována integrita mezoduodena, kdy aferentní i eferentní nervové dráhy probíhající ve stěně duodena a v mezoduodenu jsou zachovány. Po úpravě tlakových a objemových poměrů v lumen duodena tak mohly všechny složky intestinální fáze řízení pankreatické sekrece začít fungovat poměrně rychle zcela fyziologicky. U pacientky z druhé kazuistiky byla provedena rovněž DDA, avšak typu end-to-end (obr. 7). Tato metoda vyžaduje úplné protětí (transsekci) duodena a rozsáhlou deliberaci duodena v rozsahu D3–D4 a jeho antepozici před SMA umožňující také dokonalou normalizaci tlakových a objemových poměrů v lumen duodena. U této operace však dochází k přerušení nervových drah ve stěně duodena a v mezoduodenu a tím jsou podstatně porušeny entero-pankreatické a vago-vagální cholinergní reflexy, které jsou primárními mediátory enzymové pankreatické sekrece. Důsledkem může být výrazné narušení procesu řízení sekrece pankreatických enzymů v nejvýznamnější intestinální fázi, které je uplatňováno převážně neurální cestou. Závěry experimentálních prací, že kmenová nebo selektivní vagotomie působí inhibičně na sekreci pankreatu [36], také podporuje interpretaci patofyziologických změn a exokrinní dysfunkci po operaci typu DDA end-to-end provedené u pacienta č. 2.
ZÁVĚRY
- U dvou pacientů se SMAS jsme opakovaně prokázali dosud v literatuře nepopsanou nízkou aktivitu FE-1 před chirurgickou léčbou.
- Po chirurgické úpravě tlakových a objemových poměrů v lumen duodena došlo k plné normalizaci hodnot FE-1, pokud byla zvolena operační technika se zachováním longitudinální kontinuity duodena, bez většího zásahu do integrity mezoduodena.
- Operační technika s užitím úplné transsekce duodena a rozsáhlým zásahem do integrity mezoduodena byla následována naopak dalším výrazným snížením FE-1.
- V diagnostické rozvaze nad pacientem s nespecifickými horními obstrukčními příznaky doporučujeme uvažovat také o SMAS.
- Stanovení pankreatické elastázy ve stolici by mělo být zahrnuto mezi cílená vyšetření v diagnostice SMAS.
- EIP představuje závažný stav, který může být způsoben SMAS. V případě chirurgické terapie SMAS je žádoucí zvolit operační postup co nejméně zasahující do kontinuity duodena a integrity mezoduodena.
- Cílem takové volby je vedle odstranění pacientových potíží vytvoření předpokladů pro optimální nutriční a metabolickou prosperitu pacienta v celém pooperačním období s normalizací zevní sekrece pankreatu.
Studie byla podporována výzkumným programem Progres Q 39.
Došlo: 6. 6. 2017
Přijato: 20. 9. 2017
MUDr. Radim Petro
Ambulance pro dětskou gastroenterologii
Nemocnice s poliklinikou Karviná-Ráj
Vydmuchov 399
734 01 Karviná
e-mail: radimpetro@seznam.cz
Zdroje
1. Wilkie D. Chronic duodenal ileus. Am J Med Sci 1927; 173 : 643–649.
2. Valdes A, Cárdenas A, Espinosa A, et al. Superior mesenteric artery syndrome. J Am Coll Surg 2005; 201 : 808.
3. Rokitansky C. Handbuch der Pathologischen Anatomie. Vienna: Braumuller and Siedel, 1842.
4. Boráňová S, Žáčik M. Syndrom arteria mesenterialis superior. Pediatr praxi 2012; 13 : 407–408.
5. Mihál V, Malý T, Heřmanová Z, Michálková K. Vzácná etiologie horní střevní obstrukce u dětí – syndrom arteria mesenterialis superior. Pediatr praxi 2014; 15 : 371–373.
6. Zlámal Z. Několik poznámek chirurga k duodenální obstrukci u dětí. Pediatr praxi 2006; 6 : 288–289.
7. Fargaš E, Skácel V. Syndrom kraniální mezenterické arterie. Acta Univ Palacki Olomuc Fac Med 1963; 32 : 63–71.
8. Shiu JR, Chao HC, Luo CC, et al. Clinical and nutritional outcomes in children with idopathic superior mesenteric artery syndrome. J Pediatr Gastroenterol Nutr 2010; 51 : 177–182.
9. Okugawa Y, Inoue M, Uchida K, et al. Superior mesenteric artery syndrome in an infant: case report and literature review. J Pediatr Surg 2007; 42: E5–E8.
10. Elbadawy MH. Chronic superior mesenteric artery syndrome in anorexia nervosa. Br J Psychiatry 1992; 160 : 552–554.
11. Van Brussel JP, Dijkema WP, Adhin SK, Jonkers GJPM. Wilkie‘s syndrome, a rare cause of vomiting and weight loss: diagnosis and therapy. Neth J Med 1997; 51 : 179–181.
12. Shapiro G, Green DW, Fatica NS, Boachie-Adjei O. Medical complications in scoliosis surgery. Curr Opin Pediatr 2001; 13 : 36–41.
13. Pedoto MJ, O‘Dell MW, Thrun M, Hollifield D. Superior mesenteric artery syndrome in traumatic brain injury: two cases. Arch Phys Med Rehabil 1995; 76 : 871–875.
14. Laffont I, Bensamil D, Rech C, et al. Late superior mesenteric artery syndrome in paraplegia: case report and review. Spinal Cord 2002; 40 : 88–91.
15. Roth EJ, Fenton LL, Gaebler-Spira DJ, et al. Superior mesenteric artery syndrome in acute traumatic quadriplegia: case reports and literature review. Arch Phys Med Rehabil 1991; 72 : 417–420.
16. Kitaura K, Harima K. Superior mesenteric artery syndrome with vascular calcification in a maintenance hemodialysis patient. Clin Nephrol 2009; 71 : 228–230.
17. Bakker MEC, van Delft R, Vaessens NAL, Rosias PRR. Superior mesenteric artery syndrome in a 15-year-old boy during Ramadan. Eur J Pediatr 2014; 173 : 1619–1621.
18. Zaraket V, Deeb L. Wilkie’s syndrome or superior mesenteric artery syndrome: Facto or fantasy. Case Rep Gastroenterol 2015; 9 : 194–199.
19. Konen E, Amitai M, Apter S, et al. CT Angiogrpahy of superior mesenteric artery syndrome. AJR 1998; 171 : 1279–1281.
20. Merrett ND, Wilson RB, Cosman P, Biankin AV. Superior mesenteric artery syndrome: diagnosis and treatment strategies. J Gastrointest Surg 2009; 13 : 287–292.
21. Biank V, Werlin S. Superior mesenteric artery syndrome in children: a 20-year experience. J Pediatr Gastroenterol Nutr 2006; 42 : 522–525.
22. Nishigucchi S, Shirobe T. Acute abdominal pain causesd by superior mesenteric artery syndrome in a healthy young boy. BMJ Case Rep 2016 Dec 19 pii: bcr2016217512. Doi 10.1136/bcr-2016-217512.
23. Barquin-Yaguez J, Abadía-Barno P, Garcia-Pérez JC. Superior mesenteric artery syndrome: an uncommon cause of intestinal obstruction. Rev Esp Enferm Dig 2017; 109 : 60.
24. Gustafsson L, Falk A, Lukes PJ, Gamklou R. Diagnosis and treatment of superior mesenteric artery. Br J Surg 1984; 71 : 499–501.
25. Moran TH. Gut peptides in the control of foof intake. Int J Obes 2009; 33 (Suppl 1): S7–S10.
26. Berry AJ. Pancreatic enzyme replacement therapy during pancreatic insufficiency. Nutr Clin Pract 2014; 29 : 312–321.
27. Pandol SJ. Neurohumoral control of exocrine pancreatic secretion. Curr Opin Gastroenetrol 2003; 19 : 443–446.
28. Chan DK, Mak KS, Cheah YL. Successful nutritional therapy for superior mesenteric artery syndrome. Singapore Med J 2012; 53: e233–e236.
29. Strong EK. Mechanism of arteriomesenteric duodenal obstruction and direct surgical attack upon etiology. Ann Surg 1958; 148 : 725–730.
30. Sandmann W. Wilkie syndrom – ein seltenes Krankheitsbild und eine neue Therapie. Z Gastroenterol 2013; 51: K309.
31. Yakan S, Calıskan C, Kaplan H, et al. Superior mesenteric artery syndrome: a rare cause of intestinal obstruction. Diagnosis and surgical management. Indian J Surg 2013; 75 : 106–110.
32. Love JA, Yi E, Smith TG. Autonomic pathways regulativ pancreatic exocrine secretion. Auton Neurosci 2007; 133 : 19–39.
33. Konturek SJ, Zabielski R, Konturek JW, Czarnecki J. Neuroendocrinology of the pancreas; role of brain-gut axis in pancreatic secretion. Eur J Pharmacol 2003; 481 : 1–14.
34. Li Y, Wu X, Zhu J, et al. Hypothalamic regulation of pancreatic secretion is mediated by central cholinergic pathway in the rat. J Physiol 2003; 552 : 571–587.
35. Li Y. Sensory signal transduction in the vagal primary oferent neurons. Curr Med Chem 2007; 14 : 2554–2563.
36. Li Y, Owyang C. Vagal afferent pathway mediates physiological action of cholecystokinin on pancreatic enzyme secretion. J Clin Invest 1993; 92 : 418–424.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článek Talasemické syndromyČlánek Věcný rejstřík
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2017 Číslo 8- Subkutánne vs. intravenózne imunoglobulíny u pacientov s CLL
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Gastroezofageální reflux a gastroezofageální refluxní onemocnění u kojenců a batolat
-
Všetky články tohto čísla
- Věcný rejstřík
- Prof. MUDr. Otto Hrodek, DrSc. – 95 let
- Současné možnosti měření funkce destiček u novorozenců
- Talasemické syndromy
- Talasémie a hemoglobinové varianty u dětí
- Změny obsahu bílkoviny v mateřském mléce po předčasném porodu
- Zevně sekretorická insuficience pankreatu u dětí se syndromem horní mezenteriální arterie – Wilkieho syndrom: následné ovlivnění metodou chirurgického zákroku
- Mozgový absces – zriedkavá, ale závažná infekcia v detskom veku
- Sitosterolémie: klinická, biochemická a molekulárně genetická charakteristika 3letého chlapce s významnou hypercholesterolémií
- Chronický zánět středního ucha v dětském věku
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Talasemické syndromy
- Chronický zánět středního ucha v dětském věku
- Mozgový absces – zriedkavá, ale závažná infekcia v detskom veku
- Talasémie a hemoglobinové varianty u dětí
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



