-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Cirkulující endoteliální a progenitorové buňky jako biomarkery angiogeneze u dětských onkologických pacientů
Circulating endothelial and progenitor cells as biomarkers of angiogenesis in pediatric oncology patients
Introduction:
Neovascularization by angiogenesis or vasculogenesis is an integral part of the tumor growth, it is essential for tumor invassivness and for the process of metastasis. With the development of antiangiogenic therapies there is urgent need for reliable biomarkers of angiogenesis, that would have both - prognostic and predictive meaning. Circulating endothelial cells (CEC) and circulating endothelial progenitor cells (EPC) have been proposed as a potential noninvasive biomarker of tumor angiogenesis in several studies.
Objective:
The aim of our work was a detailed analysis of the amount of CEC and EPC in pediatric cancer patients, both in relation to tumor type, extent of the disease, type of the treatment response as well as monitoring the dynamics of these cells during treatment.
Patients and methods:
The analysis of objectives in the first part of the research was performed in 171 children. Cells were determined by flowcytometry. We evaluated activated CEC (aCEC) with immunophenotypic definition CD45-CD146+CD105+, mature CEC (mCEC) CD45-CD146+CD31+ and EPC CD45-/+CD146+CD34+.
Results:
We did not find a significant difference in the initial amount of the monitored cells in correlation with the tumor type. Comparing the values before and during treatment, regardless of the diagnosis, there was a decrease in the amount of aCEC and mCEC. In correlation with the treatment response, there was a statistically significant decrease in aCEC in patients who achieved only disease stabilization or progressed on treatment compared to patients who achieved regression in the tumor volume. The extent of the disease and type of the treatment did not have a significant effect on the amount of each of measured endothelial cells.
Conclusions:
In our study, we did not confirm the significance of EPC and CEC as reliable markers in pediatric cancer patients. In practice, aCEC monitoring could be used to identify patients who may be less responsive to treatment. For the further use of EPC and CEC as biomarkers of angiogenesis, a standardized protocol for flowcytometry analysis is required.
KEY WORDS:
angiogenesis, vasculogenesis, circulating enothelial cells, circulating endothelial progenitor cells, pediatric malignancy, flowcytometry
Autori: D. Zapletalová 1,2; L. Zdražilová Dubská 3; A. Wágnerová 3; M. Kýr 1; J. Štěrba 1,2
Pôsobisko autorov: Klinika dětské onkologie LF MU a FN Brno 1; Mezinárodní centrum klinického výzkumu FN U sv. Anny (FNUSA-ICRC), Brno 2; Masarykův onkologický ústav, Brno 3
Vyšlo v časopise: Čes-slov Pediat 2018; 73 (7): 439-448.
Kategória: Původní práce
Súhrn
Úvod:
Novotvorba cév angiogenezí či vaskulogenezí je nedílnou součástí nádorového růstu. Má zásadní význam pro jeho invazivitu a metastazování. S rozvojem antiangiogenní léčby se objevila potřeba spolehlivého markeru angiogeneze, jenž by měl jak prognostický, tak prediktivní význam. Cirkulující endoteliální buňky (CEC) a cirkulující endoteliální progenitorové buňky (EPC) byly několika studiemi navrženy jako potenciální neinvazivní biomarkery nádorové angiogeneze.
Cíle:
Cílem naší práce byla podrobná analýza množství CEC a EPC u dětských onkologických pacientů jak ve vztahu k typu nádoru, rozsahu onemocnění, typu dosažené odpovědi na léčbu, tak i monitorace dynamiky těchto buněk v průběhu léčby.
Pacienti a metody:
Analýza cílů byla provedena u 171 dětí. Množství buněk bylo stanoveno pomocí průtokové cytometrie. Ve studii byly hodnocené aktivované CEC (aCEC) s imunofenotypickou definicí CD45-CD146+CD105+, zralé CEC (mCEC) CD45-CD146+CD31+ a EPC CD45-/+CD146+CD34+.
Výsledky:
Nenalezli jsme signifikantní rozdíl v iniciálním množství sledovaných buněk v korelaci s typem nádoru. Při srovnání hodnot před léčbou a v jejím průběhu bez ohledu na diagnózu došlo k poklesu v množství aCEC a mCEC. Při korelaci s odpovědí na léčbu byl patrný statisticky signifikantní pokles aCEC u pacientů, kteří dosáhli pouze stabilizace onemocnění, nebo u nichž došlo k progresi ve srovnání s pacienty, jež dosáhli objemové regrese tumoru. Rozsah onemocnění, ev. modalita léčby neměly významný vliv na počty jednotlivých typů endoteliálních buněk.
Závěr:
V naší studii jsme nepotvrdili význam EPC a CEC jako spolehlivých biomarkerů u dětských onkologických pacientů. V praxi by bylo možné využít monitoraci aCEC k vytypování pacientů, kteří by mohli hůře odpovídat na léčbu. Pro další využitelnost EPC a CEC je nutný standardizovaný a robustně validovaný protokol pro analýzu pomocí průtokové cytometrie.
KLÍČOVÁ SLOVA:
angiogeneze, vaskulogeneze, cirkulující endoteliální buňky, cirkulující endoteliální progenitorové buňky, dětské nádory, průtoková cytometrie
ÚVOD
Léčba zhoubných nádorů u dětských pacientů zaznamenala v posledních třech desetiletích výrazný pokrok. Zatímco celkové pětileté přežití u dětí s akutní leukémií stouplo z 25 % počátkem 60. let na téměř 90 % v současnosti, u pacientů s progredujícími nebo refrakterními solidními nádory je i dnes prognóza velmi neuspokojivá [1]. V dětské onkologii tak stále existuje skupina pacientů s vysoce rizikovými solidními nádory, u nichž standardní protokolární léčba a terapeutické postupy tzv. druhé volby, často zahrnující vysoké dávky chemoterapie s výraznou toxicitou, selhaly. U těchto dětí jsou proto nutné ke zlepšení prognózy nové terapeutické přístupy. Cílem pro tyto léčebné strategie tak může být spíše mikroprostředí nádoru než nádorové buňky samotné. Jedním z takovýchto slibných přístupů je antiangiogenní léčba.
Antiangiogenní terapie využívá závislosti nádoru na dostupnosti cévního zásobení. Nádor pro svůj růst potřebuje přísun živin a kyslíku. Dosáhne-li kritické velikosti (cca 1‒2 mm3), pouhá difuze na zajištění výživových nároků tumoru již nestačí. Dochází k hypoxii a deprivaci nutrientů, které vedou k převaze angiogenních faktorů, jež vyústí v tzv. angiogenní přepnutí („angiogenic switch“) a následně tvorbě nových cév buď pomocí endoteliálních buněk z již existující cévní sítě (proces angiogeneze), nebo vyplavením endoteliálních progenitorových buněk z kostní dřeně (proces postnatální vaskulogeneze) [2]. Dalšími alternativními způsoby tumorem indukované angiogeneze je tvorba tzv. mozaikových cév, kdy se do cévní stěny začleňují kromě endoteliálních buněk také buňky nádorové, koopce již existujících cév nebo tvorba vaskulogenních mimiker, kdy se agresivní nádorové buňky transdiferencují a získají charakter endotelových buněk. Ty vytvářejí avaskulární kanály, kterými protéká krev a které jsou napojené na vlastní cévy [3].
S rostoucím množstvím informací ohledně procesu nádorové neovaskularizace vyvstala poptávka po spolehlivém markeru angiogeneze u onkologicky nemocných ve snaze lépe predikovat prognózu pacienta, odpověď na léčbu, riziko relapsu onemocnění a také identifikovat skupinu pacientů, kteří by mohli profitovat z antiangiogenní léčby. Efekt těchto léků je často zprostředkován jinými mechanismy než u klasických cytostatik, a proto zmenšení nádorové masy tak nemusí být ideálním ukazatelem efektivity antiangiogenní léčby ani indikátorem biologické aktivity. K optimalizaci klinického testování těchto látek je tedy potřeba validovaného spolehlivého biomarkeru. V preklinických i klinických studiích bylo zkoumáno mnoho biomarkerů angiogeneze, nicméně žádný z nich se rutinně v současnosti v klinické praxi nepoužívá. Tyto markery lze rozdělit na preklinické modely, mikrovaskulární denzitu, proteiny plazmy, zobrazovací metody a buněčné markery angiogeneze – cirkulující endoteliální buňky („circulating endothelial cells“ ‒ CEC) a cirkulující endoteliální progenitorové buňky („circulating endothelial progenitor cells“ – EPC) [4].
CEC se považují za zralé endotelie odloučené z cév po vaskulárním inzultu, jsou tak spíše důsledkem než iniciátorem patologického stavu. Odloučení endoteliálních buněk zahrnuje několik faktorů, z nich nejčastěji je zmiňován vaskulární mechanický inzult. CEC tak můžou sloužit jako marker vaskulárních (nebo spíše endoteliálních) dysfunkcí a zánětlivých onemocnění. Jejich zvýšené množství bylo prokázáno například u pacientů s kardiovaskulárními poruchami, s infekcí, poruchou imunity, plicní hypertenzi, se srpkovitou anémií a u onkologických pacientů s různými typy nádorového onemocnění [5–7].
EPC jsou na rozdíl od CEC buňky derivované z kostní dřeně, o nichž se předpokládá, že hrají roli v udržování integrity cévního systému. Jsou schopné migrace, kolonizace, proliferace a následně pravděpodobně i diferenciace v zralé EC. Většina EPC se nachází v klidovém stadiu v mikroprostředí kostní dřeně, jež se označuje pojmem „niche“ (v překladu hnízdo/nika) kmenových buněk. Stresové faktory jako ozáření, zánět, hypoxie a také některé léky stimulují trombocyty, zralé endoteliální buňky a pericyty v poškozených tkáních nebo v nádoru k produkci SDF-1 (stromal derived factor-1), jehož zvýšená hladina vede k mobilizaci EPC z kostní dřeně do cirkulace. Po vstupu EPC do krevního oběhu proteinázy jako například katepsin L a MMP2 zprostředkují migraci EPC do poškozené cévy. V tomto místě pak specifické cytokinové prostředí rozhodne o tom, zda se EPC budou dále diferencovat ve zralé EC, nebo zda budou produkovat cytokiny a růstové faktory, jež iniciují opravu buněčné stěny z okolních endoteliálních buněk [8]. Ovšem toto specifické prostředí, které reguluje diferenciaci a funkci EPC, zatím nebylo jasně definováno.
Snížené hodnoty EPC i narušená funkce těchto buněk bývá spojována s různými chronickými onemocněními, a to jak u dospělých, tak u dětí [9]. Mezi nejvíce prozkoumané patologické stavy spojené s alterací EPC patří obezita, diabetes mellitus prvního typu, familiární hypercholesterolémie a juvenilní idiopatická artritida. Jen několik málo studií se věnovalo množství CEC a EPC u dětských onkologických pacientů.
Počet CEC i EPC v periferní krvi je u zdravých jedinců extrémně nízký. Vzhledem k rozmanitosti metod k detekci těchto buněk je referovaný počet velmi variabilní, pohybuje se u CEC mezi 0 až 7900 bb/ml, u EPC od 70 bb//ml až k 5000 bb/ml [6, 9]. Zatímco hodnoty CEC u zdravých jedinců se jeví být stabilní v průběhu života, kromě 1,5 - až 2násobného zvýšení u žen v průběhu menstruace, jež patrně souvisí s vaskulární remodelací v děloze [10], u EPC studie na zvířecích i lidských modelech ukazují postupné snižování jejich proliferace, nedostatečnou mobilizaci z kostní dřeně a snížené přežití těchto buněk v průběhu života [11].
V současnosti neexistuje jednoznačná shoda na přesné fenotypické identifikaci CEC a EPC. Žádný marker není dostatečně specifický pro fenotyp těchto endoteliálních buněk, ani žádný není konstantně exprimován. CEC jsou obecně definovány jako buňky s expresí endoteliálních antigenů (např. von Willenbrandův faktor, CD146, VE--cadherin) při absenci hematopoetických (CD45 a CD14) a progenitorových (CD133) markerů [12]. Na zralých CEC je ale také přítomen progenitorový marker CD34. Zato CD146, jenž byl původně považován za hlavní marker CEC, je exprimován také na buňkách trofoblastu, na mezenchymálních kmenových buňkách, na některých nádorových tkáních i na aktivovaných T lymfocytech [13]. Exprese CD31 byla prokázána taktéž na trombocytech, endoteliálních mikročásticích, lymfocytech, zralých myeloidních buňkách a hematopoetických progenitorových buňkách [10]. Stejně tak vWf byl popsán na trombocytech. Exprese CD34 se vyskytuje jak na EPC, tak i na CEC. Nejčastěji užívaným imunofenotypem pro CEC je CD45-, CD31+, CD146+, nicméně většina publikovaných studií neprokázala jednoznačný endoteliální původ takto definovaných buněk [14]. U EPC některé studie také poukazují na možnou změnu exprese povrchových antigenů ve vztahu k jejich vývojovému stadiu, nebo by se mohlo jednat o více podtypů, které přispívají k neoangiogenezi různou měrou.
Imunofenotypická definice EPC by tedy měla obsahovat alespoň jeden marker nezralosti a jeden marker endoteliálního původu. Z markerů kmenových buněk je nejčastěji k detekci EPC používán CD34 a CD133, z endoteliálních pak CD31, VEGFR-2 či VEGFR-1 [15]. Vzhledem k této antigenní promiskuitě je náročné odlišit od sebe CEC, EPC, trombocyty, hematopoetické progenitorové buňky a endoteliální mikročástice [16].
K identifikaci CEC a EPC se využívají zejména 2 metody – imunomagnetická separace a průtoková cytometrie (FCM), která umožňuje simultánní multiparametrickou analýzu v poměrně krátkém čase. Vzhledem k enormně nízkému počtu CEC i EPC v periferní krvi u zdravých jedinců vyžaduje jejich přesná kvantifikace technicky pečlivý analytický přístup. V současnosti existuje mnoho protokolů pro evaluaci obou typů buněk pomocí průtokové cytometrie, jež se liší v kombinaci použitých protilátek, ve způsobu zpracování vzorku, v použití aditivních barvení, v gatovací strategii a v systému analýzy získaných dat [12]. Vzhledem k rozdílným kombinacím endoteliálních markerů je obtížné výsledky jednotlivých skupin srovnávat.
CÍLE
S rozvojem antiangiogenní léčby se objevila potřeba spolehlivého markeru angiogeneze, jenž by měl jak prognostický, tak prediktivní význam, pomocí kterého by bylo možné určit optimální dávku antiangiogenních léčiv, měřit jejich biologickou aktivitu a identifikovat pacienty, kteří by z dané léčby nejvíce profitovali.
Cirkulující endoteliální buňky a cirkulující endoteliální progenitorové buňky byly několika studiemi navrženy jako potenciální neinvazivní biomarker nádorové angiogeneze. Nicméně výsledky těchto studií jsou rozporuplné.
Cílem studie bylo stanovení množství aktivovaných CEC (aCEC), zralých CEC (mCEC) a EPC u pacientů Kliniky dětské onkologie FN Brno v korelaci s diagnózou a srovnání těchto hodnot při diagnóze a v rámci přešetření v korelaci s rozsahem onemocnění, léčbou a odpovědí na léčbu.
PACIENTI
Do studie byli zařazeni pacienti hospitalizovaní na Klinice dětské onkologie FN Brno k diagnostice primárního onemocnění nebo relapsu základního onemocnění v době od 1. 12. 2007 do 1. 12. 2009 bez ohledu na diagnózu. Rodiče pacientů nebo jejich zákonní zástupci podepsali informovaný souhlas s odběrem biologického materiálu a jeho využitím v rámci biologických studií. Tyto podmínky splnilo 171 pacientů ‒ 164 pacientů s iniciální diagnózou a 7 pacientů s nově diagnostikovaným relapsem základního onemocnění.
Odběr periferní krve byl proveden před zahájením léčby maligního onemocnění. Pro korelaci hodnot s rozsahem onemocnění, léčbou a odpovědí na léčbu byli z tohoto souboru vyloučeni pacienti s nenádorovým onemocněním, s relapsem nádorového onemocnění a ti, o nichž nebyla k dispozici data o rozsahu onemocnění, léčbě a odpovědi na léčbu.
Kompletní data byla dohledána u 136 pacientů. U 52 dětí z tohoto souboru byl proveden také druhý odběr periferní krve ke stanovení aCEC, mCEC a EPC v rámci přešetření základního onemocnění.
METODY
CEC a EPC byly detekovány pomocí průtokové cytometrie. Vzorky periferní krve ke stanovení CEC a EPC byly odebrány do EDTA zkumavek. Analyzovány byly do 24 hodin po odběru, do té doby byly uchovávány v temnu a při teplotě 4 °C. Monoklonální protilátky označené fluorochromem byly použity od firmy Beckman Coulter, IN, USA, v následujících kombinacích: CD45-FITC, CD146--PC5, CD105-PE, CD34-PC7, CD31-PE. Ke stanovení absolutního počtu buněk byly použity fluorosféry (Flow-Count Fluorospheres). K lýze erytrocytů byl použit výrobcem definovaný lyzační roztok VersaLyse Lysing Solution, kterého hlavní účinnou složkou je cyklický amin. Pro zajištění hydronamické fokusace byl použit nosný roztok IsoFlow Sheat Fluid od stejnojmenné firmy pro snímání signálu z jednotlivých částic zvlášť. Do každé zkumavky bylo přidáno 50 µl periferní krve, obsah byl promíchán a inkubován ve tmě při 20–25 °C. Následně byl přidán lyzační roztok a opět proběhla inkubace za stejných podmínek. Těsně před měřením byly přidány Flow-Count Fluorospheres. Takto připravený vzorek byl analyzován na průtokovém cytometru Navios (Beckman Coulter, IN, USA).
Gatovací strategie byla následující: první gate (gate I) vymezuje populace buněk pomocí FS (forward scatter – podává informaci o velikosti buněk) a SS (side scatter – informace o granularitě buněk). Podle izotopové kontroly (oddělení negativní populace od pozitivní) byl nastaven gate D na buňky CD31+. Podle gate D byly upraveny všechny následující scattegramy, kde na jedné z os je znak CD31.
aCEC byly identifikovány jako CD146+CD105+CD45-, mCEC jako CD146+CD31+CD45- a EPC jako CD146+CD45+/-CD34+. Hodnoty byly uvedeny jako počet bb/ml.
Deskriptivní statistika byla u kategoriálních proměnných dána absolutní a relativní četností, u spojitých proměnných pak průměrem a směrodatnou odchylkou, mediánem a rozpětím mezi minimální a maximální hodnotou. Pro srovnání klinických dat při více kategoriích byla použita neparametrická obdoba analýzy rozptylu – Kruskalův-Wallisův test. Pro srovnání párových hodnot jednotlivých parametrů v čase byl použit Wilcoxonův test.
Pro zkoumání dynamiky hodnocených parametrů byl využit lineární model. Opakovaná měření v čase byla zohledněna použitím lineárního smíšeného modelu. Nejprve byla data logaritmicky transformována, aby bylo dosaženo přibližně normálního rozložení dat. Na transformovaných datech byl vytvořen časový lineární lomený model s uzly po jednom týdnu s náhodným efektem pro každého pacienta.
Smíšený lineární model byl specifikován následovně:
yij=β00 + β10T0ij + β20T7ij + β30T14ij + b0j + εij
kde γij jsou logaritmované hodnoty hodnocených parametrů (CEC, EPC); β00, β10T0ij, β20T7ij, β30T14ij jsou fixní efekty (absolutní člen respektive časové změny v jednotlivých uzlech); b0j je náhodný efekt (absolutní člen) pro každého pacienta; εij je náhodná chyba [17].
Výsledky jsou prezentovány formou tabulky s odhady efektů a odpovídající chybou se statistickou významností. Pro jednoduchou interpretaci byl model zobrazen jako průměrný trend na pozadí zdrojových dat formou case-profile plotu.
Za statisticky signifikantní byly považovány hodnoty p <0,05.
VÝSLEDKY
Stanovení množství CEC a EPC u pacientů Kliniky dětské onkologie FN Brno a korelace s diagnózou
Celkem byla analyzována data od 171 pacientů. V souboru bylo lehce více chlapců než děvčat (55,6 % vs. 44,4 %), průměrný věk byl téměř 10 let (medián ± SD: 8,90 ± 6,46). Základní data o pacientech jsou shrnuta v tabulce 1.
Tab. 1. Popisná statistika souboru podle diagnóz. 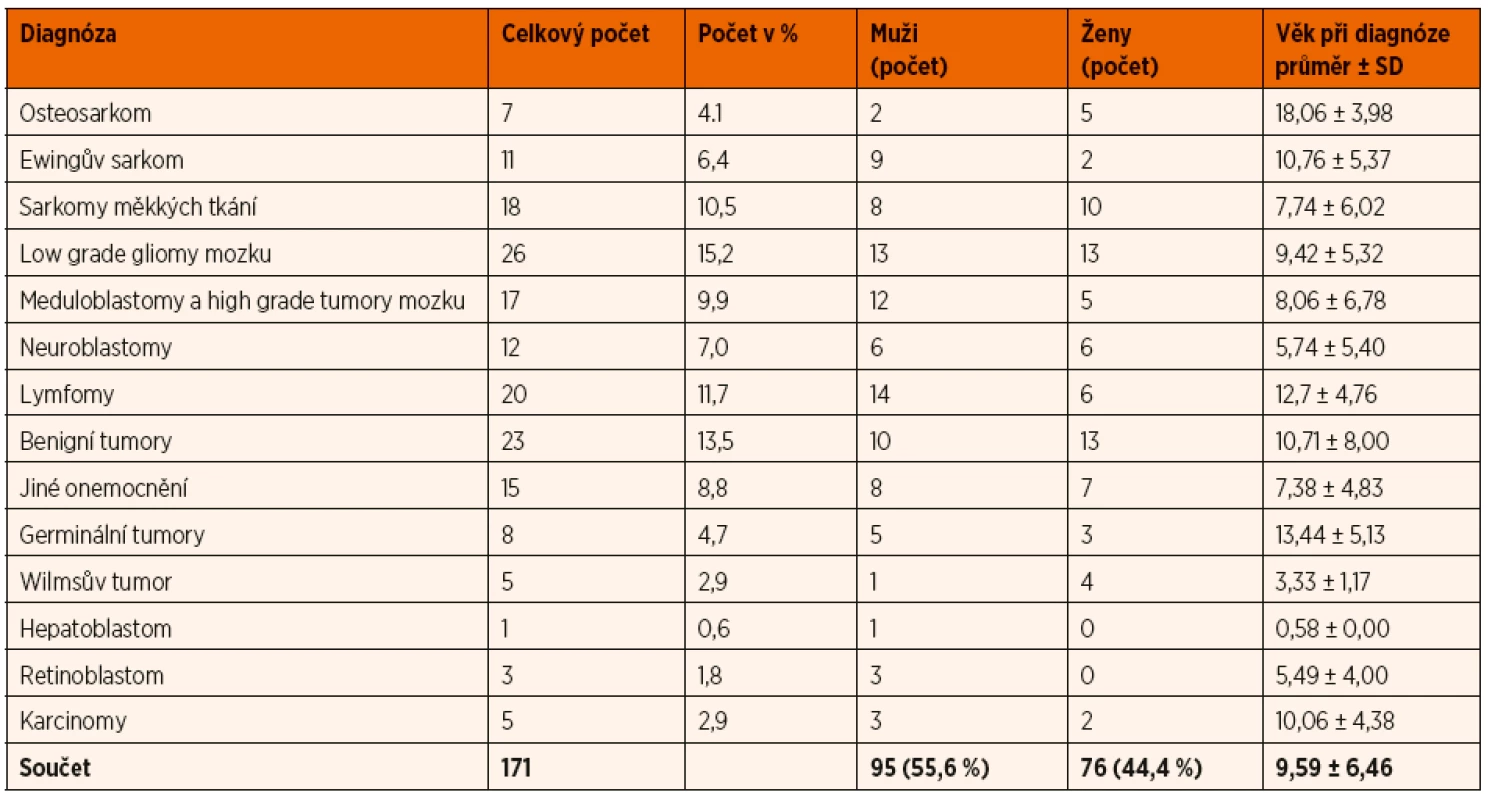
SD – směrodatná odchylka Vzhledem k významné heterogenitě jednotlivých typů solidních nádorů dětského věku byly jednotlivé diagnózy na základě obvyklých společných biologických charakteristik sloučeny do menšího počtu větších diagnostických skupin: embryonální sarkomy mimo CNS, sarkomy a jiné high grade tumory, lymfomy, low grade tumory, benigní nádory a jiné onemocnění. Rozložení diagnostických skupin v analyzovaném souboru je zobrazeno v grafu 1.
Graf 1. Rozložení diagnostických skupin v analyzovaném souboru. 
Rozpětí hodnot pro jednotlivé buňky bylo poměrně rozsáhlé a hodnoty vykazovaly výraznou individuální intervariabilitu. U EPC se hodnoty bez ohledu na diagnózu pohybovaly od 0 do 44 442 bb//ml, hodnoty aktivovaných CEC byly v rozmezí 501 až 78 375 bb//ml a zralých CEC 1040 až 470 871 bb/ml.
V našem souboru jsme neprokázali statisticky významný rozdíl v množství CEC (aktivovaných a zralých) a EPC mezi jednotlivými diagnostickými skupinami. Srovnání aCEC, mCEC a EPC mezi jednotlivými diagnostickými skupinami je znázorněno v grafu 2A, B, C.
Graf 2. A, B, C – Hodnoty EPC, aCEC a mCEC u jednotlivých diagnostických skupin. HG – high grade; LG – low grade; EPC – cirkulující endoteliální progenitorové buňky; aCEC – aktivované cirkulující endoteliální buňky; mCEC – zralé cirkulující endoteliální buňky 
Srovnání hodnot aCEC, mCEC a EPC při diagnóze a v rámci přešetření
Ze souboru 171 pacientů byla u 52 provedena analýza aCEC, mCEC a EPC také v průběhu léčby v rámci přešetření základního onemocnění. Poměr chlapců a dívek byl 59,6 % vs. 40,4 %, průměrný věk byl necelých 9 let. Základní data o pa-cientech jsou shrnuta v tabulce 2.
Tab. 2. Popisná statistika souboru podle diagnóz při druhém odběru. 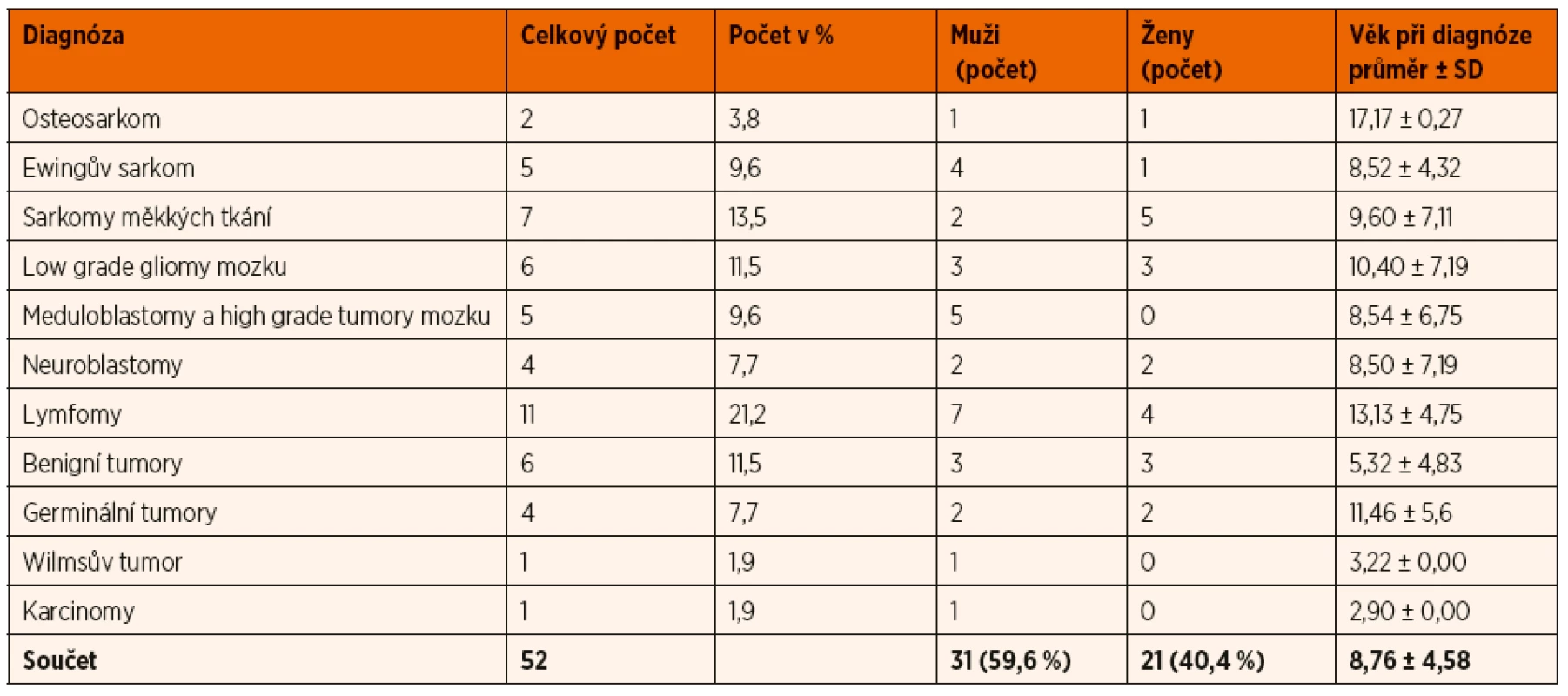
SD – směrodatná odchylka Obdobně jako při odběru v rámci diagnózy, i zde vykazovaly hodnoty jednotlivých buněk výraznou individuální intervariabilitu a ani zde jsme nenalezli statisticky signifikantní rozdíl mezi množstvím aCEC, mCEC a EPC a jednotlivými diagnostickými skupinami.
Při srovnání dynamiky počtu aCEC a mCEC bez ohledu na diagnózu došlo ke statisticky významnému poklesu těchto hodnot v čase, zatímco hodnoty EPC se výrazněji nezměnily (graf 3A, B, C).
Graf 3. A, B, C – Hodnoty EPC, aCEC a mCEC při prvním a druhém odběru bez ohledu na diagnózu. EPC – cirkulující endoteliální progenitorové buňky, aCEC – aktivované cirkulující endoteliální buňky, mCEC – zralé cirkulující endoteliální buňky, bb – buňky 
Dynamika v množství aCEC, mCEC a EPC v korelaci s rozsahem onemocnění
Do této části studie bylo zahrnuto 136 pacientů s primární diagnózou, u nichž byla k dispozici data o rozsahu onemocnění, léčbě a odpovědi na léčbu. Základní data o pacientech jsou shrnuta v tabulce 3.
Tab. 3. Popisná statistika souboru podle diagnóz k analýze rozsahu onemocnění, léčby a odpovědi na léčbu. 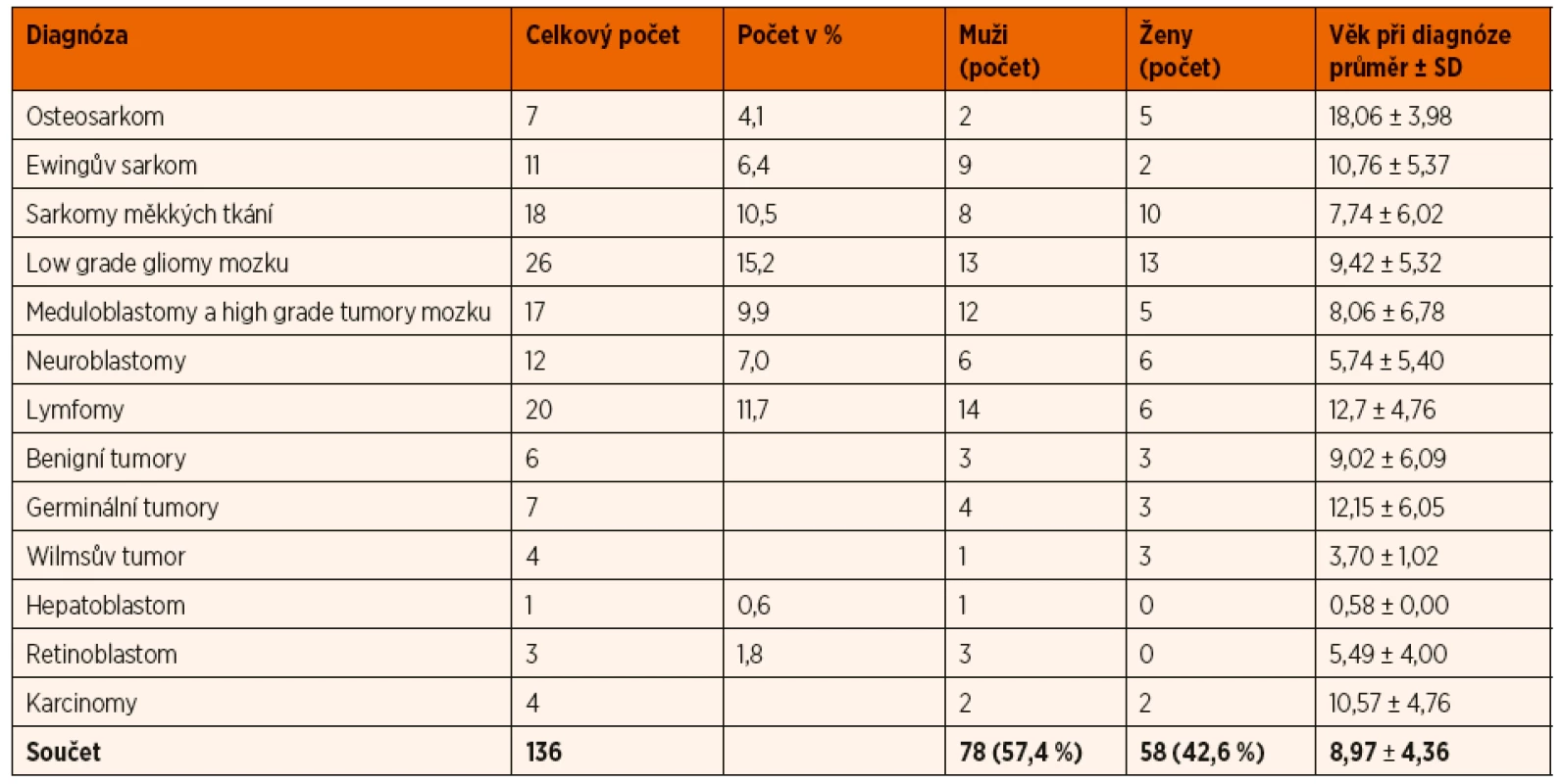
SD – směrodatná odchylka Při korelaci dynamiky hodnot aCEC s rozsahem onemocnění v době diagnózy nebyl nalezen statisticky významný rozdíl mezi skupinami pacientů s lokalizovanou versus metastatickou chorobou. U mCEC byl patrný výraznější klesající trend ve skupině s metastatickou chorobou ve srovnání s lokalizovaným onemocněním. Tento rozdíl ale nebyl statisticky významný (graf 4). Na hranici statistické významnosti (p = 0,09) byl rozdíl v absolutní hodnotě EPC v závislosti na rozsahu onemocnění, pacienti s metastatickou chorobou měli nižší hodnoty EPC, a to jak při diagnóze, tak i při přešetření ve srovnání s pacienty s lokalizovanou chorobou. Dynamika v hodnotách EPC v době diagnózy a při přešetření byla přitom u obou skupin obdobná (graf 5).
Graf 4. Dynamika mCEC v korelaci s rozsahem onemocnění. mCEC – zralé cirkulující endoteliální buňky; bb – buňky 
Graf 5. Dynamika EPC v korelaci s rozsahem onemocnění. EPC – cirkulující endoteliální progenitorové buňky; bb – buňky 
Dynamika v množství aCEC, mCEC a EPC v korelaci s léčbou
V dynamice hodnot aCEC a mCEC nebyl nalezen statisticky významný rozdíl mezi skupinou pacientů, kteří absolvovali pouze operační zákrok, a skupinou pacientů, kteří absolvovali chemoterapii a/nebo radioterapii.
Při srovnání hodnot EPC v době diagnózy a v rámci přešetření byl patrný výraznější klesající trend ve skupině s následnou léčbou ve srovnání s pacienty, kteří absolvovali pouze operaci. Tento trend nebyl statisticky signifikantní (graf 6).
Graf 6. Dynamika EPC v korelaci s léčbou. EPC – cirkulující endoteliální progenitorové buňky; bb – buňky 
Dynamika v množství aCEC, mCEC a EPC v korelaci s odpovědí na léčbu
Srovnáním dynamiky hodnot aCEC v čase byl pozorován výrazný klesající trend ve skupině, jež neodpověděla na léčbu nebo dosáhla pouze stabilizace onemocnění ve srovnání se skupinou s objemovou regresí tumoru. Rozdíl v této dynamice mezi oběma skupinami byl statisticky významný (graf 7), zatímco dynamika hodnot mCEC a EPC byla srovnatelná mezi oběma skupinami.
Graf 7. Dynamika aCEC v korelaci s odpovědí na léčbu. aCEC – aktivované cirkulující endoteliální buňky; bb – buňky; CR – kompletní remise; PR – parciální remise; SD – stabilní onemocnění; PD – progrese onemocnění 
DISKUSE
V předkládané práci jsme se zaměřili na rozdíly v množství CEC a EPC u různých diagnostických skupin. Neprokázali jsme statisticky významný rozdíl mezi hodnotami aCEC a mCEC u jednotlivých diagnostických skupin, a to jak iniciálně před zahájením léčby, tak i při druhém odběru v rámci přešetření. V naší studii jsme neměli tzv. zdravou kontrolu, jako kontrolu jsme proto použili skupinu pacientů s neonkologickým onemocněním, kteří byli hospitalizováni na Klinice dětské onkologie FN Brno v rámci diferenciální diagnostiky. Nicméně třetina těchto dětí měla zánětlivé onemocnění, jež je v literatuře spojováno se zvýšenými hodnotami CEC. Tři dívky z této skupiny měly torzi vaječníků, stav, který vede k narušení cév a tím i endotelia, což ve finále může také vést ke zvýšeným hodnotám CEC. Stejně tak byli do této skupiny zahrnuti tři pacienti s cévní malformací, kde je narušení endotelu více než pravděpodobné. I přes tyto důvody při srovnání hodnot CEC u pacientů s neonkologickým onemocněním z naší studie s hodnotami uvedenými v publikaci Taylor a spol. u zdravých dětí není patrný výrazný rozdíl [18].
Hodnoty mCEC ve skupině dětí s neonkologickým onemocněním v naší studii byly v rozsahu 1,1‒98,1 bb//ml, medián 12,5 bb/ml, hodnoty CEC u zdravých dětí uvedené v publikaci Taylor a spol., kde CEC byly definovány obdobně jako u našich pacientů, byly v rozsahu 0‒56 bb/ml s mediánem 7,5 bb/ml. Nicméně ve srovnání s hodnotami uvedenými v publikaci Duboisa a kol. byly hodnoty u zdravých dětí několikanásobně vyšší než v naší studii – medián 1670 bb/ml, rozsah 330‒4700 bb//ml [19]. Definice CEC přitom byla obdobná jako v naší studii. Důvod pro tento rozdíl se zdá být metodologický, analytická fáze je však obdobná, rozdíl může tedy být v preanalytické fázi, jež v publikaci není uvedena.
Také hodnoty EPC se u jednotlivých diagnostických skupin významně nelišily. Obdobné závěry byly publikovány i ostatními skupinami investigátorů, nicméně korelace s těmito studiemi je obtížná, jelikož definice EPC se mezi jednotlivými studiemi lišila, zejména v expresi CD133. V naší studie jsme protilátku proti tomuto antigenu nepoužili, což může být limitující pro definitivní stanovení EPC.
Při srovnání dynamiky hodnocených buněk iniciálně a v průběhu přešetření byl nalezen statisticky signifikantní pokles v aCEC a mCEC. Tento pokles může být díky normalizaci cévního zásobení tumoru působením chemoterapie, jež vede ke stabilizaci cév a tím i endotelia, což by odpovídalo nižším hodnotám CEC ve srovnání s hodnotami při diagnóze.
Ve své první studii Pradhan a spol. prokázali signifikantně nižší hodnoty CEC u dětských onkologických pacientů ve srovnání se zdravou kontrolou, a to jak iniciálně při stanovení diagnózy, tak i D21 léčby, tedy po prvním cyklu chemoterapie [20]. Nicméně při srovnání hodnot CEC u pacientů v těchto dvou bodech nebyl patrný žádný významný rozdíl. Je nutno podotknout, že Pradhan definoval CEC jako pouze apoptotické zralé CEC, což může být důvodem pro rozdílné výsledky mezi naší a jeho studií.
Ve své druhé studii z roku 2015 prokázali Pradhan a spol. hodnoty CEC u onkologických pacientů signifikantně nižší ve srovnání se zdravou kontrolou a tento významný rozdíl zůstal zachován v průběhu a po ukončení léčby [21]. Nicméně zde již byl statisticky signifikantní rozdíl mezi hodnotami CEC po ukončení léčby u pacientů, kteří dosáhli kompletní remisi a množství CEC u nich bylo nižší, ve srovnání s těmi, kteří kompletní remisi nedosáhli. I přesto však nebyl patrný významný rozdíl mezi hodnotami CEC iniciálně a po ukončení léčby. Jelikož jsme nepoužili barvení na viabilitu buněk, nelze přesně určit, zda v naší studii došlo ke snížení viabilních CEC nebo i těch apoptotických.
V korelaci s ostatními podobnými výzkumnými skupinami jsme neprokázali statisticky významný rozdíl v hodnotách aCEC, mCEC a EPC mezi pacienty s lokalizovanou vs. metastatickou chorobou. U hodnot mCEC byl patrný výraznější klesající trend ve skupině s metastatickou chorobou ve srovnání s lokalizovaným onemocněním, což by hypoteticky mohlo odpovídat výraznější odezvě rozvinutější nádorové vaskulatury při již metastatickém onemocnění na chemoterapii. Možná ale je i opačná hypotéza – mírnější klesající trend u lokalizovaného onemocnění by také mohl být způsoben současně stoupající hodnotou apoptotických CEC, jež se při naši definici těchto buněk promítnou do mCEC také, což by poukazovalo na lepší efekt chemoterapie u těchto pacientů.
Na hranici statistické významnosti byl rozdíl v absolutním počtu EPC mezi pacienty s lokalizovanou vs. metastatickou chorobou iniciálně i při druhém odběru v průběhu přešetření, přičemž dynamika u obou skupin zůstala stejná. Hodnoty EPC u pacientů s metastázami byly nižší než u těch s pouze primárním tumorem.
Taylor a spol. ve své studii naopak prokázali korelaci výše hodnot EPC s metastatickým onemocněním. Jelikož analyzovaný soubor byl obdobný s naším včetně heterogenity zkoumaných diagnóz, důvod takto rozdílného výsledku se zdá být opět spíše metodologický. Taylor a spol. k analýze použili suspenzi mononukleárních buněk obohacenou o progenitory, zatímco v naši studii jsme použili plnou krev bez předchozí separace buněk. EPC ve francouzské studii byly definovány jako CD45dimCD34+VEGFR2+7AAD-, zatímco u nás jako CD45+/-CD34+CD146+.
Při sledování vlivu léčby na hodnoty aCEC, mCEC a EPC nebyl nalezen statisticky signifikantní rozdíl mezi dětmi pouze po operačním zákroku ve srovnání s těmi, jež následně absolvovaly léčbu chemoterapií a/nebo radioterapií. Pouze při srovnání hodnot EPC v době diagnózy a v rámci přešetření byl patrný výraznější klesající trend ve skupině s následnou léčbou. Pradhan a spol. ve své práci z roku 2011 prokázali naopak zvýšené množství endoteliálních buněk schopných tvořit kolonie (ECFC) u dětských onkologických pacientů po prvním bloku chemoterapie ve srovnání se zdravou kontrolou, přičemž ale rozdíl hodnot ECFC u těchto pacientů před léčbou a den 21 bloku nebyl statisticky významný, tedy šlo nejspíše jen o mírný nárůst hodnot mezi těmito dvěma daty. Také definice ECFC je v této práci rozdílná od definice EPC v naší studii. Tudíž srovnání zde není úplně možné.
Při korelaci dynamiky hodnot cirkulujících endotelií s odpovědí na léčbu jsme u mCEC a EPC nenalezli statisticky signifikantní rozdíl mezi pacienty, kteří dosáhli objemovou regresi tumoru (s kompletní a parciální remisí), a pacienty, kteří dosáhli pouze stabilizaci onemocnění nebo u nichž došlo k progresi tumoru. V hodnotách aCEC byl ale pozorován výrazný klesající trend ve skupině bez objemové redukce tumoru ve srovnání s druhou skupinou s kompletní či parciální remisi. Tento rozdíl mezi dynamikou obou skupin byl statisticky významný, nicméně hodnoty aCEC při druhém odběru, provedeném v rámci přešetření, byly u obou skupin obdobné. Rozdíl byl tedy zejména v iniciálních hodnotách před zahájením léčby. Tyto výsledky mohou naznačovat, že pacienti s iniciálně vyšší hladinou aCEC hůře odpovídají na konvenční léčbu.
Hlavním problémem studia cirkulujících endoteliálních buněk, a to jak CEC, tak i EPC, je absence jednoznačné imunofenotypické definice těchto buněk, což činí srovnávání výsledků různých studií jen velice obtížné. Také tento fakt dosud brání jejich eventuálnímu využití jako markeru angiogeneze u onkologických pacientů. Navíc se ukazuje, že množství CEC i EPC se po stimulaci mohou měnit během hodin, tedy problémem zůstává i načasování jednotlivých odběrů, což může být limitující i pro naši studii (například odběr krve ráno ještě před podáním samotné chemoterapie). Také množství těchto buněk je ovlivňováno několika faktory, jež se často u dětských onkologických pacientů prolínají, například febrilní neutropenie, menší operační zákrok, podávání Neupogenu atd.
ZÁVĚR
V naší studii jsme tedy nepotvrdili význam EPC a CEC jako spolehlivého snadno dostupného markeru u onkologických pacientů, jelikož hodnoty byly srovnatelné i s pacienty s benigním tumorem nebo neonkologickým onemocněním. Pro další využitelnost EPC a CEC je nutná jednoznačná imunofenotypická definice těchto buněk a jasný protokol pro analýzu pomocí průtokové cytometrie, aby bylo možné výsledky jednotlivých studií věrohodně srovnávat.
Došlo: 19. 1. 2018
Přijato: 7. 5. 2018
MUDr. Danica Zapletalová
Klinika dětské onkologie FN Brno
Černopolní 9
613 00 Brno
e-mail: zapletalova.danica@fnbrno.czs
Zdroje
1. Selt F, Deiß A, Korshunov A, et al. Pediatric targeted therapy: Clinical feasibility of personalized diagnostics in children with relapsed and progressive tumors: Pediatric targeted therapy. Brain Pathol 2016; 26 (4): 506–516.
2. Wang W, Zhang E, Lin C. MicroRNAs in tumor angiogenesis. Life Sci 2015; 136 : 28–35.
3. Ronca R, Benkheil M, Mitola S, et al. Tumor angiogenesis revisited: Regulators and clinical implications. Med Res Rev 2017; 37 (6): 1231–1274.
4. Van de Broek I. Circulating endothelial cells as a biomarker for angiogenesis in cancer: where do we stand? Belg J Med Oncol 2010; (4): 10–17.
5. Mehran R, Nilsson M, Khajavi M, et al. Tumor endothelial markers define novel subsets of cancer-specific circulating endothelial cells associated with antitumor efficacy. Cancer Res 2014; 74 (10): 2731–2741.
6. Schmidt DE, Manca M, Hoefer IE. Circulating endothelial cells in coronary artery disease and acute coronary syndrome. Trends Cardiovasc Med 2015; 25 (7): 578–587.
7. Camus SM, De Moraes JA, Bonnin P, et al. Circulating cell membrane microparticles transfer heme to endothelial cells and trigger vasoocclusions in sickle cell disease. Blood 2015; 125 (24): 3805–3814.
8. Laurenzana A, Fibbi G, Margheri F, et al. Endothelial progenitor cells in sprouting angiogenesis: Proteases pave the way. Curr Mol Med 2015; 15 (7): 606–620.
9. Madonna R, De Caterina R. Circulating endothelial progenitor cells: Do they live up to their name? Vascul Pharmacol 2015; 67–69 : 2–5.
10. Bertolini F, Shaked Y, Mancuso P, Kerbel RS. The multifaceted circulating endothelial cell in cancer: towards marker and target identification. Nat Rev Cancer 2006; 6 (11): 835–845.
11. Obeid J, Nguyen T, Walker RG, et al. Circulating endothelial cells in children: role of fitness, activity, and adiposity. Med Sci Sports Exerc 2014; 46 (10): 1974–1980.
12. Danova M, Comolli G, Manzoni M, et al. Flow cytometric analysis of circulating endothelial cells and endothelial progenitors for clinical purposes in oncology: A critical evaluation (review). Mol Clin Oncol 2016; 4 (6): 909–917.
13. Espagnolle N, Guilloton F, Deschaseaux F, et al. CD146 expression on mesenchymal stem cells is associated with their vascular smooth muscle commitment. J Cell Mol Med 2014; 18 (1): 104–114.
14. Barteneva NS, Vorobjev IA (Eds). Imaging Flow Cytometry. Vol. 1389. New York, NY: Springer New York, 2016.
15. Medina RJ, Barber CL, Sabatier F, et al. Endothelial progenitors: A consensus statement on nomenclature: Endothelial progenitors nomenclature. Stem Cells Transl Med 2017; 6 (5): 1316–1320.
16. Bertolini F, Mancuso P, Braidotti P, et al. The multiple personality disorder phenotype(s) of circulating endothelial cells in cancer. Biochim Biophys Acta BBA – Rev Cancer 2009; 1796 (1): 27–32.
17. Kyr M, Fedora M, Elbl L, et al. Modeling effect of the septic condition and trauma on C-reactive protein levels in children with sepsis: a retrospective study. Crit Care 2007; 11 (3): R70.
18. Taylor M, Rossler J, Geoerger B, et al. High levels of circulating VEGFR2+ bone marrow-derived progenitor cells correlate with metastatic disease in patients with pediatric solid malignancies. Clin Cancer Res 2009; 15 (14): 4561–4571.
19. DuBois SG, Stempak D, Wu B, et al. Circulating endothelial cells and circulating endothelial precursor cells in patients with osteosarcoma. Pediatr Blood Cancer 2012; 58 (2): 181–184.
20. Pradhan KR, Mund JA, Johnson C, et al. Polychromatic flow cytometry identifies novel subsets of circulating cells with angiogenic potential in pediatric solid tumors. Cytometry B Clin Cytom 2011; 80B (5): 335–338.
21. Pradhan KR, Mund JA, Claussen HL, et al. A pilot study of circulating endothelial and hematopoietic progenitor cells in children with sarcomas. J Pediatr Hematol Oncol 2015; 37 (6): 443–448.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článek Hemofilie a léčba inhibitoru
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2018 Číslo 7- Subkutánne vs. intravenózne imunoglobulíny u pacientov s CLL
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Gastroezofageální reflux a gastroezofageální refluxní onemocnění u kojenců a batolat
-
Všetky články tohto čísla
- Editorial: Když hluchý slyší, aneb zázraky moderní medicíny
- Sluchové vady a poruchy dětského věku
- Historie a současnost kochleárních implantací v Česku
- Rehabilitace sluchu v dětském věku
- Súčasný stav skríningu sluchu novorodencov a skríningu sluchu v predškolskom a školskom veku v Slovenskej republike
- Cirkulující endoteliální a progenitorové buňky jako biomarkery angiogeneze u dětských onkologických pacientů
- Tubulointersticiálna nefritída ako príčina akútneho renálneho zlyhania u detí
- Hemofilie a léčba inhibitoru
- Možnosti antibiotické léčby akutního středoušního zánětu
- Základy klinické imunologie – informace o nové knize
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Možnosti antibiotické léčby akutního středoušního zánětu
- Tubulointersticiálna nefritída ako príčina akútneho renálneho zlyhania u detí
- Sluchové vady a poruchy dětského věku
- Historie a současnost kochleárních implantací v Česku
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



