-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Monogenně podmíněný diabetes MODY v dětském věku: retrospektivní studie pacientů diagnostikovaných na Dětské klinice FN Plzeň v letech 2000–2017
Monogenic diabetes MODY in childhood: a retrospective study of patients diagnosed at the Department of Pediatrics, University Hospital in Pilsen in 2000–2017
Objective:
The aim of the retrospective study was to investigate the incidence of monogenic diabetes MODY (Maturity Onset Diabetes of the Young) in patients examined at the Department of Pediatrics, University Hospital in Pilsen in 2000–2017. 16 patients with monogenic diabetes were included in the study: 9 girls and 7 boys with an average age of 10.2 years (ranging from 3 to 17 years).
Methods:
The following parameters were retrospectively analysed in all patients: sex, age at the time of diagnosis, familial incidence of the disease, baseline parameters of carbohydrate metabolism (fasting blood glucose, glycated hemoglobin HbA1c), oral glucose tolerance test (oGTT), intravenous glucose tolerance test (ivGTT), and islet cell autoantibodies. The diagnosis of MODY diabetes was confirmed by molecular genetic testing of GCK, HNF1A, HNF4A a HNF1B genes.
Results:
In the analysed group, 13 cases of GCK-MODY and 3 cases of HNF-diabetes (HNF4A-MODY, HNF1A-MODY, HNF1B-MODY) were confirmed. Patients with GCK-MODY had a slightly elevated fasting blood glucose (6.3–7.3 mmol/l) and HbA1c (median of 46 mmol/mol), impaired glucose tolerance on the oGTT in 94%, physiological first-phase insulin response (FPIR) during ivGTT, and negative islet cell autoantibodies. In one family, the most frequently described mutation in the glucokinase gene p.Glu40Lys in the Czech Republic was confirmed. Patients with HNF-diabetes had a diabetic curve on the oGTT, decreased FPIR during ivGTT, median HbA1c of 64 mmol/mol, and negative islet cell autoantibodies. The diagnosis of GCK-MODY in the families allowed discontinuation of treatment with insulin and oral antidiabetic drugs (OADs) and, in the case of HNF-diabetes, switching from insulin to OADs.
Conclusion:
The differential diagnosis in patients with impaired glucose tolerance or diabetes mellitus should include MODY diabetes. Confirmation or ruling out of the gene mutation predicts disease progression and proper choice of therapy. Knowledge of the gene mutation enables disease detection in the presymptomatic phase in the affected families.
Keywords:
molecular genetic testing – monogenic diabetes – MODY diabetes – oral glucose tolerance test
Autoři: J. Zamboryová 1; R. Pomahačová 1; K. Fiklík 1; L. Elblová 2; J. Sýkora 1
Působiště autorů: Dětská klinika Lékařské fakulty v Plzni, Univerzity Karlovy v Praze a Fakultní nemocnice, Plzeň 1; Pediatrická klinika 2. lékařské fakulty Univerzity Karlovy a Fakultní nemocnice Motol, Praha 2
Vyšlo v časopise: Čes-slov Pediat 2019; 74 (1): 16-21.
Kategorie: Sympozium: Dětská diabetologie
Souhrn
Cíl:
Cílem retrospektivní studie bylo zmapování výskytu monogenního diabetu MODY (Maturity Onset Diabetes of the Young) u pacientů vyšetřených na Dětské klinice FN Plzeň v letech 2000–2017. Do studie bylo zařazeno 16 pacientů s monogenním diabetem, z toho 9 dívek a 7 chlapců průměrného věku 10,2 roku (rozmezí 3–17 let).
Metody:
U všech pacientů jsme retrospektivně hodnotili zastoupení pohlaví, věk v době diagnózy, familiární výskyt onemocnění, vstupní parametry sacharidového metabolismu (glykémie nalačno, glykovaný hemoglobin HbA1c), orální glukózový toleranční test (oGTT), intravenózní glukózový toleranční test (ivGTT) a specifické autoprotilátky proti β-buňkám pankreatu. Diagnóza MODY diabetu byla potvrzena molekulárně genetickým vyšetřením genů GCK, HNF1A, HNF4A a HNF1B.
Výsledky:
V hodnoceném souboru byl ve 13 případech potvrzen glukokinázový diabetes (GCK-MODY) a ve 3 případech diabetes transkripčních faktorů (HNF-diabetes) – HNF4A-MODY, HNF1A-MODY a HNF1B-MODY. Pacienti s GCK-MODY měli mírně zvýšenou lačnou glykémii (6,3–7,3 mmol/l) a HbA1c (medián 46 mmol/mol), při oGTT v 94 % poruchu glukózové tolerance, při ivGTT fyziologickou iniciální fázi sekrece inzulinu (FPIR) a negativní specifické autoprotilátky proti β-buňkám pankreatu. V jedné rodině byla potvrzena nejčastěji popisovaná mutace P.Glu40Lys v genu pro glukokinázu v ČR. Pacienti s HNF-diabetem měli diabetický průběh oGTT, sníženou FPIR při ivGTT, medián HbA1c 64 mmol/mol a negativní specifické autoprotilátky. Diagnóza GCK-MODY v rodinách umožnila ukončení léčby inzulinem a perorálními antidiabetiky (PAD) a v případě HNF-diabetu došlo k převedení léčby z inzulinu na PAD.
Závěr:
U pacientů s poruchou glukózové tolerance nebo s diabetes mellitus je třeba diferenciálně diagnosticky myslet na MODY diabetes. Potvrzení nebo vyloučení genové mutace predikuje vývoj onemocnění a volbu správné terapie. Znalost genové mutace umožňuje záchyt onemocnění v presymptomatické fázi v postižených rodinách.
Klíčová slova:
molekulárně genetické vyšetření – monogenní diabetes – MODY diabetes – orální glukózový toleranční test
ÚVOD
Monogenně podmíněný diabetes je forma diabetes mellitus (DM), která je způsobena odchylkou jediného genu. Podle odhadů postihuje tato forma diabetu 3–5 % všech diabetických pacientů. Řada pacientů s monogenním diabetem bývá prvotně vedena pod diagnózou diabetes mellitus 1. nebo 2. typu. Většina případů monogenního diabetes mellitus je u dětí způsobena mutacemi v genech regulujících funkci β-buněk pankreatu. MODY (Maturity Onset Diabetes of the Young) je definovaný jako DM s časným začátkem a autosomálně dominantní dědičností [1, 2]. Projevuje se jako glukokinázový diabetes (GCK) nebo jako diabetes transkripčních faktorů. Správné určení monogenně podmíněného typu diabetu je důležité pro zahájení vhodné terapie [3].
Glukokinázový diabetes (familiární mírná hyperglykémie, GCK-MODY, dříve MODY2) je způsobený heterozygotním nosičstvím mutace v genu pro glukokinázu (GCK). Homozygotní mutace v genu pro GCK je příčinou permanentního novorozeneckého diabetu. GCK-MODY je charakterizován chronickou mírnou hyperglykémií od narození do stáří, s minimální progresí během života [1, 3]. Hyperglykémie při GCK-MODY vzniká na podkladě poruchy funkce enzymu glukokinázy, který je senzorem β-buněk pro glukózu. V důsledku tohoto defektu β-buňky zahajují sekreci inzulinu při vyšší glykémii než 5 mmol/l [2, 3]. Většinou se jedná o asymptomatickou, náhodně zjištěnou hyperglykémii. U pacientů je typicky mírně zvýšená lačná glykémie o 2–3 mmol/l nad fyziologickou mez. Postprandiálně glykémie většinou nepřesahuje hranici 10 mmol/l. Při orálním glukózovém tolerančním testu (oGTT) mají pacienti normální glukózovou toleranci nebo splňují kritéria pro poruchu glukózové tolerance. Při intravenózním glukózovém tolerančním testu (ivGTT) vykazují fyziologickou iniciální fázi sekrece inzulinu β-buňkami pankreatu. Specifické autoprotilátky proti β-buňkám pankreatu jsou negativní. Glykovaný hemoglobin je u pacientů s GCK-MODY trvale pouze mírně zvýšený a k progresi poruchy do diabetes mellitus spolu s rizikem pozdních diabetických komplikací nedochází [2, 3]. GCK-MODY nevyžaduje léčbu inzulinem, doporučují se dietní opatření s omezením rychle působících sacharidů. Inzulinoterapie je někdy podávána pouze u žen v graviditě [2, 4].
Nejčastější formou diabetu transkripčních faktorů (HNF-diabetes) je HNF1A-MODY (dříve MODY3), způsobený heterozygotní mutací v genu pro hepatocytární nukleární faktor-1 alfa, HNF4A-MODY (dříve MODY1), který vzniká na podkladě heterozygotního nosičství mutace v genu pro hepatocytární nukleární faktor-4 alfa a HNF1B-MODY (syndrom renálních cyst a diabetu, dříve MODY5), způsobený mutací v genu pro hepatocytární nukleární faktor-1 beta. Vedle glukokinázového diabetu jsou toto nejčastější formy MODY diabetu. V prvních letech života mají pacienti normální glukózovou toleranci, postupně však dochází k selhání funkce β-buněk s rozvojem diabetu v dětství, adolescenci nebo časné dospělosti. HNF-diabetes se většinou manifestuje jako náhodně zjištěná hyperglykémie nebo se projeví osmotickými příznaky. Typická bývá pozitivní rodinná anamnéza DM a negativní specifické autoprotilátky proti β-buňkám pankreatu [4]. Diabetes není životně závislý na inzulinu. Vysazení inzulinu nevede přímo ke ketoacidóze, ale v zátěžových situacích, jako je například dehydratace při akutní gastroenteritidě, se diabetická ketoacidóza může vyvinout [5]. Pro tento typ diabetu je typická nízká potřeba inzulinu a pozitivní C-peptid více než 3 roky po manifestaci diabetu. Pacienti jsou ohroženi pozdními diabetickými komplikacemi, proto je u nich nezbytná optimální metabolická kontrola. Diabetes lze léčit deriváty sulfonylurey.
CÍL STUDIE
Cílem retrospektivní studie bylo zmapování výskytu monogenního diabetu MODY u pacientů diagnostikovaných na Dětské klinice Fakultní nemocnice v Plzni v letech 2000–2017. Hodnoceno bylo zastoupení pohlaví v souboru, věk v době diagnózy, familiární výskyt onemocnění, vstupní parametry sacharidového metabolismu (glykémie nalačno, glykovaný hemoglobin HbA1c), zátěžové testy (oGTT, ivGTT) a specifické autoprotilátky proti β-buňkám pankreatu.
SOUBOR PACIENTŮ
Soubor tvořilo 16 pacientů s monogenním diabetem MODY, z toho 9 dívek a 7 chlapců průměrného věku 10,2 roku (rozmezí 3–17 let). V hodnoceném souboru bylo zahrnuto 13 pacientů s glukokinázovým diabetem (GCK-MODY) a 3 pacienti s HNF-diabetem (HNF1A-MODY, HNF4A-MODY a HNF1B-MODY).
LABORATORNÍ METODY
U všech pacientů byl retrospektivně pro zachycenou zvýšenou lačnou glykémii (glykémie >5,6 mmol/l) proveden orální glukózový toleranční test (oGTT). Jedinci s patologickým oGTT (porucha glukózové tolerance s glykémií ve 120. minutě po podání glukózy 7,8–11,1 mmol/l nebo diabetický průběh zátěžové křivky s glykémií ve 120. minutě nad 11,1 mmol/l) podstoupili intravenózní glukózový toleranční test (ivGTT) ke zjištění první fáze stimulované inzulinové sekrece (FPIR „first-phase insulin response“ = součet hladin inzulinu v 1. a 3. minutě po intravenózně podaném bolusu glukózy). Za normu byla považována u prepubertálních pacientů FPIR nad 30 mIU/l, v pubertě nad 40 mIU/l a postpubertálně nad 45 mIU/l [6]. U všech pacientů byly stanoveny specifické autoprotilátky proti dekarboxyláze kyseliny glutamové (anti-GAD), proti tyrosinfosfatáze (anti-IA2), proti inzulinu (anti - IRI) jako markery autoimunitní inzulitidy a glykovaný hemoglobin HbA1c (norma <40 mmol/mol). K potvrzení MODY diabetu bylo provedeno molekulárně genetické vyšetření DNA. Genetická analýza byla provedena v Laboratoři molekulární genetiky Pediatrické kliniky 2. LF UK a FN Motol. Oblasti kódujících sekvencí, promotoru a rozhraní exonů a intronů u genů GCK (NM_000162), HNF1A (NM_000545) a HNF4A (NM_175914) byly analyzovány metodou Sangerova sekvenování [13]. Gen HNF1B (NM_000458) byl vyšetřen metodou MLPA (Multiplex Ligation Probe-dependent Amplification) na přítomnost strukturálních variant (delece, inzerce) a Sangerovým sekvenováním. Všichni vyšetřovaní pacienti podepsali informovaný souhlas s genetickým testováním.
VÝSLEDKY
Glukokinázový diabetes byl potvrzen u 13 pacientů, z toho u 8 dívek a 5 chlapců ve věkovém rozmezí 3–15 let (medián 11 let). Retrospektivně byla u všech pacientů při prvovyšetření zjištěna zvýšená lačná glykémie (rozmezí 6,0–7,4 mmol/l). oGTT potvrdil ve 12 případech (94 %) poruchu glukózové tolerance (glykémie ve 120. minutě 7,8–11 mmol/l), v 1 případě byla glukózová tolerance normální (glykémie ve 120. minutě < 7,8 mmol/l). Žádný pacient s potvrzenou diagnózou glukokinázového diabetu neměl diabetický průběh zátěžové křivky s glukózou (glykémie ve 120. minutě >11,1 mmol/l). Hodnota glykovaného hemoglobinu HbA1c v době stanovení diagnózy byla ve všech případech zvýšená (rozmezí 41–50 mmol/mol; medián 46 mmol/mol). ivGTT vykazoval fyziologickou FPIR. Specifické protilátky proti pankreatu (anti-GAD, anti-IA2, anti-IRI) byly negativní. Laboratorní výsledky souboru shrnuje tabulka 1.
Tab. 1. Hodnoty sledovaných parametrů v době stanovení diagnózy u pacientů s glukokinázovým diabetem. 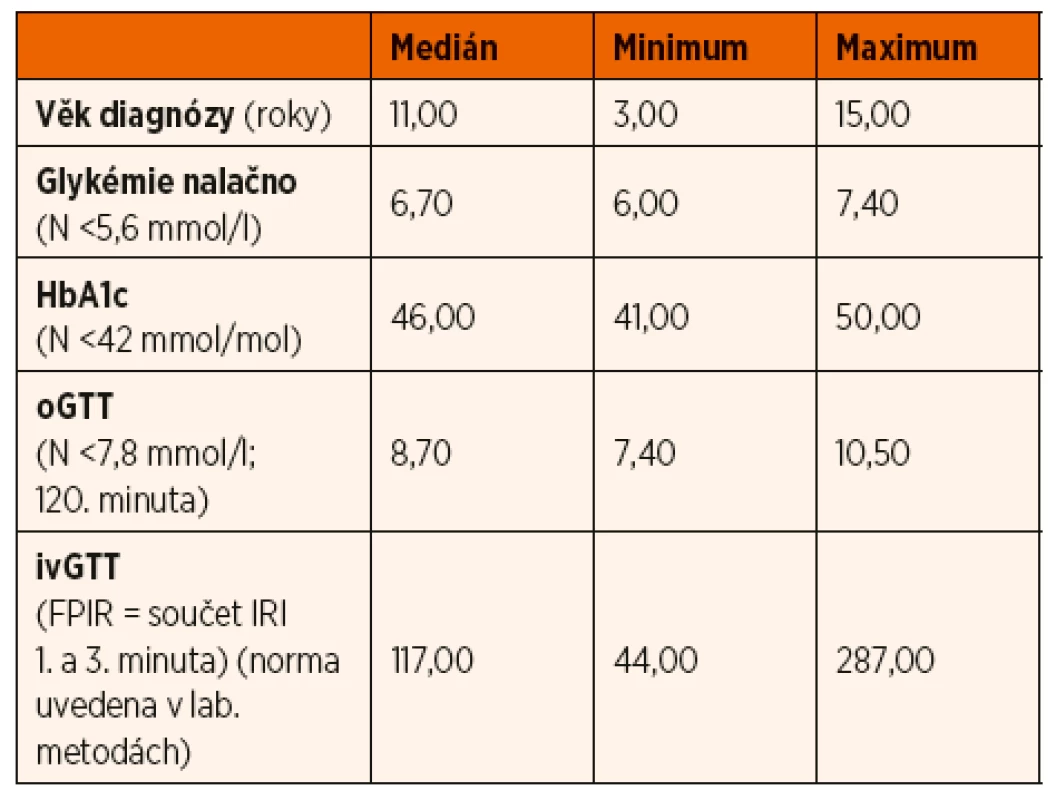
Diagnóza glukokinázového diabetu byla u všech jedinců potvrzena molekulárně geneticky. Jedna rodina je nositelem nejčastěji popisované mutace p.Glu40Lys v genu pro GCK v České republice. Příslušníci dvou rodin jsou nositeli stejné mutace p.Glu268Ter. V jedné rodině byly zjištěny dvě mutace na jedné alele v genu pro GCK (p.Val226Glu, p.Ala188Thr).
Pozitivní rodinná anamnéza poruchy sacharidového metabolismu byla v souboru přítomna v 11 rodinách (85 %); z toho anamnéza gestačního diabetu ve 4 případech, u jednoho člena rodiny byl diabetes léčen inzulinem a veden jako DM 1. typu, 6 osob bylo léčeno jako DM 2. typu perorálními antidiabetiky (PAD). Potvrzení diagnózy glukokinázového diabetu umožnilo u těchto jedinců vysazení inzulinu a PAD. Obrázek 1 ukazuje typický rodokmen rodiny s glukokinázovým diabetem.
Obr. 1. Rodokmen rodiny nesoucí mutaci v genu GCK. Probandem byl 7letý chlapec s náhodně zachycenou zvýšenou lačnou glykémií. Matka a teta dítěte byly vedeny pod diagnózou gestačního diabetu. GCK-MODY: glukokinázový diabetes, GDM: gestační diabetes mellitus 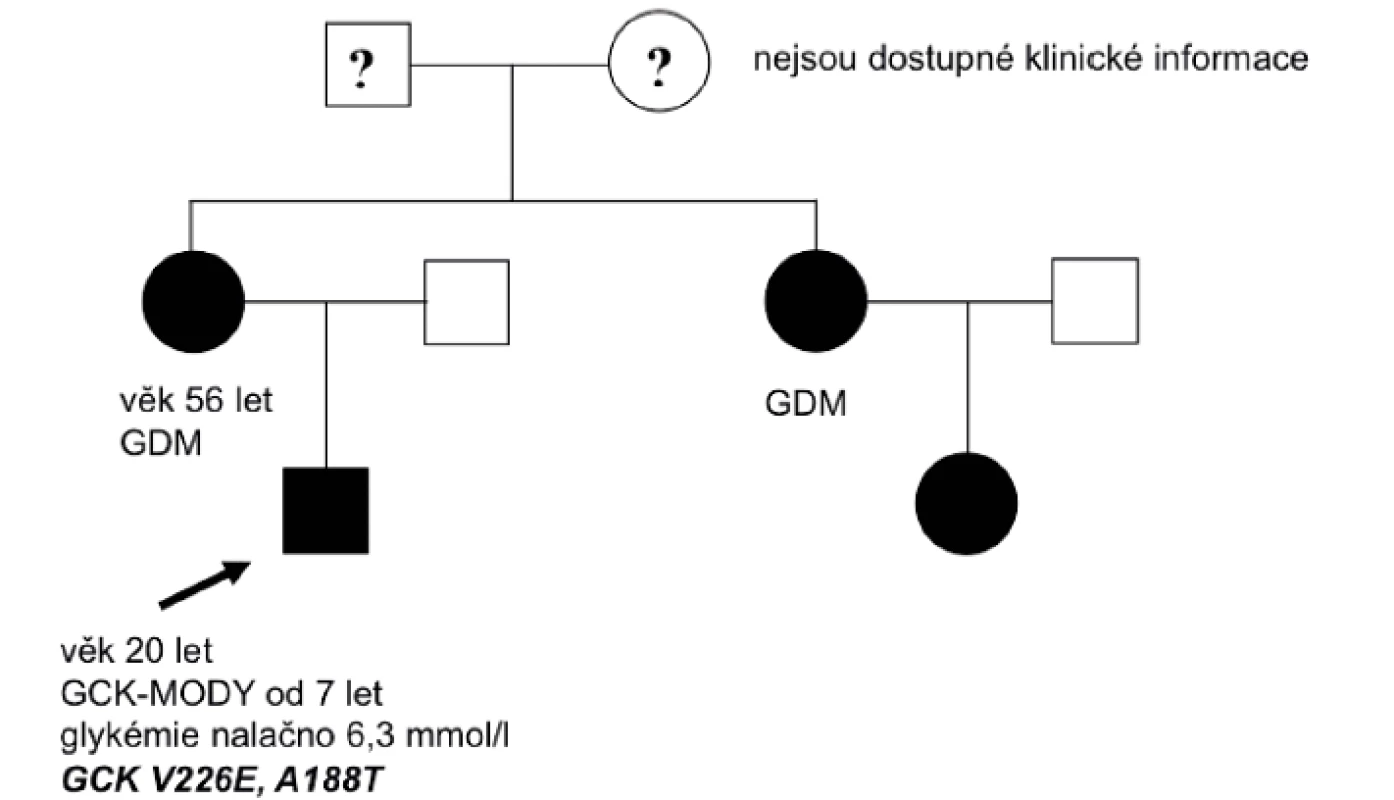
Diabetes transkripčních faktorů byl potvrzen u 3 pacientů, z toho u 2 chlapců a 1 dívky ve věkovém rozmezí 5–17 let (medián 13 let). Pacienti s HNF-diabetem měli diabetický průběh oGTT a sníženou FPIR při ivGTT. Hodnota glykovaného hemoglobinu v době stanovení diagnózy byla zvýšená (medián 64 mmol/mol, rozmezí 52–68). Specifické protilátky proti pankreatu byly negativní. Laboratorní výsledky souboru shrnuje tabulka 2.
Tab. 2. Hodnoty sledovaných parametrů v době stanovení diagnózy u pacientů s diabetem transkripčních faktorů. 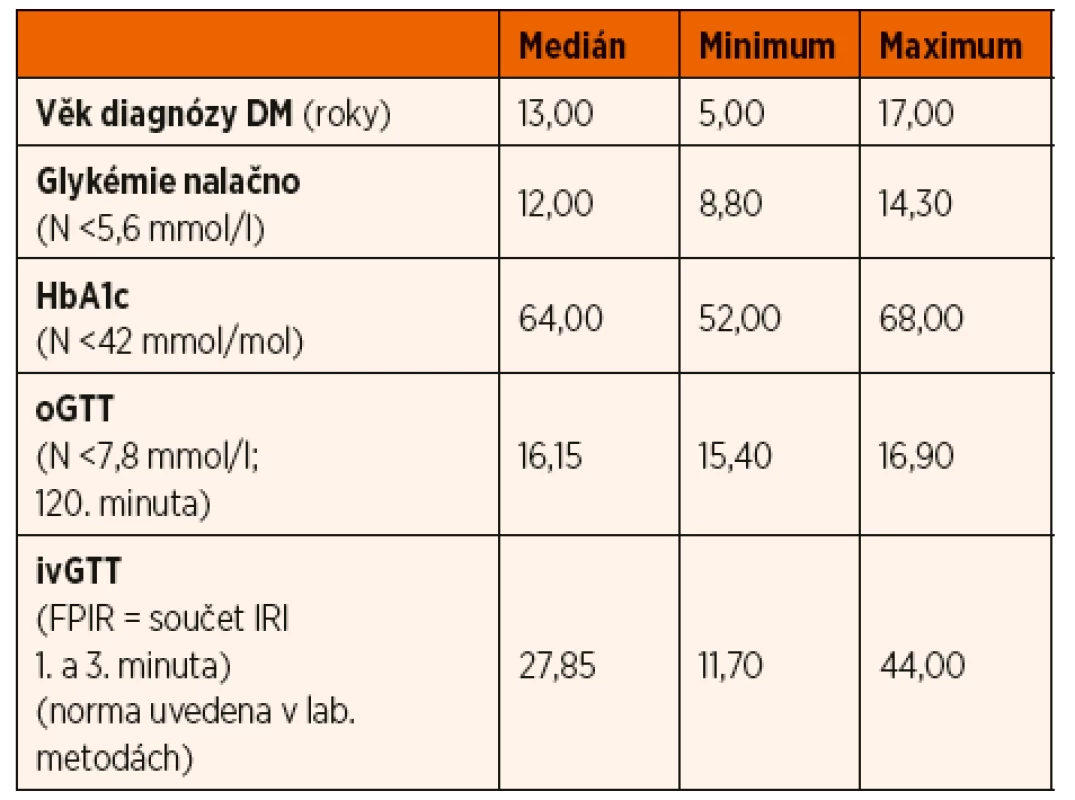
Diagnóza diabetu u pacientky s HNF4A-MODY a u pacienta s HNF1B-MODY diabetem byla stanovena na základě náhodně zachycené hyperglykémie bez osmotické symptomatologie. U pacienta s HNF1A-MODY diabetem byla diagnóza stanovena na podkladě znalosti této diagnózy u matky a u dalších rodinných příslušníků (obr. 3). K podezření na diagnózu diabetu transkripčních faktorů vedl u dětí výskyt diabetes mellitus v rodině ve dvou generacích (obr. 2 a 3), u pacientky s HNF4A-MODY současně více než 3 roky trvající pozitivita C-peptidu, chybějící vývoj diabetické ketoacidózy po vysazení inzulinu při non-compliance v léčbě a negativní autoprotilátky proti pankreatu. U pacienta s HNF1B-MODY bylo vysloveno podezření na tento diabetes díky přítomnosti renální anomálie (solitární levá ledvina s hydronefrózou a megaureterem). Tento pacient nese heterozygotní deleci celého genu HNF1B.
Obr. 2. Rodokmen rodiny nesoucí mutaci v genu HNF4A. Probandem byla 13letá pacientka s náhodným záchytem DM. Markery autoimunitní inzulitidy byly negativní a pozitivita C-peptidu trvala déle než 3 roky. Diabetes mellitus se v rodině vyskytoval ve 3 generacích. Jedinci byli vedeni pod diagnózou diabetes mellitus 1. typu a měli závažné diabetické komplikace. Babička a strýc probandky odmítli podstoupit genetické vyšetření. 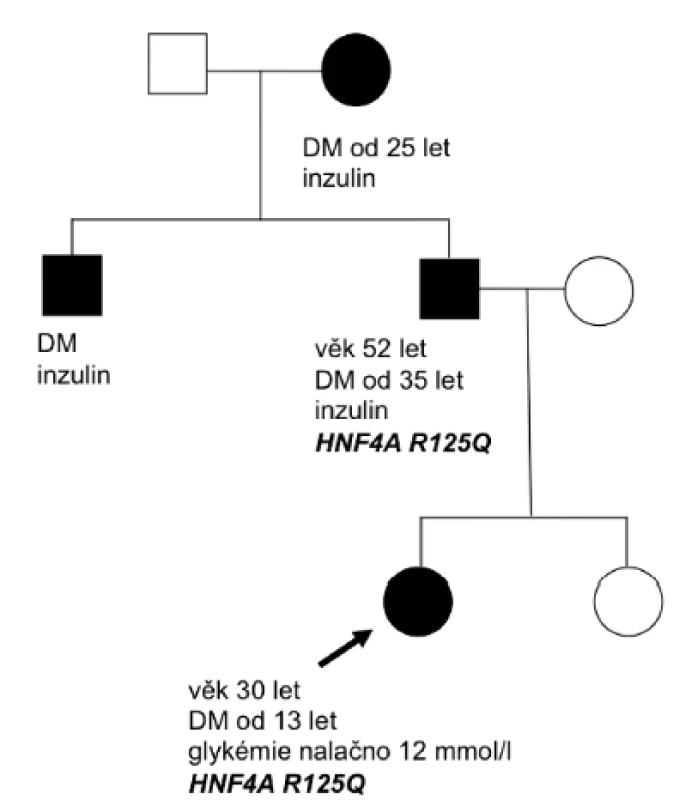
Obr. 3. Rodokmen rodiny nesoucí mutaci v genu HNF1A. Cílené vyšetření potvrdilo mutaci v HNF1A genu u našeho probanda v 5 letech věku a k rozvoji diabetu došlo v 9 letech věku. Nositelkami mutace je mladší sestra pacienta a sestřenice, které mají zatím normální glukózovou toleranci. 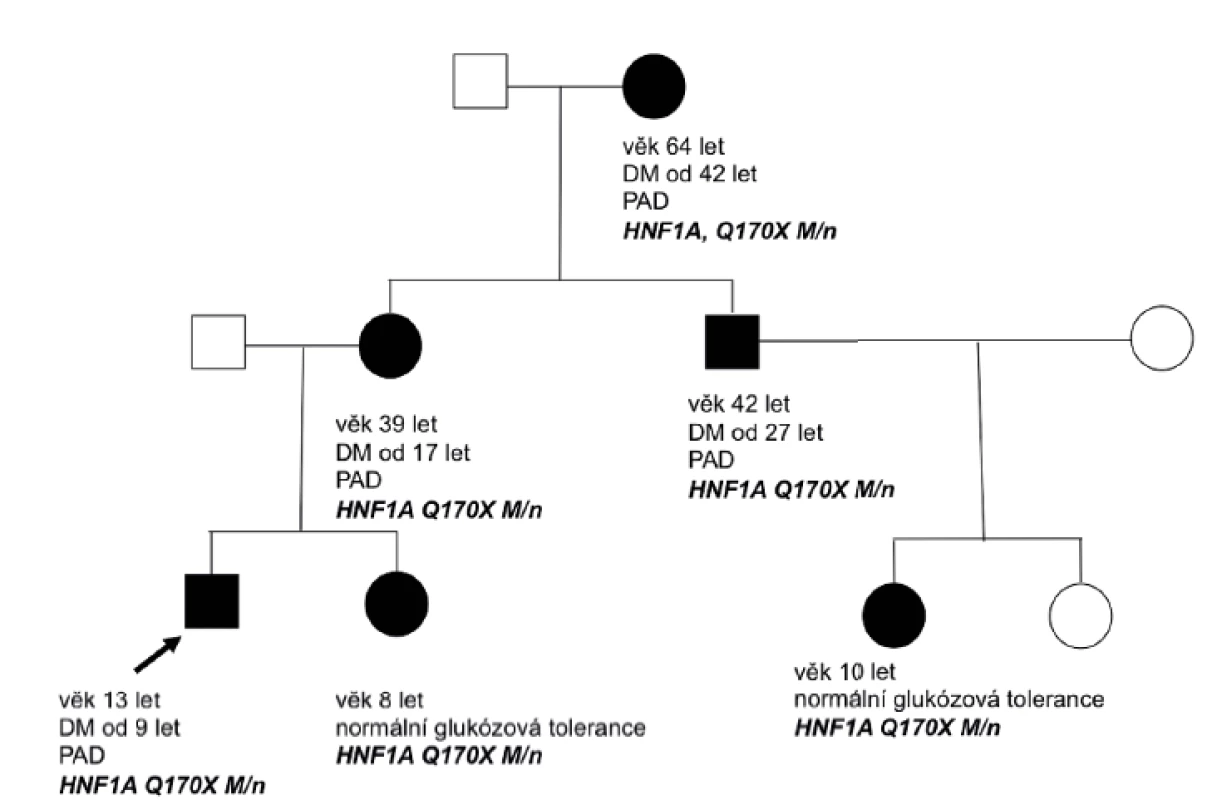
Diagnóza HNF4A-MODY diabetu u naší pacientky vedla k potvrzení stejné diagnózy u dalších rodinných příslušníků, kteří byli vedeni pod diagnózou DM 1. typu, byli léčeni inzulinem a měli závažné pozdní komplikace diabetu. Znalost mutace v genu HNF4A v této rodině současně umožnila vyšetření nevlastní sestry pacientky s vyloučením nosičství dané mutace (obr. 2). V rodině s HNF1A-MODY diabetem umožnila znalost mutace v HNF1A genu potvrzení nosičství stejné mutace u dalších členů rodiny (obr. 3). U těchto dětí je pravidelně sledována glukózová tolerance.
Pacienti s potvrzeným HNF4A-MODY a HNF1B-MODY diabetem byli převedeni z léčby inzulinem na léčbu PAD. Pacient se známou mutací v genu HNF1A byl po stanovení diagnózy HNF1A-MODY diabetu nastaven již přímo na terapii derivátem sulfonylurey.
DISKUSE
Retrospektivní studie pacientů s MODY diabetem diagnostikovaných na Dětské klinice FN Plzeň v letech 2000–2017 potvrdila, ve shodě s literárními údaji, převahu benigní formy glukokinázového GCK-MODY diabetu. K suspekci na MODY diabetes s indikací k molekulárně genetickému vyšetření nás vedl výskyt poruchy sacharidového metabolismu v rodinách v několika generacích, negativní autoprotilátky proti β-buňkám pankreatu, trvající pozitivita C-peptidu s nízkou potřebou inzulinu, chybějící rozvoj diabetické ketoacidózy po vysazení inzulinu a přítomnost renální anomalie. Znalost genové mutace umožnila v našem souboru časnou diagnózu MODY diabetu u dalších rodinných příslušníků s volbou optimální terapie.
Molekulárně genetické vyšetření je v indikovaných případech rozhodující pro diagnózu diabetu MODY a pro určení jeho podtypů [7]. Podle literárních zdrojů jsou k vyšetření indikováni pacienti s pozitivní rodinnou anamnézou diabetu s výskytem nemoci do 30 let věku v každé generaci. Nové poznatky ale poukazují na mnohem vyšší frekvenci de novo mutací, než se dříve předpokládalo. Proto lze genetické testování MODY zvážit i u pečlivě vybraných jedinců bez rodinné anamnézy diabetu [8]. Mezi podpůrná kritéria indikace k molekulárně genetickému vyšetření MODY patří manifestace diabetu bez diabetické ketoacidózy, trvalá stacionární mírná hyperglykémie, dobrá kompenzace diabetu na malých dávkách inzulinu, na dietě nebo na PAD, dále snížený renální práh pro glukózu (glykosurie při normální glykémii) a negativní autoprotilátky proti β-buňkám pankreatu [9].
Glukokinázový diabetes byl v našem souboru potvrzen ve 13 případech. Ve shodě s literárními údaji [1, 2, 4], k diagnóze GCK-MODY diabetu vedl u všech pacientů náhodný záchyt mírně zvýšené lačné glykémie, spolu se zvýšenou hodnotou glykovaného hemoglobinu, nediabetický průběh oGTT, fyziologický FPIR při ivGTT testu a negativita specifických autoprotilátek proti pankreatu. Diagnóza GCK-MODY byla ve všech případech potvrzena molekulárně geneticky. V jedné rodině byla potvrzena nejčastěji popisovaná mutace E40K v genu pro GCK v České republice. oGTT vykazoval v 94 % poruchu glukózové tolerance, ostatní pacienti měli normální glukózovou toleranci. V průběhu našeho sledování zůstává glukózová tolerance, ve shodě s literárními údaji, stacionární [4].
Léčba inzulinem je indikována pouze u gravidních žen s GCK-MODY, pokud podle ultrazvukového vyšetření hrozí makrosomie plodu. Právě těhotenství bývá u těchto žen prvním momentem, kdy je zjištěna hyperglykémie. Podle literárních údajů je mutace v genu pro glukokinázu nalezena u 1–4 % žen s gestačním diabetem [10]. V našem souboru byla anamnéza gestačního diabetu přítomna ve 4 případech (obr. 1; rodokmen rodiny s GCK-MODY diabetem, s anamnézou gestačního diabetu).
Pozitivní rodinná anamnéza poruchy sacharidového metabolismu byla v souboru pacientů s GCK-MODY přítomna v 11 rodinách (85 %). Potvrzení diagnózy GCK-MODY diabetu u těchto rodinných příslušníků umožnilo vysazení inzulinu nebo PAD se zlepšenou kvalitou života.
Diabetes transkripčních faktorů (HNF1A-MODY, HNF4A-MODY a HNF1B-MODY) byl v souboru potvrzen ve 3 případech. K diagnóze HNF-diabetu (HNF4A-MODY a HNF1A-MODY) vedl, ve shodě s literárními údaji, výskyt diabetes mellitus v rodině ve dvou generacích, u pacientky s HNF4A-MODY více než 3 roky trvající pozitivita C-peptidu a chybějící vývoj diabetické ketoacidózy po vysazení inzulinu [1, 2, 4]. V této rodině s HNF4A-MODY umožnila znalost mutace v HNF4A genu vyloučení nosičství dané mutace u nevlastní sestry probandky. U HNF4A-MODY je u 56 % nositelů mutace tendence k novorozenecké makrosomii, která může být provázena v 15 % tranzientní novorozeneckou hypoglykémií [11]. V rodině s HNF4A-MODY diabetem jsme anamnesticky novorozeneckou makrosomii a novorozeneckou hypoglykémii nezjistili.
V rodině s HNF1A-MODY diabetem vedla znalost mutace v HNF1A genu k potvrzení nosičství stejné mutace u dalších členů rodiny, u kterých pravidelně sledujeme glukózovou toleranci (obr. 3; rodokmen rodiny s HNF1A-MODY diabetem). Pacienti s HNF1A-MODY diabetem mají snížený renální práh pro glukózu, což lze využít při screeningu u příbuzných pacientů s tímto typem diabetu [12].
U pacienta s HNF1B-MODY vedla k diagnóze dlouhodobě nápadně nízká potřeba inzulinu a přítomnost renální anomálie se solitární levou ledvinou s hydronefrózou a megaureterem.
Pacienti s HNF4A-MODY a HNF1B-MODY diabetem byli převedeni z léčby inzulinem na léčbu PAD. V případě naší pacientky s HNF4A-MODY došlo k výraznému zlepšení kompenzace diabetu s poklesem hladiny HbA1c. Pacient z rodiny s HNF1A-MODY byl, díky znalosti genové mutace, po stanovení diagnózy DM nastaven na léčbu derivátem sulfonylurey II. generace v jedné denní dávce (gliklazid). Jeho kompenzace diabetu je zatím výborná.
ZÁVĚR
U pacientů s poruchou glukózové tolerance nebo s DM je třeba diferenciálně diagnosticky myslet na možnost monogenně podmíněné formy MODY diabetu.
Potvrzení nebo vyloučení příslušné genové mutace predikuje další vývoj onemocnění a u DM umožňuje správnou volbu terapie inzulinem nebo PAD.
Znalost příslušné genové mutace pomáhá zachytit onemocnění u dalších rodinných příslušníků v presymptomatické fázi.
Důležitou roli v diferenciální diagnóze MODY diabetu a DM 1. typu hraje, vedle stanovení specifických protilátek proti β-buňkám pankreatu, také výskyt DM v několika generacích.
Molekulárně genetická část studie vznikla za podpory grantu Ministerstva zdravotnictví ČR AZV s reg. č. NV18-01-00078.
MUDr. Jana Zamboryová
Dětská klinika
Fakultní nemocnice Plzeň
Univerzita Karlova v Praze
Lékařská fakulta v Plzni
Alej Svobody 80
304 60 Plzeň
e-mail: zamboryovaj@fnplzen.cz
Zdroje
- Průhová Š. Monogenní formy diabetes mellitus u dětí a dospívajících. Postgraduální med 2009; 11 (4): 247–252.
- Lebl J, Průhová Š. Monogenní diabetes mellitus: od genetiky k léčbě. Praha: Maxdorf, 2009 : 13–15.
- Průhová Š. Léčba pacientů s monogenním diabetem. Remedia 2011; 21 : 34–39.
- Lebl J, Al Taji E, Koloušková S, a kol. Dětská endokrinologie a diabetologie. Praha: Galén, 2016.
- Průhová Š, Dušátková P, Neumann D, et al. Two cases of diabetic ketoacidosis in HNF1A-MODY linked to severe dehydration: is it time to change the diagnostic criteria for MODY? Diabetes Care 2013 Sep; 36 (9): 2573–2574.
- Heinze E, Holl RW. Tests of β-cell function in childhood and adolescence. In: Ranke MB (ed). Diagnostics of Endocrine Function in Children and Adolescents. Basel: Karger, 2003 : 318–338.
- Matyka KA, Beards F, Appleton M, et al. Genetic testing for maturity onset diabetes of the young in childhood hyperglycaemia. Arch Dis Child 1998; 78 : 552–554.
- Staník J, et al. De novo mutations of GCK, HNF1A and HNF4A may be more frequent in MODY than previously assumed. Diabetologia 2014 Mar; 57 (3): 480–484.
- Ellard S, Bellanné-Chantelot C, Hattersley AT. Best practice guidelines for the molecular genetic diagnosis of maturity-onset diabetes of the young. Diabetologia 2008; 51 : 546–553.
- Ellard S, Beards F, Allen LI, et al. A high prevalence of glucokinase mutations in gestational dia-betic subjects selected by clinical criteria. Diabetologia 2000; 43 : 250–253.
- Pearson ER, Boj SF, Steele AM, et al. Macrosomia and hyperinsulinaemic hypoglycaemia in patients with heterozygous mutations in the HNF4A gene. PLoS Med 2007 Apr; 4 (4): e118.
- Stride A, Ellard S, Clark P, et al. Β-cell dysfunction, insulin sensitivity, and glycosuria precede diabetes in hepatocyte nuclear factor-1 alpha mutation carriers. Diabetes Care 2005, 28 (7): 1751–1756.
- Průhová Š, Dušátková P, Šumník Z, et al. Glucokinase diabetes in 103 families from a country-based study in the Czech Republic: geographically restricted distribution of two prevalent GCK mutations. Pediatr Diabetes 2010; 11 (8): 529–535.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2019 Číslo 1- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficitmi v reálnej praxi
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
-
Všetky články tohto čísla
- Etiologie a léčba novorozeneckého diabetu
- Monogenně podmíněný diabetes MODY v dětském věku: retrospektivní studie pacientů diagnostikovaných na Dětské klinice FN Plzeň v letech 2000–2017
- Depresívne a úzkostné symptómy vo vzťahu k spánku u detí a adolescentov s diabetes mellitus 1. typu
- Editorial: Česko-slovenská pediatrie v roce 2019
- Rizikové faktory ovlivňující výsledek léčby novorozenců s hypoxicko-ischemickou encefalopatií léčených řízenou hypotermií
- Editorial: Dětský diabetes na prahu nové éry
- Možnosti antibiotické léčby akutní sinusitidy
- Poděkování spolupracovníkům za rok 2018
- 20. dny dětské endokrinologie Ostrov u Tisé, Ústecký kraj 25.–26. 1. 2019
- Moderní technologie v terapii diabetu 1. typu v dětském věku
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Možnosti antibiotické léčby akutní sinusitidy
- Etiologie a léčba novorozeneckého diabetu
- Moderní technologie v terapii diabetu 1. typu v dětském věku
- Rizikové faktory ovlivňující výsledek léčby novorozenců s hypoxicko-ischemickou encefalopatií léčených řízenou hypotermií
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



