Vliv výživy na rozvoj obezity v různých obdobích vývoje dítěte
The effect of nutrition on the development of obesity in different periods of childhood
The author summarizes the data to different nutritional factors that affect the formation of adipose tissue. Not only excessive energy intake, but also differences of essential nutrients have their importance. The individual components of the nutrients is variously involved in metabolic processes. The formation of adipose tissue activates more diet with a higher content of sugars than other carbohydrates, diet with a higher content of saturated and monoenic unsaturated fatty acids than polyunsaturated omega 3 fatty acids.
In the context of the age is changing not only the way of nutrition, but also habits of the individual. In the diet is so the five time periods that are individually specific to activate the development of excessive accumulation of fat tissue. To prevent childhood obesity is necessary to pay attention to the child´s diet systematically and differentially.
Keywords:
obesity
Autoři:
P. Tláskal
Působiště autorů:
Společnost pro výživu z. s
; Oddělení léčebné výživy FN Motol, Praha
Vyšlo v časopise:
Čes-slov Pediat 2019; 74 (2): 88-92.
Kategorie:
Sympozium: Dětská obezita v teorii a praxi
Souhrn
Autor shrnuje údaje k nutričním faktorům, které různým mechanismem ovlivňují tvorbu rezervní tukové tkáně. Nejen nepřiměřený příjem energie, ale i odlišnosti základních živin mají svůj význam. Jednotlivé složky živin se různě zapojují do metabolických procesů. Tvorbu tukové tkáně aktivuje více strava s vyšším obsahem cukrů než ostatních sacharidů, strava s vyšším obsahem saturovaných a monoenových nenasycených mastných kyselin než polynenasycených omega 3 mastných kyselin.
V rámci věku se mění nejen způsob výživy jedince, ale i jeho návyky. Ve výživě je tak možno uvést pět časových období, která jsou samostatně specifická pro aktivaci rozvoje nadměrné kumulace tukové tkáně. Pro prevenci dětské obezity je nutné věnovat výživě dítěte systematickou a diferencovanou pozornost.
Klíčová slova:
obezita – tuková tkáň
ÚVOD
Výživa je základní podmínkou existence života, tvorby, obnovy a udržení činnosti tělesných tkání a tělesných orgánů. Je tak logické, že výživa se podílí i na nadměrném hromadění tukových zásob u obézních pacientů.
Základní mechanismus je obecně známý, nadměrný příjem, spojený s nedostatečným výdejem energie. Zjednodušeně řečeno, energie přijatá v nadbytku se ukládá do tukové tkáně. Údaj, že nositelem energie jsou pro organismus tuky (1 g = 9 kcal = cca 38 kJ), sacharidy a bílkoviny (1 g = 4 kcal = cca 17 kJ) je rovněž dobře známý. Příjem energie se tak snadno propočítá se znalostí složení konzumovaných potravin a jejich množství.
V rámci metabolických procesů, které v organismu probíhají, jsou však tato schémata velmi zjednodušená. K podrobnějšímu hodnocení účinku výživy na tvorbu tukové tkáně bychom měli znát, jak se jednotlivé složky základních živin vstřebávají z trávicího traktu, jak se zapojují do metabolických procesů.
K základním a největším dodavatelům energie patří sacharidy (tvoří cca 55 % celkového energetického příjmu). Po jejich zpracování v trávicím traktu je cca 80‒90 % energie přijaté ze sacharidů vstřebáno ve formě glukózy. U zdravého člověka je 60 gramů glukózy ze 100 gramů během tří hodin oxidováno a ostatní se ukládá jako jaterní, případně svalový glykogen. Glykogen tvoří rezervu 400‒500 kcal. Při větším přívodu glukózy je tato metabolizována na mastné kyseliny a ukládá se do tukové tkáně. Podle Zadáka [1] pouze 50 % glukózy je oxidováno přímo, zbytek se z největší části uplatní v lipogenezi. Konzumujeme-li potraviny, které obsahují škroby, tak záleží na tom, jak rychle se z nich uvolňuje a vstřebává glukóza. U potravin uvádíme jejich glykemický index, který je buď nízký (znamená to, že glukóza se ze škrobu uvolňuje pomalu a tím i dlouhodoběji), nebo vysoký (glukóza se z potraviny uvolní rychle a zaplaví tak krevní oběh). V rámci výše uvedených skutečností to znamená, že rychle absorbovaná glukóza je ve větší míře metabolizována do mastných kyselin a tím i do tukové tkáně. Glykemický index je vysoký třeba u bagety (cca 95 %), nižší již třeba u těstovin (kolem 40 %), nízký je u čočky (29 %). Záleží však i na formě zpracování či úpravy potravin [2]. Toto je moment, kdy v rámci obezity například varujeme před „fast-food“ stravováním (systém rychlého občerstvení).
Když zůstaneme u metabolismu dalších vstřebatelných cukrů, tak se dostáváme k fruktóze. Fruktóza aktivuje lipogenezi, není v metabolismu závislá na inzulinu a uvádí se, že při dlouhodobějším podávání vyvolává rezistenci k leptinu. Náhrada glukózy fruktózou tak rozhodně není ve výživě benefitem. Vyšší zátěž organismu sacharózou, která se štěpí na glukózu a fruktózu, snadněji aktivuje poruchu lipidového spektra a tím i ukládání mastných kyselin do tukových zásob organismu. Laktóza obsažená v mléce a mléčných výrobcích je z uváděných cukrů nejvýhodnější. Je méně solubilní než ostatní disacharidy a například ve spojení se stravou s vyšším obsahem tuků tlumí lipogenezi [3].
Tuky sice zajišťují na jednotku své hmotnosti energeticky nejvyšší přívod energie, ale v celkovém příjmu je to cca 30‒35 %. U kojenců je doporučovaný příjem vyšší, až do 45 % celkového energetického příjmu [4]. Pro tvorbu, růst a funkci některých tkání je v časném věku tuk velmi významnou živinou. Po vstřebání se nezvyšuje oxidace mastných kyselin s hladinou jejich množství, ale mastné kyseliny se ukládají do energetických rezerv tukové tkáně. V rámci lipogeneze se však uvádí rozdíly, které souvisí s tím, o jaké se jedná mastné kyseliny. Saturované a monoenové nenasycené mastné kyseliny zvyšují tvorbu tukové tkáně významně více než polynenasycené mastné kyseliny. Vyšší obsah polynenasycených mastných kyselin (PUFA) zvyšuje klidový energetický výdej, zvyšuje oxidaci lipidů, zvyšuje termogenezi [5]. Saturované mastné kyseliny (kyselina laurová, myristová, palmitová) mají vliv na hypetrofii tukových buněk, nenasycené mastné kyseliny (olejová, linolová) mají vliv na hyperplazii tukových buněk [6]. Vyšší příjem PUFA – alfa linolenové omega 3 mastné kyseliny aktivuje hypoplazii a hypotrofii tukových buněk, nikoliv však již příjem PUFA – kyseliny linolové omega 6 mastné kyseliny [6].
Z uvedených studií je patrné, že v rámci prevence, a to nejen obezity, budeme podporovat příjem potravin, které v rámci tuků obsahují více PUFA – zvláště omega 3 mastných kyselin. Naše studie, kterou jsme provedli zhodnocením jídelníčků 1087 dětí z mateřských škol a u 1705 dětí ze ZŠ, prokázala [7] nedostatečný příjem PUFA (norma 7 %, v naší studii v obou skupinách kolem 4 %).
Existují i určité rozdíly v rámci bílkovin a jejich vstřebatelných složek aminokyselin. Podle studií je vliv bílkovin na tvorbu tukové tkáně v organismu různý, závisí na věku jedince, na množství bílkovin, ale i na jejich složení. Koncem minulého století se objevila první práce [8], která při sledování dětí ve věku od 10 měsíců do 8 let prokázala korelaci mezi příjmem bílkovin a tvorbou tukové tkáně. Závěrem bylo zhodnocení, že vyšší příjem bílkovin v časném věku zvyšuje riziko rozvoje obezity ve věku pozdějším. Dánská studie z roku 2004 [9] prokázala, že vyšší příjem bílkovin v 9. měsíci života koreloval s větší tělesnou velikostí, ale nesouvisel s větším hromaděním tukové tkáně. Další studie následovaly [10]. Z výsledků je patrné, že vyšší příjem bílkoviny v časném věku podporuje růst tukové i tuku prosté tkáně. Studie u dospělé populace prokazují [11], že vyšší příjem bílkovin v rámci celkového energetického příjmu naopak pomáhá v rámci redukčních diet ke snížení tvorby tukové tkáně. Zdá se, že nejen množství, ale i složení bílkovin má svůj význam v uvedených procesech. Van Vught [12] hodnotil vliv koncentrací argininu a lysinu na tvorbu tukové a tuku prosté tkáně, kde zjišťoval významné rozdíly jejich účinku. Na tvorbu tukové tkáně mají vliv i některé mikronutrienty – například vitamin A, vitamin D nebo vápník, které příznivě zasahují do energetického metabolismu a inhibují tvorbu adipocytů [13, 14].
Máme-li hodnotit vliv výživy na tvorbu tukové tkáně v různých věkových obdobích růstu a vývoje dítěte, tak je nutné uvést, že i zde existuje plno faktorů, které v rámci výživy změnu tvorby tukové tkáně aktivují. Základem pro posouzení obezity je znalost fyziologického vývoje tukové tkáně v průběhu dětského věku. Organismus si z tuku průběžně vytváří nejen energetické rezervy, ale vyplňuje i prostory mezi orgány a chrání je tak před mechanickým postižením. Tuk je samozřejmě ve svých komponentech součástí buněk a tkání. Nejlépe jsou však zhodnotitelné energetické tukové rezervy odvozené z měření kaliperem či dalšími novějšími metodikami. Vzhledem k civilizačnímu nárůstu obezity uvádíme fyziologickou křivku tvorby tukové tkáně (obr. 1) v kojeneckém a batolecím věku z měření, která byla prováděna koncem minulého století a ověřována i našimi studiemi [15, 16].
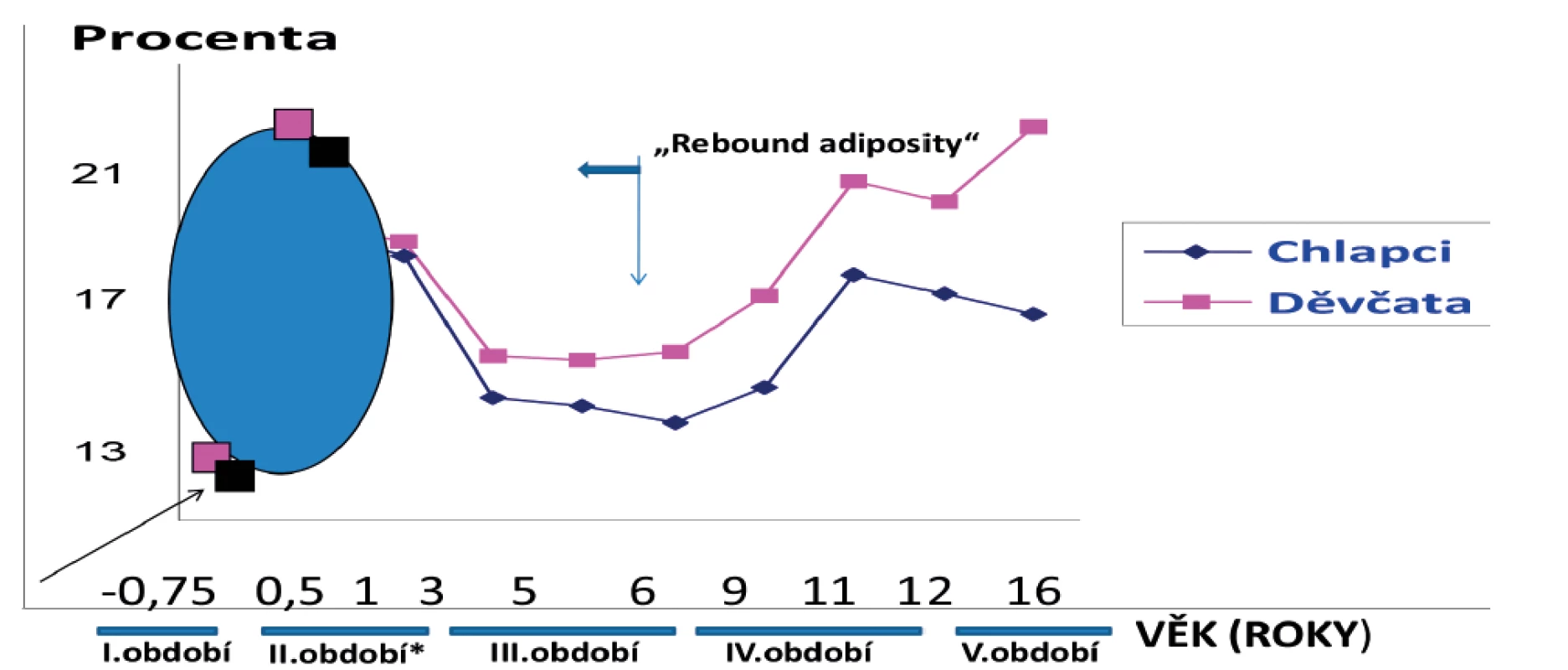
Z uvedených výsledků bylo patrné, že při narození má donošené dítě cca 13 % tukové tkáně. Ve třech měsících věku cca 20 %, v šesti měsících cca 25%, v jednom roce již pouze 23 %, ve dvou letech 22 %. Dále množství tukové tkáně se zvyšující se jeho tělesnou aktivitou klesá a opětně začne stoupat od šestého roku života dítěte. Geneticky mají děvčata tělesného tuku více než chlapci. Uvedený obrázek 1 je schematický vzhledem k rozdílným údajům ze studií v dalším věkovém období. Původní křivka, kdy k opětovnému navyšování zásob tukové tkáně (rebound adipozity) docházelo v šestém roce života, se mění, během času se vzestup ukládání tuku posouvá stále do nižších věkových kategorií. K rozvoji dětské obezity tak dochází dříve [17].
Literární údaje stále přináší nové informace o výživě a příčinách aktivace dětské obezity. Tyto informace je proto nutné dobře identifikovat a následně využít v rámci preventivních opatření k rozvoji dětské obezity. V souvislosti s uvedeným schematickým obrázkem křivky tvorby tukové tkáně můžeme hovořit o pěti specifických obdobích, kdy se uplatňuje výživa:
- období charakterizuje výživu dítěte ještě před narozením;
- období je dáno výživou dítěte v novorozeneckém, kojeneckém a batolecím věku;
- období tvoří výživa předškolního věku;
- období představuje výživu časného školního věku;
- období ‒ výživa pozdního školního věku a adolescence.
1. OBDOBÍ
Na rozvoj dětské obezity má samozřejmě vliv genetika a v rámci výživy těhotné matky a plodu se uplatňují epigenetické faktory. Uvádí se, že genetická výbava člověka ovlivňuje tělesnou hmotnost ze 40 až 70 % [18]. Barkerova hypotéza otevřela nový obzor etiologických souvislostí. Změny výživy plodu mohou navodit trvalé odchylky strukturálního uspořádání, fyziologie a metabolismu plodu, jež zvyšují dispozice rozvoje některých onemocnění v jeho dospělosti (obezita, inzulinová rezistence, hypertenze, dyslipidemie...). Tuto hypotézu potvrzují i současné studie [19]. Epigenetický účinek výživy, který nemění genetickou výbavu, ale působí na expresi genů, je tak patrný.
K prevenci:
V rámci prevence obezity je nutné věnovat se výživě matky v těhotenství. Prvorodičky míjí ambulance dětských lékařů, měly by být dostatečně a správně edukovány i nepediatrickými zdravotnickými pracovišti.
2. OBDOBÍ
Toto období je dáno narozením dítěte. Společně s předchozí dobou se zde ještě silně uplatňují epigenetické faktory. Již dříve bylo známo, že kojení má pozitivní vliv nejen na aktuální, ale i pozdější zdravotní stav jedince. V souvislosti s obezitou autoři [20] uvádí, že kojení snižuje riziko výskytu pozdější obezity. V účinku mateřského mléka byla prokázána exprese specifických genů, kdy kojení ukázalo na nižší riziko rozvoje inzulinové rezistence a dislipidemie [21]. V rámci nutrigenomicky působících faktorů, a to nejen v rámci možného ovlivnění vývoje k rozvoji obezity, se zde mohou nastartovat i jiné, pro zdraví nepříznivé reakce. Hovoříme o metabolickém programování a výživě prvních 1000 dnů života. Příznivý účinek mateřského mléka vychází z jeho složení (nízký obsah bílkovin, vyšší obsah polynenasycených mastných kyselin a obsah leptinu). Leptin [22] ovlivňuje během morfogeneze hypotalamu distribuci excitačních a inhibičních synapsí pro neuropeptidy a ty modifikují odpovědi na stimulační či inhibiční podněty pro apetit. Jedná se o reakce na početnou skupinu hormonů (grehlin, orexin, apelin a další), které ovlivňují energetický metabolismus, termogenezi, trávení a další momenty související s výživou.
K prevenci:
V časném věku se pozitivně uplatňuje účinek mateřského mléka, je tak nutno podporovat kojení. Je důležité se více věnovat i ostatní výživě kojenců a batolat, jak to prokázala naše studie [23], která vyústila do Iniciativy 1000 dnů života. Aspekt působení jednotlivých nutrietů jsme prokázali u sacharidů. Při sledování vlivu mono- a disacharidů na tvorbu tukové tkáně (BMI) bylo patrné, že u dětí ve věku dva až tři roky souvisela vyšší hodnota BMI již signifikantně s vyšší konzumací cukrů.
3. OBDOBÍ
Období batolecího věku a dále období věku předškolního je v rámci výživy stále více ovlivňováno osobností dítěte a zvyklostmi rodiny. Regulační schopnost příjmu množství potravy má svůj vrozený základ. Narušení energetické rovnováhy přináší zevní zásahy. Fixuje se preference určitých chutí, přetrvává pozitivní vnímání sladké chuti, fixuje se obliba jídel s vysokým obsahem tuku. Zvláště příliš pevná pravidla v kombinaci živin či potravin mohou vést ke vzniku stereotypů, které se v pozdějším věku obtížně překonávají.
Významným fenoménem tohoto období je neofobie. Dítě odmítá jídlo, s nímž se ještě ve své výživě nesetkalo. Z našich studií [7, 23] vyplynulo, že 10 % sledovaných fyziologických dětí v batolecím věku konzumovalo více jak 18,4 % saturovaných mastných kyselin (SAFA) a méně jak 2 % polynenasycených mastných kyselin (PUFA). Doporučení [4] uvádí 10 % SAFA a 7‒10 % PUFA z celkového energetického příjmu. V předškolním věku 10 % dětí konzumovalo více jak 17,7 % saturovaných mastných kyselin a méně jak 2,7 % polynenasycených mastných kyselin. U dětí této skupiny byl rovněž zaznamenán vysoký příjem cukrů. 10 % dětí konzumovalo více jak 38,3 % mono- a disacharidů. Toto jsou všechny atributy, které aktivují rozvoj a ukládání tukové tkáně.
K prevenci:
Významnou úlohu zde má dětský lékař. Měl by být průvodcem rodičů a současně i jejich aktivátorem k tomu, aby se věnovali i nutriční výchově svých dětí. Rodiče by sami nejdříve měli mít dostatek informací, které by jim umožnily čelit neofobii dětí nebo jiným zlozvykům ve výživě.
4. OBDOBÍ
Časný školní věk je charakterizován již větší samostatností dítěte. Dítě se více dostává mimo dohled rodiny. Samo si o své výživě již i více rozhoduje. Vrátíme-li se opět k sacharidům a z toho k cukrům, tak stanovisko WHO z roku 2003 ke konzumaci těchto složek výživy uvádí v rámci doporučení k prevenci chronických nezánětlivých onemocnění, včetně obezity [24], že výživa by měla zajišťovat maximální příjem minimálně procesně upravených sacharidů a měla by minimalizovat příjem volných cukrů – méně než 10 % celkového energetického příjmu. Naše zatím nepublikovaná studie z roku 2010 (1558 dětí) ukázala, že děti pijí sladké nápoje především ze školních automatů. V domácím prostředí děti konzumovaly sladkých nápojů daleko méně. Zajisté jste slyšeli o pamlskové vyhlášce, která výnosem MŠMT upravila sortiment prodávaných potravin a nápojů v prostorách základních škol. Tato vyhláška přinesla plno diskusí, je to však cesta správným směrem.
K prevenci:
Je nutno podpořit preventivní společenské programy, které se danou problematikou pozitivně zabývají. Edukační aktivity se zaměřením na děti již většinou ubývají na síle.
5. OBDOBÍ
Toto období je charakterizováno již plně fixovanými stravovacími návyky a působením vlivu prostředí (nabídka, reklama a podobně). Nebezpečím je to, že přetrvávající obezita adolescentů přechází v 50 a více procentech do obezity dospělých. Nicméně toto období je spojováno i s tím, že jedinec zvyšuje svoji pozornost na vzhled a postavu, což zvláště u děvčat skrývá nebezpečí přechodu dětské obezity do mentální anorexie či mentální bulimie nebo orthorexie či alternativních způsobů stravování.
K prevenci:
Prevence odpovídá obecně doporučovaným opatřením [25]. K ochranným faktorům, které příznivě ovlivňují rozvoj dětské obezity, patří pravidelná a věrohodná fyzická aktivita, podpora domácího a školního prostředí, příjem neškrobových polysacharidů/vlákniny, konzumace snídaně. K rizikovým faktorům patří: sedavý způsob života, vysoký příjem energeticky bohaté stravy, konzumace potravin chudých na mikroživiny, masivní tržní prodej energeticky bohatých potravin a rychlého občerstvení, zvláště slazených nealkoholických nápojů, ovocných džusů, a horší sociální a ekonomické podmínky.
ZÁVĚR
Výživa se uplatňuje při tvorbě tukové tkáně nejen v rámci množství základních energeticky akčních živin, ale i v rámci jejich variability. Pro různá věková období jsou charakteristické odlišné spouštěcí mechanismy. Jejich poznání umožňuje lépe provádět prevenci.
MUDr. Petr Tláskal, CSc.
Oddělení léčebné výživy
FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: Petr.Tlaskal@fnmotol.cz
Zdroje
- Zadák Z. Výživa v intenzivní péči. Praha: Grada Publishing, 2002: 42–49.
- Ramdath DD, Wolver TMS, Siow YC, et al. Effect of processing on postprandial glycemic response and consumer acceptability of lentil-containing food items. Foods 2018 May 11; 7 (5).
- Bierman EL. Carbohydrates, sucrose and human diseases. Am J Nutr 1979; 32: 2712–2722.
- Kolektiv autorů DACH. Referenční hodnoty pro příjem živin. 1. vyd. Praha: Výživaservis s.r.o., 2011: 40–47.
- Couet C, Delarue J, Ritz P, et al. Effect of dietary fish oil on body fat mass and basal fat oxidation in healthy adults. Int J Obes Relat Metab Disord 1997 Aug; 21 (8): 637–643.
- Expertise collective. Obésité – dépistage et prevention chez l´enfant. Paris: Inserm, 2000: 131–163.
- Tláskal P, Hrstková H, Balíkova M, et al. Výživové doporučené dávky v realitě jídelníčků českých předškolních a školních dětí. Výživa a potraviny 2009; 6: 91–94.
- Rolland-Cachera LM, Deheeger M. Influence of macronutrients on adiposity development: a follow up study of nutrition and growth from 10 months to 8 years of age. Int J Obes Relat Metab Disord 1995 Aug; 19 (8): 573–578.
- Hoppe C, Molgaard C, Thomsen BL, et al. Protein intake at 9 mo of age is associated with body size but not with body fat in 10-y-old Danish children. Am J Clin Nutr 2004 Mar; 79 (3): 494–501.
- Günther AL, Buyken AE, Kroke E. The influence of habitual protein intake in early childhood on BMI and age at adiposity rebound: results from the DONALD Study. Int J Obes (Lond) 2006 Jul; 30 (7): 1072–1079.
- Aller EE, Larsen TM, Claus H, et al. Weight loss maintenance in overweight subjects on ad libitum diets with high or low protein content and glycemic index: the DIOGENES trial 12-month results. Int J Obes (Lond) 2014 Dec; 38 (12): 1511–1517.
- Van Vught JAH, et al. Association between diatary protein and 6y change in body composition among normal and overweight 9y old boys and girl. ESPEN 2008, Italy.
- Leao AL, Santos LC. Micronutrient consumption and overweight: Is there a relationship? Rev Bras Epidemiol 2012 Mar; 15 (1): 85–95.
- Frey SK, Vogel S. Vitamin A metabolism and adipose tissue biology. Nutrients 2011 Jan; 3 (1): 27–39.
- Romahn A, Burmeister W. Körperzusammensetzung während der ersten zwei Lebensjahre, Bestimmungen mit der Kalium 40-Metode. Klin Pädiat 1977; 1891: 29–45.
- Tláskal P, Krásničanová H. Der Einfluss der Frűhernährung von Säuglingen auf ihre spätere somatische Entwicklung. HOMO 1999; 50 (1): 1–13.
- Vignerová J, Humeníková L, Brabec M, et al. Long-term changes in body weight, BMI, and adiposity rebound among children and adolescents in the Czech. Econ Hum Biol 2007 Dec; 5 (3): 409–425.
- Meas HH, Neale MC, Eaves LI. Genetic and environmental factors in relative body weight and human adiposity. Behav Genet 1997 Jul; 27 (4): 325–351.
- Zenetti D, Tikkanen E, Gustafsson S, et al. Birthweight, type 2 diabetes mellitus, and cardiovascular disease: Addressing the Barker hypothesis with Mendelian randomization. Circ Genom Precis Med 2018 Jun; 11 (6): e002054.
- Von Kries R, Koletzko B, Sauerwald T, et al. Breast feeding and obesity: cross sectional study. BMJ 1999 Jul 17; 319 (7203): 147–150.
- Priego T, Sánchez J, et al. Influence of breastfeeding on blood-cell transcript-based biomarkers of health in children. Pediatr Obes 2014; 9 (6): 463-470.
- Levion BE. Synergy of nature and nurture in the development of childhood obesity. Int J Obes (Lond) 2009 Apr; 33 (Suppl 1): 53–56.
- Tláskal P, Kudlová E, Šebková A, et al. Analysis of the nutrition of Czech infants and toddlers. Ann Nutr Metab 2015; 67 (Suppl 1): S116.
- Nishida C, Martinez Nocito F. FAO/WHO Scientific Update on carbohydrates in human nutrition: introduction. Eur J Clin Nutr 2007 Dec; 61 (Suppl 1): S1–S4.
- Swinburn BA, Caterson I, Seidell JC, et al. Diet, nutrition and the prevention of excess weight gain and obesity. Public Health Nutr 2004 Feb; 7 (1A): 123–146.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorastČlánok vyšiel v časopise
Česko-slovenská pediatrie

2019 Číslo 2
- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- Využití hodnoticích skóre a objektivních nástrojů při léčbě astmatu
- Nech brouka žít… Ať žije astma!
Najčítanejšie v tomto čísle
- Nadhmotnosť a obezita u detí vo veku 7–8 rokov: výsledky projektu WHO na Slovensku
- Obezita v dětském věku – historie a současnost
- Etiopatogeneze dětské obezity
- Obezita a hypertenze u dětí
