-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Novorozenecké záchvaty
Neonatal seizures
The incomplete development of the central nervous system of a newborn is a predisposing factor of increased seizure susceptibility in this age category. Primarily premature newborns are a highly endangered group. Early diagnosis of neonatal seizures, and initiation of their adequate therapy, with regard to etiology, is crucial. Seizures, especially repetitive or status epilepticus, have a negative impact on the psychomotor development of the subject, and may lead to irreversible neurological damage. The prediction of prognosis in the individual patient is based mainly on the primary cause.
The past decade has shown a significant improvement in prognosis of the affected newborns. Despite the progress in diagnostics and therapy, the neonatal seizures are still linked to a high morbidity, and mortality.
Keywords:
neonatal seizures – epileptic and nonepileptic seizures – EEG – antiepileptic therapy
Autoři: K. Španělová 1; K. Česká 1; T. Jimramovský 2; H. Ošlejšková 1; Š. Aulická 1
Působiště autorů: Klinika dětské neurologie LF MU a FN Brno, Centrum pro epilepsie Brno, EU referenční centrum 1; Pediatrická klinika, Neonatologické oddělení, LF MU a FN Brno 2
Vyšlo v časopise: Čes-slov Pediat 2019; 74 (3): 153-160.
Kategorie: Sympozium: dětská neurologie
Souhrn
Nedokončený vývoj centrálního nervového systému novorozence je predisponujícím faktorem zvýšené záchvatové pohotovosti v této věkové kategorii. Vysoce ohroženou skupinou jsou především nezralí novorozenci. Včasné stanovení diagnózy novorozeneckých záchvatů a zahájení adekvátní terapie s ohledem na etiologii je zcela zásadní. Záchvaty, zejména opakované nebo status epilepticus, mají negativní dopad na psychomotorický vývoj jedince a mohou vést k ireverzibilním neurologickým změnám. Predikce prognózy u konkrétního pacienta se odvíjí zejména od primární příčiny.
Poslední desetiletí je spjato s významným zlepšením prognózy postižených novorozenců. I přes pokroky v diagnostice a terapii jsou novorozenecké záchvaty stále spojeny s vysokou morbiditou a mortalitou.
Klíčová slova:
novorozenecké záchvaty – epileptické a neepileptické záchvaty – EEG – antiepileptická terapie
ÚVOD
Novorozenecké záchvaty (NZ) lze definovat jako věkově vázané záchvatové onemocnění, které se liší od populace starších dětí řadou klinických a elektrografických rysů. Jedná se pravděpodobně o nejčastější projev neurologického onemocnění v novorozeneckém období. Jejich klinická manifestace je v mnoha případech natolik diskrétní, že mohou snadno uniknout pozornosti. Naopak celé spektrum motorických, autonomních a behaviorálních projevů novorozence může NZ přesvědčivě imitovat. Vzhledem k této variabilitě klinického obrazu je z hlediska racionálního diagnosticko-terapeutického postupu zásadní správné rozpoznání paroxyzmálního projevu a odlišení epileptických a neepileptických záchvatů [1, 2]. Pokroky v diagnostice a léčbě umožnily nové elektroencefalografické metody monitorace, nové neuroradiologické zobrazovací metody a zavádění neuroprotektivních terapeutických strategií.
Výskyt NZ je významně vyšší v rizikových populacích novorozenců, kam patří nedonošení novorozenci a novorozenci s nízkou porodní hmotností. Riziko rozvoje NZ je spjato s některými faktory, které zahrnují komplikace průběhu porodu nebo více či méně ovlivnitelné faktory ze strany matky nebo dítěte. Souhrn těchto rizikových faktorů je uveden v tabulce 1.
Tab. 1. Rizikové faktory NZ [3]. ![Rizikové faktory NZ [3].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/6f6f8b166dc3e07334d413c1e58a3517.png)
EPIDEMIOLOGIE
Určit přesný výskyt NZ je relativně obtížné, protože mnoho epidemiologických studií využívá klinická diagnostická kritéria, nikoliv elektroencefalografická, nebo jejich kombinace. Údaje se liší v závislosti na metodologii konkrétní studie. Incidence NZ kolísá v souvislosti s gestačním stářím a porodní hmotností.
U donošených novorozenců se incidence pohybuje v rozmezí 1–3/1000 živě narozených. U předčasně narozených je incidence vyšší a stoupá v závislosti na snižujícím se gestačním stáří a porodní hmotnosti. V kategorii novorozenců nízké porodní hmotnosti je incidence 13,5/1000 živě narozených. V kategorii velmi nízké porodní hmotnosti je rozmezí velmi široké a pohybuje se mezi 55–130/1000 živě narozených dětí [2, 3].
PATOFYZIOLOGICKÉ ASPEKTY
Vzhledem k nedokončené maturaci centrálního nervového systému (CNS) představuje novorozenecké období nejrizikovější periodu pro rozvoj epileptických záchvatů. Neurony vyvíjejícího se mozku mají vyšší excitabilitu, a tedy záchvatovou pohotovost, ve srovnání s neurony mozku s ukončenou maturací. Za pravděpodobné mechanismy nadměrné depolarizace buněčné membrány u novorozenců jsou považovány zejména tyto aspekty – nezralost excitačních a inhibičních neurotransmisních systémů, selhávání energetického metabolismu buňky a zvýšená permeabilita buněčné membrány [4, 5].
- Nadbytek excitačních neurotransmiterů v mozku novorozence je důsledkem jejich zvýšeného uvolňování nebo snížené reabsorpce. Ke zvýšenému uvolňování excitačního neurotransmiteru glutamátu vedou zejména hypoxicko-ischemické inzulty. K nedostatku hlavního inhibičního neurotransmiteru kyseliny gama-aminomáselné dochází například v rámci deficitu pyridoxinu. Pyridoxalfosfát je kofaktor enzymu glutamát-dekarboxylázy, který zabezpečuje přeměnu excitačního neurotransmiteru kyseliny glutamové na kyselinu gama-aminomáselnou. Relativní nedostatek inhibičních neurotransmiterů oproti excitačním je v nezralém mozku zcela fyziologickým jevem. Také se ukázalo, že receptory pro kyselinu gama-aminomáselnou v nezralém mozku mohou být paradoxně excitační [4, 5].
- Selhání ATP-dependentní sodno-draselné pumpy vede k nestabilitě membránového potenciálu. K takovému narušení energetického metabolismu buňky vedou procesy neuronálního poškození, jako jsou hypoxemie, ischemie nebo hypoglykémie [4, 6].
- Kalcium a magnesium interagují s buněčnou membránou a inhibují vstup natria do buňky. Iontová dysbalance ve smyslu hypokalcémie a hypomagnesémie tedy zvyšuje influx natriových iontů, což vede k depolarizaci [4].
Vyvíjející se mozek je ve srovnání s mozkem dospělého jedince odolnější vůči poškození indukovanému záchvatem. Jednou z příčin této odolnosti je pravděpodobně nezralost biochemických kaskád, které jsou zodpovědné za buněčnou smrt [4, 6].
ETIOLOGIE
Přestože k rozvoji NZ může vést celá řada příčin, za dominující lze považovat etiologii strukturální a metabolickou [7]. Nejčastěji se jedná o hypoxicko-ischemickou encefalopatii, následují intrakraniální hemoragie, infekce a vývojové vady CNS. Tyto faktory jsou zodpovědné za více než 80 % případů NZ [3]. Spektrum etiologických faktorů shrnuje tabulka 2.
Tab. 2. Etiologické faktory rozvoje NZ [3]. ![Etiologické faktory rozvoje NZ [3].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/342eaac9e60eddd2900340e62f4eee27.png)
KLINICKÁ MANIFESTACE A DIFERENCIÁLNÍ DIAGNOSTIKA
NZ se vyskytují v období prvních 3 měsíců života dítěte, z toho se však více než dvě třetiny případů obvykle manifestují již v prvním týdnu života. Specifické klinické a elektrografické vlastnosti NZ jsou dány nedokončeným neuroanatomickým a neurofyziologickým vývojem mozku. Klinický obraz NZ je velmi variabilní a semiologie některých iktálních a postiktálních symptomů může být zaměňována za normální behaviorální, motorické a autonomní projevy novorozence a naopak. Takovými projevy mohou být tonická protahování, nespecifické náhodné pohyby končetin, fyziologický myoklonus, sací pohyby, kašel apod. Jejich výskyt souvisí s nezralostí nervové soustavy a poporodní adaptací. Novorozenecký tremor a dráždivost (jitteriness) mohou postihnout nejen fyziologické, ale i patologické novorozence [4].
Většina paroxyzmálních projevů novorozeneckého období je neepileptické patogeneze. Řada z nich jsou zcela benigní příhody (např. benigní spánkové myoklonie), zatímco některé, i přes svou neepileptickou patogenezi, mohou souviset s neurologickým onemocněním dítěte (např. hyperekplexie, kmenové deliberační fenomény, apnoické pauzy, dystonické ataky) [4, 8]. Situace, při nichž dochází ke kombinaci více typů neepileptických záchvatů současně, nebo dokonce ke kombinaci epileptických a neepileptických záchvatů, nelze považovat za výjimečné. Všechny podezřelé paroxyzmální projevy novorozence vyžadují podrobnou diferenciální diagnostiku a odlišení epileptické a neepileptické patogeneze. Základní rozdíly jsou shrnuty v tabulce 3.
Tab. 3. Diferenciální diagnostika epileptických a neepileptických NZ [4, 8]. ![Diferenciální diagnostika epileptických a neepileptických NZ [4, 8].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/ad3c2e708610fb1960cec6c38262df23.png)
Epileptická patogeneze je častěji asociována s fokálními záchvaty, oproti generalizovaným a ty-
pickým znakem je, že manipulační manévry nebo
vnější stimuly jsou neefektivní k přerušení záchvatu [9].Klasifikační schémata NZ se v čase mění a existuje jich celá řada. Nejběžněji používaná klinická klasifikace je uvedena v tabulce 4.
Tab. 4. Klasifikace NZ podle klinických projevů [4]. ![Klasifikace NZ podle klinických projevů [4].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/d70ea085086f9d66e489afe8defdb03d.png)
Elektrografické charakteristiky NZ
NZ se v EEG obraze vyznačují měnlivostí iktálních vzorců a zpravidla fokálním nebo regionálním počátkem. Typickými znaky jsou: repetitivní vzorec hrotů a vln s vývojem frekvence, distribuce a morfologie v čase, amplituda alespoň 2 mV a délka trvání minimálně 10 s. Samotný nález vyvíjejícího se vzorce epileptiformních výbojů však nestanovuje epileptickou patogenezi záchvatu. Některé interiktální vzorce mají diagnostický význam. Suppression burst u epileptických encefalopatií (EME, EIEE) a theta pointu alternant u benigních familiárních novorozeneckých záchvatů [10].
Na základě korelace klinického projevu NZ s EEG nálezem lze popsat 3 typy NZ [9]:
- Klinický záchvat – klinický projev nekoreluje se simultánním EEG nálezem.
- Elektroklinický záchvat – klinický projev koreluje se simultánním EEG nálezem.
- Elektrografický záchvat – EEG nález nemá klinický korelát (subklinický, nonkonvulzivní, okultní). Vyskytují se zejména u kriticky nemocných novorozenců. Mohou se objevit také v průběhu léčby, kdy dochází pouze k potlačení klinické manifestace, ale přetrvává elektrografická záchvatová aktivita – elektroklinická disociace.
DIAGNOSTIKA
Správná detekce NZ a odhalení jejich etiologie jsou hlavní cíle diagnostického procesu a rozhodují o terapeutické strategii. V popředí diagnostického algoritmu stojí anamnéza, která je vodítkem pro indikaci dalších vyšetřovacích metod. Zásadním anamnestickým údajem je detailní popis paroxyzmálního projevu včetně okolností výskytu, délky trvání a frekvence. Neopomenutelnou součástí diagnostiky je interní a objektivní neurologické vyšetření (tab. 5, tab. 6).
Tab. 5. Paraklinické metody [11]. ![Paraklinické metody [11].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/a2f98fd1c30339d70020b39da7ce9167.png)
Základní laboratorní screening vyloučí hypoglykémii, iontové dysbalance a infekci. Další vyšetřovací metody by měly být poté indikovány individuálně podle konkrétních klinických rysů. Například k podezření na dědičné metabolické poruchy nás mohou přivést některé varovné signály, jako rozvoj záchvatů již prenatálně, refrakterika záchvatů k antiepileptické léčbě, deteriorace klinického a elektrografického obrazu v čase a známky kortikální atrofie nebo hypoxicko-ischemické encefalopatie v radiologickém obraze bez vysvětlující příčiny. Součástí diagnostického algoritmu při podezření na dědičné metabolické poruchy je často likvorologické vyšetření. Nález normoglykémie a nízké hladiny glukózy v likvoru může souviset s GLUT1 deficitem, zvýšená hladina laktátu v likvoru pak může poukazovat na mitochondriální poruchy [4].
V minulosti byla diagnóza NZ verifikována pouze na základě klinických příznaků. Čistě klinickou evaluací jsme schopni zachytit přibližně polovinu záchvatů, pouze však za předpokladu prakticky kontinuální monitorace pacienta. Nástup moderních elektrofyziologických metod usnadnil diagnostiku NZ a ukázal, že většina suspektních paroxyzmálních projevů novorozence není epileptické patogeneze. Nejpodstatnějšími benefity těchto metod je tedy možnost verifikace epileptických záchvatů, určení lokalizace epileptogenní zóny nebo určení syndromologické diagnózy, hodnocení efektu antiepileptické terapie a v neposlední řadě přináší důležité prognostické informace. Kromě výše uvedených výhod s sebou nesou tyto metody nároky na přístrojové vybavení a ošetřující personál. Indikace a interpretace konvenčního EEG by měla být v rukou neurologa s erudicí v epileptologii a s funkční odborností v elektroencefalografii. Vlastní monitoraci provádí vyškolený EEG laborant [12–14].
V současné době řada jednotek intenzivní péče neonatologických pracovišť využívá aEEG, jehož primární výhody spočívají v možnosti kontinuální bed-side monitorace a relativně snadné aplikaci a interpretaci, které nevyžadují nutně posouzení neurologem. Tato metoda snímá EEG aktivitu obvykle pomocí tří elektrod. Záznam je přístrojově upraven a výsledkem je amplitudově integrovaný záznam. Ve srovnání s konvenčními metodami má aEEG nižší senzitivitu a specificitu, které se odvíjí od zkušeností interpretující osoby. U zkušených uživatelů se v literatuře uvádí senzitivita a specificita aEEG téměř 85%, u nových uživatelů kolem 50 % [12]. Problematická je detekce krátce trvajících záchvatů (<30 s), fokálních záchvatů a záchvatů probíhajících distálně od elektrod. Jedná se tedy o metodu orientační, kterou nelze nahradit konvenční EEG, jež je zlatým standardem diagnostiky NZ [6, 14].
TERAPIE
Identifikace etiologie je velmi důležitá, protože ovlivňuje léčebnou strategii a má významný vliv na prognózu pacienta. Je známo, že NZ, zejména opakované nebo status epilepticus, negativně ovlivňují psychomotorický vývoj dítěte a mohou vést k sekundárnímu cerebrálnímu poškození [9]. Cílem terapie je zabránit rozvoji ireverzibilních neurologických změn, minimalizovat riziko rekurence záchvatů a zajistit tak pacientovi co nejlepší prognózu.
Kauzální terapie, je-li to vzhledem k základnímu onemocnění možné, je stěžejní součástí terapeutického postupu a probíhá v koincidenci se symptomatickou terapií.
Zavádění nových léčebných strategií v posledních letech vedlo ke zlepšení prognózy pacientů s hypoxicko-ischemickou encefalopatií. Časně indikovaná a správně vedená terapeutická hypotermie má prokazatelně neuroprotektivní efekt a snižuje riziko následného rozvoje epilepsie. I přesto stále trpí až 50 % novorozenců s hypoxicko-ischemickou encefalopatií elektrografickými záchvaty [15].
Metabolické příčiny vyžadují korekci poruch vnitřního prostředí ve smyslu iontové rovnováhy, acidobazické rovnováhy, udržování normoglykémie a normovolémie. Hypoglykémii korigujeme intravenózním bolusem 10% glukózy v dávce 2 ml/kg (0,2 g/kg) a ev. následnou kontinuální infuzí glukózy v dávce až 0,5 g/kg/hod
(8 mg/kg/min). Hypokalcémii korigujeme intravenózním podáním 10% glukonátu vápenatého v dávce 2 ml/kg v průběhu 10 minut za současné monitorace srdečního rytmu. Fenobarbital může v některých případech záchvaty u hypokalcémie potlačit, a proto pokles záchvatů po podání fenobarbitalu hypokalcémii nevylučuje. S touto dysbalancí bývá často asociována hypomagnesémie, ale může se vyskytnout i samostatně. V takovém případě ji korigujeme intravenózně aplikovaným 10% magnesium sulfátem v dávce 1 ml/kg. Stejnou dávku lze opakovat kaž-
dých 12 hodin až do dosažení normomagnesémie [4, 16].Pyridoxin dependentní epilepsie vyžadují intravenózní podání pyridoxinu v dávce 100 mg a následné podávání 15–30 mg/kg/den ve třech dílčích dávkách. Pyridoxal-fosfát dependentní epilepsie jsou na terapii pyridoxinem refrakterní, ale reagují na léčbu pyridoxal-fosfátem
(30 mg/kg/den pyridoxal-fosfátu a 3–5 mg/kg/den leucovorinu) [11].Antiepileptická terapie
Nezralost neurotransmisních systémů novorozenců často komplikuje léčbu konvenčními antiepileptiky. Ve srovnání s populací starších dětí se terapie liší. Výběr konkrétního antiepileptika se odvíjí od výchozího stavu pacienta, jeho kardiopulmonální stability a hepatálních a renálních funkcí. Racionálním krokem je zvolit k akutní léčbě takové antiepileptikum případně kombinace antiepileptik, které lze následně podávat i v rámci udržovací terapie.
Lékem 1. volby u NZ je fenobarbital. Mimo antikonvulzivního efektu má prokázané neuroprotektivní vlastnosti. Podává se v úvodním bolusu 20 mg/kg i.v. rychlostí <5 mg/kg/minutu. Jestliže je terapie efektivní, pokračujeme dávkou 4–6 mg/kg/den ve dvou dílčích dávkách. Fenobarbital je metabolizován hepatorenální cestou, proto je nutná obezřetnost v případě poruchy funkce jater nebo ledvin, kdy mohou být standardní dávky pro pacienta toxické.
V případě neúspěchu fenobarbitalu volíme z řady antiepileptik 2. volby, mezi které patří – fenytoin, midazolam, clonazepam, levetiracetam, ev. lidokain. Pro úplnost je třeba zmínit také topiramát a bumetanid. Fenytoin představuje svým mechanismem účinku alternativu fenobarbitalu. Jeho hlavní nevýhodou je kolísání hladiny v krvi. Jeho nežádoucími účinky mohou být arytmie a hypotenzní efekt. Podává se v úvodní nasycovací dávce 20 mg/kg i.v. rychlostí maximálně 3 mg/kg/minutu, následně 4–6 mg/kg/den ve dvou dílčích dávkách. Midazolam je krátce působící benzodiazepin, který se používá zejména u refrakterního status epilepticus. Podává se v úvodním bolusu 0,15 mg/kg a pokračujeme v kontinuální infuzi v dávce 1 μg/kg/minutu s možnou titraci dle efektu a tolerance. Alternativu midazolamu představuje clonazepam, který se používá v úvodním bolusu 0,01–0,02 mg/kg i.v., následně pokračujeme kontinuální infuzí 0,1 mg/kg/den. Lidokain lze uplatnit u refrakterních NZ. K jeho nežádoucím účinkům patří poruchy srdečního rytmu. Úvodní bolusová dávka je 2 mg/kg/10 minut následovaná kontinuální infuzí 7 mg/kg/hod (po čtyřech hodinách snižovat dávku o 50 %).
Poslední desetiletí je spjato se zavedením nových antiepileptik do běžné praxe, přičemž některé z nich byly v „off label“ indikaci použity k léčbě NZ – levetiracetam a topiramát. Levetiracetam má velmi příznivý farmakokinetický profil a je velmi dobře tolerován. Nasycovací dávka je 40 mg/kg i.v., následně lze pokračovat dávkou 40–60 mg/ kg/den ve 2–3 dílčích dávkách. Topiramát má významné neuroprotektivní vlastnosti zejména u NZ asociovaných s hypoxicko-ischemickou encefalopatií. V současné době ovšem není k dispozici ve formě pro parenterální podání. Kličkové diuretikum bumetanid je pro svoje antikonvulzivní vlastnosti experimentálně zkoumáno jako léčba NZ, nicméně klinická data prozatím nejsou příliš uspokojivá [11, 16, 17].
Obr. 1. Algoritmus léčby NZ konvenčními antiepileptiky.
(Převzato a upraveno z: https://www.uptodate.com/contents/treatment-of-neonatal-seizures)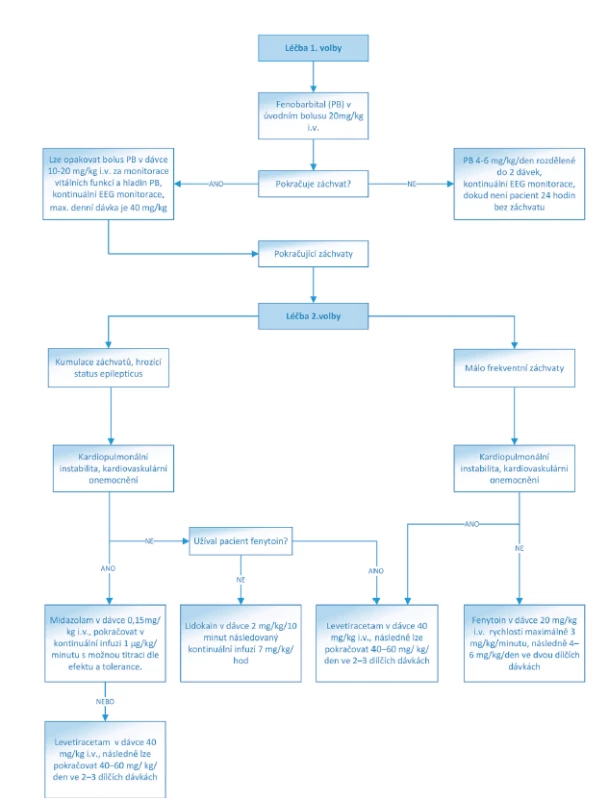
Obr. 2. Algoritmus léčby NZ refrakterních ke konvenčním antiepileptikům.
(Převzato a upraveno z: https://www.uptodate.com/contents/treatment-of-neonatal-seizures)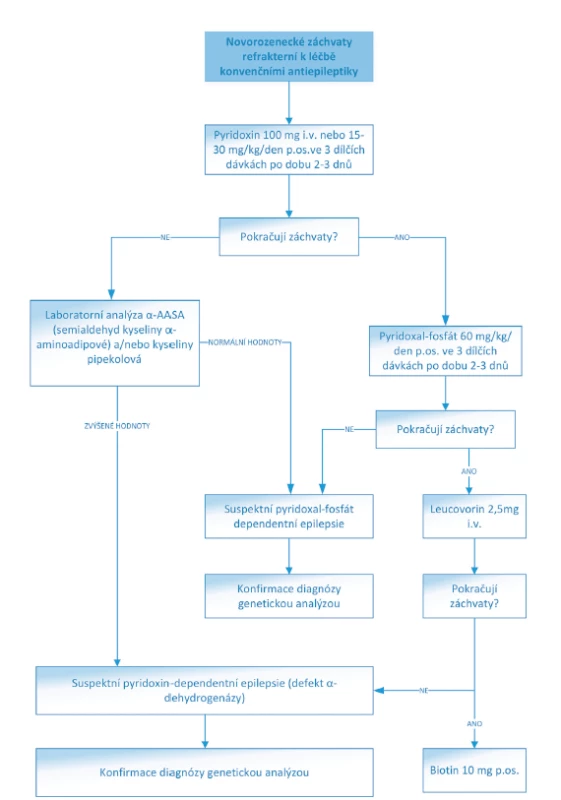
ZÁVĚR
Přestože se prognóza novorozenců s NZ v posledních desetiletích významně zlepšila, jsou stále asociovány s vysokou mortalitou a morbiditou. Nejsilnějším prognostickým prediktorem je etiologie. Dalšími faktory, které ovlivňují prognózu, jsou gestační stáří, závažnost poškození mozku, vstupní nález při neurologickém vyšetření a elektrografické iktální a interiktální charakteristiky [18]. Vyšší riziko horších následků mají novorozenci s trvale abnormním pozadí základní aktivity dle EEG, novorozenci se záchvaty rezistentními k antikonvulzivní terapii a novorozenci s nízkým Apgar skóre [9]. K závažným následkům NZ patří dětská mozková obrna, psychomotorická retardace, mentální deficit a následný rozvoj epilepsie. Za méně závažné lze považovat například specifické poruchy učení.
Riziko rozvoje epilepsie se odvíjí zejména od primární etiologie. Její následný rozvoj negativně potencuje řada faktorů – nízká porodní hmotnost, abnormální neuroradiologický nález, refrakterní záchvaty nebo status epilepticus, trvale abnormní EEG pozadí, multifokální EEG nález nebo kontralaterální propagace epileptické aktivity. Řada recentních studií uvádí, že epilepsií je postiženo 18–25 % dětí s NZ, přičemž u více než poloviny pacientů dochází k její manifestaci již v prvním roce života [18, 19]. Mortalita se pohybuje kolem 15–20 %, a to zejména v rizikových populacích novorozenců a v asociaci s hypoxicko-ischemickou etiologií [1].
Podpořeno z fondů LF MU Juniorský výzkumník 2018 Štefania Aulická.
Dále podpořeno projektem MZ ČR – RVO FN Brno (62569705).
Korespondenční autor:
MUDr. Štefánia Aulická, Ph.D.
Klinika dětské neurologie LF MU a FN Brno
Centrum pro epilepsie Brno
Černopolní 9
613 00 Brno
e-mail: stefania.aulicka@gmail.com
Zdroje
1. Glass HC, Shellhaas RA, Wusthoff CJ, et al. Contemporary profile of seizures in neonates: A prospective cohort study. J Pediatr 2016; 174 : 98–103.
2. Uria-Avellanal C, Marlow N, Rennie JM. Outcome following neonatal seizures. Semin Fetal Neonatal Med 2013; 18 : 224–232.
3. Vasudevan C, Levene M. Epidemiology and aetiology of neonatal seizures. Semin Fetal Neonatal Med 2013; 18 : 185–191.
4. Volpe JJ. Volpe’s Neurology of the Newborn. 6th ed. In: Abend NS, Jensen FE, Inder TE, et al. Neonatal Seizures. Philadelphia: Elsevier, 2017 : 275–321.
5. Rusnáková Š, Fajkusová L, Jansová E. Pyridoxin-dependentní epilepsie – nové trendy v diagnostice a terapii. Neurol pro Praxi 2010; 11 (5): 327–330.
6. Glass HC. Neonatal seizures: Advances in mechanisms and management. Clin Perinatol 2014; 41 : 177–190.
7. Scheffer IE, Berkovic S, Capovilla G, et al. ILAE classification of the epilepsies: Position paper of the ILAE Commission for Classification and Terminology. Epilepsia 2017; 58 : 512–521.
8. Panayiotopoulos CP. The Epilepsies: Seizures, Syndromes and Management. 2nd ed. In: Panayiotopoulos CP. Chapter 5, Neonatal Seizures and Neonatal Syndromes. Chipping Norton, England: Bladon Medical Publishing 2005. Dostupné z: https://www.ncbi.nlm.nih.gov/books/NBK2599/
9. Tadic BV, Kravljanac R, Sretenovic V, et al. Long-term outcome in children with neonatal seizures: A tertiary center experience in cohort of 168 patients. Epilepsy Behav 2018; 84 : 107–113.
10. Tsuchida TN, Wusthoff CJ, Shellhaas RA, et al. American clinical neurophysiology society standardized EEG terminology and categorization for the description of continuous EEG monitoring in neonates: report of the American Clinical Neurophysiology Society critical care monitoring committee. J Clin Neurophysiol 2013; 30 : 161–173.
11. Aulická Š, Aulický P, Česká K, et al. Generalizovaný konvulzivní status epilepticus v dětském věku. Anest intenziv Med 2018; 29 : 139–147.
12. Abend NS, Wusthoff CJ. Neonatal seizures and status epilepticus. J Clin Neurophysiol 2012; 29 : 441–448.
13. Fernández IS, Loddenkemper T. aEEG and cEEG: Two complementary techniques to assess seizures and encephalopathy in neonates: Editorial on “Amplitude-integrated EEG for detection of neonatal seizures: A systematic review” by Rakshasbhuvankar A,et al. Seizure-Eur J Epilepsy 2015; 33 : 88–89.
14. Rakshasbhuvankar A, Paul S, Nagarajan L, et al. Amplitude-integrated EEG for detection of neonatal seizures: a systematic review. Seizure 2015; 33 : 90–98.
15. Inoue T, Shimizu M, Hamano S, et al. Epilepsy and West syndrome in neonates with hypoxic-ischemic encephalopathy. Pediatr Int 2014; 56 : 369–372.
16. Shellhaas R. Treatment of neonatal seizures .UpToDate. Retrieved Dec 19, 2017. Dostupné z: https://www.uptodate.com/contents/treatment-of-neonatal-seizures.
17. Yozawitz E, Stacey A, Pressler RM. Pharmacotherapy for seizures in neonates with hypoxic ischemic encephalopathy. Paediatr Drugs 2017; 19 : 553–567.
18. Pisani F, Spagnoli C. Neonatal seizures: A review of outcomes and outcome predictors. Neuropediatrics 2015; 47 : 012–019.
19. Buraniqi E, Sansevere AJ, Kapur K, et al. Electrographic seizures in preterm neonates in the neonatal intensive care unit. J Child Neurol 2017; 32 : 880–885.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2019 Číslo 3- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficitmi v reálnej praxi
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
-
Všetky články tohto čísla
- Editorial: Dětská neurologie
- Přehled nových, a ještě novějších léků na Duchennovu svalovou dystrofii a spinální svalovou atrofii
- Možnosti nefarmakologické léčby epilepsie u dětí
- Novorozenecké záchvaty
- Fibromuskulárna dysplázia u 2-ročného dieťaťa – kazuistika
- Klinické a laboratórne charakteristiky detí s orálnym alergickým syndrómom
- Primárna pľúcna hemosideróza – skúsenosti z Banskej Bystrice
- Závažné primární imunodeficience a možnosti jejich časné diagnostiky, uvedení testu TREC/KREC
- Životné jubileum prof. MUDr. Alexandra Jurka, DrSc. Srdce pre deti
- PUBLIKACE ČESKÝCH PEDIATRICKÝCH NEFROLOGŮ ZA POSLEDNÍ 4 ROKY V ČASOPISECH (HOME PUBMED)
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Závažné primární imunodeficience a možnosti jejich časné diagnostiky, uvedení testu TREC/KREC
- Primárna pľúcna hemosideróza – skúsenosti z Banskej Bystrice
- Přehled nových, a ještě novějších léků na Duchennovu svalovou dystrofii a spinální svalovou atrofii
- Fibromuskulárna dysplázia u 2-ročného dieťaťa – kazuistika
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



