-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Intrakraniální krvácení u pacientů s hemofilií A
Intracranial haemorrhage in patients with haemophilia A
Objective: The aim of this survey was to find out incidence and other circumstances of CNS bleeding in patients with haemophilia A in the Czech Republic.
Methods: Data from Czech National Haemophilia Program (CNHP) registry were evaluated. The findings were compared with available published evidence. Three case reports of CNS bleeding in newborns with haemophilia A are also presented.
Results: CNS bleeding is very rare in patients with haemophilia in Czech Republic – about one out of 1000 bleeding episodes. Patients at any age can be affected, though; bleeds reported between 0 to 79 years. Up to 5% of newborns with haemophilia A may experience CNS bleeding.
Conclusions: CNS bleeding is rare, but serious manifestation of haemophilia. Clinical manifestation and sequels can be various, from mild to fatal, as demonstrated in case reports. Diagnosis has to be done quickly and proper therapy including factor FVIII substitution should be immediately initiated. Diagnostics and treatment shall be done only in adequately equipped Haemophilia centre (HTC – Haemophilia Treatment Centre or CCC – Complex Care Centre)..
Keywords:
haemophilia – brain bleeding
Autoři: O. Zapletal; J. Blatný; P. Ovesná 1; V. Komrska 2; T. Pavlíková 3; S. Köhlerová; Čnhp V. Jménem Center Spolupracujících V Rámci Fiamoli 4
Působiště autorů: Oddělení dětské hematologie Fakultní nemocnice Brno, Centrum komplexní léčby hemofilie ; Institut biostatistiky a analýz Masarykovy univerzity, Brno 1; Klinika dětské hematologie a onkologie 2. LF UK a FN Motol, Praha 2; Klinika dětské radiologie Fakultní nemocnice Brno 3; Český národní hemofilický program (http://cnhp. registry. cz) 4
Vyšlo v časopise: Čes-slov Pediat 2019; 74 (4): 233-239.
Kategorie: Původní práce
Souhrn
Cíl: Cílem práce bylo zjistit, jak často a u kterých pacientů s hemofilií v České republice dochází ke krvácení do centrálního nervového systému.
Metody: Hodnotili jsme údaje o krvácení do CNS u pacientů s hemofilií zadané do registru Českého národního hemofilického programu. Zjištěné skutečnosti byly porovnány s dostupnou literaturou. K dokreslení problematiky jsou uvedeny 3 kazuistiky novorozenců s těžkou hemofilií A a různě závažným CNS krvácením.
Výsledky: CNS krvácení je u pacientů s hemofilií v České republice velmi vzácné (asi jedna z tisíce krvácivých příhod). Může postihnout pacienty v jakémkoliv věku – v hodnoceném souboru je věkové rozmezí 0–79 let. CNS krvácení postihuje asi 1–5 % novorozenců s těžkou formou hemofilie. Zjištěné skutečnosti odpovídají publikovaným údajům.
Závěry: CNS krvácení je vzácným, ale závažným projevem hemofilie. Může se vyskytnout v různých formách, s různou závažností, klinickými projevy a následky, jak demonstrují kazuistiky uvedených pacientů. Diagnóza musí být stanovena rychle a je třeba neprodleně zahájit správnou léčbu včetně substituce koncentrátem koagulačního faktoru. Diagnostika a léčba může být poskytnuta jen v hemofilickém centru, které má patřičné diagnosticko-terapeutické možnosti a zázemí.
Klíčová slova:
hemofílie – CNS krvácení
ÚVOD
Hemofilie A je vzácné vrozené krvácivé onemocnění různé klinické tíže způsobené defektem koagulačního faktoru VIII. U pacientů s těžkou formou hemofilie A dochází k prvním krvácivým projevům časně – v období porodu, nebo častěji na přelomu kojeneckého a batolecího věku, v souvislosti s počínajícími pohybovými aktivitami a drobnými úrazy.
Typické pro těžkou formu hemofilie je samovolné kloubní nebo svalové krvácení, tvorba velkých hematomů a krvácení při úrazech či operacích. Vzácněji se vyskytují další formy krvácení, jako jsou krvácení do urogenitálního či trávicího traktu, do centrálního nervového systému (CNS) a další. K léčbě nebo prevenci krvácení se v současnosti používá substituční léčba koncentráty FVIII.
SOUBOR A METODY
Od roku 2011 funguje v České republice síť hemofilických center sdružená v rámci Českého národního hemofilického programu (ČNHP, http://cnhp.registry.cz/) zaměřená na diagnostiku, sledování a léčbu pacientů postižených hemofilií, von Willebrandovou chorobou a jinými vrozenými koagulopatiemi. V rámci ČNHP bylo v ČR ustanoveno s podporou České hematologické společnosti (ČHS), České pediatrické společnosti (ČPS) a České společnosti pro trombózu a hemostázu (ČSTH) ČLS JEP jedenáct hemofilických center – pět center komplexní péče (CCC): dvě v Praze, dvě v Brně a jedno Ostravě – a šest hemofilických léčebných center (HTC) v dalších krajských městech. Údaje o pacientech jsou zadávány do registru. Cílem registru je sběr a získávání epidemiologických a prognostických údajů, dat o léčbě a jejím vývoji, sledování zdravotního stavu a léčby pacientů pomocí kvantitativních dat, sledování kvality života pacientů s hemofilií, srovnávání jednotlivých center v ČR, srovnávání celonárodních dat vůči ostatním zemím a získávání podkladů pro strukturování a plánování lékařské péče. Registr ČNHP je webovou aplikací plně kompatibilní se systémy, které jsou provozované pro sběr dat z klinických studií, jeho tvorba splňuje kritéria, která definují normy ISO20001 a ISO27001.
K 31. 12. 2016 bylo v registru ČNHP zařazeno celkem 1424 validních pacientů s poruchami krevního srážení – z nich je 649 s hemofilií A, 98 s hemofilií B, 565 s von Willebrandovou chorobou a 112 s deficity jiných faktorů krevního srážení. Údaje o stavu pacientů jsou aktualizovány na roční bázi. Z databáze registru ČNHP byla pro tuto práci vybrána všechna zaznamenaná CNS krvácení spolu s údaji o věku pacienta, druhu a tíži hemofilie a také roce, kdy ke krvácení došlo. Byly rovněž získány údaje o celkovém počtu krvácení u všech pacientů, kteří v daném roce měli krvácivou epizodu. Uvedená data jsou dostupná od roku 2003 do 2016. Nejedná se o všechny pacienty s hemofilií A v České republice, nicméně v letech 2011–2016 jsou obsaženy údaje o všech dětských pacientech a o reprezentativním vzorku dospělé populace. Pro srovnání jsou uvedeny shodné údaje i u pacientů s hemofilií B (tab. 1).
Tab. 1. Počty hemofiliků s krvácivou příhodou u jednotlivých letech z registru ČNHP. 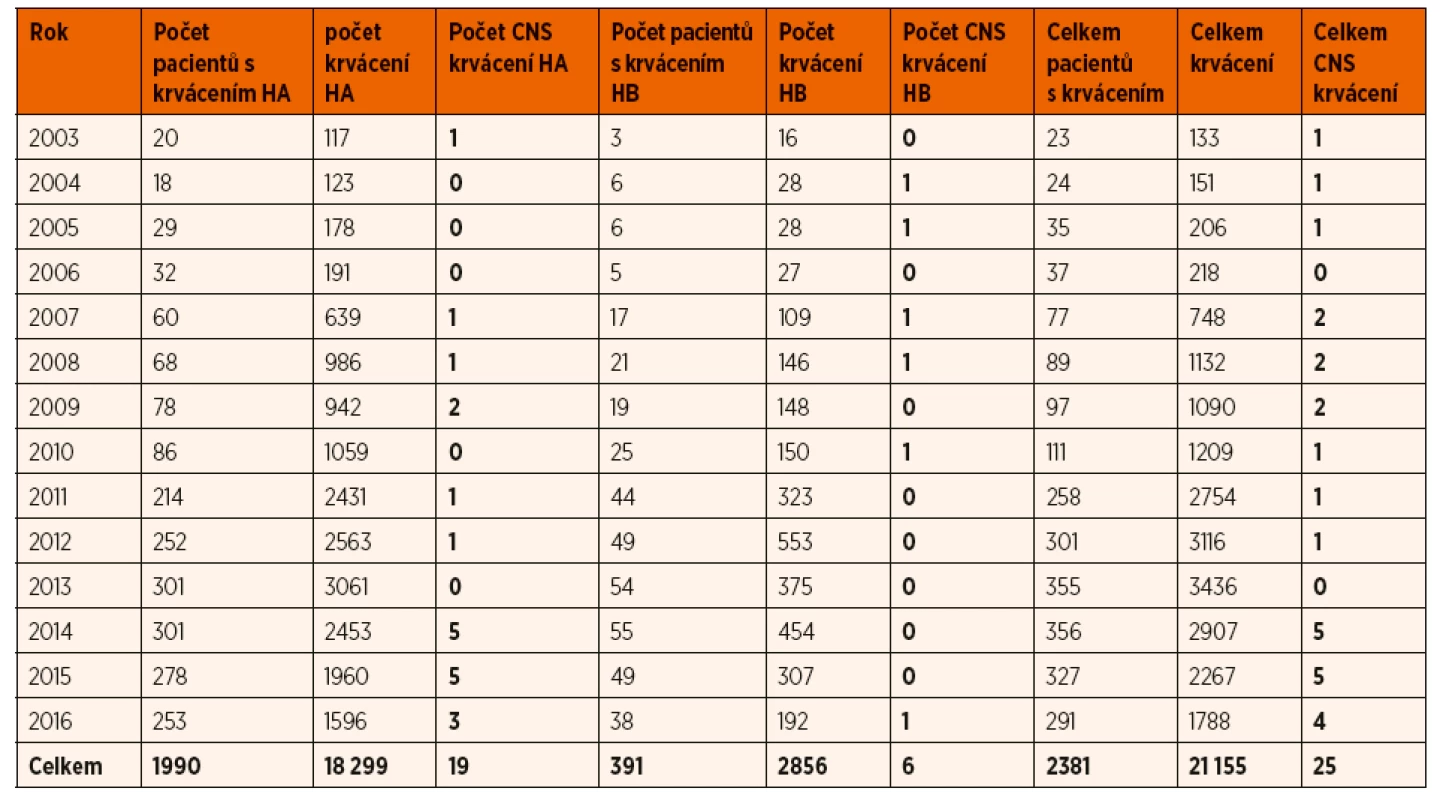
Zkratky: HA – hemofilie A, HB – hemofilie B, CNS – centrální nervový systém VÝSLEDKY
V letech 2003–2016 bylo zaznamenáno v registru ČNHP celkem 26 CNS krvácení u pacientů s hemofilií ve věku 0 až 79 let (průměr 38 let, medián 41 let). Celkem se ve sledované skupině vyskytlo v daném období 21 155 případů krvácení, 26 CNS krvácení tak tvořilo pouze 0,12 % ze všech krvácení. Jednalo se o 20 pacientů s hemofilií A a 6 s hemofilií B. Dále se budeme zabývat pouze pacienty s hemofilií A.
Těžkou formu hemofilie A mělo 15 pacientů s CNS krvácením. Z nich bylo 5 krvácení v dětském věku – 3 v novorozeneckém a pak pacienti krváceli v 1 roce a 5 letech věku. U dospělých hemofiliků šlo převážně o mladší pacienty (7krát CNS krvácení ve skupině 23–34 let oproti 3 krvácením u starších (60–68 let). CNS krvácením byli postiženi také 2 dospělí s lehkou hemofilií A (věk 51 a 79 let) a 3 se střední formou onemocnění (krvácení ve věku 56, 59 a 65 let), viz tabulka 2.
Tab. 2. Údaje o pacientech v dětském věku (0–18 let) z registru ČNHP v letech 2011-2016. 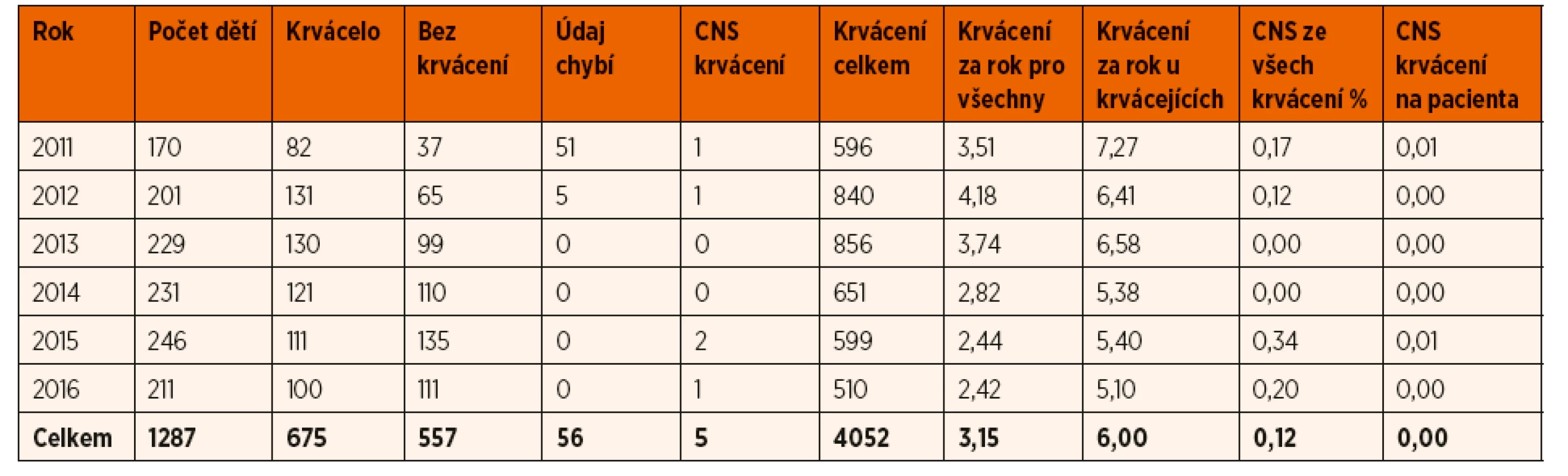
V letech 2011 až 2016 došlo k 5 CNS krvácením u dětí. To je méně než jedno CNS krvácení za rok v celé ČR. Vztaženo k celkovému počtu krvácení u dětí tvoří CNS krvácení pouze 0,1 %. Všech 5 krvácení se vyskytlo u pacientů s těžkou formou hemofilie A.
Za posledních 14 let byla v naší zemi v registru ČNHP dokumentována jen 3 CNS krvácení u novorozenců – kazuistiky uvádíme níže. V ČR se dlouhodobě rodí ročně 10–12 hemofiliků (z toho asi 3 s těžkou formou hemofilie). Můžeme tak odhadnout, že CNS krvácení se v daném období vyskytlo u asi 2 % všech novorozenců s hemofilií, a přibližně u 7 % s těžkou formou onemocnění.
KAZUISTIKA 1
Matka pacienta je prokázaná přenašečka těžké formy hemofilie A (inverze intronu 22 v genu pro FVIII, tato mutace je nejčastější příčinou těžké formy hemofilie A [1]). Na přání rodiny nebyla provedena doporučená prenatální diagnostika. Chlapec se narodil v dubnu 2015. Porod proběhl ve spádové porodnici, spontánně, záhlavím ve 38. týdnu gravidity. Po porodu (APGAR skóre 9–10–10) dítě bez komplikací, plně kojeno, na pokoji s maminkou. Od třetího dne hoch hůře pil, s nutností dokrmů. Čtvrtý den po porodu se objevila apatie, bledost a při odběrech krve v 4,45 hod došlo k záškubům pravostranných končetin, opistotonu a anizokorii. Dítě bylo transferováno na JIP, intubováno a tlumeno. Bylo provedeno ultrazvukové vyšetření mozku s nálezem rozsáhlé hyperechogenity vpravo s přetlakem středočárových struktur.
Chlapec byl akutně přeložen do spádové fakultní nemocnice, na novorozeneckou JIP v 10,30 hod. Ultrazvuk potvrdil rozsáhlé krvácení do mozkového parenchymu i komor. Byl kontaktován hematolog, vzhledem rodinné anamnéze akutně vyšetřen FVIII. Byla zjištěna aktivita FVIII <1 % – potvrzena těžká forma hemofilie A. Byla zahájena substituční léčba koncentrátem FVIII (rFVIII, Advate®, Shire). První dávka 250 IU byla podána ve 12,40 hod dalšího dne, tedy až 30 hodin od prvních příznaků. Bylo doplněno CT vyšetření (obr. 1) a z vitální indikace byl téhož dne večer proveden neurochirurgický výkon – kraniotomie a evakuace hematomu.
Obr. 1. Akutně provedené CT – axiální řez: Jsou patrné denzity čerstvé krve v obou postranních komorách, přesun středočárových struktur při extenzivním intraparenchymovém hematomu P-O vpravo, dále subdurální hematom l. dx.
Fig. 1. Acute CT scan – axial view: Right P-O acute hemorrhage with midline shift is demonstrated as well as bilateral intraventricular bleeding and right F-P subdural haematoma.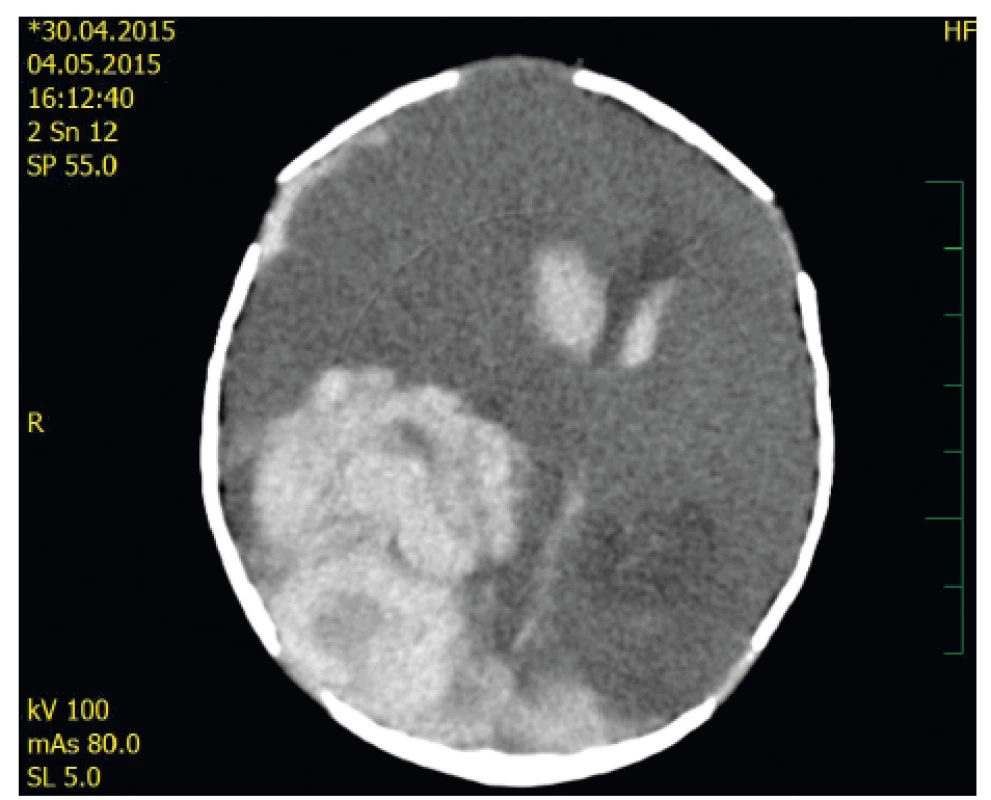
Po operaci pokračovala komplexní péče včetně substituce Advate, byl monitorován nitrolební tlak. Druhý pooperační den nitrolební tlak narůstal, bylo nutno provést dekompresní kraniotomii. Po výkonu se stav postupně stabilizoval, pokračovala intenzivní substituce Advate. Neurologický stav nebyl příznivý – křečová aktivita s nutností navyšování antiepileptik, trvala anizokorie, alterace kmenových reflexů, počínající spasticita. Patnáct dní po operaci bylo provedeno kontrolní MR s nálezem rozsáhlých malatických změn bilaterálně, bez čerstvého krvácení, bez rozvoje hydrocefalu (obr. 2). Od 17. dne byla intenzivní substituce Advate snížena, lék byl dále podáván 1x denně. Ultrazvukový nález i neurologický stav zůstávaly nepříznivé, 4 týdny po operaci byl extrahován centrální žilní katétr a byla ukončena substituce Advate.
Obr. 2. MR vyšetření bylo provedeno 15. den po dekompresivní kraniotomii u téhož pacienta: Signálové změny ve FLAIR obrazech na axiálním řezu odpovídají subakutnímu hematomu P-O vpravo po evakuaci, krvi v obou postranních komorách s podílem rozvíjejících se malatických změn oboustranně. Je patrná asymetrie kalvy – v souvislosti s kraniotomií a polohou hlavy, hematom P-O vpravo.
Fig. 2. MR scan – day 15 after decompressive craniotomy – the same patient: Signal changes in FLAIR are indicative of subacute intraparenchymal hematoma right P-O after evacuation and blood in both lateral ventricles, malacic changes bilaterally.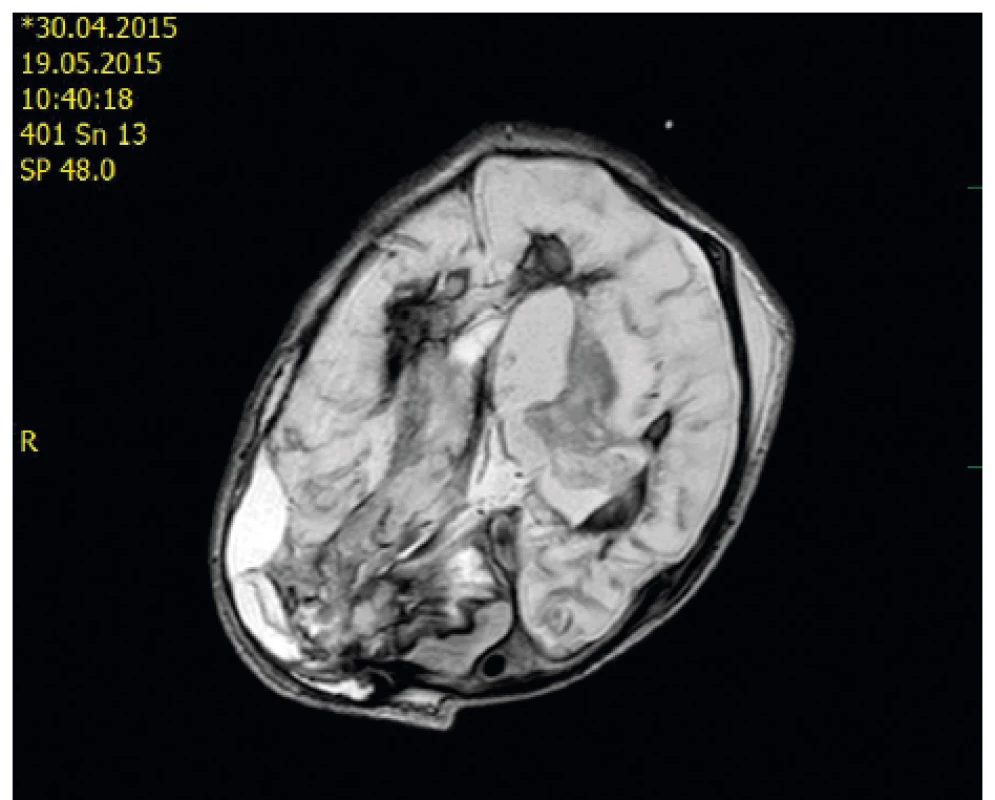
V půl roce života vykazoval chlapec centrální spastickou hemiparézu s levostrannou převahou, těžkou psychomotorickou retardaci, mikrocefalii a sekundární epilepsii. Tento stav trvá doposud, chlapec je těžce neurologicky postižený, v lokálním azylovém ústavu.
KAZUISTIKA 2
Chlapec se narodil v září 2015 jako první dítě zdravých nepříbuzných rodičů. Rodina neměla známou zátěž ve smyslu krvácivých chorob. Porod proběhl ve 39. týdnu gravidity, spontánně, záhlavím. Porodní hmotnost byla 3170 g, délka 47 cm, APGAR skóre 10–10–10 bodů. Od porodu byl patrný velký kefalhematom. Hoch krvácel i po snesení pahýlu pupečníku a po odběru screeningu metabolických vad z patičky. V provedeném koagulačním vyšetření byl nález neměřitelného aPTT a nízkého FVIII 0,6 %. FIX byl 44 %, v normě.
Chlapec byl přeložen se suspektní hemofilií A do spádového hemofilického centra, kde byla těžká forma hemofilie A z dalších odběrů potvrzena. Vzhledem k negativní rodinné anamnéze byla provedena i rodinná genetická studie. Stav kefalhematomu a nález v CNS byly opakovaně kontrolovány ultrazvukovým vyšetřením. Sedmý den po porodu kefalhematom narůstal, došlo k anemizaci s nutností podání transfuze erytrocytů. Ve snaze vyhnout se časnému zahájení substituční léčby koncentrátem faktoru FVIII, která může při podání v novorozeneckém věku zvyšovat riziko vzniku inhibitoru FVIII [11], byla ke zvládnutí měkkotkáňového krvácení zvolena by-passová terapie rekombinantním aktivovaným FVII (rFVIIa, Novoseven®, Novo Nordisk) 90 µg/kg á 3 hod. Při kontrolním UZ vyšetření bylo vysloveno podezření na CNS krvácení v oblasti mozečku. Nález byl následně verifikován CT vyšetřením s nálezem rozsáhlé expanzivní hemoragie mediálně v zadní jámě lební, zasahující IV. mozkovou komoru, šířící se podél tentoria s hrozícím okcipitálním konusem. Pravá postranní komora byla dilatována na 13 mm, levá na 9 mm, byl přítomen pravostranný kefalhematom ve vrstvě 23 mm (obr. 3 a 4).
Obr. 3. Akutní CT vyšetření, koronární řez: Je patrný objemný pravostranný kefalhematom. Dále byla prokázána expanzivní hemoragie mediálně v zadní jámě lební zasahující IV. mozkovou komoru, s propagací supratentoriálně vlevo a lem krve i podél mozečkových hemisfér. Je patrná dilatace postranních komor, více vpravo.
Fig. 3. Acute CT scan, coronal view: Voluminous right-sided cephalhematoma, extensive intracerebellar hemorrhage promoting supratentorially and subdural hematoma infratentorially.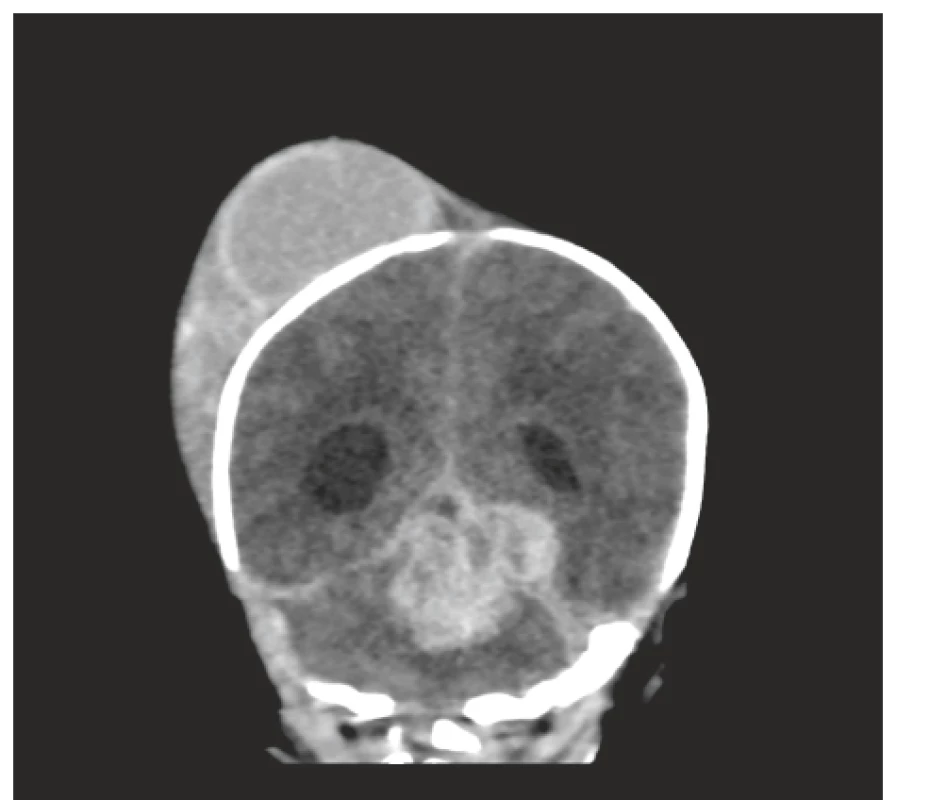
Obr. 4. Stejné CT vyšetření jako na obr. č. 3 – nyní v sagitálním řezu: Je zachycen především objemný kefalhematom. Hrozící okcipitální konus.
Fig. 4. The same patient as No. 3 – CT scan, sagittal view: Voluminous cephalhematoma. Oncoming occipital conus.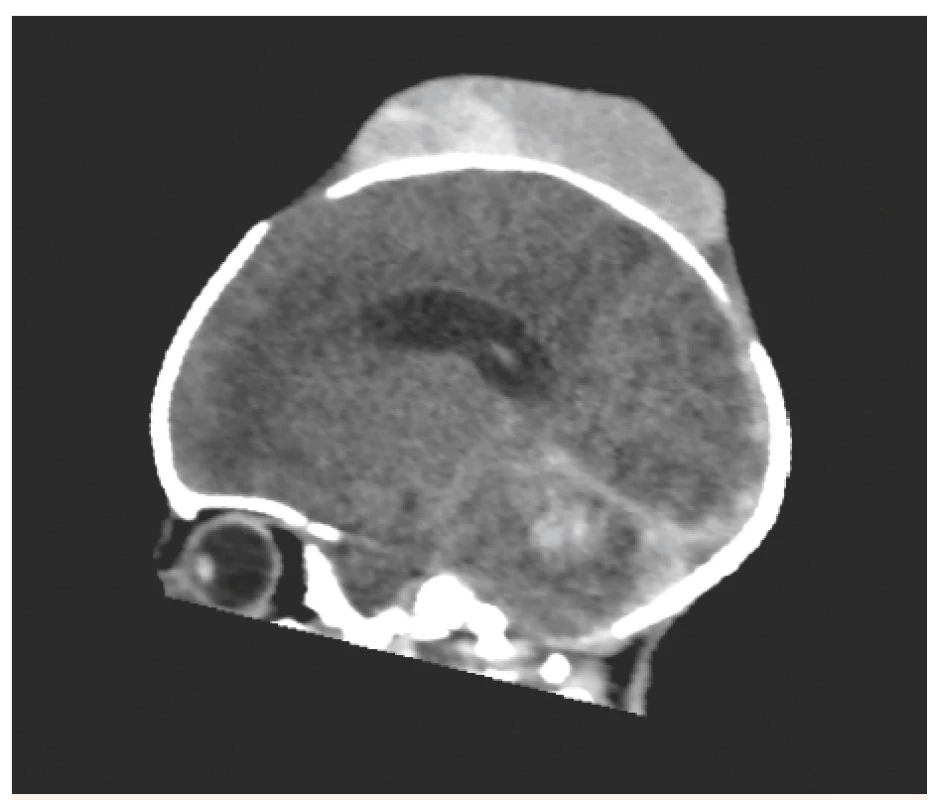
Neurolog našel pouze slabší reflexní úchop PDK, bez dalších známek latelarizace. Pacient byl intubován, tlumen, byla podána antiedematózní terapie (dexametazon, manitol). Zároveň byla zahájena intenzívní substituční léčbu koncentrátem FVIII (rFVIII, Advate®, Shire) v dávce 50 IU/kg á 12 hod, za monitorace hladin FVIII. Dávky byly modifikovány tak, aby byla aktivita FVIII udržována v požadovaném rozmezí 80–150 %. Neurochirurgický evakuační zákrok nebyl indikován. Kontrolní CT v následujících dnech neprokázalo progresi krvácení, ale objevil se nález ischemií v levé hemisféře. Bylo doplněno MR-angiografické vyšetření s nálezem subakutní hemoragie intrakraniálně i subkutánně, rozsáhlé ischemie vlevo O-T-P nekopírující jednoznačně některé z arteriálních teritorií (obr. 5 a 6).
Obr. 5. MR vyšetření, koronární řez – stejný pacient jako na obr. č. 3 a 4, odstup 7 dní: V obrazech T1W FFE SENSE jsou patrné subakutní subdurální hematomy podél tentoria a levé mozkové hemisféry, dále hematom mediálně v zadní jámě, nově rozvíjející se ischemické změny T-P-O vlevo. Velikost kefalhematomu nyní lehce zmenšena.
Fig. 5. MR scan, coronal view – the same patient as No. 3 and 4 – interval 7 days: T1 FFE SENSE signal intensity are indicative of left sided subacute subdural hematoma, intracerebellar hemorrhage, newly developing left T-P-O ischemic changes.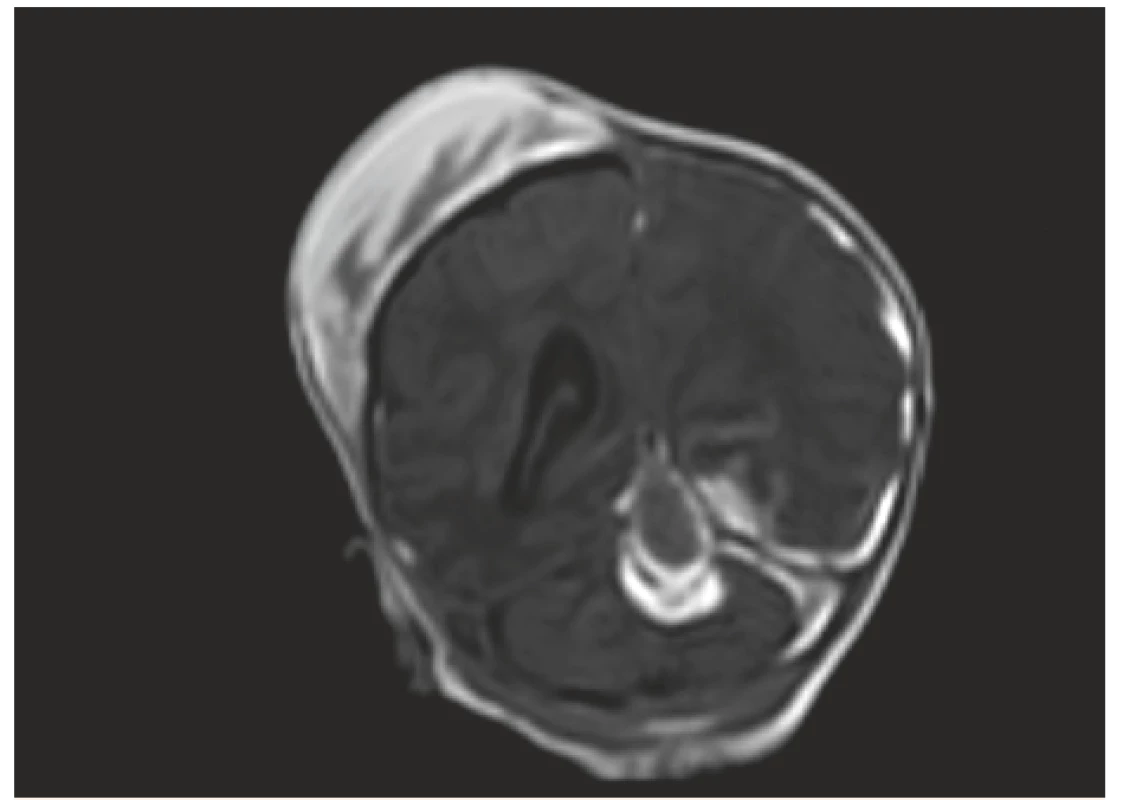
Obr. 6. MR vyšetření, sagitální řez – T1W FFE SENSE – stejný pacient jako na obr. 3, 4, 5. Kefalhematom, subakutní subdurální hematom podél tentoria a levé mozkové i mozečkové hemisféry.
Fig. 6. MR scan, sagittal view – T1W FFE SENSE – the same patient as No. 3, 4, 5. Cephalhematoma, left sided subacute subdural hematoma.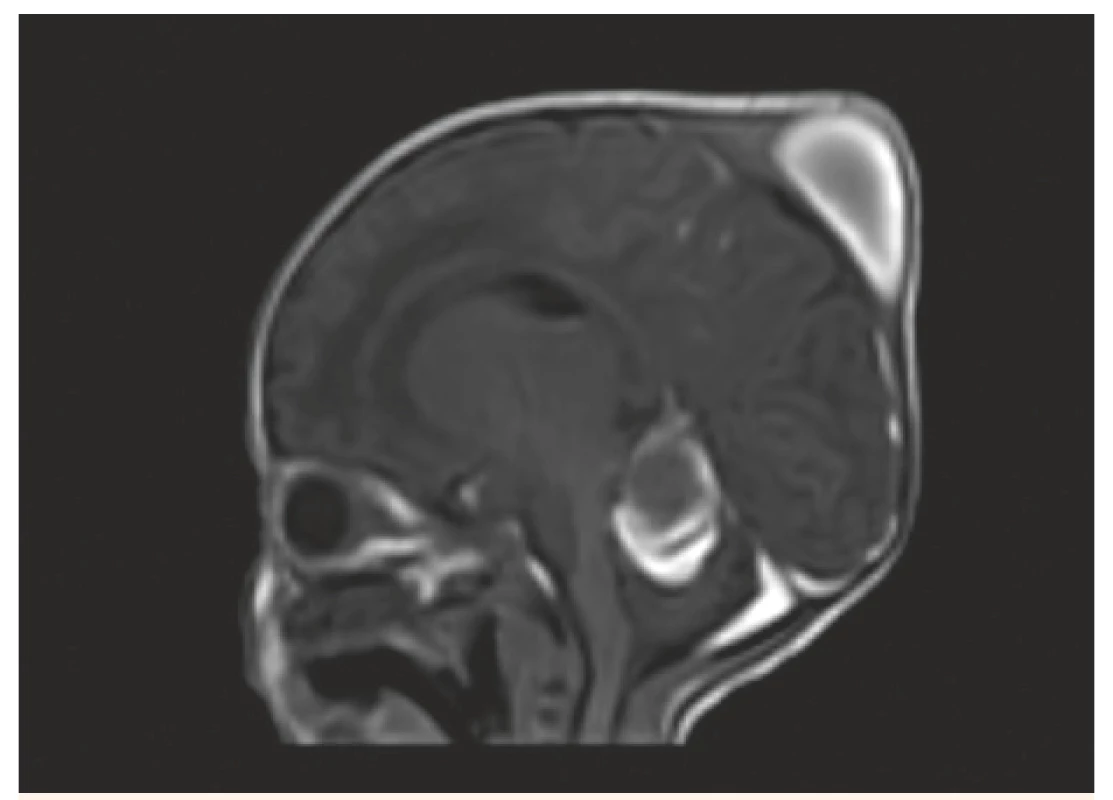
Po 5 dnech bylo ukončeno tlumení, pacient byl extubován. Neurologický nález zůstával nadále bez ložiskové symptomatologie. Pokračovala substituce rFVIII denně. Po 3 týdnech byl zaveden centrální žilní katétr – baby port – k zajištění kvalitního žilního přístupu. Po zhojení portu, měsíc od CNS krvácení, proběhla změna frekvence substituční léčby Advate na obdenní podávání. Rodiče byli zaučeni k aplikaci a podávali substituční léčbu od portu. Byla tak umožněna dimise a domácí léčba. Postupně se začala zhoršovat funkce CVK-portu (obtížná aplikace, špatný návrat krve). Po 7 měsících od zavedení (v květnu 2016) byla nástřikem kontrastní látkou pod rtg kontrolou prokázána netěsnost systému a extravazace kontrastní látky do okolí komůrky portu. Současně s tím, zřejmě při krvácení do okolí portu a prolongované expozici koncentrátu FVIII extravazálně, došlo ke vzniku inhibitoru FVIII (iFVIII).
Výskyt inhibitoru po tak dlouhé době léčby (cca 70 expozičních dní) je méně obvyklý. Iinhibitor FVIII nejčastěji vzniká po 10–20 dávkách (expozičních dnech) koncentrátu FVIII [6, 8]). Jednalo se o iFVIII v nízkém titru, maximálně 1,2 BU (Bethesda units), s poklesem IVR (in vivo recovery – tj. poměr předpokládaného a reálného vzestupu hladiny FVIII po podání koncentrátu). Bylo nutno explantovat nefunkční port a zavést nový. Hemostáza během výkonu byla zajištěna substitucí by-passového preparátu (rFVIIa) kvůli prevenci dalšího vzestupu titru iFVIII při operaci. Výkon proběhl koncem května téhož roku. Po zhojení portu byla v červnu 2016 zahájena imunotoleranční nízce dávkovaná léčba (Advate 50 IU/kg obden) s cílem eradikovat inhibitor. To se zdařilo po 2 měsících – nejprve poklesl inhibitor do negativních hodnot (0 BU), následně se normalizovalo IVR po podání FVIII a nakonec se normalizoval i poločas FVIII. Od srpna 2016 pacient přešel na profylaktickou substituci 3krát týdně 500 IU Advate.
Aktuálně má hoch přes 2 roky, je přítomna lehká psychomotorická retardace. Suspektní korová porucha vizu nebyla potvrzena. Geneticky byla prokázána kauzální mutace u pacienta a jeho maminky – inverze intronu 22.
KAZUISTIKA 3
Chlapec se narodil v únoru 2016, ve 39. týdnu gravidity. Porod byl indukovaný, záhlavím a jednalo se o první dítě zdravých nepříbuzných rodičů. Porodní hmotnost byla 3300 g, délka 48 cm, APGAR skóre 10–10–10. Třetí den po porodu došlo po zastřižení pupečního pahýlu ke krvácení, které se nedařilo zastavit. Byla nutná sutura. Laboratorním vyšetřením bylo zjištěno prodloužené aPTT R 3,6. Na UZ mozku bylo prokázáno nitrokomorové krvácení (IVH), vpravo II. stupně (bez rozšíření komor) a vlevo I. stupně (pouze subependymální hematom). Pacient byl přeložen na spádové pracoviště ve věku 4 dní.
Neurologický nález byl v normě, byla stanovena diagnóza těžké formy hemofilie A, aktivita FVIII 0,4 %. FIX byl 43 %, v normě. Bylo provedeno genetické vyšetření pacienta i rodiny. Byla zahájena substituční léčba koncentrátem rFVIII (Advate®, Shire) 50 IU/kg á 12 hod, později 1x denně, za monitorace hladin. CNS krvácení bylo sledováno ultrazvukem, k progresi nedocházelo, krvácení se na léčbě postupně vstřebalo. Při kontrolním vyšetření MR s odstupem 16 dní již bez známek krvácení. Chlapec byl propuštěn po 3 týdnech do domácí péče za obdenního podávání Advate, rodiče byli zaučeni k aplikaci léku. Po 21 dnech léčby (ED) byl při kontrolním vyšetření prokázán inhibitor FVIII v titru 5,2 BU. Byla zahájena imunotoleranční léčba v nízce dávkovaném režimu 50 IU/kg obden, dle aktuálních britských doporučení [12]. Pro nedostatečný periferní žilní přístup byl v dubnu zaveden CVK - baby port. Výkon byl pokryt by-passovou léčbou aPCC (Feiba®, Shire). ITT pokračovala. Po výkonu došlo k anemizaci s nutností podání transfuze erytrocytů. Rodiče byli zaučeni k aplikaci do portu při domácí léčbě. Pro další vzestup titru iFVIII na hodnoty přes 10 BU byla zintenzivněna ITT na 100 IU Advate/kg a den. Na této léčbě pak došlo k rychlému poklesu iFVIII až do negativních hodnot. Pomaleji se upravovalo IVR, které stagnovalo na 50–60 % a nebyl normalizován poločas FVIII po podání (po 24 hod od podání ITT neměl chlapec aktivitu FVIII nad svou bazální hodnotou). V říjnu 2017 došlo i k opětovnému nárůstu titru iFVIII až na 3,8 BU. ITT léčba pokračovala (100 IU/kg Advate denně) a od prosince 2017 byla intenzifikována imunosupresí rituximabem (MabThera®, Roche) v dávce 375 mg/m2, 4 dávky v týdenním odstupu.
Psychomotorický vývoj u pacienta je zcela v normě, neurologicky bez nálezu, port funguje správně. Genetickým vyšetřením byla prokázána v rodině (pacient i jeho maminka přenašečka) kauzální mutace způsobující těžkou formu hemofilie A – inverze v intronu 22, stejně jako v předchozích případech.
DISKUSE
CNS krvácení zaznamenaná v registru ČNHP postihují spíše starší pacienty, zčásti při úrazech. U dětí je krvácení do CNS velmi vzácné (méně než 0,1 % ze všech krvácení). U novorozenců s hemofilií se CNS krvácení vyskytlo
u 2 % pacientů, resp. u 7 % s těžkou formou onemocnění.Literární data uvádí u novorozenců s hemofilií výskyt intrakraniálního krvácení v rozmezí 1–4 % [1, 2], např. Tarantino udává 3,4 % u souboru 580 hemofiliků oproti 0,11 % u novorozenců bez hemofilie [1], obdobně Davies uvádí 44násobné zvýšení rizika CNS krvácení u hemofiliků oproti běžné populaci [3]. Podle francouzských údajů je v průběhu života osoby s hemofilií riziko CNS krvácení nejvyšší právě v novorozeneckém věku [4]. Intrakraniální krvácení se může vyskytovat samostatně, nebo v kombinaci s extrakraniálním subgaleálním krvácením – kefalhematomy. Výskyt kefalhematomů je u hemofiliků 8krát zvýšený oproti běžné populaci [3]. Krevní ztráta při objemném kefalhematomu může novorozence ohrozit hypovolémií a zvýšenou mortalitou [3, 5]. Následky ICH zůstávají závažné i v současnosti. Přes časnější detekci a lepší léčbu, neurologický deficit postihuje 9–50 % pacientů [3, 6, 7]. Riziko intra - i extrakraniálního krvácení je zvýšeno při komplikovaném, traumatickém porodu nebo při použití vakuum-extraktoru či kleští [1, 3, 8–10]. Porod císařským řezem naopak riziko CNS krvácení u hemofiliků snižuje [3].
S přihlédnutím k výše uvedenému můžeme konstatovat, že výskyt ICH u dětí s hemofilií v ČR je zhruba srovnatelný s publikovanými údaji, byť náš soubor má relativně nízký počet pacientů.
ZÁVĚR
Perinatální CNS krvácení je vzácným, ale závažným projevem hemofilie. Postihuje asi 1–5 % novorozenců s hemofilií. Může se vyskytnout v různých formách, s různou závažností, klinickými projevy a následky, jak demonstrují kazuistiky uvedených pacientů. V oblasti hlavy se u hemofiliků kromě intrakraniálního mohou objevovat i subgaleální krvácení (kefalhematomy), která mohou být rovněž závažná a vést ke klinicky významné anemizaci pacienta. Riziko krvácení u novorozenců s hemofilií je vyšší při vaginálním porodu než při císařském řezu a dále stoupá při nutnosti asistovaného porodu (kleště, vakuumextraktor). V některých případech (kefalopelvický nepoměr či jiné porodnické riziko, anamnéza CNS krvácení u předchozího dítěte) je tak na zvážení provedení plánovaného operativního porodu.
Ne všichni pacienti s vrozenou krvácivou chorobou však mají pozitivní rodinnou anamnézu, nebo dokonce již prenatálně stanovenou diagnózu. Proto je při neobvyklém krvácení u novorozence (typicky krvácení po snesení pahýlu pupečníku, nezastavitelné krvácení ze vpichu do patičky při odběru screeningu metabolických vad nebo po odběrech ze žíly, stejně jako u případného CNS krvácení či u velkých kefalhematomů) potřebné provést patřičná laboratorní vyšetření. Jedná se zejména o krevní obraz k vyloučení trombocytopenie a případné anemie, základní koagulační vyšetření, kde u těžké formy hemofilie nacházíme prodloužení aPTT do vysokých, někdy až neměřitelných hodnot (aPTT R >5). Při tomto nálezu je indikováno vyšetření jednotlivých koagulačních faktorů (zejména FVIII, FIX, FXI, VWF, případně dalších) a pacient musí být referován do spádového hemofilického centra.
Komplexní péče o pacienta s vrozenou krvácivou chorobou, jako je hemofilie nebo von Willebrandova choroba, může být poskytnuta pouze v hemofilickém centru, které má patřičné diagnosticko-terapeutické možnosti a zázemí. Diagnóza musí být stanovena rychle a je třeba neprodleně zahájit správnou léčbu včetně substituce koncentrátem koagulačního faktoru. Nutnost intenzivní léčby u novorozence s CNS krvácením může být rizikovým faktorem zvyšujícím pravděpodobnost vzniku inhibitorů.
Došlo: 18. 4. 2018
Přijato: 4. 6. 2019
MUDr. Ondřej Zapletal, Ph.D.
Oddělení dětské hematologie
Fakultní nemocnice Brno
Černopolní 9
613 00 Brno
e-mail: zapletal.ondrej@fnbrno.cz
Zdroje
1. Lee Ch A, et al. Textbook of Hemophilia. 2nd ed. Wiley-Blackwell, 2010 : 110–114. IBSN 978-4051-6914-1.
2. Tarantino MD, et al. The incidence and outcome of intracranial hemorrhage in newborns with hemophilia: Analysis of Nationwide Inpatient Sample database. Haemophilia 2007; 13 : 380–382.
3. Davies J, et al. Mode of delivery and cranial bleeding in newborns with haemophilia: a systematic review and meta-analysis of the literature. Review. Haemophilia 2016 Jan; 22 (1): 32–38. doi: 10.1111/hae.12726. Epub 2015 May 20.
4. Stieltjes N, et al. Intracranial haemorrhages in French haemophilia patients (1991–2001): clinical presentation, management and prognosis factors for death. Haemophilia 2005; 11 : 452–458.
5. Kletzel M, et al. Postdelivery head bleeding in hemophilic neonates. Arch J Dis Child 1989; 143 : 1107–1110.
6. Revel-Vilk S, et al. Effect of intracranial bleeds on the health and quality of life of boys with hemophilia. J Pediatr 2004; 144 : 490–495.
7. Richards M, et al. Neonatal bleeding in haemophilia: a European cohort study. Br J Haematol 2012; 156 : 374–382.
8. Klinge J, et al. Prevalence and outcome of intracranial haemorrhage in haemophiliacs–a survey of the paediatric group of the German Society of Thrombosis and Haemostasis (GTH). Eur J Pediatr 1999; 158 (Suppl 3): S162–S165.
9. Whitby EH, et al. Frequency and natural history of subdural haemorrhages in baibies and relation to obstetric factors. Lancet 2004; 363 : 846–851.
10.Kulkarni R, et al. Perinatal management of newborns with hemophilia, Br J Hematol 2001; 112 : 264–274.
11. Gouw SC, et al. Treatment-related risk factors of inhibitor development in previously untreated patients with hemophilia A: the CANAL cohort study. Blood 2007 Jun 1; 109 (11): 4648–4654. Epub 2007 Feb 8.
12. http://www.ukhcdo.org/wp-content/uploads/2017/01/ITI-protocol-2017.pdf.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2019 Číslo 4- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficitmi v reálnej praxi
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
-
Všetky články tohto čísla
- Editorial: Dětská a dorostová psychiatrie ve 21. století
- Longitudinální sledování vývoje sociálních schopností u pacientů s autismem: problematika spolehlivosti rodičovské výpovědi v telefonickém interview
- Význam maternálních autoprotilátek při vzniku poruch autistického spektra
- Možnosti farmakoterapie depresívnej poruchy u detí a adolescentov
- Specifika posttraumatické stresové poruchy v dětství a dospívání
- Psychiatrické poruchy s převahou somatických projevů v dětství a adolescenci
- Vplyv dlhodobej kortikoterapie na kostné zdravie u detí s idiopatickým nefrotickým syndrómom
- Odešel prof. MUDr. Josef Koutecký, DrSc.
- Intrakraniální krvácení u pacientů s hemofilií A
- Dieťa s príznakmi akútneho zápalu hrtana na urgentnom príjme – analýza súboru pacientov ošetrených v rokoch 2016 a 2017
- Profesor Dr. Leopold Moll *2. 3. 1877 Česká Lípa – ✞21. 2. 1933 Vídeň
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Specifika posttraumatické stresové poruchy v dětství a dospívání
- Psychiatrické poruchy s převahou somatických projevů v dětství a adolescenci
- Možnosti farmakoterapie depresívnej poruchy u detí a adolescentov
- Význam maternálních autoprotilátek při vzniku poruch autistického spektra
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



