-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Markery kostního obratu u osteoporózy: společné stanovisko k jejich využití Společnosti pro metabolická onemocnění skeletu České lékařské společnosti J. E. Purkyně (SMOS ČLS JEP) a České společnosti klinické biochemie České lékařské společnosti J. E. Purkyně (ČSKB ČLS JEP)
Bone turnover markers in osteoporosis: a common statement on their use of the Society for Metabolic Bone Diseases within the Czech Medical Association of J.E. Purkyne (SMBD CzMA JEP) and the Czech Society of Clinical Biochemistry within the Czech Medical Association of J.E. Purkyne (CSCB CzMA JEP)
The publication is a joint position of the Czech Society of Clinical Biochemistry and the Society for Metabolic Skeletal Diseases on the use of bone turnover markers in patients with osteoporosis. It is recommended to use PINP (Procollagen type I N-terminal propeptide) in μg/L as a marker of bone formation and CTX-I (C-terminal telopeptide of type I collagen) in ng/L as a marker of bone resorption. Blood sampling should be performed after an overnight fasting, an enormous physical load 24 hours prior to collection should be also avoided. Always take blood samples between hours 7 : 00 and 10 : 00 in the morning. Both serum and EDTA-plasma are acceptable. EDTA-plasma is preferable when CTX-I cannot be processed within 8 hours. PINP is not an optimal parameter in patients monitoring treated by corticoids, except anabolic therapy monitoring. Harmonised reference limits were recommended to unify their interpretation. For Roche systems we suggested basal reference range (CTX-I 100–600 ng/L for women, 70–700 ng/L for men; PINP 20–70 µg/L for both men and women), upper pathological limit (CTX-I 1 000 ng/L for women, 850 ng/L for men; PINP 100 µg/L for both men and women) For IDS systems we suggested to use basal reference limit (CTX-I 50–670 ng/L in women, 90–780 ng/L in men; PINP 20–75 µg/L in women, 20–80 µg/L in men), upper pathological limit (CTX-I 1 050 ng/L in women, 850 ng/L in men; PINP 100 µg/L in both men and women). For therapy monitoring a 25% change in serum CTX-I and PINP values is defined as LSC (least significant change), or in absolute values it means 100 ng/L change of serum CTX-I and 10 µg/L change for PINP.
Keywords:
bone markers – clinical use – CTX-I –osteoporosis – PINP – recommendation
Autori: Pikner Richard 1,2,3; Palička Vladimír 4; Rosa Jan 5; Zikán Vít 6; Švagera Zdeněk 7; Racek Jaroslav 2; Friedecký Bedřich 8,4; Kratochvíla Josef 8; Zima Tomáš 9
Pôsobisko autorov: Oddělení klinických laboratoří, pracoviště kostního metabolizmu, Klatovská nemocnice a. s., Klatovy 1; Ústav klinické biochemie a hematologie LF UK a FN Plzeň 2; Katedra záchranářství, diagnostických oborů a veřejného zdravotnictví, Fakulta zdravotnických studií Západočeské univerzity v Plzni 3; Ústav klinické biochemie a diagnostiky LF UK a FN Hradec Králové 4; Osteocentrum, Affidea Praha s. r. o., Praha 5; Ambulance pro metabolická onemocnění skeletu a poruchy kalciového metabolismu, III. interní klinika 1. LF UK a VFN v Praze 6; Ústav laboratorní diagnostiky, oddělení klinické biochemie FN Ostrava 7; SEKK spol. s r. o., Pardubice 8; Ústav lékařské biochemie a laboratorní diagnostiky 1. LF UK a VFN v Praze 9
Vyšlo v časopise: Clinical Osteology 2020; 25(2): 65-82
Kategória: Doporučené postupy
Súhrn
Publikace je společným stanoviskem České společnosti klinické biochemie a Společnosti pro metabolická onemocnění skeletu k využití markerů kostního obratu u pacientů s osteoporózou. Doporučuje se užívat PINP (N-terminální propeptid prokolagenu typu 1/Procollagen type I N-terminal propeptide) v jednotkách μg/l jako marker kostní novotvorby a CTX-I (C-terminální příčně vázaný telopeptid kolagenu typu 1/C-terminal telopeptide of type I collagen) v jednotkách ng/l jako marker kostní resorpce. Odběr vzorku krve se provádí po nočním lačnění a je třeba se vyhnout enormní fyzické zátěži 24 hodin před odběrem, u PINP není lačnění třeba. Vzorky krve odebírejte vždy dopoledne v rozmezí mezi 7.–10. hodinou. Akceptovatelné jsou jak sérum, tak EDTA(EthyleneDiamineTetraacetic Acid/kyselina ethylendiamintetraoctová) plazma. EDTA-plazma je vhodnější, když není možné CTX-I zpracovat do 8 hodin od odběru. Optimální doba separace krvinek od plazmy nebo séra je do 2 hodin od odběru. PINP není vhodným parametrem při léčbě systémově podávanými kortikoidy, kromě sledování efektu anabolické terapie. Abychom sjednotili interpretaci CTX-I a PINP je doporučeno užívat pro systémy firmy Roche: základní referenční mez (CTX-I 100–600 ng/l u žen, 70–700 ng/l u mužů; PINP 20–70 μg/l u žen i mužů), horní patologická mez (CTX-I 1 000 ng/l u žen, 850 ng/l u mužů; PINP 100 μg/l u mužů i žen) a pro firmu IDS: základní referenční mez ( CTX-I 50–670 ng/l u žen, 90–780 ng/l u mužů; PINP 20–75 μg/l u žen, 20–80 μg/l u mužů), horní patologická mez (CTX-I 1 050 ng/l u žen, 850 ng/l u mužů; PINP 100 μg/l u mužů i žen). Pro monitorování terapie je definována změna sérových hodnot CTX-I a PINP o 25 % jako LSC (Least Significant Change/nejmenší signifikantní změna) nebo v absolutní hodnotě, to znamená změnu sérových hodnot CTX-I o 100 ng/l a u PINP o 10 μg/l.
Klíčová slova:
CTX-I – doporučení – klinické využití – kostní markery –osteoporóza – PINP
Úvod
Osteoporóza je pomalu se vyvíjející onemocnění, které řadu let probíhá skrytě bez příznaků. Při osteoporóze dochází k postupnému úbytku kostní hmoty a ke zhoršení mikroarchitektury a kvality kosti. Výsledkem je zvýšená kostní lomivost a vyšší riziko vzniku zlomenin. Typickým a často prvním klinickým příznakem je až osteoporotická zlomenina [1]. Ve věku 50 let má každá druhá žena (46 %) a každý pátý muž (22 %) riziko, že v průběhu svého života prodělají osteoporotickou zlomeninu. V České republice se v roce 2010 odhadovalo, že osteoporózou trpí 426 000 žen a 103 000 mužů. Zároveň se předpokládá, že v České republice dojde v letech 2010–2025 k nárůstu osteoporotických zlomenin o 27 % [2]. To dopovídá i nárůstu incidence zlomenin proximálního femoru v České republice mezi roky 1981–2009. V hodnoceném období došlo k nárůstu o přibližně 260 % u žen a o 210 % u mužů [3].
V bezpříznakovém období je diagnostika osteoporózy založena na měření kostní denzity (Bone Mineral Density – BMD) a zhodnocení rizikových faktorů. Jedním z rizikových faktorů osteoporotických zlomenin jsou i zvýšené koncentrace vybraných markerů kostního obratu (Bone Turnover Markers – BTM) [1,4]. Daleko významnější roli má stanovení markerů kostního obratu při sledování efektu terapie osteoporózy [5].
V této publikaci lze nalézt přehled možností využití BTM a jejich limitací v oblasti diagnostiky a léčby osteoporózy.
Kostní obrat
Kostní obrat je souhrnná aktivita dvou protichůdných procesů. Prvním je kostní resorpce reprezentovaná aktivitou osteoklastů a druhým kostní novotvorba reprezentovaná aktivitou osteoblastů. Pokud obě tyto aktivity probíhají propojeně v čase i místě, mluvíme o kostní remodelaci. Kostní remodelace je zodpovědná za obnovu staré či poškozené kostní hmoty, za uvolnění v kostní hmotě uložených růstových faktorů a podílí se na udržení kalciofosfátové homeostázy a acidobazické rovnováhy [6]. Remodelace probíhá lokálně v kostních mnohobuněčných remodelačních jednotkách (BMU – Bone Multicellular Unit nebo BRC – Bone Remodeling Compartment). V trámčité kosti je BMU lokalizována na povrchu kosti, krytá klenbou mezenchymálních buněk (tzv. bone lining cells – BLC). Je tvořena specializovanými kostními buňkami osteoklasty, osteoblasty, osteocyty v kostní matrix, kostními povrchovými buňkami (bone lining cells), které ohraničují prostor BMU a dále endoteliálními buňkami, které tvoří kapiláry zajišťující prokrvení BMU (obr. 1).
Obr. 1. Bone remodeling compartment v trámčité kosti. Upraveno podle [7] ![Bone remodeling compartment v trámčité kosti. Upraveno podle [7]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/e65249c5ba4f204b3a9ed1bbdcf38422.png)
BLC – bone lining cell BRC – bone remodeling compartment v trámčité kosti, mnohobuněčná jednotka krytá krycí klenbou z bone lining cells HSC – hematopoetická kmenová buňka MSC – mezenchymální kmenová buňka V kortikální kosti formuje BMU tzv. „řezný kužel (cutting cone)“ s osteoklasty v čele, které následují osteoblasty s centrální kapilárou a nervovým zakončením a navazující pojivovou tkání (obr. 2) [7].
Obr. 2. Bone remodeling compartment v kortikální kosti. Upraveno podle [7] ![Bone remodeling compartment v kortikální kosti. Upraveno podle [7]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/b3e44ef9cea34bc74cf5c520c2c10ee1.png)
BRC – bone remodeling compartment v trámčité kosti, mnohobuněčná jednotka krytá krycí klenbou z bone linning cells HSC – hematopoetická kmenová buňka MSC – mezenchymální kmenová buňka U zdravého dospělého je aktivováno 3–4 milióny BMU každý rok, z čehož 1 milión je právě aktivní. Délka celého procesu kostní remodelace se liší podle oblasti skeletu, ve kterém probíhá. Průměrná délka přestavby spongiózní kosti činí asi 200 dní, přičemž většina (přibližně 150 dní) připadá na osteoblastickou kostní novotvorbu. Proces osteoresorpce trvá 2–3 týdny a novotvorby 5–6 měsíců (včetně mineralizace nově vytvořeného osteoidu). Proces se v daném místě opakuje za 2–5 let, frekvence je však rozdílná podle typu kostní tkáně, lokality a zátěže. Průměrně se ročně obnoví asi 10 % skeletu, ale i obnova se liší dle typu kostní hmoty. U kortikální kosti, která reprezentuje 75 % kostní hmoty, se obnoví pouze asi 4 %, ale u trabekulární kosti reprezentující 25 % kostní hmoty se obnoví 28 % kostní hmoty ročně [7,8].
Dalším procesem je kostní modelace. Kostní modelace je proces tvarování kosti a změny jejího tvaru a růstu. Je dominantním procesem prvních 20 let života. V menší míře přetrvává i v dospělosti, v níž je zodpovědná za tvarovou adaptaci kosti na zátěž. Při modelaci není novotvorba místně a časově spřažena s resorpcí. Novotvorba probíhá typicky na periostálním povrchu, zatímco resorpce probíhá na endokortikálním povrchu [6,7].
Markery kostního obratu (Bone Turnover Makers)
Markery kostního obratu (BTM) jsou definovány jako molekuly měřené v krvi nebo moči, které odráží metabolickou aktivitu kostní hmoty a kostních buněk, ale samy nemají žádnou funkci v regulaci kostního obratu [9]. Tak jako je kostní obrat složen z procesů kostní resorpce a novotvorby, stejně tak rozlišujeme markery kostní resorpce a markery kostní novotvorby. V roce 2010 International Osteoporosis Foundation a International Federation of Clinical Chemistry and Laboratory Medicine doporučila sérové markery PINP (N-terminální propeptid prokolagenu typu I) a CTX-I (C-terminální příčně vázaný telopeptid kolagenu typu 1) jako referenční markery klinických studií, a tedy i pro klinickou praxi u osteoporózy (tab. 1) [9]. Stejně tak učinila i National Bone Health Alliance v roce 2012 [10]. Stanovení BTM v séru nebo plazmě je preferováno oproti stanovení v moči z důvodu vysoké variability BTM v moči. Navíc BTM v moči by měly být korigovány na kreatinin, jehož exkrece však klesá s věkem a s úbytkem svalové hmoty. Korekce na glomerulární filtraci vyžaduje 24 hodinový sběr v moči a vše výše uvedené způsobuje sníženou praktickou využitelnost stanovení BTM v moči [11].
Tab. 1. Názvy a zkratky markerů kostního obratu. Upraveno podle [9] ![Názvy a zkratky markerů kostního obratu. Upraveno podle [9]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/fecab9d3720a7ea07e96d98607841956.png)
*markery doporučené International Osteoporosis Foundation a International Federation of Clinical Chemistry jako referenční markery kostní novotvorby a resorpce Stanovení BTM velmi slabě (r = 0,21; -0,36) korelují s histomorfometrickým měřením. Zde je nutné si uvědomit, že sérové koncentrace BTM reprezentují celkovou aktivitu BMU v celém skeletu, zatímco histomorfometrické parametry reprezentují pouze malou část kostní hmoty (biopsie malého vzorku tkáně nejčastěji z lopaty kyčelní), přičemž míra kostního obratu se místně může lišit. Kostní biopsie jako „zlatý standard“ je invazivní, obtížně opakovatelná a nákladná [11–12].
Stanoviska o použití PINP a CTX-I jako referenčních parametrů kostní novotvorby a resorpce byla znovu potvrzena stanovisky pracovní skupiny pro standardizaci kostních markerů IFCC-IOF [4]principally in regard to the relationship between BTM and incident fractures. Important data are now available on reference interval values for CTX and PINP across a range of geographic regions and for individual clinical assays. An apparent lack of comparability between current clinical assays for CTX has become evident indicating the possible limitations of combining such data for meta-analyses. Harmonization of units for reporting serum/plasma CTX (ng/L a National Bone Health Alliace (USA) [13] včetně jednotek.
Doporučení SMOS a ČSKB ČLS JEP č. 1:
Užívat PINP a CTX-I jako základní markery kostní novotvorby a resorpce.
Doporučení SMOS a ČSKB ČLS JEP č.2:
Z důvodu harmonizace jednotek je doporučeno vyjadřovat CTX-I v jednotkách ng/l a PINP v jednotkách μg/l.
Markery kostní novotvorby
PINP a PICP odráží míru syntézy kolagenu s maximem v proliferativní fázi osteoblastů, zatímco maximální aktivita bALP je v období vyzrávání bílkovinné matrix a produkce osteokalcinu během mineralizace [12].
PINP (N-terminální propeptid prokolagenu typu 1/Procollagen type I N-terminal Propeptide)
PICP (C-terminální propeptid prokolagenu typu 1/Procollagen type I C-terminal Propeptide)
Kolagen typu 1 představuje 90 % proteinové složky kosti (osteoidu). Prokolagen je syntetizován jako trimer složený ze dvou α1 a jednoho α2 řetězce [11]. Vytvoření finálního vlákna kolagenu vyžaduje odštěpení C-terminálního propeptidu (PICP) a N-terminálního propeptidu (PINP), které jsou následně uvolněny do cirkulace a mohou být detekovány v séru. Kolagen typu 1 je však kromě kosti syntetizován i v jiných tkáních, jako jsou kůže a šlachy, a PINP a PICP tedy nejsou stoprocentně specifické pro kost. Kolagen typu 1 z kosti představuje největší podíl cirkulujících PINP a PICP s výjimkou onemocnění s vysokým metabolickým obratem v tkáních obsahujících kolagen typu 1 [14]. V cirkulaci lze detekovat 2 formy PINP. Trimer PINP (intaktní PINP) a monomerické formy PINP. Trimery jsou vychytávány a degradovány v játrech (aktivní fibróza jater ovlivňuje jejich sérové hodnoty), zatímco monomery jsou vylučovány ledvinami [11]. Automatizované imunoanalytické metody k měření PINP jsou od firmy Roche a firmy IDS. Roche Cobas detekuje jak trimer, tak monomer. Jedná se tedy o stanovení celkové koncentrace PINP v séru (PINP total). Hodnoty PINP firmy Roche jsou tak ovlivněny renální insuficiencí, a to od hodnot eGFR < 0,5 ml.s-1.1,73 m-2 [15]. Naproti tomu imunoanalytické stanovení PINP firmy IDS iSYS stanovuje pouze trimer, a jedná se tedy o stanovení PINP intaktní formy (PINP intact). Vzhledem k minimálnímu ovlivnění hodnot sníženou renální funkcí je tato metoda spolu manuálním stanovením PINP Orion Diagnostika doporučena u pacientů s chronickým renálním selháním [4]. Výsledky rozdílných metod jsou mezi sebou nepřenositelné.
Osteokalcin
Osteokalcin (OC) je hlavním nekolagenním proteinem bílkovinné matrice kosti. Po vlastní syntéze prochází posttranslační γ-karboxylací, která závisí na vitaminu K. Tato forma má 3 zbytky kyseliny γ-glutamové a nazývá se karboxylovaný osteokalcin. Ten má silnou afinitu k hydroxyapatitu kostní tkáně a je na něj navázán. Původní význam pro mineralizaci se nepotvrdil. [16], ale OC kontroluje tvar a rozměry krystalů [17]. Při kostní resorpci je osteokalcin dekarboxylován a uvolněn do cirkulace. Dekarboxylovaný osteokalcin (UnOC) má zřejmě několik endokrinních funkcí. V posledních letech probíhá intenzivní výzkum o významu UnOC v oblasti kognitivních funkcí, při svalové adaptaci na fyzickou aktivitu a v endokrinním systému (sekrece inzulinu, zvýšení citlivosti k inzulinu a sekrece testosteronu) [16,18,19]. V cirkulaci lze detektovat jak karboxylovanou (kostní novotvorba), tak nedostatečně karboxylovanou formu. Navíc v séru cirkuluje také N-terminální-mid fragment osteokalcinu (zbytek 1.–43. aminokyseliny) [11]. Z výše uvedeného vyplývá, že naměřené hodnoty celkového osteokalcinu (karboxylované i dekarboxylované formy) jsou spíš markerem celkového kostního obratu než jen novotvorby.
Kostní alkalická fosfatáza
Prvním identifikovaným sérovým kostním markerem byla v roce 1923 kostní alkalická fosfatáza (bALP) [20]. Tento enzym je přítomen ve všech tkáních a katalyzuje hydrolýzu monoesterů fosfátů. Má řadu izoenzymů v závislosti na místě tkáňové exprese (střevní, placentární, zárodečných buněk, jaterní, ledvinou a kostní) [21]. Kostní izoenzym je klíčový pro kostní mineralizaci. Za fyziologického stavu představuje přibližně 50 % celkové sérové aktivity ALP. Na membráně osteoblastů hydrolyzuje difosfát na anorganický fosfát, který se slučuje s ionty vápníku a hořčíku a tvoří hydroxyapatit. Deficit ALP je spojen s genetickou poruchou hypofosfatázií [22]. Naopak izolovaně zvýšené hodnoty ALP lze pozorovat u Pagetovy choroby a měření ALP nebo bALP se užívá ke sledování efektu terapie. [23]. Díky minimálnímu ovlivnění renálními funkcemi je kostní frakce ALP vhodným markerem u pacientů s chronickým renálním selháním (CKD-MBD) [24].
Markery kostní resorpce
Jsou to produkty aktivity osteoklastů. CTX-I, NTX-I vznikají katalytickou degradací kolagenu katepsinem K, zatímco ICTP vzniká degradací kolagenu aktivitou matrixových metaloproteináz [11]. Tartarát rezistentní kyselá fosfatáza (TRAP 5b) je enzym, který se vyskytuje v lyzosomech. Zatímco hodnoty CTX-I a NTX-I odráží resorpční aktivitu osteoklastů, hodnoty TRAP5b spíše reflektují jejich počet [12].
C-terminální příčně vázaný telopeptid kolagenu typu 1 (CTX-I) a N-terminální příčně vázaný telopeptid kolagenu typu 1 (NTX-I)
Vznikají a jsou uvolňovány do cirkulace během kostní resorpce osteoklasty. Jedná se o C - a N-terminální fragmenty kolagenu obsahující propojovací regiony (crosslinks – deoxypyridinolin a pyridinolin). V séru dochází k spontánní izomerizaci z α - na β-formu, a proto je někdy užíván termín β-CTX, β-Crosslaps. Tyto fragmenty mohou být stanoveny jak v séru, tak v moči, mají významnou cirkadiánní variabilitu a jejich sérové koncentrace významně klesají po jídle. V séru jsou finálně degradovány na malé fragmenty jako pyridinolin, deoxypyridinolin a hydroxyprolin, které jsou vyloučeny močí [11,14].
ICTP
ICTP (C-telopeptid kolagenu typu 1/cross-linked telopeptide of type I collagen) je produktem nefyziologické degradace kolagenu typu 1 pomocí matrixových metaloproteináz (MMP1, 2, 13, 14) [25]. Proto je často využíván jako marker degradace kosti u kostních metastáz a myelomu [11,26,27].
TRAP5b
Tartarát rezistentní kyselá fosfatáza je syntetizována v kostech, slezině a plicích. Její izoenzym 5b je specifický pro osteoklasty a koreluje s jejich počtem více, než s jejich aktivitou [28]. TRAP5b je nestabilní při pokojové teplotě (max. 8 hodin), v séru při +4 °C 48 hodin a 1 měsíc při -20 °C, její aktivita se snižuje dlouhodobým zmrazením (stabilní 2 roky při -80 °C), hemolýza stanovení významně neovlivňuje [11,29,30]. Koncentrace nejsou ovlivněny renálními funkcemi, proto lze TRAP5b využít jako marker kostní resorpce u pacientů s chronickým renálním selháním [31]. Rovněž je spolu s ICTP využitelný v časné detekci kostních metastáz [32,33].
DPD
Deoxypyridinolin (DPD) je spolu pyridinolinem (PYR) produktem degradace kolagenu I, II a III, ale v kostním kolagenu je více DPD, než PYR. Výhodou odběru vzorku je stanovení v moči, což je kompenzováno větší variabilitou výsledků [14]. Je méně specifický než CTX-I a NTX-I [34]. Vzhledem ke snazšímu odběru vzorku by mohl mít význam v případech, v nichž je vyžadován opakovaný odběr vzorku v krátkém intervalu a u dětí. V současnosti je jeho stanovení obsolentní.
Preanalytická fáze stanovení u doporučených markerů CTX-I a PINP
Preanalytická fáze významně ovlivňuje kvalitu stanovení a interpretaci výsledků CTX-I a PINP. Velmi důležitá je volba odběrové soupravy, aditiva a skladování vzorků do analýzy.
Odběr a skladování vzorku
CTX-I má vyšší stabilitu v EDTA plazmě (24 hodin při pokojové teplotě, 2–8 dní při teplotě 2–8 °C) než v séru (8 hodin při teplotě 4 °C). PINP je mnohem stabilnější než CTX-I (při pokojové teplotě 24 hodin, při teplotě 2–8 °C 5 dní, a to jak v séru, tak v EDTA-plazmě). Dlouhodobě lze vzorky skladovat při teplotě -20 °C, a to 3 měsíce CTX-I a 6 měsíců PINP. V případě potřeby skladovat vzorky po delší dobu (3 roky) je nutné je zmrazit na teplotu -70 °C. Problém je ale u intaktního PINP, u kterého dlouhodobým skladováním dochází k nárůstu hodnot až o desítky procent. Vzorky na stanovení CTX-I a PINP je možné rozmrazit až 2krát [13,35].
Ovlivnitelné a neovlivnitelné faktory
Preanalytické faktory rozdělit na ovlivnitelné, neovlivnitelné a asociované s chorobnými stavy nebo léčbou viz tab. 2, tab. 3 a tab. 4 [11–14].
Tab. 3. Neovlivnitelné faktory 
Tab. 4. Ovlivnění kostního obratu klinickým stavem 
Faktory asociované s chorobnými stavy
V tab. 4 a tab. 5 jsou uvedeny faktory asociované s chorobnými stavy nebo léčbou. Obecně lze říci, že rozdílnou mírou jsou markery kostního obratu skoro vždy ovlivněny u onemocnění spojených se sekundární osteoporózou, a to v závislosti na stadiu a aktivitě onemocnění, typu a dávce léčby.
Tab. 5. Ovlivnění kostního obratu léky 
Po prodělané zlomenině přetrvává zvýšený kostní obrat až 12 měsíců, více je zvýšena novotvorba [36].
Chronická renální insuficience může mít jak zvýšený, tak normální nebo snížený kostní obrat v závislosti na typu kostní renální poruchy (CTX-I i PINP total se v séru významně kumulují) [15,37].
Harmonizace a preciznost měření BMT
Harmonizace CTX-I a PINP očima studií referenčních intervalů
Harmonizace výsledků měření má zcela zásadní význam pro jejich klinickou interpretaci, pro srovnatelnost s jinými metodami a k záruce její nezávislosti na použité měřící platformě, metodě měření a laboratoři, ve které se měření provádí (ICHCRL AACC, IFCC). Zásadní podmínkou harmonizovaných výsledků je standardizace metody a metrologická návaznost kalibrace na certifikovaný referenční materiál. Pokud tyto podmínky nejsou splněny, lze harmonizace výsledků dosáhnout pouze použitím stejné metody v různých laboratořích. Shrneme-li situaci, nezbývá než konstatovat, že vlivem nedostatku harmonizace nejsou k dispozici ani obecné referenční intervaly obou doporučených markerů [38,39]. Harmonizace u CTX-I a PINP proběhla v Austrálii v roce 2014 stanovením hodnot populačních referenčních intervalů pomocí diagnostik Roche. Zásadní východiska této požadované harmonizace, která mají být respektována ještě před laboratorním měřením, jsou dva:
omezení preanalytických vlivů snížením dávek jídla před odběrem a respektování diurnálních variací pomocí ranního odběru nalačno
důsledné používání harmonizovaných jednotek měření, ng/l u CTX-I a µg/L u PINP a jejich vyžadování v programech Externího hodnocení kvality (EHK)
Ovlivnění výsledků CTX-I použitou metodou měření je významně vyšší než u PINP [38,39]. Z několika dalších studií referenčních intervalů [40,41], plyne, že diference mezi testovacími soupravami u CTX-I běžně dosahují hodnot až 30 %, zatímco u PINP jsou jejich hodnoty minimální.
Mezilaboratorní srovnatelnost CTX-I a PINP očima dat programů externího hodnocení kvality
Z dat uvedených v tab. 6 a tab. 7 je zřejmá solidní analytická spolehlivost měření v jednotlivých laboratořích, stabilní v čase (5 let), ale zároveň i nutnost maximální metodické unifikace, aby bylo dosaženo také solidní mezilaboratorní reprodukovatelnosti. Z dat obou tabulek výsledků programů EHK (SEKK a RfB Německo) je závislost míry ovlivnění výsledků použitou metodou dobře patrná. Stejně zřetelně je vidět již uvedená vyšší závislost CTX-I a malá závislost PINP na použité metodě.
Tab. 6. Mezilaboratorní reprodukovatelnost měření CTX-I a PINP ve dvou programech EHK akreditovaných podle normy ISO 17043 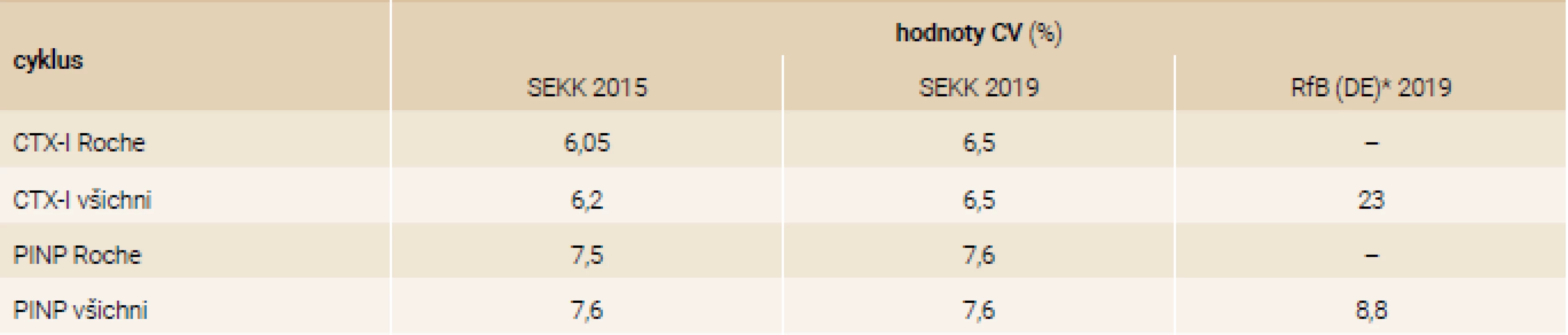
*Referenzinstitut für Bioanalytik, Bonn, Německo (DE) Tab. 7. Homogenita měřících systémů použitých v programu EHK 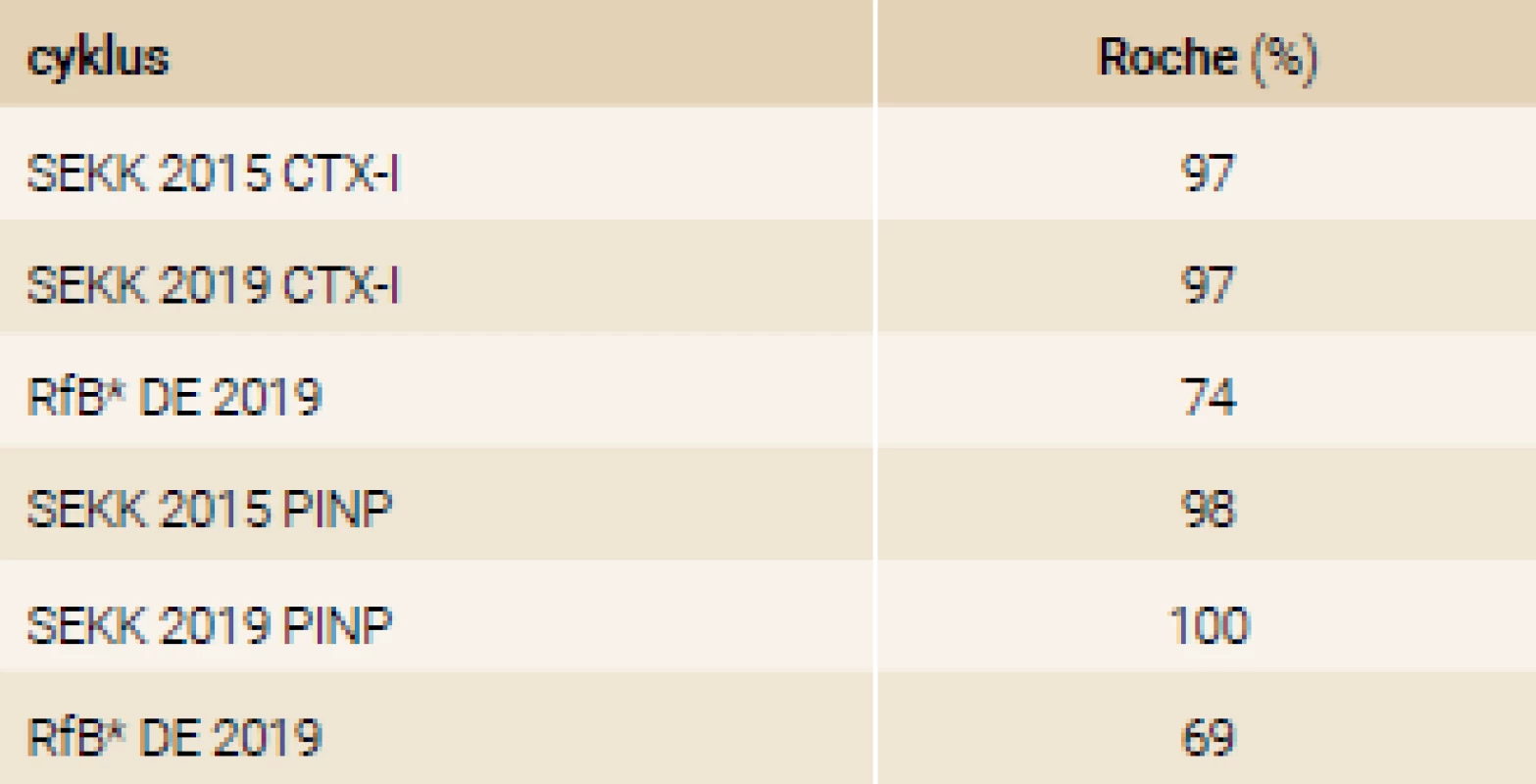
*Referenzinstitut für Bioanalytik, Bonn, Německo (DE) DOPORUČENÍ SMOS a ČSKB ČLS JEP č. 3:
Opatření k minimalizaci variability stanovení PINP a CTX-I
- Odběr vzorku provádět po nočním lačnění a zajistit, aby pacient nebyl vystaven 24 hodin před odběrem enormní fyzické zátěži (u PINP – lačnění není třeba)
- Vzorky odebírat vždy dopoledne mezi 7.-10. hodinou
- Akceptovatelné jsou jak sérum, tak EDTA-plazma. EDTA-plazma je vhodnější, když není možno CTX-I zpracovat do 8 hodin od odběru
- Optimální doba separace krvinek od plazmy nebo séra je do 2 hodin od odběru
- PINP není vhodným parametrem při léčbě kortikoidy podávanými intravenózně anebo perorálně kromě monitorace efektu anabolické terapie
- Pokud nejsou vzorky zpracovány v den odběru, je možné je zmrazit a ideálně analyzovat posléze najednou s použitím jedné šarže diagnostické soupravy, a to především v klinických studiích
Samotné zhodnocení výsledku by mělo probíhat v kontextu s účelem, dále se znalostí klinického stavu, komorbidit a aktuální terapie.
Referenční meze
Referenční meze jsou základním nástrojem v hodnocení výsledků. V případě kostních markerů je třeba v jejich hodnocení brát v úvahu účel, aktuální klinický stav a medikaci.
Dětská populace
I když využití markerů kostního obratu v dětské populaci není předmětem této publikace, je nutné si uvědomit, že u dětí a adolescentů referenční meze vykazují významnou závislost na věku, pohlaví stadiu puberty, růstu a metabolizmu a také zároveň na hladinách vitaminu D [42]. Jejich hodnocení tedy patří do rukou zkušených odborníků na kostní metabolizmus u dětí. Pro českou populaci (1–18 let, n = 439) jsou dostupná referenční rozmezí pro PINP a osteokalcin [43]. Pro CTX-I a evropskou kohortu existují data (n = 1 946) v korelaci na výšku a věkové rozmezí 3,5–8,5 roku [44]. Dále existují data z německé kohorty (2 měsíce-18 let, n = 572) v korelaci s věkem, výškou, hmotností a stadiem puberty pro CTX-I, osteokalcin, BALP, ICTP a TRAP5b [45] a z kanadské kohorty (6–18 let, n = 356) pro CTX-I, PINP, osteokalcin, ALP a BALP v korelaci s BMI, vitaminem D a PTH [42].
Dospělá populace
I u této populace jsou hodnoty kostních markerů závislé na pohlaví a věku jak u žen, tak i u mužů. Optimálním věkem pro stanovení referenčních mezí u žen je 30–45 let [4]. Důvodem je ukončení růstového období a zachovaná hormonální stimulace kosti. Ze stejných důvodů je u mužů optimální období pro stanovení referenčních mezí 35–50 let (pozdější ukončení růstu).
V posledních letech bylo publikováno několik kohort s problematikou referenčních rozmezí. Rozdíly v jednotlivých kohortách u premenopauzálních žen shrnuje tab. 8.
Tab. 8. Rozpětí referenčních mezí u premenopauzálních žen z jednotlivých studií 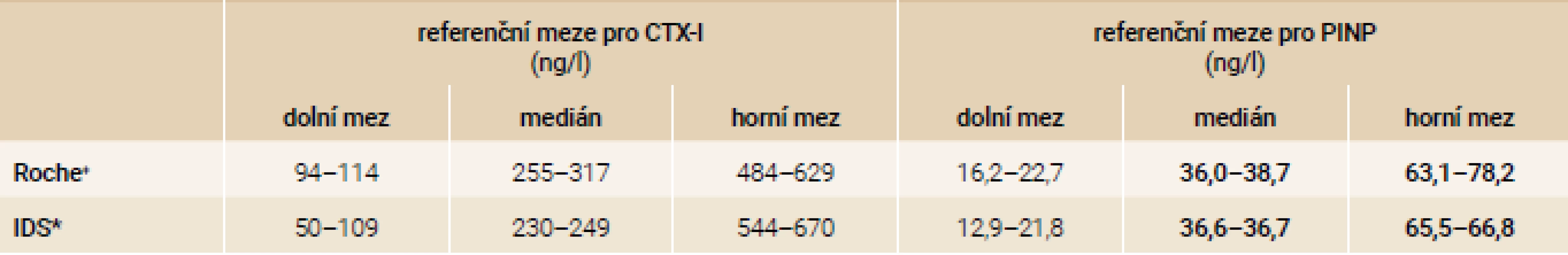
+[38,41,46–49] *[40,41,50] U dvou nejčastěji užívaných automatických analytických systémů firem Roche (Cobas) a IDS (iSYS) lze konstatovat, že referenční hodnoty se u žen prakticky neliší u PINP(pokud mají normální renální funkce), ale liší se u CTX-I. Rozdíly jsou dány mírně odlišnými věkovými skupinami a exclusion kritérii v jednotlivých kohortách [4].
Hodnoty kostních markerů jsou i u zdravých postmenopauzálních žen vyšší, než u premenopauzálních. Referenční meze postmenopauzálních žen Cobas, Roche [49] a iSYS, IDS [40], viz tab. 9.
Tab. 9. Rozpětí referenčních mezí u postmenopauzálních žen 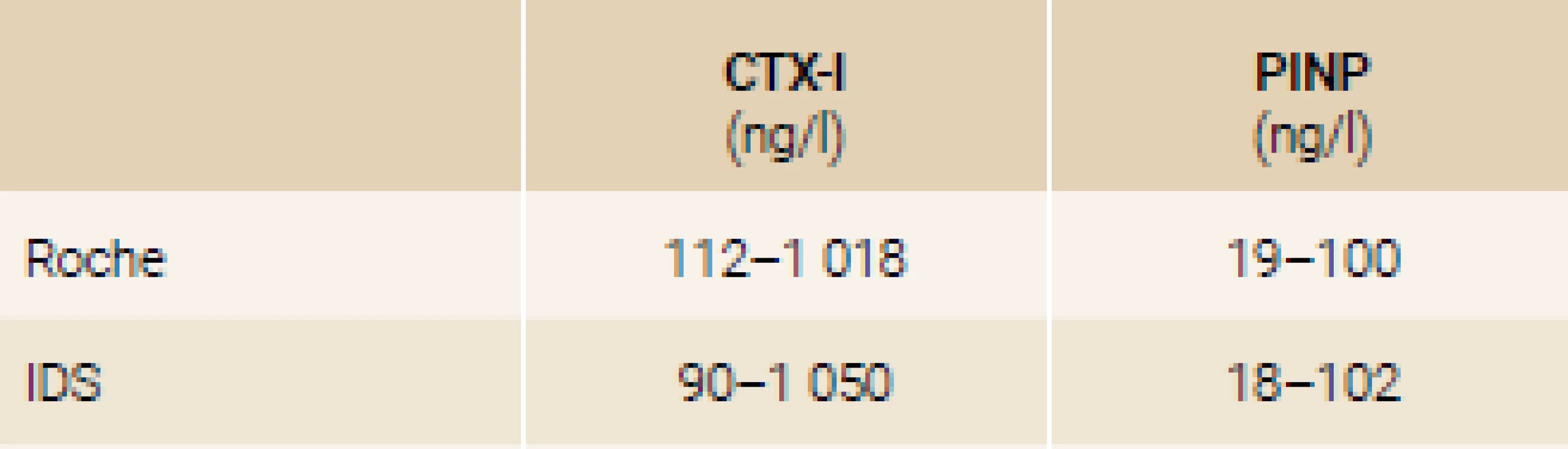
Tab. 10 a tab. 11 shrnují referenční meze u imunoanalytického systému Roche (Cobas).
Tab. 10. CTX- I (ng/l), Roche Elecsys. Upraveno podle [51] ![CTX- I (ng/l), Roche Elecsys. Upraveno podle [51]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/1e84bfdfed5352c5172a63a2583efb6e.png)
Tab. 11. PINP (μg/l), Roche Elecsys. Upraveno podle [52,53] ![PINP (μg/l), Roche Elecsys. Upraveno podle [52,53]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/be716c0039b2619ae9d0fce96f44ce7d.png)
n – nestanoveno Stejně tak, jako je méně častá osteoporóza u mužů, je i méně publikací věnovaných referenčním mezím u mužů [39,40,54].
Ve studii Olmose a kol. [54] byly zjištěny referenční meze u mužů 17–71 µg/l pro PINP a 70–681 ng/l pro CTX-I (muži > 50 let, 25-OH D > 75 nmol/l, BMD T-skóre > -2,5 SD a PTH < 6,85 pmol/l). Medián PINP byl 33,2 µg/l a medián CTX-I byl 270 ng/l.
V tab. 12 a tab. 13 jsou shrnuty referenční rozmezí u mužů pro imunoanalytický systém firmy IDS (iSYS).
Tab. 12. CTX- I (ng/l), iSYS IDS. Upraveno podle [40] ![CTX- I (ng/l), iSYS IDS. Upraveno podle [40]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/13984bf9911920ae4e61e2dfba07b110.png)
Tab. 13. PINP (μg/l), iSYS IDS. Upraveno podle [40] ![PINP (μg/l), iSYS IDS. Upraveno podle [40]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/a5da25519bbdeea1e9df727bf21dbe5e.png)
Nastavení referenčních mezí a cílových hodnot pro léčbu osteoporózy
Premenopauzální referenční hodnoty u žen a u mužů mezi 30.–50. rokem věku odpovídají období vyrovnané kostní remodelace. Jejich využití jako základních referenčních mezí má 2 důvody:
hodnocení abnormalit kostního obratu v premenopauzálním období u žen a v příslušné věkové kategorii u mužů
cílové hodnoty pro léčbu postmenopauzální osteoporózy a osteoporózy u mužů
Horní referenční meze u postmenopauzálních žen a starších mužů jsou nápomocné v případě, jestliže hodnotíme pravděpodobnost abnormálního kostního obratu (sekundární osteoporózy, nebo jiné sekundární příčiny) u osob příslušného věku a pohlaví. Hodnoty nad horní referenční mezí upozorňují na možnou sekundární příčinu.
U žen je tedy vhodné nastavit premenopauzální hodnoty jako základní a horní referenční mez postmenopauzálních hodnot jako významně patologickou mez. Tím se omezí chybná interpretace při neznalosti menopauzálního statutu vyšetřované ženy a i případné hormonální substituce.
U mužů lze akceptovat hodnoty mezi 30.–50. rokem věku jako základní referenční rozmezí, nebo hodnoty u mužů nad 50 let za předpokladu BMD mimo pásmo osteoporózy, dostatečné substituce vitaminem D a absence sekundární hyperparatyreózy.
Fyziologicky u mužů kostní obrat s věkem klesá a je nižší, než u postmenopauzálních žen. Proto významně patologická mez by měla být definovaná jako významně se lišící se od horní referenční meze, ale nižší, než u žen.
Hodnoty mediánu lze užít jako cílové hodnoty, která prokazuje dobrý efekt antiresorpční léčby a dobrou komplianci s léčbou. Hodnoty kostního obratu pod mediánem základního referenčního rozmezí jsou spojeny s nejnižším rizikem vzniku osteoporotických zlomenin [5] a největším efektem antiresorpční léčby [55].
V České republice se majoritně využívá stanovení CTX-I a PINP na automatických imunoanalyzátorech firmy Roche. Jak je ukázáno v přechozích tabulkách referenční meze jsou u kostních markerů především závislé na definování referenční populace (věk, komorbidity, stav zásobení vitaminem D, BMD, hodnoty PTH, užívání kontracepce atd).
DOPORUČENÍ SMOS a ČSKB ČLS JEP č 4:
Doporučení k nastavení referenčních mezí pro CTX-I a PINP
- Cílem je sjednocení interpretace výsledků CTX-I a PINP v rámci ČR
- U žen je tedy vhodné nastavit premenopauzální hodnoty jako základní a horní referenční mez postmenopauzálních hodnot jako významně patologickou mez
- U mužů lze akceptovat hodnoty mezi 30.–50. rokem věku jako základní referenční rozmezí
Doporučené nastavení referenčních mezí je navrženo pro imunoanalytické systémy firmy Roche v tab. 14 a IDS v tab. 15. Tyto meze jsou konsenzuální na základě dat uvedených v tab. 8–13.
Tab. 14. Harmonizované konsenzuální referenční meze pro klinické využití CTX-I a PINP v České republice pro imunoanalytický systém firmy Roche 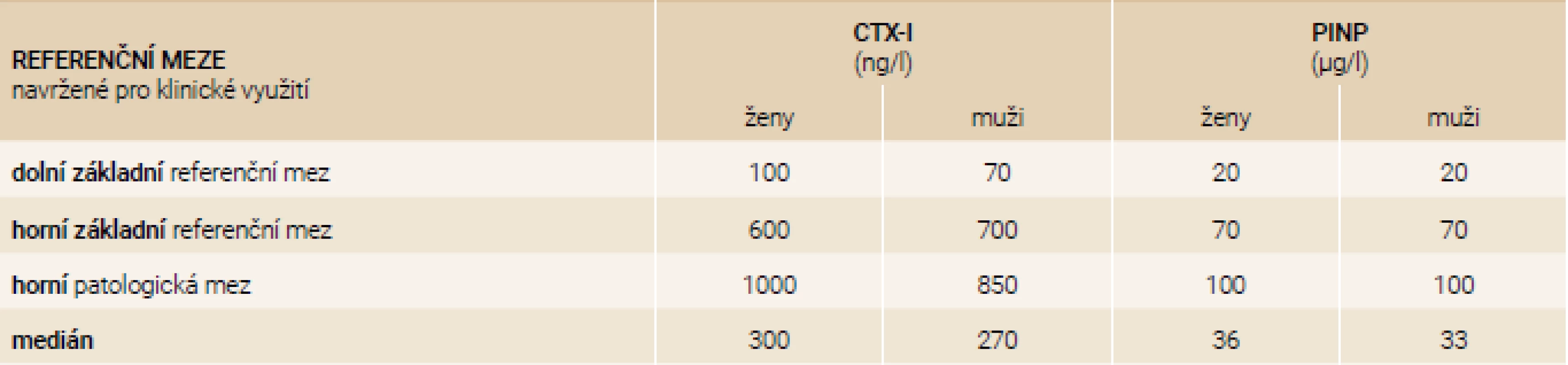
Tab. 15. Harmonizované konsenzuální referenční meze pro klinické využití CTX-I a PINP v České republice pro imunoanalytický systém firmy IDS 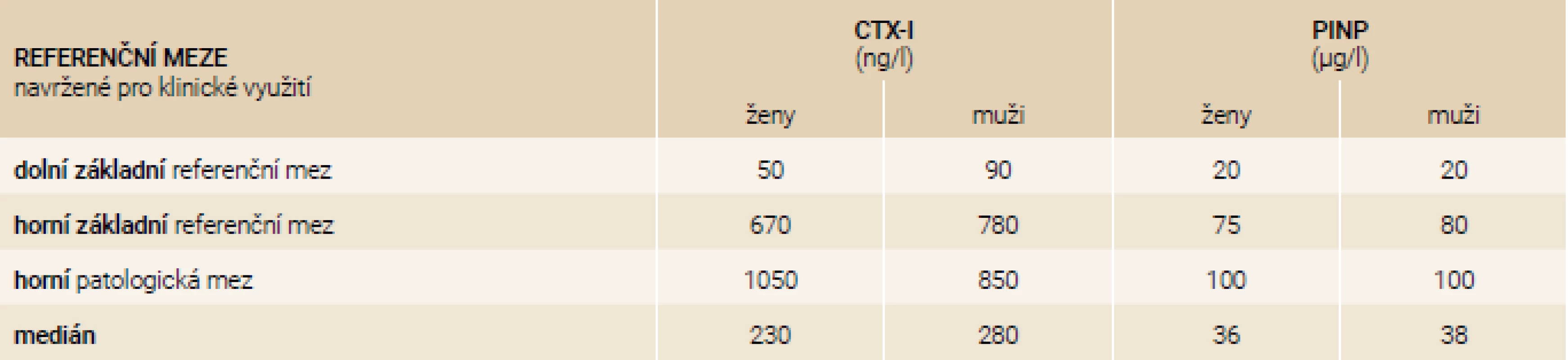
Využití kostních markerů v klinické praxi
Diagnóza osteoporózy je až do současnosti založena na splnění denzitometrického kritéria osteoporózy (T-skóre ≤ -2,5) a/nebo prodělání osteoporotické zlomeniny [56,57]. Kostní denzita velké části pacientů s „osteoporotickou“ zlomeninou je však mimo pásmo osteoporózy [58]. Byla identifikována řada rizikových faktorů, včetně nástrojů na kalkulaci rizika osteoporotické zlomeniny [59,60]. Zároveň byla kalkulace rizika zahrnuta v některých doporučeních do indikačních kritérií k léčbě [61].
Markery kostního obratu u osteologických pacientů mají následující význam [61,62]:
- predikují riziko zlomeniny nezávisle na BMD u neléčených pacientů
- predikují míru poklesu BMD u neléčených pacientů
- predikují efektivitu snížení rizika zlomeniny již 3–6 měsíců po zahájení léčby
- predikují míru nárůstu BMD u léčených pacientů
- pomáhají určit, zda pacienti užívají léčbu (kompliance a perzistence)
- pomáhají stanovit délku přerušení terapie
Význam BTM v diagnostice a v diferenciální diagnostice osteoporózy
Přestože markery kostního obratu pomáhají v pochopení celé řady patofyziologických procesů v kosti [63], nelze je využít k diagnostice osteoporózy. Na základě znalosti hodnoty kostního markeru nelze určit, zda se jedná o osteoporózu, či nikoliv. Rovněž tak limitovaný význam mají v diferenciální diagnostice, i když hodnoty zvýšené nad referenční mez příslušného věku a pohlaví, nebo naopak snížené u hypokortizolizmu a hypotyreóze, mohou upozornit na možnou sekundární etiologii osteoporózy [14]. Izolovaně zvýšené hodnoty ALP nebo bALP mohou pomoci diagnostikovat Pagetovu chorobu, nízké hodnoty naopak mohou svědčit pro hypofosfatázii. TRAP5b, bALP či intact PINP mohou mít význam v rozlišení histologických typů CKD-MBD [64]. Hlavní význam mají kostní markery především jako rizikový faktor zlomenin, mají prediktivní hodnotu změny BMD a jsou velmi cenné při kontrole efektu terapie.
Prediktivní hodnota BTM
Zvýšený kostní obrat (nad premenopauzální hodnoty) je u postmenopauzálních žen spojen se zvýšenou ztrátou kostní hmoty, především pokud je více zvýšena resorpce, než novotvorba [65–67]. Tato korelace je nejvýznamnější v časné postmenopauze, v porovnání s pozdějším obdobím (nad 70 let) nebo v premenopauzálním období [68]. BTM predikují i změnu BMD po zahájení antiresorpční terapie. Čím vyšší je hodnota kostního obratu, tím větší bude pravděpodobně nárůst BMD během terapie [69–70]. Tato data vycházejí z epidemiologických studií, tedy na individuální úrovni nemusí vždy odpovídat předpokladům z populačních studií. Zvýšené hodnoty BTM především predikují riziko osteoporotické zlomeniny a jsou považovány za nezávislý prediktivní faktor. Jak zvýšené hodnoty PINP, tak i CTX-I přibližně 1,2krát zvyšují, nezávisle na BMD, riziko osteoporotické zlomeniny, především proximálního femoru [71]. V příloze 1 je navržen algoritmus hodnocení vstupního vyšetření kostních markerů ve vztahu k diferenciální diagnostice osteoporózy a k jejich prediktivní hodnotě.
Příloha 1 | Algoritmus hodnocení vstupního vyšetření 
Poslední významnou prediktivní oblastí jsou nádorová onemocnění. Zvýšené hodnoty markerů kostní resorpce ICTP a CTX-I, případně TRAP5b reflektují změny v kostním metabolizmu, které jsou asociované s nádorovým onemocněním, respektive s postižením kostní tkáně nádorovým onemocněním. Dále predikují zvýšené riziko tzv. skeletal related events, progrese onemocnění, odpověď na léčbu a kratší dobu přežití u mnohočetného myelomu [26] a také solidních nádorů především plic, prsu a prostaty [27,33].
BTM a terapie
Logicky lze usuzovat, že při znalosti vstupních hodnot kostních markerů by bylo možné volit užití antiresorpčních léků (denosumab, bisfosfonáty, SERM) u vysokého kostního obratu, a naopak anabolických léků (teriparatid, abaloparatid) u nízkého kostního obratu. Tento přístup není u primární osteoporózy v současnosti doložen žádnými výsledky klinických studií [5].
Svůj význam však kostní markery prokázaly ve sledování efektu terapie. Neboť přestože je denzitometrie „zlatým standardem“ změny BMD jsou velmi malé. Významných změn (3–6 % u proximálního femoru a 2–4 % u lumbální páteře) dosahujeme většinou až po 2 letech terapie s výjimkou léčby teriparatidem a denosumabem [5,14,61]. Oproti tomu změny kostních markerů lze pozorovat již po několika dnech (denosumab, intravenózní bisfosfonáty), až 2–3 měsících (perorální bisfosfonáty, SERM) od zahájení terapie [13]. Bisfosfonáty a denosumab snižují kostní obrat o 40–85 %, nejvíce denosumab a kyselina zoledronová, zatímco SERM o 30–40 % [11]. K hodnocení významnosti změny hodnoty kostního markeru je třeba znát hodnotu minimální klinicky významné změny (LSC), která je u PINP a CTX-I 25 % [9]. V Sheffieldu převedli procentuální hodnoty do praktičtější absolutní hodnoty, tj. LSC pro PINP > 10 μg/l a LSC pro CTX-I > 100 ng/l. Pokud je léčba efektivní dojde ke změně větší než LSC. Protože nejnižší riziko zlomenin je při hodnotách kostních markerů pod mediánem referenčního rozmezí premenopauzálních žen a zároveň vstupní hodnoty se mohou mezi pacienty lišit až o desítky procent, je vhodné zhodnotit, zda kontrolní měření BTM vykazuje pokles pod hodnotou tohoto mediánu [5]. Tuto myšlenku podporuje i zjištění, že čím větší je pokles hodnot kostních markerů u antiresorpčních léků, tím větší je snížení rizika vertebrálních zlomenin [55]. V Příloze 2 je navržen algoritmus zhodnocení změn kostních markerů při monitoraci efektu terapie u antiresorpční léčby.
Příloha 2 | Algoritmus hodnocení vyšetření během antiresorpční terapie 
POZNÁMKA:
V případě potřeby časnější odběru markeru kostního obratu je nutné brát ohled na omezení frekvence úhrady u CTX-I (1krát za 6 měsíců) a PINP (1krát za 3 měsíce).
Odběr musí být proveden za standardních podmínek, viz preanalytická variabilita! (např. sladký čaj = pokles CTX-I až o 50 %).
U anabolické terapie dochází opačně ke zvýšení PINP již během několika dnů, zatímco kostní resorpce se zvyšuje méně a později s maximem do 3 do 6 měsíců. Tyto změny jsou pomalejší u pacientů předléčených alendronátem, než raloxifenem nebo risedronátem. Romosozumab indukuje zvýšení PINP během 14. dní doprovázené obdobným poklesem CTX-I. Následně dochází k mírnému vzestupu CTX-I, ale stále pod výchozí hodnotu. Obdobně dochází k poklesu PINP, ale hodnoty PINP zůstávají nad bazální hodnotou [11]. V příloze 3 je navržen algoritmus zhodnocení změn kostních markerů při monitoraci efektu terapie u anabolické léčby.
Příloha 3 | Algoritmus hodnocení vyšetření během anabolické terapie 
POZNÁMKA:
V případě odběru markeru kostního obratu za 3 měsíce od zahájení terapie, je nutné brát ohled na omezení frekvence úhrady u CTX-I (1krát za 6 měsíců) a PINP (1krát za 3 měsíce). Prakticky to může znamenat odběr po 3 měsících pouze PINP a po 6 měsících PINP a CTX-I.
Nárůst CTX-I bez vzestupu PINP by mohl znamenat i sekundární etiologii.
Doporučení SMOS a ČSKB ČLS JEP č. 5:
Definice LSC u CTX-I a PINP pro potřeby monitorování efektu léčby
Hodnota 25 % představuje LSC (minimální signifikantní změna) pro sérové hodnoty CTX-I a PINP nebo lze využít i absolutní změny sérových hodnot, tj. o 100 ng/l u CTX-I a o 10 μg/l u PINP.
Přerušení terapie
Přerušení léčby denosumabem je doprovázeno nárůstem kostního obratu již 3 měsíce po vynechání plánované dávky, s postupným nárůstem kostního obratu nad vstupní úroveň s vrcholem 12–18 měsíců po poslední dávce a následným poklesem. Zároveň dochází k poklesu kostní denzity k vstupním hodnotám. Tento „re-bound“ fenomén může být u některých pacientů doprovázen vznikem vertebrálních zlomenin v obdobné četnosti jako u neléčených. Ve větším riziku jsou pacienti s předchozí vertebrální zlomeninou [72].
Takový „re-bound“ fenomén nebyl popsán po léčbě bisfosfonáty. Proto ASBMR pracovní skupina doporučuje po 5leté léčbě perorálními a po 3leté léčbě intravenózními bisfosfonáty zhodnotit další pokračování v léčbě. U žen ve vysokém riziku (jako např. senioři, nízké T-skóre v proximálním femoru, předchozí významná osteoporotická zlomenina nebo vysoké riziko zlomenin) je vhodné pokračovat v léčbě u perorálně podávaných bisfosfonátů až 10 let a u intravenózně podávaných bisfosfonátů 6 let [73]. V období po přerušení léčby jsou pak kostní markery vhodným parametrem sledování změn kostního metabolizmu. Změna BTM predikuje změnu BMD po přerušení léčby především v oblasti proximálního femoru, výsledky BMD v oblasti lumbální páteře mohou být zkresleny degenerativními změnami [74,75]. Vzestup BTM o LSC nebo nad medián premenopauzálních hodnot by měl vést k posouzení opětovného zahájení léčby [5].
Ve studii TRIO porovnávající 3 perorální bisfosfonáty došlo během prvních 2 let léčby k odpovídajícímu poklesu BTM. Po následném přerušení terapie na dobu 2 let bylo možné sledovat postupný vzestup BTM většinou pod mediánem premenopauzálních hodnot a mírný, postupný pokles BMD v celkovém proximálním femoru k počátečním hodnotám. Míra poklesu BMD odpovídala míře vzestupu BTM, především CTX-I [74,75].
Analýza podskupin studie HORIZON prokázala obdobný, ale delší efekt u kyseliny zoledronové. Jedna dávka kyseliny zoledronové vedla k redukci rizika zlomenin po dobu 3 let [76]. Antiresorpční efekt kyseliny zoledronové na BMD a BTM přetrvává až 5 let [77]. V roce 2019 byla publikována studie sledování efektu přerušení léčby po 5 letech užívání alendronátu a 3 intravenózních dávkách kyseliny zoledronové ve studii FLEX a HORIZON-PFT Extension 1 [78]. Po přerušení byla zaznamenána stabilní BMD u kyseliny zoledronové po dobu 1,5 roku, a pak mírný pokles o 1,2 % za 3 roky po přerušení. U pacientů léčených alendronátem byl zřetelný pokles BMD již od počátku přerušení a po 3 letech byl větší (o 2,3 %) než u kyseliny zoledronové [78]. Tyto změny jsou stále v rámci běžné chyby měření denzitometru (2–4 % L páteř, 3–6 % HIP) [61]. PINP analyzované v této studii po 3 letech vzrostlo > 36 μg/l (medián premenopauzálních žen) u 42 % pacientek po léčbě alendronátem a pouze u 24,6 % pacientek po léčbě kyselinou zoledronovou [78]. V příloze 4 je navržen algoritmus zhodnocení změn kostních markerů při monitoraci efektu terapie u antiresorpční léčby [79].
Příloha 4 | Algoritmus hodnocení vyšetření při přerušení terapie 
Poděkování
Autoři děkují slečně Kateřině Škorvánkové za pomoc s překreslením obr. 1 a obr. 2 dle původního originálu se svolením autorů.
Autor a spoluautoři práce prohlašují, že v souvislosti se vznikem a publikací článku nejsou ve střetu zájmů a publikace nebyla podpořena žádnou farmaceutickou nebo diagnostickou firmou.
Hlavní autor Richard Pikner je honorovaný přednášející a člen poradního sboru společnosti Amgen Česká republika, honorovaný přednášející společností Takeda, Roche, DiaSorin, Abbott, Beckmann-Coulter
MUDr. Richard Pikner, Ph.D. | richard.pikner@klatovy.nemocnicepk.cz | www.klatovy.nemocnicepk.cz
First time published in | Poprvé uveřejněno v | Prvýkrát uverejnené v
Klin Biochem Metab 2020; 28(49), No. 2 : 48–63. Dostupné z WWW: <https://www.cskb.cz/wp-content/uploads/2020/07/KBM-2-20-dop-osteo-48.pdf>.
©2020 Společnost pro metabolická onemocnění skeletu ČLS JEP
©2020 Česká společnost klinické biochemie ČLS JEP
The article is published with the permission of the first author and the publisher | Článek je uveřejněn se souhlasem prvního autora a vydavatele
First time published in | Prvýkrát uverejnené v | Poprvé uveřejněno v
Klin Biochem Metab 2020; 28(49), No. 2 : 48–63. Dostupné z WWW: <https://www.cskb.cz/wp-content/uploads/2020/07/KBM-2-20-dop-osteo-48.pdf>.
©2020 Společnost pro metabolická onemocnění skeletu ČLS JEP
©2020 Česká společnost klinické biochemie ČLS JEP
The article is published with the permission of the first author and the publisher | Článek je uveřejněn se souhlasem prvního autora a vydavatele
Zdroje
Kanis JA, Cooper C, Rizzoli R et al. European guidance for the diagnosis and management of osteoporosis in postmenopausal women. Osteoporos Int 2019; 30(1): 3–44. Dostupné z DOI: <https://doi.org/10.1007/s00198–018–4704–5>.
Svedbom A, Hernlund E, Ivergård M et al. Osteoporosis in the European Union: a compendium of country-specific reports. Arch Osteoporos 2013; 8(1–2): 137. Dostupné z DOI: <https://doi.org/10.1007/s11657–013–0137–0>.
Stepan JJ, Vaculik J, Pavelka K et al. Hip Fracture Incidence from 1981 to 2009 in the Czech Republic as a Basis of the Country-Specific FRAX Model. Calcif Tissue Int 2012; 90(5): 365–372. Dostupné z DOI: <https://doi.org/10.1007/s00223–012–9582–9>.
Morris HA, Eastell R, Jorgensen NR et al. Clinical usefulness of bone turnover marker concentrations in osteoporosis. Clin Chim Acta 2017; 467 : 34–41. Dostupné z DOI: <https://doi.org/10.1016/j.cca.2016.06.036>.
Eastell R, Pigott T, Gossiel F et al. Diagnosis of Endocrine Disease: Bone turnover markers: are they clinically useful? Eur J Endocrinol 2018; 178(1): R19–R31. Dostupné z DOI: <https://doi.org/10.1530/EJE-17–0585>.
Langdahl B, Ferrari S, Dempster DW. Bone modeling and remodeling: potential as therapeutic targets for the treatment of osteoporosis. Ther Adv Musculoskelet Dis 2016; 8(6): 225–235. Dostupné z DOI: Dostupné z DOI: <https://doi.org/10.1177/1759720X16670154>.
Sims NA, Martin TJ. Coupling the activities of bone formation and resorption: a multitude of signals within the basic multicellular unit. Bonekey Rep 2014; 3 : 481. Dostupné z DOI: <https://doi.org/10.1038/bonekey.2013.215>.
Manolagas SC. Birth and death of bone cells: basic regulatory mechanisms and implications for the pathogenesis and treatment of osteoporosis. Endocr Rev 2000; 21(2):115–137. Dostupné z DOI: <https://doi.org/10.1210/edrv.21.2.0395>.
Vasikaran S, Eastell R, Bruyère O et al. Markers of bone turnover for the prediction of fracture risk and monitoring of osteoporosis treatment: a need for international reference standards. Osteoporos Int 2011; 22(2): 391–420. Dostupné z DOI: <https://doi.org/10.1007/s00198–010–1501–1>.
Bauer D, Krege J, Lane N et al. National Bone Health Alliance Bone Turnover Marker Project: current practices and the need for US harmonization, standardization, and common reference ranges. Osteoporos Int 2012; 23(10): 2425–2433. Dostupné z DOI: <https://doi.org/10.1007/s00198–012–2049-z>.
Szulc P. Bone turnover: Biology and assessment tools. Best Pract Res Clin Endocrinol Metab 2018; 32(5): 725–738. Dostupné z DOI: <https://doi.org/10.1016/j.beem.2018.05.003>.
Eastell R, Szulc P. Use of bone turnover markers in postmenopausal osteoporosis. Lancet Diabetes Endocrinol 2017; 5(11): 908–923. Dostupné z DOI: <https://doi.org/10.1016/S2213–8587(17)30184–5>.
Szulc P, Naylor K, Hoyle NR et al. Use of CTX-I and PINP as bone turnover markers: National Bone Health Alliance recommendations to standardize sample handling and patient preparation to reduce pre-analytical variability. Osteoporos Int 2017; 28(9): 2541–2556. Dostupné z DOI: <https://doi.org/10.1007/s00198–017–4082–4>.
Naylor K, Eastell R. Bone turnover markers: use in osteoporosis. Nat Rev Rheumatol 2012; 8(7): 379–89. Dostupné z DOI: <http://dx.doi.org/10.1038/nrrheum.2012.86>.
Cavalier E, Lukas P, Carlisi A et al. Aminoterminal propeptide of type I procollagen (PINP) in chronic kidney disease patients: the assay matters. Clin Chim Acta 2013; 425 : 117–118. Dostupné z DOI: <https://doi.org/10.1016/j.cca.2013.07.016>.
Moser SC. Osteocalcin – A Versatile Bone-Derived Hormone. Front Endocrinol (Lausanne) 2019; 9 : 6. Dostupné z DOI: <http://dx.doi.org/10.3389/fendo.2018.00794>.
Boskey AL, Gadaleta S, Gundberg C et al. Fourier transform infrared microspectroscopic analysis of bones of osteocalcin-deficient mice provides insight into the function of osteocalcin. Bone 1998; 23(3): 187–196. Dostupné z DOI: <https://doi.org/10.1016/S8756–3282(98)00092–1>.
Liu Y, Liu X, R Lewis J et al. Relationship between serum osteocalcin/undercarboxylated osteocalcin and type 2 diabetes: a systematic review/meta-analysis study protocol. BMJ Open 2019; 9(3): e023918. Dostupné z DOI: <https://doi.org/10.1136/bmjopen-2018–023918>.
Wei J, Karsenty G. An overview of the metabolic functions of osteocalcin. Rev Endocr Metab Disord 2015; 16(2): 93–98. Dostupné z DOI: <https://doi.org/10.1007/s11154–014–9307–7>.
Siller AF, Whyte MP. Alkaline Phosphatase: Discovery and Naming of Our Favorite Enzyme. J Bone Miner Res 2018; 33(2): 362–364. Dostupné z DOI: <https://doi.org/10.1002/jbmr.3225>.
Sharma U, Pal D, Prasad R. Alkaline Phosphatase: An Overview. Indian J Clin Biochem 2014; 29(3): 269–278. Dostupné z DOI: <https://doi.org/10.1007/s12291–013–0408-y>.
Szabo SM, Tomazos IC, Petryk A et al. Frequency and age at occurrence of clinical manifestations of disease in patients with hypophosphatasia: a systematic literature review. Orphanet J Rare Dis 2019; 14(1): 85. Dostupné z DOI: <https://doi.org/10.1186/s13023–019–1062–0>.
Tan A, Goodman K, Walker A et al. Long‐Term Randomized Trial of Intensive Versus Symptomatic Management in Paget’s Disease of Bone: The PRISM‐EZ Study. J Bone Miner Res 2017; 32(6): 1165–1173. Dostupné z DOI: <http://dx.doi.org/10.1002/jbmr.3066>.
Ketteler M, Block GA, Evenepoel P et al. Executive summary of the 2017 KDIGO Chronic Kidney Disease–Mineral and Bone Disorder (CKD-MBD) Guideline Update: what’s changed and why it matters. Kidney Int 2017; 92(6): 26–36. Dostupné z DOI: <https://doi.org/10.1016/j.kint.2017.04.006>.
Garnero P, Ferreras M, Karsdal MA et al. The Type I Collagen Fragments ICTP and CTX Reveal Distinct Enzymatic Pathways of Bone Collagen Degradation. J Bone Miner Res 2003; 18(5): 859–867. Dostupné z DOI: <https://doi.org/10.1359/jbmr.2003.18.5.859>.
Terpos E, Sezer O, Roodman D et al. The use of biochemical markers of bone remodeling in multiple myeloma: a report of the International Myeloma Working Group. Leukemia 2010; 24(10): 1700–1712. Dostupné z DOI: <https://doi.org/10.1038/leu.2010.173>.
Voorzanger-Rousselot N, Juillet F, Mareau E et al. Association of 12 serum biochemical markers of angiogenesis, tumour invasion and bone turnover with bone metastases from breast cancer: a crossectional and longitudinal evaluation. Br J Cancer 2006; 95(4):506–514. Dostupné z DOI: <https://doi.org/10.1038/sj.bjc.6603285>.
Halleen JM, Tiitinen SL, Ylipahkala H et al.Tartrate-resistant acid phosphatase 5b (TRACP 5b) as a marker of bone resorption. Clin Lab 2006; 52(9–10): 499–509.
Wheater G, Elshahaly M, Tuck SP et al. The clinical utility of bone marker measurements in osteoporosis. J Transl Med 2013; 11 : 201. Dostupné z DOI: <https://doi.org/10.1186/1479–5876–11–201>.
Haima P. Tartrate-Resistant Acid Phosphatase active isoform 5b. A biomarker for osteoclastic bone-resorption activity in renal insufficiency and cancer. Dostupné z WWW: <http://www.life-force-health.com/cms/wp-content/afbeeldingen/2015/02/TECO_TRAP5b_GB_0113_B.pdf>.[30–12–2019].
Shidara K, Inaba M, Okuno S et al. Serum Levels of TRAP5b, a New Bone Resorption Marker Unaffected by Renal Dysfunction, as a Useful Marker of Cortical Bone Loss in Hemodialysis Patients. Calcif Tissue Int 2008; 82(4): 278–287. Dostupné z DOI: <https://doi.org/10.1007/s00223–008–9127–4>.
Tang C, Liu Y, Qin H et al. Clinical significance of serum BAP, TRACP 5b and ICTP as bone metabolic markers for bone metastasis screening in lung cancer patients. Clin Chim Acta 2013; 426 : 102–107. Dostupné z DOI: <https://doi.org/10.1016/j.cca.2013.09.011>.
D’Oronzo S, Brown J, Coleman R. The role of biomarkers in the management of bone-homing malignancies. J Bone Oncol 2017; 9 : 1–9. Dostupné z DOI: <https://doi.org/10.1016/j.jbo.2017.09.001>.
Park SG, Jeong SU, Lee JH et al. The Changes of CTX, DPD, Osteocalcin, and Bone Mineral Density During the Postmenopausal Period. Ann Rehabil Med 2018; 42(3):441–448. Dostupné z DOI: <https://doi.org/10.5535/arm.2018.42.3.441>.
Lombardi G, Lanteri P, Colombini A, Banfi G. Blood biochemical markers of bone turnover: pre-analytical and technical aspects of sample collection and handling. Clin Chem Lab Med 2012; 50(5): 771–789. Dostupné z DOI: <https://doi.org/10.1515/cclm-2011–0614>.
Ingle BM, Hay SM, Bottjer HM et al. Changes in Bone Mass and Bone Turnover Following Distal Forearm Fracture. Osteoporos Int 1999; 10(5): 399–407. Dostupné z DOI: <https://doi.org/10.1007/s001980050246>.
Delanaye P, Souberbielle J-C, Lafage-Proust M-H et al. Can we use circulating biomarkers to monitor bone turnover in CKD haemodialysis patients? Hypotheses and facts. Nephrol Dial Transplant 2014; 29(5): 997–1004. Dostupné z DOI: <https://doi.org/10.1093/ndt/gft275>.
Eastell R, Garnero P, Audebert C et al. Reference intervals of bone turnover markers in healthy premenopausal women: Results from a cross-sectional European study. Bone 2012; 50(5): 1141–1147. Dostupné z DOI: <https://doi.org/10.1016/j.bone.2012.02.003>.
Chubb P, Byrnes E, Manning L, et al (2015) Reference intervals for bone turnover markers and their association with incident hip fractures in older men : the Health in Men Study. J Clin Endocrinol Metab 2015; 100(1): 90–99. Dostupné z DOI: <https://doi.org/10.1210/jc.2014–2646>.
Mchelsen J, Wallaschofski H, Friedrich N, et al. Reference intervals for serum concentrations of three bone turnover markers for men and women. Bone 2013; 57(2): 399–404. Dostupné z DOI: https://doi.org/10.1016/j.bone.2013.09.010
Guañabens N, Filella X, Monegal A et al. Reference intervals for bone turnover markers in Spanish premenopausal women. Clin Chem Lab Med 2016; 54(2): 293–303. Dostupné z DOI: <https://doi.org/10.1515/cclm-2015–0162>.
Huang Y, Eapen E, Steele S et al. Establishment of reference intervals for bone markers in children and adolescents. Clin Biochem 2011 : 44(10–11): 771–778. Dostupné z DOI: <https://doi.org/10.1016/j.clinbiochem.2011.04.008>.
Bayer M. Reference values of osteocalcin and procollagen type I N-propeptide plasma levels in a healthy Central European population aged 0–18 years. Osteoporos Int 2014; 25(2): 729–736. Dostupné z DOI: <https://doi.org/10.1007/s00198–013–2485–4>.
Herrmann D, Lauria F, Mårild S et al. Reference values of bone stiffness index and C-terminal telopeptide in healthy European children. Int J Obes 2014; 38(Suppl 2): S76–S85. Dostupné z DOI: <https://doi.org/10.1038/ijo.2014.138>.
Rauchenzauner M, Schmid A, Heinz-Erian P et al. Sex - and Age-Specific Reference Curves for Serum Markers of Bone Turnover in Healthy Children from 2 Months to 18 Years. J Clin Endocrinol Metab 2007; 92(2): 443–449. Dostupné z DOI: <https://doi.org/10.1210/jc.2006–1706>.
de Papp AE, Bone HG, Caulfield MP et al. A cross-sectional study of bone turnover markers in healthy premenopausal women. Bone 2007; 40(5): 1222–1230. Dostupné z DOI: <https://doi.org/10.1016/j.bone.2007.01.008>.
Glover SJ, Gall M, Schoenborn‐Kellenberger O et al. Establishing a Reference Interval for Bone Turnover Markers in 637 Healthy, Young, Premenopausal Women From the United Kingdom, France, Belgium, and the United States. J Bone Miner Res 2009; 24(3): 389–397. Dostupné z DOI: <https://doi.org/10.1359/jbmr.080703>.
Vasikaran SD, Chubb SP, Ebeling PR et al. Harmonised Australian Reference Intervals for Serum PINP and CTX in Adults. Clin Biochem Rev 2014; 35(4): 237–242.
Martínez J, Olmos JM, Hernández JL et al. Bone turnover markers in Spanish postmenopausal women. Clin Chim Acta 2009; 409(1–2): 70–74. Dostupné z DOI: <https://doi.org/10.1016/j.cca.2009.08.020>.
Morovat A, Catchpole A, Meurisse A et al. IDS iSYS automated intact procollagen-1-Nterminus pro-peptide assay: method evaluation and reference intervals in adults and children. Clin Chem Lab Med 2013; 51(10): 2009–2018. Dostupné z DOI: <https://doi.org/10.1515/cclm-2012–0531>.
Elecsys total P1NP, metodický list. Dostupné z WWW <https://dialog1.roche.com/cz/cs/eLabDoc ,downloaded 2018>.
Kostní markery, nepostradatelný nástroj v diferenciální diagnostice metabolických poruch kostí. Promo Material Osteo_v17.indd 8 Roche,17.09.2017.
Elecsys β-CrossLaps_serum, metodický list. Dostupné z WWW <https://dialog1.roche.com/cz/cs/eLabDoc, downloaded 2018>.
Olmos JM, Hernández JL, Martínez J et al. Bone turnover markers in Spanish adult men. Clin Chim Acta 2010; 411(19–20): 1511–1515. Dostupné z DOI: <https://doi.org/10.1016/j.cca.2010.06.010>.
Bauer DC, Black DM, Bouxsein ML et al. Treatment-Related Changes in Bone Turnover and Fracture Risk Reduction in Clinical Trials of Anti-Resorptive Drugs: A Meta-Regression. J Bone Miner Res 2018; 33(4): 634–642. Dostupné z DOI: <https://doi.org/10.1002/jbmr.3355>.
Assessment of fracture risk and its application to screening for postmenopausal osteoporosis : report of a WHO study group [meeting held in Rome from 22 to 25 June 1992]. WHO Technical Report 843 : 1994. ISBN 9241208430. Dostupné z WWW: <https://apps.who.int/iris/bitstream/handle/10665/39142/WHO_TRS_843_eng.pdf?sequence=1&isAllowed=y>.
[WHO Scientific Group]. Prevention and management of osteoporosis : report of a WHO scientific group 2000. World Health Organization: 2003. WHO Technical Report 921: Geneva 2003. ISBN 9241209216. Dostupné z WWW: https://apps.who.int/iris/bitstream/handle/10665/42841/WHO_TRS_921.pdf?sequence=1&isAllowed=y
Sornay‐Rendu E, Munoz F, Garnero P et al. Identification of Osteopenic Women at High Risk of Fracture: The OFELY Study. J Bone Miner Res 2005; 20(10):1813–1819. Dostupné z DOI: <https://doi.org/10.1359/JBMR.050609>.
Kanis JA et al. [WHO Scientific Group]. Assessment of osteoporosis at the primary health care level. WHO Scientific Group Technical Report 2007. Dostupné z WWW: <https://www.iofbonehealth.org/sites/default/files/WHO_Technical_Report-2007.pdf>.
Kanis JA, Johansson H, Cooper C et al. European guidance for the diagnosis and management of osteoporosis in postmenopausal women. Osteoporos Int 2013; 24(1): 23–57. Dostupné z DOI: <https://doi.org/10.1007/s00198–012–2074-y>.
Cosman F, de Beur SJ, LeBoff MS et al. Clinician’s Guide to Prevention and Treatment of Osteoporosis. Osteoporos Int 2014; 25(10): 2359–2381. Dostupné z DOI: <https://doi.org/10.1007/s00198–014–2794–2>.
Burch J, Rice S, Yang H et al. Systematic review of the use of bone turnover markers for monitoring the response to osteoporosis treatment: the secondary prevention of fractures, and primary prevention of fractures in high-risk groups. Health Technol Assess 2014; 18(11): 1–180. Dostupné z DOI: <https://doi.org/10.3310/hta18110>.
Luchavova M, Zikan V, Michalska D et al. The effect of timing of teriparatide treatment on the circadian rhythm of bone turnover in postmenopausal osteoporosis. Eur J Endocrinol 2011; 164(4):643–648. Dostupné z DOI: <https://doi.org/10.1530/EJE-10–1108>.
Glendenning P, Chubb SAP, Vasikaran S. Clinical utility of bone turnover markers in the management of common metabolic bone diseases in adults. Clin Chim Acta 2018; 481 : 161–170. Dostupné z DOI: <https://doi.org/10.1016/j.cca.2018.03.009>.
Garnero P, Sornay-Rendu E, Chapuy M-C et al. Increased bone turnover in late postmenopausal women is a major determinant of osteoporosis. J Bone Miner Res 1996; 11(3): 337–349. Dostupné z DOI: <https://doi.org/10.1002/jbmr.5650110307>.
Rosen CJ, Chesnut CH, Mallinak NJ. The Predictive Value of Biochemical Markers of Bone Turnover for Bone Mineral Density in Early Postmenopausal Women Treated with Hormone Replacement or Calcium Supplementation. J Clin Endocrinol Metab 1997; 82(6): 1904–1910. Dostupné z DOI: <https://doi.org/10.1210/jcem.82.6.4004>.
Shieh A, Ishii S, Greendale GA et al. Urinary N-telopeptide and Rate of Bone Loss Over the Menopause Transition and Early Postmenopause. J Bone Miner Res 2016; 31(11): 2057–2064. Dostupné z DOI: <https://doi.org/10.1002/jbmr.2889>.
Rogers A, Hannon RA, Eastell R. Biochemical Markers as Predictors of Rates of Bone Loss After Menopause. J Bone Miner Res 2000; 15(7): 1398–1404. Dostupné z DOI: <https://doi.org/10.1359/jbmr.2000.15.7.1398>.
Brown JP, Prince RL, Deal C et al. Comparison of the Effect of Denosumab and Alendronate on BMD and Biochemical Markers of Bone Turnover in Postmenopausal Women With Low Bone Mass: A Randomized, Blinded, Phase 3 Trial. J Bone Miner Res 2009; 24(1): 153–161. Dostupné z DOI: <https://doi.org/10.1359/jbmr.0809010>.
Eastell R, Vrijens B, Cahall DL et al. Bone turnover markers and bone mineral density response with risedronate therapy: Relationship with fracture risk and patient adherence. J Bone Miner Res 2011; 26(7): 1662–1669. Dostupné z DOI: <https://doi.org/10.1002/jbmr.342>.
Johansson H, Odén A, Kanis JA et al. A Meta-Analysis of Reference Markers of Bone Turnover for Prediction of Fracture. Calcif Tissue Int 2014; 94(5):560–567. Dostupné z DOI: <https://doi.org/10.1007/s00223–014–9842-y>.
Cummings SR, Ferrari S, Eastell R et al. Vertebral Fractures After Discontinuation of Denosumab: A Post Hoc Analysis of the Randomized Placebo-Controlled FREEDOM Trial and Its Extension. J Bone Miner Res 2018; 33(2): 190–198. Dostupné z DOI: <https://doi.org/10.1002/jbmr.3337>.
Adler RA, Fuleihan GE-H, Bauer DC et al. Managing Osteoporosis in Patients on Long-Term Bisphosphonate Treatment: Report of a Task Force of the American Society for Bone and Mineral Research. J Bone Miner Res 2016; 31 : 16–35. Dostupné z DOI: <https://doi.org/10.1002/jbmr.2708>.
Naylor KE, Bradburn M, Paggiosi MA et al. Effects of discontinuing oral bisphosphonate treatments for postmenopausal osteoporosis on bone turnover markers and bone density. Osteoporos Int 2018; 29(6): 1407–1417. Dostupné z DOI: <https://doi.org/10.1007/s00198–018–4460–6>.
Naylor KE, McCloskey EV, Jacques RM et al. Clinical utility of bone turnover markers in monitoring the withdrawal of treatment with oral bisphosphonates in postmenopausal osteoporosis. Osteoporos Int J 2019; 30(4):917–922. Dostupné z DOI: <https://doi.org/10.1007/s00198–018–04823–5>.
Reid IR, Black DM, Eastell R et al. Reduction in the Risk of Clinical Fractures After a Single Dose of Zoledronic Acid 5 Milligrams. J Clin Endocrinol Metab 2013; 98(2):557–563. Dostupné z DOI: <https://doi.org/10.1210/jc.2012–2868>.
Grey A, Bolland MJ, Horne A, et al.Five years of anti-resorptive activity after a single dose of zoledronate — Results from a randomized double-blind placebo-controlled trial. Bone 2012 : 50(6): 1389–1393. Dostupné z DOI: <https://doi.org/10.1016/j.bone.2012.03.016>.
Kim TY, Bauer DC, McNabb BL et al. Comparison of BMD Changes and Bone Formation Marker Levels 3 Years After Bisphosphonate Discontinuation: FLEX and HORIZON‐PFT Extension I Trials. J Bone Miner Res 2019; 34(5): 810–816. Dostupné z DOI: <https://doi.org/10.1002/jbmr.3654>.
Boonen S, Ferrari S, Miller PD et al. Postmenopausal osteoporosis treatment with antiresorptives: Effects of discontinuation or long-term continuation on bone turnover and fracture risk—a perspective. J Bone Miner Res 2012; 27(5): 963–974. Dostupné z DOI: <https://doi.org/10.1002/jbmr.1570>. Erratum in J Bone Miner Res 2012; 27(11): 2414–2415. J Bone Miner Res 2012; 27(11): 2416.
Štítky
Biochémia Detská gynekológia Detská rádiológia Detská reumatológia Endokrinológia Gynekológia a pôrodníctvo Interné lekárstvo Ortopédia Praktické lekárstvo pre dospelých Rádiodiagnostika Rehabilitácia Reumatológia Traumatológia Osteologie
Článok vyšiel v časopiseClinical Osteology
Najčítanejšie tento týždeň
2020 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Životní jubileum pana profesora MUDr. Jana Štěpána, DrSc.
- Markery kostního obratu u osteoporózy: společné stanovisko k jejich využití Společnosti pro metabolická onemocnění skeletu České lékařské společnosti J. E. Purkyně (SMOS ČLS JEP) a České společnosti klinické biochemie České lékařské společnosti J. E. Purkyně (ČSKB ČLS JEP)
- Definice osteoporotické (křehké) zlomeniny: stanovisko Společnosti pro metabolická onemocnění skeletu České lékařské společnosti J. E. Purkyně (SMOS ČLS JEP)
- Osteoporóza pri systémovej mastocytóze: kazuistika
- Léčba inkompletní atypické fraktury femoru teriparatidem: kazuistika
- Osteolytická ložiska pánve vedoucí k diagnóze primární hyperparatyreózy: kazuistika
- Clinical Osteology
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Markery kostního obratu u osteoporózy: společné stanovisko k jejich využití Společnosti pro metabolická onemocnění skeletu České lékařské společnosti J. E. Purkyně (SMOS ČLS JEP) a České společnosti klinické biochemie České lékařské společnosti J. E. Purkyně (ČSKB ČLS JEP)
- Osteolytická ložiska pánve vedoucí k diagnóze primární hyperparatyreózy: kazuistika
- Osteoporóza pri systémovej mastocytóze: kazuistika
- Definice osteoporotické (křehké) zlomeniny: stanovisko Společnosti pro metabolická onemocnění skeletu České lékařské společnosti J. E. Purkyně (SMOS ČLS JEP)
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




