-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Prevence cévních mozkových příhod
Autori: prof. MUDr. Michal Vrablík, Ph.D.
Pôsobisko autorov: Centrum preventivní kardiologie, 3. interní klinika 1. LF UK a VFN v Praze
Vyšlo v časopise: CMP jour., 1, 2018, č. 1, s. 10-19
Súhrn
Prevence cévních mozkových příhod (CMP) zahrnuje široký okruh témat, což odráží mnohočetnou etiopatogenezi iktu. Proto ani následující text neberte jako vyčerpávající přehled všech možností prevence různých typů CMP, ale spíše jako poukaz na spektrum možností ovlivňujících riziko vzniku či recidivy tohoto typu cévní příhody. Přitom si musíme uvědomit, že prevence cévních mozkových příhod je účinná – mortalita na CMP klesla mezi lety 1985 a 2011 o 70 % u obou pohlaví a většina tohoto úspěchu byla výsledkem preventivních opatření (1).
Cévní mozková příhoda je náhle vzniklý ložiskový neurologický deficit způsobený poruchou cévního zásobení mozkové tkáně – poklesem krevního průtoku v přívodné mozkové tepně (ischemické CMP, iCMP, 80–85 %) nebo rupturou mozkové tepny a následným krvácením buď intraparenchymálně, nebo subarachnoidálně (hemoragické CMP, hCMP, 12–15 %). S ohledem na omezené možnosti prevence hemoragických cévních mozkových příhod, v níž se v konečném důsledku uplatní společné postupy s těmi pro profylaxi cerebrální ischemie, se v dalším textu zaměříme na možnosti předcházení ischemickému iktu.
Prevence ischemické CMP
Ischemické CMP lze dělit z časového hlediska. Dojde-li k úpravě neurologického deficitu do 24 hodin, jde o tranzitorní ischemickou ataku (TIA), trvá-li deficit i po 24 hodinách, jedná se o CMPi (mozkový infarkt). Dle délky příznaků rozlišujeme reverzibilní ischemický neurologický deficit (RIND) – příznaky odezní do 14 dnů – a dokonanou CMP – příznaky trvají i po 14 dnech. Z léčebného hlediska přistupujeme k těmto jednotkám identicky. Určení etiologie iCMP je nezbytné pro správně vedenou sekundární prevenci. Klasifikace iCMP do pěti skupin podle kritérií, která byla definována pro studii TOAST, byla nahrazena systémem CCS, podle nějž rozlišujeme 4 typy iCMP (2):
- kardioaortální embolizace,
- ateroskleróza velkých tepen,
- uzávěr malých tepen,
- jiné.
Rizikové faktory ischemických cévních mozkových příhod
Ischemické CMP vznikají zejména na podkladě aterosklerózy, a také rizikové faktory jsou tedy podobné jako u ostatních aterotrombotických cévních komplikací – obrázek 1.
Obr. 1. Rizikové faktory ischemických cévních mozkových příhod 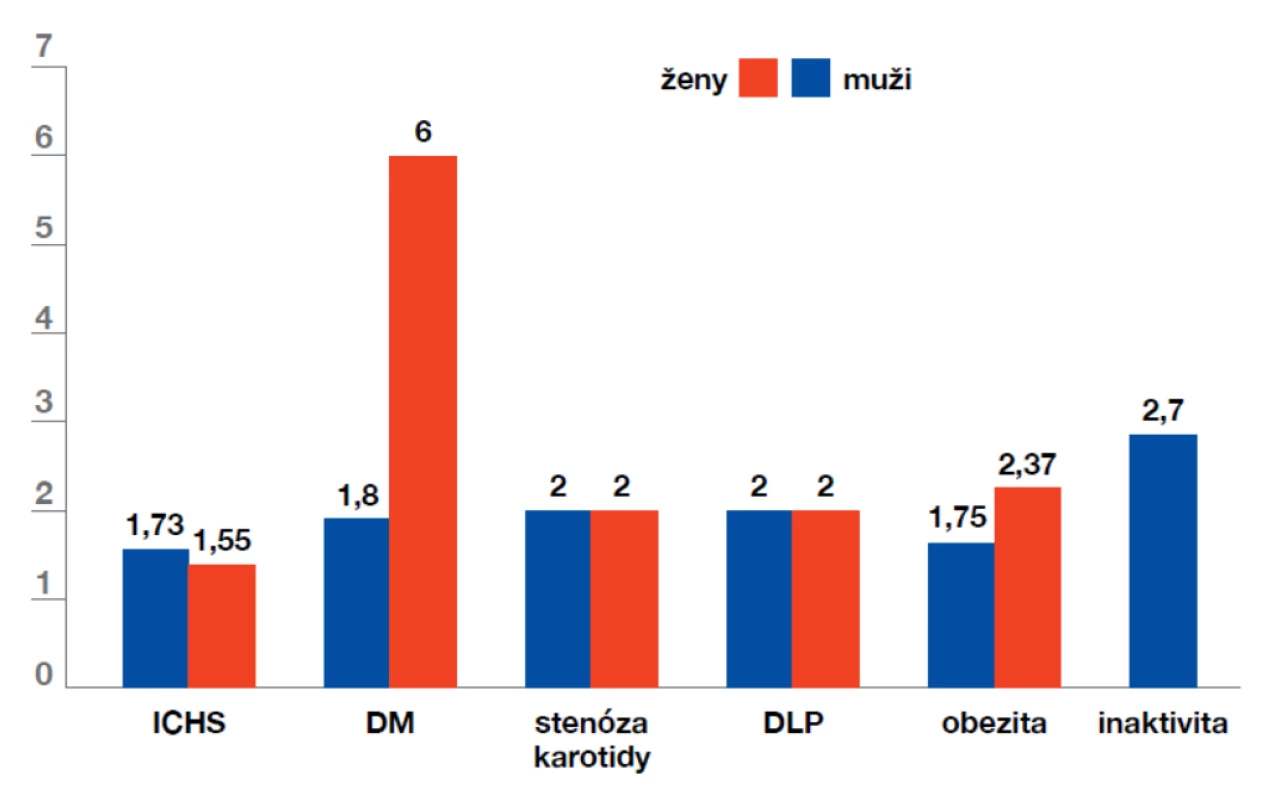
(dle: Bojar M., Tomek A. Preventivní medicina. Maxdorf,Pr aha, 2008) Mezi neovlivnitelné faktory patří věk (zdvojnásobení rizika iCMP za každou dekádu po 55. roce), mužské pohlaví (mimo věku 35–44 a nad 85 let), pozitivní rodinná anamnéza (významná zejména u vzácných genetických příčin iCMPi – Fabryho nemoci, trombofilní mutace) a kvůli rozdílnému životnímu stylu i specifickému genetickému pozadí rasa (vyšší výskyt iCMPi u černochů a Hispánců, vyšší incidence intrakraniálních stenóz a krvácení u Asiatů)
Mezi nejdůležitější ovlivnitelné rizikové faktory patří arteriální hypertenze, dyslipidemie, diabetes mellitus 2. typu, kouření a samozřejmě přítomnost fibrilace síní. Jejich význam se může mírně lišit v různých věkových skupinách, jak ukazuje obrázek 2.
Obr. 2. Význam vybraných ovlivnitelných rizikových faktorů iCMP podle věku 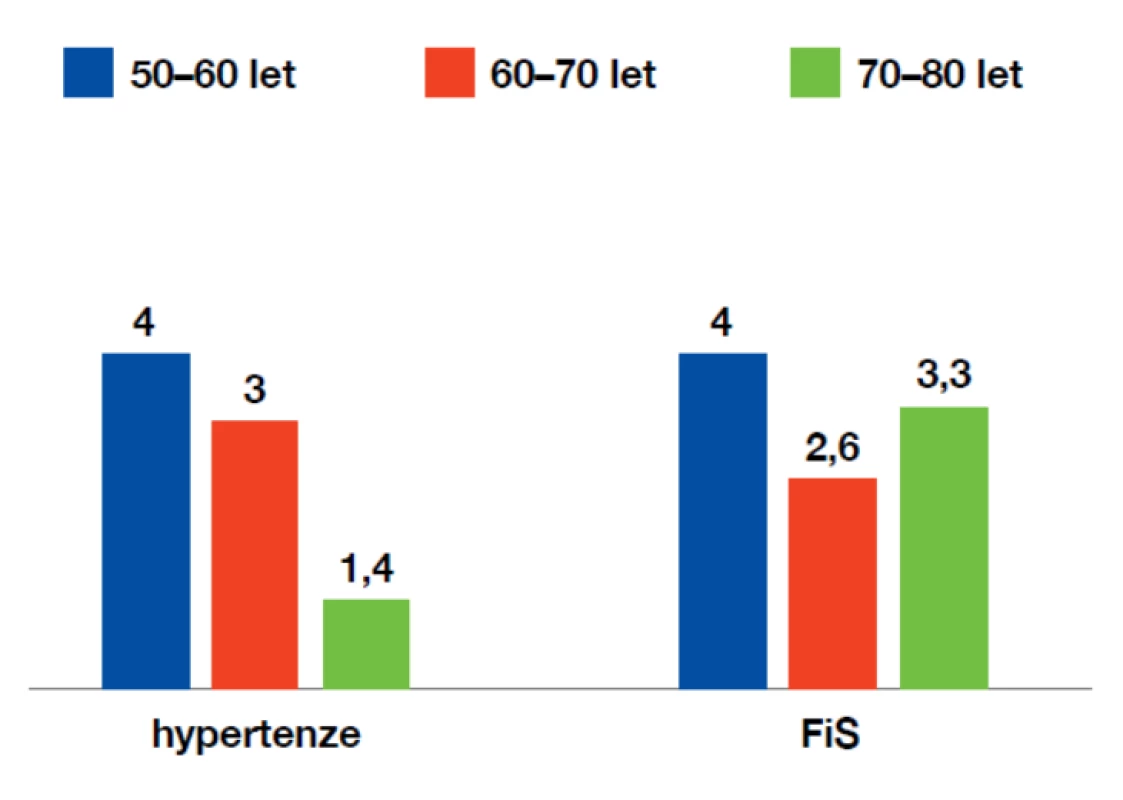
(dle: Bojar M., Tomek A. Preventivní medicina. Maxdorf, Praha, 2008) Režimová a dietní opatření: obecně účinná v prevenci aterotrombotických cévních příhod
Režimová opatření představují i z hlediska prevence iktu základní úroveň prevence. Z hlediska populačního mají větší význam než prevence medikamentózní a připomeňme, že dodržování pravidel zdravého životního stylu ovlivňuje všechny známé (a jistě i ty ještě nepoznané) ovlivnitelné rizikové faktory. Doporučení pro úpravu diety a zvýšení pohybové aktivity se v posledních letech nezměnila. Nadále nabádáme k co nejvyšší pohybové aktivitě (nejméně 30 minut denně), úpravě diety (snížení příjmu saturovaných tuků záměnou za tuky nenasycené, omezení konzumace jednoduchých sacharidů, zvýšení spotřeby zeleniny nebo ovoce na nejméně 5 porcí denně). Základem doporučení zůstává i úplné zanechání kouření, protože z hlediska rizika cévních komplikací neexistuje bezpečná dávka tabákového kouře. Diskutovanou otázkou bývá příjem alkoholu a riziko cévních komplikací. Na základě výzkumů z poslední doby snížila poslední doporučení pro prevenci cévních onemocnění maximální tolerovanou dávku alkoholu na 20 g denně u mužů a 10 g u žen (4).
Medikamentózní prevence ischemických cévních mozkových příhod
Tato otázka má široké překryvy s obecnými úvahami o prevenci aterotrombotických komplikací a zahrnuje medikamentózní intervenci hlavních rizikových faktorů aterosklerózy. Kromě toho do této kategorie zahrnujeme i farmakologickou prevenci kardioembolizačního iktu – antitrombotickou terapii.
Léčba arteriální hypertenze z hlediska prevence cévní mozkové příhody
Možnosti snížení rizika první CMP prostřednictvím snižování krevního tlaku byly sledovány v řadě klinických hodnocení. Z výsledků jednotlivých studií byly zpracovány metaanalýzy, které jednoznačně demonstrovaly přínos léčby arteriální hypertenze pro prevenci první CMP. Největší metaanalýza 147 randomizovaných studií s antihypertenzivy, publikovaná v roce 2009, ukázala, že pro snížení rizika CMP je nejdůležitější pokles krevního tlaku dosažený kterýmkoli ze základních antihypertenziv. Pro pokles systolického TK o 10 mmHg a diastolického TK o 5 mmHg autoři vypočítali snížení relativního rizika (RR) iktu o 41 %. Pokles relativního rizika iktu při léčbě různými antihypertenzivy shrnuje obrázek 3. Pro nedostatečné zastoupení v metaanalýze nejsou zahrnuty sartany.
Obr. 3. Vliv léčby antihypertenzivy na relativní riziko iktu ve 147 randomizovaných studiích 
BB – beta blokátory, ACEi – inhibitory angiotenzin konvertujícího enzymu, BKK – blokátory kalciových kanálů, thiazidy – thiazidová diuretika Subanalýza 49 studií v této práci, porovnávající různé antihypertenzivní režimy, zjistila, že nejvýznamnější vliv mají blokátory kalciových kanálů (BKK; pokles RR o 33 %) a nejmenší byl prospěch z léčby hypertenze při použití beta-blokátorů (pokles RR iktu o 19 %). Kromě této poslední práce máme k dispozici shrnutí řady dalších studií dokumentujících účinnost prevence CMP při systolicko-diastolické i izolované systolické hypertenzi. Víme, že přínos antihypertenzivní léčby v prevenci iktů je významně vyšší než v prevenci kardiovaskulárních příhod. Známý je i fakt, že léčba arteriální hypertenze ve vyšším věku snižuje cerebrovaskulární mortalitu přibližně dvakrát účinněji než ve středním věku (5, 6).
Zatímco shromáždění velkého množství dat a robustní závěry metaanalýz jsou jejich zřejmou výhodou, kombinace údajů získaných z často heterogenních populací bez možnosti přesné charakteristiky konkomitantní medikace a souběžných onemocnění jsou často jejich významnou limitací.
Jak důležitá je volba antihypertenziva pro prevenci CMP?
V předchozím odstavci jsme zopakovali, že nejdůležitějším opatřením v prevenci CMP je snížení krevního tlaku a že základní třídy antihypertenziv jsou přibližně stejně efektivní. V každodenní praxi potřebujeme konkrétnější návod pro vedení antihypertenzivní léčby a ten budeme hledat ve výsledcích jednotlivých klinických studií. Zde ale můžeme narazit na různá úskalí. Například studie ALLHAT ukázala, že léčba hypertenze založená na thiazidovém diuretiku je z hlediska prevence iktu účinnější než léčba inhibitorem angiotenzin konvertujího enzymu (ACEi). Tento výsledek je možné pravděpodobně zpochybnit rozdílem v cílovém krevním tlaku, jenž byl v „diuretické větvi“ studie v průměru o 2 mmHg nižší než u osob léčených ACEi (7). Podobná situace nastala i ve studii ASCOT, v níž byla kombinace ACEi a blokátoru kalciového kanálu spojena s významně větším snížením rizika iktu ve srovnání s léčbou beta-blokátorem a diuretikem – mezi porovnávanými intervencemi byl však opět významný rozdíl v dosaženém systolickém TK, který se lišil o 3 mmHg ve prospěch první uvedené kombinace (8). Ani v dalším srovnání ACEi v kombinaci s BKK nebo thiazidovým diuretikem ve studii ACCOMPLISH nebyl TK na konci studie zcela identický (rozdíl 1 mmHg ve prospěch kombinace ACEi + BKK) a je možné, že i zde byl příznivý efekt kombinace ACEi a BKK způsobem „pouhou“ vyšší antihypertenzivní účinností (9). Na druhé straně si musíme připomenout dnes již klasické výsledky studií s ACEi. Ve studii HOPE bylo u vysoce rizikových nemocných demonstrováno snížení rizika všech typů ischemických i hemoragických iktů při léčbě ramiprilem o jednu třetinu, i přestože krevní tlak klesl pouze o 3/2 mmHg. Je pravděpodobné, že za výrazný efekt ACEi ramiprilu ve studii HOPE byly zodpovědné další vaskuloprotektivní mechanismy, které na snížení TK přímo nezávisí (10). Dalším významným zdrojem dat o vlivu inhibice ACE na rekurenci CMP u nemocných po iktu byla studie PROGRESS s perindoprilem. Samotná monoterapie perindoprilem vedla k mírnému poklesu krevního tlaku ( − 4,9/2,8 mmHg) a riziko iktu se snížilo o nevýznamných 5 %. Naproti tomu léčba kombinací indapamidu a perindoprilu, redukující TK o 12/5 mmHg, snížila riziko všech iktů o 43 % (11). Opět je nutné připomenout, že populace studií HOPE a PROGRESS se lišily a je možné, že za rozdílný výsledek obou studií je částečně zodpovědná i použitá dávka ACEi (plná dávka ramiprilu v HOPE a poloviční dávka perindoprilu ve studii PROGRESS). Mají-li se uplatnit příznivé účinky ACEi, je třeba je titrovat do maximálních tolerovaných dávek. V kontextu řady dalších příznivých účinků inhibitorů ACE na riziko vaskulárních příhod, diabetu, mikrovaskulárních komplikací diabetu, hypertrofii levé komory srdeční a jiná rizika není překvapením, že inhibitory ACEi jsou i u nemocných se zvýšeným rizikem CMP považovány za základ léčebných strategií (12).
Jinou široce diskutovanou otázkou je léčba antagonisty AT1 receptorů – sartany – a jejich přínos pro prevenci CMP. V rozsáhlé metaanalýze 26 prospektivních randomizovaných studií s více než 200 tisíci pacienty bylo zjištěno, že medikace snižující hladiny angiotenzinu II (beta-blokátory, ACEi) snižovala riziko CMP o 17 % méně než léčba, která koncentrace angiotenzinu II zvyšuje (sartany, BKK, thiazidová diuretika; 13). Spolu se závěry některých menších studií s ACEi, v nichž nebyl jednoznačný prospěch ve smyslu snížení rizika CMP léčbou prokázán (AIRE s ramiprilem, TRACE s trandolaprilem, SAVE s captoprilem), vedlo toto pozorování k názoru, že sartany budou lepší v prevenci CMP než inhibitory ACE. Částečné řešení otázky, který způsob inhibice systému renin–agniotenzin–aldosteron (RAAS; ACEi nebo sartan) je lepší, přinesla až přímá srovnání. Ve studii ONTARGET byla léčba telmisartanem srovnatelně účinná jako referenční ramipril při hodnocení primárního složeného cíle. Ačkoli terapie telmisartanem snižovala riziko CMP o dalších 9 % ve srovnání s ramiprilem, nebyl tento rozdíl statisticky významný (14). Souběžně se studií ONTARGET probíhalo hodnocení vlivu podávání telmisartanu na výskyt kardio - a cerebrovaskulárních příhod u osob netolerujících ACEi. Tato studie s názvem TRANSCEND přinesla překvapivě negativní výsledek – snížení krevního tlaku aktivní léčbou neovlivnilo ve srovnání s placebem výskyt vaskulárních příhod (15). A třetí studie s telmisartanem (PROFESS), která sledovala kohortu nemocných netolerujících ACEi v sekundární prevenci iktu, zjistila, že ve studované populaci během průměrně 2,5 roku sledování nebyl významný rozdíl ve výskytu sledovaných příhod (8,7 % v telmisartanové větvi, 9,2 % u osob léčených placebem). Ačkoli výsledky vypadají sugestivně, musíme si opět všimnout několika důležitých aspektů. Studie PROFESS byla relativně krátká a při zpracování výsledků se zdálo, že se „nůžky“ počtu příhod začínají rozevírat až ve 2. roce sledování – studie tedy mohla být ukončena příliš brzy. Nemocní byli léčeni intenzivní antihypertenzivní léčbou podle platných guidelines, a proto byl rozdíl v hodnotách TK na konci studie relativně malý (o 3,8/2,0 mmHg nižší průměrný TK v telmisartanové větvi). Autoři také připouštějí relativně vyšší podíl špatné adherence k léčbě ve studii PROFESS, který byl významně odlišný od studie ONTARGET (16). Uvedené faktory dokreslují nesnadnou situaci, v níž se často ocitáme ve snaze zjistit, co z klinických studií vyplývá pro klinickou praxi.
V odpovědi na otázku z úvodu tohoto odstavce a ve shodě s platnými doporučeními odborných společností lze konstatovat, že pro prevenci CMP je možné použít léčiva ze základních skupin antihypertenziv (ACEi/sartany, BKK, diuretika a beta-blokátory) a nejdůležitější je dosažení významného poklesu krevního tlaku (17).
CMP a léčba dyslipidemie
Snížení výskytu cévních mozkových příhod bylo pozorováno již v prvních klinických studiích se statiny (18). Ve všech následujících statinových hodnoceních byl dokumentován obdobně příznivý vliv léčby, a proto metaanalýza statinových studií publikovaná již v roce 2005 mohla konstatovat, že relativní riziko CMP klesá při terapii statinem o 21 % (19). Vliv léčby statinem závisí přímo na míře snížení LDL-c – pokles LDL-c o 10 % snižuje riziko iktu o 13,2 % – a není závislý na koncentraci cholesterolu před léčbou (20). V hodnocených studiích nebylo podávání statinů spojeno se zvýšením rizika hemoragické CMP a bylo doloženo, že statiny jsou v prevenci iktu stejně účinné bez ohledu na pohlaví, věk, přítomnost diabetu či výši krevního tlaku. Také klinická sledování účinnosti statinů srovnávající agresivní léčbu vysokými dávkami se standardně dávkovanou terapií potvrdila, že i v prevenci cerebrovaskulárních příhod platí, že čím nižší LDL-c, tím lépe. Agresivní léčba u nemocných s koronární aterosklerózou snižuje pravděpodobnost iktu o 17 % ve srovnání s méně intenzivním přístupem, aniž by bylo ovlivněno riziko hemoragické CMP (21).
Zajímavý byl pohled na subanalýzy některých statinových studií sledujících vliv léčby statinem na výskyt rekurentních mozkových příhod. Například v simvastatinové Heart Protection Study bylo riziko opakované CMP u nemocných léčených simvastatinem 10,3 %, zatímco u léčených placebem 10,4 % (22). Žádná ze studií dokumentujících uvedený nález neměla hodnocení vlivu léčby na opakování CMP stanoveno jako primární sledovaný cíl. Proto byla provedena studie SPARCL, ve které byl srovnán vliv 80 mg atorvastatinu a placeba na opakování CMP u nemocných s anamnézou mozkové příhody v šesti měsících před zařazením do studie. Při léčbě statinem bylo dosaženo průměrné hladiny LDL-c 1,9 mmol/l a relativní riziko opakování CMP kleslo o 16 % (p = 0,03), přestože 25 % nemocným v placebové větvi byl v průběhu studie předepsán statin (23). K omezení případného zkreslení výsledků tímto vysokým zastoupením uživatelů statinu v placebové větvi autoři studie provedli následnou analýzu, v níž se zaměřili na rozdíly mezi pacienty s výrazným (> 50%) a méně znatelným snížením hladin LDL-c na konci studie ve srovnání s počáteční hodnotou. Výrazné snížení koncentrace LDL-c bylo spojeno s 31% poklesem výskytu CMP bez zvýšení rizika mozkové hemoragie (24). Studie SPARCL tak mimo jakoukoli pochybnost dokumentovala příznivý vliv terapie vysokou dávkou statinu u nemocných v sekundární prevenci cerebrovaskulární příhody.
Další dávku údajů o vlivu podávání statinů na výskyt cerebrovaskulárních příhod přinesla studie JUPITER (25). Obrovské klinické sledování účinnosti a bezpečnosti 20 mg rosuvastatinu u 17 802 nemocných s relativně nízkou hladinou LDL-c (průměrná hodnota při randomizaci byla 2,7 mmol/l) a zvýšeným C-reaktivním proteinem (průměrně 4,3 mg/l) bylo předčasně ukončeno po 1,9 roku pro výrazně pozitivní vliv aktivní léčby na sledované ukazatele. Jedním z nich byl i výskyt cévních mozkových příhod, jejichž počet byl aktivní léčbou rosuvastatinem snížen o 48 % ve srovnání s placebem. V rosuvastatinové větvi bylo 6 a v placebové 9 pacientů, kteří v průběhu sledování prodělali hemoragickou CMP; tento rozdíl nebyl statisticky významný (p = 0,44).
Jak zdůvodnit příznivé působení statinů na výskyt ischemických cévních mozkových příhod? Hlavní je (stejně jako v případě ostatních vaskulárních povodí) snižování hladiny LDL-c. Pro účinnou prevenci CMP statinem je nejdůležitější dosáhnout cílové koncentrace LDL-c < 1,8 mmol/l. Významnou roli jistě hrají i tzv. nelipidové účinky statinů. Protizánětlivé, antitrombogenní, antioxidační a další dokumentované vlastnosti jsou (stejně jako LDL-c snižující efekt) u různých statinů vyjádřeny různě, což je možným zdůvodněním rozdílů v nálezech klinických studií (26).
Na základě nashromážděných důkazů můžeme uzavřít, že statiny jsou účinné v prevenci ischemických cévních mozkových příhod u nemocných s manifestním kardiovaskulárním onemocněním (KVO), po proběhlé TIA nebo kompletním ischemickém iktu, ale i u osob se zvýšeným celkovým kardiovaskulárním rizikem bez anamnézy KVO.
Ostatní hypolipidemika (pryskyřice, fibráty, omega-3 mastné kyseliny ve farmakologických dávkách) mají nesrovnatelně menší dokumentaci svého vlivu na riziko iktu a nelze formulovat univerzální doporučení pro jejich použití v tomto kontextu.
Zmínit musíme selektivní blokátor intestinální absorpce cholesterolu ezetimib. Studie IMPROVE-IT s více než 18 tisíci pacienty po akutním koronárním syndromu přinesla jasná data o vlivu této medikace nejen na lipidogram, ale zejména na riziko sledovaných cévních příhod včetně CMP (27). Testována byla kombinace 40 mg simvastatinu a 10 mg ezetimibu proti monoterapii simvastatinem. Primárním cílovým ukazatelem studie IMPROVE-IT je složený ukazatel zahrnující úmrtí z KV příčin, IM nevedoucí k úmrtí, nefatální CMP a hospitalizaci pro nestabilní AP či koronární revaskularizaci vyskytující se nejméně 30 dní po randomizaci. Během 7 let trvání studie došlo u 32,7 % pacientů užívajících kombinační léčbu k manifestaci primárního cíle ve srovnání s 34,7 % pacientů užívajících monoterapii simvastatinem (hazard ratio 0,936; P = 0,016). Tento statisticky významný rozdíl prokazuje, že přidání ezetimibu k terapii statinem redukuje KV riziko, resp. snižuje výskyt KV příhod. Pro správné hodnocení výsledků IMPROVE-IT si musíme připomenout hladiny LDL-c v obou léčených ramenech: střední hladina LDL-c 1,4 mmol/l v případě kombinační léčby proti 1,8 mmol/l u monoterapie statinem (resp. kombinace statin + placebo). Výsledek studie IMPROVE-IT tedy není „hubený“, jak uváděli někteří komentátoři, ale přesně v souladu s předchozími intervenčními projekty, které dokumentovaly pokles rizika aterotrombotických příhod o přibližně 20 % na každý milimol poklesu LDL-c (obrázek 4).
Obr. 4. Vztah míry snížení LDL-c léčbou a kardiovaskulárního rizika 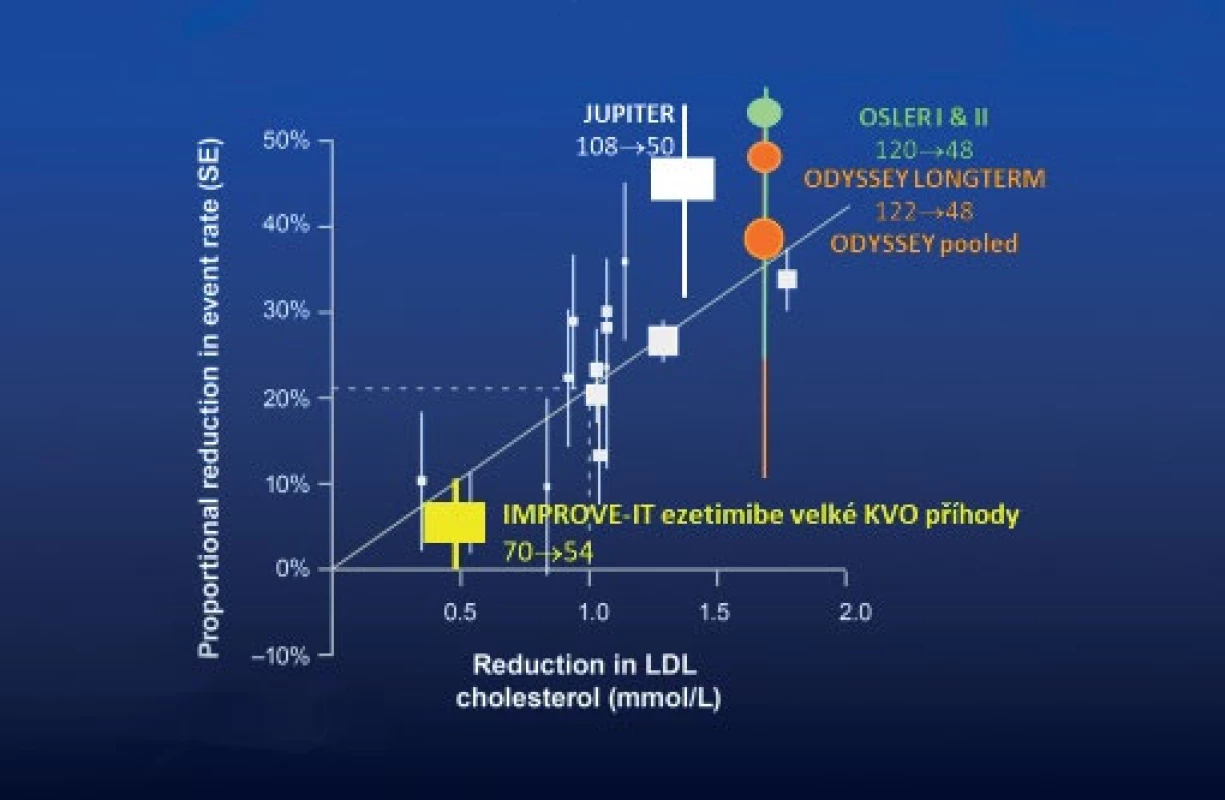
V souladu s dlouho platnými názory byl nejmarkantnější přídatný benefit z dalšího snižování LDL-c ve studii IMPROVE-IT pozorován u pacientů s extrémně zvýšeným cévním rizikem. Tuto subpopulaci reprezentovali zejména nemocní s diabetem 2. typu. Při analýzách předdefinovaných podskupin studie IMPROVE-IT byl statisticky významný účinek kombinační léčby u podskupiny diabetiků významně větší nežli u pacientů bez diabetu (pokles KV příhod o 14 % vs. nevýznamný pokles rizika o 2 %). Zajímavé je, že kombinace statin + ezetimib ve studii IMPROVE-IT snížila u diabetiků riziko ischemického iktu o 39 %, což byl ještě významnější pokles rizika než při hodnocení vlivu intervence na výskyt koronárních příhod. Kombinace statinu s ezetimibem ale ovlivňovala riziko v celém spektru KV příhod, jak dokumentuje tabulka 1.
Tab. 1. Analýza výskytu sledovaných příhod u pacientů ve studii IMPROVE-IT podle přítomnosti DM2 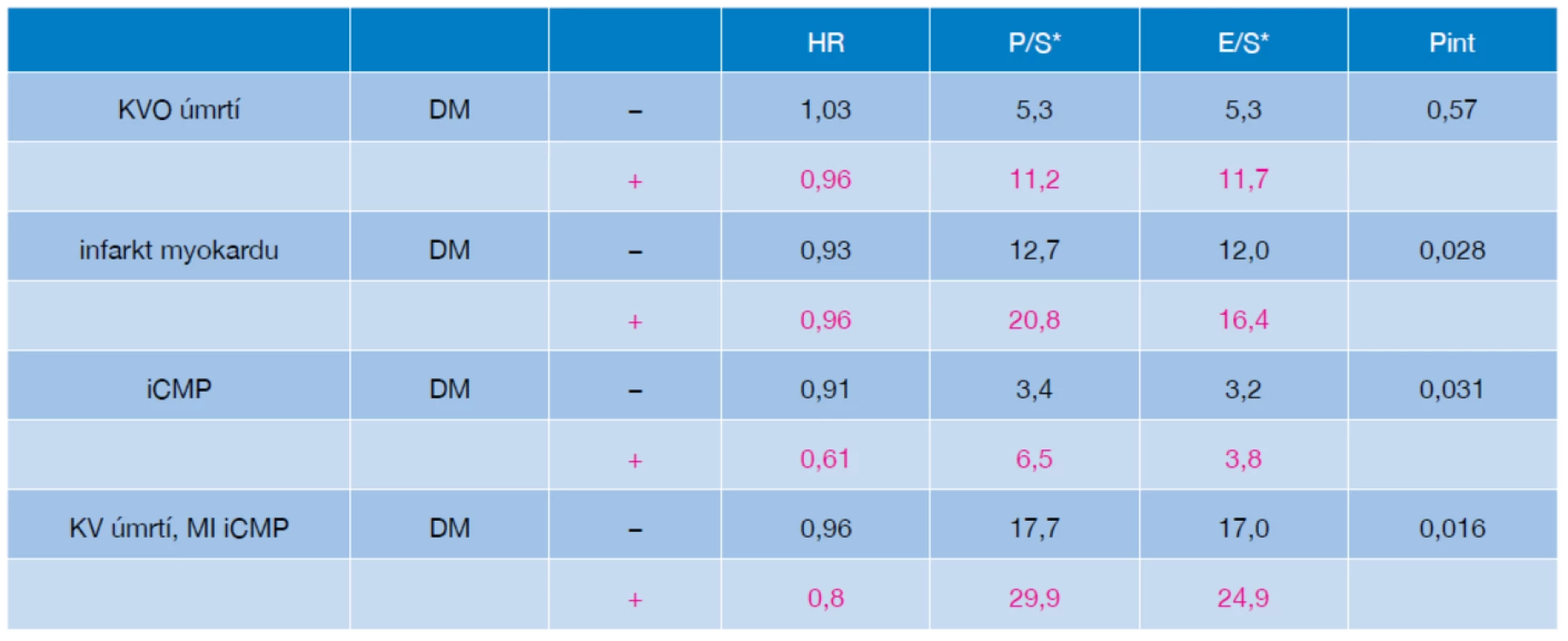
Zdá se pravděpodobné, že diabetes ve studii IMPROVE-IT nebyl specifickou podmínkou úspěchu intervence, ale spíše že reprezentoval jednu ze situací spojených s extrémním navýšením kardiovaskulárního rizika. U takových pacientů může snižování LDL cholesterolu i k hladinám nižším, než jsou dnešní cílové hodnoty LDL-C, přinést další pokles kardiovaskulárního rizika. To podporují další analýzy studie IMPROVE-IT dokládající, že lepších výsledků při kombinační léčbě statinem s ezetimibem se dosahuje u nejvíce rizikových osob. Nositelé alespoň 3 dalších rizikových charakteristik (např. věk nad 75 let, hypertonici, pacienti s anamnézou CMP, diabetici, osoby s renálním onemocněním atd.) sledovaní ve studii IMPROVE-IT měli při léčbě kombinací statin a ezetimib snížení rizika dokonce o 19 %.
K použití ezetimibu v prevenci cerebrovaskulárních příhod lze shrnout, že u nemocných se zvýšeným rizikem CMP nedosahujících cílové hodnoty celkového a LDL cholesterolu při maximální tolerované dávce statinu je vhodné zahájit léčbu kombinací statinu s ezetimibem.
Význam snižování koncentrací LDL-c z hlediska prevence iktu potvrzují studie s inhibitory proprotein konvertázy subtilisin-kexin 9 (PCSK9) z poslední doby. Používané monoklonální protilátky mají pronikavý efekt a koncentrace LDL-c při jejich použití klesají o 50–70 % nad rámec dosažitelný ostatními používanými terapiemi. Máme k dispozici výsledky morbi-mortalitních studií hodnotících vliv podávání dvou zástupců PCSK9i na riziko cévních příhod včetně ovlivnění rizika iktu. Jak studie ODYSSEY Outcomes s alirocumabem, tak hodnocení FOURIER s evolocumabem přinesly jednoznačné doklady o účinném snížení rizika ischemické CMP při použití těchto terapií, jak shrnuje tabulka 2 (28, 29).
Tab. 2. Vliv alirocumabu a evolocumabu na sledované ukazatele včetně výskytu CMP v mortalitních studiích 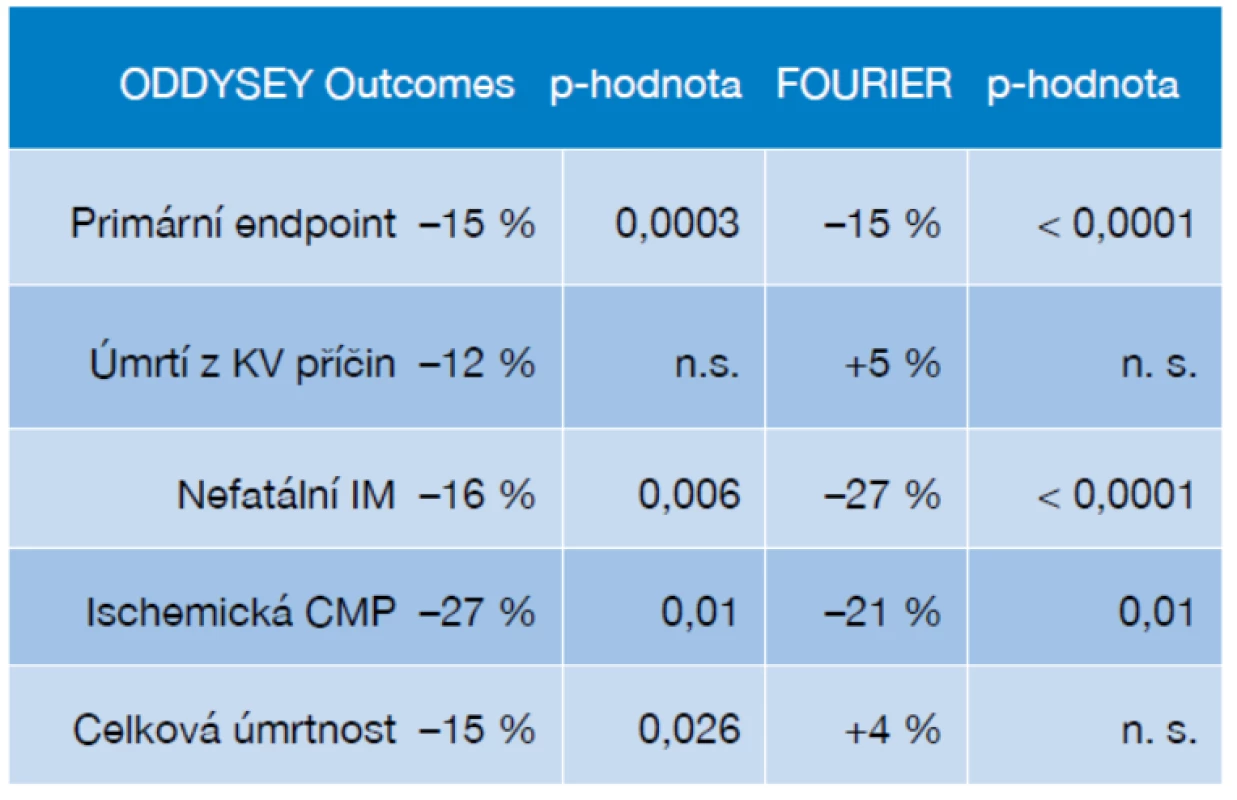
KV – kardiovaskulární, IM – infarkt myokardu, CMP – cévní mozková příhoda, n. s. – nesignifikantní Antitrombotická léčba v prevenci CMP
Antitrombotická léčba patří mezi pilíře farmakologických opatření prevence ischemického iktu. Možnosti jsou v zásadě dvě: použití antiagregační nebo antikoagulační terapie. Antiagregancia podáváme akutně při vzniku iktu (v případě kontraindikace nebo nemožnosti provedení trombolýzy či mechanické rekanalizace) i dlouhodobě u těch, kteří nejsou indikováni k léčbě antikoagulancii v kontextu velmi vysokého cévního rizika, jednoznačně pak při anamnéze aterotrombotické cévní příhody. Protidestičkové léky mají několik mechanismů účinku (30):
- inaktivace destičkové cyklooxygenázy,
- inhibice fosfodiesterázy E5 s následným vzestupem cyklického guanozin - a adenozinmonofosfátu,
- inhibice trombocytárních receptorů pro adenozindifosfát,
- inhibice exprese glykoproteinových receptorů při aktivaci adenozindifosfátem a tromboxanem.
V dalším textu se zmíníme o nejčastěji používaných protidestičkových lécích v prevenci iCMP.
Kyselina acetylsalicylová (ASA) inhibuje cyklooxygenázu 1 a v konečném důsledku omezuje přeměnu kyseliny arachidonové na tromboxan A2. Kyselina acetylsalicylová tak ireverzibilně inhibuje aktivaci glykoproteinových receptorů na membráně trombocytů. Je nejrozšířenější a nejvíce prověřenou metodou sekundární prevence mozkového iktu.
Metaanalýza z roku 2002 zahrnovala 287 studií vyhodnocujících 135 000 osob proti placebu a 77 000 při srovnání různých antiagregačních režimů (31). V agregovaném hodnocení frekvence vaskulárních příhod (infarkt myokardu, iCMP, vaskulární smrt) docílila kyselina acetylsalicylová zhruba 25% redukce. Potlačení nefatálních infarktů myokardu bylo intenzivnější než snížení počtu nefatálních iktů mozkových. Počet léčených osob nezbytný k prevenci jedné příhody (number needed to treat – NNT) je pro infarkt myokardu 73, pro mozkový iktus 246. Aktuálně používané dávky do 100 mg ASA denně mají příznivý poměr rizika krvácivých komplikací při zachovalé antitrombotické účinnosti.
Další skupinou antiagregancií jsou antagonisté destičkového receptoru pro ADP (P2Y12 antagonisté). Potlačení trombocytárních receptorů pro adenozindifosfát dosahují ireverzibilně po čtyř - až pětidenním podávání deriváty thienopyridinu tiklopidin a klopidogrel. Ve studii TASS prokázal tiklopidin v kategorii iktů a fatálních iktů redukci rizik proti ASA dokonce o 21 % vyšší (32). Pro vzácné komplikace s neutropenií byl později uveden na trh modernější klopidogrel. Ten ve studii CAPRIE redukoval recidivy iktu, infarktu myokardu či vaskulární smrti proti ASA ještě navíc o 8,7 %. V retrospektivní studii u pacientů s ischemickým iktem vzniklým při užívání ASA vedla změna protidestičkové léčby na klopidogrel ke snížení rizika recidivy ischemického iktu (33). Hemoragické komplikace jsou zcela minimální, i ostatní komplikace se vyskytují nečetně.
Ticagrelol je nethienopyridinovým přímým inhibitorem ADP receptorů typu P2Y12. Na rozdíl od thienopyridinů je účinnou látkou samotný lék, a ne jeho aktivní metabolit. V subanalýzách studie SOCRATES byl ticagrelol účinnější než ASA jednak v asijské populaci, jednak u pacientů s aterotrombotickou etiologií iktu (34).
Naděje byly vkládány do duální antiagregační léčby ASA + klopidogrel v sekundární prevenci ischemického iktu, zejména u pacientů s vyšší mírou cévně-ischemického rizika. Klinické studie dokumentovaly většinou očekávanou vyšší míru antitrombotické ochrany „vykoupenou“ zvýšením rizika krvácivých komplikací. Poslední z mnoha metaanalýz uzavírá, že správě vedená duální antiagregační terapie ASA s klopidogrelem je bezpečná (35). Stále však dlouhodobá duální antiagregační léčba v prevenci iktu zůstává vyhrazena specifickým situacím (významné symptomatické intrakraniální stenózy).
Všem pacientům v sekundární prevenci iktu nevyžadujícím antikoagulaci má být podávána antiagregační terapie. V dnešní době v této indikaci dominuje klopidogrel. Alternativně je možno ordinovat samostatně ASA.
U pacientů s rozvojem iktu na antiagregační terapii je doporučeno nové posouzení patofyziologie a rizikových faktorů; obecně se preferuje výměna antiagregancia za jiné, a nikoli zvyšování dávky.
Antikoagulační léčba v prevenci CMP
Antikoagulační léčbu dnes považujeme za samozřejmou součást prevence ischemické cévní mozkové příhody u pacientů s vyšším rizikem kardioembolického iktu při nevalvulární fibrilaci síní podle skórovacího systému CHA2DS2-VASc, který uvádí tabulka 3 (36).
Tab. 3. Stratifikace rizika CMP podle skóre CHA2DS2-VASc 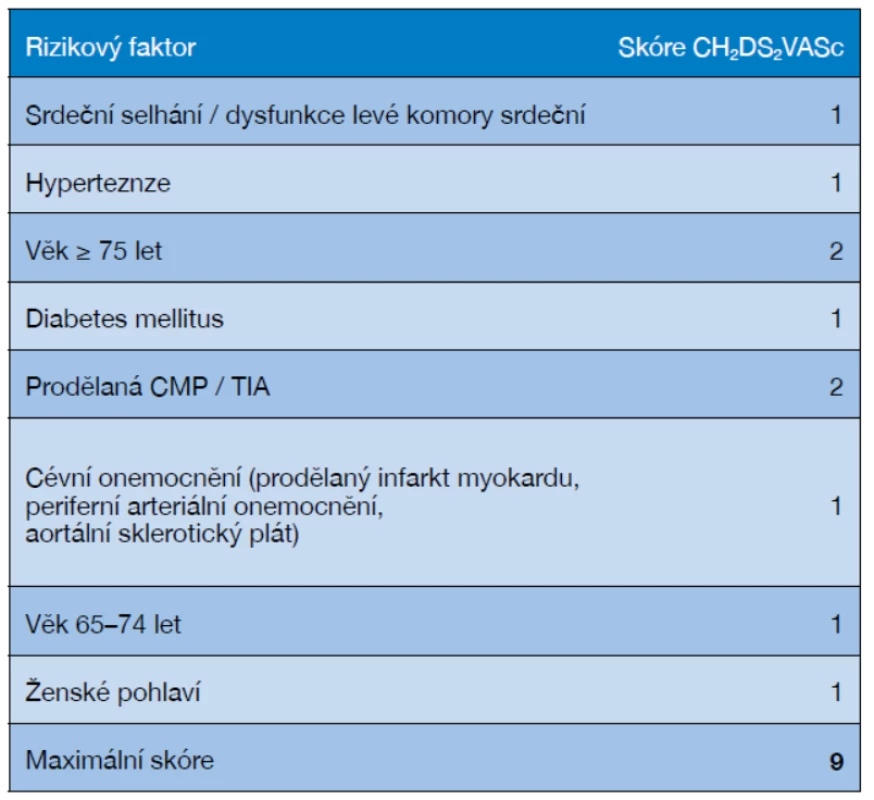
CMP – cévní mozková příhoda; TIA – tranzitorní ischemická ataka Volíme v zásadě mezi warfarinem a indikací newarfarinových orálních antikoagulačních přípravků (NOAK). Skupina NOAK se rozrůstá a v současné době můžeme používat 4 molekuly této lékové skupiny a další přibývají (tabulka 4).
Tab. 4. Srovnání farmakologického účinku NOAC 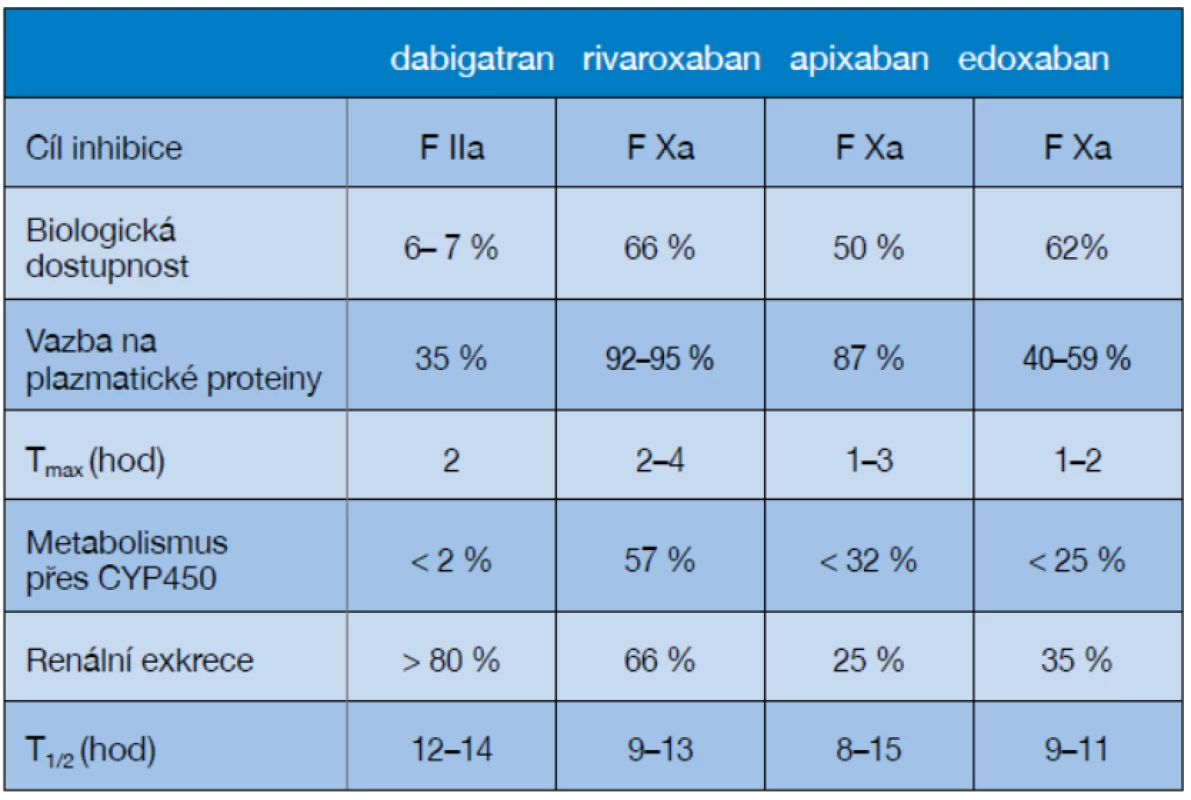
Zkratky: Tmax – čas potřebný k dosažení vrcholné koncentrace v plazmě po 1 dávce; h – hodiny; CYP450 – cytochrom 450; T1/2 – konečný poločas léku Perorální antikoagulace (s cílovým INR 2,0–3,0 při použití warfarinu) se naléhavě doporučuje u pacientů s fibrilací síní (FiS). Omezením jsou zde pouze kontraindikace u pacientů s komorbiditami, jako jsou pády, špatná spolupráce, nekontrolovaná epilepsie nebo gastrointestinální krvácení. Samotný vyšší věk není kontraindikací perorální antikoagulace; naopak, profit z této léčby s vyšším věkem pacienta stoupá (i když se zároveň zvyšuje i riziko krvácivých komplikací; 36). Dále je doporučeno podávat antikoagulancia pacientům po prodělaném kardioembolickém iktu bez spojitosti s FiS, pokud je vysoké riziko jeho recidivy (to se týká zejména pacientů do 3 měsíců po infarktu myokardu). Další skupinou pacientů indikovaných k antikoagulační léčbě jsou nemocní s ateromy aorty, fuziformním aneuryzmatem bazilární tepny, cervikální arteriální disekcí nebo s PFO (foramen ovale patens) za přítomnosti potvrzené hluboké žilní trombózy nebo aneuryzmatu septa síní (37).
Přímé inhibitory trombinu (gatrany) a koagulačního faktoru Xa (xabany) – souhrnně NOAK – mají s warfarinem srovnatelnou nebo vyšší míru antitrombotické ochrany při významně vyšší bezpečnosti a komfortu léčby pro pacienta.
Pro tyto léky je, na rozdíl od warfarinu, typický rychlý nástup účinku, krátký poločas (viz tabulka), fixní dávkování a málo interakcí s jinými léky a potravinami. Není proto nutné pravidelné monitorování koagulačních parametrů. Všechny tyto léky mají přitom prokázanou noninferioritu pro vznik CMP nebo systémové embolizace vůči warfarinu, dabigatran ve studii RE-LY, rivaroxaban ve studii ROCKET AF, apixaban ze studie ARISTOTLE a poslední, edoxaban, dokumentovaný studií ENGAGE (38–41). Při preskripci nových antikoagulancií je nutno respektovat platná omezení, která zahrnují ještě doložení selhání efektu warfarinu (recidiva iktu nebo krvácivá komplikace) nebo potvrzení výrazné fluktuace hladiny INR při léčbě warfarinem.
V případě život ohrožujícího krvácivého stavu nebo nutnosti urgentního operačního výkonu lze antikoagulační efekt dabigatranu ze skupiny přímých inhibitorů trombinu vertovat monoklonální protilátkou iduracizumabem, která účinek dabigatranu selektivně a kompletně ruší. To ověřila studie REVERSE-AD a osvědčuje to klinická praxe použití idarucizumabu u nás i v zahraničí (42). U xabanů jsou přímá antidota ve fázi klinického testování.
Prevence cévní mozkové příhody je možná
Přestože text výše komentuje jenom vybrané důležité aspekty prevence ischemické cévní mozkové příhody, není rozsah článku malý. A to nejsou informace v jednotlivých odstavcích zdaleka kompletní. Jistě bychom mohli (a měli) toto pojednání rozšířit o roli kontroly diabetu při prevenci CMP, případně o chirurgické postupy a další, ale není smyslem „kopírovat učebnici“. Spíše bychom chtěli připomenout, že prevence iktu je možná, ale musí být komplexní. Podat jednoduchý a přitom úplný přehled opatření, která bychom měli mít na paměti, asi možné není. Zatímco režimová opatření účinkují univerzálně, farmakoterapii volíme individuálně podle konstelace rizikových faktorů a dalších charakteristik pacienta.
prof. MUDr. Michal Vrablík, Ph.D.
Centrum preventivní kardiologie, 3. interní klinika 1. LF UK a VFN Praha
Zdroje
1. Cífková R., Wohlfahrt P., Krajčoviechová A. a kol. Stav léčby CMP v ČR: pohled epidemiologa. Postgraduální medicína 2016; 3 : 45–49.
2. Ay H., Benner T., Arsava E. M., Furie K. L. et al. A computerized algorithm for etiologic classification of ischemic stroke: the Causative Classification of Stroke System. Stroke 2007; 38(11): 2979–2984.
3. Bojar M., Tomek A. Prevence chorob nervového a myoskeletálního systému. In: Preventivní medicína. 2. vydání. Maxdorf, Praha, 2010.
4. Piepoli M. F., Hoes A. W., Agewall S. et al. 2016 European Guidelines on cardiovascular disease prevention in clinical practice: The Sixth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of 10 societies and by invited experts) Developed with the special contribution of the European Association for Cardiovascular Prevention & Rehabilitation (EACPR). Atherosclerosis 2016; 252 : 207–274.
5. Blood Pressure Lowering Treatment Trialists’ Collaboration. Effects of ACE inhibitors, calcium antagonists and other blood pressure lowering drugs: results of prospectively designed overviews of randomised trials. Lancet 2000; 355 : 1955–1964.
6. Blood Pressure Lowering Treatment Trialists’ Collaboration. Effects of different regimens to lower blood pressure on major cardiovascular events in older and younger adults: meta‑analysis of randomised trials. BMJ 2008; 336 : 1121–1123.
7. ALLHAT Officers and Coordinators for the ALLHAT Collaborative Research Group. Major outcomes in high‑risk hypertensive patients randomized to angiotensin‑converting enzyme inhibitor or calcium channel blocker vs. diuretic. JAMA 2002; 288 : 2981–2997.
8. Dahlöf B., Sever P. S., Poulter N. R. et al.; the ASCOT investigators. Prevention of cardiovascular events with an antihypertensive regimen of amlodipine adding perindopril as required versus atenolol adding bendroflumethiazide as required, in the Anglo‑Scandinavian Cardiac Outcomes Trial‑Blood Pressure Lowering Arm (ASCOT‑BPLA): a multicentre randomised controlled trial. Lancet 2005; 366 : 895–906.
9. Jamerson K., Weber M. A., Bakris G. L., et al.; the ACCOMPLISH trial investigators. Benazepril plus amlodipine or hydrochlorothiazide for hypertension in high‑risk patients. N Engl J Med 2008; 359 : 2417–2428.
10. HOPE (Heart Outcomes Prevention Evaluation) Study Investigators. Effects of an angiotensin‑converting‑enzyme inhibitor, ramipril, on cardiovascular events in high‑risk patients. N Engl J Med 2000; 342 : 145–153.
11. PROGRESS Collaborative Group. Randomised trial of a perindopril‑based blood pressure lowering regimen among 6,105 individuals with previous stroke or transient ischaemic attack. Lancet 2001; 358 : 1033–1041.
12.Bultas J. Blokátory systému renin – angiotenzin – aldosteron v sekundární prevenci cévních mozkových příhod. Remedia 2009; 19 : 138–142.
13. Boutitie F., Oprisiu R., Achard J. M. et al. Does a change in angiotensin II formation caused by antihypertensive drugs affect the risk of stroke? A meta-analysis of trials according to treatment with potentially different effects on angiotensin II. J Hypertens 2007; 25(8): 1543–1553.
14. The ONTARGET Investigators. Telmisartan, ramipril, or both in patients at high risk for vascular events. N Engl J Med 2008; 358 : 1547–1559.
15. The Telmisartan Randomised Assessment Study in ACE Intolerant Subjects with Cardiovascular Disease (TRANSCEND) Investigators. Effects of the angiotensin - ‑receptor blocker telmisartan on cardiovascular events in high‑risk patients intolerant to angiotensin‑converting enzyme inhibitors: a randomised controlled trial. Lancet 2008; 372 : 1174–1183.
16. Yusuf S., Diener H. C., Sacco R. L. et al. the PROFESS study group. Telmisartan to prevent recurrent stroke and cardiovascular events. N Engl J Med 2008; 359 : 1225–1226.
17. Widimský J., Cífková R., Ceral J. a kol. Doporučení pro diagnostiku a léčbu arteriální hypertenze ČSH 2017. Hypertenze a KV prevence 2018; 7(Supplementum): 1–20.
18. Scandinavian Simvastatin Survival Study Group. Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease: the Scandinavian Simvastatin Survival Study (4S). Lancet 1994; 344 : 1383–89.
19. Cholesterol Treatment Trialists’Collaborators. Efficacy and safety of cholesterol-lowering treatment: retrospective meta-analysis of data from 90 056 participants of 14 randomised trials of statins. Lancet 2005; 366 : 1267–1278.
20. Amarenco P. The effects of statins in stroke prevention. Curr Opin Lipidol 2005; 16 : 614–618.
21. Mazighi M., Lavallée P. C., Labreuche J. et al. Statin therapy and stroke prevention: what was known, what is new and what is next? Curr Opin Lipidol 2007; 18 : 622–625.
22. Heart Protection Study Collaborative Group. MRC/ BHF Heart Protection Study of cholesterol-lowering with simvastatin in 5963 people with diabetes: a randomised placebo-controlled trial. Lancet 2003; 361 : 2005–2016.
23. Amarenco P., Bogousslavsky J., Callahan A. et al.; the SPARCL investigators. High-dose atorvastatin after stroke or transient ischemic attack. N Engl J Med 2006; 355 : 549–555.
24. Amarenco P., Goldstein L. B., Szarek M. et al.; the SPARCL Investigators. Effects of intense LDL-C reduction in patients with stroke or transient ischemic attack: the Stroke Prevention by Aggressive Reduction in Cholesterol Levels (SPARCL) trial. Stroke 2007; 38 : 3198–3204.
25. Ridker P. M., Danielson E., Fonseca F. A. H. et al.; the JUPITER study group. Rosuvastatin to prevent vascular events in men and women with elevated C-reactive protein. N ENgl J Med 2008; 359 : 2159–207.
26. Nassief A., Marsh J. D. Statin therapy for stroke prevention. Stroke 2008; 39 : 1042–1048.
27. Cannon C. P., Blazing M. A., Giugliano R. P. et al. Ezetimibe added to statin therapy after acute coronary syndromes. N Engl J Med 2015; 372 : 2387–2397.
28. Wendling P. ODYSSEY Outcomes: Alirocumab cuts CV events, all-cause death post-ACS. Medscape Medical News > Conference News, 2018 Mar 10.
29. Sabatine M. S., Giugliano R. P., Wiviott S. D. et al. Efficacy and safety of evolocumab in reducing lipids and cardiovascular events. N Engl J Med 2015; 372 : 1500–1509.
30. Bultas J., Karetová D. Protidestičková léčba – kde jsme a co můžeme očekávat. Remedia 2012; 2 : 104–114.
31. Antithrombotic Trialists’ Collaboration. Collaborative meta-analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients. BMJ 2002; 324(7329): 71–86. 32. Hass W. K., Easton J. D., Adams H. P. jr. et al.; the Ticlopidine Aspirin Stroke Study Group. A randomized trial comparing ticlopidine hydrochloride with aspirin for the prevention of stroke in high-risk patients. N Engl J Med 1989; 321 : 501–507.
33. CAPRIE Steering Committee. A randomised, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE). CAPRIE Steering Committee. Lancet 1996; 348(9038): 1329–1339.
34. Johnston S. C., Amarenco P., Albers G. W. et al.; SOCRATES Steering Committee and Investigators. Ticagrelor versus aspirin in acute stroke or transient Ischemic attack. N Engl J Med 2016; 375(1): 35–43.
35. Zhou X., Tian J., Zhu M. Z., He C. K. A systematic review and meta-analysis of published randomized controlled trials of combination of clopidogrel and aspirin in transient ischemic attack or minor stroke. Exp Ther Med 2017; 14(1): 324–332.
36. Čihák R., Haman L., Táborský M. Doporučené postupy ESC 2016 pro léčbu fibrilace síni formulované ve spolupráci s EACTS. Souhrn dokumentu připravený Českou kardiologickou společností. Cor et Vasa 2016; 58 : 728–771.
37. Bultas J., Karetová D. Farmakoterapie tromboembolických stavů. Maxdorf, Praha, 2015.
38. Connolly S. J., Ezekowitz M. C., Yusuf S. et al. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med 2009; 361(12): 1139–1151.
39. Patel M. R., Mahaffey K. W., Garg J. et al.; ROCKET AF Investigators. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med 2011; 365 : 883–891.
40. Granger C. B., Alexander J. H., McMurray A. C. et al. Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2011; 365(11): 981–992.
41. Giugliano R. P., Ruff C. T., Braunwald E. et al. Edoxaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2013; 369(22): 2093–2104.
42. Pollack C., Reilly P. A., van Ryn J. et al. Idarucizumab for dabigatran reversal – full cohort analysis. N Engl J Med 2017; 377(5): 431–441.
Štítky
Interné lekárstvo Kardiológia Neurochirurgia Neurológia Rádiodiagnostika Urgentná medicína
Článok vyšiel v časopiseCMP journal
Najčítanejšie tento týždeň
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
Najčítanejšie v tomto čísle- Prevence cévních mozkových příhod
- Nejčastější endovaskulární výkony pro léčbu iCMP – část 1. – Léčba stenóz krkavic
- Výživa u pacientů s CMP s následnou poruchou polykání
- Vývoj vzdělávání zaměstnanců přednemocniční péče v problematice CMP
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



