-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Lipofilné kvasinky rodu Malassezia a choroby kože.
I. Seboroická dermatitída
Lipophilic Yeasts of the Genus Malassezia and Skin Diseases.
I. Seborrhoeic DermatitisRecent technological advances have revived the interest in Malassezia yeasts and their clinical role, which has long been a matter of controversy because of their fastidious nature in vitro and relative difficulty in isolation, cultivation and identification. Lipophilic yeasts of the genus Malassezia form a part of normal microbial flora of healthy human (and animal) skin, but they also have been associated with several dermatological diseases, like seborrhoeic dermatitis and atopic dermatitis. Our understanding of the interactions between Malassezia and the host might provide new opportunities to better control these often chronically relapsing diseases.
Key words:
yeasts – Malassezia – seborrhoeic dermatitis.
Autoři: D. Buchvald
Působiště autorů: Detská dermatovenerologická klinika LFUK a DFNsP, Bratislava, Slovenská republika
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 59, 2010, č. 3, s. 119-125
Souhrn
Pokrok v laboratórnych technikách v ostatných rokoch oživil záujem o kvasinky rodu Malassezia a ich patogenetický potenciál, ktorý bol po dlhý čas zdrojom diskusií vzhľadom na náročnosť ich izolácie, in vitro kultivácie a identifikácie. Lipofilné kvasinky tvoria súčasť normálnej mikróbnej flóry zdravej ľudskej kože, ale bývajú spájané aj s viacerými kožnými chorobami, napríklad seboroickou dermatitídou alebo atopickou dermatitídou. Lepšie pochopenie vzájomných vzťahov medzi malasseziami a ich hostiteľom môže byť východiskom pre zavedenie nových postupov zabezpečujúcich lepšiu kontrolu týchto často chronicky recidivujúcich chorôb.
Kľúčové slová:
kvasinky – Malassezia – seboroická dermatitída.Úvod
Lipofilné kvasinky rodu Malassezia sú už desaťročia spájané s niektorými chorobami kože, podrobnejšiemu poznaniu ich patogenetického pôsobenia však dlho bránila relatívna náročnosť ich izolácie, kultivácie a identifikácie a z nej vyplývajúce časté zmeny v taxonómii ako aj skutočnosť, že tieto mikroorganizmy tvoria súčasť normálnej mikróbnej flóry ľudskej kože, ďalej sťažovali štúdium ich úlohy pri vzniku kožných chorôb. Až v ostatných rokoch sa s nástupom metód molekulovej biológie a genetiky významne rozšírili naše možnosti rozpoznať a charakterizovať jednotlivé druhy v rámci rodu Malassezia a súčasne sa oživil záujem o štúdium vzťahov medzi týmito kvasinkami a niektorými kožnými chorobami. V prvej časti dvojdielneho prehľadového článku bude venovaná pozornosť novým poznatkom biológie kvasiniek rodu Malassezia a ich úlohe v patogenéze seboroickej dermatitídy. V druhej časti budú zhrnuté súčasné poznatky o interakcii týchto kvasiniek s imunitným systémom hostiteľa a ich účasti na priebehu atopickej dermatittídy.
Taxonómia kvasiniek rodu Malassezia
Ako prvý opísal nález mykotických elementov na ložiskách kožnej choroby pityriasis versicolor v roku 1846 E. Eichstedt [26], ale mikroorganizmus bol pomenovaný až v roku 1853 Charlesom Robinom ako Microsporon furfur a názov Malassezia furfur pre neho ako prvý použil Francúz Henri Baillon v roku 1889 [5]. Dimorfizmus tejto huby bol dlho zdrojom nezrovnalostí v jej taxonómii – myceliálna fáza bola označovaná ako Malassezia a fáza kvasinky (spóry), považovaná za odlišný mikroorganizmus, bola R. Sabouraudom v roku 1904 pomenovaná Pityrosporum [53]. Až v roku 1977 boli publikované výsledky viacerých štúdií, ktorých autori za použitia definovaných médií dokázali in vitro konverziu medzi týmito dvoma fázami, a bol tak potvrdený dimorfný charakter huby [25]. Na základe týchto poznatkov sa od roku 1986 rod jednotne označuje ako Malassezia a boli do neho zaradené aj tri pôvodne rozlišované druhy rodu Pityrosporum (v tejto klasifikácii P. orbiculare a P. ovale splynuli s druhom M. furfur a zoofilný druh P. pachydermatis bol premenovaný na M. pachydermatis) [15]. Rodové meno bolo zvolené na počesť francúzskeho anatóma a histológa Louisa-Charlesa Malasseza (1842–1909), ktorý v roku 1874 tieto kvasinky opísal a poukázal na ich odlišnosť od rodu Microsporon, do ktorého boli vtedy zaraďované [42].
Od roku 1990 začali do rodu Malassezia k prvým dvom druhom (M. furfur a M. pachydermatis) pribúdať nové klinické izoláty, ktorých morfologické, biochemické a imunologické charakteristiky viedli k definovaniu rôznych sérovarov M. furfur [20] a opísaný bol aj nový druh M. sympodialis [57]. Vysoká variabilnosť kultivačných a biochemických vlastností množiaceho sa počtu izolovaných kmeňov mikroorganizmov výrazne prispievali k zneprehľadneniu ich klasifikácie. Francúzski mykológovia Jacques Guillot a Eveline Guého preto v roku 1995 vo svojej prelomovej štúdii zozbierali celkom 104 vzoriek izolovaných mikroorganizmov s rôznymi vlastnosťami a podrobili ich sekvenovaniu rRNA a porovnaniu nukleárnej DNA [29]. Výsledky použitých metód molekulovej biológie dokázali značné genetické rozdiely medzi izolátmi a okrem potvrdenia jestvovania troch už známych druhov (M. furfur, M. sympodialis a M. pachydermatis) umožnili definovať aj štyri nové druhy rodu Malassezia (M. globosa, M. obtusa, M. restricta a M. slooffiae) [28] – tabuľka 1. V ďalších rokoch boli potom, najmä vďaka japonským autorom, postupne izolované, charakterizované a formálne identifikované ako samostatné druhy M. dermatis [61], M. japonica [60], M. yamatoensis [59] a zo zvieracej kože M. nana [37]. V roku 2002 opísaný M. equi, izolovaný zo zdravej kože koňa [47], nebol doteraz formálne uznaný ako samostatný druh a jediný kmeň, ktorý bol deponovaný v National Collection of Yeast Cultures (NCYC) zbierke kvasinkových húb vo Veľkej Británii, už nejestvuje [14]. Ako ostatné boli z domácich zvierat izolované a identifikované dva druhy – M. caprae a M. equina [14].
Tab. 1. Vývoj klasifikácie kvasiniek rodu Malassezia (podľa [2]) Table 1. Evolution of the classification of Malassezia yeasts (adapted from [2]) ![Vývoj klasifikácie kvasiniek rodu Malassezia (podľa [2])
Table 1. Evolution of the classification of Malassezia yeasts (adapted from [2])](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/e115dde7fc600cb29317ca29d0c8547f.png)
Kvasinkové huby rodu Malassezia sa dnes na základe morfologických, biochemických a tinkčných vlastností (mnohovrstevnej štruktúry bunkovej steny, enteroblastického typu pučania s tvorbou golierika, ureázovej aktivity, farbenia diazóniovou modrou B) a predovšetkým výsledkov sekvenovania nukleárnych a mitochondriálnych rRNA génov ako aj génov kódujúcich špecifické proteíny zaraďujú do podkmeňa Ustilagomycotina (incertae sedis, bez zaradenia do triedy) oddelenia Basidiomycota [7, 36]. Do rodu sa v súčasnosti formálne zaraďuje 13 druhov, z toho 4 primárne zoofilné (M. pachydermatis, M. nana, M. caprae a M. equina). Nové metódy molekulovej biológie a genetiky však poukazujú na jestvovanie určitých podskupín aj v rámci v súčasnosti akceptovaných druhov a je pravdepodobné, že v budúcnosti môže dôjsť k vyčleneniu niektorých z týchto podskupín a sformovaniu nových druhov [1].
Biológia kvasiniek rodu Malassezia
Z morfologického hľadiska sú tieto kvasinky charakterizované veľmi hrubou bunkovou stenou, ktorá obsahuje mimoriadne vysoké množstvo lipidov, desaťnásobne vyššie ako Candida albicans [63]. Vonkajší povrch bunkovej steny je obalený lamelárnou, kapsule-podobnou štruktúrou tvorenou lipidmi, ktorá sa pravdepodobne zúčastňuje na procesoch adhézie kvasiniek ku korneocytom [45] a má schopnosť blokovať zápalovú reakciu hostiteľa inhibíciou produkcie zápalových cytokínov keratinocytmi [63]. Bunky vo fáze kvasinky majú tvar, ktorý sa opisuje ako fľaštičkovitý, ale môžu byť aj okrúhle alebo oválne, v závislosti na druhu mikroorganizmu (obr. 1). Rozmnožujú sa asexuálnou reprodukciou, pučanie je monopolárne a dcérske bunky sa tvoria následne vždy na tom istom mieste, zanechávajúc prominujúcu jazvu. Väčšina druhov je schopná tvoriť mycélium in vivo aj in vitro [19].
Obr. 1. Kultúra kvasiniek Malassezia pachydermatis (foto Dr. Čonková, Košice) Fig. 1. Culture of Malassezia pachydermatis yeasts (photo courtesy of Dr. Čonková, Košice) 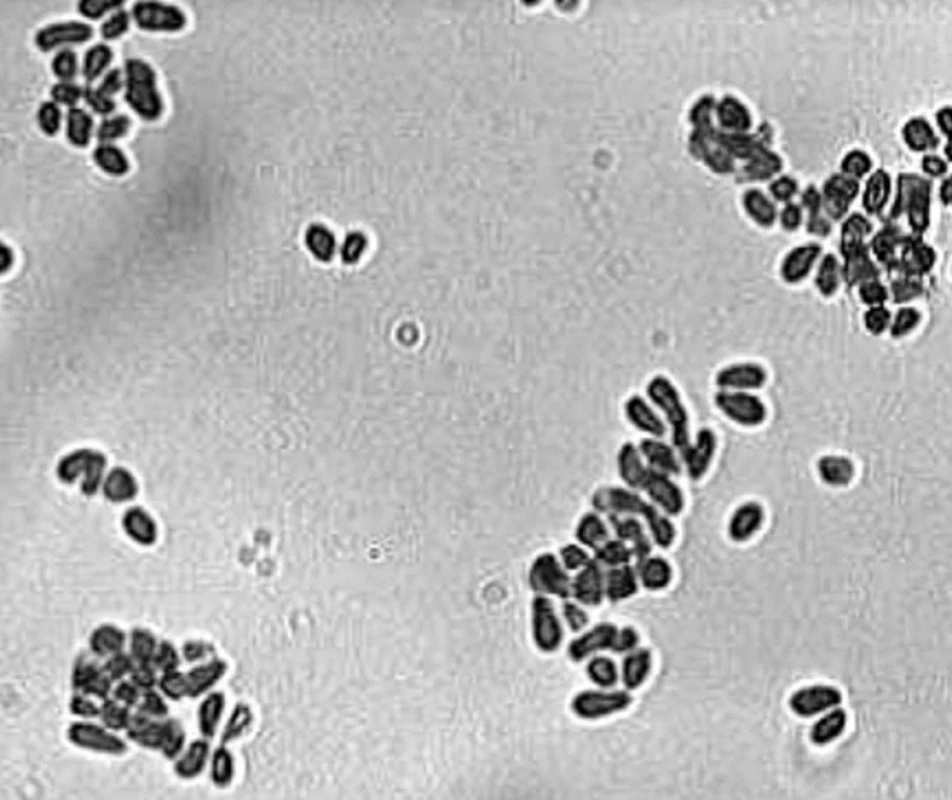
Z fyziologického hľadiska je charakteristickou vlastnosťou všetkých doteraz rozpoznaných druhov kvasiniek rodu Malassezia lipofilnosť. Súčasne sú všetky (s výnimkou M. pachydermatis) absolútne závislé na externom zdroji lipidov, pretože ich bunky nie sú schopné de novo syntetizovať štrnásť - a šestnásťuhlíkové (C14 a C16) nasýtené mastné kyseliny pre blok v syntéze kyseliny myristovej [56]. Sekvenovanie genómu M. globosa ukázalo, že kvasinke chýba gén kódujúci enzým syntetáza mastných kyselín [21]. Tieto mastné kyseliny kvasinky nevyhnutne potrebujú pre svoju existenciu (syntézu bunkovej steny) a ako ich zdroj musia využívať lipidy zo svojho mikroprostredia. Bohatým zdrojom tukových látok je kožný maz a koža človeka (a niektorých zvierat), ktorá tvorí vhodné prirodzené prostredie pre rast týchto kvasiniek. Rovnako aj pri kultivácii in vitro vyžadujú malassezie médium s obsahom lipidov a jednotlivé druhy sa líšia schopnosťou rastu na médiách suplementovaných rôznymi lipidmi [1]. Práve nepoznanie lipofilného charakteru bolo dlho príčinou neúspešných pokusov o in vitro kultiváciu malassezií, až kým v roku 1939 Rhoda Benham neukázala, že na rast týchto mikroorganizmov je nutný prídavok lipidov do kultivačného média [8]. Aj v súčasnosti je však najmä dlhodobejšia kultivácia niektorých druhov veľmi náročná a doteraz sa nepodarilo pripraviť univerzálne kultivačné médium, ktoré by dokázalo spoľahlivo zachytiť a udržať v kultúre všetky druhy kvasiniek rodu Malassezia.
Na štiepenie triacylglycerolov kožného mazu využívajú lipofilné kvasinky hydrolytické enzýmy lipázy. Na bunky viazaná (v rôznych frakciách bunkových ultrasonikátov) a/alebo do prostredia uvoľňovaná (supernatanty kultúr a/alebo tuhé kultivačné médium) lipázová aktivita bola doteraz dokázaná u kvasiniek M. furfur, M. pachydermatis, M. globosa a M. sympodialis a je veľmi pravdepodobné, že aj ostatné druhy malassezií syntetizujú tieto enzýmy [23]. Na génovej úrovni boli doteraz klonované a sekvenované gény MfLIP1 M. furfur [11], lipázy M. pachydermatis [55] a LIP1 M. globosa [23]. Sekvenovanie celého genómu M. globosa ukázalo prítomnosť génov pre 13 rôznych sekretovaných lipáz [64] a expresia génov pre viaceré lipázy bola pomocou reverznej polymerázovej reťazovej reakcie (PCR) dokázaná aj priamo v materiáli odobratom z oblasti štice [21].
Kvasinky rodu Malassezia produkujú viaceré metabolity, ktoré sa môžu uplatňovať pri ich interakcii s hostiteľským organizmom. Pri kultivácii za prítomnosti kyseliny olejovej syntetizujú dikarboxylovú kyselinu azelaovú, ktorá – okrem iných účinkov – pôsobí ako kompetitívny inhibítor enzýmu tyrozinázy [46]. Blokáda tohto kľúčového enzýmu melanogenézy môže mať za následok zníženú produkciu melanínu v melanocytoch hostiteľa a tvorbu hypopigmentovaných ložísk na koži.
Inými dôležitými metabolitmi produkovanými kvasinkami M. furfur ako aj niektorými kmeňmi iných druhov malassezií, ktoré boli kultivované za prítomnosti tryptofánu ako jediného zdroja dusíka, sú bioaktívne indolové alkaloidy s vlastnosťami fluorochrómov, resp. pigmentov (pityrialaktón, pityriacitrín, pityriarubíny, malassezín) [43, 44]. Tieto metabolity môžu, okrem ochrany kvasiniek pred účinkami ultrafialového žiarenia, ovplyvňovať zápalovú reakciu makroorganizmu. Pityriarubíny majú napríklad schopnosť inhibovať respiračné vzplanutie fagocytujúcich buniek hostiteľa [39].
Všetky druhy rodu Malassezia majú in vitro za prítomnosti L-DOPA v kultivačnom médiu schopnosť produkovať čierny, melanínu podobný pigment a melanizované kvasinky boli dokázané aj in vivo v materiáli z ložísk seboroickej dermatitídy [27]. Melanínové pigmenty patria medzi významné faktory virulencie mnohých patogénnych húb, zvyšujú ich odolnosť voči antimykotikám, znižujú vnímavosť na toxické pôsobenie reaktívnych metabolitov kyslíka generovaných počas imunitnej obrannej reakcie hostiteľa a chránia pred UV žiarením [40].
Ekológia lipofilných kvasiniek
Závislosť na externom zdroji lipidov obmedzuje možnosti prežitia lipofilných kvasiniek len na prostredie s dostatočným obsahom tukových látok zodpovedajúceho zloženia. Kožný maz predstavuje bohatý zdroj triacylglycerolov a kvasinky rodu Malassezia sa prispôsobili na život v mikroprostredí najpovrchovejších rohových vrstiev epidermy pokrytej tenkým filmom emulzie potu a kožného mazu. Väčšina druhov malassezií tvorí súčasť normálnej mikróbnej flóry ľudskej aj zvieracej kože [7, 17, 18], niektoré boli doteraz dokázané len na koži rôznych teplokrvných zvierat [14, 37]. Všetky však už boli izolované aj z chorobných ložísk na koži človeka, resp. zvieraťa [16, 30]. Modernými metódami je možno priamo v materiáli z povrchu jednej oblasti kože človeka identifikovať priemerne 2–3 rôzne druhy malassezií [62].
Postupná identifikácia nových druhov malassezií podnietila štúdie zamerané na zistenie prípadných rozdielov v kolonizácii zdravej ľudskej kože rôznymi druhmi týchto mikroorganizmov. Podľa výsledkov tureckých autorov bolo už v prvom mesiaci života lipofilnými kvasinkami (najčastejšie M. furfur) kolonizovaných 37 % zdravých dojčiat [4]. Naproti tomu, výsledky kanadskej štúdie označili za najčastejší druh lipofilnej kvasinky kolonizujúci zdravé deti vo veku do 3 rokov M. globosa [32]. Výsledky získané pri vyšetrení dospelých zdravých jedincov sú podobne rozdielne – ako celkove najčastejší druh malassezií kolonizujúcich túto vekovú skupinu rôzni autori zaznamenali M. restricta [58], M. sympodialis [32], respektíve M. globosa [3]. Naopak, izolácia M. furfur zo zdravej kože dospelého je veľmi zriedkavá [19]. Vo všeobecnosti, bez ohľadu na druh lipofilnej kvasinky, je malasseziami kolonizovaných 80–100 % zdravých dospelých jedincov [31, 33, 41, 54].
Kvasinky Malassezia a seboroická dermatitída
V ostatnom čase sa v súvislosti s kvasinkami Malassezia venovala pozornosť najmä dvom kožným chorobám – seboroickej dermatitíde a atopickej dermatitíde. Intenzívne štúdium tejto problematiky prinieslo mnoho nových poznatkov, ktoré poukazujú na rozdielny mechanizmus účasti malassezií na ich patogenéze.
Z klinických prejavov seboroickej dermatitídy sa zvyčajne izolujú rovnaké druhy lipofilných kvasiniek ako zo zdravej kože [54, 62]. V ložiskách dermatitídy sa pritom dokazujú signifikantne nižšie počty malassezií ako na nezapálenej koži [33, 62]. Je preto pravdepodobné, že medzi počtom kvasiniek, resp. konkrétnym druhom rodu Malassezia, na jednej strane a vznikom klinických prejavov choroby na strane druhej nejestvuje jednoduchá príčinná súvislosť [1].
Etiopatogenéza seboroickej dermatitídy bola až do nedávneho času nejasná. V roku 1979 Kligman charakterizoval vtedajšie poznatky lakonicky: „... choroba, o ktorej nie je nič známe, a čo bolo napísané, je nesprávne alebo nepodstatné“ [38]. Z účasti na nej boli už od čias Malasseza podozrievané lipofilné kvasinky, ale predovšetkým chýbanie korelácie medzi počtom týchto mikroorganizmov a závažnosťou priebehu ťažkostí pacienta bolo tým faktom, ktorý hovoril proti možnosti vzniku choroby v dôsledku priameho pôsobenia kvasiniek [22]. Ich účasti na etiopatogenéze však jednoznačne nasvedčovali dobré výsledky liečby choroby rôznymi antimykotikami [35] a úzka korelácia ústupu klinických ťažkostí s redukciou počtu kvasiniek na ošetrovanej koži [50]. Ukazovalo sa, že seboroická dermatitída nie je vyvolaná premnožením malassezií, ale abnormálnou odpoveďou hostiteľa na ich prítomnosť [10].
Niektorí autori poukazovali na možnú úlohu oslabenej celulárnej imunity pri vzniku seboroickej dermatitídy [48], čomu nasvedčuje aj vysoká prevalencia choroby u imunodeficientných pacientov s oslabenou bunkovou imunitou pri AIDS. Odlišná imunitná odpoveď však nebola ako možný patogenetický mechanizmus výsledkami iných štúdií potvrdená, medzi súbormi pacientov a zdravých osôb neboli signifikantné rozdiely v špecifickej protilátkovej ani bunkovej odpovedi na rôzne antigénové preparáty malassezií [9, 49]. Tieto kvasinky však majú schopnosť modulovať expresiu rôznych cytokínov, adhezínov a antimikróbnych proteínov keratinocytmi, a blokovať tak zápalovú reakciu hostiteľa [6, 24]. Tento mechanizmus im umožňuje saprofyticky prežívať na kožnom povrchu, či je však jeho zlyhanie súčasťou patogenézy seboroickej dermatitídy zatiaľ ostáva nezodpovedanou otázkou.
V súčasnosti sa za príčinu abnormálnej odpovede hostiteľa na prítomnosť lipofilných kvasiniek na koži považuje porušená epidermálna bariéra a následná zvýšená vnímavosť na dráždivé pôsobenie produktov metabolizmu malassezií. Komplexná etiopatogenetická teória je postavená na konvergencii troch faktorov – kožného mazu, kvasiniek rodu Malassezia a individuálnej vnímavosti jedinca na iritačné pôsobenie nenasýtených mastných kyselín [21].
Kožný maz jednoznačne zohráva úlohu pri vývoji seboroickej dermatitídy – jej prevalencia v závislosti od veku pacienta časovo koreluje s obdobiami najvyššej aktivity mazových žliaz a choroba predilekčne postihuje oblasti s najvyššou hustotou mazových žliaz. Na druhej strane, opakovane sa nepodarilo dokázať koreláciu medzi množstvom vyprodukovaného mazu a vývojom seboroickej dermatitídy [12, 13, 51] a jej príčina teda nespočíva v jednoduchej nadprodukcii mazu. Sebaceálne žľazy sekretujú na kožný povrch maz obsahujúci najmä triacylglyceroly, estery voskov, skvalén a prevažne nenasýtené voľné mastné kyseliny [65]. Kvasinky rodu Malassezia prostredníctvom sekretovaných lipáz degradujú dostupné triacylglyceroly, uvoľnené špecifické nasýtené mastné kyseliny využívajú pre svoj metabolizmus a nevyužité nenasýtené mastné kyseliny nechávajú na kožnom povrchu. Zmeny zloženia kožného mazu pôsobením malassezií, s nárastom zastúpenia voľných mastných kyselín a poklesom zastúpenia triacylglycerolov, sú reverzibilné a po úspešnej antimykotickej liečbe sa vracajú na pôvodné hodnoty [52]. Jedinci predisponujúci na vývoj seboroickej dermatitídy majú, v porovnaní s osobami bez tejto predispozície, vyššiu vnímavosť na iritačné pôsobenie nenasýtených mastných kyselín z kožného mazu. Dokazuje to možnosť vyvolať u seboroického pacienta, na rozdiel od nevnímavého jedinca, charakteristické, ultraštrukturálne so seboroickou dermatitídou identické ošupovanie v štici aplikáciou voľnej nenasýtenej mastnej kyseliny (napr. kyseliny olejovej), aj za preukázateľnej neúčasti malassezií [22]. Medzi jedincami vnímavými a nevnímavými na vývoj seboroickej dermatitídy teda jestvuje rozdiel v penetrácii a zápalovej odpovedi na mastné kyseliny. Jeho príčina nie je celkom jasná, ale predpokladá sa, že spočíva vo vrodenej poruche permeabilitnej bariéry epidermy [34].
Záver
Výsledky výskumu z ostatných rokov priniesli mnohé nové poznatky o taxonómii a biológii lipofilných kvasiniek rodu Malassezia a rovnako aj o ich úlohe v patogenéze seboroickej dermatitídy. Mnohé otázky však ostávajú nezodpovedané a ďalšie sa objavujú paralelne s rozširovaním našich vedomostí. Nové možnosti štúdia, ktoré prinášajú moderné techniky molekulovej biológie a genetiky, nám budú pomáhať pri hľadaní odpovedí a ešte hlbšom pochopení vzájomných vzťahov medzi lipofilnými kvasinkami a ľudskou kožou. Praktickým výstupom by malo byť rozšírenie našich možností terapeutického ovplyvnenia viacerých chronických, respektíve chronicky recidivujúcich kožných chorôb. [2]
MUDr. Dušan Buchvald, CSc.
Detská dermatovenerologická klinika LFUK a DFNsP
Limbová 1
833 40 BratislavaSlovenská republika
e-mail: buchvald@nextra.sk
Zdroje
1. Ashbee, H. R. Update on the genus Malassezia. Med. Mycol., 2007, 45, 4, p. 287–303.
2. Ashbee, H. R., Evans, E. G. Immunology of diseases associated with Malassezia species. Clin. Microbiol. Rev., 2002, 15, 1, p. 21–57.
3. Aspiroz, C., Moreno, L. A., Rezusta, A., Rubio, C. Differentiation of three biotypes of Malassezia species on human normal skin. Correspondence with M. globosa, M. sympodialis and M. restricta. Mycopathologia, 1999, 145, 2, p. 69–74.
4. Ayhan, M., Sancak, B., Karaduman, A., Arikan, S. et al. Colonization of neonate skin by Malassezia species: relationship with neonatal cephalic pustulosis. J. Am. Acad. Dermatol., 2007, 57, 6, p. 1012–1018.
5. Baillon, H. Traite de botanique medicale cryptogamique. Paris : Octave Doin, 1889, 376 p.
6. Baroni, A., Perfetto, B., Paoletti, I., Ruocco, E. et al. Malassezia furfur invasiveness in a keratinocyte cell line (HaCat): effects on cytoskeleton and on adhesion molecule and cytokine expression. Arch. Dermatol. Res., 2001, 293, 8, p. 414–419.
7. Batra, R., Boekhout, T., Gueho, E., Cabanes, F. J. et al. Malassezia Baillon, emerging clinical yeasts. FEMS Yeast Res., 2005, 5, 12, p. 1101–1113.
8. Benham, R. W. The cultural characteristics of Pityrosporum ovale – a lipophylic fungus. J. Invest. Dermatol., 1939, 2, 4, p. 187–203.
9. Bergbrant, I. M., Andersson, B., Faergemann, J. Cell-mediated immunity to Malassezia furfur in patients with seborrhoeic dermatitis and pityriasis versicolor. Clin. Exp. Dermatol., 1999, 24, 5, p. 402–406.
10. Bergbrant, I. M., Faergemann, J. Seborrhoeic dermatitis and Pityrosporum ovale: a cultural and immunological study. Acta Derm. Venereol., 1989, 69, 4, p. 332–335.
11. Brunke, S., Hube, B. MfLIP1, a gene encoding an extracellular lipase of the lipid-dependent fungus Malassezia furfur. Microbiology, 2006, 152, 2, p. 547–554.
12. Burkhart, C. G., Burkhart, C. N. Qualitative, not quantitative, alterations of sebum important in seborrhoeic dermatitis. J. Eur. Acad. Dermatol. Venereol., 2009, 23, 4, p. 441–441.
13. Burton, J. L., Pye, R. J. Seborrhoea is not a feature of seborrhoeic dermatitis. Br. Med. J. (Clin. Res. Ed.), 1983, 286, 6372, p. 1169–1170.
14. Cabanes, F. J., Theelen, B., Castella, G., Boekhout, T. Two new lipid-dependent Malassezia species from domestic animals. FEMS Yeast Res., 2007, 7, 6, p. 1064–1076.
15. Cannon, P. F. International Commission on the Taxonomy of Fungi (ICTF): name changes in fungi of microbiological, industrial and medical importance. Part 2. Microbiol. Sci., 1986, 3, 9, p. 285–287.
16. Chen, T. A., Hill, P. B. The biology of Malassezia organisms and their ability to induce immune responses and skin disease. Vet. Dermatol., 2005, 16, 1, p. 4–26.
17. Crespo, M. J., Abarca, M. L., Cabanes, F. J. Occurrence of Malassezia spp. In horses and domestic ruminants. Mycoses, 2002, 45, 8, p. 333–337.
18. Crespo, M. J., Abarca, M. L., Cabanes, F. J. Occurrence of Malassezia spp. in the external ear canals of dogs and cats with and without otitis externa. Med. Mycol., 2002, 40, 2, p. 115–121.
19. Crespo-Erchiga, V., Delgado Florencio, V. Malassezia species in skin diseases. Curr. Opin. Infect. Dis., 2002, 15, 2, p. 133–142.
20. Cunningham, A. C., Leeming, J. P., Ingham, E., Gowland, G. Differentiation of three serovars of Malassezia furfur. J. Appl. Bacteriol., 1990, 68, 5, p. 439–446.
21. Dawson, T. L., Jr. Malassezia globosa and restricta: breakthrough understanding of the etiology and treatment of dandruff and seborrheic dermatitis through whole-genome analysis. J. Investig. Dermatol. Symp. Proc., 2007, 12, 2, p. 15–19.
22. DeAngelis, Y. M., Gemmer, C. M., Kaczvinsky, J. R., Kenneally, D. C. et al. Three etiologic facets of dandruff and seborrheic dermatitis: Malassezia fungi, sebaceous lipids, and individual sensitivity. J. Investig. Dermatol. Symp. Proc., 2005, 10, 3, p. 295–297.
23. DeAngelis, Y. M., Saunders, C. W., Johnstone, K. R., Reeder, N. L. et al. Isolation and expression of a Malassezia globosa lipase gene, LIP1. J. Invest. Dermatol., 2007, 127, 9, p. 2138–2146.
24. Donnarumma, G., Paoletti, I., Buommino, E., Orlando, M. et al. Malassezia furfur induces the expression of beta-defensin-2 in human keratinocytes in a protein kinase C-dependent manner. Arch. Dermatol. Res., 2004, 295, 11, p. 474–481.
25. Dorn, M., Roehnert, K. Dimorphism of Pityrosporum orbiculare in a defined culture medium. J. Invest. Dermatol., 1977, 69, 2, p. 244–248.
26. Eichstedt, E. Pilzbildung in der Pityriasis versicolor. Froriep neue Notizen aus dem Gebiete der Natur - und Heilkunde, 1846, 39, p. 270–271.
27. Gaitanis, G., Chasapi, V., Velegraki, A. Novel application of the Masson-Fontana stain for demonstrating Malassezia species melanin-like pigment production in vitro and in clinical specimens. J. Clin. Microbiol., 2005, 43, 8, p. 4147–4151.
28. Gueho, E., Midgley, G., Guillot, J. The genus Malassezia with description of four new species. Antonie van Leeuwenhoek, 1996, 69, 4, p. 337–355.
29. Guillot, J., Gueho, E. The diversity of Malassezia yeasts confirmed by rRNA sequence and nuclear DNA comparisons. Antonie van Leeuwenhoek, 1995, 67, 3, p. 297–314.
30. Gupta, A. K., Batra, R., Bluhm, R., Boekhout, T. et al. Skin diseases associated with Malassezia species. J. Am. Acad. Dermatol., 2004, 51, 5, p. 785–798.
31. Gupta, A. K., Bluhm, R., Summerbell, R. Pityriasis versicolor. J. Eur. Acad. Dermatol. Venereol., 2002, 16, 1, p. 19–33.
32. Gupta, A. K., Kohli, Y. Prevalence of Malassezia species on various body sites in clinically healthy subjects representing different age groups. Med. Mycol., 2004, 42, 1, p. 35–42.
33. Gupta, A. K., Kohli, Y., Summerbell, R. C., Faergemann, J. Quantitative culture of Malassezia species from different body sites of individuals with or without dermatoses. Med. Mycol., 2001, 39, 3, p. 243–251.
34. Harding, C. R., Moore, A. E., Rogers, J. S., Meldrum, H. et al. Dandruff: a condition characterized by decreased levels of intercellular lipids in scalp stratum corneum and impaired barrier function. Arch. Dermatol. Res., 2002, 294, 5, p. 221–230.
35. Hay, R. J., Graham-Brown, R. A. Dandruff and seborrhoeic dermatitis: causes and management. Clin. Exp. Dermatol., 1997, 22, 1, p. 3–6.
36. Hibbett, D. S., Binder, M., Bischoff, J. F., Blackwell, M. et al. A higher-level phylogenetic classification of the Fungi. Mycol. Res., 2007, 111, 5, p. 509–547.
37. Hirai, A., Kano, R., Makimura, K., Duarte, E. R. et al. Malassezia nana sp. nov., a novel lipid-dependent yeast species isolated from animals. Int. J. Syst. Evol. Microbiol., 2004, 54, 2, p. 623–627.
38. Kligman, A. M. Perspectives and problems in cutaneous gerontology. J. Invest. Dermatol., 1979, 73, 1, p. 39–46.
39. Kramer, H. J., Kessler, D., Hipler, U. C., Irlinger, B. et al. Pityriarubins, novel highly selective inhibitors of respiratory burst from cultures of the yeast Malassezia furfur: comparison with the bisindolylmaleimide arcyriarubin A. ChemBioChem, 2005, 6, 12, p. 2290–2297.
40. Langfelder, K., Streibel, M., Jahn, B., Haase, G. et al. Biosynthesis of fungal melanins and their importance for human pathogenic fungi. Fungal. Genet. Biol., 2003, 38, 2, p. 143–158.
41. Lee, Y. W., Yim, S. M., Lim, S. H., Choe, Y. B. et al. Quantitative investigation on the distribution of Malassezia species on healthy human skin in Korea. Mycoses, 2006, 49, 5, p. 405–410.
42. Malassez, L. Note sur le champignon du pityriasis simple. Arch. Physiol., 1874, 2, 1, p. 451–464.
43. Mayser, P., Tows, A., Kramer, H. J., Weiss, R. Further characterization of pigment-producing Malassezia strains. Mycoses, 2004, 47, 1–2, p. 34–39.
44. Mayser, P., Wille, G., Imkampe, A., Thoma, W. et al. Synthesis of fluorochromes and pigments in Malassezia furfur by use of tryptophan as the single nitrogen source. Mycoses, 1998, 41, 7–8, p. 265–271.
45. Mittag, H. Fine structural investigation of Malassezia furfur. II. The envelope of the yeast cells. Mycoses, 1995, 38, 1–2, p. 13–21.
46. Nazzaro-Porro, M., Passi, S. Identification of tyrosinase inhibitors in cultures of Pityrosporum. J. Invest. Dermatol., 1978, 71, 3, p. 205–208.
47. Nell, A., James, S. A., Bond, C. J., Hunt, B. et al. Identification and distribution of a novel Malassezia species yeast on normal equine skin. Vet. Rec., 2002, 150, 13, p. 395–398.
48. Neuber, K., Kroger, S., Gruseck, E., Abeck, D. et al. Effects of Pityrosporum ovale on proliferation, immunoglobulin (IgA, G, M) synthesis and cytokine (IL-2, IL-10, IFN gamma) production of peripheral blood mononuclear cells from patients with seborrhoeic dermatitis. Arch. Dermatol. Res., 1996, 288, 9, p. 532–536.
49. Parry, M. E., Sharpe, G. R. Seborrhoeic dermatitis is not caused by an altered immune response to Malassezia yeast. Br. J. Dermatol., 1998, 139, 2, p. 254–263.
50. Pierard, G. E., Arrese, J. E., Pierard-Franchimont, C., De Doncker, P. Prolonged effects of antidandruff shampoos – time to recurrence of Malassezia ovalis colonization of skin. Int. J. Cosmet. Sci., 1997, 19, 3, p. 111–117.
51. Pierard-Franchimont, C., Xhauflaire-Uhoda, E., Pierard, G. E. Revisiting dandruff. Int. J. Cosmet. Sci., 2006, 28, 5, p. 311–318.
52. Ro, B. I., Dawson, T. L. The role of sebaceous gland activity and scalp microfloral metabolism in the etiology of seborrheic dermatitis and dandruff. J. Investig. Dermatol. Symp. Proc., 2005, 10, 3, p. 194–197.
53. Sabouraud, R. Maladies de cuir chevelu. II. Les maladies desquamatives, pityriasis et alopecies. Paris: Masson, 1904, 646 p.
54. Sandstrom Falk, M. H., Tengvall Linder, M., Johansson, C., Bartosik, J. et al. The prevalence of Malassezia yeasts in patients with atopic dermatitis, seborrhoeic dermatitis and healthy controls. Acta Derm. Venereol., 2005, 85, 1, p. 17–23.
55. Shibata, N., Okanuma, N., Hirai, K., Arikawa, K. et al. Isolation, characterization and molecular cloning of a lipolytic enzyme secreted from Malassezia pachydermatis. FEMS Microbiol. Lett., 2006, 256, 1, p. 137–144.
56. Shifrine, M., Marr, A. G. The requirement of fatty acids by Pityrosporum ovale. J. Gen. Microbiol., 1963, 32, p. 263–270.
57. Simmons, R. B., Gueho, E. A new species of Malassezia. Mycol. Res., 1990, 94, 8, p. 1146–1149.
58. Sugita, T., Suzuki, M., Goto, S., Nishikawa, A. et al. Quantitative analysis of the cutaneous Malassezia microbiota in 770 healthy Japanese by age and gender using a real-time PCR assay. Med. Mycol., 2009, DOI: 10.1080/13693780902977976.
59. Sugita, T., Tajima, M., Takashima, M., Amaya, M. et al. A new yeast, Malassezia yamatoensis, isolated from a patient with seborrheic dermatitis, and its distribution in patients and healthy subjects. Microbiol. Immunol., 2004, 48, 8, p. 579–583.
60. Sugita, T., Takashima, M., Kodama, M., Tsuboi, R. et al. Description of a new yeast species, Malassezia japonica, and its detection in patients with atopic dermatitis and healthy subjects. J. Clin. Microbiol., 2003, 41, 10, p. 4695–4699.
61. Sugita, T., Takashima, M., Shinoda, T., Suto, H. et al. New yeast species, Malassezia dermatis, isolated from patients with atopic dermatitis. J. Clin. Microbiol., 2002, 40, 4, p. 1363–1367.
62. Tajima, M., Sugita, T., Nishikawa, A., Tsuboi, R. Molecular analysis of Malassezia microflora in seborrheic dermatitis patients: comparison with other diseases and healthy subjects. J. Invest. Dermatol., 2008, 128, 2, p. 345–351.
63. Thomas, D. S., Ingham, E., Bojar, R. A., Holland, K. T. In vitro modulation of human keratinocyte pro - and anti-inflammatory cytokine production by the capsule of Malassezia species. FEMS Immunol. Med. Microbiol., 2008, 54, 2, p. 203–214.
64. Xu, J., Saunders, C. W., Hu, P., Grant, R. A. et al. Dandruff-associated Malassezia genomes reveal convergent and divergent virulence traits shared with plant and human fungal pathogens. Proc. Natl. Acad. Sci. USA, 2007, 104, 47, p. 18730–18735.
65. Zouboulis, C. C., Schagen, S., Alestas, T. The sebocyte culture: a model to study the pathophysiology of the sebaceous gland in sebostasis, seborrhoea and acne. Arch. Dermatol. Res., 2008, 300, 8, p. 397–413.
Štítky
Hygiena a epidemiológia Infekčné lekárstvo Mikrobiológia
Článek Poděkování paní Haně Hájkové
Článok vyšiel v časopiseEpidemiologie, mikrobiologie, imunologie
Najčítanejšie tento týždeň
2010 Číslo 3- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Očkování proti virové hemoragické horečce Ebola experimentální vakcínou rVSVDG-ZEBOV-GP
- Koronavirus hýbe světem: Víte jak se chránit a jak postupovat v případě podezření?
-
Všetky články tohto čísla
- Aplikace metod molekulární genetiky v klinické mikrobiologii: zpráva z jednání Pracovní skupiny molekulární mikrobiologie – TIDE
- Vyšetření komárů na přítomnost arbovirů na jižní Moravě v letech 2006–2008
- Klíšťová encefalitida ve východočeském regionu a úskalí její mikrobiologické diagnostiky
-
Lipofilné kvasinky rodu Malassezia a choroby kože.
I. Seboroická dermatitída - Poděkování paní Haně Hájkové
- Perniciózní anémie – diagnostický přínos detekce autoprotilátek proti vnitřnímu faktoru a terčovému antigenu parietálních buněk žaludku H+/K+ ATPáze
- Výskyt protilátok proti vírusu Epsteina-Barrovej u detí a adolescentov so sekundárnou imunodeficienciou
- Herpes zoster v České republice – epidemiologie a klinické projevy
- Jednoduchá metoda k průkazu CD154 (CD40L) na lymfocytech v periferní krvi
- Odhalení pamětní desky prof. MUDr. Karla Rašky, DrSc., v jeho rodišti ve Strašíně na Šumavě
- Epidemie antraxu u uživatelů heroinu v UK
- Epidemiologie, mikrobiologie, imunologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle-
Lipofilné kvasinky rodu Malassezia a choroby kože.
I. Seboroická dermatitída - Perniciózní anémie – diagnostický přínos detekce autoprotilátek proti vnitřnímu faktoru a terčovému antigenu parietálních buněk žaludku H+/K+ ATPáze
- Herpes zoster v České republice – epidemiologie a klinické projevy
- Výskyt protilátok proti vírusu Epsteina-Barrovej u detí a adolescentov so sekundárnou imunodeficienciou
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



