-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Genetický a molekulový podklad vývoja autoimunitného diabetes mellitus
Genetic and molecular background in autoimmune diabetes mellitus
Type 1 diabetes mellitus (T1 DM) is caused by autoimmune-mediated and idiopathic beta-cell destruction of the pancreatic islets of Langerhans resulting in absolute insulin deficiency. Susceptibility to T1 DM is influenced by both genetic and environmental factors. It is generally believed that in genetically susceptible individuals, the disease is triggered by environmental agents, such as viral infections, dietary factors in early infancy, or climatic influences. Many candidate genes for diabetes have been reported; those within the Major Histocompatibility Complex being among the most important. The most common autoantigens are insulin, glutamic acid decarboxylase 65, insuloma-associated antigen 2, and zinc transporter ZnT8. The destruction of b-cells is mediated mainly by cellular mechanisms; antibodies only seem to reflect the ongoing autoimmune processes and are not directly involved in the tissue damage. They, however, appear prior to the onset of insulin deficiency which makes them suitable for use in the prevention of the disease.
Keywords:
autoantigens – autoantibodies – HLA alleles – insuline – B, T, and NKT cells
Autori: D. Kantárová 1,2; D. Prídavková 1; I. Ságová 1; M. Vrlík 2; J. Mikler 3; M. Buc 4
Pôsobisko autorov: I. interná klinika JLF UK a UNM, Martin, Slovensko 1; Martinské centrum imunológie, Martin, Slovensko 2; Klinika detí a dorastu JLF UK a UNM, Martin, Slovensko 3; Imunologický ústav LF UK, Bratislava, Slovensko SÚHRN 4
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 64, 2015, č. 3, s. 121-129
Kategória: Souhrnné sdělení
Súhrn
Diabetes mellitus 1. typu je choroba podmienená auto-imunitnou alebo idiopatickou deštrukciou pankreatických ostrovčekov, ktorá vyústi do absolútneho chýbania inzulínu. Vývoj choroby je podmienený genetickými a environmentálnymi faktormi. Všeobecne akceptovaným názorom je, že chorobu u geneticky predisponovaných jedincov spúšťajú environmentálne faktory, ako sú vírusová infekcia, diétne faktory v skorom detstve alebo klimatické vplyvy. Existuje niekoľko kandidátskych génov, z ktorých najvýznamnejšie sú gény hlavného histokompatibilného systému. Najčastejšími autoantigénmi sú inzulín, dekarboxyláza kyseliny glutámovej 65 a zinkový transportér ZnT8. Deštrukcia b-buniek pankreasu je sprostredkovaná bunkovými mechanizmami, protilátky sú pravdepodobne len odrazom prebiehajúcich autoimunitných procesov a do poškodenia tkaniva sa priamo nezapájajú. Objavujú sa však už pred nástupom klinických príznakov, čo umožňuje ich praktické využitie v prevencii choroby.
Kľúčové slová:
autoantigény – autoprotilátky – HLA-alely – inzulín – lymfocyty T a B – NKT-bunkyÚVOD
Diabetes mellitus je skupina metabolických porúch charakterizovaná predovšetkým chronickou hyperglykémiou, ktorá vzniká v dôsledku poruchy sekrécie inzulínu, poruchy účinku tohto hormónu alebo ich kombináciou. Chýbanie inzulínu a jeho nedostatočný účinok v tkanivách zapríčiní poruchu metabolizmu sacharidov, čo sa následne spája so vznikom poruchy metabolizmu tukov a bielkovín. Diabetes mellitus je najčastejšou príčinou slepoty, amputácií a zlyhania obličiek a je jedným z hlavných faktorov, prispievajúcich k zvýšenému výskytu kardiovaskulárnych chorôb a predčasných úmrtí [1].
Najnovšia klasifikácia diabetes mellitus podľa ADA (American Diabetes Association) a EASD (European Association for the Study of Diabetes) sa zakladá najmä na etiológii choroby (tab. 1) [2]. Diabetes mellitus 1. typu (T1 DM) vzniká primárne následkom deštrukcie β-buniek pankreasu a nedostatočnej sekrécie inzulínu. Podľa príčiny ich deštrukcie sa ďalej delí na dva podtypy, autoimunitný a idiopatický. Autoimunitný DM vzniká na podklade autoimunitnej deštrukcie β-buniek pankreasu, ktorá vyústi do ich ireverzibilnej deštrukcie (v našej populácii predstavuje až 95 % diabetikov 1. typu). Autoimunitná deštrukcia pankreatických β-buniek je ireverzibilná a bez komplexnej imunosupresívnej liečby ničí aj tkanivo transplantovaného pankreasu. Idiopatický DM sa vyznačuje tým, že pri ňom príčinu deštrukcie buniek pankreasu nepoznáme (5 % pacientov, typický je skôr pre africkú a ázijskú populáciu) [3, 4].
Tab. 1. Klasifikácia diabetes mellitus podľa ADA 2010 [2, 4] Table 1. ADA classification of diabetes mellitus, 2010 [2, 4] ![Klasifikácia diabetes mellitus podľa ADA 2010 [2, 4]
Table 1. ADA classification of diabetes mellitus, 2010 [2, 4]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/1c670381c5da5b5e2a104fa5603d253b.jpg)
T1 DM sa zvyčajne manifestuje akútnymi príznakmi hyperglykémie a absolútnou závislosťou na exogénnom inzulíne. U detí je deštrukcia β-buniek väčšinou takmer kompletná, zatiaľ čo u dospelých môže ešte niekoľko rokov pretrvávať zvyšková produkcia inzulínu – táto forma sa označuje ako latentný autoimunitný DM (latent autoimmune diabetes of adults, LADA) [5, 6, 7].
GENETICKÁ PREDISPOZÍCIA K T1 DM
Autoimunitný DM je choroba so silnou genetickou predispozíciou; opísalo sa viacero génov a génových oblastí, ktoré sa spájajú s vývojom choroby. Najvýznamnejšie postavenie majú gény prvej a druhej triedy hlavného histokompatibilného systému (HLA), aj keď v ostatnej dobe pribúdajú aj viaceré non-HLA gény. V databáze GWAS (genome-wide association studies) ich je v súčasnosti opísaných viac ako 70 [8, 9, 10, 11]; zatiaľ najaktuálnejší prehľad je v práci Zóka et al. 2013 [12] a viac informácií je možné nájsť na webovej stránke www.t1dbase.org. Viaceré z týchto génov sa exprimujú priamo v bunkách pankreatických ostrovčekov a táto expresia, spolu s vplyvmi prostredia, vyústi do deštrukcie a zániku β-buniek.
HLA-gény predstavujú až 40 % genetického rizika rozvoja T1 DM, pričom najsilnejšiu genetickú predispozíciu k autoimunitným chorobám predstavujú HLA gény druhej triedy (obr. 1). Jedinci s najvyšším rizikom vlastnia haplotyp DQA1*05 : 01 - DQBl*02 : 01 (DQ2), ktorý sa takmer vždy dedí spolu s DRBl*03 : 01 (DR3) alebo haplotyp DQA1*03 : 01 - DQBl *03 : 02 (DQ8) v spojení s DRBl*04 : 01 alebo DRBl*04 : 02 (DR4) [11, 13, 14]. Takýchto pacientov označujeme ako DR3/DR4, DO2/DQ8 heterozygotov a tento genotyp sa u diabetikov prvého typu vyskytuje najčastejšie: vlastní ho asi 40 % diabetických detí v porovaní s 2 % výskytom v zdravej populácii [9, 11, 15]. Na druhej strane niektoré HLA-alely sa spájajú s rezistenciou voči vývoju choroby; najsilnejšiu ochranu (dokonca aj u tých, ktorí vlastnia niektorých z predispozičných HLA-haplotypov) poskytuje haplotyp DQA1*01 : 02 - DQB1*06 : 02 - DRB1*15 : 01 (DQ6, DR15). Ak sa DQB1*06 : 02 raritne vyskytne u diabetika, choroba sa objavuje vo vyššom veku, a to aj u pacientov s dokázanou pozitivitou „diabetických“ autoprotilátok [9, 16].
Obr. 1. Schematické znázornenie genetickej oblasti hlavného histokompatibilného systému u človeka [8] Génová oblasť hlavného histokompatibilného systému u človeka – HLA (Human Leukocyte Antigens) sa nachádza na krátkom ramienku 6. chromozómu (6p21.3) a zahŕňa úsek DNA dlhý 3 600 kb (3,6 cM). Polymorfné gény vytvárajú oddelené skupiny – triedu I (telomericky) a triedu II (centromericky). Tieto dve oblasti sú oddelené ďalšou skupinou génov, ktoré zahrňujeme pod pojem „trieda III“. HLA-A, -B a -C reprezentujú klasické HLA lokusy triedy I, k lokusom triedy II patria HLA-DR (DRA, DRB), -DQ (DQA, DQB), a -DP (DPA, DPB). HLA oblasť triedy III zahŕňa gény pre niektoré gény komplementu C2, C4, B, proteíny tepelného šoku HSP70 a iné. Fig. 1. Diagrammatic representation of the human major histocompatibility complex genes [8] The genes encoding the human major histocompatibility complex – HLA (Human Leukocyte Antigens) are located on the short arm of chromosome 6 (6p21.3) in a 3 600 kb (3,6 cM) DNA fragment. The polymorphic genes group in two separate classes – telomeric class I and centromeric class II. These two classes are separated by another group of genes designated class III. HLA-A, -B and -C are classical class I HLA loci while HLA-DR (DRA, DRB), -DQ (DQA, DQB), and -DP (DPA, DPB) are classified into class II HLA loci. The class III HLA genes encode some complement components C2, C4, B, heat shock proteins HSP70, and others. ![Schematické znázornenie genetickej oblasti hlavného histokompatibilného systému u človeka [8] Génová oblasť hlavného histokompatibilného systému u človeka – HLA (Human Leukocyte Antigens) sa nachádza na krátkom ramienku 6. chromozómu (6p21.3) a zahŕňa úsek DNA dlhý 3 600 kb (3,6 cM). Polymorfné gény vytvárajú oddelené skupiny – triedu I (telomericky) a triedu II (centromericky). Tieto dve oblasti sú oddelené ďalšou skupinou génov, ktoré zahrňujeme pod pojem „trieda III“. HLA-A, -B a -C reprezentujú klasické HLA lokusy triedy I, k lokusom triedy II patria HLA-DR (DRA, DRB), -DQ (DQA, DQB), a -DP (DPA, DPB). HLA oblasť triedy III zahŕňa gény pre niektoré gény komplementu C2, C4, B, proteíny tepelného šoku HSP70 a iné.
Fig. 1. Diagrammatic representation of the human major histocompatibility complex genes [8] The genes encoding the human major histocompatibility complex – HLA (Human Leukocyte Antigens) are located on the short arm of chromosome 6 (6p21.3) in a 3 600 kb (3,6 cM) DNA fragment. The polymorphic genes group in two separate classes – telomeric class I and centromeric class II. These two classes are separated by another group of genes designated class III. HLA-A, -B and -C are classical class I HLA loci while HLA-DR (DRA, DRB), -DQ (DQA, DQB), and -DP (DPA, DPB) are classified into class II HLA loci. The class III HLA genes encode some complement components C2, C4, B, heat shock proteins HSP70, and others.](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/b11bc9b7eaf91987c5f0418c04f0578c.jpg)
V súčasnosti existuje aj niekoľko informácií o asociácii s T1 DM s poslednou skupinou HLA aliel druhej triedy – HLA-DP. HLA-DPB1*01 : 01, -DPB1*03 : 01 a -DPB1*02 : 02 sú pozitívne a HLA-DPB1*04 : 02 negatívne asociované s rozvojom choroby [17, 18, 19]. Sumárne môžeme konštatovať, že HLA-haplotypy sú asociované s vysokým, stredným, resp. nízkym rizikom, alebo dokonca s ochranou voči rozvoju T1 DM. Ich identifikáciu možno preto využiť aj v predikcii rozvoja choroby (tab. 2).
Tab. 2. Prehľad rizikových a protektívnych HLA haplotypov Table 2. Summary of high-risk and protective HLA haplotypes 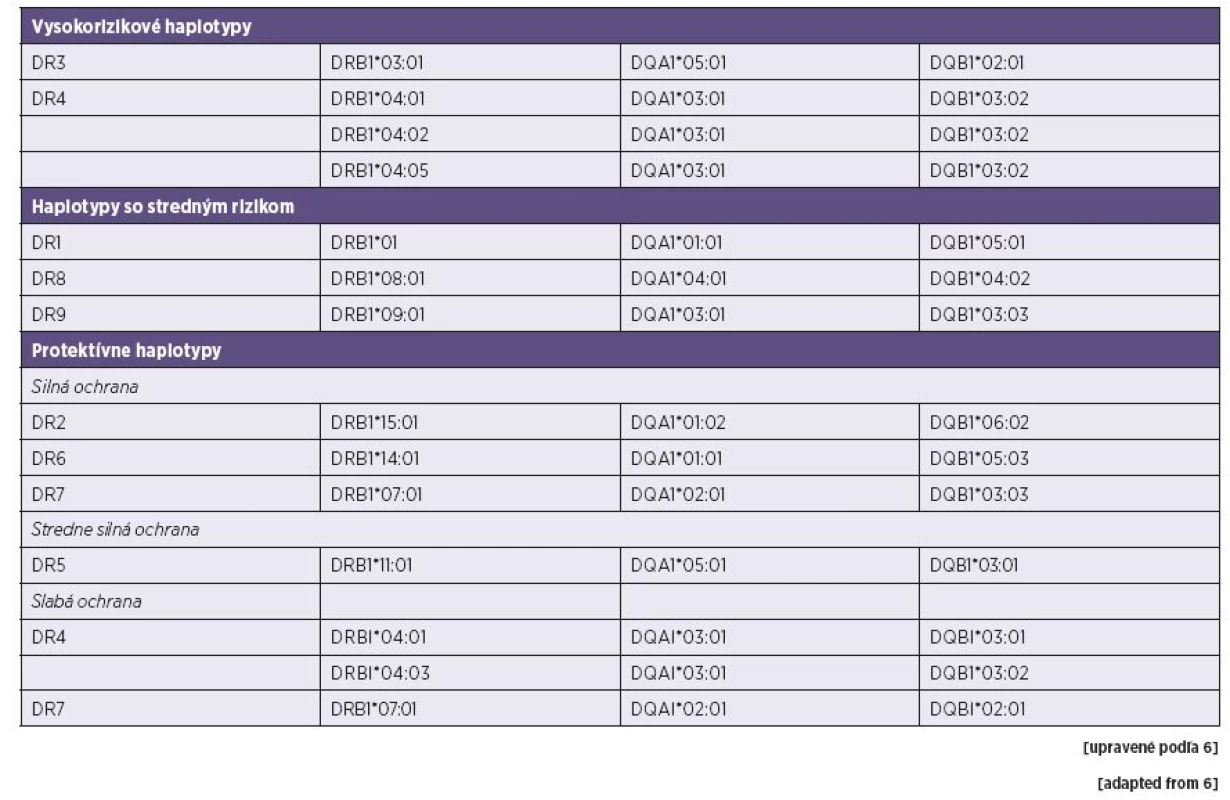
Kľúčová úloha HLA-génov v patogenéze autoimunitných chorôb sa zakladá na ich dôležitej funkcii v indukcii recesívnej (centrálnej) tolerancie, prezentácii antigénu a aktivácii pomocných T-lymfocytov. Strata tolerancie závisí od charakteru väzby špecifických peptidov do žliabku HLA-molekúl druhej triedy a ich prezentácii T-lymfocytom, ktoré ich rozpoznávajú svojimi antigénovými receptormi. Protektívne HLA-molekuly interagujú s tými autoreaktívnymi T-lymfocytmi, ktoré majú zvýšenú afinitu pre rozpoznávanie vlastných peptidov, čo zvýši negatívnu selekciu, t. j. ich deléciu. Súčasne sa vo zvýšenej miere vznikajú prirodzené regulačné T-lymfocyty (nTreg), ktoré dokážu tlmiť autoimunitnú odpoveď viacerými mechanizmami. Naopak, interakcia HLA-molekúl s nízkoafinitnými autoreaktívnymi T-lymfocytmi vedie k poruchám negatívnej selekcie a vývoja nTreg, čo vytvára stav predispozície k indukcii autoimunitných reakcií. Za únik autoreaktívnych T-lymfocytov z týmusu zodpovedá nestatočná väzba peptidov do žliabku HLA-molekúl [20]. Modifikácia autoantigénov, rovnako ako nadbytok jednotlivých antigénov (ako napr. inzulínu v tkanive pankreatických ostrovčekov), takisto napomáhajú úspešnej prezentácii epitopov autoreaktívnym T-lymfocytom [21].
Druhým susceptibilným lokusom významným v etio-patogenéze T1 DM je chromozóm 11p15.5 – inzulínový promotorový región. Táto oblasť je typická variabilným počtom tandemovo sa opakujúcich sekvencií nukleotidov (VNTR polymorfizmus, Variable Number of Tandem Repeats). Rozoznávame tri typy VNTR – VNTR I obsahuje 26–63 opakujúcich sa jednotiek (5’ - - - ACAGGGGTGGTGGGG - - - 3’), VNTR II 80 a VNTR III až 140–210 jednotiek. U jedincov homozygótnych pre VNTR I, v porovnaní s VNTR III homozygótnymi osobami, sa T1 DM vyskytuje častejšie; naopak VNTR II homozygótnosť sa spája s rezistenciou k vývoju choroby.
Expresia inzulínu (a iných autoantigénov) v týmuse a následná delécia autoreaktívnych T-lymfocytov počas procesu negatívnej selekcie je pod regulačným vplyvom génu AIRE (autoimunne regulator). Typ VNTR v promótorovej oblasti inzulínového génu pravdepodobne ovplyvňuje nadviazanie transkripčného faktora, ktorý AIRE-gén determinuje. Alely VNTR I môžu predisponovať k vývoju T1 DM pravdepodobne tým, že nedostatočne viažu AIRE, čo zapríčiní nižšiu transkripciu a tým aj expresiu inzulínu v dreňových bunkách týmusu s následnou neúplnou deléciou autoreaktívnych T-lymfocytov. Tieto sa takto dostanú do periférnych lymfoidných orgánov a po prípadnej aktivácii môžu spustiť autoimunitný proces, ktorý v konečnom dôsledku vedie ku klinicky manifestnej chorobe.
Na druhej strane prítomnosť VNTR III sa spája so zvýšenou expresiou proinzulínu v medulárnych epitelových bunkách týmusu, čo naznačuje koreláciu medzi úrovňou antigénu a negatívnou selekciou vysokoafinitných autoreaktívnych T-lymfocytov buniek. Opätovne to podporuje významnú úlohu recesívnej tolerancie v ochrane proti rozvoju autoimunitných reakcií voči inzulínu [10, 16]. V ostatnej dobe sa tetramérovou analýzou dokázalo, že diabetici, oproti jedincom vlastniacim protektívny variant VNTR polymorfizmu, majú vyššie hladiny inzulínovo-špecifických T-lymfocytov [22].
Ďalší predispozičný genetický región sa nachádza na dlhom ramienku 2. chromozómu (2q33) a obsahuje gén kódujúci CTLA-4 (cytotoxic T-lymphocyte antigen-4). Tento hrá dôležitú úlohu v regulácii imunitnej odpovede, predovšetkým pri supresívnych aktivitách FOXP3
+CD4+CD25+ regulačných T-lymfocytov. Genetické analýzy a korelácia polymorfizmu génu pre CTLA-4 s hladinami mRNA naznačuje, že za zvýšenú vnímavosť k vývoju T1 DM zodpovedá znížená hladina solubilného CTLA-4 ako aj prirodzených Treg-lymfocytov [23, 24].
PTPN 22 (protein tyrosine phosphatase non-receptor type 22) na 1. chromozóme (1p13) je štvrtým predispozičným “diabetickým” génom. Kóduje tyrozínovú fosfatázu významnú pri negatívnej kontrole aktivácie a vývoja T-lymfocytov [25,26]. Je významná najmä pri cytokínovej signalizácii (IL-2 a IL-15). PTPN22-variant asociovaný s výskytom T1 DM vedie k zníženiu fosforylácie STAT5 v T-lymfocytoch, čo narúša cytokínovú signalizáciu a môže ovplyvňovať prežívanie nTreg buniek, ktoré sú závislé od aktivity IL-2 [27].
IL-2 má v homeostáze T-lymfocytov paradoxnú funkciu – účinkuje totiž ako silný aktivátor ich rastu a zároveň ukončuje T-lymfocytovú odpoveď a navodzuje autotoleranciu. Druhá spomenutá funkcia bude pravdepodobne súvisieť s nutnosťou IL-2 signalizácie pri vývoji a fungovaní prirodzených regulačných T-lymfocytov, a preto nie je prekvapujúce, že genetická oblasť kódujúca a-reťazec receptora pre IL-2 (IL-2RA, CD25) na 10. chromozóme (10p14) je asociovaná s vývojom T1 DM [28]. U jedincov s predispozíciou k vývoju choroby pozorujeme 30–50 % pokles expresie CD25 pre-mRNA a aj samotného proteínu na aktivovaných pamäťových T-lymfocytoch a v menšej miere aj na nTreg-lymfocytoch. Navyše znížená expresia CD25 na pamäťových T-lymfocytoch u jedincov so susceptibilnými IL-2RA genotypmi sa spája aj s nižšou syntézou IL-2, čo môže pôsobiť synergicky s nižšou expresiou CD25 na nTreg-lymfocytoch a tak ďalej znižovať ich funkčnosť [29, 30].
Keďže signalizácia prostredníctvom IL-2 má kľúčovú úlohu pri vývoji nTreg-lymfocytov [31], asociácia s vývojom T1 DM je sprostredkovaná redukciou expresie IL-2 a IL2RA, ktorá narúša vývoj aj funkčnosť nTreg. Výsledky nedávnych štúdií potvrdili, že poruchy v IL-2 signalizácii majú vplyv aj na expresiu FOXP3-génu [27]. Porucha CD25 u diabetikov sa dá preto považovať za patogenetický mechanizmus, ktorý sa podieľa na rozvoji T1 DM u pacientov s IPEX-syndrómom. Ide o imunodefi-cientnú chorobu, ktorú spôsobuje mutácia vo FOXP3--géne (Xp11.23-q13.3.); výsledkom je porucha diferenciácie nTreg-lymfocytov. Klinicky sa manifestuje viacerými autoimunitnými chorobami vrátane T1 DM.
Ďalšia asociácia sa týka génu pre transkripčný faktor STAT4; ide o polymorfizmus jednotlivých nukleotidov (SNP), konkrétne rs7574865 G/T. Pozoroval sa zvýšený výskyt alely T [32,33]. STAT4 je dôležitý pre IL-12 signalizáciu a indukciu TH1-odpovede, ktorá u diabetikov sprostredkováva autoimunitný atak. Nedávno sa opísala ďalšia „podozrivá“ genetická oblasť – región TLR7 – TLR8 na chromozóme Xp22.2 [9] (www.t1dbase.org). Tieto gény kódujú intracelulárne receptory vírusovej RNA a DNA, resp. RNA apoptotických buniek [34,35]. Toto zistenie naznačuje, že rôzne vírusové infekcie by mohli, prostredníctvom zvýšenej hladiny interferónov prvého typu zvyšovať náchylnosť k autoimunitnej deštrukcii b-buniek a rozvoju T1 DM u jedincov vlastniacich susceptibilné gény. Sezónne rozdiely vo výskyte vírusových infekcií, rovnako ako ďalšie sezónne vplyvy (ako je znížená hladina vitamínu D v severských krajinách v priebehu zimných mesiacov) by rovnako mohli čiastočne vysvetliť dobre známu sezónnu variabilitu vo výskyte T1 DM [36].
Význam vírusov, resp. vírusovej infekcie, podčiarkuje aj asociácia s polymorfizmom génu IF1H1 (interferon induced with helicase C domain 1). U pacientov s va-riantom IF1H1 rs2111485 GG progreduje choroba do klinicky manifestného DM omnoho rýchlejšie (31 % do 5 rokov) v porovnaní s tými, ktorí vlastnia variant GA alebo AA [37]. IF1H1 gén kóduje vzorkové receptory MDA5 (melanoma differentiation associated gene 5), ktoré ovplyvňujú odpoveď na vírusovú infekciu. Receptory MDA5 rozpoznávajú určité druhy RNA, ktoré sa tvoria počas replikácie niektorých RNA vírusov. Molekula MDA5 sa aktivuje okrem iného aj enterovírusmi, ktoré sú známym environmentálnym spúšťačom autoimunitných procesov vedúcich k T1 DM [38, 39].
Na asociáciu T1 DM s infekciami spôsobovanými enterovírusmi upozornili výsledky pozorovaní, ktoré ukázali, že enterovírusová infekcia predchádzala rozvoju protiostrovčekých autoimunitných reakcií u viac ako 51 % pacientov v porovnaní s 28-% výskytom u zdravých [40, 41]. Začalo sa preto uvažovať sa o tom, že vírusy by mohli stáť na samom začiatku indukcie autoimunitnej odpovede voči pankreatickým β-bunkám. Túto predstavu podporuje aj existencia sekvenčnej zhody medzi molekulou glutamátdekarboxylázy a proteínom 2 Coxasckie vírusov (aminokyselinová pozícia 249–279). Táto sekvencia je u Coxsackie B4 vírusov vysoko konzervovaná a príslušný peptid sa viaže na molekulu HLA-DQ8, nie však na DQ7 [42]. Polymorfizmus DQb reťazca v pozícii 57 je spojený s rizikom, alebo, na druhej strane, s ochranou proti rozvoju choroby. Molekuly, ktoré v tejto pozícii obsahujú kyselinu asparágovú (HLA-DQ7), sú protektívne, zatiaľ čo molekuly, ktoré v tejto pozícii majú serín alebo alanín (HLA-DQ8) predstavujú pre vývoj T1 DM riziko [43, 44]. Tieto vírusy teda stoja za aktiváciou a proliferáciou T-lymfocytov špecifických pre daný vírusový epitop, ktorý je zhodný s proteínmi tvoriacimi pankreatické β-bunky (fenomén molekulového mimikri), čo vyústi do “útoku” cytotoxických T-lymfocytov proti β-bunkovým autoantigénom. Avšak neskôr sa ukázalo, že enterovírusy majú síce svoje miesto v patogenéze T1 DM, ale nie v dobe rozvoja autoimunitných procesov [45, 46]. Infekcia bude zodpovedať skôr za progresiu choroby, avšak iniciácia autoimunitných procesov a ich ďalšia progresia budú pravdepodobne sprostredkované rozdielnymi mechanizmami – zlyhaním mechanizmov autotolerancie.
Ako sa uvádza vyššie, alely kódujúce HLA-DQ6 patria medzi protektívne. K nim možno pridať aj ďalšie gény, konkrétne gén kódujúci IL-7R alpha [47] a gén pre delta 32 variant CCR5 [48].
K poznaniu patogenézy choroby môžu napomôcť gény, ktoré nie sú asociované s T1 DM. Pri Crohnovej chorobe a psoriáze, ale aj iných autoimunitných chorobách sa opísali predispozičné gény významné pri dozrievaní a aktivácii TH17-lymfocytov. Avšak štúdiom T1 DM databázy (www.t1dbase.org) a známych jednoduchých nukleotidových polymorfizmov (SNP) sa ukazuje, že tieto „TH17-gény“ nebudú asociované s touto chorobou. Rovnako ďalšie genetické oblasti, ako 4p15.5, 6q22.32, 7p15.2, 7p12.1, 10q23.31, 14q24.1, 16q23.1, 19q13.32, 20p11, 22q12.2 a Xq28, pravdepodobne neobsahujú gény významné v patogenéze T1 DM [9, 12].
AUTOIMUNITNÉ MECHANIZMY
Autoimunitný diabetes mellitus je výsledkom progresívnej straty funkčných pankreatických ostrovčekov. Autoimunitná reakcia je namierená proti viacerým zložkám pankreatických b-buniek. Pri tomto chronic-kom deštruktívnom procese má význam tak celulárna, ako aj humorálna zložka imunitnej odpovede. Po naštartovaní autoimunitných reakcií (ich odrazom je pozitivita autoprotilátok a progresívne znižovanie sekrécie inzulínu) môže do objavenia sa prvých kli-nických príznakov hyperglykémie prejsť ešte pomerne dlhý čas [49, 50].
Dôležitými charakteristickými črtami T1 DM sú infiltrácia pankreatických ostrovčekov makrofágmi a lymfocytmi a prítomnosť autoprotilátok proti viacerým β-bunkovým antigénom v plazme chorých [51, 52].
Zápalová infiltrácia pankreatického tkaniva, známa tiež ako inzulitída, je typickou črtou choroby. Ako prvé infiltrujú tkanivo pankreatických ostrovčekov mono-nukleárne bunky, predovšetkým makrofágy a dendritové bunky. Následne sa k nim pridávajú B - a T-lymfocyty (tak cytotoxické, ako aj pomocné) a spoločne indukujú periinzulitídu. Keď makrofágy a aktivované T-lymfocyty napadnú bunky pankreatických ostrovčekov produkujúce inzulín, nastupuje inzulitída. Tieto procesy prebiehajú v tzv. pred-diabetickej fáze a vedú postupne k úplnej deštrukcii β-buniek pankreasu a absolútnemu nedostatku endogénneho inzulínu [42, 53].
T-lymfocyty sa považujú za bunkovú populáciu s kľúčovým významom v patogenéze choroby [54, 55]. Infiltrácia pankreatických ostrovčekov T-lymfocytmi sa pôvodne opísala pri zvieracích modeloch (myši NOD a potkany BB) a až neskôr sa dokázalo, že predstavujú aj podstatnú časť bunkového infiltrátu u ľudí [56]. Odstránenie zrelých T-lymfocytov pri vyššie uvedených zvieracích modeloch zabránilo vzniku choroby [57, 58].
Patologický proces z veľkej časti závisí od prítomnosti autoreaktívnych CD8+ a CD4+ T-lymfocytových subpopulácií. Všeobecne sa CD8+ T-lymfocytom prikladá význam v priebehu počiatočných fáz patogenézy, zatiaľ čo CD4+ T-lymfocyty sú skôr potrebné aj na indukciu aj na udržiavanie autoimunitných procesov [49, 58, 59].
Infiltrácia ostrovčekov autoreaktívnymi T-lymfocytmi je pre rozvoj diabetes mellitus 1. typu nevyhnutná. Štúdie pri NOD-myšiach dokumentovali, že po vstupe T-lymfocytov do pankreatického tkaniva dochádza k de novo formovaniu lymfoidných folikulov, čo je typickou črtou progresívneho chronického zápalu. Experimentálne výsledky ďalej naznačujú, že interakcia medzi membránovým lymfotoxínom (LTa1b2) T-lymfocytov a ich receptorom (LTbR) v membráne stromálnych buniek je nevyhnutná pre vývoj a udržanie tohto lymfoidného mikroprostredia. Pri knock-out myšiach, ktoré neprodukujú lymfotoxín a pri normálnych myšiach, ktorým sa podával fúzny proteín obsahujúci receptor pre LTb (LTb receptor-immunoglobulin fusion protein = LTbR-Ig) bolo možné zvrátiť vývoj inzulitídy a predísť tvorbe lymfoidných folikulov, a to aj vtedy, keď už bola inzulitída rozvinutá [60, 61]. Gén LTA je u ľudí polymorfný. Z tohto dôvodu je zaujímavé pozorovanie, že LTA*1 alela je vo väzbovej nerovnováhe s haplotypom HLA-A1, -B8, -DR3 predisponujúcim k vývoju T1 DM [62].
Autoimunitné procesy začínajú aktiváciou autoreaktívnych T-lymfocytov, ktoré unikli negatívnej selekcii v týmuse a osídľujú periférne lymfoidné orgány. Neznámy inzult spôsobí uvoľnenie autoantigénov pankreatických β-buniek do prostredia. Bunky prezentujúce antigén (antigen presenting cells – APC, napr. dendritové bunky a makrofágy) ich pohltia a začnú migrovať do pankreatických lymfatických uzlín. Počas svojho presunu spracúvajú autoantigén a produkty tohto spracovania – peptidy sa viažu do žliabkov HLA-molekúl. Keď sa dostanú do lymfatických uzlín, aktivujú naivné autoreaktívne CD4+ a CD8+ T-lymfocyty.
CD8+ T-lymfocyty sa aktivovajú po rozpoznaní komplexu peptid + HLA molekula I. triedy v membráne APC a v prítomnosti IL-2 a ďalších cytokínov produkovaných autoreaktívnymi pomocnými CD4+-lymfocytmi. Následne proliferujú, diferencujú na zrelé cytotoxické CD8+ T-lymfocyty a migrujú do pankreatických ostrovčekov, ktoré deštruujú [21].
Výsledky štúdií o liečbe ťažkej inzulitídy použitím fúznych molekúl „LTbR-IgG1“ naznačujú, že migrácia buniek spôsobujúcich zápal do tkaniva pankreatických ostrovčekov je dynamický proces, v ktorom sa bunky neustále presúvajú dovnútra a von z cieľového tkaniva, čoho výsledkom je neustála kontinuálna aktivácia autoreaktívnych T-lymfocytov predtým nerozpoznanými autoantigénmi (šírenie epitopov) a ďalšie poškodenie tkaniva [60].
U mnohých jedincov s jasnými znakmi predklinického T1 DM však ku klinickým prejavom vôbec nedôjde. To naznačuje, že existuje možnosť, že títo jedinci môžu vyvinúť dostatočnú regulačnú imunitnú odpoveď na zvrátenie imunopatologického stavu. Avšak v tejto oblasti sú protichodné údaje. U diabetikov sa pozorovali aj normálne aj znížené počty nTreg-lymfocytov [63, 64, 65], rovnako aj ich regulačná činnosť sa hodnotila raz ako znížená a nedostatočná a raz ako normálna [66, 67, 68]. Je možné, že táto nesúrodosť výsledkov vyplýva aj z rôznych metodických a technologických postupov použitých v rôznych laboratóriách.
Makrofágy majú rovnako deštrukčný efekt ako cytotoxické T-lymfocyty, a to vďaka produkcii reaktívnych foriem kyslíka a dusíka. Aktivované makrofágy produkujú aj proinflamačné cytokíny, najmä TNF a IL-1 [69], ktoré pôsobia na pankreatické β-bunky priamo cytotoxicky. Naviac aj β-bunky samotné môžu byť zdrojom IL-1 (najmä ako reakcia na glukózu), čo môže ďalej akcelerovať deštruktívny proces potenciovaný hyperglykémiou. Hyperglykémia samotná zvyšuje expresiu prozápalových mediátorov a tie ďalej aktivujú imunitný systém a ničia β-bunky [70].
Interferóny prvého typu (IFN), ktoré sa tvoria v počiatočných fázach infekcie, parakrinným pôsobením znižujú vnímavosť susedných aj vzdialených buniek na infekciu vírusmi. Podobne skorá produkcia IFN-g môže navodiť protivírusovú obranu. Avšak interferónová odpoveď nielen znižuje vnímavosť β-buniek k vírusovej infekcii, ale zvyšuje aj expresiu HLA molekúl prvej triedy a chráni tak bunky pred útokom NK--buniek. Toto všetko naznačuje, že nedostatočná, resp. narušená antivírusová obrana β-buniek môže zvýšiť ich poškodenie, a viesť tak k uvoľneniu sekvestrovaných antigénov, ktoré sú následne terčom autoimunitných procesov [71].
iNKT-bunky sú populáciou T-lymfocytov, ktorá má niektoré spoločné vlastnosti s NK - bunkami. Ku kľúčovým charakteristikám patrí prítomnosť variabilného génu pre antigénový receptor T-lymfocytov, CD1d reštrikcia a masívna produkcia cytokínov (najmä IL-4 a IFN-γ) [72]. Vďaka tejto schopnosti sa iNKT-bunky zúčastňujú regulácie imunitnej odpovede, môžu ovplyvniť polarizáciu pomocných T-lymfocytov a tým výrazne prispieť k rozvoju autoimunitných procesov. Analýzy iNKT-buniek u diabetikov podľa niektorých autorov vykazujú znížené počty aj funkčnosť, v ďalších štúdiách sa však tieto sledovania úplne nepotvrdili [73, 74]. Aj napriek tomu však štúdie na zvieracích myších modeloch prinášajú sľubné výsledky a naznačujú, že úprava hladiny iNKT buniek môže viesť k prevencii, resp. aj liečbe DM1 [75].
Hoci v patogenéze T1 DM mimoriadne významnú úlohu zohrávajú T-lymfocyty, svoje miesto tu majú aj B-lymfocyty. Ak sa NOD-myšiam, ktoré spontánne vyvíjajú diabetes, zabráni, aby produkovali B-lymfocyty, napriek fyziologickým počtom T-lymfocytov, sa choroba nevyvinie [76]. Význam B-lymfocytov podčiarkuje aj skutočnosť, že aj u človeka [77] aj pri myšiach [78] podávanie monoklonových anti-CD20 protilátok zvráti progresiu choroby. Vzhľadom k tomu, že B-lymfocytmi sa nedá preniesť ani inzulitída, ani diabetes, plnia pravdepodobne nedeštruktívne funkcie; po vhodnej stimulácii a aktivácii plnia predovšetkým funkciu buniek prezentujúcich antigén [77, 79].
Autoprotilátky sa nachádzajú v plazme u 60–80 % pacientov (tab. 3), ale u časti z nich v dobe stanovenia diagnózy ich stále nesme schopní dokázať [80, 81]. Výskyt autoprotilátok je odrazom autoimunitného ataku voči pankreatickým b-bunkám, pričom ich množstvo odráža progresiu autoimunitnej deštrukcie. Prítomnosť len jednej protilátky voči niektorej zo štyroch hlavných antigénových skupín predstavuje len hranične zvýšené riziko, ktoré sa však výrazne zvyšuje, ak sa u detí zachytí pozitivita dvoch (alebo viacerých) autoprotilátok. Riziko vzniku choroby u prvostupňových príbuzných rastie z < 25 % na 25–50 % a > 50 % pri pozitivite jednej, dvoch alebo troch autoprotilátok. V rámci jednotlivých autoprotilátok sa s najvyšším rizikom vzniku choroby spája IA-2 (ICA512 alebo IA-2b alebo phogrin) [16, 49, 82] (tab. 4, tab. 5). Zároveň platí, že čím skôr sa protilátky objavia, tým rýchlejšie choroba progreduje [83]. Longitudinálne štúdie preukázali, že u detí s vysokým genetickým rizikom rozvoja choroby sa dajú autoprotilátky detegovať už pred 6. mesiacom života. U mnohých detí dôjde k sérokonverzii do troch rokov ich veku a takmer u všetkých približne do 7 rokov. Priemerný vek v čase stanovenia diagnózy je pritom 12 rokov [7].
Tab. 3. Frekvencia výskytu autoprotilátok u novodiagnostikovaných pacientov s diabetes mellitus 1. typu [2, 8] Table 3. Incidence of autoantibodies in patients newly diagnosed with type 1 diabetes mellitus [2, 8] ![Frekvencia výskytu autoprotilátok u novodiagnostikovaných pacientov s diabetes mellitus 1. typu [2, 8]
Table 3. Incidence of autoantibodies in patients newly diagnosed with type 1 diabetes mellitus [2, 8]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/9e00dbdd76a9fa284cacb32c9289f21b.jpg)
Skutočnosť, že nie u všetkých pacientov s autoprotilátkovou pozitivitou sa choroba aj vyvinie, naznačuje, že protilátky v patogenéze kľúčovú úlohu hrať nebudú. Dôkazom toho, že autoprotilátky priamo neprispievajú k poškodeniu β-buniek je aj skutočnosť, že transplacentárne prenesené autoprotilátky matiek-diabetičiek chorobu u ich detí nevyvolajú [1, 84].
Súčasti pankreatických β-buniek, ktoré môžu byť roz-poznávané ako potenciálne autoantigény, sú najmä inzulín alebo proinzulín, GAD65, IA-2 a ZnT8. Inzulín sa pritom identifikoval ako prvý autoantigén a pre b-bunky pankreasu je stále jediným špecifickým. Uvoľňuje sa po enzýmovom odštiepení tzv. C-peptidu (connecting peptide) z molekuly proinzulínu v sekrečnych granulách pankreasu. Autoprotilátky rozpoznávajú priamo molekulu inzulínu, dajú sa však len veľmi ťažko dokázať. Protilátky proti inzulínu (IAA, antibodies against insulin) sú jedným z najskorších klinických znakov choroby. Vyskytujú sa v sére u 60 % novodia-gnostikovaných pacientov ešte pred začatím liečby inzulínom. Ich hladina inverzne koreluje s vekom pacienta v dobe stanovenia diagnózy (s takmer 100 % záchytom u detí vo veku menej ako 5 rokov v porovnaní s 20 % pozitivitou vo vekovej skupine viac ako 15 rokov). Hladiny IAA rovnako odrážajú aj intenzitu autoimunitnej deštrukcie a v sére od pacientov sa nachádzajú už pred objavením sa prvých klinických príznakov. Z uvedeného vyplýva, že IAA majú svoje nesporné postavenie tak v diagnostike, ako aj v prevencii choroby [49, 84].
Dekarboxyláza kyseliny glutámovej s Mr 65 000 (GAD65) je enzým, ktorý konvertuje glutamát na g-aminomaslovú kyselinu. Exprimuje sa na pankreatických β-bunkách (ale aj na α - a δ-bunkách ostrovčekov) a predstavuje hlavný autoantigén. Protilátky proti GAD65 (GADA, glutamic acid decarboxylase antibodies) bývajú pozitívne v sére od pacientov s novodiagnostikovaným diabetom takmer v 80 % (viz tab. 3). Pri súčasnej pozitivite iných špecifických „diabetických“ autoprotilátok predstavuje takáto kombinácia vysoké riziko; pri izolovanej pozitivite GADA sa častejšie stretávame s pomalou progresiou choroby. Je zároveň najčastejšie zachytenou autoprotilátkou u pacientov s tzv. LADA [81, 84].
Tab. 4. Riziko vzniku diabetes mellitus 1. typu [10, 15] Table 4. Risk of type 1 diabetes mellitus [10, 15] ![Riziko vzniku diabetes mellitus 1. typu [10, 15]
Table 4. Risk of type 1 diabetes mellitus [10, 15]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/cb32c44ccfa04efdaf56ce17b4841a2d.jpg)
U 60–75 % novodiagnostikovaných pacientov zachytávame pozitivitu protilátok proti ostrovčekovému antigénu 512 (ICA 512 alebo IA-2), zatiaľ čo u zdravých jedincov sa jej záchyt pohybuje len okolo 2 %. ICA512 je molekula, ktorá sa podobá tyrozínovej fosfatáze, ale nemá enzýmovú aktivitu; exprimuje sa v pankrease a v mozgu. Molekula sa syntetizuje v dvoch variantoch, IA-2α a IA-2β (phogrin). Približne 10 % pacientov reaguje len voči jednému variantu, ostatní väčšinou tvoria autoprotilátky voči obom [16].
Najnovší autoantigén významný v patogenéze T1 DM je zinkový transporter 8 (ZnT8, zinc transporter 8). Jeho molekula sa nachádza v membráne sekrečnych granúl pankreasu a prenáša zinok, ktorý tvorí komplexy s inzulínom. Autoprotilátky ZnT8A (zinc transporter 8 antobodies) sa pozorovali u 60–80 % novodiagnostikovaných pacientov v porovnaní s 2 % v zdravej populácii. U jedincov sledovaných od narodenia po objavenie sa choroby sa objavili priemerne vo veku dvoch rokov (teda neskôr ako GADA alebo IAA). Stanovenie kombinácie autoprotilátok, t. j. ZnT8A, GADA, IA-2A a IAA, zvyšuje záchyt autoimunitných procesov až na 98 %. Pri tak vysokom záchyte sa dá o tomto vyšetrení uvažovať aj ako o preventívnom vyhľadávaní potenciálnych pacientov vo všeobecnej detskej populácii [83, 84, 85].
V detstve je autoimunitný diabetes charakteristický skorým výskytom autoprotilátok. Pozorovania ukazujú, že druhý vrchol výskytu sa objavuje v období puberty. Profil autoprotilátok proti antigénom pankreatických ostrovčekov u detí s „neskorým“ výskytom autoprotilátok je heterogénny a odlišný od mladších (1–2-ročných). Častá je pozitivita autoprotilátok proti jednej antigénovej skupine (najčastejšie proti GAD65 a inzulínu), bez reakcie voči ďalším ostrovčekovým proteínom. Objavenie sa autoprotilátok v útlom veku sa silne spája s predispozičnými HLA-alelami triedy II, na druhej strane pri neskoršom rozvoji autoimunity sa genotyp HLA-DRB1*04-DQB1*03 : 02 objavuje menej často.
Aj u starších jedincov bez pozitívnej rodinnej anamnézy výskytu T1 DM je badateľný trend k slabšej HLA--dominancii a heterogénnejšiemu autoprotilátkovému profilu [49] (viz tab. 4). Jedným z vysvetlení rozdielov súvisiacich s vekom pacientov a autoprotilátkovým spektrom je odlišnosť imunizácie a faktorov, ktoré vedú k rozvoju autoimunitných procesov (anti-inzulínových) vo veku jedného roku a tých, ktoré spôsobujú anti-GAD65 reakcie vo veku 11 a viac rokov. Existuje možnosť, že prah pre spustenie imunitných reakcií voči ostrovčekovým antigénom v detstve je naprogramované už počas fetálneho života.
Tab. 5. Porovnanie typických čŕt autoimunitných reakcií v ranom detstve a v adolescentnom veku [41, 84] Table 5. Comparison of typical characteristics of autoimmune responses in early infancy and adolescence [41, 84] ![Porovnanie typických čŕt autoimunitných reakcií v ranom detstve a v adolescentnom veku [41, 84]
Table 5. Comparison of typical characteristics of autoimmune responses in early infancy and adolescence [41, 84]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/c6fec8983599a369266237fb32f42f14.jpg)
ZÁVER
V súčasnosti je jasné, že diabetes mellitis typu 1 je spôsobený komplexným autoimunitným procesom, ktorý spúšťajú zatiaľ nie presne definované environmentálne faktory u jedinca s predispozičným gene-tickým pozadím. Viaceré génové varianty sú roztrúsené v celom genóme a všeobecne pôsobia cez relatívne malé zmeny v expresii a/alebo funkcii. Tým naštartujú celý rad zmien v imunitnej odpovedi, do ktorej sú zahrnuté prakticky všetky typy buniek imunitného systému a ktorá nakoniec vrcholí v takmer úplnej deštrukcii β-buniek pankreasu [86]. Pochopenie tejto komplexnej poruchy je nevyhnutné v snahe o adekvátnu liečbu, resp. vyliečenie. Zavádzanie sofistikovaných technologických postupov laboratórnej medicíne a zdokonalenie štatistických metód iste v budúcnosti prinesie nové poznatky a dopomôže nám splniť tento cieľ.
Do redakce došlo dne 11. 2. 2015.
Adresa pre korešpondenciu:
MUDr. Ján Mikler, PhD.
Klinika detí a dorastu JLF UK a UNM
Kollárova 2
036 59 Martin
Slovenská republika
e-mail: mikler@unm.sk
Zdroje
1. TEDDY Study Group. The Environmental Determinants of Diabetes in the Young (TEDDY) Study. Ann New York Acad Scie, 2008;1150 : 1-13.
2. American Diabetes Association. Diagnosis and classification of diabetes mellitus. Diabetes Care, 2010;33(Suppl 1):S62–S69.
3. Hanafusa T, Imagawa A. Insulitis in human type 1 diabetes. Ann New York Acad Scie, 2008;1150 : 297–299.
4. American Diabetes Association. Standards of Medical Care in Diabetes – 2014. Diabetes Care, 2014; 37(S1):S14–S80.
5. Aguilera E, Casamitjana R, Ercilla G, et al. Adult-onset atypical (type 1) diabetes: additional insigh ts and differences with type 1A diabetes in a European Mediterranean population. Diabetes Care, 2004;27(5):1108–1114.
6. Atkinson MA, Eisenbarth GS. Type 1 diabetes: new perspectives on disease pathogenesis and treatment, Lancet, 2001 : 358(9277):221–229.
7. Todd JA, Knip M, Mathieu C. Strategies for the prevention of autoimmune type 1 diabetes. Diabet Med., 2011;28(10):1141–1143.
8. Kantarova D, Buc M. Genetic susceptibility to type 1 diabetes mellitus in humans. Physiological research, 2007;56(3):255–266.
9. Todd JA. Etiology of type 1 diabetes. Immunity, 2010;32(4):457–467.
10. Maier LM, Wicker LS. Genetic susceptibility to type 1 diabetes. Curr Opin Immunol, 2005;17(6):601–608.
10. Concannon P, Rich SS, Nepom GT. Genetics of type 1A diabetes. New Engl J Med, 2009;360(16):1646–1654.
11. Zoka A, Muzes G, Somogyi A, et al. Altered Immune Regulation in Type 1 Diabetes. Clin Develop Immunol, 2013;254874.
12. Buc M, Bucova M, Javor J, et al. Associations between HLA class II alleles and type 1 diabetes mellitus in the Slovak population. Endocr Regul, 2006;40(1):1–6.
13. Morran MP, Vonberg A, Khadra A, Pietropaolo M. Immunogenetics of type 1 diabetes mellitus. Mol Aspects Med., 2015; doi: 10.1016/j.mam.2014.12.004
14. Concannon P, Erlich HA, Julier C, et al. Type 1 diabetes: evidence for susceptibility loci from four genome-wide linkage scans in 1,435 multiplex families. Diabetes, 2005;54(10):2995–3001.
15. Ziegler AG, Nepom GT. Prediction and pathogenesis in type 1 diabetes. Immunity, 2010;32(4):468–478.
16. Stuchlikova M, Kantarova D, Michalkova D, et al. Association of HLA-DPB1 alleles with type I diabetes mellitus in Slovak population. Bratisl Lek Listy, 2006;107(3):73–75.
17. Noble JA, Valdes AM, Thomson G, Erlich HA. The HLA class II locus DPB1 can influence susceptibility to type 1 diabetes. Diabetes, 2009;49(1):121–125.
18. Valdes AM, Noble JA, Genin E, et al. Modeling of HLA class II susceptibility to Type I diabetes reveals an effect associated with DPB1. Genetic Epidemiol, 2001;21(3):212–223.
19. Tsai, S., Santamaria, P. MHC Class II Polymorphisms, Autoreactive T-Cells, and Autoimmunity. Front Immunol, 2013;4(321):Epub 2013/10/18.
20. Santamaria P. The long and winding road to understanding and conquering type 1 diabetes. Immunity, 2010;32(4):437–445.
21. Durinovic-Bello I, Wu RP, Gersuk VH, et al. Insulin gene VNTR genotype associates with frequency and phenotype of the autoimmune response to proinsulin. Genes Immunity, 2010;11(2):188–193.
22. Ueda H, Howson JM, Esposito L, et al. Association of the T-cell regulatory gene CTLA4 with susceptibility to autoimmune disease. Nature, 2003;423(6939):506–511.
23. Atabani SF, Thio CL, Divanovic S, et al. Association of CTLA4 polymorphism with regulatory T cell frequency. Eur J Immunol, 2005;35(7):2157–2162.
24. Bottini N, Musumeci L, Alonso A, et al. A functional variant of lymphoid tyrosine phosphatase is associated with type I diabetes. Nature genetics, 2004;36(4):337–338.
25. Smyth D, Cooper JD, Collins JE, et al. Replication of an associa-tion between the lymphoid tyrosine phosphatase locus (LYP//PTPN22) with type 1 diabetes, and evidence for its role as a general autoimmunity locus. Diabetes, 2004;53(11):3020–3023.
26. Long SA, Cerosaletti K, Bollyky PL, et al. Defects in IL-2R signaling contribute to diminished maintenance of FOXP3 expression in CD4(+)CD25(+) regulatory T-cells of type 1 diabetic subjects. Diabetes, 2010;59(2):407–415.
27. Vella A, Cooper JD, Lowe CE, et al. Localization of a type 1 diabetes locus in the IL2RA/CD25 region by use of tag single-nucleotide polymorphisms. Am J Hum Genet, 2005;76(5):773–779.
28. Dendrou CA, Wicker LS. The IL-2/CD25 pathway determines susceptibility to T1D in humans and NOD mice. J Clin Immunol, 2008;28(6):685–696.
29. Dendrou CA, Plagnol V, Fung E, et al. Cell-specific protein phenotypes for the autoimmune locus IL2RA using a genotype-selectable human bioresource. Nature Genet, 2009;41(9):1011–1015.
30. Sakaguchi S, Miyara M, Costantino CM, Hafler DA. FOXP3+ regulatory T cells in the human immune system. Nat Rev Immunol, 2010;10(7):490–500.
31. Zervou MI, Mamoulakis D, Panierakis C, et al. STAT4: a risk factor for type 1 diabetes? Human Immunol, 2008;69(10),647–650.
32. Korman BD, Alba MI, Le JM, et al. Variant form of STAT4 is associated with primary Sjogren’s syndrome. Genes Immunity, 2008;9(3):267–270.
33. Sandor F, Buc M. Toll-like receptors. I. Structure, function and their ligands. Folia Biol, 2005;51(5):148–157.
34. Swiecki M, McCartney SA, Wang Y, Colonna M. TLR7/9 versus TLR3/MDA5 signaling during virus infections and diabetes. J Leukocyte Bio, 2011;90(4):691–701.
35. Svoren BM, Volkening LK, Wood JR, Laffel LM. Significant vitamin D deficiency in youth with type 1 diabetes mellitus. J Pediatrics, 2009;154(1):132–134.
36. Winkler C, Lauber C, Adler K, et al. An interferon-induced helicase (IFIH1) gene polymorphism associates with different rates of progression from autoimmunity to type 1 diabetes. Diabetes, 2011;60(2):685–690.
37. Witso E, Tapia G, Cinek O, et al. Polymorphisms in the innate immune IFIH1 gene, frequency of enterovirus in monthly fecal samples during infancy, and islet autoimmunity. PloS One, 2011;6(11):e27781.
38. Anagandula M, Richardson SJ, Oberste MS, et al. Infection of human islets of langerhans with two strains of coxsackie B virus serotype 1: Assessment of virus replication, degree of cell death and induction of genes involved in the innate immunity pathway. J Med Virol, 2014, 86(8):1402–1411.
39. Salminen K, Sadeharju K, Lonnrot M, et al. Enterovirus infections are associated with the induction of beta-cell autoimmunity in a prospective birth cohort study. J Med Virol, 2003;69(1):91–98.
40. Yoon JW, Austin M, Onodera T, Notkins AL. Isolation of a virus from the pancreas of a child with diabetic ketoacidosis. New Engl J Med, 1979;300(21):1173–1179.
41. Kukreja A, Maclaren NK. Autoimmunity and diabetes. J Clin Endocrinol Metabolism, 1999 : 84(12):4371–4378.
42. Todd JA, Bell JI, McDevitt HO. HLA-DQ beta gene contributes to susceptibility and resistance to insulin-dependent diabetes mellitus. Nature, 1987;329(6140):599–604.
43. Cucca F, Muntoni F, Lampis R, et al. Combinations of specific DRB1, DQA1, DQB1 haplotypes are associated with insulin-dependent diabetes mellitus in Sardinia. Human Immunol, 1993;37(2):85–94.
44. Horwitz, M.S., Bradley, L.M., Harbertson, J., Krahl, T., Lee, J., Sarvetnick, N. Diabetes induced by Coxsackie virus: initiation by bystander damage and not molecular mimicry. Nat Med, 1998;4(7):781–785.
45. Heino L, Lonnrot M, Knip M, et al. No evidence of abnormal regulation of antibody response to coxsackievirus B4 antigen in prediabetic children. Clin Exp Immunol, 2001;126(3):432–436.
46. Hoe E, McKay FC, Schibeci SD, et al. Functionally significant dif-ferences in expression of disease-associated IL-7 receptor alpha haplotypes in CD4 T cells and dendritic cells. J Immunol, 2010;184(5):2512–2517.
47. Smyth DJ, Plagnol V, Walker NM, et al. Shared and distinct genetic variants in type 1 diabetes and celiac disease. New Engl J Med, 2008;359(26):2767–2777.
48. Stadinski B, Kappler J, Eisenbarth GS. Molecular targeting of islet autoantigens. Immunity, 2010;32(4):446–456.
49. Eisenbarth GS. Type I diabetes mellitus. A chronic autoimmune disease. New Engl J Med, 1986;314(21):1360–1368.
50. Haskins K, Bradley B, Powers K, et al. Oxidative stress in type 1 diabetes. Ann New York Acad Scie, 2003;1005 : 43–52.
51. Achenbach P, Bonifacio E, Ziegler AG. Predicting type 1 diabetes. Curr Diabetes Rep, 2005;5(2):98–103.
52. Kent SC, Chen Y, Bregoli L, et al. Expanded T cells from pan-creatic lymph nodes of type 1 diabetic subjects recognize an insulin epitope. Nature, 2005;435(7039):224–228.
53. Anderson MS, Bluestone JA. The NOD mouse: a model of immune dysregulation. Ann Revi Immunol, 2005;23 : 447–485.
54. Culina S, Brezar V, Mallone R. Insulin and type 1 diabetes: immune connections. Eur J Endocrinol., 2013; 168(2):R19–31.
55. Miyazaki A, Hanafusa T, Yamada K, et al. Predominance of T lymphocytes in pancreatic islets and spleen of pre-diabetic non-obese diabetic (NOD) mice: a longitudinal study. Clin Exp Immunol, 1985;60(3):622–630.
56. Like AA, Biron CA, Weringer EJ, et al. Prevention of diabetes in BioBreeding/Worcester rats with monoclonal antibodies that recognize T lymphocytes or natural killer cells. The J ExpMed, 1986;164(4):1145–1159.
57. Christianson SW, Shultz LD, Leiter EH. Adoptive transfer of diabetes into immunodeficient NOD-scid/scid mice. Relative contributions of CD4+ and CD8+ T-cells from diabetic versus prediabetic NOD.NON-Thy-1a donors. Diabetes, 1993;42(1):44–55.
58. Groen H, Klatter F, Pater J, et al. Temporary, but essential requirement of CD8+ T cells early in the pathogenesis of diabetes in BB rats as revealed by thymectomy and CD8 depletion. Clin Develop Immunol, 2003;10(2-4):141–151.
59. Wu Q, Salomon B, Chen M, et al. Reversal of spontaneous autoimmune insulitis in nonobese diabetic mice by soluble lymphotoxin receptor. J Exp Med, 2001;193(11):1327–1332.
60. Gommerman JL, Browning JL. Lymphotoxin/light, lymphoid microenvironments and autoimmune disease. Nat Rev Immunol, 2003;3(8):642–655.
61. Valdes AM, Thomson G, Barcellos LF. Genetic variation within the HLA class III influences T1D susceptibility conferred by high-risk HLA haplotypes. Genes Immunity, 2010;11(3):209–218.
62. Luczynski W, Stasiak-Barmuta A, Urban R, et al. Lower percentages of T regulatory cells in children with type 1 diabetes - preliminary report. Ped Endocrinol, Diabetes Metabol, 2009;15(1):34–38.
63. Vrabelova Z, Hrotekova Z, Hladikova Z, et al. CD 127 - and FoxP3+ expression on CD25+CD4+ T regulatory cells upon specific diabetogeneic stimulation in high-risk relatives of type 1 diabetes mellitus patients. Scand J Immunol, 2008;67(4):404–410.
64. Link M, Salur L, Kisand K, et al. Higher FoxP3 mRNA expression in peripheral blood mononuclear cells of GAD65 or IA-2 autoantibody-positive compared with autoantibody-negative persons. Apmis, 2008;116(10):896–902.
65. Putnam AL, Brusko TM, Lee MR, et al. Expansion of human regulatory T-cells from patients with type 1 diabetes. Diabetes, 2009;58(3):652–662.
66. Long SA, Walker MR, Rieck M, et al. Functional islet-specific Treg can be generated from CD4+CD25 - T cells of healthy and type 1 diabetic subjects. Eur J Immunol, 2009;39(2):612–620.
67. Schneider A, Rieck M, Sanda S, et al. The effector T cells of diabetic subjects are resistant to regulation via CD4+ FOXP3+ regulatory T cells. J Immunol., 2008; 181(10),7350–7355.
68. Ferencik M, Stvrtinova V, Hulin I, Novak M. Inflammation-a lifelong companion. Attempt at a non-analytical holistic view. Folia Microbiol, 2007;52(2):159–173.
69. Luo X, Herold KC, Miller SD. Immunotherapy of type 1 diabetes: where are we and where should we be going? Immunity, 2010;32(4):488–499.
70. Flodstrom M, Maday A, Balakrishna D, et al. Target cell defense prevents the development of diabetes after viral infection. Nature Immunol, 2002;3(4):373–382.
71. Gapin L, Godfrey DI, Rossjohn J. Natural Killer T cell obsession with self-antigens. Curr Opin Immunol, 2013;25(2):168–173.
72. Kukreja A, Costi G, Marker J, et al. NKT cell defects in NOD mice suggest therapeutic opportunities. J Autoimmun, 2002;19(3):117–128.
73. Oikawa Y, Shimada A, Yamada S, et al. High frequency of valpha24(+) vbeta11(+) T-cells observed in type 1 diabetes. Diabetes Care, 2002;25(10):1818–1823.
74. Diana J, Gahzarian L, Simoni Y, Lehuen A. Innate immunity in type 1 diabetes. Discov Med, 2011;11(61):513–520.
75. Serreze DV, Chapman HD, Varnum DS, et al. B lymphocytes are essential for the initiation of T cell-mediated autoimmune diabetes: analysis of a new “speed congenic” stock of NOD.Ig mu null mice. The Journal of experimental medicine, 1996;184(5), 2049–2053.
76. Pescovitz MD, Greenbaum CJ, Krause-Steinrauf H, et al. Rituximab, B-lymphocyte depletion, and preservation of beta-cell function. New Eng J Med, 2009;361(22):2143–2152.
77. Hu CY, Rodriguez-Pinto D, Du W, et al. Treatment with CD20-specific antibody prevents and reverses autoimmune diabetes in mice. J Clin Invest, 2007;117(12):3857–3867.
78. Hinman RM, Cambier JC. Role of B lymphocytes in the pathogenesis of type 1 diabetes. Curr Diab Rep., 2014;14(11):543–550.
79. Koczwara K, Bonifacio E, Ziegler AG. Transmission of maternal islet antibodies and risk of autoimmune diabetes in offspring of mothers with type 1 diabetes. Diabetes, 2004; 53(1):1–4.
80. Towns R, Pietropaolo M. GAD65 autoantibodies and its role as biomarker of Type 1 diabetes and Latent Autoimmune Diabetes in Adults (LADA). Drugs Future, 2011; 36(11):847.
81. Bingley PJ, Gale EA. Progression to type 1 diabetes in islet cell antibody-positive relatives in the European Nicotinamide Diabetes Intervention Trial: the role of additional immune, genetic and metabolic markers of risk. Diabetol, 2006;49(5):881–890.
82. Hummel M, Bonifacio E, Schmid S, et al. Brief communication: early appearance of islet autoantibodies predicts childhood type 1 diabetes in offspring of diabetic parents. Ann Int Med, 2004;140(11):882–886.
83. Ziegler AG, Hummel M, Schenker M, Bonifacio E. Autoantibody appearance and risk for development of childhood diabetes in offspring of parents with type 1 diabetes: the 2-year analysis of the German BABYDIAB Study. Diabetes, 1999;48(3):460–468.
84. Kawasaki E. Type 1 Diabetes and Autoimmunity. Clin Pediatr Endocrinol, 2014; 23(4):99–105.
85. Wållberg M, Cooke A. Immune mechanisms in type 1 diabetes. Trends Immunol, 2013;34(12):583–591.
Štítky
Hygiena a epidemiológia Infekčné lekárstvo Mikrobiológia
Článek Nové knihy
Článok vyšiel v časopiseEpidemiologie, mikrobiologie, imunologie
Najčítanejšie tento týždeň
2015 Číslo 3- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Očkování proti virové hemoragické horečce Ebola experimentální vakcínou rVSVDG-ZEBOV-GP
- Koronavirus hýbe světem: Víte jak se chránit a jak postupovat v případě podezření?
-
Všetky články tohto čísla
- Lidská prionová onemocnění v České republice
- Genetický a molekulový podklad vývoja autoimunitného diabetes mellitus
- Antigenní variabilita kmenů Bordetella pertussis izolovaných v letech 1967–2010 v České republice – možné vysvětlení vzestupu nemocnosti pertusí?
- Vyhodnocení epidemie spalniček v Ústeckém kraji
- Klonální analýza populace meningokoků z invazivního onemocnění a od zdravých nosičů izolovaných v České republice v období 1971 – 2014 (květen)
- Kampylobakteriózy na Klinice infekčních chorob Fakultní nemocnice Brno v letech 2011–2013: retrospektivní studie
- Klinická rezistence lidského cytomegaloviru při léčbě gancyklovirem u pacientů po alogenní transplantaci hematopoetických buněk – zkušenosti jednoho centra
- Hodnocení tvorby biofilmu vybraných patogenů vyskytujících se v potravinářském průmyslu
- Nové knihy
- Epidemiologie, mikrobiologie, imunologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Lidská prionová onemocnění v České republice
- Klinická rezistence lidského cytomegaloviru při léčbě gancyklovirem u pacientů po alogenní transplantaci hematopoetických buněk – zkušenosti jednoho centra
- Genetický a molekulový podklad vývoja autoimunitného diabetes mellitus
- Hodnocení tvorby biofilmu vybraných patogenů vyskytujících se v potravinářském průmyslu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



