-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Hodnocení tvorby biofilmu vybraných patogenů vyskytujících se v potravinářském průmyslu
Detection of biofilm formation by selected pathogens relevant to the food industry
Objective:
Detection of biofilm formation by microbial pathogens relevant to the food industry and comparison of biofilm formation under different conditions of culture.Material and methods:
The following microorganisms were selected for the study: Staphylococcus aureus, Listeria innocua, Listeria ivanovii, Cronobacter sakazakii, Cronobacter muytjensii, Arcobacter butzleri, Arcobacter cryaerophilus, Campylobacter jejuni, and Campylobacter coli. To detect biofilm formation the microtiter plate assay, as described by Christensen and culture on stainless steel coupons were used.Results:
The biofilm forming capacity was confirmed in all microorganisms tested, both on the microtiter plates and stainless steel coupons. Biofilm formation was influenced by the culture medium, material used, and culture duration as well as by the test microorganism. It was found that different species and strains of the same genus differ in biofilm formation. Differences were also found between the collection strains and isolates from the environment. Some bacteria tended to form biofilm more readily on the surface of the polyethylene microtiter plates and less readily on stainless steel coupons while others appeared to have an opposite tendency. Some pathogens were able to increase the planktonic cell density in the initial suspension even by three orders of magnitude within 72 hours while producing plenty of biofilm.Conclusions:
The study of biofilm formation by high risk pathogens is of utmost importance, not only to the food industry. From the obtained results, it is evident that bacterial biofilms form rapidly (within 24 hours in the present study). Due to their architecture, these biofilms are difficult to eradi-cate, and therefore, it is crucial to prevent biofilm formation.Keywords:
stainless steel – biofilm – pathogens – planktonic cells – microtiter plate
Autoři: L. Šilhová-Hrušková; P. Moťková; D. Šilha; J. Vytřasová
Působiště autorů: Katedra biologických a biochemických věd, Fakulta chemicko-technologická, Univerzita Pardubice
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 64, 2015, č. 3, s. 169-175
Kategorie: Původní práce
Souhrn
Cíl práce:
Účelem této studie bylo detekování biofilmu patogenních mikroorganismů vyskytujících se v potravinářském průmyslu a porovnání jeho tvorby při různých kultivačních podmínkách.Materiál a metody:
Ke studii byly zvoleny následující mikroorganismy – Staphylococcus aureus, Listeria innocua, Listeria ivanovii, Cronobacter sakazakii, Cronobacter muyt-jensii, Arcobacter butzleri, Arcobacter cryaerophilus, Campylobacter jejuni a Campylobacter coli. Pro detekci biofilmu vybraných mikroorganismů byla použita Christensenova metoda v mikrotitračních destičkách a metoda kultivace na kuponech z nerezové oceli.Výsledky:
U všech sledovaných mikroorganismů byla potvrzena schopnost tvorby biofilmu, a to jak v mikrotitračních destičkách, tak na kuponech z nerezové oceli. Tvorba biofilmu byla ovlivněna jak kultivačním médiem, použitým materiálem a dobou kultivace, tak samotným mikroorganismem. Bylo prokázáno, že různé druhy a kmeny téhož rodu tvoří biofilm rozdílně. Rozdíl byl zjištěn i při porovnání sbírkových kultur a izolátů z prostředí. Některé bakterie tvořily biofilm ve větší míře na povrchu polyetylenových mikrotitračních destiček a na nerezových kuponech pak méně, nebo tomu bylo naopak. Některé patogeny byly schopny zvýšit denzitu planktonních buněk původní suspenze během 72 hodin až o 3 řády a zároveň vytvořit velké množství biofilmu.Závěry:
Sledování tvorby biofilmu obávaných patogenů je velice důležité, a to nejen v potravinářském průmyslu. Podle získaných výsledků je zřejmé, že se bakteriální biofilmy formují již po relativně krátkém čase (v našem případě 24 hodin). Vzhledem ke struktuře těchto biofilmů je jejich likvidace velice náročná, je tedy žádoucí předcházet samotnému vzniku biofilmu.Klíčová slova:
nerezová ocel – biofilm – patogeny – planktonní buňky – mikrotitrační destičkaÚVOD
V posledních letech je tvorba biofilmu v potravinářském průmyslu vážným problémem. Jedná se o organizované systémy mikrobiálních buněk rostoucích na různých površích, jako jsou např. plasty, sklo, kovy a dřevo vystavované vlhkému prostředí [1–3]. Mikroby tvoří biofilm z řady důvodů, mezi které patří zejména snadnější výměna genetického materiálu a přenos živin mezi buňkami. Tato schopnost napomáhá k jejich přežití v jinak ne zcela vhodném prostředí, např. v potravinářském průmyslu na různém zařízení a v prostředí s nestandardními podmínkami. Dále tato struktura buněk zabraňuje přístupu např. biocidů a dezinfekčních látek, a jelikož je biofilm z velké části tvořen vodou, brání tak i vysychání [1, 2, 4–9].
Mezi faktory ovlivňující formování biofilmu patří vlastnosti buněk, povrch substrátu, složení a proudění okolního média. Nedostatečná hygiena technologického zařízení a prostředí (povrchy), která přicházejí do styku s potravinami, mohou tvorbu biofilmu podporovat [1, 2, 4, 5, 10, 11]. Zařízení pro zpracování potravin se vyrábí z mnoha různých materiálů, na které mohou bakterie adherovat. Jedná se především o nerezovou ocel, sklo, plast, pryž a jiné [12].
Mezi mikroorganismy, které jsou v potravinářských závodech nebezpečné z hlediska tvorby biofilmu, patří zejména stafylokoky, listerie, streptokoky, koliformní bakterie, kampylobaktery a arkobaktery. V závodech, kde se vyrábí dehydratovaná mléčná strava a dětské výživy, může činit problémy Cronobacter spp. [13–17].
Pokud se biofilm vyskytuje v potravinářských závodech, může při výrobě nebo balení potravin docházet k jeho uvolňování, a tím ke kontaminaci produktu. Mikrobiální kontaminací potravin dochází ke snížení jejich trvanlivosti a zvyšuje se riziko přenosu bakte-riálních infekcí [1, 4, 5, 18].
Sanitace povrchů a prostředí konvenčními metodami s využitím dezinfekčních prostředků je často neúčinná, jelikož bylo prokázáno, že bakteriální biofilmy vykazují zvýšenou rezistenci k vnějším vlivům [1, 2, 9]. V biofilmu mohou také buňky podstupovat fyziologické změny, kterými mohou opět zvyšovat jeho odolnost [19].
Cílem této studie byla detekce biofilmu patogenních mikroorganismů vyskytujících se v potravinářském průmyslu a porovnání jeho tvorby při různých kultivačních podmínkách. Stanovení bylo provedeno metodou podle Christensena v mikrotitračních destičkách [20, 21] a kultivační metodou na nerezových kuponech představujících povrch v potravinářské výrobně.
MATERIÁL A METODY
Testované kmeny a příprava bakteriální suspenze
Použité bakteriální kmeny byly získány ze sbírek – CCUG (Sbírka mikroorganismů Univerzity v Göteborgu, Švédsko), CCM (Sbírka mikroorganismů Masarykovy univerzity v Brně, Česká republika), ATCC (Americká sbírka mikroorganismů, Manassas, USA) a UPa (sbírka Univerzity Pardubice, Česká republika).
Bakteriální suspenze o denzitě 108 cfu×ml-1 (Staphylococcus aureus CCM 3953; Listeria innocua CCM 4030; Listeria ivanovii CCM 5884; Cronobacter sakazakii CCM 3461; Arcobacter cryaerophilus CCM 7050; Cronobacter muytjensii ATCC 51329; Arcobacter butzleri CCUG 30484; Arcobacter cryaerophilus UPa 2012/1 - izolát z odpadní vody; Arcobacter butzleri UPa 2013/7 – izolát z kuřecího krku) byly připraveny z 24 (48) hodinových kultur na TSA (trypton-sójový agar; Himedia; Indie), kultury termofilních kampylobakterů (Campylobacter jejuni CCM 6214; Campylobacter coli CCM 7227) byly připraveny z CAM agaru (Campylosel agar; Biomerieux; Francie). Pro kontrolu výchozí denzity připravených bakteriálních suspenzí byly suspenze vhodně naředěny a vyočkovány na TSA. Takto připravené misky byly kultivovány za optimálních podmínek podle sledovaného mikroorganismu. Po kultivaci byly jednotlivé kolonie spočítány.
Christensenova metoda v mikrotitračních destičkách
Modifikovanou Christensenovou metodou [20, 21] byla sledována tvorba biofilmu vybraných mikroorganismů v CASO bujónu (kasein-sójový bujón; Merck; Německo), BHI bujónu (mozko-srdcová infuze; Himedia; Indie) a peptonové vodě (PV) s 1 % NaCl. Pro toto stanovení byly použity polyetylenové mikrotitrační destičky (96 jamek) s plochým dnem (NunclonTM Surface; Německo).
Mikrotitrační destička byla promyta 96% etanolem. Po oschnutí byly bakteriální suspenze v testovaném živném médiu pipetovány po 100 µl do každé jamky. Souběžně byla vždy provedena negativní kontrola (nezaočkované médium). Následovala kultivace po dobu 2 a 6 dní při 25 °C za aerobních podmínek (v případě kampylobakterů za mikroaerofilních podmínek). Vždy před kultivací i po ní byla destička proměřena na spektrofotometru TECAN Infinite M 200 (Tecan Trading AG; Švýcarsko) při 620 nm (A620). Po proměření byla 3krát promyta sterilní destilovanou vodou (SDV), aby došlo k odstranění volných buněk a dále nechána 45 minut schnout. Obarvení vytvořeného biofilmu bylo provedeno 1% roztokem krystalové violeti (100 µl; 45 min; 25 °C). Po obarvení byla destička 5krát promyta SDV a nechána 30 minut volně schnout. Poté bylo do každé jamky pipetováno 200 µl 96% etanolu, po čemž byla destička 5 minut míchána na vortexu. Následně bylo z každé jamky pipetováno 100 µl do nové etanolem promyté destičky a vyhodnocováno pomocí spektrofotometru, a to měřením absorbance zbarveného roztoku při 620 nm, která koresponduje s množstvím vytvořeného biofilmu.
Dále byla sledována schopnost růstu vybraných mikro-organismů během kultivace v daných médiích, což bylo provedeno pravidelným měřením absorbance během formování biofilmu po celou dobu experimentu (6 dní). Schopnost růstu byla určena jako rozdíl absorbance suspenze na počátku kultivace a absorbance suspenze po kultivaci, a to s odečtením hodnoty absorbance negativní kontroly, aby nedocházelo k ovlivňování výsledků kultivačním médiem.
V rámci jednoho experimentu bylo provedeno celkem 8 opakování pro každé testované médium a bakterii (1 řada mikrotitrační destičky). Veškeré experimenty byly 4krát nezávisle opakovány.
Kultivace na kuponech z nerezové oceli
Ke sledování tvorby biofilmu na nerezových kuponech byla použita stejná média jako u metody Christensenovy. Vyjma kampylobakterů byly použity i shodné mikro-biální kmeny. Tato metoda podle Djordjevic et al. [22] byla dále modifikována.
Zkumavky se sterilními kupony (4 x 1 cm) a 9 ml živného média byly zaočkovány 1 ml bakteriální suspenze a kultivovány 72 hodin při 25 °C. Po kultivaci byly zkumavky 1 minutu vortexovány, poté bylo 100 µl vhodného ředění vyočkováno na TSA a provedena kultivace za optimálních podmínek.
Kupony byly ze zkumavek vyjmuty pomocí sterilní pinzety a opláchnuty 2 ml SDV. Biofilm byl z každé strany 10krát setřen vatovým tamponem, který byl následně vytřepán do 10 ml fosfátového pufru (2 min; vortex), 100 µl vhodného ředění bylo vyočkováno na TSA a kultivováno.
V rámci jednoho experimentu byly pro každý typ média použity 3 zkumavky. Veškeré experimenty byly dále 4krát nezávisle opakovány.
Hodnocení výsledků
Naměřené hodnoty u obou metod byly statisticky vyhodnoceny, a to pomocí programů Excel 2010 MS Office (Microsoft, USA) a Statistica 12 (StatSoft, USA). Extrémní hodnoty byly testovány Deanovým-Dixonovým testem a případné odlehlé hodnoty byly s pravděpodobností 95 % vyloučeny. Ze zbylých hodnot byl určen medián a směrodatná odchylka. U Christensenovy metody byl uvažován i možný zdroj chyb, čímž je vliv nedostatečného vymytí barviva, což vede k nárůstu absorbance. Stejně tak příliš vysoké absorbance v porovnání s ostatními hodnotami.
VÝSLEDKY
Christensenova metoda
K hodnocení výsledků tvorby biofilmu bylo pro jednotlivá média stanoveno tzv. cut-off score (ACOS), a to ACOSCASO = 0,084 ± 0,0015, ACOSBHI = 0,086 ± 0,0017 a ACOSPV+1%NaCl = 0,084 ± 0,0028. Bakteriální kmeny, jejichž A ≤ ACOS, byly považovány za negativní. Kmeny, u nichž platilo ACOS < A ≤ 0,1, byly považovány za slabě pozitivní (*); za středně pozitivní (**) byly považovány kmeny, jejichž absorbance byla 0,1 < A ≤ 0,15 a jako silně pozitivní (***) byly označeny ty kmeny, jejichž A > 2 x ACOS.
Po 48 hodinách kultivace v CASO bujónu byla největší tvorba biofilmu zaznamenána u L. ivanovii (A620 = 0,112 ± 0,0008**) a L. innocua (A620 = 0,110 ± 0,0006**). Následně u A. butzleri CCUG 30484 (A620 = 0,100 ± 0,0009*) a u St. aureus (A620 = 0,099 ± 0,0010*). Naopak nejmenší tvorba biofilmu byla zjištěna u Cr. muytjensii (A620 = 0,086 ± 0,0016*). U ostatních testovaných mikroorganismů nebyly větší rozdíly v míře tvorby biofilmu pozorovány. V BHI bujónu byla největší produkce biofilmu zaznamenána opět u L. ivanovii (A620 = 0,114 ± 0,0013**) a nejmenší znovu u Cr. muytjensii (A620 = 0,089 ± 0,0005*). Jinak tomu bylo v případě PV s 1 % NaCl, kde byla produkce biofilmu u St. aureus (A620 = 0,170 ± 0,0094***) výrazně vyšší ve srovnání s ostatními sledovanými mikroorganismy. Nejmenší tvorbu biofilmu vykazoval opět Cr. muytjensii (A620 = 0,093 ± 0,0004*). Po 6 dnech kultivace již takové rozdíly v produkci biofilmu nebyly patrné. V CASO a BHI bujónu bylo dosaženo obdobných výsledků jako po 48 hodinách kultivace. V peptonové vodě s 1 % NaCl byla zaznamenána největší tvorba biofilmu u St. aureus (A620 = 0,109 ± 0,0032**). Větší tvorba biofilmu byla zjištěna u L. ivanovii (A620 = 0,107 ± 0,0065**), C. jejuni (A620 = 0,106 ± 0,0042**) a C. coli (A620 = 0,102 ± 0,0046**).
Avšak u některých bakterií byla vlivem doby kultivace sledována změna v tvorbě biofilmu. Například St. aureus byl po 48 hodinách kultivace v PV s 1 % NaCl zařazen mezi silně pozitivní kmeny, ale po 6denní kultivaci byl zařazen mezi kmeny středně pozitivní. Naopak C. jejuni a C. coli se po 6denní kultivaci zařadili mezi středně pozitivní, přičemž po 48 hodinové kultivaci spadali do skupiny slabě pozitivních kmenů. U ostatních sledovaných kmenů zůstala tvorba biofilmu ve všech médiích a obou kultivačních časech na stejné úrovni.
Při sledování růstu planktonních buněk během 6 dnů kultivace v CASO bujónu (graf 1) byly zaznamenány různé hodnoty jejich nárůstu. Z grafu je zřejmé, že již po 48 hodinách kultivace nastal pokles absorbance u několika kmenů, což bylo pravděpodobně způsobeno vázáním planktonních buněk do rostoucího biofilmu. Největšího přírůstku bylo dosaženo u St. aureus (A620 = 0,607 ± 0,0301). U Cr. muytjensii bylo nejvyšší hodnoty absorbance dosaženo již po 24 hodinách (A620 = 0,435 ± 0,0221), dále pak docházelo k postupnému poklesu. Podobný trend byl zaznamenán i v případě L. ivanovii, obou kmenů A. butzleri a A. cryaerophilus. V případě L. innocua a Cr. sakazakii došlo k nárůstu absorbance po 24 hodinách, po 48 hodinách poklesla a po 72 hodinách se její hodnota začala opět zvyšovat. Po 6 dnech byla hodnota absorbance nejvyšší. U ostatních mikroorganismů nedocházelo během kultivace k významnějším změnám v měření optické denzity.
Graf 1. Sledování růstu planktonních buněk v CASO bujónu po dobu 6 dnů při teplotě 25 °C v mikrotitrační destičce Fig. 1. Growth of planktonic cells in CASO broth in a microtiter plate at 25 °C over six days 
Kultivace na kuponech z nerezové oceli
Výsledky (R) jsou vyjádřeny jako log cfu×cm-2. Podle dosažených hodnot R bylo možno vytvořit skupiny, do kterých byly podle masivnosti tvorby biofilmu bakteriální kmeny řazeny. Kmeny, u kterých platilo 2 < R ≤ 3, byly považovány za slabě pozitivní (*). Kmeny s 3 < R ≤ 4 byly považovány za středně pozitivní (**). Za silně pozitivní (***) byly považovány kmeny s 4 < R £ 5 a jako extrémně pozitivní (****) byly označeny kmeny s R > 5.
Graf 2 znázorňuje tvorbu biofilmu při kultivaci na kuponech z nerezové oceli. Sledované patogeny tvořily biofilm ve všech médiích, avšak v rozdílné míře. St. aureus tvořil oproti ostatním mikroorganismům nejvíce biofilmu v CASO bujónu (R = 5,412 ± 0,2711****) a BHI bujónu (R = 5,360 ± 0,2680****). Každý z testovaných kmenů listerií se choval naprosto odlišně. L. innocua tvořila biofilm nejméně v PV s 1 % NaCl (R = 3,684 ± 0,1842**) a nejvíce v CASO bujónu (R = 3,816 ± 0,1911**), zatímco u L. ivanovii bylo nejvíce biofilmu tvořeno v BHI bujónu (R = 4,559 ± 0,2283***) a nejméně v CASO bujónu (R = 3,544 ± 0,1771**). Naopak oba zástupci kronobakterů se chovali podobně a biofilm tvořili v obdobném trendu a ve shodné míře. Avšak nejméně v PV s 1 % NaCl (Cr. sakazakii R = 2,952 ± 0,1916*; Cr. muytjensii R = 2,8628 ± 0,2001*) a nejvíce v BHI bujónu (Cr. sakazakii R = 3,750 ± 0,1847**; Cr. muytjensii R = 3,753 ± 0,1941**). Jistá variabilita byla zaznamenána v tvorbě biofilmu mezi kmeny A. butzleri, kde izolát z kuřecího krku tvořil ve všech médiích více biofilmu než sbírkový kmen. Sbírkový A. butzleri CCUG 30484 tvořil nejvíce biofilmu v PV s 1 % NaCl (R = 3,120 ± 0,1564**) a nejméně v CASO bujónu (R = 2,581 ± 0,1292*). Izolát z kuřecího krku A. butzleri UPa 2013/7 tvořil nejvíce biofilmu v PV s 1 % NaCl (R = 3,662 ± 0,1833**) a téměř ve shodné míře v BHI bujónu a CASO bujónu. U testovaných kmenů A. cryaerophilus byla nejnižší absorbance naměřena u PV s 1 % NaCl a nejvyšší u CASO bujónu. Oba kmeny tvořily biofilm v podobném trendu.
Graf 2. Tvorba biofilmu vybraných mikroorganismů na kuponech z nerezové oceli po 72 hodinách kultivace při teplotě 25 °C Fig. 2. Biofilm formation by selected microorganisms on stainless steel coupons after 72 hours of culture at 25 °C 
Dále byla sledována denzita planktonních buněk (graf 3) v suspenzi před kultivací na nerezových kuponech a po ní. V případě St. aureus vzrostla denzita planktonních buněk oproti původní v CASO a BHI bujónu o 3 řády, v PV s 1 % NaCl o 2 řády. U obou listerií byl zaznamenán nárůst o 2 řády v CASO a BHI bujónu, v PV s 1 % NaCl o 1 řád. U obou kmenů testovaných kronobakterů byla zvýšena denzita planktonních buněk oproti původní ve všech médiích o 2 řády. V případě arkobakterů se množství planktonních buněk po kultivaci nezměnilo, a/nebo vzrostlo maximálně o 1 řád.
Graf 3. Porovnání denzity planktonních buněk před kultivací a po 72 hodinách kultivace při teplotě 25°C na nerezových kuponech (FR – fyziologický roztok) Fig. 3. Comparison of planktonic cell density at baseline and after 72 hours of culture at 25 °C on stainless steel coupons (FR – normal saline) 
Tab. 1. Tvorba biofilmu vybraných mikroorganismů v mikrotitrační destičce po 48 hodinách a 6 dnech kultivace při teplotě 25 °C. Table 1. Biofilm formation by selected microorganisms in microtiter plates after 48 hours and six days of culture at 25 °C 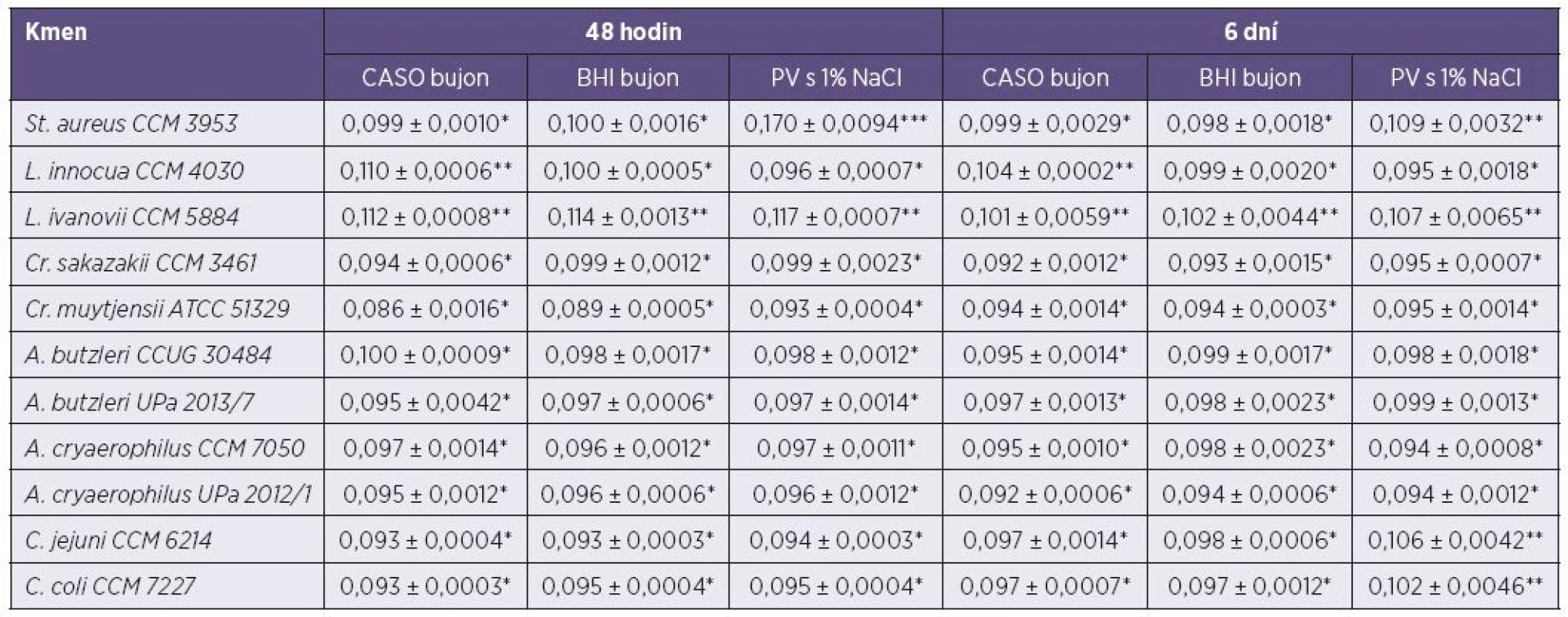
*slabě biofilm-pozitivní; **středně biofilm-pozitivní; ***silně biofilm-pozitivní *weak biofilm positivity, **moderate biofilm positivity, ***strong biofilm positivity Z naměřených hodnot byl určen medián a směrodatná odchylka. The median and standard deviation were calculated from the measurements. DISKUSE
Jak již bylo zmíněno, biofilmy představují nejen v potravinářském průmyslu velké nebezpečí. V posledních letech došlo k ohromnému vzestupu bakteriální rezistence k různým antimikrobiálním látkám, na čemž se pravděpodobně podílí i různé faktory vnějšího prostředí [8].
V naší studii bylo prokázáno, že existuje několik faktorů, které mohou tvorbu biofilmu výrazně ovlivnit, např. se jedná o dobu kultivace, složení média a s tím spojené množství dostupných živin a další. Nelze jednoznačně říci, jaké podmínky jsou či nejsou pro formování biofilmu optimální, neboť každý konkrétní kmen se může chovat odlišně.
Podobnou problematikou se v případě stafylokoků zabývali Stepanović et al. [23], kteří sledovali tvorbu biofilmu u sbírkových kmenů a klinických izolátů Christensenovou metodou. Téměř všechny kmeny, včetně kmenů St. aureus, tvořily biofilm. Takto byl také detekován biofilm vytvořený izoláty Cr. sakazakii ve studii Du et al. [20] či Ferreira et al. [24], kteří sledovali tvorbu biofilmu za různých kultivačních podmínek u A. butzleri izolovaných z drůbežích jatek. Obě studie uvádí, že divoké kmeny tvořily více biofilmu než ostatní testované kmeny. To však neodpovídá našim výsledkům, kdy pomocí Christensenovy metody byla jak u sbírkových kmenů arkobakterů, tak u izolátu z reálného prostředí zjištěna tvorba biofilmu v téměř shodné míře. Obdobnou metodou byla v minulosti sledována i tvorba biofilmu u C. jejuni [25].
Kjeldgaard et al. [9] sledovali tvorbu biofilmu jak u sbírkového kmene A. butzleri, tak u izolátů získaných z kuřecího masa. Biofilm detekovali v mikrotitračních destičkách a zároveň na kuponech z nerezové oceli, a to při různých teplotách a dobách kultivace. Autoři uvádějí, že všechny sledované arkobaktery tvořily biofilm v mikrotitrační destičce v BHI bujónu i bujónu podle Mueller-Hintona, a to při teplotách 10–37 °C. Zároveň dodávají, že se množství vytvořeného biofilmu s časem a teplotou zvyšovalo. Na základě našich výsledků však toto potvrdit nelze. V naší studii se množství biofilmu u sledovaných arkobakterů v závislosti na čase kultivace téměř nezměnilo.
Djordjevic et al. [22] studovali tvorbu biofilmu u izolátů L. monocytogenes jak na kuponech z nerezové oceli, tak z polyvinylchloridu (PVC) v médiích s minimem živin. Tvorba biofilmu byla zaznamenána na obou površích a následná mikroskopická analýza ukázala, že k vyššímu pokrytí biofilmem došlo na PVC kuponech v porovnání s nerezem u všech testovaných kmenů. Autoři to vysvětlují přítomností flagel, které mohou hrát významnou roli v počáteční fázi tvorby biofilmu či rozdílem hydrofóbnosti povrchů. I v naší studii byla prokázána schopnost formovat biofilm u obou použitých kmenů listerií na testovaných površích. Schopnost tvorby biofilmu u listerií popsali také Blackman and Frank [26], kteří sledovali formování biofilmu na nerezové oceli, teflonu a dalších površích.
Naše studie také prokázala schopnost vybraných mikroorganismů tvořit biofilm na povrchu nerezové oceli. I v tomto případě bylo prokázáno, že existuje několik hledisek, která mohou tvorbu biofilmu ovlivnit.
Podle informací získaných z předešlých studií bylo zjištěno, že bakterie mohou adherovat k celé řadě povrchů. Například adheze buněk Legionella pneumophila byla největší na povrchu z latexu, poté v sestupném pořadí na etylen-propylenu, PVC, měkké oceli, nerezové oceli, polyetylenu a skle [10]. Toto koresponduje i s výsledky studie Djordjevic et al. [22]. Gough a Dodd [27] dále uvádějí, že dřevěná potravinářská prkénka jsou mnohem častěji kolonizována mikroby než prkénka plastová. I Strydom et al. [17] se ve své studii, zabývající se tvorbou biofilmu u Cronobacter spp., zmiňují o schopnosti adheze na povrch nerezové oceli, skla, silikonu, latexu či polykarbonátu.
ZÁVĚRY
Pro průkaz tvorby biofilmu a sledování jeho fyziologie byla vyvinuta již celá řada metod. V této studii byla porovnána míra tvorby biofilmu u vybraných patogenních bakterií. Oběma metodami byla prokázána schopnost tvořit biofilm u všech vybraných mikroorganismů ve všech kultivačních médiích. Avšak projevily se zde rozdíly mezi jednotlivými sledovanými druhy mikroorganismů (listerie, arkobaktery), ale i mezi stejnými druhy mikrobů, a sice sbírkovou kulturou A. butzleri a izolátem z vnějšího prostředí, které byly pro experiment použity.
Některé bakterie tvořily biofilm ve větší míře na povrchu polyetylenových mikrotitračních destiček a na nerezových kuponech pak méně, nebo tomu bylo naopak. Rozdíly byly zaznamenány i mezi použitými médii. Například St. aureus při 48hodinové kultivaci v PV s 1 % NaCl byl při použití destiček zařazen mezi kmeny silně tvořící biofilm a při kultivaci na povrchu nerezové oceli pak jako středně pozitivní. Opačně tomu bylo v případě CASO a BHI bujónu, kdy byl St. aureus po kultivaci v destičkách zařazen mezi slabě pozitivní kmeny a po kultivaci na nerezové oceli mezi kmeny extrémně pozitivní. Podobné rozdíly nastaly například i u kmenů A. cryaerophilus, kronobakterů či listerií.
Potvrdili jsme, že modifikovaná metoda podle Christensena je vhodná pro hodnocení tvorby biofilmu bakterií. Umožňuje sledování jeho tvorby u vybraných mikroorganismů v několika médiích najednou, stejně tak jako kvantifikaci biofilmu. Velkou výhodou této metody je snadná manipulace s mikrotitrační destičkou během experimentu.
Metoda kultivace na nerezových kuponech má oproti Christensenově metodě jisté výhody. Lépe simuluje reálné prostředí potravinářských závodů a zpracovatelských míst, neboť ty jsou ve většině případů z nerezové oceli.
Poděkování
Tato práce vznikla za finanční podpory Univerzity Pardubice, projekt SGFChT 07/2014.
Do redakce došlo dne 23. 6. 2014.
Adresa pro korespondenci:
Ing. Lucie Šilhová-Hrušková
Katedra biologických a biochemických věd, Fakulta chemicko-technologická, Univerzita Pardubice
Studentská 573
532 10 Pardubice
e-mail: lucie.silhova@atlas.cz
Zdroje
1. Schlegelová J, Karpíšková S. Mikrobiální biofilmy v potravinářském průmyslu. Epidemiol Mikrobiol Imunol, 2007;56 : 14–19.
2. Trachoo N. Biofilms and the food industry. Songklanakarin J Sci Technol, 2003;25 : 807–815.
3. Sanz-Lázaro C, Navarrete-Mier F, Marín A. Biofilm responses to marine fish farm wastes. Environ Pollut, 2011;159 : 825–832.
4. Chmielewski RAN, Frank JF. Biofilm formation and control in food processing facilities. Compr Rev Food Sci F, 2003;2 : 22–32.
5. Lindsay D, Von Holy A. What food safety professional should know about bacterial biofilm. Brit Food J, 2006;108 : 27–37.
6. De Lancey Pulcini E. Bacterial biofilms: a review of current research. Nephrologie, 2001;22 : 439–441.
7. Růžička F, Holá V, Votava M. Možnosti průkazu tvorby biofilmu v rutinní mikrobiologické praxi. Epidemiol Mikrobiol Imunol, 2006;55 : 23–29.
8. Černohorská L, Sláviková P. Pseudomonas aeruginosa, její rezistence k vybraným antibiotikům a tvorba biofilmu u kmenů izolovaných od pacientů s infekcí močových cest. Epidemiol Mikrobiol Imunol, 2009;58 : 154–157.
9. Kjeldgaard J, Jørgensen K, Ingmer H. Growth and survival at chiller temperatures of Arcobacter butzleri. Int J Food Microbiol, 2009;131 : 256–259.
10. Van Houdt R, Michiels CW. Biofilm formation and the food industry, a focus on the bacterial outer surface. J Appl Microbiol, 2010;109 : 1117–1131.
11. Kumar A, Prasad R. Biofilms. JK Science, 2006;8 : 14–17.
12. Brooks JD, Flint SH. Biofilms in the food industry: problems and potential solutions. Int J Food Sci Tech, 2008;2 : 2163–2176.
13. Piskernik S, Klančnik A, Riedel CT et al. Reduction of Campylo-bacter jejuni by natural antimicrobials in chicken meat-related conditions. Food Control, 2011;22 : 718–724.
14. Douidah L, De Zutter L, Vandamme, P, et al. Identification of five human and mammal associated Arcobacter species by a novel multiplex-PCR assay. J Microbiol Meth, 2010;80 : 281–286.
15. Phillips CA. Arcobacter spp. in food: isolation, identification and control. Trends Food Sci Tech, 2001;12 : 263–275.
16. Demnerová K, Pazlarová J. Enterobacter sakazakii alias Cronobacter sakazakii – Nová hrozba? Chem Listy, 2009;103 : 641–646.
17. Strydom A, Cawthorn DM, Cameron M, et al. Species of Cronobacter – A review of recent advances in the genus and their significance in infant formula milk. Int Dairy J, 2012;27 : 3–12.
18. Hood SK, Zottola EA. Biofilms in food processing. Food Control, 1995;6 : 9–18.
19. Mah TFC, O´Toole GA. Mechanisms of biofilm resistance to antimicrobial agents. Trends Microbiol, 2001;9 : 34–39.
20. Du XJ, Wang F, Lu X et al. Biochemical and genetic characteristics of Cronobacter sakazakii biofilm formation. Res Microbiol, 2012;163 : 448–456.
21. Purkrtová S, Pilchová T, Ďurišová J, et al. Podmínky tvorby biofilmu u Listeria monocytogenes. Mlékařské listy, 2009;12 : 12–15.
22. Djordjevic D, Wiedmann M, McLandsborough LA. Microtiter plate assay for assessment of Listeria monocytogenes biofilm formation. Appl Environ Microb, 2002;68 : 2950–2958.
23. Stepanović S, Vuković D, Dakić I, et al. A modified microtiter-plate test for quantification of staphylococcal biofilm formation. J Microbiol Meth, 2000;40 : 175–179.
24. Ferreira F, Fraqueza MJ, Queiroz JA, et al. Genetic diversity, antibiotic resistance and biofilm-forming ability of Arcobacter butzleri isolated from poultry and environment from a Portuguese slaughterhouse. Int J Food Microbiol, 2013;162 : 82–88.
25. Teh KH, Flint S, French N. Biofilm formation by Campylobacter jejuni in controlled mixed-microbial populations. Int J Food Microbiol, 2010;143 : 118–124.
26. Blackman IC, Frank JF. Growth of Listeria monocytogenes as a biofilm on various food-processing surfaces. J Food Protect, 1996;59 : 827–831.
27. Gough NL, Dodd CER. The survival and disinfection of Salmonella typhimurium on chopping board surfaces of wood and plastic. Food Control, 1998;6 : 363–368.
Štítky
Hygiena a epidemiológia Infekčné lekárstvo Mikrobiológia
Článek Nové knihy
Článok vyšiel v časopiseEpidemiologie, mikrobiologie, imunologie
Najčítanejšie tento týždeň
2015 Číslo 3- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Očkování proti virové hemoragické horečce Ebola experimentální vakcínou rVSVDG-ZEBOV-GP
- Koronavirus hýbe světem: Víte jak se chránit a jak postupovat v případě podezření?
-
Všetky články tohto čísla
- Lidská prionová onemocnění v České republice
- Genetický a molekulový podklad vývoja autoimunitného diabetes mellitus
- Antigenní variabilita kmenů Bordetella pertussis izolovaných v letech 1967–2010 v České republice – možné vysvětlení vzestupu nemocnosti pertusí?
- Vyhodnocení epidemie spalniček v Ústeckém kraji
- Klonální analýza populace meningokoků z invazivního onemocnění a od zdravých nosičů izolovaných v České republice v období 1971 – 2014 (květen)
- Kampylobakteriózy na Klinice infekčních chorob Fakultní nemocnice Brno v letech 2011–2013: retrospektivní studie
- Klinická rezistence lidského cytomegaloviru při léčbě gancyklovirem u pacientů po alogenní transplantaci hematopoetických buněk – zkušenosti jednoho centra
- Hodnocení tvorby biofilmu vybraných patogenů vyskytujících se v potravinářském průmyslu
- Nové knihy
- Epidemiologie, mikrobiologie, imunologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Lidská prionová onemocnění v České republice
- Klinická rezistence lidského cytomegaloviru při léčbě gancyklovirem u pacientů po alogenní transplantaci hematopoetických buněk – zkušenosti jednoho centra
- Genetický a molekulový podklad vývoja autoimunitného diabetes mellitus
- Hodnocení tvorby biofilmu vybraných patogenů vyskytujících se v potravinářském průmyslu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



