-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Kampylobakteriózy na Klinice infekčních chorob Fakultní nemocnice Brno v letech 2011–2013: retrospektivní studie
Campylobacteriosis at the Department of Infectious Diseases of the University Hospital Brno in 2011–2013: a retrospective study
Objective:
To provide basic clinical, laboratory, and microbiological characteristics of adult patients with campylobacteriosis admitted to the Department of Infectious Diseases University Hospital Brno (UHB), in 2011–2013.Materials and methods:
A retrospective analysis of clinical and laboratory parameters of 160 patients hospitalized with campylobacteriosis at the Department of Infectious Diseases, UHB from 1 January 2011 to 31 December 2013.Results:
There was no lethality or bacteremia reported in the study group of 160 adult patients (n = 160) with campylobacteriosis. A more severe form of the disease with signs of systemic inflammatory response syndrome (SIRS) occurred in 24 patients, i.e. 15% of the study population. Transient mild to moderate leukocytopenia and thrombocytopenia were seen in 16 (10.0%) and 24 patients (15.0%), respectively, and seven patients (4.4%) had bicytopenia. The following factors correlated statistically significantly with the intestinal form of the disease and SIRS: age under 70 years (p = 0.037), absence of arterial hypertension (p = 0.044), immunosuppressive treatment (p = 0.008), leukocyte count in the peripheral blood over 12.0 × 109/l (p = 0.023), and body temperature over 38.0 °C (p < 0.001). Antibiotic treatment was used in 96.3% of patients with the intestinal form and in 100.0% of patients with SIRS. The average duration of antibiotic treatment was 8.8 and 9.3 days, respectively. Postantibiotic colitis due to Clostridium difficile occurred in seven patients (4.4%). There were no organ or autoimmune complications observed.Conclusions:
Campylobacteriosis with SIRS occurs preferentially in persons under 70 years of age. Empirical antibiotic treatment is used too frequently without being adequately deescalated.Keywords:
campylobacteriosis – invasive disease – antibiotic resistance
Autori: P. Polák 1,2; M. Vrba 3; Z. Bortlíček 4; J. Juránková 3,5; M. Freibergerová 1; P. Husa 1,2; J. Kamelander 6; M. Dastych 1,7
Pôsobisko autorov: Lékařská fakulta Masarykovy univerzity Brno 1; Klinika infekčních chorob, Fakultní nemocnice Brno 2; Oddělení klinické mikrobiologie, Fakultní nemocnice Brno 3; Institut biostatistiky a analýz, Lékařská fakulta Masarykovy univerzity Brno 4; Katedra laboratorních metod, Lékařská fakulta Masarykovy univerzity Brno 5; Oddělení klinické hematologie, Fakultní nemocnice Brno 6; Oddělení klinické biochemie, Fakultní nemocnice Brno 7
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 64, 2015, č. 3, s. 153-159
Kategória: Původní práce
Súhrn
Cíl práce:
Posoudit základní klinické, laboratorní a mikrobiologické charakteristiky dospělých pacientů s kampylobakteriózou hospitalizovaných na Klinice infekčních chorob (KICH) Fakultní nemocnice (FN) Brno v letech 2011–2013.Materiál a metodiky:
Retrospektivní analýza klinických a laboratorních parametrů 160 dospělých pacientů hospitalizovaných na Klinice infekčních chorob Fakultní nemocnice Brno v období 1. 1. 2011 až 31. 12. 2013.Výsledky:
V souboru 160 dospělých pacientů (n = 160) nebyla zaznamenána letalita ani bakteriémie. Závažnější forma onemocnění s příznaky SIRS se vyskytla u 24 pacientů (15 % souboru). Přechodná lehká až středně těžká leukocytopenie byla přítomna u 16 osob (10,0 %) a trombocytopenie u 24 pacientů (15,0 %); bicytopenie pak u 7 jedinců (4,4 %). S výskytem intestinální formy kampylobakteriózy se SIRS statisticky významně korelují následující faktory: věk do 70 let (p = 0,037), nepřítomnost arteriální hypertenze (p = 0,044), imunosupresivní léčba (p = 0,008), počet leukocytů v periferní krvi nad 12 × 109/l (p = 0,023) a tělesná teplota nad 38,0 °C (p < 0,001). Antibiotiky bylo léčeno 96,3 % jedinců s neinvazivní formou onemocnění a 100,0 % jedinců se současným SIRS. Průměrná doba antibiotické terapie byla 8,8 dne ve skupině s neinvazivním onemocněním a 9,3 dne u pacientů splňujících kritéria SIRS. Postantibiotická kolitida způsobená Clostridium difficile se vyskytla celkem u 7 pacientů (4,4 %). Orgánové komplikace ani autoimunitní následky nebyly pozorovány.Závěry:
Intestinální formou onemocnění se SIRS jsou ohroženi především jedinci do věku 70 let. Empirická antibiotická terapie je na KICH indikována příliš často a není adekvátně deeskalována.Klíčová slova:
kampylobakterióza – invazivní onemocnění – rezistence k antibiotikůmÚVOD
Kampylobakterióza patří celosvětově k jedné z nejčastějších alimentárních bakteriálních nákaz. Za humánní nákazy nejčastěji zodpovídá Campylobacter jejuni a C. coli [9]. Zdrojem nákazy je nejčastěji kontaminovaná strava (drůbeží, vepřové či hovězí maso – kontaminované buď primárně během chovu, nebo i sekundárně – zkříženě při zpracování; nepasterizované mléko a mléčné výrobky), ale i zvířata (domácí mazlíčci včetně koček a psů a divoce žijící zvířata včetně ptactva a plazů). Příhodným vehikulem se může stát i kontaminovaný písek dětských hřišť a voda (říční, jezerní, pobřežní i podzemní, dešťová či akvarijní kontaminovaná trusem ptáků či plazů) [3, 39]. Inkubační doba se u 84 % jedinců pohybuje do 4 dnů a pouze u 1 % jedinců je delší než 8 dnů. Onemocnění zpravidla spontánně odezní po 3–7 dnech. Základní projevy onemocnění jsou nespecifické: průjem (případně s příměsí krve), horečka, bolesti břicha [9, 14]. K bakteriémii dochází především u kojenců, seniorů, pacientů nakažených lidským virem imunitní nedostatečnosti (HIV), při jaterní cirhóze a při medikamentózní imunosupresi [2, 6, 10, 13, 25]. C. jejuni je častým původcem perzistující kolitidy u jedinců s agamaglobulinémií – onemocnění s relabujícím septickým průběhem může probíhat dlouhé měsíce až roky. Orgánové komplikace (peritonitida, endokarditida) jsou vzácné. Celosvětově dochází k nárůstu rezistence kampylobakterů k antibiotikům [4, 5, 16, 29, 40]. V posledních 10 letech byly v České republice publikovány pouze epidemiologické studie kampylobakteriózy, naopak klinické studie zcela chybí. Předkládaná práce popisuje soubor dospělých pacientů hospitalizovaných pro kampylobakteriózu na Klinice infekčních chorob (KICH) Fakultní nemocnice (FN) Brno v posledních 3 letech (na KICH nejsou léčeny děti).
Cíl práce
Sestavit a statisticky popsat soubor dospělých pacientů s onemocněním způsobeným Campylobacter spp. na KICH FN Brno v letech 2011–2013.
MATERIÁL A METODY
Jedná se o retrospektivní studii. Sběr dat probíhal pomocí vyhledávání v nemocničním informačním systému na základě kódu A045 mezinárodní klasifikace nemocí. Do studie byli zařazeni pacienti s mikrobiologicky verifikovanou kampylobakteriózou v období od 1. 1. 2011 do 31. 12. 2013. U všech pacientů byly studovány vstupní charakteristiky: pohlaví, věk, závažné komorbidity, konkomitantní terapie inhibitory protonové pumpy, inhibitory cyklooxygenázy a opioidy, tělesná teplota a doba trvání příznaků. Dále byly studovány laboratorní parametry při přijetí do nemocnice. Zvláště byli hodnoceni pacienti s projevy syndromu systémové zánětlivé odpovědi (SIRS). Kritéria SIRS: tělesná teplota nad 38 °C nebo pod 36 °C, tachykardie nad 100/min, tachypnoe nad 20/min a počet leukocytů v periferní krvi nad 12 × 109/l nebo pod 4 × 109/l. při splnění dvou a více těchto parametrů splňoval pacient kritéria syndromu systémové zánětlivé odpovědi. Byla sledována hodnota prokalcitoninu v séru (nad 0,5 ng/ml), případně výsledek hemokultivačního vyšetření. U všech pacientů byla sledována doba hospitalizace, antibiotická léčba a její délka a rozvoj komplikací přímo souvisejících s kampylobakteriózou nebo s použitou léčbou.
Statistická metodika
Kategoriální proměnné jsou prezentovány pomocí četnosti výskytu jednotlivých kategorií a příslušným procentuálním zastoupením. Spojité proměnné jsou sumarizovány pomocí popisné statistiky, konkrétně mediánu, minima a maxima.
Pro zhodnocení souvislosti mezi vstupními charakteristikami pacientů a formy onemocnění byla spočítána odds ratia (poměry šancí), která kvantifikují šanci na výskyt invazivní formy onemocnění v rizikové kategorii vůči referenční kategorii. Odhad je doplněn 95% intervalem spolehlivosti a příslušnou p-hodnotou.
Vzhledem ke statisticky významnému rozdílu ve věku mezi pacienty s různou formou onemocnění a zřejmé korelaci mezi věkem pacientů a dalšími charakteristikami v anamnéze pacienta, byla výsledná odds ratia adjustována na věk pacienta při přijetí, pro zjištění vlivu hodnoceného parametru na průběh onemocnění po zohlednění rozdílného věku při přijetí.
Hodnocený soubor pacientů
Pacienti byli rozděleni do dvou podskupin dle průběhu onemocnění:
- pacienti s intestinální formou kampylobakterové infekce,
- pacienti s intestinální formou kampylobakterové infekce a současným SIRS.
Počty pacientů hospitalizovaných v jednotlivých letech s danou formou onemocnění jsou prezentovány v tabulce 1.
Tab. 1. Počty pacientů hospitalizovaných v jednotlivých letech s danou formou onemocnění Table 1. Patients hospitalized with different forms of cammpylobacteriosis by year 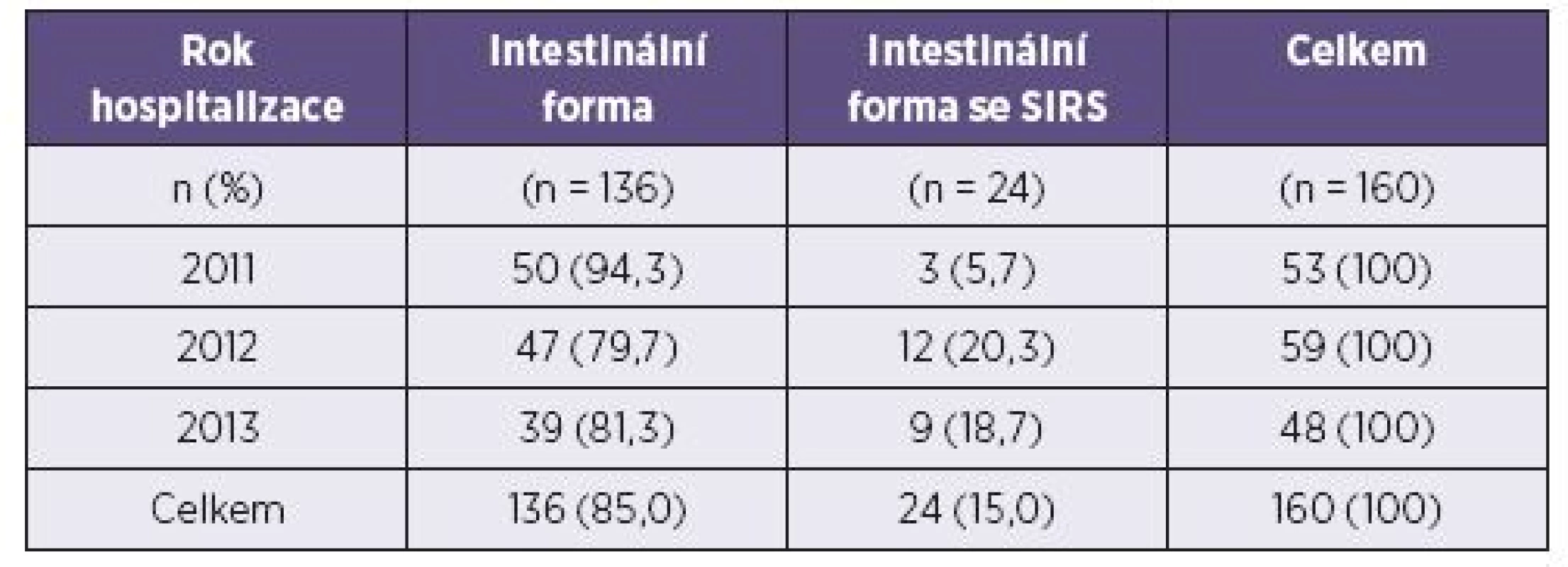
VÝSLEDKY
Souhrnné charakteristiky souboru jsou uvedeny v tabulce 2.
Tab. 2. Základní charakteristiky studovaného souboru Table 2. Basic characteristics of the study patients 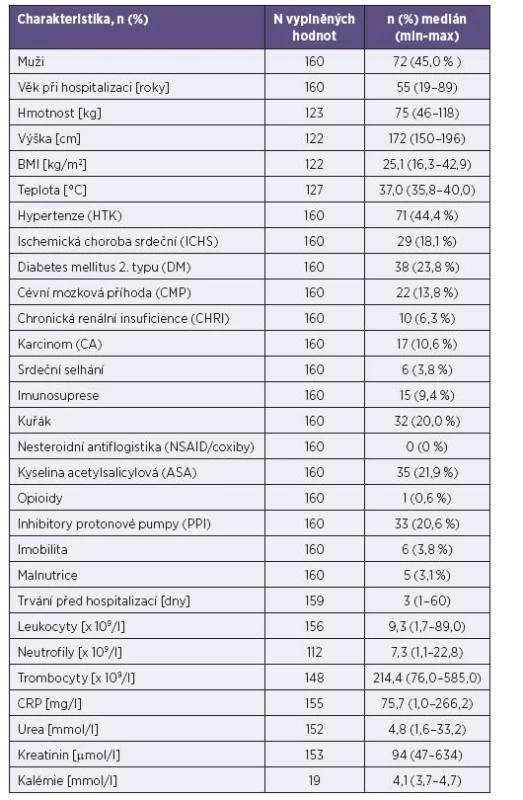
Intestinální forma onemocnění se současným SIRS se vyskytla u 15,0 % pacientů. Letalita ani bakteriémie nebyly v souboru zaznamenány. Transientní nekomplikovaná leukocytopenie se vyskytla u 10,0 % souboru a transientní nekomplikovaná trombocytopenie u 15,0 % souboru. Bicytopenie (leukocytopenie s trombocytopenií) se vyskytla u 4,4 % pacientů. Tabulky 3 a 4 uvádějí faktory, které statisticky významně korelují s výskytem této závažnější formy onemocnění. Empirickou antibiotickou terapií bylo ve sledovaném souboru léčeno 96,3 % pacientů s čistě intestinální formou onemocnění a 100,0 % pacientů splňujících kritéria SIRS. Průměrná doba antibiotické terapie byla 8,8 dne ve skupině s intestinálním onemocněním a 9,3 dne u pacientů se SIRS. Postantibiotická kolitida způsobená Clostridium difficile se vyskytla celkem u 7 pacientů (4,4 %). Orgánové komplikace ani autoimunitní následky nebyly pozorovány.
Tab. 3. Potenciální prediktory výskytu SIRS dle anamnézy Table 3. Potential predictors of SIRS depending on patient medical history 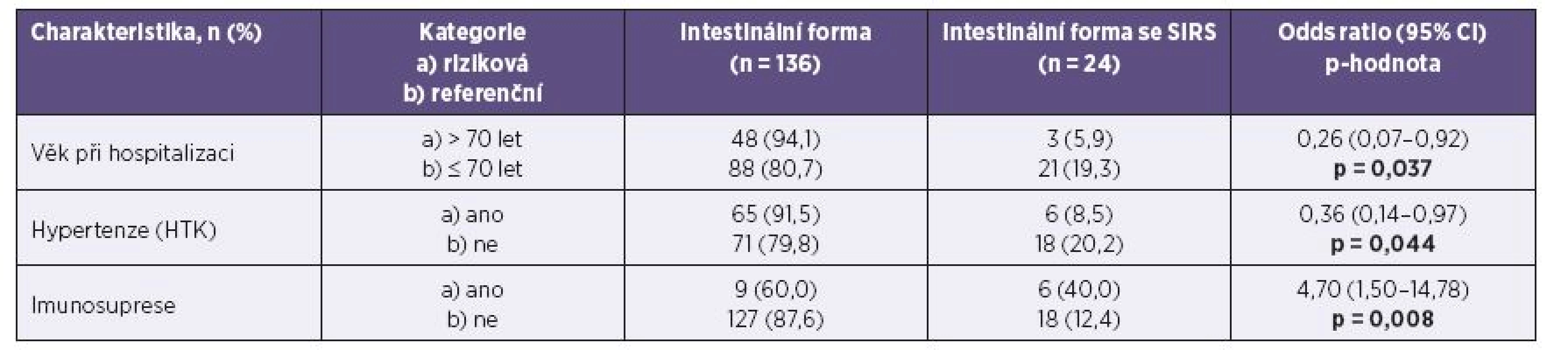
Mezi faktory, u nichž nebyla prokázána statisticky významná souvislost s rozvojem SIRS, patřilo pohlaví, ischemická choroba srdeční, diabetes mellitus 2. typu, cévní mozková příhoda v anamnéze, chronická renální insuficience, karcinom v anamnéze, srdeční selhávání, kouření cigaret, užívání kyseliny acetylosalicylové a inhibitorů protonové pumpy, imobilita a malnutrice. Factors with no statistically significant link to SIRS were: gender, coronary heart disease, type 2 diabetes mellitus, a history of cerebrovascular event, chronic renal failure, a history of cancer, heart failure, smoking cigarettes, use of acetylsalicylic acid and proton pump inhibitors, immobility, and malnutrition. Tab. 4. Základní klinické a laboratorní parametry pacientů při přijetí do nemocnice – kategoriálně Table 4. Basic clinical and laboratory parameters of patients on admission – categorially 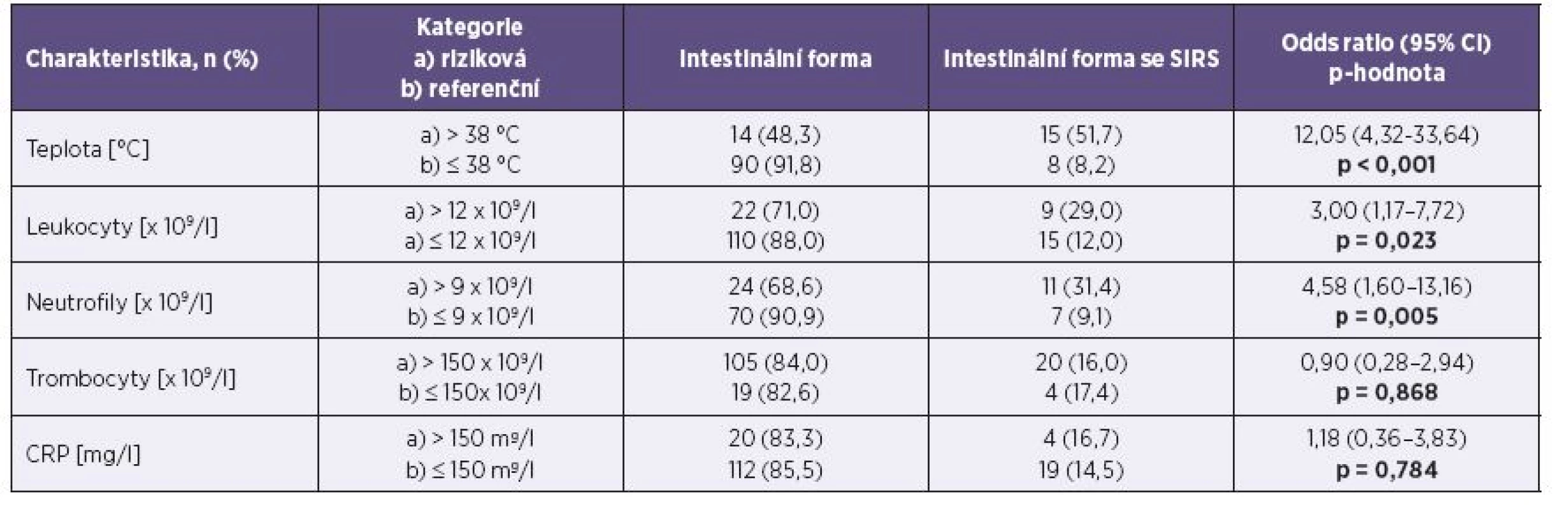
Skupina pacientů splňující kritéria SIRS
Průměrná doba hospitalizace pacientů splňujících kritéria SIRS (n = 24) činila 5,9 dnů (medián 4,0). Zvýšené kardiovaskulární riziko bylo přítomno u 6 pacientů (25,0 %): hypertenzní choroba 6krát, ischemická choroba srdeční 2krát, stav po cévní mozkové příhodě v minulosti 2krát, diabetes mellitus 2. typu 3krát. U 4 pacientů byly přítomny 2 a více rizikových kardiovaskulárních faktorů (16,7 %). Dlouhodobými kuřáky cigaret bylo 7 pacientů (25,0 %). Celkem 4 pacienti (16,7 %) užívali dlouhodobou imunosupresivní léčbu (1krát metotrexát v kombinaci s metylprednisolonem, 1krát prednison, 1krát tamoxifen a 1krát leflunomid v kombinaci s prednisonem); 1 pacient měl Crohnovu nemoc (bez dlouhodobé léčby) a 1 pacient měl běžný variabilní imunodeficit (common variable immunodeficiency, CVID) v kombinaci s Hodgkinovým lymfomem bez dlouhodobé imunosupresivní léčby. Opioidy neužíval žádný pacient. Celkem 3 jedinci užívali dlouhodobě inhibitory protonové pumpy. Malnutrice byla přítomna u 2 pacientů. U dvou pacientů se vyskytla klinicky nevýznamná enteroragie. U žádného z pacientů se nevyskytlo akutní renální selhání. Chirurgické vyšetření proběhlo vstupně u 3 pacientů (12,5 %) – u žádného nebyla prokázána náhlá příhoda břišní. Průměrný počet trombocytů v periferní krvi byl 212,0 × 109/l (medián 212,5 × 109/l, rozpětí hodnot 57–385). Trombocytopenie se vyskytla u 6 pacientů, ve 3 případech pouze mírná s hodnotami nad 100,0 × 109/l; u 3 jedinců těžší trombocytopenie s hodnotami pod 100,0 × 109/l. Během léčby došlo u všech jedinců k rychlé úpravě počtu trombocytů k normě bez dalších komplikací. Leukocytopenie se vyskytla celkem u 4 jedinců, z toho ve 3 případech s hodnotami pod 2,5 × 109/l. U všech jedinců došlo během léčby k rychlé obnově počtu leukocytů do referenčního rozmezí bez dalších komplikací. Bicytopenie (leukocytopenie s trombocytopenií) byla přítomna u 3 pacientů. Pouze 4 pacienti měli při přijetí počet leukocytů v periferní krvi v referenčním rozmezí. Průměrná hodnota C-reaktivního proteinu byla 95,5 mg/l, medián 86,1 mg/l (19,3–266,2). Hodnota prokalcitoninu v séru byla zvýšena u 9 pacientů s průměrnou hodnotou 5,7 ng/l (medián 0,21 ng/l; rozpětí hodnot 0,21–46,7). Mikrobiologicky byl ve 14 případech prokázán C. jejuni, v ostatních případech nebyl druh kampylobakterů přesně určen. Antibiotiky bylo léčeno všech 24 pacientů. V terapii byl u 17 pacientů použit roxithromycin, u 12 jedinců kotrimoxazol, u 7 je-dinců metronidazol, u 5 jedinců cefalosporiny III. generace, vždy u 2 jedinců aminoglykosidy, fluorochinolony či rifaximin a vždy u jednoho pacienta meropenem a klaritromycin. Kombinovaná, většinou sekvenční, antibiotická terapie byla použita celkem u 18 jedinců. Monoterapii obdrželo pouhých 6 pacientů – 4 z nich roxitromycin, jeden kotrimoxazol a jeden rifaximin. Průměrná délka antibiotické terapie dosahovala 9,3 dne (3,0–21,0 dnů, medián 12,0 dne). U 2 pacientů došlo v bezprostřední souvislosti s léčbou k rozvoji kolitidy způsobené Clostridium difficile. U dalších 2 pacientů bylo nutno současně léčit infekci uropoetického traktu. Letalita nebyla v souboru pozorována.
Skupina pacientů s intestinální formou onemocnění
Počet pacientů v podskupině byl 136 (n = 136). Průměrné trvání projevů onemocnění bylo 3,6 dne (1,0–60,0; medián 3,0), přičemž u 7 pacientů trvalo onemocnění 10 dnů a déle. Průměrná doba hospitalizace činila 4,8 dne (medián 4,0; rozptyl hodnot 1,0–25,0). Zvýšené kardiovaskulární riziko bylo přítomno u 71 pacientů (52,2 %): hypertenzní choroba 65krát, ischemická choroba srdeční 27krát, chronické srdeční selhání 6krát, stav po cévní mozkové příhodě v minulosti 20krát, diabetes mellitus 2. typu 35krát, chronická renální insuficience 10krát. U 45 pacientů (33,1 %) byla přítomna dvě a více těchto kardiovaskulárních rizik. Dlouhodobými kuřáky cigaret bylo 25 pacientů (18,4 %). Celkem 9 pacientů užívalo dlouhodobou imunosupresivní léčbu (kortikoterapie 5krát, léčba metotrexátem 2krát, a vždy 1krát cyklofosfamid, cyklosporin A, takrolimus a leflunomid). U 4 pacientů bylo přítomno chronické onemocnění jater s ascitem; 7 pacientů mělo základní onkologické onemocnění: 1krát karcinom žaludku, 1krát kolorektální karcinom, 2krát chronická lymfatická leukémie, 1krát mnohočetný myelom, 1krát karcinom ledviny, 1krát karcinom prostaty. Jedna pacientka byla po kombinované transplantaci ledviny a pankreatu; 1 pacient byl léčen pro kongenitální adrenální hyperplazii; 1 pacient byl léčen pro adenom hypofýzy. Jeden pacient dlouhodobě užíval metotrexát pro reaktivní artritidu a 1 pacientka byla dlouhodobě sledována pro leukocytopenii. Opioidy užíval dlouhodobě 1 pacient. Celkem 30 jedinců (22,1 %) užívalo dlouhodobě inhibitory protonové pumpy. Malnutrice byla přítomna u 3 pacientů. U 16 pacientů se vyskytla klinicky nevýznamná enteroragie (11,8 %). U 5 pacientů byly při přijetí známky akutní renální insuficience, vždy bez nutnosti použití dialyzační léčby. U jednoho pacienta byly přítomny laboratorní projevy mírné pankreatitidy; u jednoho pacienta byl při přijetí paralytický ileus tenkého i tlustého střeva; u dvou pacientů byly mírně zvýšené hodnoty transamináz v séru při přijetí s následnou úpravou k normě. Letalita nebyla v souboru pozorována. Chirurgické vyšetření při přijetí proběhlo u 22 pacientů (16,2 %), u žádného nebyla prokázána náhlá příhoda břišní. Průměrný počet trombocytů v periferní krvi byl 214,8 × 109/l (medián 203,0, rozpětí hodnot 76,0–585,0).Trombocytopenie se vyskytla celkem u 18 pacientů (13,2 %), z toho v 15 případech mírná s hodnotami nad 100 × 109/l (83,3 %) a u 3 jedinců těžší (16,7 %). Během léčby došlo u všech jedinců k rychlé úpravě počtu trombocytů k normě bez dalších komplikací. U 12 pa-cientů byla pozorována mírná transientní leukocytopenie (s hodnotami pod 2,5 × 109/l). U 78 pacientů se pohyboval počet leukocytů v krvi v referenčním rozmezí (57,4 %). Bicytopenie (leukocytopenie s trombocytopenií) byla pozorována u 4 jedinců. Průměrný počet neutrofilů v krvi první den onemocnění byl 7,1 × 109/l (1,5–20,4 × 109/l; medián 5,0); u 42 jedinců (30,9 %) nebyl počet neutrofilů stanoven. Průměrná hodnota C-reaktivního proteinu v séru byla při přijetí 78,8 mg/l (1,0–264,3 mg/l; medián 28,1) – u 4 jedinců nebyla tato hodnota stanovena. Hodnota prokalcitoninu v séru nebyla u těchto pacientů stanovena. Mikrobiologicky byl v 57 případech prokázán C. jejuni, ve 4 případech C. coli; v ostatních případech nebyl druh kampylobakterů přesně určen. Ve dvou případech byla zaznamenána konkomitantní salmonelóza. Antibiotiky bylo léčeno celkem 131 pacientů (96,3 %); pouze 5 pacientů bylo léčeno symptomaticky. Průměrná doba antibiotické terapie byla 8,8 dne (medián 7,0 dnů; rozptyl hodnot 5,0–14,0). U 75 pacientů (57,3 % souboru) byla použita kombinovaná, zpravidla sekvenční, antibiotická terapie. Makrolidové antibiotikum (roxitromycin či klaritromycin) bylo indikováno celkem 117krát (89,3 %), kotrimoxazol byl aplikován v 57 případech (43,5 %), metronidazol a rifaximin vždy v 17 případech (13,0 %), cefalosporiny III. generace 2krát. Vždy v jednom případě byl použit amikacin, ciprofloxacin a fenoxymetylpenicilin.
U 5 jedinců došlo během hospitalizace a léčby k rozvoji kolitidy způsobené Clostridium difficile. U 2 pacientů byla současně léčena infekce uropoetického traktu.
DISKUSE
Kampylobakteriózy patří i v České republice k nejčastějším bakteriálním nákazám zažívacího traktu člověka [23]. Zřejmě i z tohoto důvodu je toto onemocnění bagatelizováno a není mu kliniky věnována dostatečná pozornost, přestože se průběžně mění epidemiologická situace. Obdobnou práci zabývající se nákazami gastrointestinálního traktu na pracovišti totožném s autory publikovala Latová et al. v roce 1978 [22]. V roce 1983 zveřejnil svůj přehled o výskytu kampylobakteriózy na území ČSSR Kahlich [19]. Koncem 90. let 20. století vydaly své práce o klinickém průběhu kampylobakteriózy Táborská (u dětí) a Virtová (u dospělých) [36, 38] a na Slovensku Poracká [28]. Výskyt rezistence k antibiotikům u kampylobakterů v ČR v posledních letech detailně monitoroval Bardoň [4, 5].
Vztah přítomnosti arteriální hypertenze a zvýšeného rizika kampylobakteriózy není jasný. Podle zahraničních autorů souvisí zvýšené riziko invazivní kampylobakterové infekce s věkem, porušeným imunitním systémem, diabetus mellitus a aterosklerózou. Ve své 9leté studii pozoroval Gazaigne celkem 21 sepsí způsobených C. fetus, přičemž v 62,0 % byly přítomny zmíněné rizikové faktory [13]. Samotná kampylobakterióza může snad k arteriální hypertenzi predisponovat: Garg publikoval rozsáhlou prospektivní 4letou studii, kde prokázal statisticky významnou souvislost rozvoje arteriální hypertenze a snížené funkce ledvin u jedinců, kteří prodělali symptomatickou kampylobakteriózu [12]. Ve studovaném souboru korelovala přítomnost arteriální hypertenze s nekomplikovanou, intestinální, formou onemocnění, tento vztah se však po adjustaci na věk nepotvrdil. Obdobně nebyla prokázána případná souvislost s dalšími rizikovými kardiovaskulárními faktory (cévní mozková příhoda, ischemická choroba srdeční a kouření).
V literatuře je dobře dokumentována souvislost mezi užíváním inhibitorů protonové pumpy (proton pump inhibitors, PPI) a gastrointestinálními bakteriálními infekcemi včetně kampylobakteriózy. Brophy analyzoval vliv dlouhodobého užívání inhibitorů protonové pumpy na výskyt salmonelózy a kampylobakteriózy: ve skupině užívající PPI bylo riziko rozvoje kampylobakteriózy 1,4krát vyšší a salmonelózy 1,2krát vyšší [8]. V některých pracích dosahovalo relativní riziko rozvoje kampylobakteriózy během léčby PPI až 11,7 [30]. Ve studovaném souboru nebyl pozorován statisticky významný vztah mezi užíváním PPI a rizikem rozvoje SIRS.
Osterberg popsal negativní vliv selektivních inhibitorů cyklooxygenázy (COX) na imunitní funkci střeva [26]. V prezentovaném souboru nebyl prokázán statisticky významný vztah mezi užíváním ASA (neselektivní inhibitor COX) a rozvojem SIRS.
Dlouhodobé užívání opioidů má negativní vliv na imunitní funkce a současně ovlivňuje metabolismus žlučových kyselin ve střevě [15, 17, 31]. Ve studovaném souboru nebylo možno posoudit případný vztah užívání opioidů a rozvoje SIRS, protože opioidy dlouhodobě užíval jen jeden pacient v souboru.
U infekčních onemocnění zažívacího traktu se běžně vyskytují transientní změny počtu leukocytů i trombocytů. Schattner publikoval roční retrospektivní studii výskytu poruch počtu krevních buněk u kampylobakteriózy – leukocytopenie byla pozorována celkem ve 30,0 %, trombocytopenie ve 25,0 % a bicytopenie v 5,0 % případů; vždy se však jednalo o klinicky nezávažné a přechodné změny [33]. Ve studovaném souboru se poruchy počtu leukocytů a trombocytů vyskytovaly poměrně pravidelně a vždy byly nekomplikované. Tyto změny v krevním obraze jsou klinicky relevantní, neboť leukocytopenie pod 4 × 109/l je jedním z kritérií SIRS a trombocytopenie může být hodnocena jako první projev konsumpce při rozvoji diseminované intravaskulární koagulace.
Bakteriémie je při kampylobakterové infekci celkem vzácná. Španělští autoři pozorovali ve své obšírné 23leté retrospektivní analýze kampylobakterových infekcí bakteriémii s incidencí 0,06/1000,0 hospitalizací a rok; mezi hlavní predisponující faktory patřilo onemocnění jater, nádorové onemocnění, hypogamaglobulinémie, stav po orgánové transplantaci a nákaza HIV [10]. Dánští autoři uvádějí prevalenci bakteriémie 2,9/1 000 000,0 obyvatel a rok; mezi hlavní rizikové faktory patřil věk nad 80 let, alkoholismus, porucha imunitního systému, nákaza HIV a břišní operace v anamnéze [25]. Kopecký popsal případ kampylobakterové sepse u deficitu podtřídy protilátek IgG [20]. Relabující bakteriémii při poruše humorální imunity popsal i Ariganello [2]. Izraelští autoři se zabývali výskytem invazivní formy kampylobakteriózy u dětí: tato byla častější u imunokompromitovaných a zpravidla nebyla doprovázena intestinálními příznaky. U imunokompromitovaných byl současně často pozorován rekurentní průběh onemocnění [6]. Ve studovaném souboru nebyla bakteriémie zaznamenána, u většiny jedinců však nebylo provedeno hemokultivační vyšetření (v podskupině splňující kritéria SIRS jen ve 29,2 %). V prezentované studii se potvrzuje vysoká pravěpodobnost rozvoje SIRS u pacientů s alespoň jedním z následujících faktorů: počet leukocytů nad 12,0 × 109/l, absolutní neutrofilie a/nebo tělesná teplota nad 38,0 °C.
Naopak hodnota C-reaktivního proteinu nebo přítomnost renální insuficience ani enteroragie nepředstavují známky komplikované formy onemocnění. Ve studovaném souboru nebyl pozorován vztah mezi trváním příznaků onemocnění a rizikem rozvoje SIRS.
Užívání imunosupresivní terapie je ve studovaném souboru významný rizikový faktor pro rozvoj SIRS. Přitom nebyly pozorovány rozdíly mezi jednotlivými typy medikamentózní imunosuprese.
Ve studovaném souboru nebyla letalita pozorována. Smith a Blaser popsali 2 případy úmrtí na kampylobakterovou infekci – oba pacienti užívali antimotilika a měli hypokalémii. Vypočítaná populační mortalita byla 2,4/100 000,0 obyvatel [35].
Vzhledem k retrospektivnímu hodnocení klinických dat nebylo možno vyhodnotit případný rozvoj autoimunitních následků kampylobakteriózy ve studovaném souboru. Ve své rozsáhlé metaanalýze 14 kohortových studií odhaduje Ajene kumulovanou incidenci reaktivní artritidy na 9,0/1000,0 případů kampylobakteriózy [1]. Zautner zaznamenal výskyt protilátek proti kampylobakterům v séru u 65,0 % pacientů se syndromem Guillaina-Barrého, u 75,0 % pacientů s revmatoidní artritidou a u 40,0 % pacientů s nespecifickým střevním zánětem [41]. Případ oligoartritidy s Raynaudovým fenoménem v návaznosti na kampylobakterovou infekci popsali slovenští autoři [27].
Francouzští autoři se zabývali rozdíly v klinickém průběhu nákazy způsobené různými kmeny kampylobakterů [7]. V prezentovaném souboru nebyly všechny kmeny kampylobakterů přesně určeny z důvodu omezených možností laboratorní diagnostiky; mezi určenými kmeny převažoval C. jejuni.
Prakticky všichni autoři se shodují ve stanovisku, že neinvazivní formy kampylobakteriózy nevyžadují antibiotickou léčbu [14, 21, 38], a to ani v případě enteroragie, silných tenesmů či výrazně zvýšené hodnoty C-reaktivního proteinu. Použití antibiotické léčby rovněž neovlivní případný rozvoj autoimunitních následků kampylobakteriózy. V klinické praxi je však často obtížné správně indikovat empirickou antibiotickou terapii. Příčinou je nejasná diagnóza při přijetí (výsledky kultivačního vyšetření stolice na obligátně intestinální patogeny jsou dostupné v odstupu 48–72 hodin od získání biologického materiálu) a často výrazně horší klinický stav pacientů při přijetí do nemocnice než v odstupu po úvodní rehydratační léčbě.
Indikace empirické antibiotické léčby tak nadále zůstává klíčovou otázkou v každodenní praxi [21]. I zde je třeba vzít v úvahu několik faktorů: klinický stav pa-cienta (věk, stav imunitního systému a jiné komorbidity) a přítomnost známek SIRS. Lékem volby invazivních forem kampylobakteriózy nadále zůstávají makrolidy, protože jen zřídka indukují bodové mutace vedoucí k rozvoji rezistence. U gravidních žen by bylo možno použít spiramycin. Doba léčby by neměla překročit 7 dnů. V analyzovaném souboru byl často v úvodní léčbě použit kotrimoxazol, cefalosporiny III. generace a metronidazol. Cefalosporiny III. generace byly zpravidla používány společně s metronidazolem v rámci empirické terapie za účelem pokrytí širokého spektra možných patogenů. Tato léčba byla zpravidla podle mikrobiologických výsledků konvertována na makrolidy či rifaximin. U kotrimoxazolu byl popsán významný vliv na indukci bakteriální (poly-)rezistence k antibiotikům, a proto by měla být vyvinuta maximální snaha o omezení jeho použití na indikované případy [37]. Ostatní antibiotika jsou uvedena pro úplnost přehledu – amikacin a doxycyklin byly použity pro léčbu uroinfekce, fenoxymetylpenicilin jako profylaktická léčba kontaktu se suspektním invazivním meningokokovým onemocněním a ampicilin jako empirická léčba enteritidy suspektní listeriové etiologie u gravidní ženy. Jistou alternativu by v tomto kontextu mohla představovat fágová terapie, nejsou však dostupné validní klinické studie [11, 18, 32].
Za hlavní limitaci této práce považují autoři retrospektivní a monocentrický sběr dat.
ZÁVĚR
Autoři prezentují v České republice ojedinělou studii zabývající se klinickým průběhem a paraklinickými parametry kampylobakteriózy. Hlavním zjištěním je neadekvátní indikace antibiotické terapie, která je zpravidla zahajována empiricky v době, kdy nejsou dostupné výsledky mikrobiologických kultivačních vyšetření. Správné vyhodnocení kontextu doby trvání onemocnění, přítomnosti známek syndromu systémové zánětové odpovědi a hodnot parametrů zánětu v periferní krvi a jejich dynamiky může usnadnit uvážlivější preskripci antibiotik. Bylo by přínosné provést obdobnou studii i na jiných pracovištích v České republice.
Prohlášení
Tato práce nezakládá střet zájmů. Nebyla a nebude publikována v jiném časopise než v časopise Epidemiologie, mikrobiologie a imunologie.
Podpořeno MZ ČR – RVO (FNBr, 65269705).
Do redakce došlo dne 23. 9. 2014.
Adresa pro korespondenci:
MUDr. Pavel Polák
Klinika infekčních chorob FN a LF MU Brno
Jihlavská 20
625 00 Brno
e-mail: pavel.polak@fnbrno.cz
Zdroje
1. Ajene AN, Fischer Walker CL, Black RE. Enteric pathogens and reactive arthritis: a systematic review of Campylobacter, salmonella and Shigella-associated reactive arthritis. J Health Popul Nutr, 2013;31(3):299–307.
2. Ariganello P, Angelino G, Scarselli A, et al. Relapsing Campylobacter jejuni systemic infections in a child with X-linked agammaglobulinemia. Case Rep Pediatr, 2013;2013 : 735108.
3. Bardoň J, Ondrušková J, Oslíková M, Vyroubalová Š. Zoonotický potenciál syrového kravského mléka v ČR. Klin mikrobiol inf lék, 2012;18(2):32–37.
4. Bardoň J, Kolář M, Čekanová L, et al. Prevalence of Campylobacter jejuni and its Resistance to Antibiotics in Poultry in the Czech Republic. Zoonoses and Public Health, 2009;56 : 111–116.
5. Bardoň J., Kolář M, Karpíšková R, et al. Prevalence of thermotolerant Campylobacter spp. in broilers at retail in the Czech Republic and their antibiotic resistance. Food Control, 2011;22 : 328–332.
6. Ben-Shimol S, Carmi A, Greenberg D. Demographic and clinical characteristics of Campylobacter bacteremia in children with and without predisposing factors. Pediatr Infect Dis J, 2013;32(11):e414–418. doi: 10.1097/INF.0b013e31829baae0.
7. Bessède E, Lehours P, Labadi L, et al. Comparison of characteristics of patients infected by Campylobacter jejuni, Campylobacter coli, and Campylobacter fetus. J Clin Microbiol, 2014;52(1):328–330.
8. Brophy S, Jones KH, Rahman M, et al. Incidence of Campylobacter and Salmonella infections following first prescription for PPI: A cohort study using routine data. Am J Gastroenterol, 2013;108 : 1094–1100.
9. Epps SV, Harvey RB, Hume ME, et al. Foodborne campylobacter: infections, metabolism, pathogenesis and reservoirs. Int J Environ Res Public Health, 2013;10(12):6292–6304.
10. Fernández-Cruz A, Muñoz P, Mohedano R, et al. Campylobacter bacteremia: clinical characteristics, incidence, and outcome over 23 years. Medicine (Baltimore), 2010;89(5):319–330.
11. Fischer S, Kittler S, Klein G, et al. Impact of a single phage and a phage cocktail application in broilers on reduction of Campylobacter jejuni and development of resistance. PLoS One, 2013;8(10):e78543.
12. Garg AX, Moist L, Matsell D, et al. Risk of hypertension and reduced kidney function after acute gastroenteritis from bacteria-contaminated drinking water. CMAJ, 2005;73(3):261–268.
13. Gazaigne L, Legrand P, Renaud B, et al. Campylobacter fetus bloodstream infection: risk factors and clinical features. Eur J Clin Microbiol Infect Dis, 2008;27(3):185–189.
14. Horn BJ, Lake RJ. Incubation period for campylobacteriosis and its importance in the estimation of incidence related to travel. Euro Surveill, 2013;18(40).
15. Hugunin KM, Fry C, Shuster K, et al. Effects of tramadol and buprenorphine on select immunologic factors in a cecal ligation and puncture model. Shock, 2010;34(3):250–260.
16. Iovine NM. Resistance mechanisms in Campylobacter jejuni. Virulence, 2013;4(3):230–240.
17. Iwata T, Chiku K, Amano K, al. Effects of lipooligosaccharide inner core truncation on bile resistance and chick colonization by Campylobacter jejuni. PLoS One, 2013;8(2):e56900.
18. Janež N, Loc-Carrillo C. Use of phages to control Campylobacter spp. J Microbiol Methods, 2013;95(1):68–75.
19. Kahlich R, Paleček A. Kampylobakterioza v ČSSR. Informační zpravodaj. Vojenská lékařská akademie JEP v Hradci Králové. 1983;24(1):15–33.
20. Kopecký O, Horáček J, Černá Pařízková R, et al. Campylobacter sepsis with multiple organ failure in IgG subclass deficiency. Folia microbiologica, 2006;51(6):604–608.
21. Kotalová R. Léčba akutních gastroenteritid. Postgrad Med, 2010;12(suppl. 2):6–15.
22. Latová Z, Nezval J, Sedláčková D, et al. Vývoj infekčních střevních onemocnění u pacientů Kliniky infekčních chorob v Brně v letech 1970–1975. Čas lék čes, 1978;117(10):295–299.
23. Lexová P, Beneš Č, Částková J, et al. Výskyt infekčních onemocnění přenášených potravinami a vodou v ČR – rok 2012 a trendy nemocnosti. Zprávy Centra epidemiologie a mikrobiologie, 2013;22(7):233–239.
24. Malik-Kale P, Parker CT, Konkel ME. Culture of Campylobacter jejuni with sodium deoxycholate induces virulence gene expression. J Bacteriol, 2008;190(7):2286–2297.
25. Nielsen H, Hansen KK, Gradel KO, et al. Bacteraemia as a result of Campylobacter species: a population-based study of epidemiology and clinical risk factors. Clin Microbiol Infect, 2010;16(1):57–61.
26. Osterberg J, Ljungdahl M, Haglund U. Influence of cyclooxygenase inhibitors on gut immune cell distribution and apoptosis rate in experimental sepsis. Shock, 2006;25(2):147–154.
27. Piesecká Lˇ, Votrubová A, Líšková A, et al. Kampylobakterová infekcia komplikovaná oligoartritídou a Raynaudovým fenoménom. Postgrad med, 2010;12(8):915–917.
28. Poracká Ľ, Schréter I. Niektoré klinické hľadiská pri vybraných bakteriálnych črevných nákazách. Časť 2. K priebehu salmonelózy, šigelózy, kampylobakteriózy a yerziniózy u dospelých ľudí. Slov lek, 1998;8(3),15–18.
29. Randall LP, Ridley AM, Cooles SW, et al. Prevalence of multiple antibiotic resistance in 443 Campylobacter spp. isolated from humans and animals. J Antimicrob Chemoth, 2003;52 : 507–510.
30. Reimer C. Safety of long-term PPI therapy. Best Pract Res Clin Gastroenterol, 2013;27(3):443–454.
31. Roy S, Ninkovic J, Banerjee S, et al. Opioid drug abuse and modulation of immune function: consequences in the susceptibility to opportunistic infections. J Neuroimmune Pharmacol, 2011;4 : 442–465.
32. Sharma M. Lytic bacteriophages: Potential interventions against enteric bacterial pathogens on produce. Bacteriophage, 2013;1(3):2:e25518.
33. Schattner A. Campylobacter jejuni and cytopenias. Am J Med, 2013;126(11):1020–1021.
34. Shen Z, Pu X-Y, Zhang Q. Salicylate functions as an efflux pump inducer and promotes the emergence of fluoroquinolone-resistant Campylobacter jejuni mutants. Appl Environ Microbiol, 2011;77(20):7128–7133.
35. Smith GS, Blaser MJ. Fatalities associated with Campylobacter jejuni infections. JAMA, 1985;253(19):2873–2875.
36. Táborská J, Kobesová A. Kampylobakteriózy u hospitalizovaných dětí do tří let věku. Prakt lék, 1997;77(10):485–488.
37. van der Veen EL, Schilder AG, Timmers TK, et al. Effect of long-term trimethoprim/sulfamethoxazole treatment on resistance and integron prevalence in the intestinal flora: a randomized, double-blind, placebo-controlled trial in children. J Antimicrob Chemother, 2009;63(5):1011–1016.
38. Virtová S, Táborská J, Valchová M, et al. Salmonelózy a kampylobakteriózy u dospělých. Prakt lék, 1998;78(6):295–298.
39. Wagenaar JA, French NP, Havelaar AH. Preventing Campylobacter at the source: why is it so difficult? Clin Infect Dis, 2013;57(11):1600–1606.
40. Wieczorek K, Osek J. Antimicrobial resistance mechanisms among Campylobacter. Biomed Res Int, 2013;2013 : 340605.
41. Zautner AE, Johann C, Strubel A, et al. Seroprevalence of campylobacteriosis and relevant post-infectious sequelae. Eur J Clin Microbiol Infect Dis, 2014;33(6):1019–1027.
42. Zhangqi S, Xiao-Ying P, Qijing Z. Salicylate functions as an efflux pump inducer and promotes the emergence of fluoroquinolone-resistant Campylobacter jejuni mutants. Appl Environ Microbiol, 2011;77(20):7128–7133.
Štítky
Hygiena a epidemiológia Infekčné lekárstvo Mikrobiológia
Článek Nové knihy
Článok vyšiel v časopiseEpidemiologie, mikrobiologie, imunologie
Najčítanejšie tento týždeň
2015 Číslo 3- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Očkování proti virové hemoragické horečce Ebola experimentální vakcínou rVSVDG-ZEBOV-GP
- Koronavirus hýbe světem: Víte jak se chránit a jak postupovat v případě podezření?
-
Všetky články tohto čísla
- Lidská prionová onemocnění v České republice
- Genetický a molekulový podklad vývoja autoimunitného diabetes mellitus
- Antigenní variabilita kmenů Bordetella pertussis izolovaných v letech 1967–2010 v České republice – možné vysvětlení vzestupu nemocnosti pertusí?
- Vyhodnocení epidemie spalniček v Ústeckém kraji
- Klonální analýza populace meningokoků z invazivního onemocnění a od zdravých nosičů izolovaných v České republice v období 1971 – 2014 (květen)
- Kampylobakteriózy na Klinice infekčních chorob Fakultní nemocnice Brno v letech 2011–2013: retrospektivní studie
- Klinická rezistence lidského cytomegaloviru při léčbě gancyklovirem u pacientů po alogenní transplantaci hematopoetických buněk – zkušenosti jednoho centra
- Hodnocení tvorby biofilmu vybraných patogenů vyskytujících se v potravinářském průmyslu
- Nové knihy
- Epidemiologie, mikrobiologie, imunologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Lidská prionová onemocnění v České republice
- Klinická rezistence lidského cytomegaloviru při léčbě gancyklovirem u pacientů po alogenní transplantaci hematopoetických buněk – zkušenosti jednoho centra
- Genetický a molekulový podklad vývoja autoimunitného diabetes mellitus
- Hodnocení tvorby biofilmu vybraných patogenů vyskytujících se v potravinářském průmyslu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



