-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Epidemiologie vankomycin-rezistentních enterokoků ve Fakultní nemocnici Hradec Králové v roce 2017
Epidemiology of vancomycin-resistant enterococci in the Hradec Králové University Hospital in 2017
Vancomycin-resistant enterococci (VRE) have been a major public health concern for years. These pathogens are highly resistant, which facilitates their spread in health care settings where they may cause infections difficult to treat with antibiotics, particularly in immunocompromised patients. Over recent years, a considerable increase in VRE has also been observed in the Hradec Králové University Hospital. In 2017, 59 cases of VRE colonization or infection were newly diagnosed in inpatients. Based on a retrospective investigation, infected patients were identified, and from the hospital information system data, clinical and epidemiological factors possibly linked to VRE were analysed. It was concluded that one of the reasons behind the increase in VRE was poor compliance with the hygienic antiepidemic rules in general and with hand hygiene in particular, which was confirmed by the changed epidemiological situation the following year after more stringent rules were adopted. Raising awareness of health care workers about good practices to reduce the risk of the spread of resistant pathogens is crucial for the prevention of these infections.
Keywords:
surveillance – Epidemiology – vancomycin-resistant enterococci – antiepidemic measures
Autori: P. Polcarová 1; L. Hobzová 2; J. Smetana 1
; R. Šošovičková 3; R. Chlíbek 1
Pôsobisko autorov: Katedra epidemiologie Fakulty vojenského zdravotnictví Univerzity obrany v Brně, Hradec Králové 1; Oddělení nemocniční hygieny, Fakultní nemocnice Hradec Králové 2; Vojenský zdravotní ústav, Praha 3
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 69, 2020, č. 3, s. 107-115
Kategória: Původní práce
Súhrn
Vankomycin rezistentní enterokoky (VRE) již několik let představují významný zdravotnický problém. Jedná se o značně odolné patogeny, což usnadňuje jejich šíření ve zdravotnických zařízeních, kde mohou, zejména u imunosuprimovaných pacientů, způsobovat antibiotiky obtížně léčitelné infekce. Značný nárůst výskytu VRE byl během posledních let zaznamenán také ve Fakultní nemocnici Hradec Králové. V roce 2017 zde bylo zachyceno 59 nových případů kolonizace či infekce VRE u hospitalizovaných pacientů. Formou retrospektivního šetření byli jednotliví pacienti dohledáni a pomocí údajů z nemocničního informačního systému byly zhodnoceny klinické a epidemiologické souvislosti potencionálně se vztahující k výskytu VRE. Podle šetření se usoudilo, že jednou z příčin nárůstu VRE bylo nedostatečné dodržování hygienicko-protiepidemických pravidel, zejména hygieny rukou, což potvrdila změna epidemiologické situace v následujícím roce po zpřísnění těchto pravidel. Velký význam v prevenci šíření rezistentních patogenů má tak důkladná osvěta personálu o správných postupech omezujících riziko jejich šíření.
Klíčová slova:
vankomycin rezistentní enterokoky – epidemiologie – protiepidemická opatření – surveillance
ÚVOD
Enterokoky jsou grampozitivní bakterie, které jsou součástí přirozené mikroflóry gastrointestinálního traktu. Řadí se mezi podmíněné patogeny, převážně pak významné původce nozokomiálních infekcí močového traktu, dýchacích cest, chirurgických ran či méně často infekcí krevního řečiště endogenního i exogenního původu. Většina těchto nákaz je způsobena druhy Enterococcus faecalis a Enterococcus faecium. Nejčastěji bývají postiženi dlouhodobě hospitalizovaní pacienti se zavedenými močovými a intravaskulárními katétry léčení širokospektrálními antibiotiky, ke kterým jsou enterokoky mnohdy přirozeně rezistentní. Léčba nozokomiálních enterokokových infekcí je tedy značně komplikovaná nejen pro jejich rozsáhlou přirozenou rezistenci, ale v poslední době hlavně pro jejich narůstající rezistenci získanou. Za nejvýznamnější je považována rezistence ke glykopeptidovému antibiotiku vankomycinu [1].
Vankomycin rezistentní enterokoky (VRE) byly poprvé izolovány v roce 1986, přibližně třicet let po uvedení vankomycinu na světový trh, na odděleních hematologie a transplantačních jednotkách ve Francii a Anglii a rok poté byly zachyceny v USA. Následně došlo k jejich rychlému celosvětovému šíření, čímž se zařadily mezi nejvýznamnější globální nozokomiální patogeny [2]. K rozšíření rezistence pravděpodobně přispěl významný nárůst užívání vankomycinu při léčbě methicillin rezistentních kmenů Staphylococcus aureus (MRSA) [3]. V Evropě se na rozšíření VRE nejspíše podílelo také používání glykopeptidového antibiotika avoparcinu jako růstového stimulátoru v chovech hospodářských zvířat, zejména drůbeže, jež se stala významným zdrojem VRE [4]. V současnosti je největší záchyt VRE popisován v Severní Americe, kde je až 40 % všech enterokokových nemocničních nákaz způsobeno kmeny rezistentními k vankomycinu a je-li původcem E. faecium dosahuje rezistence k vankomycinu až 77 % [5]. VRE představují významný problém také v Austrálii, kde jsou endemické v řadě nemocnic a kde způsobují až 50 % enterokokových bakteriémií. Výjimkou v epidemiologii VRE je Kanada, kde je sledován sestupný trend ve výskytu VRE [6]. V Evropě je prevalence VRE nižší, avšak na vzestupu. Jistou roli zde hraje komunitní výskyt jedinců kolonizovaných VRE mimo nemocniční prostředí, který v USA pozorován nebyl [7]. Výskyt nejčastějších invazivních bakterií rezistentních k antibiotikům včetně VRE, převážně pak vankomycin rezistentního E. faecium, je na území Evropy sledován pomocí mezinárodní databáze EARS-Net (European Antimicrobial Resistance Surveillance Network). Tato síť národních systémů surveillance monitoruje antibiotickou rezistenci u vybraných invazivních kmenů izolovaných z krve, popřípadě z likvoru. Data o ostatních infekcích či kolonizaci způsobených rezistentními bakteriemi nedokumentuje. Podle EARS-Net bylo ve sledovaných evropských zemích v roce 2016 ze všech bakteriémií způsobených E. faecium zachyceno průměrně 11,8 % kmenů rezistentních k vankomycinu. Poměr mezi kmeny E. faecium rezistentními a citlivými k vankomycinu se však v jednotlivých zemích značně liší. V některých (Estonsko, Finsko) je zanedbatelný či nulový, v jiných (Kypr, Irsko) přesahuje podíl rezistence k vankomycinu i 40 % [8]. V České republice byl první VRE zachycen v roce 1997 na Hemato-onkologické klinice Fakultní nemocnice Olomouc. V současnosti jsou VRE detekovány v celé řadě dalších českých nemocnic. Podle EARS-Net bylo v roce 2016 v České republice (ČR) rezistentních 7,8 % E. faecium izolovaných z krve, v roce 2017 pak 13 %. Od roku 2001 se tento poměr pohyboval v rozmezí 2–14 %. Bližší informace o prevalenci VRE v ČR v nemocničním i mimonemocničním prostředí během posledních let však dostupné nejsou [4, 8].
K první izolaci VRE ve Fakultní nemocnici Hradec Králové (FN HK) došlo v roce 2012. V reakci na to byla zavedena preventivní a represivní opatření spočívající zejména v průběžném screeningu na vybraných rizikových pracovištích a izolaci pacientů s pozitivním nálezem VRE. Přesto došlo během následujících let k mnohonásobnému nárůstu výskytu VRE ve FN HK (tab. 1). Cílem prezentované práce bylo zdokumentovat okolnosti výskytu VRE ve FN HK, přiblížit jejich epidemiologii a charakterizovat skupinu pacientů s pozitivním nálezem VRE.
Tab. 1. Počet VRE izolovaných ve FN HK v letech 2013–2017
Table 1. VRE isolated in the HKUH in 2013–20177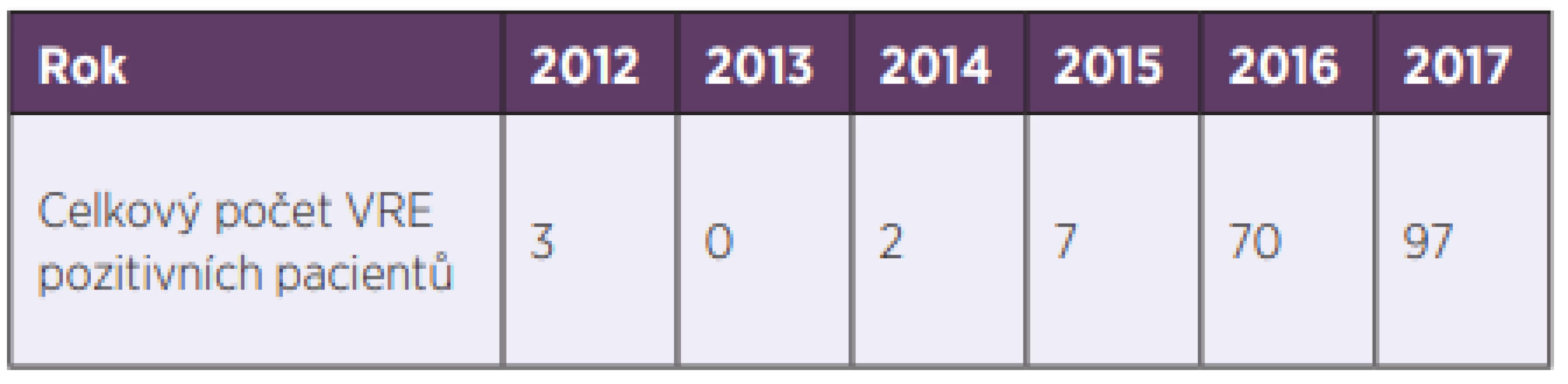
MATERIÁL A METODIKA
Práce byla provedena formou retrospektivního šetření u pacientů hospitalizovaných ve FN HK, u kterých během roku 2017 došlo k prvnímu záchytu VRE. Všechny záchyty VRE byly hlášeny na Oddělení nemocniční hygieny a současně byl údaj o pozitivním nálezu VRE zaznamenán do karty pacienta v databázi nemocničního systému (NIS). Vedle náhodných záchytů VRE z mikrobiologicky vyšetřovaného klinického materiálu byly VRE zachyceny také v materiálu pro průběžný mikrobiologický screening, který se ve FN HK provádí podle klinického pracoviště jednou až dvakrát týdně u všech pacientů ležících na jednotkách intenzivní péče (JIP) v rámci aktivní surveillance multirezistentních bakteriálních kmenů (stěry z rekta, z chronických ran, případně z dýchacích cest a moč z permanentního katétru).
Získávání dat o pacientech s VRE probíhalo pomocí NIS, díky kterému byly jednotlivé případy zpětně dohledány. Informace o výsledcích jednotlivých mikrobiologických vyšetření provedených v Ústavu klinické mikrobiologie FN HK jsme získali z laboratorního informačního systému, do kterého jsou zaznamenávány údaje všech mikrobiologických vyšetření prováděných ve FN HK. Sledovali jsme druh vyšetřovaného materiálu, datum izolace VRE, hodnotu minimální inhibiční koncentrace (MIC) vankomycinu apod. Pro průkaz VRE byla podle EUCAST za breakpoint vankomycinu u enterokoků stanovena koncentrace MIC 4 mg/l.
Zaznamenané případy VRE pozitivity byly rozděleny na pacienty, u kterých se jednalo o opakovanou izolaci VRE, a na pacienty s prvním záchytem VRE, kteří byly vybráni pro sledování v rámci našeho šetření. U případů nového záchytu VRE v roce 2017 se v NISu sledovaly záznamy pojednávající o klinických a epidemiologických souvislostech potencionálně se vztahujících k příčině vzniku infekce či kolonizace VRE. Získané informace ohledně délky hospitalizace, hlavní diagnózy, komorbiditách, stěhování pacienta v průběhu hospitalizace, antibiotické terapie, lokalizace záchytu VRE, typu enterokoka aj. byly anonymně zaznamenávány. Za hlavní diagnózu se stanovil stav specifikovaný na konci hospitalizace, který byl primárně zodpovědný za potřebu nemocného léčit se a být vyšetřován (v závěrečné zprávě).
Jednotlivé případy byly podle klinického stavu pacienta a vyšetřovaného materiálu vyhodnoceny jako infekce nebo kolonizace. Za kolonizaci se považovaly případy, kdy byl VRE zachycen náhodně u pacienta bez symptomů vztahujících se k vyšetřovanému materiálu, převážně v rámci screeningu. Jako infekce byly označeny případy, kdy byl VRE izolován z klinického materiálu orgánového systému (vyjma gastrointestinálního traktu, kde jsou enterokoky součástí běžné mikroflóry) vyšetřovaného pro probíhající bakteriální zánět způsobující klinické obtíže pacienta s laboratorními změnami charakteristickými pro infekci. V těchto případech byl izolovaný VRE případně spolu s jinými patogeny určen jako etiologické agens infekce, která byla buď příčinou hospitalizace či přidruženým onemocněním.
Získané údaje byly zpracovány a pomocí programu Microsoft Excel 2010 byly vytvořeny prezentované grafy a tabulky. Výsledná data byla následně autory komentována a srovnána s daty mezinárodních studií zaměřených na problematiku VRE.
VÝSLEDKY
Během roku 2017 bylo ve FN HK zachyceno celkem 97 případů kolonizace či infekce VRE u hospitalizovaných pacientů, z čehož 59 případů bylo nových a u 38 případů došlo k izolaci VRE již dříve během předchozí hospitalizace. Práce byla zaměřena pouze na nové případy. Soubor pacientů s novým pozitivním záchytem VRE se skládal z 28 žen a 31 mužů ve věku od 27 do 88 let, s maximem ve věkové kategorii 61–70 let (obr. 1). Celkový věkový průměr činil 67,4 let.
Obr. 1. Věkové rozložení pacientů s novým pozitivním záchytem VRE v roce 2017
Figure 1. Age distribution of patients newly diagnosed with VRE infection in 2017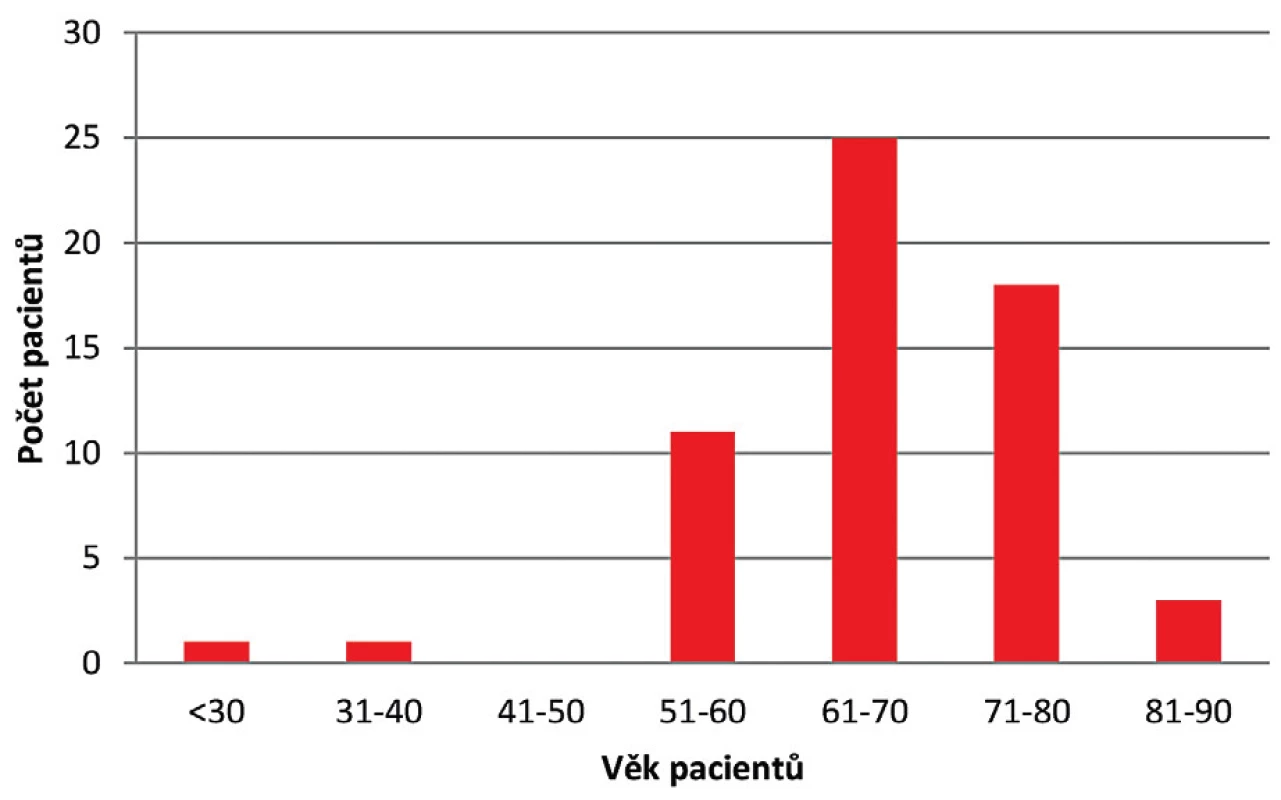
Největší počet pacientů s nálezem VRE (54 %) byl zaznamenán od ledna do března. V červnu nedošlo k jedinému záchytu VRE. K menšímu nárůstu došlo během srpna, kdy byl VRE zachycen u 8 pacientů. V ostatních měsících se počet nově izolovaných VRE pohyboval od jednoho po čtyři případy za měsíc.
Během prvních pěti dnů po příjmu pacienta byl VRE zachycen u 17 % případů. Nejčastěji k záchytu VRE docházelo mezi 6. a 10. dnem hospitalizace (25 %) a nejméně mezi 16. a 20. dnem (7 %). Průměrná doba od příjmu pacienta po záchyt VRE byla 16 dnů. U třech pacientů došlo k záchytu VRE po 35 dnech hospitalizace, přičemž nejdelší časová prodleva od příjmu po izolaci byla 56 dnů (obr. 2).
Obr. 2. Termín prvního záchytu VRE u pacientů v závislosti na délce hospitalizace
Figure 2. Date of the first detection of VRE in patients depending on the length of hospital stay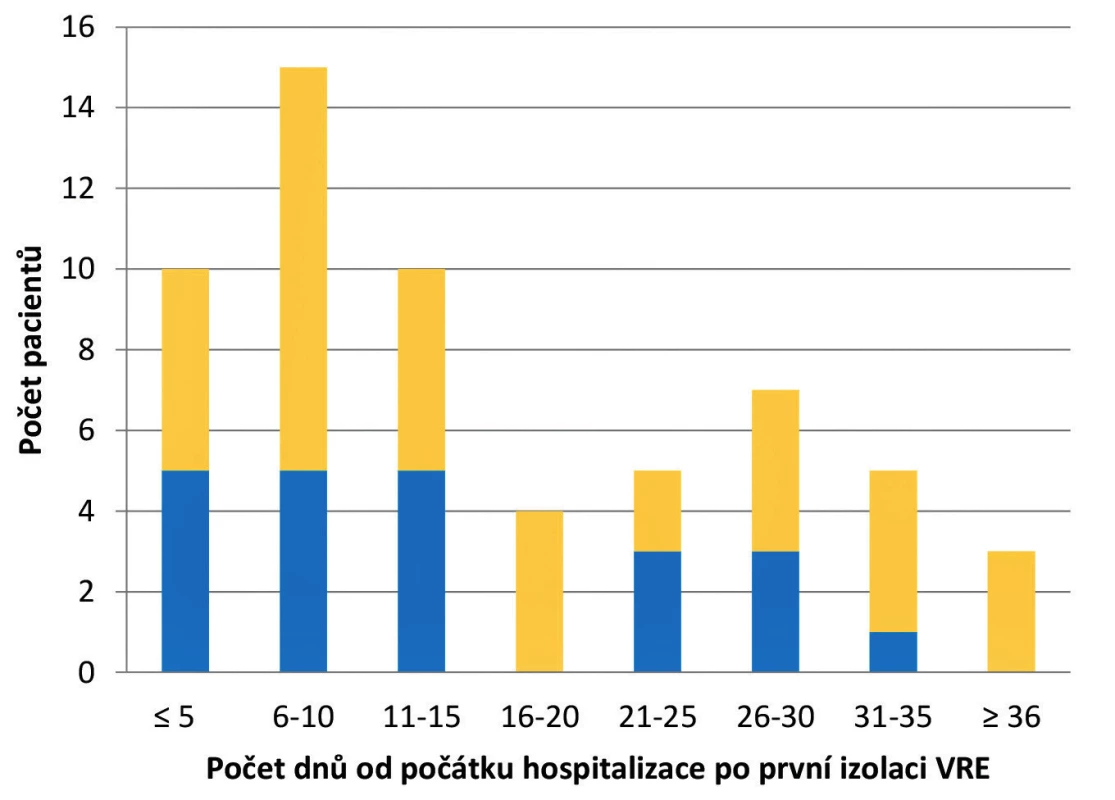
U 37 případů byl záchyt VRE hodnocen jako kolonizace, a to nejčastěji rekta a po jednom případu nosohltanu a hrtanu. Jednalo se o náhodné nálezy při plošném screeningu na vybraných odděleních. Jako původce infekce byl VRE označen u zbylých 22 případů, které detailněji popisuje tabulka 2. Všichni pacienti, u kterých byl záchyt VRE vyhodnocen jako infekce, byli značně polymorbidní. V tabulce 2 je uvedena pouze hlavní diagnóza a diagnóza související s lokalizací zachyceného VRE, je-li jiná než diagnóza hlavní. U 14 pacientů následovaly v průběhu hospitalizace další záchyty VRE z klinických materiálů odlišných od prvního vzorku pozitivního na VRE. Týkalo se to zejména případů vyhodnocených jako infekce (10 případů).
Tab. 2. Případy, kdy byl VRE izolován jako původce infekce
Table 2. Cases with VRE detected as the causative pathogen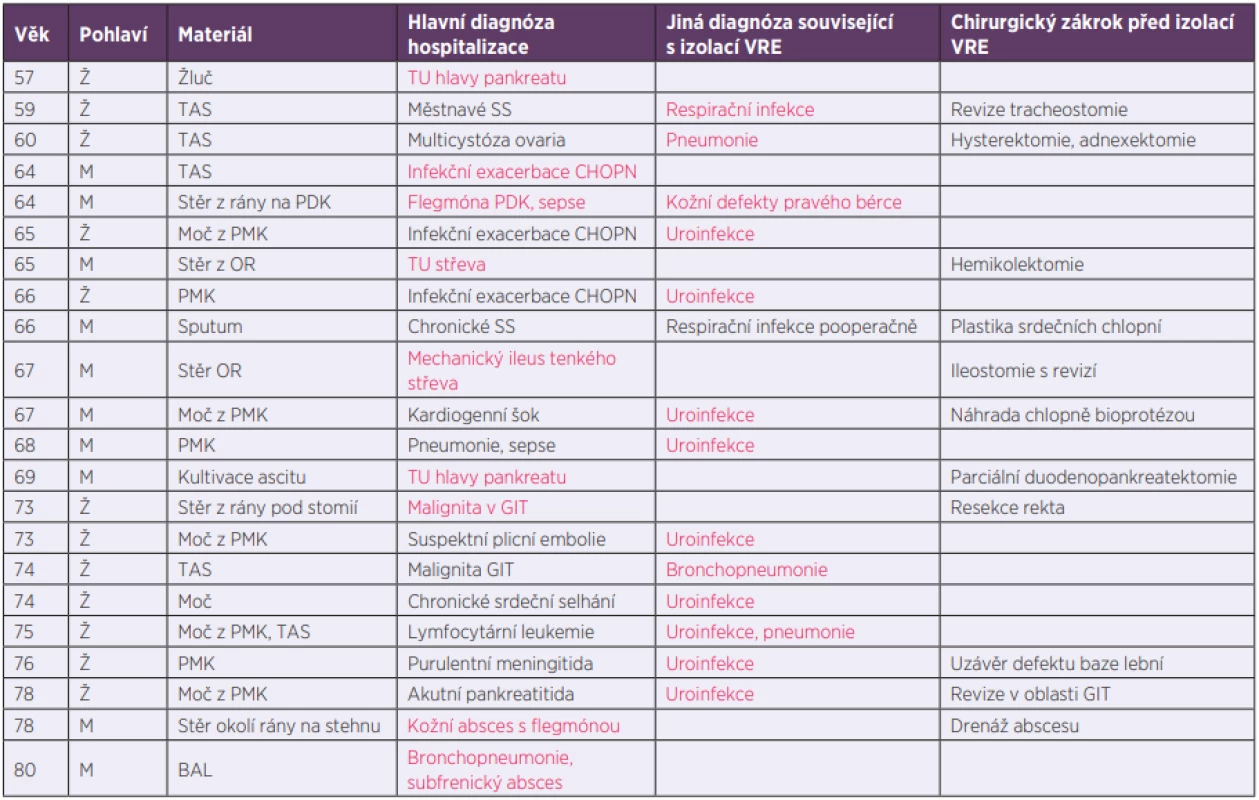
Ž – žena, M – muž, TAS – tracheální aspirát, PDK – pravá dolní končetina, PMK – permanentní katétr, OR – operační rána, BAL – bronchoalveolární laváž, TU – tumor, GIT – gastrointestinální trakt Červeně označena diagnóza související s odběrem materiálu, ze kterého byl izolován VRE.
F – female, M – male, TAS – tracheal aspirate, PDK – right lower limb, PMK – permanent catheter, OR – operation wound, BAL – bronchoalveolar lavage, TU – tumour, GIT – gastrointestinal tract The diagnosis on the basis of which a specimen where VRE were isolated had been collected is highlighted in red.Z pacientů nově pozitivních na přítomnost VRE v roce 2017 bylo 18 případů do FN HK přeloženo z jiného zdravotnického zařízení. U ostatních se jednalo o plánovanou či akutní hospitalizaci pro náhlé zhoršení stavu. V průběhu jednoho roku předcházejícího aktuální hospitalizaci bylo ve FN HK minimálně jednou hospitalizováno 26 sledovaných pacientů.
Důvodem léčby v průběhu hospitalizace byla celá řada diagnóz (obr. 3). Nejčastějšími diagnózami, pro které byli pacienti v průběhu hospitalizace zejména léčeni, byla onemocnění v oblasti gastrointestinálního traktu – GIT (tumory v oblasti střeva či pankreatu, náhlé příhody břišní, pankreatitidy aj.). Kromě jednoho pacienta prodělali před izolací VRE všichni pacienti s primárním onemocněním GIT chirurgický výkon v oblasti trávicího traktu. Dále byli pacienti hospitalizováni pro onemocnění dýchacího traktu (bronchopneumonie, chronická obstrukční nemoc, astma či plicní embolie), hematologická onemocnění (různé typy leukémií a lymfomů), onemocnění srdce a méně často pro selhávání ledvin a urosepsi, pro infekce nervového systému či kůže, pro traumatická poranění a ojediněle pro chirurgické výkony (amputace) či gynekologická onemocnění. Až na jeden případ měli všichni pacienti v diagnostickém souhrnu v průběhu hospitalizace více než dvě diagnózy.
Obr. 3. Rozdělení pacientů s novým záchytem VRE v roce 2017 podle základního onemocnění
Figure 3. Distribution of patients newly diagnosed with VRE in 2017 by underlying disease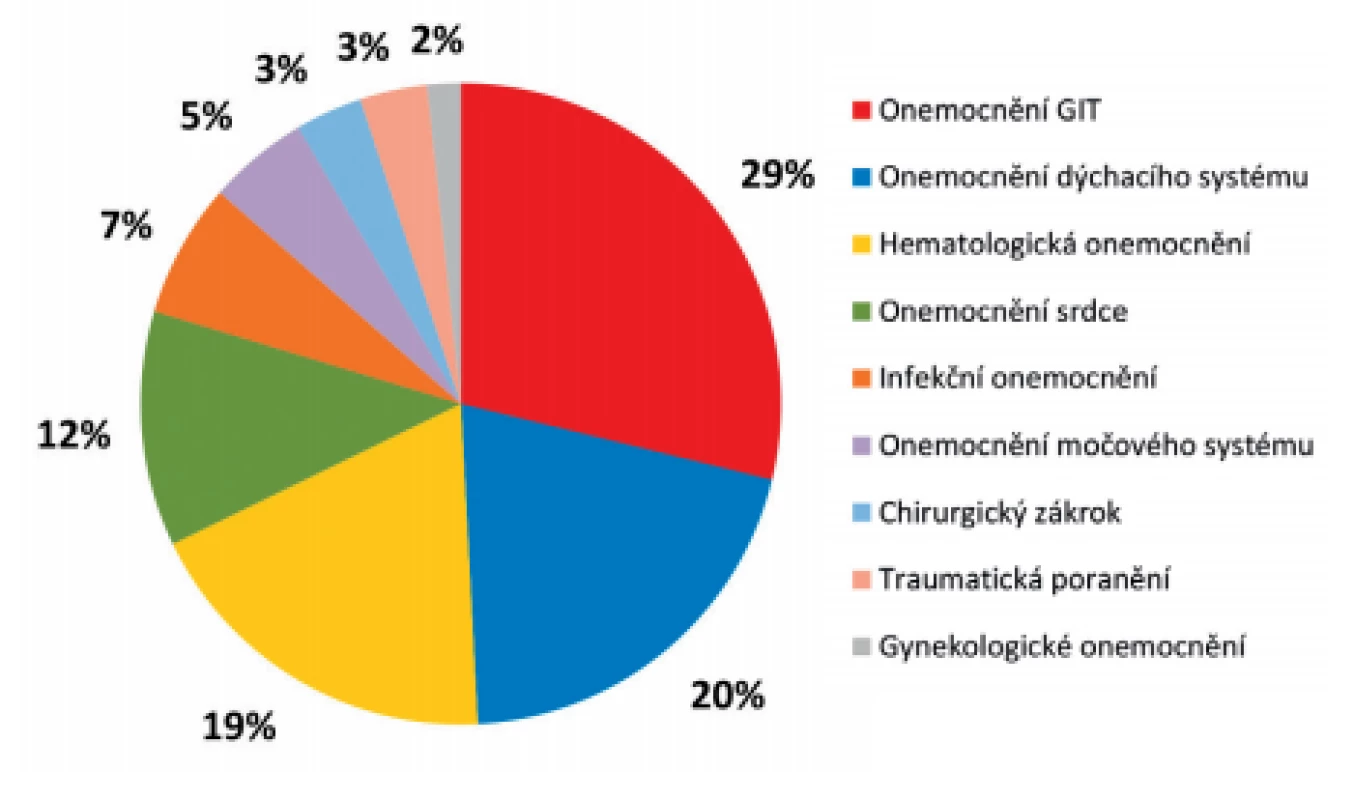
V průběhu hospitalizace mělo 95 % pacientů zavedený žilní katétr a 75 % pacientů mělo zavedený močový katétr. Na umělou plicní ventilaci bylo během hospitalizace napojeno 42 % pacientů, nazogastrickou sondu mělo zavedenou 17 % pacientů a tracheostomii prodělalo 15 % pacientů. Před záchytem VRE podstoupilo 47 % pacientů během hospitalizace chirurgický výkon, z nichž 50 % bylo pro obtíže v oblasti GIT. Ostatní invazivní výkony byly prováděny spíše jednotlivě. Cvičení s fyzioterapeutem absolvovalo 71 % pacientů.
Všichni pacienti byli před záchytem VRE léčeni antibiotiky. Jedno antibiotikum bylo podáváno 12 % pacientů, dva různé antibiotické přípravky užívalo 27 % pacientů a tři 22 % pacientů. Více než tři antibiotika byla podána 39 % pacientů. Více antibiotických přípravků užívali pacienti buď současně, či v různých časových intervalech po sobě. Nejčastěji užívanými antibiotiky byly beta-laktamy, a to zejména karbabenemy (42 %) a peniciliny s inhibitorem beta-laktamázy (převážně amoxicilin/klavulanát (42 %) a piperacilin/tazobaktam (39 %)), dále cefalosporiny (41 %) a antibiotika ze skupiny fluorochinolonů (36 %). Metronidazol byl podán 29 % pacientů a vankomycin 24 % pacientů. V průběhu roku před aktuální hospitalizací bylo antibiotiky léčeno prokazatelně 27 % pacientů. Imunosupresivní léčbu, zahrnující systémovou kortikoterapii a chemoterapii, podstoupilo během hospitalizace 44 % pacientů a v průběhu předešlého roku 17 % pacientů.
Nejčastěji byly VRE (celkem – jako infekce i kolonizace) zachyceny na interních klinikách (52 %). Ve 27 % došlo k záchytu VRE na klinikách chirurgických, a to převážně na odděleních všeobecné chirurgie. Na ostatních pracovištích nemocnice byly VRE zachyceny spíše ojediněle (obr. 4). Poměr mezi počtem případů infekce a kolonizace VRE se na jednotlivých pracovištích často velmi lišil (viz obr. 4). Na Interní hematologické klinice bylo všech 12 záchytů VRE vyhodnoceno jako kolonizace a nebyl zde zaznamenán ani jeden případ infekce způsobené VRE. Oproti tomu na Kardiochirurgické klinice byly všechny izolované VRE původci infekce. Přibližně 68 % pacientů absolvovalo během hospitalizace pobyt na oddělení jednotky intenzivní péče (JIP). V průběhu hospitalizace docházelo často ke stěhování pacientů, a to jak v rámci kliniky (z lůžkového oddělení na JIP či naopak), tak mezi jednotlivými klinikami. Minimálně jednou došlo ke stěhování u 64 % pacientů.
Obr. 4. Klinická pracoviště FN HK, kde byli pacienti hospitalizováni při prvním záchytu VRE v roce 2017
Figure 4. HKUH clinical centres to which the patients newly diagnosed with VRE were admitted in 2017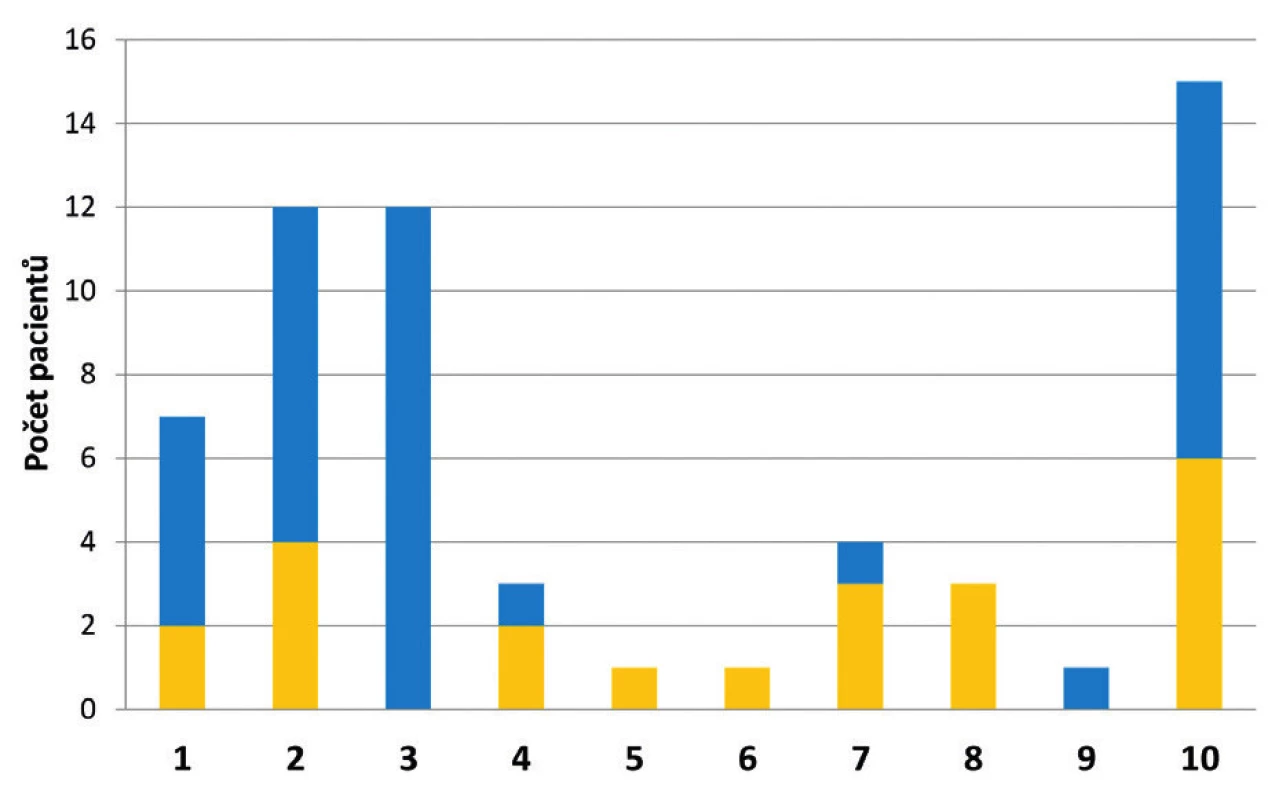
1 – Interní kardioangiologická klinika, 2 – Interní gerontometabolická klinika, 3 – Interní hematologická klinika, 4 – Plicní klinika, 5 – Klinika infekčních nemocí, 6 – Klinika onkologie a radioterapie, 7 – Klinika anesteziologie, resuscitace a intenzivní medicíny, 8 – Kardiochirurgická klinika, 9 – Neurochirurgická klinika, 10 – Chirurgická klinika všeobecná
1 – Internal cardioangiology clinic, 2 – Internal gerontometabolic clinic, 3 – Internal haematology clinic, 4 – Pulmonary clinic, 5 – Infectious diseases clinic, 6 – Oncology and radiotherapy clinic, 7 – Anaesthesiology, resuscitation and intensive care clinic, 8 – Cardiac surgery clinic, 9 – Neurosurgery clinic, 10 – General surgical clinicVe všech případech nového záchytu VRE se jednalo o E. faecium. Hodnota MIC vankomycinu u 42 případů VRE byla rovna či vyšší než 256 mg/l. Nejnižší hodnota MIC vyhodnocená jako rezistence k vankomycinu byla 6 mg/l. Všechny izolované kmeny VRE byly citlivé k linezolidu.
DISKUSE
V roce 2016 byl ve FN HK zaznamenán výrazný nárůst výskytu VRE, který pokračoval také v roce 2017. Tento zlom v epidemiologii VRE byl impulsem pro naše šetření, jehož cílem bylo popsat klinické, mikrobiologické a epidemiologické okolnosti výskytu a šíření VRE v podmínkách zdravotnického zařízení.
Nárůst výskytu VRE je sledován celosvětově. Situace v Evropě je značně rozmanitá a prevalence VRE se liší jak mezi státy, tak mezi regiony. Přestože se problematikou VRE zabývala řada studií, zůstávají mnohé aspekty epidemiologie VRE stále neznámé [8, 9, 10]. Předpokládá se, že za nárůstem výskytu VRE v Evropě stálo užívání glykopeptidu avoparcinu jako růstového faktoru v chovu hospodářských zvířat, které zapříčinilo vznik rezervoáru VRE nejen mezi zvířaty, ale i zdravými lidmi [11, 12]. Po jeho zákazu v roce 1997 byl sice zaznamenán pokles výskytu VRE, stále se však VRE mezi hospodářskými zvířaty vyskytují [13, 14]. Proč však došlo k nenadálému a rychlému nárůstu výskytu VRE ve FN HK třicet let po zákazu avoparcinu a třicet let po prvním výskytu VRE v ČR, tato skutečnost však dostatečně nevysvětluje. Na vzniku a šíření VRE má vliv několik faktorů na úrovni molekulární, genetické, epidemiologické a klinické. Enterokoky mají poměrně tvárný genom. Rezistenci snadno získávají, a to buď působením selekčního tlaku antibiotika s následně vzniklými mutacemi, nebo transferem genetického materiálu z rezistentní bakterie na citlivou pomocí mobilních genetických elementů (plasmidy či transpozony) [15]. Jelikož se vznik rezistence k vankomycinu de novo u hospitalizovaných pacientů léčených antibiotiky jeví jako méně pravděpodobný, předpokládá se, že pacient s nálezem VRE musel být podle všeho kolonizován již před hospitalizací nebo přijít s VRE do kontaktu v prostředí nemocnice. I přesto má léčba antibiotiky v epidemiologii VRE jistou úlohu [16]. Zejména antibiotika se širokým spektrem účinku, ke kterým jsou enterokoky přirozeně rezistentní, eliminují velkou část střevní mikroflóry, což vede k přerůstání VRE v trávicím traktu u pacientů s asymptomatickou kolonizací VRE a tedy i k vyšší pravděpodobnosti jejich záchytu ve stolici či stěru z rekta. U pacientů doposud nekolonizovaných VRE mohou antibiotika narušením mikroflóry ve střevě snižovat odolnost proti kolonizaci VRE, a naopak tak zvýšit pravděpodobnost jejího vzniku. Mezi antibiotika asociována s rozvojem a šířením VRE se řadí zejména cefalosporiny 3. generace, antianaerobní antibiotika (metronidazol) či v menší míře glykopeptidy nebo jiná antibiotika. Jistý vliv má také celkový objem užívaných antibiotik a délka léčby [16, 17]. V našem šetření užívali antibiotika před záchytem VRE všichni pacienti, přičemž 88 % z nich bylo léčeno kombinací dvou a více antibiotik. Nejčastěji byly pacientům podávány karbapenemy, širokospektré peniciliny s inhibitory beta-laktamáz a cefalosporiny třetí generace, tedy skupiny antibiotik s širokým spektrem účinku.
Nadpoloviční většina případů VRE zachycených ve FN HK v roce 2017 byla vyhodnocena jako kolonizace zjištěná v rámci průběžného screeningu na daném oddělení, zejména pak na JIP a Interní hematologické klinice. Právě asymptomatičtí nosiči s kolonizovaným trávicím traktem představují rezervoár VRE. Uvádí se, že k záchytu VRE u nich dochází náhodně, a to až desetkrát častěji než při záchytu VRE při cílené izolaci z infikovaného ložiska [15, 18, 19]. Jelikož ne všichni pacienti projdou screeningovým vyšetřením multirezistentních bakteriálních kmenů a mnohdy se nepodaří při prvním mikrobiologickém vyšetření VRE zachytit, dá se předpokládat, že prováděl-li by se průběžný a opakovaný screening na všech odděleních, byl by počet zachycených jedinců kolonizovaných VRE vyšší. Otázkou zůstává, odkud VRE u pacientů v našem souboru pochází. Zda je jejich původ endogenní, kdy je VRE součástí běžné střevní mikroflóry pacienta, či exogenní, kdy je pacient kontaminován VRE z nemocničního prostředí, ve kterém mohou dlouhodobě přežívat. K záchytu VRE u pacientů docházelo i v prvních dnech hospitalizace, což podporuje spíše hypotézu endogenního původu s komunitním výskytem. Existuje-li však komunitní „pool“ zdravých jedinců kolonizovaných VRE, je otázkou proč nedošlo k rozšíření VRE ve FN HK již dříve. Oproti tomu případy záchytu VRE po několikatýdenní hospitalizaci s předchozími negativními výsledky mikrobiologického screeningu podporují teorii nozokomiálního šíření. Někteří pacienti však byli před přijetím do FN HK léčeni v jiném zdravotnickém zařízení, kde se mohli dostat do kontaktu s VRE a kde část z nich byla léčena antibiotiky. Výsledky mikrobiologických vyšetření a údaje o antibiotické terapii z těchto zařízení však byly nedostatečné či nedohledatelné. Pro objasnění původu VRE je třeba provést molekulárně-biologickou analýzu s cílem zjistit případnou genetickou příbuznost mezi kmeny VRE izolovanými od pacientů a z prostředí, jakou provedla v roce 2006 Vágnerová et al. nebo Bonten et al. v roce 1995 [17, 20].
Bezpříznaková kolonizace střev VRE je obecně sama o sobě benigní, jelikož enterokoky běžně u zdravých jedinců v trávicím traktu infekce nezpůsobují. Avšak u některých pacientů, zejména s oslabeným imunitním systémem a po antibiotické terapii, která vede ke změně původního střevního mikrobiomu s přerůstáním VRE, může dojít k translokaci VRE do jiných částí těla za vzniku infekce, případně se může VRE dostat do prostředí a infikovat jiné pacienty [21]. Ve vyšším riziku vzniku enterokokové infekce, včetně té způsobené VRE, jsou těžce nemocní polymorbidní pacienti, často s hematologickým onemocněním či pacienti po transplantaci. U imunokompetentních jedinců se infekce způsobené VRE vyskytují zcela ojediněle [22]. Některé studie popisují jistou spojitost mezi infekcí způsobenou VRE a narušenou renální funkcí, hemodialýzou, vaskulárním onemocněním, diabetes mellitus, malignitou, prodělaným výkonem v oblasti GIT, umělou plicní ventilací, zavedením centrálního žilního katétru či užíváním imunosupresivní terapie a podobně [17, 23, 24, 25, 26]. Není však známo žádné konkrétní onemocnění či okolnosti, které by bezprostředně přímo souvisely s rozvojem infekce způsobené VRE, ať vzniklé nově či na podkladě předchozí kolonizace. V našem šetření byla jako infekce vyhodnocena přítomnost VRE u 22 osob, z nichž 17 absolvovalo během hospitalizace pobyt na JIP, 13 bylo napojeno na umělou plicní ventilaci (včetně pěti pacientů z šesti, u kterých byl VRE detekován z dýchacích cest), 11 prodělalo před izolací VRE chirurgický výkon a všichni byli v průběhu hospitalizace léčeni pro více než tři diagnózy. Jelikož u těchto pacientů nebyly VRE izolovány z materiálu určeného pro screening, ale z materiálu mikrobiologicky vyšetřovaného pro suspektní infekci s klinickými obtížemi, což se v případě potřeby provádí na všech odděleních nemocnice, lze konstatovat, že VRE jako původci infekcí jsou ve FN HK v naprosté většině případů zachyceny. Nepředpokládáme tedy možnou vyšší prevalenci jako v případě kolonizace.
Celkově představoval soubor pacientů v našem šetření skupinu polymorbidních jedinců se závažným základním onemocněním nejčastěji trávicího traktu, dýchacích cest či s hematologickým onemocněním a byl tedy podobný souborům pacientů popisovaných i v jiných studiích. Jelikož bývají polymorbidní jedinci nejčastěji pokročilejšího věku, je s vyšší pravděpodobností kolonizace či infekce VRE spojován také vyšší věk pacientů. Soubory pacientů se záchytem VRE ve většině studií vykazují vyšší průměrný věk, zpravidla od 50 do 60 a více let [28, 29, 30, 31, 32, 33]. U mladších jedinců se vyskytují spíše sporadicky, jako tomu bylo i v případě našeho šetření. Mladší 50 let byli pouze dva pacienti (27 a 38 let), oba muži kolonizovaní VRE a oba se závažnou hlavní diagnózou, pro kterou byla nutná umělá plicní ventilace a léčba širokospektrými antibiotiky. Pohlaví na přítomnost VRE s největší pravděpodobností nemá vliv. Ve většině publikovaných studií, stejně jako v našem šetření, je prevalence VRE u mužů a žen srovnatelná. Mezi rizikové faktory uváděné v literatuře se dále řadí prodloužená doba hospitalizace, dále hospitalizace, která v nedávné době předcházela té, kdy byl zachycen VRE, stěhování pacientů v rámci zdravotnického zařízení či pobyt na JIP [23, 34, 35]. Čím delší či častější je totiž pobyt ve zdravotnickém zařízení, tím větší je pravděpodobnost získání VRE z prostředí, ale i rozvoje endogenní kolonizace vlivem dlouhodobé léčby vedoucí k přerůstání VRE v GIT pacienta. V našem průzkumu k nejvíce záchytům VRE docházelo mezi 6. a 10. dnem hospitalizace a přestože byly některé VRE zachyceny i po době delší než 30 dnů, domníváme se, že prodloužená hospitalizace (déle jak dva týdny) se na zvýšeném riziku rozvoje infekce či kolonizace VRE spíše nepodílí. K objasnění souvislosti mezi délkou hospitalizace a rizikem osídlení VRE jsou však potřeba další studie. Oproti tomu opakovaná hospitalizace by riziko představovat mohla. Pouze ve FN HK bylo během roku předcházejícího současnou hospitalizaci hospitalizováno 64 % pacientů z našeho šetření. Údaje o hospitalizaci v jiném zdravotnickém zařízení byly nedostatečné a lze tedy předpokládat, že celkově bylo během posledního roku hospitalizováno více pacientů. Nutnost opakované hospitalizace rovněž vypovídá o tíži zdravotního stavu pacientů a vede k častějšímu vystavení se rizikovým faktorům, jako je antibiotická léčba či invazivní výkony. Stěhování v rámci nemocnice zase zvyšuje pravděpodobnost kontaktu pacienta s jiným pacientem či zdravotnickým pracovníkem kolonizovaným VRE či kontaminovaným předmětem.
V roce 2017 bylo v rámci našeho šetření nejvíce VRE zachyceno na interních klinikách, méně často docházelo k záchytu VRE na chirurgických klinikách a ojediněle na ostatních klinikách. Pro závažnost svého stavu muselo 68 % pacientů absolvovat minimálně jednodenní pobyt na JIP. Vyšší výskyt VRE na těchto odděleních se dá vysvětlit, stejně jako nutnost opakované hospitalizace, závažnějším stavem pacientů zde hospitalizovaných spolu s větší mírou užívání antibiotik, případně možným výskytem VRE v prostředí daného oddělení. Podobně také podle databáze EARS-Net bylo v roce 2017 v České republice nejvíce vankomycin rezistentních E. faecium hlášeno na odděleních JIP (13 případů) a na interních odděleních (10 případů). Je však nezbytné připomenout, že tato databáze mapuje pouze případy, kdy byl VRE izolován z hemokultury, proto se jedná o malá čísla [36]. V našem šetření nebyl z hemokultury žádný VRE izolován. Kolonizace či infekce VRE však zpravidla předchází systémové infekci, jelikož hrozí riziko průniku VRE do krevního řečiště s následným rozvojem septického stavu. Enterokoky patří mezi často izolované patogeny z hemokultur při rozvoji bakteriémie. V Severní Americe jsou čtvrtým nejčastějším původcem bakteriémií a v Evropě jsou na pátém místě [37]. Jsou-li původcem těchto infekcí VRE, zvyšuje se podle některých studií potencionální riziko úmrtí, a to až dvakrát oproti infekcím způsobených enterokoky k vankomycinu citlivými [2, 38]. Podle jiných studií vede k úmrtní samotná enterokoková bakteriémie, zejména je-li původcem E. faecium, spolu se základní diagnózou, věkem a komorbiditami pacienta a tudíž samotná rezistence k vankomycinu se na zvyšování smrtnosti nepodílí [39, 40]. Zda tedy rezistence k vankomycinu je důvodem horšího průběhu enterokokových infekcí, zůstává sporné. Bezpochyby jsou však infekce způsobené VRE spojeny s vyššími finančními náklady na léčbu [40].
K záchytu VRE docházelo v našem šetření nejčastěji v zimních a jarních měsících. Častější výskyt VRE v chladnějších měsících roku zaznamenaly i jiné studie, přičemž se předpokládá, že důvodem této sezonnosti by mohl být nárůst v počtu pacientů ve zdravotnickém zařízení během tohoto období roku či různé změny v imunitním systému spojené s nižší teplotou [26]. Šíření VRE pravděpodobně usnadňují i další těžko ovlivnitelné faktory, jako například meteorologické podmínky (zejména vlhkost) či zeměpisná šířka [41]. VRE vykazují značnou odolnost vůči vnějšímu prostředí. Na rukou mohou perzistovat déle jak 60 minut a na povrchu zdravotnického materiálu i několik týdnů, což umožňuje jejich exogenní přenos a usnadňuje šíření po zdravotnickém zařízení [2, 42]. Řada epidemiologických studií prokázala, že šíření VRE z kolonizovaného pacienta na další pacienty se uskutečňuje jak přímým kontaktem (tzv. cross colonisation), tak rukama ošetřujícího zdravotnického personálu či kontaminovanými předměty (teploměry, stetoskopy, tlakoměry, nádoby na moč, rámy postelí apod.) [11, 43]. V našem šetření absolvovalo 71 % pacientů s nálezem VRE cvičení s fyzioterapeutem, což mohlo usnadnit přenos a šíření VRE. Zdravotničtí pracovníci a zejména ošetřující a rehabilitační sestry manipulují během dne s velkým množstvím pacientů často z různých oddělení. Dodržování zásad bariérové péče a hygieny rukou je u nich však v běžném provoze obtížně kontrolovatelné. Navíc VRE bývají často rezistentní k řadě dezinfekčních látek, takže i správně provedená dezinfekce rukou nemusí být zcela účinná [4]. Pro potvrzení této teorie by však bylo nezbytné provést opakovaná mikrobiologická vyšetření stěrů z rukou uvedeného zdravotnického personálu. K přenosu VRE na vnímavého pacienta může dojít také z prostředí kontaminovaného VRE od pacientů. Do kontaktu s prostředím (rámy postelí, kliky od dveří atd.) přicházejí jak pacienti, tak zdravotníci, kteří se ho běžně dotýkají nechráněnýma rukama. Provádění dezinfekce rukou po každém kontaktu s předměty či prostředím bývá obvykle méně časté než po kontaktu s pacientem. Některé studie však považují přenos VRE z prostředí za méně pravděpodobný, jelikož jeho kontaminace bývá přechodná pro nízký růst bakterií na kontaminovaných plochách, a vyzdvihují význam přímého přenosu [17].
Co tedy dělat a jaká opatření provádět, zjistí-li se, že hospitalizovaný pacient je kolonizován či infikován VRE? Při potvrzení nozokomiálního charakteru šíření VRE je nutno zpřísnit protiepidemická opatření, jelikož řada dřívějších studií se ve svých publikacích dělí o zkušenost, že jakmile se VRE vyskytne ve zdravotnickém zařízení a rozšíří se na více oddělení, počet případů kolonizace a infekce narůstá a nejsou-li včas zavedena účinná kontrolní opatření, VRE se adaptuje a stává se zde endemickým patogenem [44]. V takovém případě je eradikace patogenu téměř nemožná, avšak zpřísněním protiepidemických opatření může být omezeno alespoň šíření VRE mezi pacienty [11]. Od prvního výskytu VRE ve FN HK byla stanovena opatření spočívající v izolaci pacienta, v přísném dodržování pravidel bariérové ošetřovatelské péče, v úpravě antimikrobiální terapie a také v upravení dezinfekčního plánu. Izolace pacienta trvá do třetí negativní kultivace na přítomnost VRE a ruší ji nemocniční hygienik. Také většina studií zabývajících se epidemiologií VRE považuje za nezbytnou izolaci pacienta a spolupráci zdravotnického personálu v zásadách bariérové ošetřovatelské péče, která spočívá zejména v používání ochranných osobních pomůcek a v důkladné a pravidelné hygieně rukou. Cílem je zamezení šíření VRE na další pacienty či zdravotnický personál [11, 38]. Rozšíření VRE ve zdravotnickém zařízení totiž představuje hrozbu z několika důvodů. Nejen že se zde může VRE stát endemickým patogenem, ale jeho přítomnost navíc vytváří rezervoár mobilních genů rezistence, které se mohou přenést nejenom na citlivé enterokoky, ale i na jiné, případně i virulentnější patogeny. Popsán byl přenos na methicillin rezistentního Staphylococcus aureus za vzniku vankomycin rezistentního S. aureus (VRSA) [3, 44, 45]. Rozšíření takového patogenu by mohlo být dalším krokem v globální krizi antibiotické rezistence. Kromě toho jsou VRE rezistentní nejen k vankomycinu, ale i k mnoha dalším antibiotikům, tudíž vhodná léčba infekcí způsobených VRE je značně omezená a většinou spočívá v podávání antibiotik s vyšší toxicitou i vyšší cenou (linezolid, quinupristin/dalfopristin) [1, 22]. Používání těchto antibiotik sice pomůže zamezit dalšímu šíření VRE, avšak vede k navýšení finančních nákladů zdravotnického zařízení. Navíc se v posledních letech objevují případy VRE rezistentních i k těmto lékům [46]. Jako nákladově efektivní se proto jeví průběžný screening všech pacientů v riziku včetně kontaktů pacientů s nálezem VRE a následnou izolací kolonizovaných či infikovaných pacientů [38]. Některé studie popisují snížení výskytu VRE po omezení podávání vankomycinu či cefalosporinů. Úplná redukce užívání vybraných antibiotik však není možná, jelikož by omezovala možnosti léčby s případným nadužíváním jiných antibiotik, což by mohlo vést ke vzniku dalších rezistentních patogenů [47]. Výsledky jiných studií popisují po omezení užívání vankomycinu naopak zvýšení výskytu VRE. Úspěch ve snížení výskytu VRE zaznamenaly většinou studie, které omezení užívání vankomycinu zavedly v kombinaci s dalšími protiepidemickými opatřeními (pravidelný screening, bariérová ošetřovatelská péče – pravidelná dezinfekce rukou, izolace pacienta apod.) [48, 49]. Avšak objevují se i studie zpochybňující účinnost izolace či průběžného screeningu a zdůrazňující význam jiných opatření, jako je precizní hygiena rukou, důkladná dezinfekce prostředí či efektivní antibiotická politika [50, 51].
Epidemiologie VRE se v rozličných regionech světa významně liší a diskuse v problematice jejich prevence bývají poměrně kontroverzní. I výsledky různých studií bývají rozdílné a neexistuje žádné univerzální pravidlo pro předcházení vzniku a šíření VRE. Při jejich výskytu je tedy třeba situaci individuálně vyhodnotit a podle možností zdravotnického zařízení zavést ideálně kombinaci více opatření.
Při zpracovávání této práce již byl znám celkový počet hospitalizovaných pacientů s nálezem VRE (novým i známým) ve FN HK v roce 2018, který byl shodný s rokem 2017. K nárůstu nozokomiálních přenosů VRE oproti předchozím rokům tedy již dále nedocházelo, a to nepochybně díky zpřísnění a implementací protiepidemických opatření spočívajících v každodenním sledování výskytu VRE, podrobném a průběžném epidemiologickém šetření na postižených pracovištích a v detailním poučení personálu o správných postupech omezujících riziko šíření VRE. Při zpětném hodnocení lze soudit, že jednou z příčin nárůstu VRE ve FN HK v letech 2014–2017 bylo nejspíše nedostatečné dodržování hygienicko-protiepidemických pravidel, zejména hygieny rukou. Svoji úlohu jistě hrálo nadužívání jednorázových rukavic namísto provádění hygienické dezinfekce rukou, která tak byla pravděpodobně často opomíjena. Pro definitivní potvrzení této teorie je nezbytná molekulárně genetická analýza všech zachycených VRE se stanovením případné klonality izolátů, která však provedena nebyla. Autoři jsou si vědomi i dalších limitací své práce. Vzhledem k retrospektivnímu přístupu mají prezentovaná data spíše popisný charakter a uvedené výsledky jsou časově omezené na jeden rok. Rovněž chybí kontrolní skupina pacientů se záchytem enterokoka citlivého k vankomycinu. Jelikož jeho nález se na Oddělení nemocniční hygieny nehlásí a v NIS není jednotná databáze pacientů s nálezem citlivého enterokoka, bylo by velmi obtížné tato data pro retrospektivní zpracování dohledat. O získaných výsledcích se proto diskutovalo v kontextu s výsledky prezentovanými v dřívějších publikacích.
ZÁVĚR
Výskyt VRE v nemocničním prostředí souvisí s celou řadou komplikací. Z pohledu pacienta se jedná o vyšší riziko zhoršení klinického stavu během hospitalizace, z pohledu zdravotnického zařízení jde o složitý a finančně náročný preventivní a terapeutický management a z pohledu mikrobiologa se jedná převážně o riziko přenosu genů rezistence na další případně i virulentnější bakterie. Významný vliv v kontrole výskytu VRE hraje informovanost personálu o epidemiologii VRE, o cestách přenosu a možnostech prevence.
Tato práce vznikla za finanční podpory Ministerstva obrany České republiky – dlouhodobého záměru rozvoje organizace Zdravotnická problematika zbraní hromadného ničení Fakulty vojenského zdravotnictví Univerzity obrany.
Do redakce došlo dne 12. 7. 2019.
Prohlášení autorů
Autorka práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
npor. MUDr. Petra Polcarová
Katedra epidemiologie, Fakulta vojenského zdravotnictví Univerzity obrany Brno
Třebešská 1575
500 01 Hradec Králové
e-mail: petra.polcarova@unob.cz
Zdroje
1. Vágnerová I, Kolář M. Možnosti terapie infekcí způsobených vankomycin-rezistentními enterokoky. Klin Farmakol Farm, 2003;17 : 170–173.
2. O’Driscoll T, Crank ChW. Vancomycin-resistant enterococcal infec-tions: epidemiology, clinical manifestations, and optimal management. Infect Drug Resist, 2015;8 : 217–230.
3. Miller WR, Munita JM, Arias CA. Mechanisms of antibiotic resistance in enterococci. Expert Rev Anti Infect Ther, 2014;12(10):1221–1236.
4. Kolář M. Problematika vankomycin-rezistentních enterokoků. Klin Mikrobiol Inf Lek, 2018;24(2):50–56.
5. U.S. Department of Health and Human Services. Centers for Disease Control and Prevention. Antibiotic resistance threats in the United States, 2013. Dostupné na www: https://www.cdc.gov/drugresistance/pdf/ar-threats-2013-508.pdf.
6. Talaga-Ćwiertnia K, Bulanda M. Analysis of the world epidemiological situation among vancomycin-resistant Enterococcus faecium infections and the current situation in Poland. Przegl epidemiol, 2018;72(1):3–15.
7. McDonald LC, Kuehnert MJ, Tenover FC, et al. Vancomycin-Resistant Enterococci Outside the Health-Care Setting: Prevalence, Sources, and Public Health Implications. Emerg Infect Dis, 1997;3(3):311–317.
8. European Centre for Disease Prevention and Control. Surveillance of antimicrobial resistance in Europe 2016. Annual Report of the European Antimicrobial Resistance Surveillance Network (EARS-Net), 2017. Dostupné na www: https://www.ecdc.europa.eu/sites/portal/files/documents/AMR-surveillance-Europe-2016.pdf.
9. Gastmeier P, Schröder C, Behnke M, et al. Dramatic increase in vancomycin-resistant enterococci in Germany. J Antimicrob Chemother, 2014;69(6):1660–1664.
10. Werner G, Coque TM, Hammerum AM, et al. Emergence and spread of vancomycin resistance among enterococci in Europe. Euro Surveill, 2008;20;13(47)pii: 19046.
11. Bonten MJM, Willems R, Weinstein RA. Vancomycin-resistant enterococci: why are they here, and where do they come from? Lancet Infect Dis, 2001;1 : 314–325.
12. Willems RJL, Top J, Braak van den N, et al. Host Specificity of Vancomycin-Resistant Enterococcus faecium. J Infect Dis, 2000;182(3):816–823.
13. Bortolaia V, Mander M, Jensen LB, et al. Persistence of vancomycin resistance in multiple clones of Enterococcus faecium isolated from Danish broilers 15 years after the ban of avoparcin. Antimicrob Agents Chemother, 2015;59(5):2926–2929.
14. Nilsson O, Greko C, Top J, et al. Spread without known selective pressure of a vancomycin-resistant clone of Enterococcus faecium among broilers. J Antimicrob Chemother, 2009;63(5):868–872.
15. Cetinkaya Z, Falk P, Mayhall CG. Vancomycin-Resistant Enterococci. Clin Microbiol Rev, 2000;13(4):686–707.
16. Harbarth S, Cosgrove S, Carmeli Y. Effects of Antibiotics on Nosocomial Epidemiology of Vancomycin-Resistant Enterococci. Antimicrob Agents Chemother, 2002;46(6)1619–1628.
17. Bonten MJM, Hayden MK, Nathan C, et al. Epidemiology of colonisation of patients and environment with vancomycin-resistant enterococci. Lancet, 1996;348 : 1615–1619.
18. Montecalvo MA, Lencastre H, Carraher M, et al. Natural History of Colonization with Vancomycin-Resistant Enterococcus Faecium. Infect Control Hosp Epidemiol, 1995; 16(12):680–685.
19. Tresoldi AT, Cardoso LGO, Castilho GV, et al. Low prevalence of vancomycin resistant enterococci colonization in intensive care patients in a Brazilian teaching hospital. Braz J Infect Dis, 2006;10(4):239–241.
20. Vágnerová I, Sauera P, Kolář M. Sources and pathways of spread of vancomycin-resistant enterococci in hemato-oncological patients. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub, 2006;150(1):117–120.
21. Geldart KG, Kommineni S, Forbes M, et al. Engineered E. coli Nissle 1917 for the reduction of vancomycin-resistant Enterococcus in the intestinal tract. Bioeng Transl Med, 2018;3 : 197–208.
22. Zirakyadeh A, Patel R. Vancomycin-Resistant Enterococci: Colonization, Infection, Detection, and Treatment. Mayo Clin Proc, 2006;81(4):529–536.
23. Tornieporth NG, Roberts RB, John J, et al. Risk Factors Associated with Vancomycin-Resistant Enterococcus faecium Infection or Colonization in 145 Matched Case Patients and Control Patients. Clin Infect Dis, 1996; 23 : 767–772.
24. Zaas AK, Song X, Tucker P, et al. Risk Factors for Development of Vancomycin-Resistant Enterococcal Bloodstream Infection in Patients with Cancer Who Are Colonized with Vancomycin-Resistant Enterococci. Clin Infect Dis, 2002;35(10):1139–1146.
25. Moellering RC, Linden PK, Reinhardt J, et al. The efficacy and safety of quinupristin/dalfopristin for the treatment of infections caused by vancomycin-resistant Enterococcus faecium. J Antimicrob Chemother, 1999;44(2):251–261.
26. Monteserin N, Larson E. Temporal trends and risk factors for healthcare-associated vancomycin-resistant enterococci in adults. J Hosp Infect, 2016;94(3):236–241.
27. Filipovský J. Arteriální hypertenze ve stáří. Medicína po promoci, 2017. Dostupné na www: https://www.tribune.cz/clanek/41935-arterialni-hypertenze-ve-stari.
28. Simner PJ, Adam H, Baxter M, et al. Epidemiology of vancomycin-resistant enterococci in Canadian hospitals (CANWARD study, 2007 to 2013). Antimicrob Agents Chemother, 2015;59(7):4315–4317.
29. Joels CS, Matthews BD, Sigmon LB, et al. Clinical characteristics and outcomes of surgical patients with vancomycin-resistant enterococcal infections. Am Surg, 2003;69(6):514–519.
30. Karki S, Land G, Aitchison S, et al. Long-term carriage of vancomycin-resistant enterococci in patients discharged from hospitals: a 12-year retrospective cohort study. J Clin Microbiol, 2013;51(10):3374–3379.
31. Wendt C, Krause C, Xander LU, et al. Prevalence of colonization with vancomycin-resistant enterococci in various population groups in Berlin, Germany. J Hosp Infect, 1999;42 : 193–200.
32. Louisiana Office of Public Health – Infectious Disease Epidemiology Section. Vancomycin Resistant Enterococcus (VRE). Annual Report, 2016. Dostupné na www: http://ldh.la.gov/assets/oph/Center-PHCH/Center-CH/infectious-epi/Annuals/VRE_LaIDAnnual.pdf.
33. Kampmeier S, Kossow A, Clausen LM, et al. Hospital acquired vancomycin resistant enterococci in surgical intensive care patients – a prospective longitudinal study. Antimicrob Resist Infect Control, 2008;7 : 103.
34. Mazuski JE. Vancomycin-resistant Enterococcus: Risk factors, surveillance, infections, and treatment. Surg Infect, 2008;9(6):567–571.
35. Rice LB. Emergence of Vancomycin-Resistant Enterococci. Emerg Infect Dis, 2001;7(2):183–187.
36. SZÚ. Databáze výsledků EARS-Net [online]. 2010. Dostupné na www: https://apps.szu.cz/earsnet/uvod.php.
37. Deshpande LM, Fritsche TR, Moet GJ, et al. Antimicrobial resistence and molecular epidemiology of vancomycin-resistant enterococci from North America and Europe: a report from the SENTRY antimicrobial surveillance program. Diagn Microbiol Infect Dis, 2007; 58 : 163–170.
38. Morris-Downes M, Smyth EG, Moore J, et al. Surveillance and endemic vancomycin-resistant enterococci: some succes in control is possible. J Hosp Infect, 2010;75 : 228–233.
39. Wells CL, Juni BA, Cameron SB, et al. Stool Carriage, Clinical Isolation, and Mortality During an Outbreak of Vancomycin-Resistant Enterococci in Hospitalized Medical and/or Surgical Patients. Clin Infect Dis, 1995; 21(1):45–50.
40. Kramer TS, Remschmidt C, Werner S, et al. The importance of adjusting for enterococcus species when assessing the burden of vancomycin resistance: a cohort study including over 1000 cases of enterococcal bloodstream infections. Antimicrob Resist Infect Control, 2018; 7 : 133.
41. Blanco N, Perencevich E, Li SS, et al. Effect of meteorological factors and geografic location on methicillin-resistant Staphylococcus aureus and vancomycin-resistant enterococci colonization in the US. PLoS One, 2017;12(5): e0178254.
42. Neely AN, Maley MP. Survival of Enterococci and Staphylococci on Hospital Fabrics and Plastic. J Clin Microbiol, 2000;38(2):724–726.
43. Boyce JM, Opal SM, Chow JW, et al. Outbreak of Multidrug-Resistant Enterococcus faecium with Transferable vanB Class Vancomycin Resistance. J Clin Microbiol, 1994; 32(5):1148–1153.
44. Ostrowsky BE, Trick WE, Sohn AH, et al. Control of vancomycin-resistant enterococcus in health care facilities in a region. N Engl J Med, 2001; 344(19):1427–1433.
45. Chang S, Sievert DM, Hageman JC, et al. Infection with Vancomycin-Resistant Staphylococcus aureus Containing the vanA Resistance Gene. N Engl J Med, 2003;348 : 1342–1347.
46. Greene MH, Harris BD, Nesbitt WJ, et al. Risk Factors and Outcomes Associated With Acquisition of Daptomycin and Linezolid–Nonsusceptible Vancomycin-Resistant Enterococcus. Open Forum Infect Dis, 2018;5(10):ofy185.
47. McKinnell JA, Kunz DF, Chamot E, et al. Association between vancomycin-resistant Enterococci bacteremia and ceftriaxone usage. Infect Control Hosp Epidemiol, 2012;33(7):718–724.
48. Anglim, AM, Klym B, Byers KE, et al. Effect of a Vancomycin Restriction Policy on Ordering Practices During an Outbreak of Vancomycin-Resistant Enterococcus faecium. Arch Intern Med, 1997;157(10):1132–1136.
49. de Bruin MA, Riley LW. Does vancomycin prescribing intervention affect vancomycin-resistant enterococcus infection and colonization in hospitals? A systematic review. BMC Infect Dis, 2007;7 : 24.
50. Cheah ALY, Cheng AC, Spelman D, et al. Mathematical modelling of vancomycin-resistant enterococci transmission during passive surveillance and active surveillance with contact isolation highlights the need to identify and address the source of acquisition. BMC Infect Dis, 2018;18(1):511.
51. Vehreschild MJGT, Haverkamp M, Biehl LM, et al. Vancomycin-resistant enterococci (VRE): a reason to isolate? Infection, 2019;47(1):7–11.
Štítky
Hygiena a epidemiológia Infekčné lekárstvo Mikrobiológia
Článok vyšiel v časopiseEpidemiologie, mikrobiologie, imunologie
Najčítanejšie tento týždeň
2020 Číslo 3- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Očkování proti virové hemoragické horečce Ebola experimentální vakcínou rVSVDG-ZEBOV-GP
- Koronavirus hýbe světem: Víte jak se chránit a jak postupovat v případě podezření?
-
Všetky články tohto čísla
- Epidemiologie vankomycin-rezistentních enterokoků ve Fakultní nemocnici Hradec Králové v roce 2017
- Increase in RNASEL gene expression by miR-29-3p inhibitors in HEK293T cells
- Séroprevalence IgG protilátek proti spalničkám u zaměstnanců Nemocnice Strakonice, a.s.
- Mohou hodnoty biomarkerů, imitující gramnegativní zánětlivou odpověď, negativně ovlivnit iniciální volbu antibiotika u pacientů se sepsí vyvolanou Streptococcus pyogenes?
- Implementace a využití metody sekvenace celého genomu (WGS) v surveillance invazivního pneumokokového onemocnění, Česká republika, 2017–2019
- Koutule skvrnitá – Clogmia albipunctata (Diptera: Psychodidae) – muška s epidemiologickým potenciálem a rizikem myiáz
- The duration of SARS-CoV-2 shedding in patients recovering from COVID-19
- Jubileum profesora Vladimíra Vonky
- Životní jubileum RNDr. Vratislava Němečka, CSc.
- Vzpomínky na MUDr. Evu Jílkovou
- MUDr. Jarmila Kaustová (* 8. 3. 1945 – † 1. 5. 2020)
- Smuteční oznámení: zemřel doc. MUDr. Vlastimil Obdržálek, CSc.
- Epidemiologie, mikrobiologie, imunologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Epidemiologie vankomycin-rezistentních enterokoků ve Fakultní nemocnici Hradec Králové v roce 2017
- Koutule skvrnitá – Clogmia albipunctata (Diptera: Psychodidae) – muška s epidemiologickým potenciálem a rizikem myiáz
- The duration of SARS-CoV-2 shedding in patients recovering from COVID-19
- Séroprevalence IgG protilátek proti spalničkám u zaměstnanců Nemocnice Strakonice, a.s.
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



