-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Normocytární a makrocytární anemie v seniorském věku
Normocytic and macrocytic anemia in the elderly
Anemia is a common pathological condition in patients of older age. It is associated with a variety of complications, including increased risk of death, and therefore the adequate diagnosis and treatment is important. The most common causes of anemia in elderly are iron deficiency anemia, anemia of chronic disease, anemia in chronic kidney disease or „unexplained“ anemia. The present article summarizes the issues of diagnosis and differential diagnosis of normocytic and macrocytic anemia in the elderly.
Keywords:
anemia – normocytic anemia – macrocytic anemia – anemia of chronic disease – megaloblastic anemia
Autoři: J. Kissová
Působiště autorů: Oddělení klinické hematologie LF MU a FN Brno
Vyšlo v časopise: Geriatrie a Gerontologie 2014, 3, č. 4: 183-187
Kategorie: Přehledové články
Souhrn
Anemie je častým patologickým stavem nemocných staršího věku. Je spojena se širokou škálou komplikací včetně zvýšeného rizika úmrtí, a proto je náležitá diagnostika a léčba nezbytná. Nejčastějšími příčinami anemií u starších nemocných jsou sideropenické anemie, anemie chronických chorob, anemie při renální insuficienci či tzv. „nejasná“ anemie. V předloženém článku je shrnuta problematika diagnostiky a diferenciální diagnostiky normocytárních a makrocytárních anemií u seniorů.
Klíčová slova:
anemie – normocytární anemie – makrocytární anemie – anemie chronických chorob – megaloblastová anemie
Anemie je definována kritérii Světové zdravotnické organizace jako snížení hladiny hemoglobinu pod 130 g/lu mužů a pod 120 g/l u žen(1). Při naplnění těchto kritérií je podle literárních dat anemie zjištěna u 11 % u mužů a 10,2 % žen nad 65 let věku(2). Publikované údaje o prevalenci anemií u starších nemocných jsou velmi různorodé, pohybují se mezi 2,9 až 61 % u mužů a mezi 3,3 až 41 % u žen(3). Prevalence anemie narůstá s věkem; anemie se vyskytuje u 26 % mužů a 20 % žen starších 85 let(2, 4). S ohledem na stárnutí populace jsou tato data zvláště důležitá. Anemie ovlivňuje kvalitu života, kognitivní a fyzické funkce, je spojena se širokou škálou komplikací včetně pádů, fraktur, kardiovaskulárních příhod a zvýšeným rizikem úmrtí.
Etiologie anemie u seniorů
Podle literárních dat jsou nejčastějšími typy anemií u seniorů anemie z krevních ztrát a nutriční anemie (34 %), anemie chronických chorob (32 %) a tzv. „nejasné“ anemie (34 %)(2). Z nutričních anemií tvoří polovinu případů sideropenická anemie, zatímco zbývající část je způsobena deficitem vitaminu B12 a kyseliny listové(2). Velmi častým nálezem u seniorů je anemie normocytární, a to hlavně z důvodu multifakto-riální etiologie anemie u těchto nemocných.
Diferenciální diagnostika normocytární a makrocytární anemie u starších pacientů
Diagnostický algoritmus pro anemii u seniorů zahrnuje obdobná laboratorní vyšetření jako u anemií ostatních dospělých pacientů. V tradičně využívaných přístupech k hodnocení pacienta s anemií se používá jako výchozí parametr střední objem erytrocytů (MCV)(5). Podle počtu retikulocytů lze rozlišit anemii hypo - nebo hyperproliferativní. V případě retikulocytózy je nutno vyloučit anemii hemolytickou či poztrátovou. Nezbytným vyšetřením u každé anemie by mělo být posouzení nátěru periferní krve. Zvláštní pozornost by měla být věnována závažnějším laboratorním nálezům včetně nálezu další cytopenie, makrocytózy bez zjevné příčiny nebo dysplazii v periferní krvi, naznačující možnost myelodysplastického syndromu (MDS) nebo leukemie. Abnormální elektroforéza bílkovin v séru nebo moči zvyšuje pravděpodobnost mnohočetného myelomu. Monoklonální gamapatie nejasného významu je velmi běžná v populaci seniorů, je však nutno pátrat po známkách progresivního onemocnění, jako je hyperkalcemie, osteolytické kostní léze, porucha renální funkce, zvýšené procento klonálních plazmocytů v kostní dřeni nebo narůstající koncentrace monoklonálního proteinu. Při poklesu glomerulární filtrace pod 30 ml/min by měla být zvažována jako příčina anemie porucha renálních funkcí. Makrocytóza spojená s jinou cytopenií je obvykle indikací k vyšetření kostní dřeně (k vyloučení aplastické anemie či MDS). Leukoerytroblastický obraz v periferní krvi (abnormální morfologie erytrocytů, cirkulující normoblasty a vyplavování nezralých elementů neutrofilní řady) může doprovázet postižení kostní dřeně nádorovým onemocněním či primární myelofibrózou (obr. 1). V diferenciální diagnostice normocytární a makrocytární anemie jsou nezbytným vyšetřením parametry metabolismu železa, hladiny vitaminu B12 a kyseliny listové, parametry jaterních a renálních funkcí, hladiny hormonů štítné žlázy.
Obr. 1. Nátěr periferní krve. Nález přítomnosti normoblastů v periferní krvi může upozornit na možnost primární myelofibrózy či postižení kostní dřeně nádorovým onemocněním. 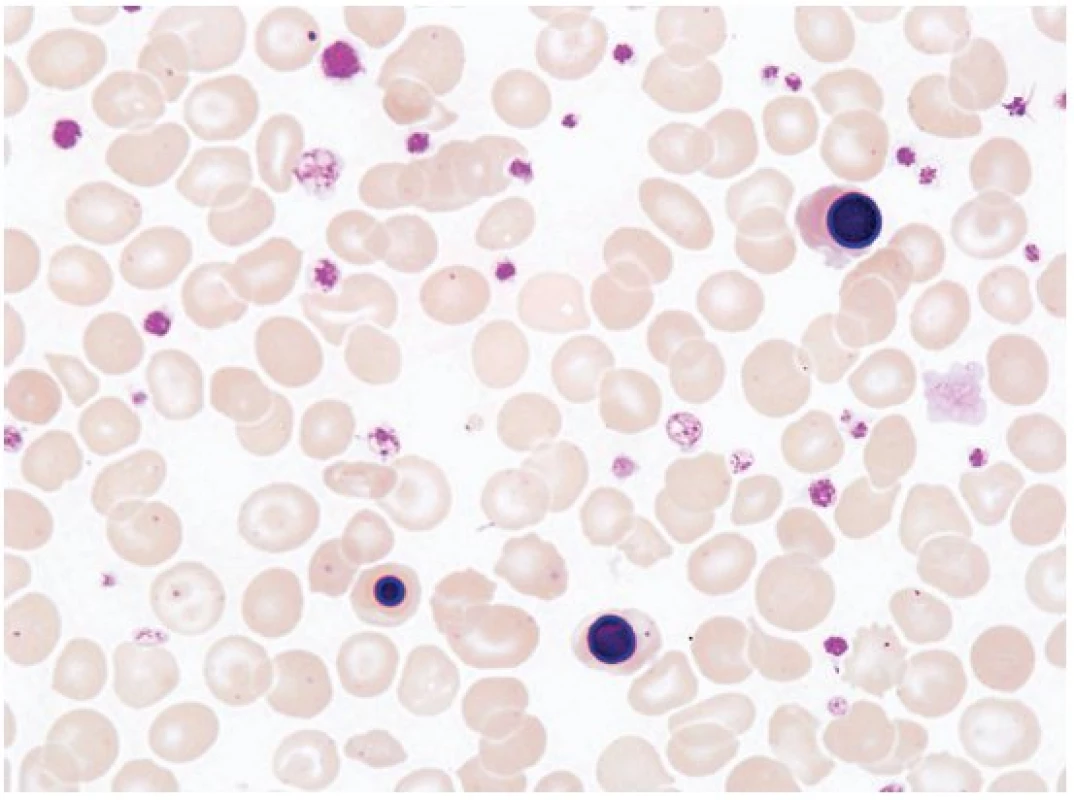
Normocytární anemie
Normocytární anemie je definovaná hodnotami středního objemu erytrocytů (MCV) v normálním rozmezí. Může být způsobena snížením produkce erytrocytů (např. anemie chronických chorob, aplastická anemie), zvýšenou destrukcí nebo ztrátou erytrocytů (např. hemolýza, posthemoragická anemie), nekompenzovaným zvýšením plazmatického objemu (např. nadbytek tekutin) nebo kombinací stavů vedoucích k mikrocytární a makrocytární anemii. Téměř všechny typy anemií mohou být v počátečním stadiu normocytární. Hlavní příčiny normocytárních anemií jsou uvedeny v tabulce 1.
Tab. 1. Příčiny normocytárních anemií 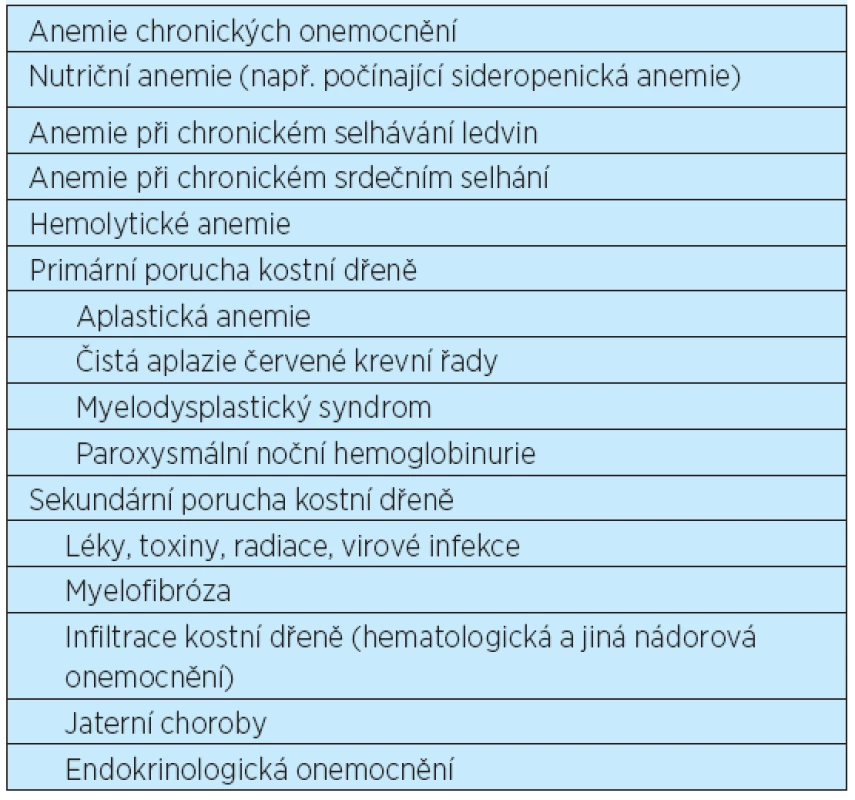
Anemie chronických onemocnění
Anemie chronických onemocnění (anemia of chronic disease – ACD) je anemie provázející chronické infekční, zánětlivé, autoimunní, neoplastické a někdy i poúrazové stavy, trvající déle než 1–2 měsíce(6). Jde o nejčastější typ anemie u hospitalizovaných nemocných a u nemocných v pokročilém věku(7). ACD lze definovat jako hypoproliferativní typ anemie způsobený zvýšenou produkcí cytokinů při jiném patologickém procesu. U nemocných staršího věku může být zánětlivá odpověď prolongovaná; přetrvává i v případě, kdy jsou zánětlivé podněty odstraněny. Přesné vysvětlení pro tuto dysregulaci není jasné; možnými zvažovanými příčinami jsou změněná regulace zánětlivé odpovědi pohlavními hormony a snížený metabolismus zánětlivých cytokinů(8).
Etiologie a patogeneze. Anemie chronických onemocnění může doprovázet řadu onemocnění. Dominantním patofyziologickým momentem ACD je zvýšená produkce zánětlivých cytokinů a hepcidinu, centrálního regulačního proteinu pro metabolismus železa. Důsledkem je porucha metabolismu železa, negativní ovlivnění proliferace a maturace erytroidních progenitorů i prekurzorů, zkrácené přežívání erytrocytů a snížení syntézy endogenního erytropoetinu doprovázené relativní rezistencí prekurzorových buněk na erytropoetin.
Laboratorní nálezy. U 70 % nemocných jde o anemii normocytární normochromní (normální MCV i střední obsah hemoglobinu v erytrocytu – MCH), v případě vleklého průběhu je anemie hypochromní mikrocytární (snížené MCV i MCH). Retikulocyty jsou normální nebo lehce nižší, parametr distribuční šíře erytrocytů (RDW) vystihující stupeň anizocytózy erytrocytů je na rozdíl od sideropenie normální, případně jen lehce zvýšený. Plazmatická hladina železa je snížena, současně je snížena nebo nejvýše normální vazebná kapacita pro železo a saturace transferinu je normální nebo jen lehce snížená. Hladina sérového feritinu je v normě nebo zvýšená. Je-li hladina feritinu pod 50 μg/l, je u nemocných s ACD velmi pravděpodobně současně přítomná sideropenie, při hodnotách pod 30 μg/l je u pacientů s ACD sideropenie téměř jistá. V úvahu je nutno vzít i skutečnost, že s věkem dochází ke vzestupu hladiny sérového feritinu. Výše solubilních transferinových receptorů (sTfR) odráží intenzitu erytropoezy, v případě ACD zůstávají hodnoty sTfR v séru nezvýšeny. Za velmi citlivý ukazatel, umožňující odlišení ACD od sideropenické anemie, je považován výpočet tzv. feritinového indexu (FI), který je podílem hladiny sTfR a dekadického logaritmu sérového feritinu (FI = sTfR/log feritin). Jeho hodnota je v případě ACD nízká. Někteří autoři tento ukazatel považují za málo citlivý a specifický a upřednostňují i nadále v diagnosticky hraničních situacích vyšetření barvitelného železa v kostní dřeni(9). Standardní vyšetření kostní dřeně je necharakteristické, zásadní význam má zhodnocení kostní dřeně s barvením za použití ferokyanidu draselného (Perlsova reakce). V případě rozvinuté ACD je počet sideroblastů snížen, bývá však přítomno zásobní železo v makrofázích. To může být i zmnoženo a mohou být přítomny četné makrofágy zcela vyplněné železem (obr. 2).
Obr. 2. Aspirát kostní dřeně s barvením na železo (Perlsova reakce). Zmnožení zásobního železa v makrofázích u pacienta s anemií chronických chorob. 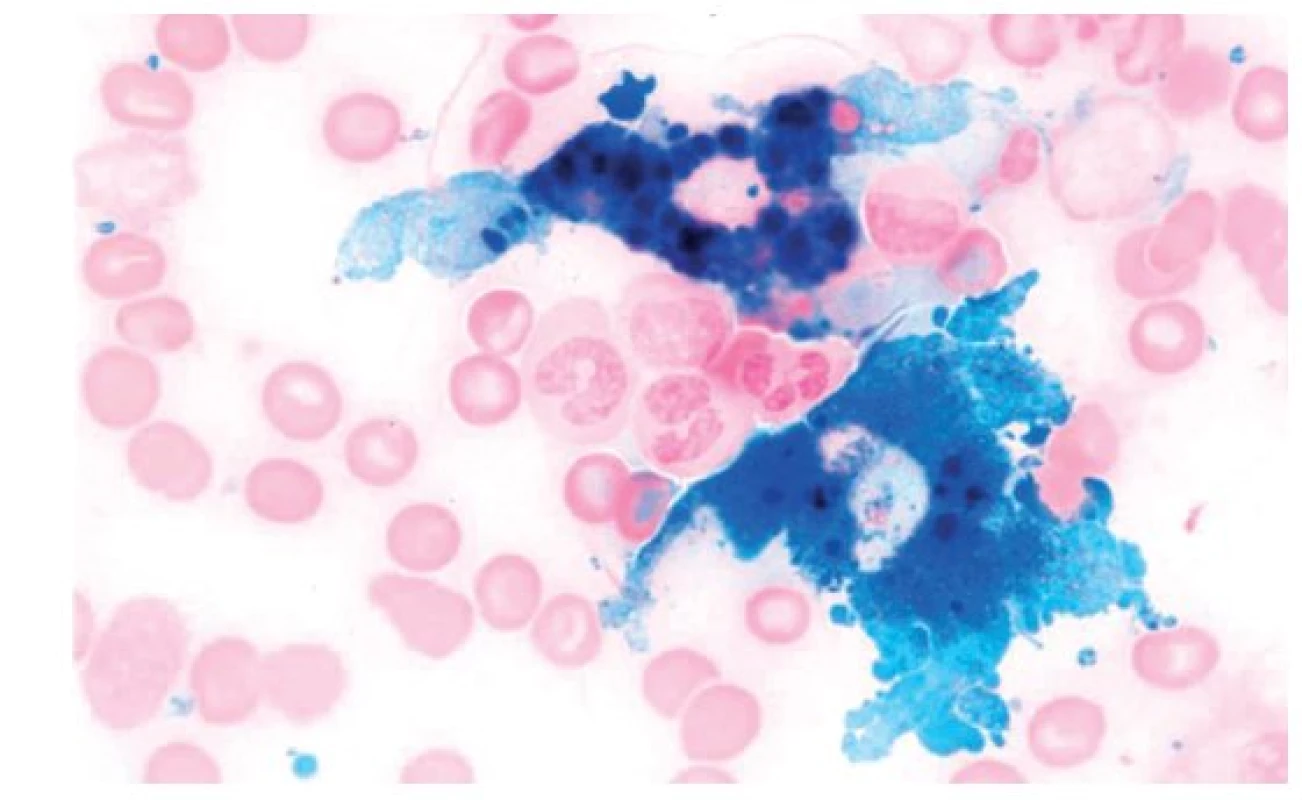
Diagnostika a diferenciální diagnostika. Východiskem diagnózy anemie chronických onemocnění je rozvoj anemie navozený určitým základním vyvolávajícím onemocněním s typickým nálezem ukazatelů metabolismu železa. Ve fázi normocytání anemie je často diferenciálnědiagnosticky zvažována možnost MDS. Nutné je vyloučení i tzv. sekundární anemie, napodobující, ale i často zahrnující podíl anemie chronických onemocnění (chronická hepatopatie, chronické renální selhání, endokrinologická onemocnění). Poměrně obtížné bývá rozpoznání koexistence nedostatku železa u nemocných s ACD. Měření sérového feritinu má v těchto případech často nízkou výpovědní hodnotu, neboť feritin je i proteinem akutní fáze, takže hladina feritinu může být ovlivněna přítomností zánětu.
Anemie u renální insuficience
Anemie u renální insuficience je typicky normocytární, normochromní a hypoproliferativní. Jedná se o multifaktoriální proces způsobený relativním deficitem erytropoetinu, uremií indukovanou inhibicí erytropoezy, zkráceným přežíváním erytrocytů a porušeným metabolismem železa. Renální postižení je u seniorů běžné, ale stupeň renálního postižení, který vede ke vzniku anemie u seniorů, je předmětem neustálé diskuse(10). Jako příčina anemie by měla být porucha renálních funkcí zvažována při poklesu glomerulární filtrace pod 30 ml/min.
Anemie při chronickém srdečním selhání
Anemie při chronickém srdečním selhání je u seniorů relativně častým jevem. Etiologie této anemie je multifaktoriální a zahrnuje anemii chronických chorob, hemodiluci při retenci tekutin, neadekvátní produkci erytropoetinu v ledvinách, snížení absorpce železa ve střevě. Rovněž vliv podávaných léků nelze vyloučit, např. inhibitory angiotenzin konvertujícího enzymu a blokátory angiotenzinového receptoru inhibují erytropoezu(11).
Hemolytické anemie
U všech typů hemolytických anemií může být zřejmý laboratorní průkaz destrukce erytrocytů (zvýšená laktátdehydrogenáza), zvýšeného katabolismu hemoglobinu (představován zvýšenou hladinou nepřímého bilirubinu), snížené hladiny haptoglobinu a regeneračního úsilí kostní dřeně (retikulocytóza). V rutinní klinické praxi je preferenčně používáno nejprve rozlišení extravaskulární (vznikající v monocyto-makrofágovém systému sleziny a jater) a intravaskulární hemolýzy (vznikající rozpadem uvnitř cévního systému). Laboratorní známky hemolýzy ukazuje tabulka 2. Žádný z těchto testů však není specifický nebo schopný rozlišení mezi rozdílnými typy hemolytických anemií. Nutno je též pomýšlet na možnost léky indukovaných hemolytických anemií.
Tab. 2. Laboratorní známky hemolýzy 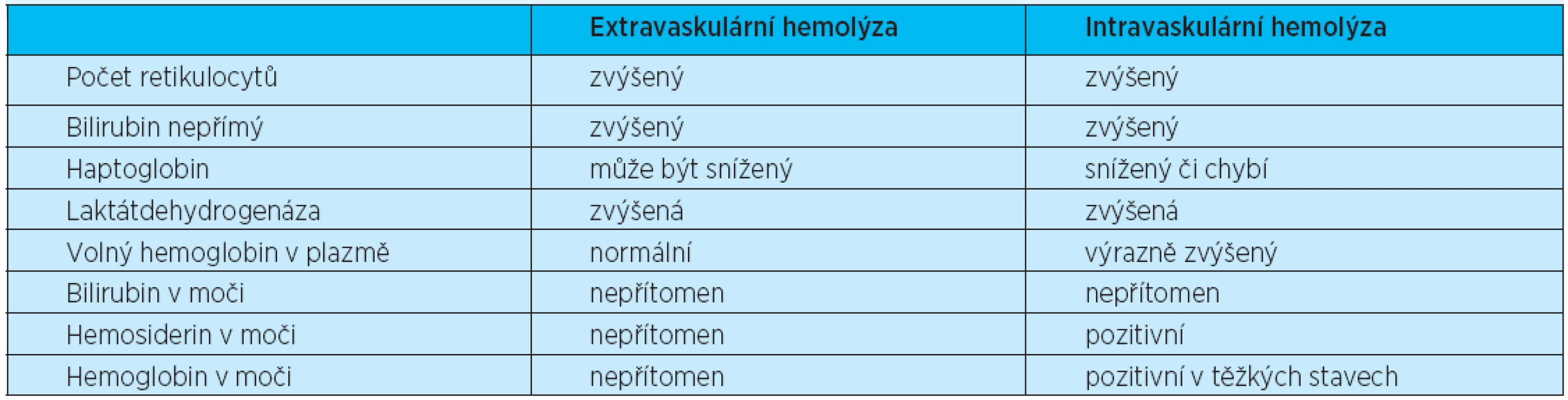
Nejasná anemie u seniorů
Nejasná anemie (v anglické literatuře nazývaná „unexplained anaemia in the elderly – UAE“ nebo „idiopathic anaemia of aging“) činí přibližně 20–30 % seniorů s anemií, až polovinu anemických pacientů v pečovatelských domech(2). V patogenezi těchto anemií jsou zvažovány následující možné mechanismy: dysregulace zánětlivé odpovědi, oslabení mechanismu odpovědi erytropoetinu na hypoxii, vliv sarkopenie, kvantitativní či kvalitativní změny v biologii kmenových buněk, snížení produkce pohlavních hormonů, časté komorbidity, polypragmazie(12, 13). Počínající myelodysplastický syndrom může být jednou z příčin „nejasné“ anemie u seniorů. Subklinický MDS nebo velmi časný MDS se může projevit izolovanou normocytární anemií jako počáteční příznak onemocnění.
Makrocytární anemie
Makrocytární anemie je anemie s hodnotami středního objemu erytrocytů (MCV) nad horní hranicí normálního rozmezí. Makrocytární anemii rozdělujeme podle počtu retikulocytů; při nezvýšeném počtu retikulocytů je rozlišována nemegaloblastová (makrocytární anemie bez přítomnosti megaloblastů) a megaloblastová anemie. Mezi příčiny nemegaloblastových anemií patří časný myelodysplastický syndrom, onemocnění jater, abusus alkoholu, aplastická anemie, hypothyreóza, časný nedostatek vitaminu B12 nebo kyseliny listové. Makrocytární anemie se zvýšeným počtem retikulocytů bývá nejčastěji příčinou hemolytických anemií, ale i substituční léčby vitaminem B12 nebo folátem. Hlavní příčiny makrocytárních anemií jsou uvedeny v tabulce 3.
Tab. 3. Příčiny makrocytárních anemií 
Anemie megaloblastová
Megaloblastová anemie je skupina anemických syndromů různé patogeneze, která je charakterizovaná určitými morfologickými znaky krvetvorných buněk v kostní dřeni, tzv. megaloblastovou přestavbou. Příčinou je buď porucha metabolismu vitaminu B12 a kyseliny listové, nebo může vznikat porucha syntézy DNA v důsledku působení léků (antimetabolity, cytostatika) či je porucha přímo v genetickém vybavení buňky.
Etiologie a patogeneze. Nejčastější příčinou megaloblastových anemií je deficit vitaminu B12 či kyseliny listové (tab. 4).
Tab. 4. Příčiny deficitu vitaminu B<sub>12</sub> a kyseliny listové 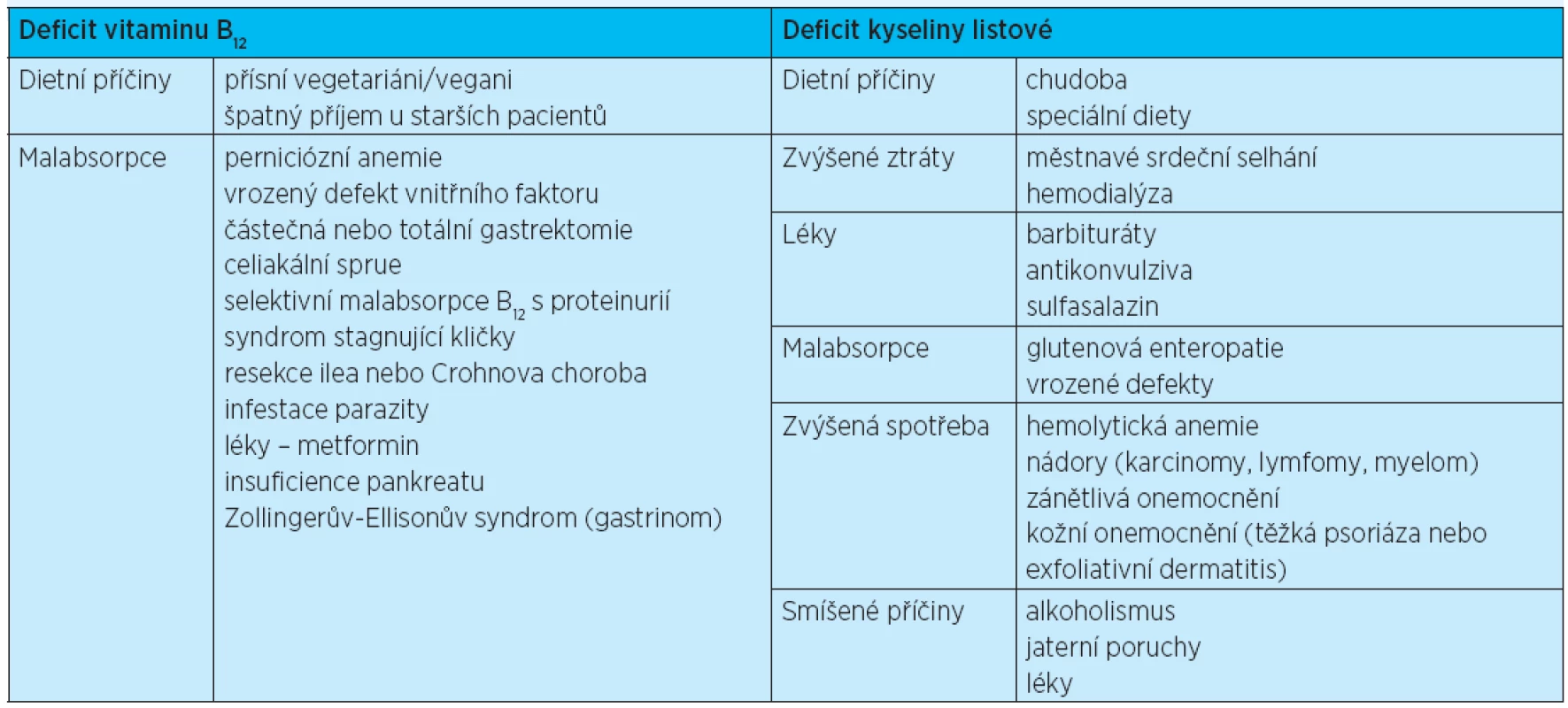
V nepřítomnosti některého z obou vitaminů dochází k poruše tvorby DNA, k prodloužení metabolismu buněk a jejich setrvání v S fázi mitózy. V důsledku těchto změn vzniká plazmojaderná asynchronie se zpožděním vyzrávání jádra za cytoplazmou. Megaloblastová přestavba se týká nejen erytropoézy, ale i vyzrávání v granulocytární řadě a megakaryopoézy.
Perniciózní anemie je anemie z nedostatku vitaminu B12 na autoimunitním podkladě, kdy v důsledku přítomnosti několika různých typů autoprotilátek je narušena resorpce tohoto vitaminu z gastrointestinálního traktu. Základním patogenetickým faktorem je nedostatek vnitřního faktoru pro resorpci vitaminu B12. Protilátky jsou namířeny buď proti parietálním buňkám žaludeční sliznice, v nichž se vnitřní faktor tvoří, nebo proti samotnému vnitřnímu faktoru; může se také jednat o tzv. blokující protilátky, které brání navázání komplexu vitaminu B12 a vnitřního faktoru na receptor v tenkém střevě (popsáno je více typů, některé se uplatní svým účinkem jen při achlorhydrii).
Klinické a laboratorní nálezy. V případě perniciózní anemie je klasickým obrazem těžká anemie, provázená plíživým rozvojem obecných příznaků anemického syndromu. Časté je postižení nervového systému, které nekoreluje s tíží anemie. Neuropatie je symetrická a postihuje častěji dolní než horní končetiny. V popředí jsou senzorické změny – symetrické parestezie nejprve konečků prstů, následně i v „ponožkových a rukavicových“ lokalizacích. Je přítomna makrocytární anemie, často s vysokými hodnotami MCV. Počet retikulocytů bývá snížený. Současně s anemií bývá mírná leukopenie a trombocytopenie. Obvykle je mírně zvýšený nepřímý bilirubin a vyšší laktátdehydrogenáza (inefektivní erytropoéza je doprovázena intramedulární hemolýzou). Vyšetření sérové hladiny vitaminu B12 a kyseliny listové může často přinést rozlišení obou stavů, ale ani tato informace není vždy dostačující. U deficitu folátu je často zjišťována nízká hladina vitaminu B12, navíc krátkodobá restrikce folátů v potravě (např. u hospitalizovaných nemocných) je spojena se snížením jeho hladiny, i když v organismu dosud skutečný deficit nenastal. Sérové hladiny folátu mohou být zvýšeny u pacientů s deficitem vitaminu B12 (více než polovina pacientů s těžším deficitem B12), pravděpodobně z důvodu poškození cesty methioninsyntházy a akumulací metyltetrahydrofolátu, hlavní formou folátu v séru. Některé publikace uvádějí možnost těžkého deficitu vitaminu B12 při současně normální hladině vitaminu B12 stanovené běžně dostupnými metodami. Měření hladiny vitaminu B12 z těchto důvodů nenaplňuje kritéria pro ideální test vysoké senzitivity a specificity(14). Nízké hladiny vitaminu B12 vznikají u 10 až 15 % seniorů, ale je odhadováno, že jen 1–2 % pacientů mají anemii z deficitu vitaminu B12(15). Izolované zjištění abnormální hladiny vitaminu B12 by nemělo být jediným kritériem, na jehož základě je postavena diagnóza. Diagnosticky cenným nálezem je v případě perniciózní anemie průkaz protilátek proti vnitřnímu faktoru a parietálním buňkám žaludeční sliznice. Protilátky proti vnitřnímu faktoru jsou pro tuto diagnózu specifické, ale mohou být negativní u 40–50 % pacientů. Častější protilátky proti parietálním buňkám žaludeční sliznice jsou pro tuto diagnózu méně specifické(16). Vyšetření kostní dřeně je součástí diferenciální diagnostiky k odlišení MDS v nejednoznačných případech. V případě podezření na malabsorpci patří mezi základní vyšetření i vyloučení patologie gastrointestinálního traktu. Při perniciózní anemii je indikováno gastroskopické vyšetření s biopsií žaludeční sliznice a histologickým vyšetřením – přítomnost atrofické gastritidy s histaminorezistentní achlorhydrií je diagnostickým nálezem. Vyšetření holotranskobalaminu představuje metodu hodnocení fyziologicky aktivního vitaminu B12, jedná se o časný marker deficitu vitaminu B12, jehož pokles lze prokázat již i při normální hladině vitaminu B12. Vyšetření kyseliny metylmalonové (MMA) a homocysteinu může být využito k odlišení deficitu folátu od deficitu vitaminu B12. Zvýšená hladina homocysteinu doprovází deficit folátu i vitaminu B12. Zvýšená hladina kyseliny metylmalonové je nalézána v případech deficitu vitaminu B12, vyšetření je užitečné k potvrzení deficitu vitaminu B12, jestliže chybí protilátky proti vnitřnímu faktoru(14). Limitací je měření MMA a homocysteinu u pacientů s renální insuficiencí (zvýšená hladina).
Diagnostika a diferenciální diagnostika. Megaloblastové anemie se projevují makrocytózou v periferní krvi a typickým nálezem v kostní dřeni. Vyšetření kostní dřeně může být nezbytné zvláště k vyloučení některých typů akutní leukemie nebo MDS. Stanovení hladiny vitaminu B12 a kyseliny listové je pro diagnózu megaloblastových anemií klíčové. Po potvrzení deficitu těchto vitaminů je nutno vyloučit příčiny uvedené v tabulce 4.
Autorka práce prohlašuje, že v souvislosti s publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny farmaceutickou firmou.
MUDr. Jarmila Kissová
Oddělení klinické hematologie LF MU a FN Brno
MUDr. Jarmila Kissová
e-mail: jkissova@fnbrno.cz
Problematikou hematologických onemocnění se zabývá od roku 1989, kdy začala pracovat na Interní hematologické a onkologické klinice LF MU a FN Brno. Od roku 2002 pracuje na Oddělení klinické hematologie FN Brno, zde od roku 2006 působí ve funkci vedoucího lékaře Laboratoře speciální morfologie. Výuce klinické hematologie se věnuje na LF MU Brno od roku 2006, od roku 2009 je odbornou asistentkou Interní hematologické a onkologické kliniky LF MU Brno. Je členkou České hematologické společnosti ČLS JEP a České skupiny pro Ph-negativní myeloproliferativní onemocnění.
Zdroje
1. Nutritional anaemias. Report of a WHO scientific group. World Health Organ Tech Rep Ser 1968; 405 : 5–37. Dostupné na http://whqlibdoc.who.int/trs/WHO_TRS_405.pdf.
2. Guralnik JM, Eisenstaedt RS, Ferrucci L et al.: Prevalence of anemia in persons 65 years and older in the United States: evidence for a high rate of unexplained anemia. Blood 2004; 104(8): 2263–2268.
3. Beghé C, Wilson A, Ershler WB: Prevalence and outcomes of anemia in geriatrics: a systematic review of the literature. Am J Med 2004; 116(Suppl 7A): 3S–10S.
4. Eisenstaedt R, Penninx BW, Woodman RC: Anemia in the elderly: current understanding and emerging concepts. Blood Rev 2006; 20(4): 213–226.
5. Tefferi A: Anemia in adults: a contemporary approach to diagnosis. Mayo Clin Proc 2003; 78(10): 1274–1280.
6. Cavill I, Auerbach M, Bailie GR et al.: Iron and the anaemia of chronic disease: a review and strategic recommendations. Current Medical research and Opinion 2006; 22(4): 731–737.
7. Buliková A: Anemie. In: Penka M, Buliková A. a kol. Neonkologická hematologie, 2. vydání, Praha: Grada Publishing 2009; 39–93.
8. Ershler WB, Keller ET: Age-associated increased interleukin-6 gene expression, late-life diseases, and frailty. Annu Rev Med 2000; 51 : 245–270.
9. Čermák J: K diferenciální diagnostice a léčbě anemií. Remedia 2003; 13 : 258–265.
10. Cumming RG, Mitchell P, Craig JC et al.: Renal impairment and anaemia in a population-based study of older people. Intern Med J 2004; 34(1–2): 20-23.
11. Pereira CA, Roscani, MG, Zanati SG et al.: Anemia, heart failure and evidence-based clinical management. Arq Bras Cardiol 2013; 101(1): 87–92.
12. Guralnik JM, Ershler WB, Schrier SL et al.: Anemia in the elderly: a public health crisis in hematology. Hematology Am Soc Hematol Educ Program 2005 : 528–532.
13. Merchant AA, Roy, CN: Not so benign haematology: anaemia of the elderly. Br J Haematol 2012; 156(2): 173–185.
14. Hamilton MS, Blackmore S: Investigation of megaloblastic anaemia: cobalamin, folate and metabolite status. In: Bain B, Bates, I, Laffan MA et al. Dacie and Levis Practical Haematology 2012; 201–228.
15. Carmel R, Green R, Rosenblatt DS et al.: Update on cobalamin, folate, and homocysteine. Hematology Am Soc Hematol Educ Program 2003 : 62–81.
16. Hoffbrand AV, Moss PAH: Megaloblastic anaemias and other macrocytic anaemias. In: Essential Haematology. Blackwell Publishing Ltd. 2011 : 58–72.
Štítky
Geriatria a gerontológia Praktické lekárstvo pre dospelých Protetika
Článok vyšiel v časopiseGeriatrie a Gerontologie
Najčítanejšie tento týždeň
2014 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Vareniklin jako pomocník v léčbě nikotinismu i u psychiatrických pacientů
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Editorial
- Hodnocení kvality života u pacientů s demencí
- Kvalita života pečovatelů – rodinných příslušníků u pacientů s těžkou demencí
- Příčiny stresu seniorů žijících v domácím prostředí
- Clostridium difficile – nebezpečný patogén pro starší pacienty
- Výživa ve stáří
- Anemie z nedostatku železa a geriatrická medicína
- Normocytární a makrocytární anemie v seniorském věku
- Dehydratace ve stáří
- Tyreopatie u seniorů
- Diabetes mellitus – geriatrické syndromy, cíle a možnosti léčby ve vyšším věku
- Nežádoucí účinky NSAID na kolopatie ve vyšším věku
-
Paliativní péče u chronického srdečního selhání:
Kdy je ten správný čas?
- Geriatrie a Gerontologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Normocytární a makrocytární anemie v seniorském věku
- Dehydratace ve stáří
- Anemie z nedostatku železa a geriatrická medicína
- Výživa ve stáří
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




