-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Mitrální stenóza
Mitral stenosis
This review article summarizes current concepts of mitral stenosis. The pathophysiological basis of the valve disease is discussed. The diagnostic tools and the therapy of the disease are pointed out.
Keywords:
mitral stenosis – rheumatic fever – echocardiography – percutaneous mitral valvotomy
Autoři: J. Ostřanský
Působiště autorů: I. interní klinika LF UP a FN Olomouc
Vyšlo v časopise: Kardiol Rev Int Med 2007, 9(4): 257-263
Kategorie: Redakční článek
Souhrn
V přehledném článku je shrnut dnešní pohled na mitrální stenózu. Je zmíněna patofyziologická podstata vady, se zvláštním zaměřením na diagnostiku a léčbu.
Klíčová slova:
mitrální stenóza – revmatická horečka – echokardiografie – perkutánní valvuloplastikaÚvod
Mitrální stenóza (MS) je většinou porevmatické onemocnění, jehož výskyt v rozvinutých zemích díky důslednější léčbě streptokokových onemocnění výrazně poklesl. V evropských centrech se snížilo zastoupení porevmatické MS mezi chlopenními vadami ze 40 % v roce 1960 na 9 % v roce 1985. V některých rozvojových zemích je však incidence stále vysoká, postiženi jsou i mladí pacienti.
Etiologie
Nejčastější příčinou vzniku MS je revmatická horečka. Málo častá je vrozená MS, nacházená u dětí a mladých pacientů. Senilní kalcifikace mitrálního anulu, karcinoid, systémový lupus erythematodes, revmatoidní artritida, mukopolysacharidóza či Fabryho choroba jsou příčiny vzácné. Obstrukci vtokové části levé komory (LK) může způsobovat tumor levé síně (LS), nejčastěji myxom, mobilní trombus nebo vrozená přepážka v LS při cor triatriatum. Jako Lutembacherův syndrom je označován defekt síňového septa a získané MS. Revmatickou horečku v anamnéze lze nalézt u 60 % pacientů (u žen 2krát častěji). Asi 1/4 pacientů s prodělanou revmatickou karditidou má izolovanou MS, častější je kombinovaná vada s mitrální insuficiencí. Etiologicky se na infekci podílí Streptococcus pyogenes skupiny A, vzácně skupiny C nebo G. Dochází ke ztluštění cípů fibrózou a srůstu komisur, v typickém případě následuje retrakce cípů a subvalvulárního aparátu se zkrácením a fúzí šlašinek. Finálně dochází ke kalcifikaci chlopně. Čím více je postižen závěsný aparát chlopně, tím častější je výskyt mitrální insuficience. Klinické symptomy se v rozvinutých zemích objevují přibližně 20-30 let od prodělané revmatické horečky. Před rozvojem chirurgického či intervenčního řešení vady bylo 10leté přežívání neléčených, asymptomatických či málo symptomatických pacientů více než 80%. Pokud se však objeví limitující příznaky, 10leté přežití klesá bez intervenčního zásahu na 5-15 %, v případě těžké plicní hypertenze je průměrná doba života kratší než 3 roky. Úmrtí je způsobeno nejčastěji srdečním selháním (60-70 %), méně často systémovou embolií (20-30 %), plicní embolií (10 %) a infekcí (do 5 %) [1-3].
Patofyziologie
Redukce plochy mitrálního ústí (mitral valve area - MVA), která se u nepoškozené chlopně pohybuje mezi 4-6 cm2, vede ke zvýšení tlaku v LS a nárůstu diastolického transmitrálního gradientu. Při redukci plochy ústí na 1,5-2 cm2, resp. na 1,0 cm2/m2 plochy těla, se jedná o MS lehkého stupně, kdy klidový tlak v LS nebývá zvýšen a střední gradient není vyšší než 8 mmHg (tab. 1). V zátěži, při zvýšení srdečního výdeje, však hodnoty gradientu i tlaku v LS mohou až dramaticky narůstat. Jako středně těžkou MS označujeme redukci MVA na 1-1,5 cm2, resp. 1,0-0,6 cm2/m2, s odpovídajícím středním gradientem 9-15 mmHg a jako těžkou MS stav, kdy MVA je menší než 1 cm2, resp. pod 0,5 cm2/m2, s odpovídajícím středním gradientem nad 16 mmHg, kdy klidový tlak v LS může převýšit 22 mmHg (a srdeční výdej je redukován již za klidových podmínek). Následkem je městnání krve v plicním řečišti a vznik plicní hypertenze. U některých pacientů (častěji s anamnézou chronického plicního onemocnění) dochází vlivem arteriolární plicní vazokonstrikce a posléze morfologických změn plicních cév ke vzniku tzv. reaktivní plicní hypertenze. Důsledkem je abnormální zátěž a hypertrofie pravé komory s možnou trikuspidalizací vady. Nízký srdeční výdej pravé komory (i v zátěži) je jedním z ochranných mechanismů před vznikem plicního edému, k nimž patří též zvýšená kapacita lymfatické drenáže v plicním řečišti a snížená permeabilita alveolokapilární membrány. Tyto patofyziologické děje doplňuje redistribuce plicní perfuze ve prospěch horních partií plic. Srdeční výdej u lehké MS je v zátěži schopen růstu, zatímco u těžké MS nebo při vzniku fibrilace síní (FiS) je redukován již v klidu. Pro vznik symptomů je totiž zásadním momentem zvýšení transvalvulárního gradientu, závislé na diastolické plnicí periodě. Zvýšení srdeční frekvence při fyzické či psychické zátěži, infekci, v těhotenství nebo při FiS s rychlou odpovědí komor tak vede k obtížím již u lehké MS. Systolická funkce LK bývá zachována, u 1/3 pacientů však sledujeme poruchu hybnosti zadní stěny bazálně, zřejmě v důsledku proběhlé revmatické karditidy [1,2,4,5].
Tab. 1. Kvantifikace mitrální stenózy. 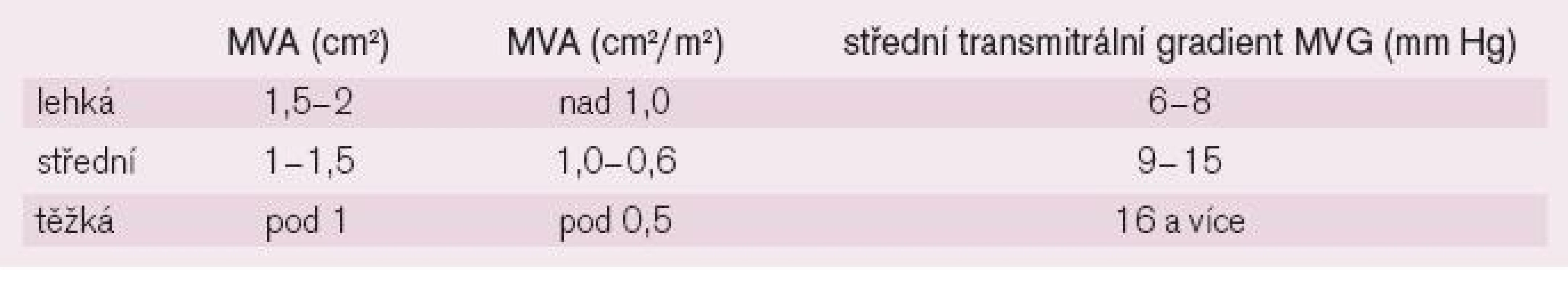
Klinické projevy
Lehká MS se většinou manifestuje jen při větší zátěži nebo vzniku FiS. Vedoucím příznakem je dušnost, zpočátku námahová, v pozdějších fázích i klidová. Pacienti s těžkou MS mohou mít trvale intersticiální plicní edém. Menší část pacientů udává hemoptýzu, která však nebývá masivní. Výskyt kašle koreluje s chronickou plicní kongescí. Bolest na hrudi charakteru anginy pectoris souvisí spíše s koincidencí ischemické choroby srdeční než s možností embolizace do věnčitých tepen. Vzácný je Ortnerův syndrom – chrapot, podmíněný kompresí levého rekurentního nervu dilatovanou plicnicí či dysfagie na podkladě útlaku jícnu dilatovanou LS [1,2,6,7].
Diagnóza
Ke stanovení diagnózy MS využíváme - kromě důsledné anamnézy - fyzikální vyšetření, RTG hrudníku, EKG, echokardiografii, katetrizaci, případně spirometrii.
Při fyzikálním vyšetření je často nápadná facies mitralis (zarudnutí tváří v oblasti lícních kostí, často spojená s cyanózou jazyka, rtů a ušních boltců, objevující se až v pokročilejších stadiích onemocnění), způsobená malým srdečním výdejem a periferní vazokonstrikcí. Při poslechu srdce je typickým nálezem tzv. mitrální trojzvuk: akcentovaná 1. srdeční ozva a časný diastolický otvírací zvuk, které nemusí být vyjádřeny u kalcifikovaných rigidních chlopní, a holodiastolický šelest s presystolickým zesílením (chybí u FiS). Jiné šelesty na srdci znamenají přítomnost přidružené vady: systolický šelest nad mitrální nebo trikuspidální chlopní při jejich insuficienci. Nepřízvučné chrůpky na plicích prozrazují přítomnost městnání, pravostranné srdeční selhání se projevuje zvýšenou náplní krčních žil, hepatomegalií, otoky dolních končetin, případně ascitem či cyanózou [1,6].
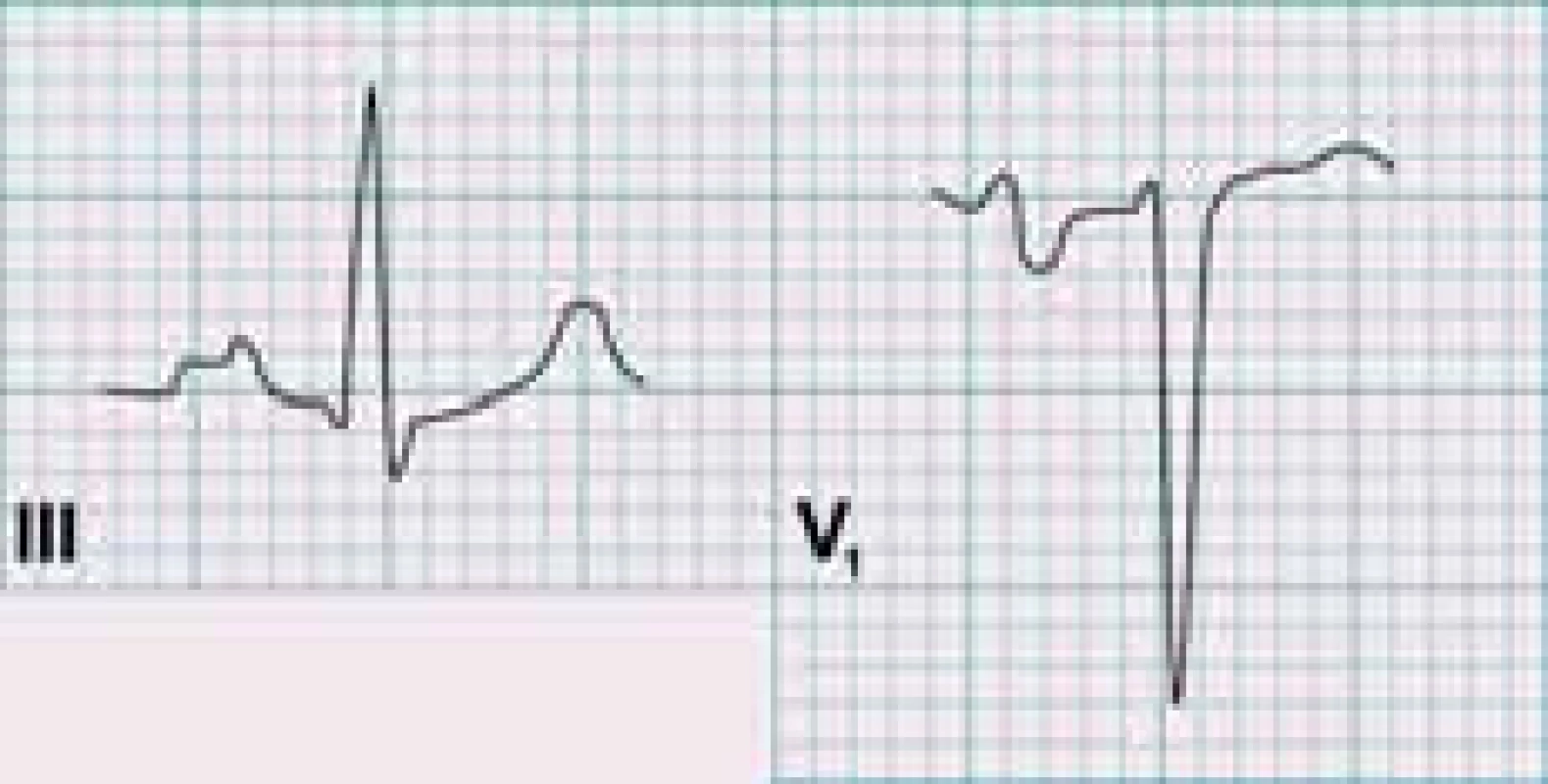
V EKG nálezu lze sledovat P mitrale (ve svodu II rozštěp vlny P s intervalem mezi vrcholy komponent nad 40 ms, ve svodu V1 prodloužení a prohloubení negativní části vlny P), odpovídající dilataci LS (obr. 1), v pokročilejších stadiích pak známky hypertrofie pravé komory. Častý je výskyt fibrilace síní [8].
Na RTG hrudníku je zřejmá mitrální konfigurace srdce s vyrovnanou levou konturou, která je tvořena obrysem dilatované LS a pravé komory, jež je rotována doleva (obr. 2). Zvětšená LS může komprimovat jícen, což prokážeme provedením ezofagogramu v bočné projekci. V plicním parenchymu nacházíme známky městnání v malém oběhu: zmnožení cévní kresby, horizontální Kerleyho linie při dilataci lymfatických cest, ve fázi alveolárního edému plic pak neostře ohraničené, splývající stíny [9].
Obr. 2. RTG-obraz mitrální stenózy. 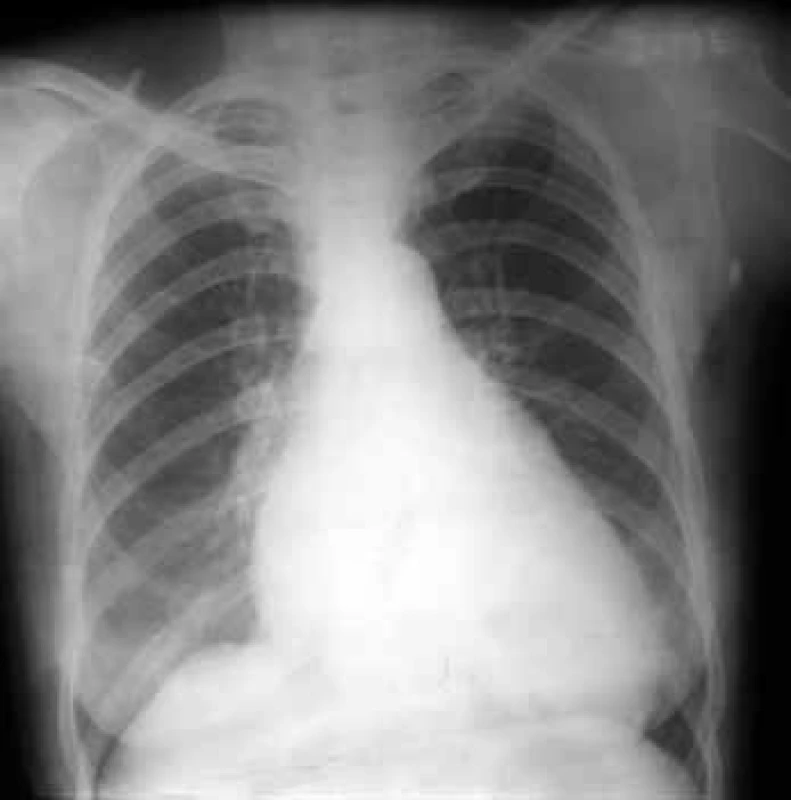
Zlatým standardem diagnostiky MS je transtorakální echokardiografie (TTE). Umožňuje diagnostikovat přítomnost a závažnost chlopenní vady, ale současně i parametry LK, závažnost plicní hypertenze, funkci komory pravé či přítomnost jiné chlopenní vady. Při dobré vyšetřitelnosti pacienta tak není třeba invazivního došetřování. Indikací pro transezofageální echokardiografii (TEE) je nutnost vyloučení trombu v LS před zvažovanou mitrální balonkovou valvuloplastikou nebo vyšetření morfologie mitrální chlopně a významnosti vady u špatně vyšetřitelných pacientů. Dvojrozměrnou TTE lze planimetricky měřit velikost mitrálního ústí. Důležitý je přesný popis morfologických změn nejen mitrálních cípů, ale i závěsného aparátu, včetně hodnocení přítomnosti, rozsahu a lokalizace kalcifikací. Doplnění o posouzení hybnosti chlopně pak umožňuje skórování vady, důležité pro rozhodování o vhodnosti provedení balonkové valvulopastiky (tab. 2). Dále jsou pro vadu typické následující charakteristiky: diastolické vydouvání předního cípu do LK, paradoxní pohyb zadního cípu k septu, snížená separace okrajů cípů, plochý diastolický sklon E-F v jednorozměrném zobrazení, dilatace LS s případnou přítomností trombu (obr. 3-5). LK není dilatována, její ejekční frakce je zachována, jen u menšiny pacientů se nachází hypokineze bazálních segmentů spodní stěny, ojediněle přední či boční stěny. Při trikuspidalizaci vady je dilatovaná pravá komora, případně s alterací její systolické funkce, přítomna trikuspidální insuficience a jiné parametry plicní hypertenze (dilatace plicnice, respirační variace dolní duté žíly). Barevným dopplerovským mapováním (CFM) nacházíme diastolický turbulentní transmitrální tok, který se objevuje později než tok případné aortální insuficience (obr. 6). Pro kvantifikaci vady je významné dopplerovské vyšetření (PW,CW). Transmitrální průtok má monofázický tvar, je zrychlen nad 1,3 m/sec, výpočtem určujeme vrcholový a střední gradient mezi levou síní a komorou v diastole. Gradient však kvadraticky závisí na průtoku mitrální chlopní, navíc je nadhodnocen při přítomnosti mitrální insuficience. Závažnost vady je tak lépe hodnotit stanovením MVA, např. pomocí poločasu poklesu tlakového gradientu od vrcholu na poloviční hodnotu (pressure half time - PHT) podle rovnice MVA = 220/PHT (obr. 7). Jinou možností výpočtu MVA je použití rovnice kontinuity při porovnání průtoku transmitrálního a ve výtokovém traktu LK. Musíme mít na paměti možnost zkreslení výsledku: PHT je prodlouženo u poruchy relaxace LK, naopak zkráceno při současné mitrální regurgitaci, měření MVA je závislé na aktuálním srdečním výdeji. Při FiS síní je nutno měření několikrát opakovat a výsledky průměrovat, tachykardie často vyšetření zcela znehodnotí.
Tab. 2. Echokardiografické skórování stenotické mitrální chlopně. 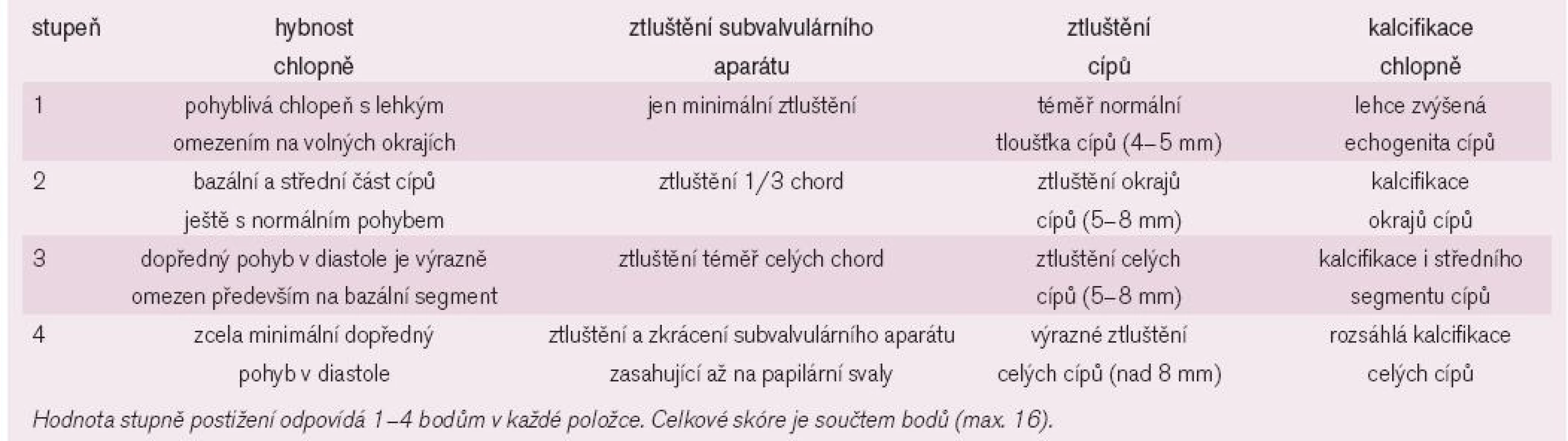
Obr. 3. Echokardiografie u mitrální stenózy – B mode zobrazení, dlouhá osa parasternálně. Revmatické ztluštění cípů mitrální chlopně. 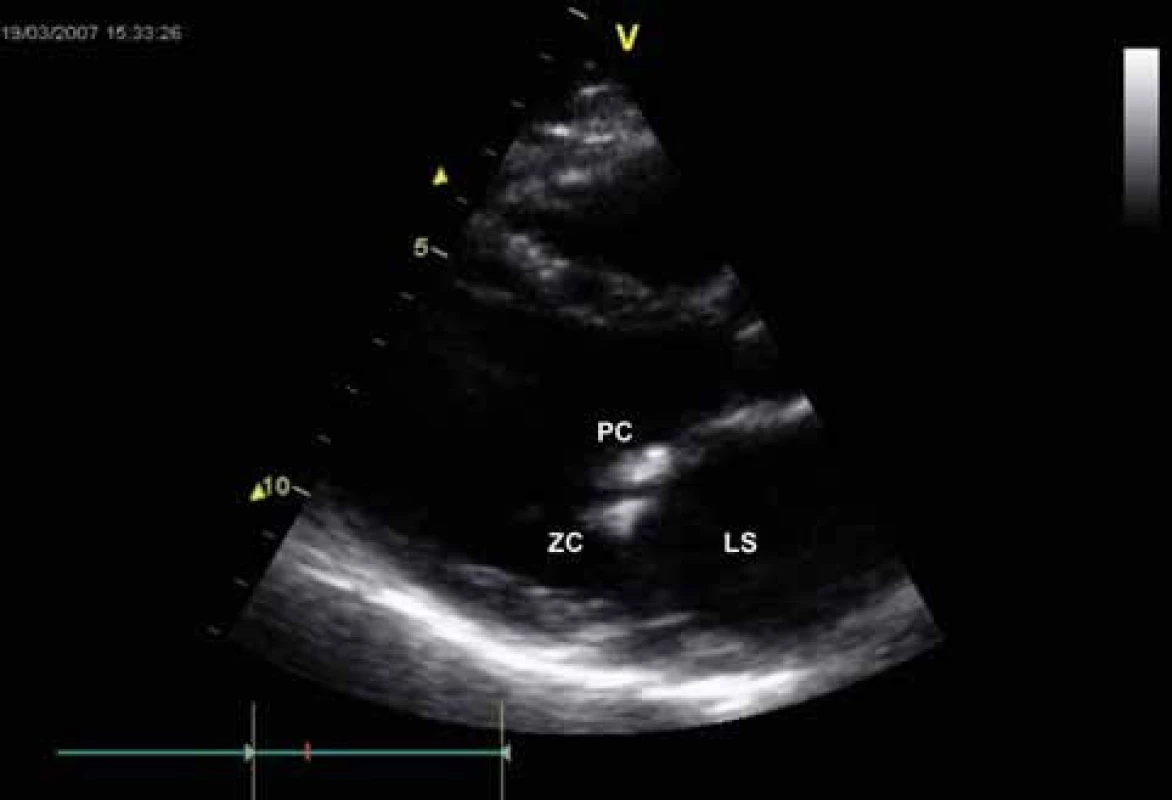
LS – levá síň, PC – přední cíp, ZC – zadní cíp Obr. 4. Echokardiografie u mitrální stenózy – B-mode zobrazení, krátká osa parasternálně. Ztluštění cípů, redukce MVA. 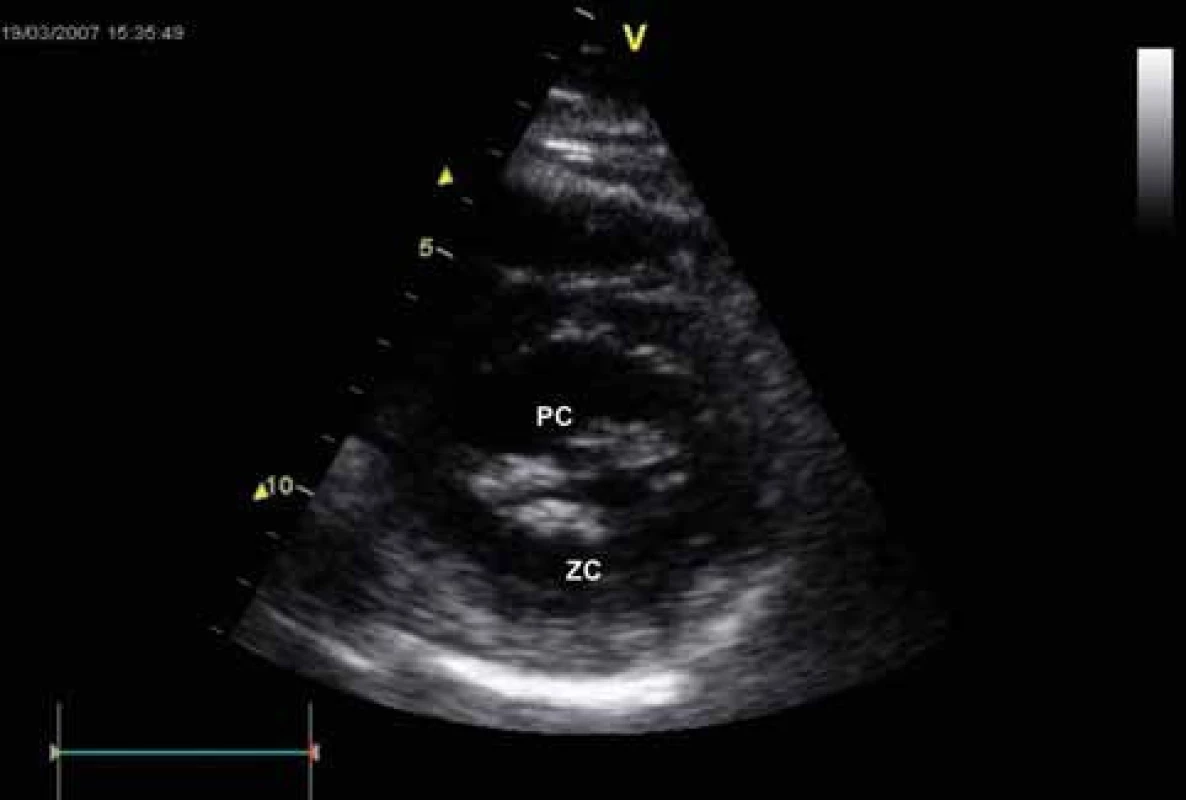
PC – přední cíp, ZC – zadní cíp Obr. 5. Echokardiografie u mitrální stenózy – M mode zobrazení. Plochý sklon E–F, paradoxní pohyb zadního cípu (ZC) k septu (S) a omezená separace cípů. 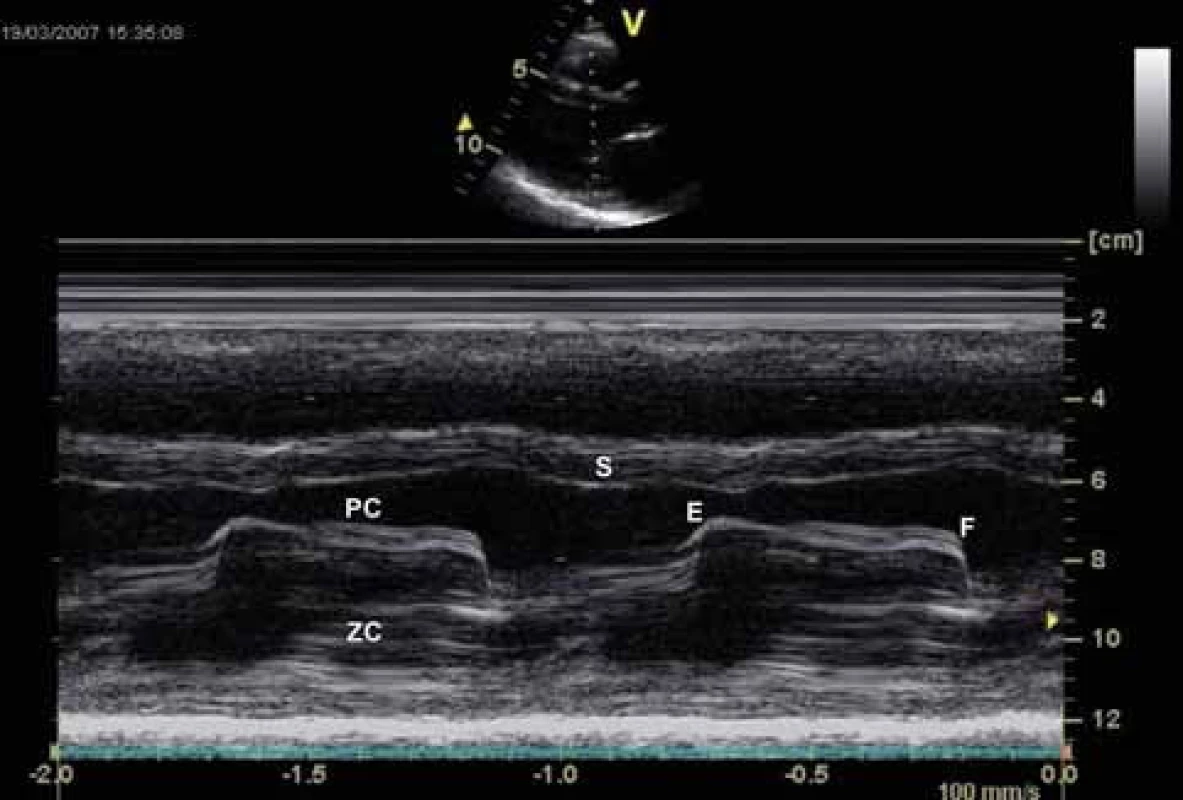
Obr. 6. Echokardiografie u mitrální stenózy – CFM zobrazení. Turbulentní diastolický tok přes kalcifikované mitrální ústí. 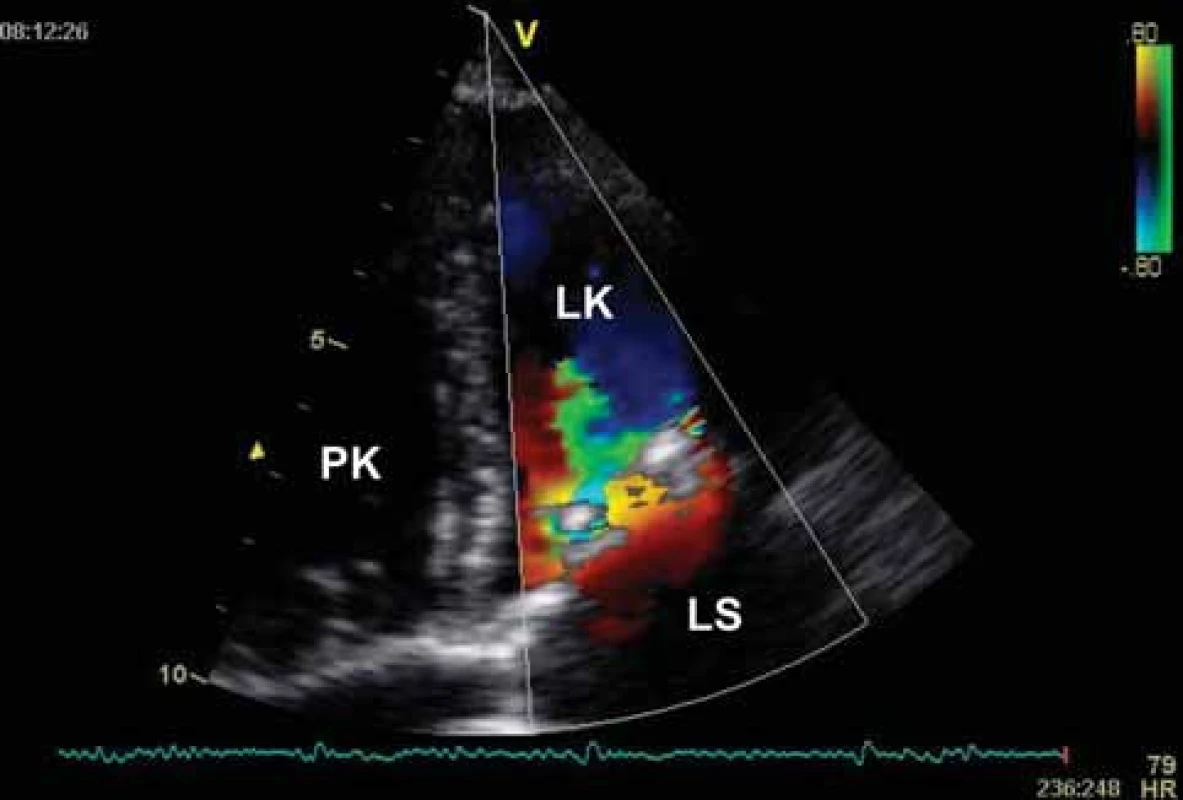
Obr. 7. Doplerovská echokardiografie u mitrální stenózy. Výpočet středního gradientu (meanPG) a MVA dle PHT. 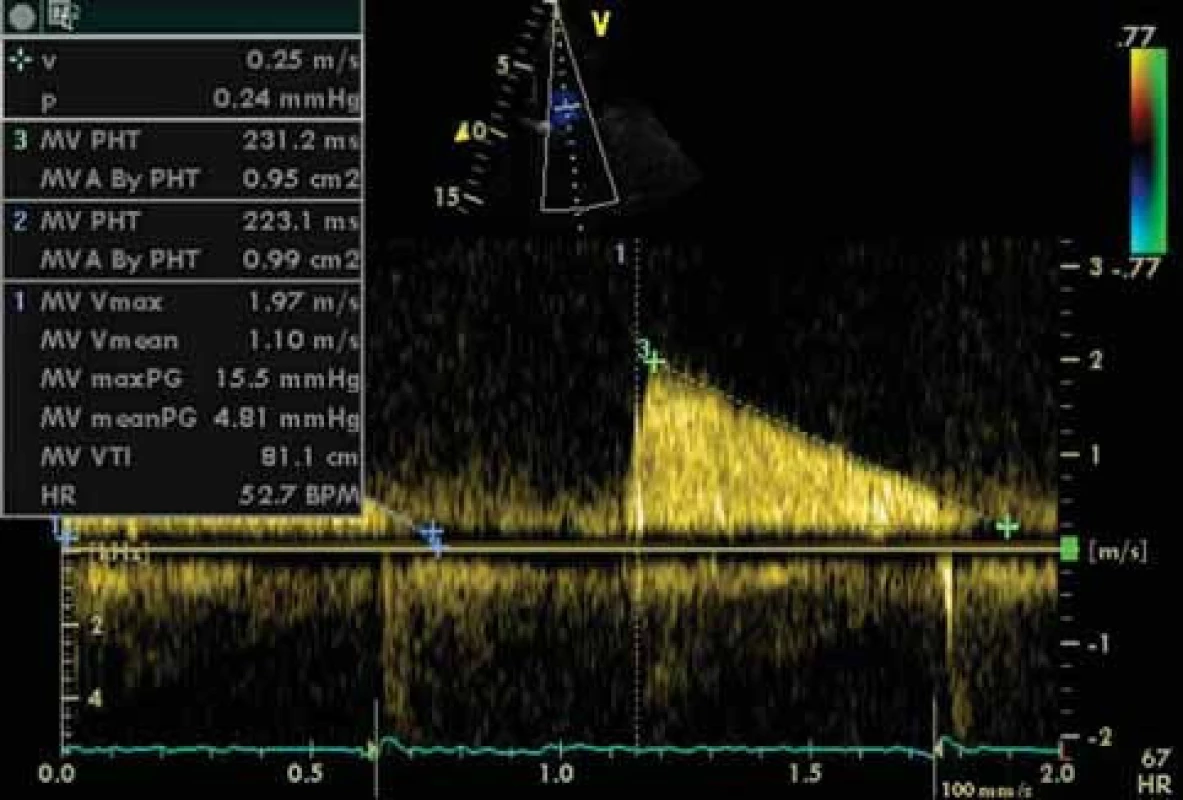
U pacientů, kde ultrazvukový nález nekoreluje se symptomatologií, je nutno doplnit zátěžový test, např. dobutaminem, k posouzení závažnosti vady, zvláště případné progrese stupně plicní hypertenze v zátěži.
Echokardiografii využijeme i při hodnocení efektu balonkové valvuloplastiky [1,10,11].
Indikací k srdeční katetrizaci je rozpor mezi výsledkem neinvazivních vyšetření a klinickým obrazem a nutnost provedení selektivní koronarografie u pacientů s vyšším rizikem ischemické choroby srdeční (u mužů nad 40 a žen nad 45 let věku). Srdeční katetrizace umožní kvantifikaci vady změřením tlakového gradientu mezi LS a LK (obr. 8). Přímé měření s použitím transseptální katetrizace je sice přesnější, využívá se ale jen vzácně. Častěji používáme oboustrannou srdeční katetrizaci, kdy Swanovým-Ganzovým katétrem změříme nejen tlaky v pravostranných srdečních oddílech, ale získáme i hodnotu tlaku v zaklínění (PCWP), s určitou nepřesností a fázovým posunem odpovídající střednímu tlaku v LS. Simultánní registrací tlaku v zaklínění a tlaku v levé komoře získáme z plochy mezi oběma křivkami hodnotu středního transmitrálního gradientu. V rámci katetrizačního vyšetření měříme termodilucí srdeční výdej a vypočítáváme hodnotu plicní cévní rezistence. Pomocí Gorlinovy rovnice lze kalkulovat plochu mitrálního ústí. V přítomnosti FiS je opět nezbytné provádět měření opakovaně a použít průměrnou hodnotu z naměřených dat [12,13].
Obr. 8. Katetrizace u mitrální stenózy. Tlakové křivky z levé komory (LV) a levé síně (LA), zbarvená plocha odpovídá střednímu transmitrálnímu gradientu. 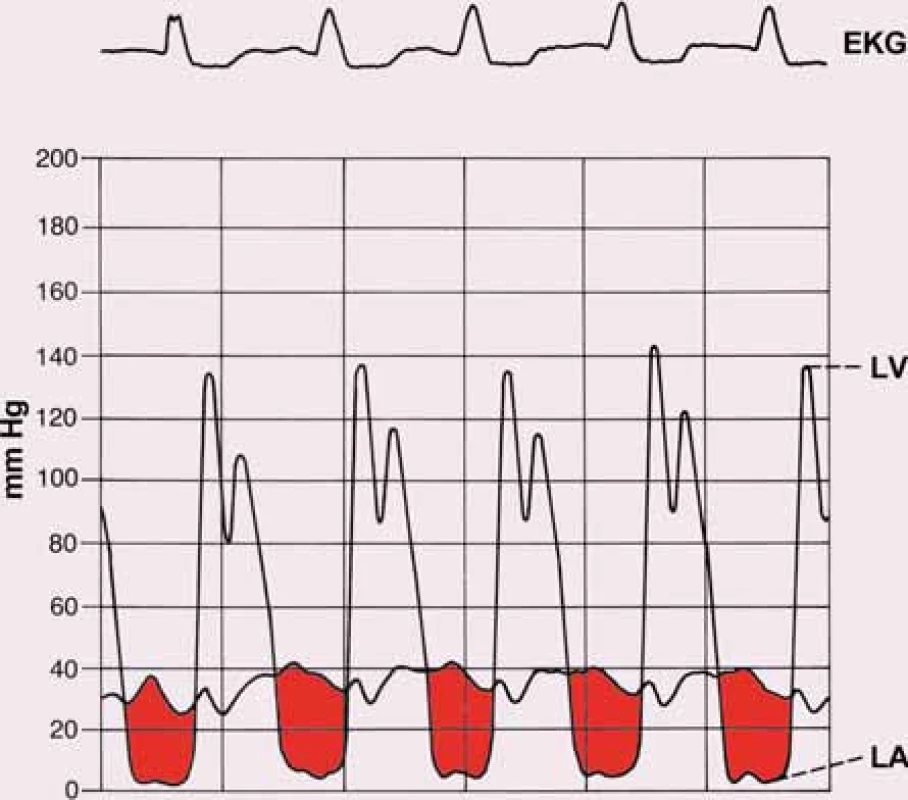
Léčba
Jedinou účinnou a specifickou léčbou je léčba chirurgická (zavřená či otevřená komisurotomie) či intervenční (perkutánní transluminální mitrální valvuloplastika – PTMV). Režimová opatření a medikamentózní léčba pouze korigují symptomy nebo snižují riziko komplikací.
Režimová opatření a medikamentózní léčba
Asymptomatické pacienty s významnější než lehkou MS omezujeme ve větší fyzické zátěži kvůli nepříznivému vlivu tachykardie. Z tohoto důvodu mohou být v léčbě vhodné betablokátory nebo verapamil. Digitalis u pacientů se sinusovým rytmem přináší benefit pouze při dysfunkci levé nebo pravé komory. Pokud se objeví známky kongesce v malém oběhu, je nutná redukce příjmu soli a užívání diuretik.
Nutná je sekundární profylaxe revmatické horečky stejně jako prevence vzniku infekční endokarditidy.
Fibrilace síní zhoršuje nejen symptomy pacientů, ale i jejich prognózu – 10leté přežívání klesá na 25 % proti 46 % u pacientů s trvajícím sinusovým rytmem. Léčba akutně vzniklé FiS spočívá v antikoagulaci heparinem a korekci tepové frekvence za užití blokátorů vedení vzruchu v atrioventrikulárním (AV) uzlu (digoxin, betablokátory, verapamil, případně amiodaron). V případě hemodynamické nestability je nutno ihned provést elektrickou kardioverzi. U stabilních pacientů, kdy FiS trvá déle než 48 hod, je postup stejný jako u pacientů bez MS: Buď pacienta elektricky vertujeme po 3týdenní účinné antikoagulační léčbě, nebo po podání heparinu po předchozím vyloučení intrakardiálních trombů pomocí TEE. Nutné je pokračování antikoagulace alespoň 3 týdny po úspěšné kardioverzi. Recidivující paroxyzmy FiS léčíme antiarytmiky skupiny IC (spolu s uzlovými léky) nebo skupiny III. V případě neúspěchu pokusů o verzi na sinusový rytmus ponecháváme pacienty na antikoagulační léčbě spolu s blokátory AV uzlu.
Prevence systémové embolizace antikoagulační léčbou snižuje riziko embolizací až 15krát. Tato léčba je jednoznačně indikována u pacientů s MS a FiS, trombem v LS a také u nemocných s prodělanou embolizační příhodou, a to i v případě trvání sinusového rytmu. Doporučována je též u asymptomatických pacientů s těžkou MS, sinusovým rytmem a dilatací LS větší než 55 mm nebo přítomností spontánního echokontrastu při TTE. [1,14]
Sledování pacientů bez doporučení radikální léčby: Nemocné s lehkou MS, buď symptomatické, nebo se symptomy třídy NYHA II, ale bez nálezu významné plicní hypertenze v zátěži, klinicky sledujeme jednou za rok (echokardiografii po 2 letech), v případě indukované těžké plicní hypertenze zátěží je vhodná kontrola po 6 měsících. Po půl roce též sledujeme symptomatické nemocné ve třídě NYHA II, s významnou MS, ale bez přítomnosti plicní hypertenze (schéma 1-3). Pokud nekorelují udávané symptomy, resp. jejich absence s výsledkem vyšetření, je nutné objektivizovat obtíže pacienta zátěžovým testem [1,14].
Schéma 1. Strategie léčebného postupu u mitrální stenózy. 
Schéma 2. Strategie léčebného postupu u mitrální stenózy – pacienti NYHA třídy II. 
Schéma 3. Strategie léčebného postupu u mitrální stenózy – pacienti NYHA třídy III–IV. 
Indikace k intervenční léčbě je jednoznačná u symptomatických pacientů ve třídě NYHA II-IV buď se středně těžkou až těžkou MS (MVA pod 1,5 cm2, resp. 1,0 cm2/m2), nebo lehkou MS a zátěží navozenou těžkou plicní hypertenzí (systolickým tlakem v plicnici - PAP - nad 60 mmHg). Podmínkou PTMV je vhodná morfologie chlopně (kalcifikace na chlopni upřednostňuje chirurgické řešení před PTMV, při užití skórovacího systému je potřebné echo skóre pod 8 – tab. 2) a současně absence trombu v LS a významné mitrální regurgitace. Asymptomatické nemocné ošetřujeme při výskytu významné vady s PAP nad 50 mmHg v klidu nebo nad 60 mmHg v zátěži. Indikováni jsou též symptomatičtí pacienti s významnou stenózou, kalcifikovanou chlopní a vysokým rizikem chirurgického výkonu. Hraničně indikovaní jsou asymptomatičtí nemocní s těžkou MS a nově vzniklou FiS (schéma 1-3).
PTMV lze provést antegrádním či retrográdním přístupem, prvně jmenovaný s nutností punkce mezisíňové přepážky je užíván častěji. Nejrozšířenější je metoda podle Inouea, při které je komisurotomie dosaženo dilatací Inoueova balonku (obr. 9). Další volbou může být užití Cribierova kovového valvulotomu (obr. 10). Úspěšný výkon je charakterizován zvětšením plochy mitrálního ústí o 50 % při absenci komplikací, mezi něž patří vznik významné mitrální insuficience (výskyt u 2-3 %), závažného levo-pravého zkratu (pod 2 %), srdeční tamponády či úmrtí (pod 1 %). Dlouhodobé výsledky zákroku jsou dobré – 70 % nemocných je bez kardiologických nežádoucích příhod při 7letém sledování [1,5,14,15].
Obr. 9. Perkutánní transluminální mitrální valvuloplastika – dilatace Inoueho balónem. 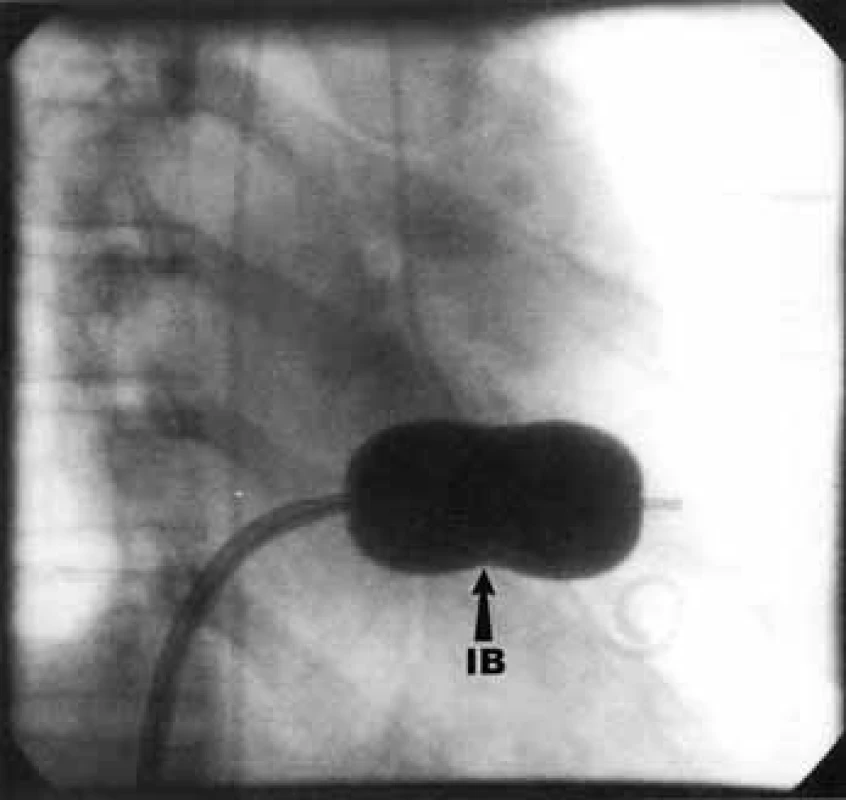
Obr. 10. Perkutánní transluminální mitrální valvuloplastika – Cribierův kovový dilatátor. 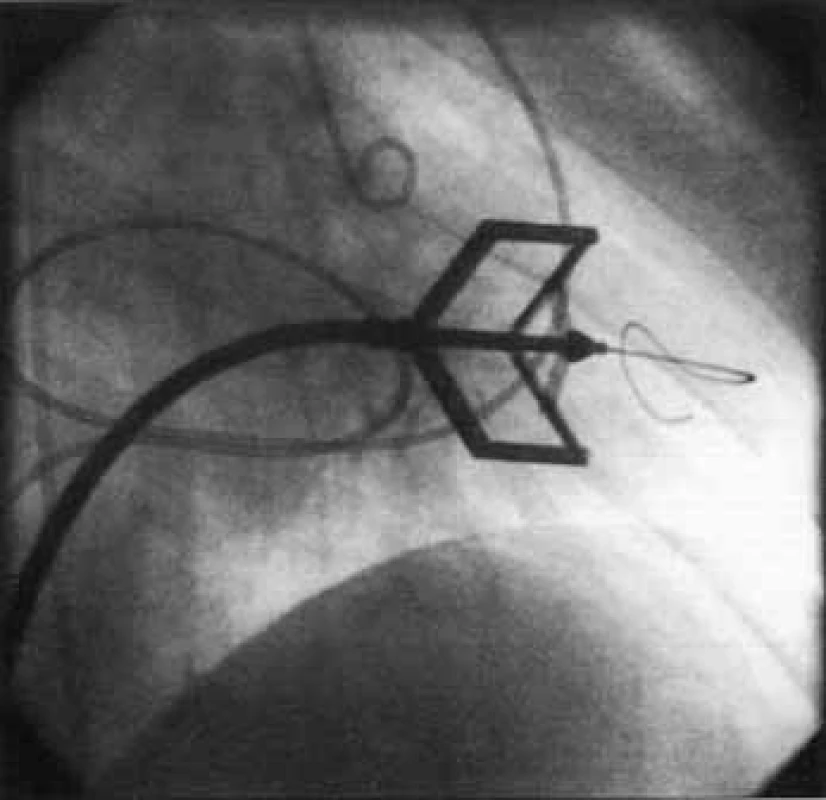
Indikace k chirurgické léčbě: Všichni symptomatičtí nemocní s významnou MS (MVA pod 1,5 cm2, resp. pod 1,0 cm2/m2) nebo symptomatičtí s lehkou stenózou (MVA nad 1,5 cm, resp. nad 1,0 cm2/m2) ve třídě NYHA III a IV, resp. třídě NYHA II, která je spojena s plicní hypertenzí (klidový PAP nad 60 mmHg), jsou indikováni k náhradě mitrální chlopně (obr. 11), méně často k otevřené komisurotomii s obnovením hybnosti cípů. Podmínkou je morfologická nevhodnost provedení PTMV. Při náhradě chlopně je volbou mechanická chlopenní protéza vzhledem k nutnosti antikoagulační léčby (z důvodu FiS) u většiny pacientů a riziku rozvoje degenerativních změn biologických náhrad. Časná mortalita po komisurotomii a plastice mitrální chlopně je nižší než 3 %, po náhradě mitrální chlopně je mezi 3-7 %. V rozvojových zemích je levnější variantou léčby operace na zavřeném srdci, tedy bez použití mimotělního oběhu: komisurolýza tlakem prstu nebo komisurotomie za použití Dogliottiho prstýnku s nožem [1,5,14,16].
Obr. 11. Stenotická, kalcifikovaná mitrální chlopeň. 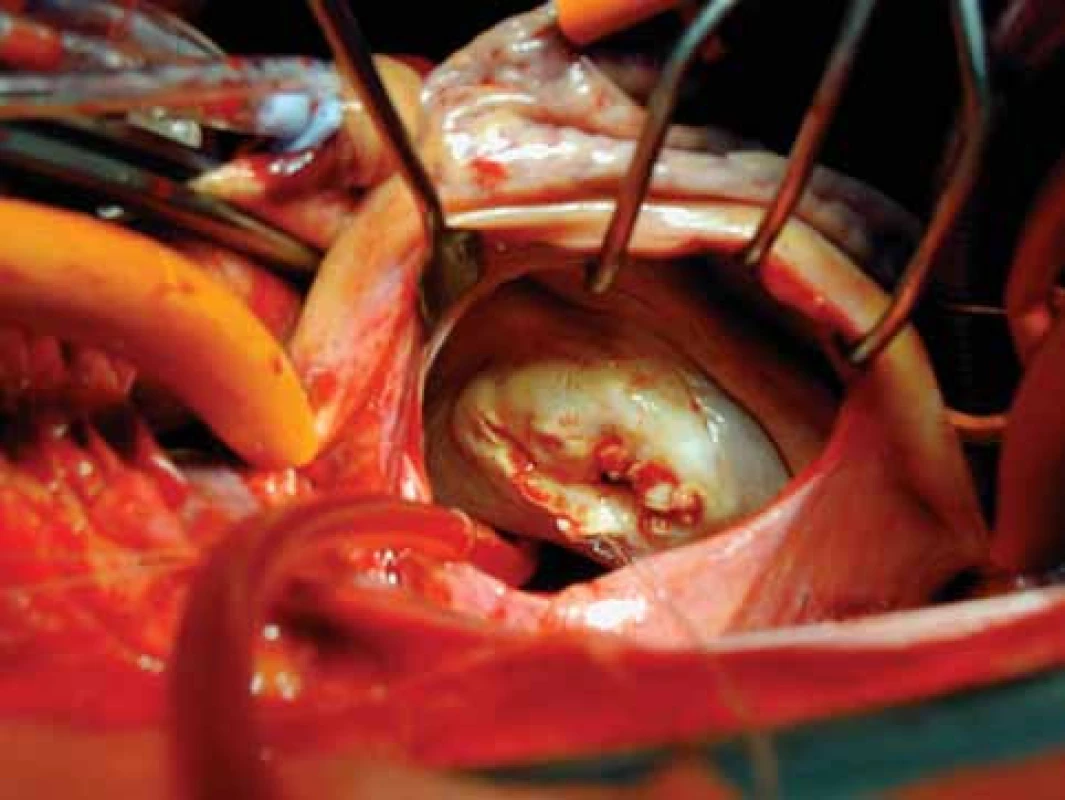
Závěr
Přehledný článek pojednává o dnešním stavu diagnostiky a léčby MS stenózy, chlopenní vady, jejíž výskyt je ve vyspělých zemích již málo častý. V rozvojových zemích však stále zůstává revmatická karditida s MS zdravotnickým problémem.
MUDr. Jiří Ostřanský
I. interní klinika LF UP a FN Olomouc
Zdroje
1.Veselka J, Honěk T, Špatenka J et al. Získané chlopenní vady srdce. Praha: Medcor Europe Publishing 2000 : 85-124.
2.Braunwald E. Heart Disease. 4. ed. Philadelphia: W.B. Saunders 1992.
3.Julian DG, Camm AJ, Fox KM et al. Disease of the Heart. London: WB Saunders 1996.
4.Čerbák R. Chlopenní srdeční vady. Kap Kardiol 2004; 6(1): 2-9.
5.Frídl P, Marek T, Čerbák R et al. Doporučené postupy pro diagnostiku a léčbu nemocných s chlopenní vadou v dospělosti. Cor Vasa 2000; 42(4): K82-K86.
6.Kordač V et al. Vnitřní lékařství I. Praha: Avicenum 1988 : 544-551.
7.Štejfa M et al. Kardiologie. 2. ed. Praha: Grada Publishing 1998 : 484-487.
8.Aschermann M et al. Kardiologie. Praha: Galén 2004; 1.vol: 193.
9.Lukl J. Klinická kardiologie stručně. Olomouc: Vydavatelství UP 2004 : 170-174.
10.Gregor P, Widimský P, Niederle P. Echokardiografie. 2. ed. Praha: Avicenum 1984 : 130-143.
11.Niederle P et al. Echokardiografie. Praha: Triton 2002; 1. vol: 102-106.
12.Endrys J. Invazivní hemodynamické metody. Hradec Králové: Nucleus HK 2005 : 94-100.
13.Darovic GO. Hemodynamic monitoring: invasive and noninvasive clinical application. 2. ed. Philadelphia: W.B. Saunders 1995 : 723-734.
14.ACC/AHA 2006 Guidelines for the Management of Patients With Valvular Heart Disease: Executive Summary. Circulation 2006; 114(5): 450-514.
15.Červinka P. Intervenční léčba chlopenních vad. Kardiologie. Praha: Galén 2004; 2. vol: 1293-1296.
16.Dominik J. Kardiochirurgie. Praha: Grada Publishing 1998 : 82-95.
Štítky
Detská kardiológia Interné lekárstvo Kardiochirurgia Kardiológia
Článok vyšiel v časopiseKardiologická revue – Interní medicína
Najčítanejšie tento týždeň
2007 Číslo 4- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Intermitentní hladovění v prevenci a léčbě chorob
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Nobelova cena za fyziologii a medicínu 2007
- Poruchy glukózového metabolizmu u infarktu myokardu
- Je dilatační kardiomyopatie geneticky podmíněné onemocnění?
- Atypicky se prezentující nebo zcela bezbolestně probíhající AIM
- Zvláštnosti léčby akutního infarktu myokardu a diagnostické problémy u nemocných s diabetes mellitus
- Studie BARI 2D – sekundární prevence a optimální léčebné strategie u diabetiků 2. typu s ischemickou chorobou srdeční
- Je protidestičková léčba indikována v primární prevenci?
- Antiagregační léčba a potahované stenty v roce 2007
- Klinický význam měření distenzibilty karotické tepny
- Mitrální stenóza
- Použití kryodestrukce v nefarmakologické terapii fibrilace síní
- Současné možnosti chirurgické léčby fibrilace síní
- Koarktace aorty
- Kardiologická revue – Interní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Mitrální stenóza
- Koarktace aorty
- Atypicky se prezentující nebo zcela bezbolestně probíhající AIM
- Je dilatační kardiomyopatie geneticky podmíněné onemocnění?
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy