-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Diagnostika aortální stenózy
The diagnosis of aortic stenosis
Aortic stenosis is found in 2.5% of patients aged over 65 years, and in developed countries it is the most commonly corrected valve disease. Our aim was to review the diagnosis of aortic stenosis and its pitfalls. The diagnosis is based on echocardiographic maximal transaortic velocity, mean transaortic gradient and calculated aortic valve area. In case of discordance between the distinctive parameters, further assessment relies mainly on the ejection fraction and stroke volume of the left ventricle. In 2007, the real time three ‑ dimensional transesophageal echocardiography was introduced into clinical practice. This method enables three ‑ dimensional dataset acquisition of the selected part of the aorta or aortic valve and reliable measurement of dimensions using multiplanar reconstruction of the image. Accurate measurements are crucial for valve prosthesis sizing before transcatheter implantation of the aortic valve, and the three ‑ dimensional transesophageal echocardiography provides results that are closest to the computed tomography measurements.
Keywords:
aortic stenosis – real time 3D transesophageal echocardiography – computed tomography – transcatheter implantation of the aortic valve
Autoři: K. Linhartová
Působiště autorů: 2. LF UK a FN V Motole, Praha ; Kardiologická klinika
Vyšlo v časopise: Kardiol Rev Int Med 2013, 15(3): 141-143
Kategorie: Chlopenní vady
Souhrn
Aortální stenóza se vyskytuje u 2,5 % osob nad 65 let a v rozvinutých zemích je nejčastěji korigovanou chlopenní vadou. Cílem tohoto přehledu je probrat diagnostiku aortální stenózy a její úskalí. Hodnocení aortální stenózy se opírá o echokardiografické měření maximální rychlosti aortálního jetu, středního gradientu a vypočtenou plochu aortálního ústí. V případě diskordance jednotlivých parametrů záleží další hodnocení vady zejména na ejekční frakci a tepovém objemu levé komory. Echokardiografie byla roku 2007 obohacena o možnost trojrozměrného jícnového zobrazení v reálném čase. Tato metoda přináší výhodu akvizice trojrozměrné sady dat z vybrané oblasti aortální chlopně, kořene a ascendentní aorty a spolehlivého měření rozměrů z multiplanární rekonstrukce. Při vyšetření kandidátů katetrizační implantace aortální chlopně, kde je přesné měření kruciální pro správné určení velikosti protézy, dosahuje trojrozměrná jícnová echokardiografie z echokardiografických metod nejvyšší shody s výpočetní tomografií.
Klíčová slova:
aortální stenóza – trojrozměrná echokardiografie – multidetektorová výpočetní tomografie – katetrizační implantace aortální chlopněÚvod
Aortální stenóza (AS) se vyskytuje u 2,5 % osob nad 65 let a v rozvinutých zemích je nejčastěji korigovanou chlopenní vadou [1]. Základní diagnostickou metodou je echokardiografie. Roku 2007 byla do klinické praxe uvedena trojrozměrná transezofageální echokardiografie v reálném čase (RT 3D TEE), která umožňuje zpřesnění diagnostiky vady a dále se uplatňuje především v rámci multimodálního přístupu k vyšetření pacientů před katetrizační implantací aortální chlopně (TAVI), během ní i po ní. Cílem tohoto přehledu je probrat echokardiografickou diagnostiku AS a její úskalí a podat informaci o možnostech RT 3D TEE pří vyšetřování kandidátů TAVI. Základní součásti echokardiografického hodnocení AS shrnuje tab. 1.
Tab. 1. Hodnocení aortální stenózy. 
Morfologie aortální chlopně a kořene aorty
Bikuspidní morfologie je přítomna u více než 50 % stenotických kalcifikovaných aortálních chlopní. Degenerace trojcípé aortální chlopně převažuje až od osmé dekády, tedy v nejvyšších věkových skupinách [2]. Morfologii posuzujeme echokardiograficky podle otevírání chlopně v krátké ose. Bikuspidní aortální chlopeň je ve více než polovině případů spojena s dilatací aorty buď již na úrovni kořene aorty, zejména u pacientů s AS však velmi často až na úrovni proximální ascendentní aorty, 4 – 6 cm od anulu [3].
Kvantifikace aortální stenózy
Základními parametry hodnocení AS jsou maximální rychlost aortálního jetu, maximální a střední gradient na aortální chlopni a efektivní plocha aortálního ústí (AVA), tj. vypočtená rovnicí kontinuity (tab. 2) [4,5]. Klasifikaci AS podle těchto parametrů ukazuje tab. 3.
Tab. 2. Kvantifikace aortální stenózy. 
Tab. 3. Klasifikace aortální stenózy. 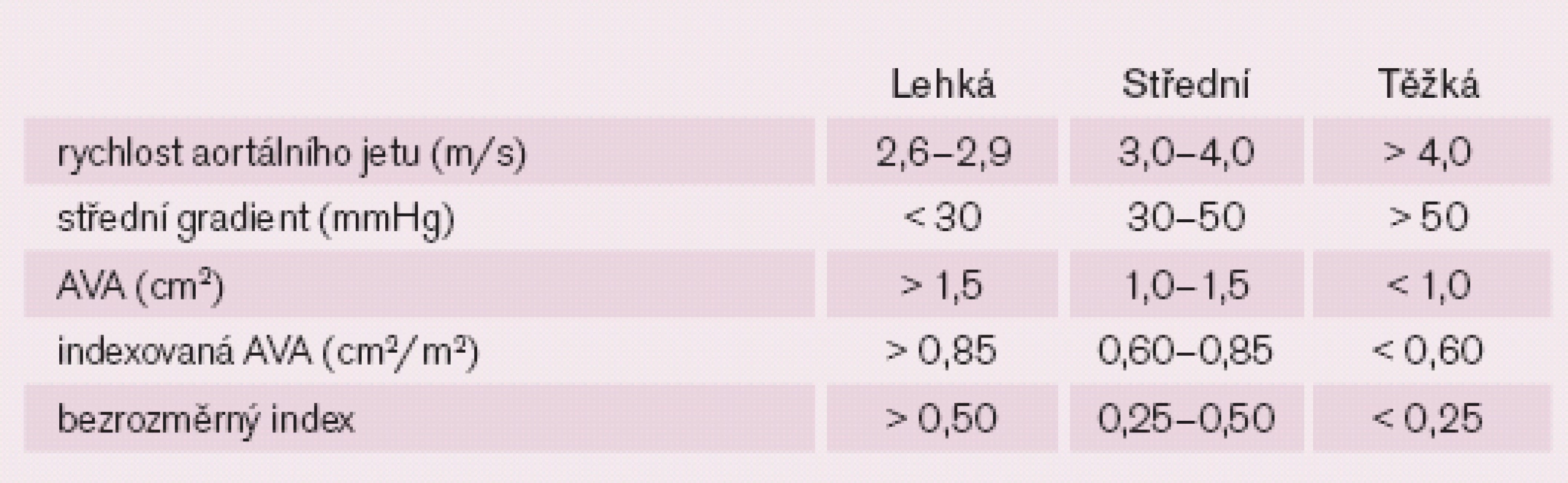
Rychlost proudění, a tedy i tlakový gradient závisí nejen na stupni stenózy, ale i na průtoku. To je třeba brát v úvahu při iniciálním hodnocení vady a také při srovnání hodnot naměřených u téhož pacienta s různým časovým odstupem. Gradient stoupá při zvýšení tepového objemu: např. při zvýšení sympatické aktivity (zátěž, rozčilení, hypertyreóza), ale také při bradykardii. Naopak klesá při sedaci nebo hypovolemii, při nedostatečném plnění, např. při fibrilaci síní s rychlou odpovědí komor; při zachované ejekční frakci (EF) levé komory (LK). U chronicky sníženého tepového objemu při systolické dysfunkci LK je gradient nízký i při významném stupni stenózy.
Planimetrické měření AVA je limitováno nepravidelností a trojrozměrnou geometrií ústí. Výrazného zpřesnění planimetrie dosáhneme pomocí RT 3D TEE. Ani přesná planimetrie však nemusí odrážet efektivní AVA u osob s nízkým srdečním výdejem.
Úskalí diagnostiky aortální stenózy
Hodnocení AS je snadné, pokud všechny měřené parametry odpovídají shodnému stupni vady a je‑li zachovaná EF LK.
AS u pacienta s vysokým transaortálním gradientem a nízkou EF LK má být korigována co nejdříve. Operován má být i pacient se středním transaortálním gradientem odpovídajícím středně těžké stenóze, avšak s nízkou efektivní AVA a s nízkou EF LK s průkazem funkční rezervy pomocí dobutaminové echokardiografie (5 – 20 μg/ kg/ min). V obou případech obvykle dochází po operaci k vzestupu EF LK. K vzestupu nemusí dojít u pacientů s nízkou EF např. na podkladě poinfarktové jizvy nebo toxického poškození myokardu bez průkazu funkční rezervy. Rozhodování o dalším postupu v těchto případech je na základě individuálního posouzení rizika, protože jde často o polymorbidní pacienty [5].
V poslední dekádě byla definována nová klinická jednotka, AS s nízkým průtokem a nízkým gradientem při normální EF LK [6]. Jde o pacienty se středním transaortálním gradientem < 40 mmHg, s AVA < 1 cm2 při zachované EF LK. Vyskytuje se častěji u starých lidí, s arteriální hypertenzí a malým lumen LK. Abychom mohli AS správně zařadit do této jednotky, musí být kladně zodpovězeny následující otázky:
Je gradient správně změřen a byly hemodynamické podmínky měření standardní?
Je AVA indexovaná na tělesný povrch, AVAi < 0,6 cm2/ m2 u osob malého vzrůstu?
Je tepový objem < 35 ml2/ m2?
Je správně změřena plocha výtokového traktu LK, tzn. je cirkulární nebo jsme schopni ji změřit spolehlivě planimetricky [7]?
Pokud ano, pak AS hodnotíme jako těžkou a dle retrospektivních analýz i tito pacienti, jsou-li symptomatičtí, významně profitují z operace vady oproti konzervativnímu postupu [8].
Kalcifikaci aortální chlopně lze kvantifikovat pomocí multidetektorové výpočetní tomografie (MDCT) a stanovit kalciové skóre chlopně, tj. objem kalcia v chlopni. Obecně platí, že čím více je kalcifikovaná chlopeň, tím těžší je vada, avšak korelace mezi transaortálním gradientem a kalciovým skóre aortální chlopně byla např. v naší studii 0,53, a nestačí tedy k přesné kvantifikaci vady [9].
Trojrozměrná transezofageální echokardiografie v reálném čase v hodnocení aortální stenózy
Kalcifikacemi aortální chlopně i kalcifikacemi protrudujícími do stěny aorty se tvar oblasti výtokového traktu, aortální chlopně, kořene a ascendentní aorty deformuje a odchyluje se od původního cirkulárního průřezu, takže měření z dvojrozměrného (2D) obrazu nemusí zachytit reprezentativní hodnoty. RT 3D TEE umožňuje zaznamenat a uložit kompletní dataset tvaru kulové výseče, který tyto struktury obsahuje. Používáme nejčastěji tzv. zobrazení „full ‑ volume“ vzniklé rekonstrukcí ze čtyř cyklů či zobrazení „zoom“ získané během jednoho cyklu (obr. 1). Z těchto dat lze následně pomocí hodnotícího softwaru provést multiplanární rekonstrukci (obr. 2), tj. současné zobrazení dvojrozměrných řezů dané oblasti ve třech (nejčastěji) na sebe kolmých rovinách, podobně jako u MDCT, a potom v off‑line zpracování ve vybraných 2D řezech lze měřit rozměry či plochy (planimetrii). Tento postup přináší dvě základní výhody oproti 2D TEE:
Obr. 1. RT 3D TEE kalcifikované aortální stenózy. 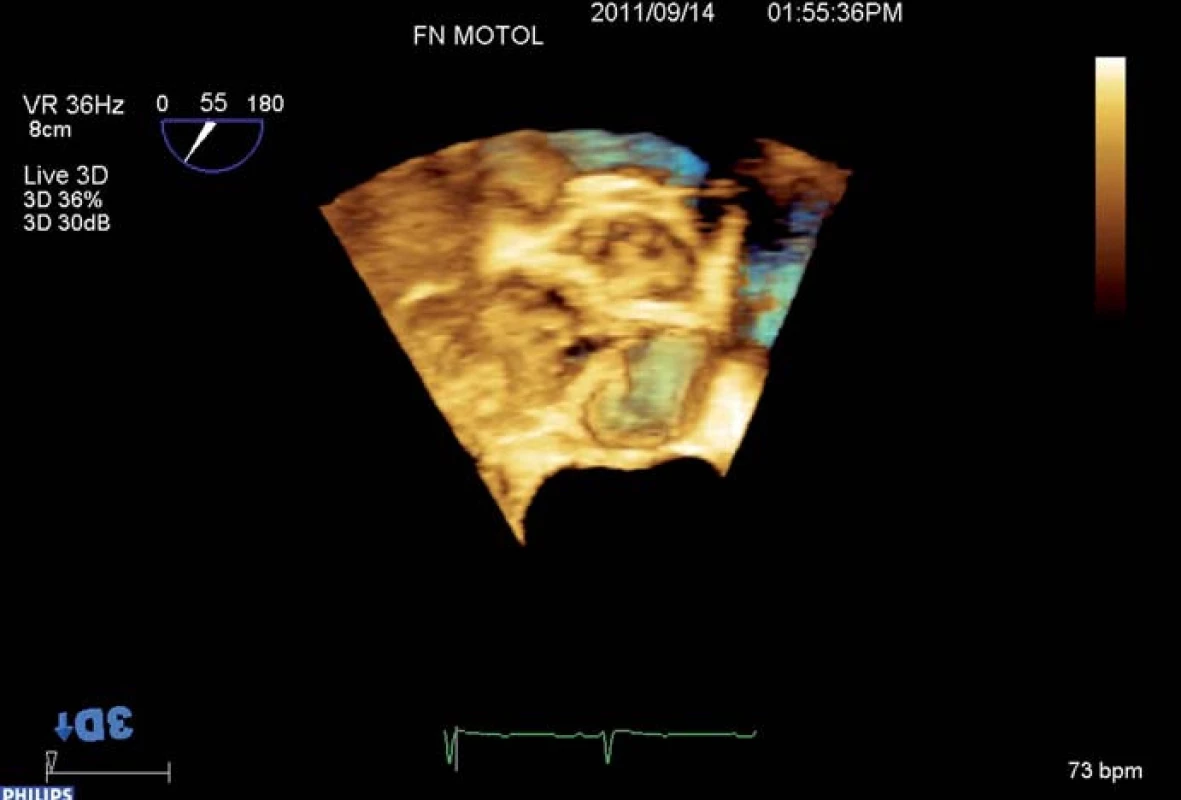
Obr. 2. RT 3D TEE aortální chlopně, multiplanární rekonstrukce. 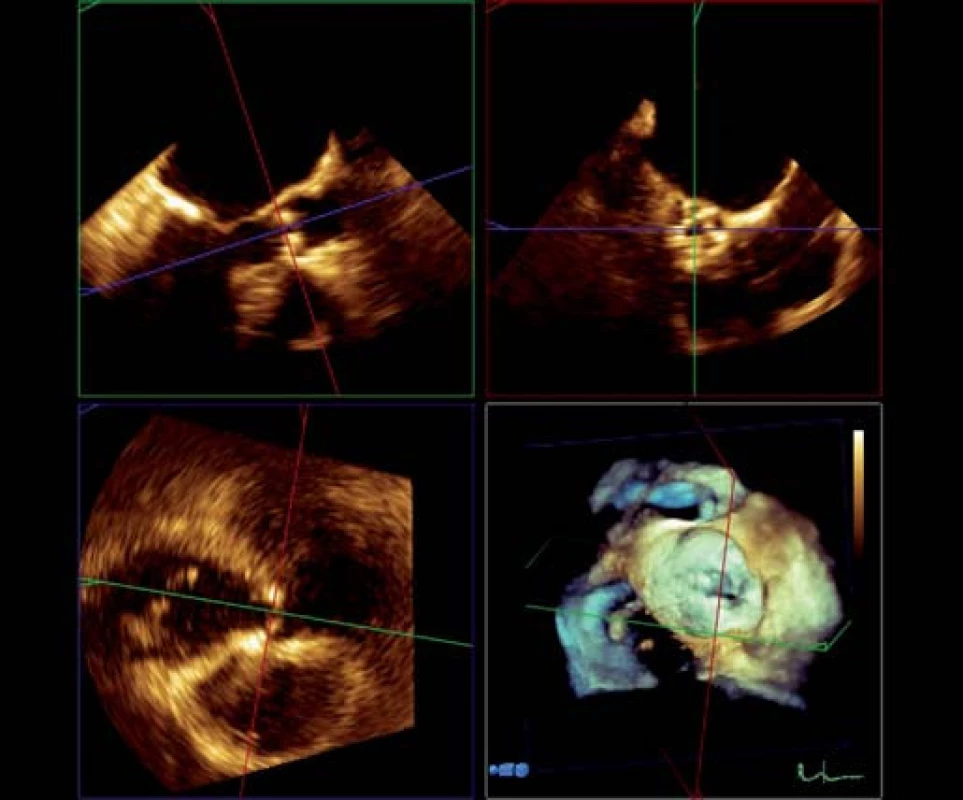
- při současném zobrazení ve třech na sebe kolmých rovinách umožní nastavení rovin tak, aby měření byla kolmá na osu aorty;
- posouváním krátké osy nebo tzv. i ‑ slice tomografií (obr. 3) zajistíme, aby měření byla přesně v požadované úrovni aorty.
Obr. 3. RT 3D TEE aortální chlopně, i-slice tomografie. 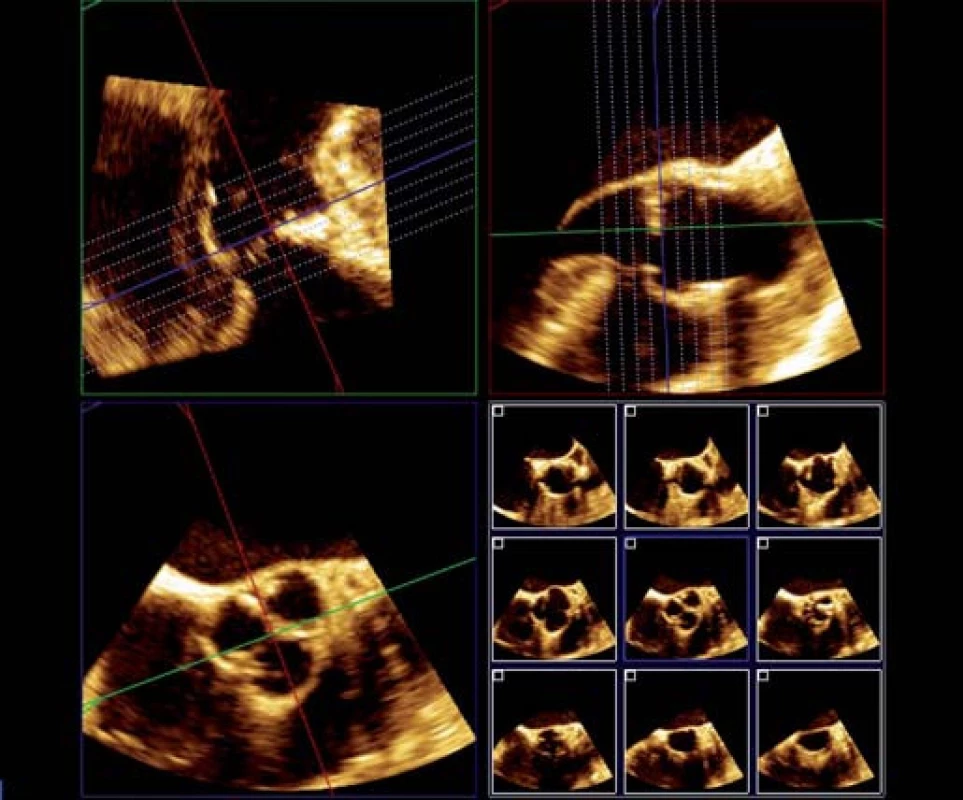
Takto můžeme získat nejspolehlivější planimetrické měření AVA, postihnout kalcifikacemi zneokrouhlený průsvit aorty, a vyvarovat se tak významných chyb v měření. Kromě toho lze měřit i další parametry, např. vzdálenost koronárního ústí od roviny anulu nebo výšku Valsalvova sinu [10].
Přesné měření rozměrů a tvaru aorty je kruciální zejména u kandidátů TAVI pro správné určení velikosti protézy [11]. Porovnání výsledků měření aorty u 57 pacientů vyšetřených před a po TAVI pomocí MDCT, 3D a 2D TEE uvádějí Ng et al [12]. Plocha anulu pomocí planimetrie MDCT byla větší než pomocí planimetrie 3D TEE i výpočtem z 2D TEE (výpočtem z diametru při předpokladu cirkulárního tvaru anulu) (4,65 ± 0,82 cm2 vs 4,22 ± 0,77 cm2 vs 3,89 ± 0,74 cm2; p < 0,001 mezi všemi hodnotami). Mezi výsledky získanými MDCT a echokardiograficky tedy existuje definovaný rozdíl daný modalitou, avšak RT 3D TEE vykazuje z echokardiografických metod největší shodu s MDCT.
Závěr
Echokardiografické hodnocení AS se opírá o hodnocení maximální rychlosti aortálního jetu, středního gradientu a vypočtené AVA. V případě diskordance jednotlivých parametrů záleží další hodnocení vady na EF a tepovém objemu LK. RT 3D TEE přináší výhodu kompletního datasetu aortální chlopně a ascendentní aorty s následnou možností multiplanární rekonstrukce. Ta umožňuje u AS spolehlivé měření rozměrů aorty i planimetrii AVA. Při vyšetření kandidátů TAVI dosahuje RT 3D TEE z echokardiografických metod nejlepší shody s MDCT..
Doručeno do redakce: 15. 7. 2013
Přijato po recenzi: 5. 8. 2013
doc. MUDr. Kateřina Linhartová, Ph.D.
Kardiologická klinika
2. LF UK a FN v Motole, Praha
linhartkaterina@seznam.cz
Zdroje
1. Stewart BF, Siscovick D, Lind BK et al. Clinical factors associated with calcific aortic valve disease. J Am Coll Cardiol 1997; 29 : 630 – 634.
2. Roberts WC, Ko JM. Frequency by decades of unicuspid, bicuspid, and tricuspid aortic valves in adults having isolated aortic valve replacement for aortic stenosis, with or without associated aortic regurgitation. Circulation 2005; 111 : 920 – 925.
3. Kang JW, Song HG, Yang DH et al. Association between bicuspid aortic valve phenotype and patterns of valvular dysfunction and bicuspid aortopathy: comprehensive evaluation using MDCT and echocardiography. JACC Cardiovasc Imaging 2013; 6 : 150 – 161.
4. Baumgartner H, Hung J, Bermejo J. Echocardiographic assessment of valve stenosis: EAE/ ASE Recommendations for clinical practice. Eur J Echocardiogr 2009; 10 : 1 – 25.
5. Vahanian A, Alfieri O, Andreotti A et al. Guidelines on the management of valvular heart disease (version 2012). The Joint Task Force on the Management of Valvular Heart Disease of the European Society of Cardiology (ESC) and the European Association for Cardio ‑ Thoracic Surgery (EACTS). Dostupné z: www.escardio.org/ guidelines.
6. Dumesnil JG, Pibarot P. Low ‑ flow, low ‑ gradient severe aortic stenosis in patients with normal ejection fraction. Curr Opin Cardiol 2013 [Epub ahead of print].
7. Michelena HI, Margaryan E, Miller FA et al. Inconsistent echocardiographic grading of aortic stenosis: is the left ventricular outflow tract important? Heart 2013; 99 : 921 – 931.
8. Jander N, Minners J, Holme I et al. Outcome of patients with low ‑ gradient ‘severe’ aortic stenosis and preserved ejection fraction. Circulation 2011; 123 : 887 – 895.
9. Ferda J, Linhartová K, Kreuzberg B. Comparison of aortic valve calcium content in bicuspid and tricuspid stenotic aortic valve using non‑enhanced 64 - detector ‑ row ‑ computed tomography with prospective ECG ‑ triggering. Eur J Radiol 2008; 68 : 471 – 475.
10. Smith LA, Dworakowski R, Bhan A et al. Real ‑ time three ‑ dimensional transesophageal echocardiography adds value to transcatheter aortic valve implantation. J Am Soc Echocardiogr 2013; 26 : 359 – 369.
11. Zamorano J, Badano L , Bruce C et al. EAE/ ASE Recommendations for the use of echocardiography in new transcatheter interventions for valvular heart disease. J Am Soc Echocardiogr 2011; 24 : 937.
12. Ng AC, Delgado V, van der Kley F et al. Comparison of aortic root dimensions and geometries before and after transcatheter aortic valve implantation by 2 - and 3 - dimensional transesophageal echocardiography and multislice computed tomography. Circ Cardiovasc Imaging 2010; 3 : 94 – 102.
Štítky
Detská kardiológia Interné lekárstvo Kardiochirurgia Kardiológia
Článek Chlopenní vady v roce 2013Článek Galerie autorů
Článok vyšiel v časopiseKardiologická revue – Interní medicína
Najčítanejšie tento týždeň
2013 Číslo 3- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Nech brouka žít… Ať žije astma!
- Intermitentní hladovění v prevenci a léčbě chorob
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Chlopenní vady v roce 2013
- Diagnostika aortální stenózy
- Nové směry v chirurgické léčbě aortální stenózy
- Katetrizační implantace aortální chlopně (TAVI) – současnost a novinky v roce 2013
- Těhotenství u pacientek s chlopenními náhradami
- Těhotenství u pacientek s vrozenými srdečními vadami
- Extrasystoly – Arytmie a možnosti léčby v kontextu chlopenních vad
- Několik poznámek k historii kardiochirurgie
- Vztah vlny L transmitrálního průtoku a vlny L’ pohybu mitrálního anulu k tlaku v zaklínění v plicnici u pacientů s dilatační kardiomyopatií
- Levosimendan a renální funkce
- Vybrané aspekty filozofie kardiologické péče
- Congress ESC Heart Failure – Lisabon 2013
- Dabigatran – klinická zkušenost z více než 2 milionů pacientoroků
- K životnímu jubileu prof. MU Dr. Romana Čerbáka, CSc.
- Galerie autorů
- Kardiologická revue – Interní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Diagnostika aortální stenózy
- Extrasystoly – Arytmie a možnosti léčby v kontextu chlopenních vad
- Katetrizační implantace aortální chlopně (TAVI) – současnost a novinky v roce 2013
- Několik poznámek k historii kardiochirurgie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



