-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Mnohočetné postižení věnčitých tepen diagnostikované při pPCI pro STEMI: kompletní revaskularizace nebo konzervativní léčba. Studie Prague‑ 13.
Multivessel coronary disease diagnosed at the time of primary PCI for STEMI: complete revascularisation versus conservative strategy. Prague-13 trial
Primary percutaneous coronary intervention (PPCI) in the occlusion or significant stenosis of an infarct (culprit) artery is a method of choice in the treatment of acute myocardial infarction with ST segment elevation (STEMI). The purpose of this trial was to identify the optimal management of patients with STEMI treated by PPCI who have at least one significant (≥ 70%) stenosis of a non-culprit coronary artery. Between 2009 and 2013, 214 patients with STEMI and multivessel coronary disease, successfully treated with infarct-related artery PPCI, were enrolled into the trial in six centres. One hundred and eight patients were randomly assigned to a non-PCI group and 106 to a staged PCI group. Patients with limiting angina pectoris present for more than 1 month prior to STEMI were excluded from the trial, among others. There were no significant differences in the baseline characteristics between both groups. The primary endpoint of the study was the incidence of the combined endpoint of all-cause mortality, nonfatal myocardial infarction and stroke during the follow-up in the group of patients treated with staged PCI in comparison with patients treated conservatively. An intention-to-treat analysis was used. Patients were followed for 38 months (median). The composite primary endpoint appeared in 15 (13.9%) patients in the non-PCI group and 17 (16.0%) in the PCI group; the hazard ratio in staged PCI group being 1.35; 95% CI 0.66–2.74; p=0.407. The hazard ratio for all-cause mortality was 0.91 (95% CI 0.30–2.70) and for nonfatal myocardial infarction 1.71 (95% CI 0.66–4.41) in the staged PCI group. Nineteen (17.6%) patients from the non-PCI group had a PCI of non-culprit coronary artery during the follow-up due to progression of angina symptoms or acute myocardial infarction. Only 13 (6.1%) patients had a non-culprit artery stenosis of ≥95% and the average non-culprit coronary artery stenosis diameter was 80%. This trial found no difference (not even a trend) favouring staged multivessel PCI over culprit-only PPCI in STEMI patients. Larger trials are needed to clarify the revascularisation strategy in STEMI patients with multivessel disease.
Keywords:
primary PCI – acute myocardial infarction – multivessel coronary disease – revascularisation
Autori: O. Hlinomaz 1; L. Groch 1; K. Poloková 1; F. Lehar 1; T. Vekov 2; R. Petkov 2; M. Stojnev 2; M. Gřiva 3; J. Sitár 1; M. Rezek 1; M. Novák 1; J. Seménka 1; N. Penkov 2
Pôsobisko autorov: I. interní kardioangiologická klinika LF MU a FN u sv. Anny v Brně 1; Bulharský kardiologický institut, Sofie, Bulharsko 2; Krajská nemocnice T. Bati, Zlín 3
Vyšlo v časopise: Kardiol Rev Int Med 2015, 17(3): 214-220
Kategória: Kardiologická revue
Súhrn
Primární perkutánní koronární intervence (pPCI) na významné stenóze nebo uzávěru infarktové tepny je metodou volby v léčbě nemocných s akutním infarktem myokardu s elevacemi ST úseků (STEMI). Cílem studie bylo určit optimální postup u pacientů se STEMI léčeným pPCI, kteří mají nejméně jednu významnou (≥ 70 %) stenózu neinfarktové věnčité tepny. Do studie jsme zařadili v šesti centrech celkem 214 pacientů, kteří měli STEMI a byli léčeni úspěšnou pPCI na infarktové tepně. 108 nemocných bylo randomizováno do konzervativní skupiny a 106 nemocných do skupiny odložené PCI neinfarktové tepny. Mimo jiných nebyli do studie zařazeni pacienti s přítomnou námahovou anginou pectoris více než jeden měsíc před pPCI. Nezjistili jsme žádné rozdíly v základních charakteristikách obou skupin. Primárním složeným cílem studie byl výskyt úmrtí z jakékoli příčiny, nefatální infarkt myokardu a cévní mozková příhoda v průběhu sledování u nemocných léčených odloženou PCI ve srovnání s konzervativní léčbou. K vyhodnocení jsme použili analýzu podle výsledků randomizace. Pacienti byli sledováni celkem 38 měsíců (medián). Primární složený cíl se vyskytl u 15 pacientů (13,9 %) v konzervativní proti 17 (16,0 %) v PCI skupině s poměrem rizik v PCI skupině 1,35; 95% CI 0,66–2,74; p = 0,407. Poměr rizik pro celkovou mortalitu byl 0,91 (95% CI 0,30 – 2,70) a pro nefatální infarkt myokardu byl 1,71 (95% CI 0,66 – 4,41) v PCI skupině. 19 pacientů (17,6 %) z konzervativní skupiny mělo PCI na neinfarktové tepně v průběhu sledování pro anginózní potíže nebo akutní infarkt myokardu. Pouze 13 (6,1 %) nemocných mělo stenózu neinfarktové tepny ≥ 95 % a průměrná stenóza neinfarktové tepny byla 80 %. Ve studii jsme nezjistili rozdíl (a dokonce ani trend) ve prospěch odložené PCI na neinfarktové stenóze ve srovnání s konzervativní léčbou u nemocných se STEMI. K prokázání optimálního léčebného postupu u pacientů se STEMI a mnohočetným postižením věnčitých tepen potřebujeme velkou klinickou studii.
Klíčová slova:
pPCI – akutní infarkt myokardu – mnohočetné postižení věnčitých tepen – revaskularizaceÚvod
Primární perkutánní koronární intervence (pPCI) uzávěru nebo významného zúžení infarktové tepny je metodou volby v léčbě akutního infarktu myokardu (IM) s elevacemi ST úseků (STEMI) [1,2]. Přibližně polovina nemocných má ale i postižení dalších tepen. To, že máme během pPCI vyřešit lézi, která IM způsobila, je zcela jasné a máme pro to dostatek důkazů. Otázkou ale zůstává, jaký je optimální léčebný postup u pacientů s akutním IM řešeném úspěšně pPCI, kteří mají ještě nejméně jednu stenózu na neinfarktových věnčitých tepnách. V tomto případě máme celkem tři možnosti [3 – 5]. Zaprvé vyřešit v rámci pPCI pouze infarktovou (tzv. culprit) stenózu a ostatní stenózy léčit konzervativně [6]. V tomto případě jsme dosáhli nekompletní revaskularizace. Druhou variantou je ošetřit v rámci pPCI nejprve infarktovou stenózu (uzávěr) a během jednoho sezení i ostatní významné, ale neinfarktové (non‑culprit) stenózy [7 – 10]. Třetí možností je při akutním STEMI provést pPCI na culprit lézi a PCI ostatních významných stenóz odložit o několik dnů až týdnů. V tomto případě mluvíme o tzv. odložené (staged) PCI [11–20]. V obou případech je dosaženo kompletní revaskularizace. Všechny uvedené postupy mají své výhody a nevýhody a dosud není jasné, který z nich je pro naše pacienty nejlepší.
Cílem studie Prague ‑ 13 bylo najít optimální léčebný postup u pacientů s akutním IM s elevacemi ST úseků řešeném úspěšně pPCI, kteří mají ještě nejméně jednu významnou stenózu na neinfarktových věnčitých tepnách. Primárním cílem bylo stanovení výskytu celkového úmrtí, nefatálního IM nebo cévní mozkové příhody ve skupině nemocných léčených odloženou revaskularizací (PCI) ve srovnání s pacienty léčenými konzervativně.
Hypotézou studie Prague ‑ 13 bylo, že kompletní postupná revaskularizace významných stenóz neinfarktových tepen u pacientů po pPCI zlepší dlouhodobou prognózu ve srovnání s konzervativní léčbou.
Metodika
Studie Prague ‑ 13 byla otevřenou prospektivní randomizovanou multicentrickou dvouramennou studií. Bylo do ní řazeno celkem 214 pacientů v šesti kardiovaskulárních centrech, z nichž dvě byla v ČR a čtyři v Bulharsku. Jednalo se o centra ve FN u sv. Anny v Brně, v Nemocnici T. Bati ve Zlíně, nemocnicích Bulharského kardiovaskulárního institutu ve Varně, Jambolu, Veliko Tarnovu a Plevenu. Studie byla schválena etickou komisí FN u sv. Anny v Brně a lokálními etickými komisemi v dalších nemocnicích.
Účastníci studie
Studie sledovala pacienty s akutním IM se STEMI a s mnohočetným postižením věnčitých tepen, kteří byli ošetřeni pPCI a kteří měli nejméně jednu angiograficky významnou ≥ 70 % stenózu neinfarktové věnčité tepny. Podmínkou zařazení bylo přesvědčení ošetřujícího lékaře, že obě studované možnosti (konzervativní nebo revaskularizační léčba) jsou pro pacienta možné. Byl‑li tedy intervenční kardiolog provádějící pPCI přesvědčen, že je pro pacienta jednoznačně lepší následná PCI na neinfarktové tepně, tak takového nemocného nerandomizoval. Stejně tak nebyli zařazeni nemocní, u kterých v rámci pPCI nebyla infarktová léze jasná, a proto měli ošetřeny všechny potenciálně infarktové stenózy v rámci jednoho sezení. Randomizaci jsme prováděli obálkovou metodou po 48 hod od vzniku STEMI, tzn. již při zcela stabilizovaném stavu.
Vstupní kritéria
- Pacient s akutním IM se STEMI.
- Angiograficky úspěšná pPCI infarktové stenózy (TIMI II – III).
- Přítomnost jedné nebo více stenóz (≥ 70 %) neinfarktové věnčité tepny (diametr tepny ≥ 2,5 mm) řešitelných pomocí PCI.
- Více než 48 hod od vzniku symptomů.
Vylučovací kritéria
- Stenóza kmene levé věnčité tepny ≥ 50 %.
- Hemodynamicky významná chlopenní vada.
- Pacienti v kardiogenním šoku při STEMI.
- Hemodynamická nestabilita.
- Angina pectoris > 2. stupně trvající déle než jeden měsíc před STEMI.
Všichni pacienti museli podepsat informovaný souhlas se studií.
Randomizace
Randomizace probíhala 2. – 7. den po pPCI pomocí obálkové metody v poměru 1 : 1 na koronární jednotce FN u sv. Anny v Brně, koronárních jednotkách Nemocnice T. Bati ve Zlíně, Varně, Jambolu, Plevenu a Veliko Tarnovu. Obálky byly připraveny ve FN u sv. Anny a rozvezeny na jednotlivá pracoviště. Lékař koronární jednotky vždy otevřel zapečetěnou obálku a přečetl, do jaké ze dvou skupin byl nemocný randomizován. Pacienti byli randomizováni do dvou skupin:
- Preventivní – kompletní revaskularizace všech významných stenóz neinfarktových věnčitých tepen (PCI 3. – 40. den po pPCI).
- Konzervativní postup – tj. běžná medikamentózní léčba.
Byl‑li pacient randomizován do skupiny revaskularizace, měl mít provedenou PCI do 40 dnů od pPCI. Následná optimální medikamentózní léčba po pPCI vycházela z doporučení Evropské, České a Bulharské kardiologické společnosti a platila samozřejmě pro obě sledované skupiny pacientů. V případě nutnosti provést PCI po randomizaci, tzn. jako plánovanou proceduru nebo neplánovaný, klinickým stavem vynucený výkon, jsme před PCI a 8 hod a 16 hod po PCI určovali ukazatele nekrózy myokardu CKMB s cílem rozpoznat periprocedurální IM. Pacienti se dostavili ke třem plánovaným kontrolám klinického stavu za 90 dnů, jeden rok a dva roky od randomizace. Vzhledem k nedostatečně rychle postupujícímu náboru pacientů jsme rozhodli o prodloužení sledování pacientů, abychom zvýšili počet dosažených sledovaných ukazatelů studie. Závěrečné kontroly jsme provedli v průběhu druhé poloviny roku 2014 a začátkem roku 2015 většinou klinicky a v menším počtu telefonicky se zaměřením na sledované klinické příhody.
Sledované ukazatele
Za primární cíl studie jsme zvolili ukazatel složený z celkové mortality, nefatálního IM a akutní cévní mozkové příhody (CMP). Periprocedurální IM jsme definovali jako nejméně trojnásobné zvýšení CKMB oproti horní hranici normy. Každou část složeného cíle jsme hodnotili také samostatně. Mezi sekundární cíle patřila kardiovaskulární mortalita, nutnost opakované revaskularizace, hospitalizace pro srdeční selhání a nestabilní anginu pectoris a dále několik složených klinických cílů.
Způsob získávání a vyhodnocení dat
Pro zajištění dat projektu jsme vytvořili tištěný parametrický Záznam o sledování pacienta (CRF) obsahující všechny sledované parametry ve formě vyhovující následnému statistickému zpracování. CRF byly originálně vyplňovány investigátory a v kopii zasílány do statistického centra ke zpracování v pravidelných a předem nastavených časových intervalech. Digitalizace CRF byla prováděna centrálně a průběžně ve statistickém centru školeným personálem.
Statistické zpracování dat bylo provedeno v softwarové aplikaci STATISTICA. Za deskriptivním účelem byly pro všechny spojité parametry (např. věk, laboratoře aj.) vypočteny základní statistické ukazatele (průměr, medián, SD, minimum a maximum) a pro data binární a kategoriální podíly nastání jevů ve vybraných skupinách pacientů. Pro srovnání binárních a kategoriálních dat mezi léčebnými skupinami byl použit binomický test nebo analýza kontingenčních tabulek a chí kvadrát test. Pro srovnání spojitých dat mezi léčebnými skupinami byl použit parametrický nepárový t‑test nebo jeho neparametrická alternativa Man ‑ Whitney U test. Rozhodnutí pro aplikaci vhodného testu bylo provedeno na základě testování normality rozložení hodnot Kolmogorov ‑ Smirnov a Shapiro Wilk’s W testem. Přežití v hodnocených skupinách pacientů bylo analyzováno prostřednictvím Kaplan ‑ Meier analýzy a srovnání byla provedena log rank testem. Všechny provedené statistické testy byly oboustranné a byly hodnoceny na hladině významnosti a = 5 %.
Výsledky
Celkově jsme do studie v letech 2009 – 2013 zařadili 214 pacientů v šesti kardiologických centrech. V ČR do studie vstoupilo 138 nemocných (64 %), v Bulharsku 76 pacientů (36 %). Z 214 nemocných bylo 106 randomizováno do skupiny preventivní PCI a 108 do skupiny konzervativní léčby. V průběhu randomizace bylo ve výše uvedených centrech provedeno celkem 2 875 pPCI, takže podíl randomizovaných pacientů ze všech pacientů s pPCI byl 7,4 %. Jedná se tedy o výrazně selektovanou skupinu nemocných. Sledované skupiny se nelišily věkem, pohlavím, krevním tlakem ani tepovou frekvencí při randomizaci. Randomizace následovala v průměru 2,4 ± 1,1 dne po pPCI. Rozdíly nebyly ani ve výskytu diabetes mellitus, hypertenze, hyperlipidemie a kouření v předchorobí. Pacienti v obou skupinách se nelišili v základních klinických charakteristikách, jak ukazuje tab. 1 a 2. Ze všech stentů implantovaných při pPCI bylo pouze 6,6 % lékových. Pacienti léčení konzervativně měli ve větším procentu přítomnou významnou stenózu na RIA než pacienti ve skupině preventivní PCI. Ti měli naopak častěji jako neinfarktovou tepnu pravou věnčitou tepnu (ACD). Rozdíly ale nebyly statisticky významné. Průměrná diametr stenóza neinfarktové tepny v obou souborech činila 80 %. Jeden pacient měl v průměru 1,2 závažných stenóz. Pouze 13 (6,1 %) pacientů mělo diametr stenózu neinfarktové tepny ≥ 95 %. Průměrná doba od IM léčeného pPCI do provedení preventivní PCI na non‑culprit stenóze činila 19,6 ± 15,9 dnů. Z celkového počtu naimplantovaných stentů bylo celkem 23,8 % lékových (DES). Pouze čtyři (3,8 %) pacienti měli periprocedurální IM.
Tab. 1. Základní charakteristika pacientů při randomizaci. 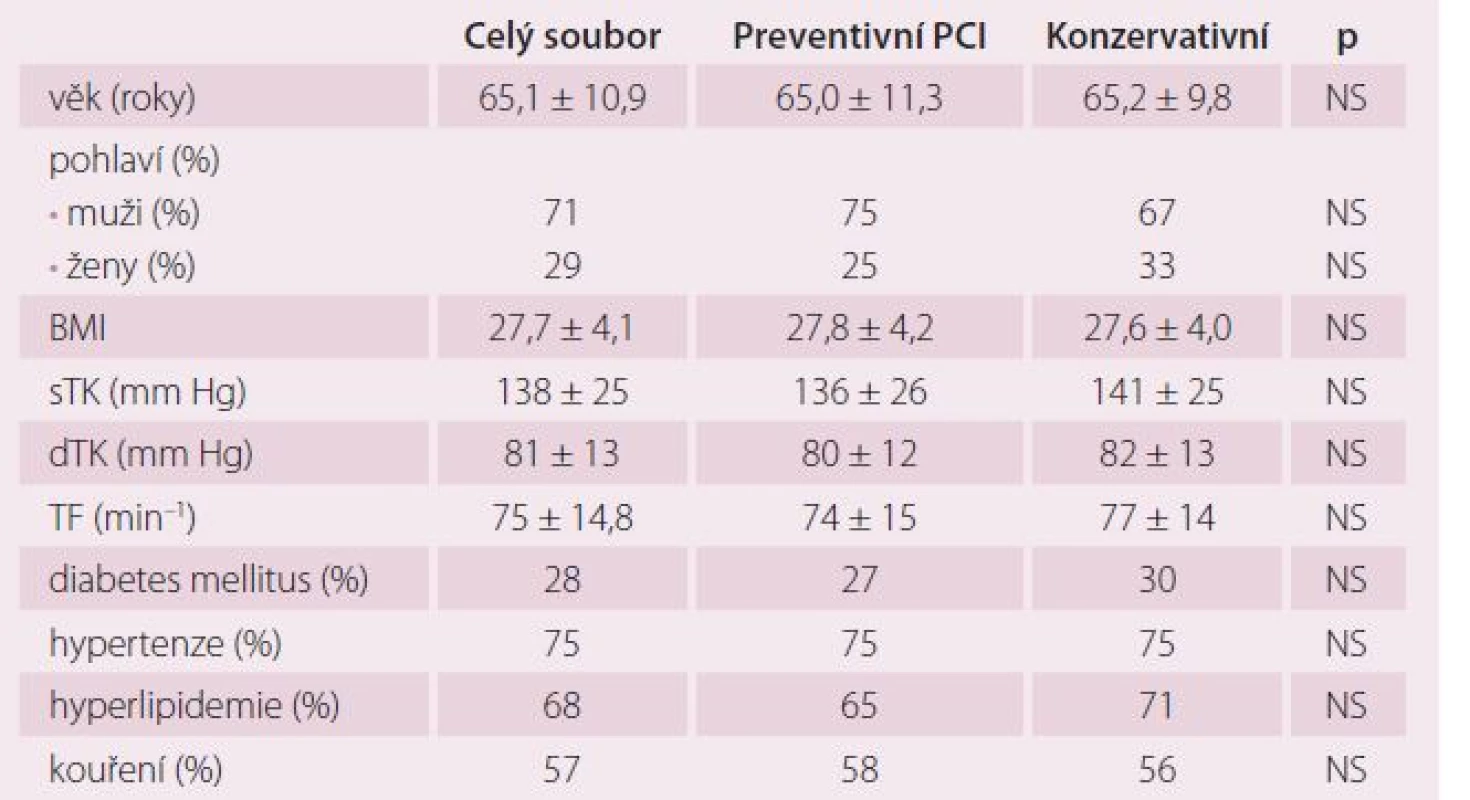
BMI – body mass index, sTK – systolický krevní tlak, dTK – diastolický krevní tlak, TF – tepová frekvence, PCI – perkutánní koronární intervence Tab. 2. STEMI léčený pPCI. 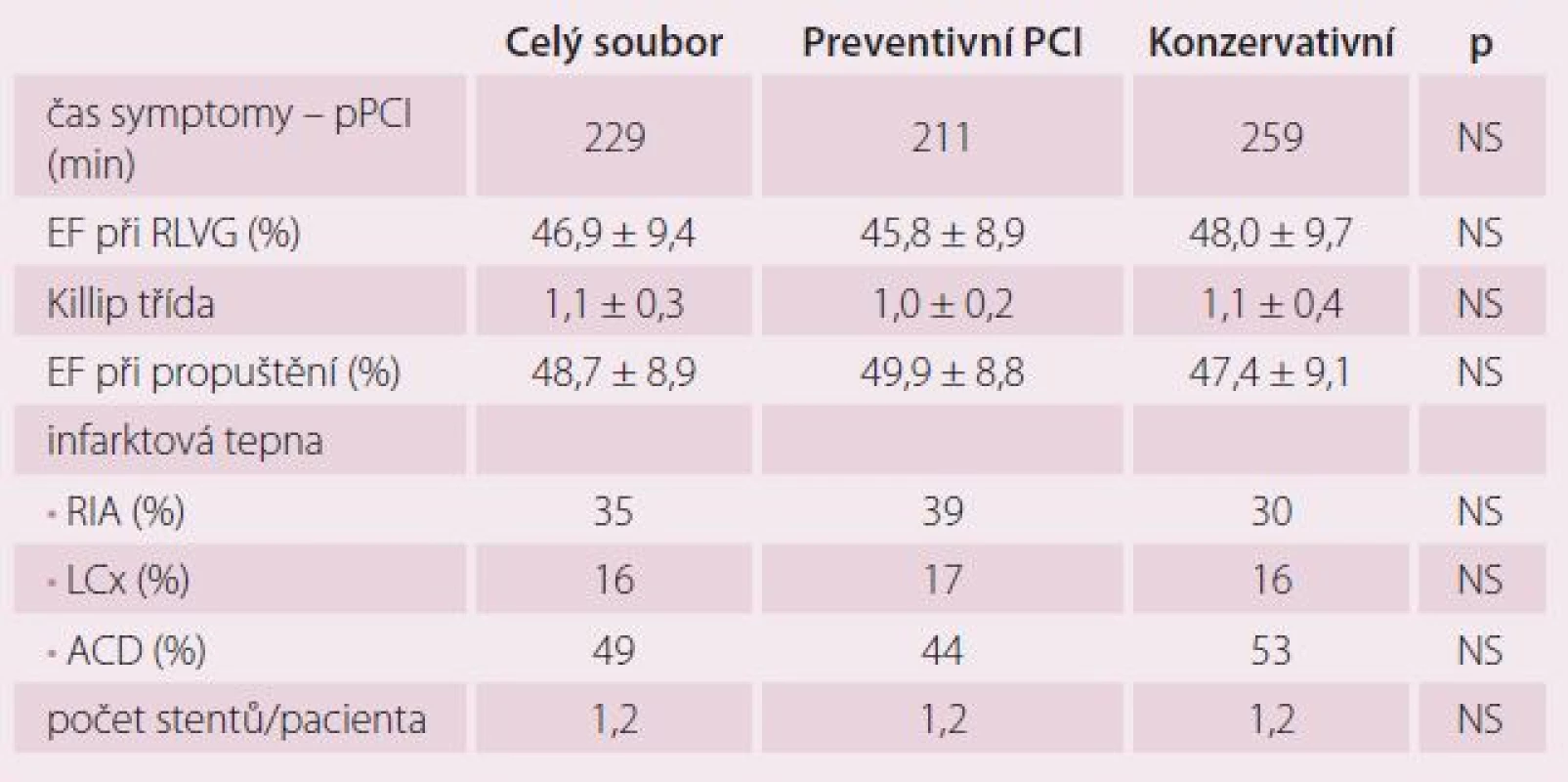
pPCI – primární perkutánní koronární intervence, EF – ejekční frakce, RVLG – retrográdní levostranná ventrikulografie Primární a sekundární cíle studie
V naší studii zemřelo během průměrného sledování (1 387 dnů, což je 3,8 roku), celkem 13 pacientů, z toho šest randomizovaných do skupiny preventivní PCI a sedm do skupiny konzervativní (intention to treat). Tři pacienti, původně randomizovaní do skupiny PCI, ji nakonec nepodstoupili a zemřeli. Z toho ve dvou případech měli přidělen řádný termín preventivní PCI a toho se vzhledem k náhlému úmrtí nedočkali. U jednoho pacienta musela být PCI odložena pro krvácející hemoroidy. Pacient byl znovu hospitalizován pro nestabilní anginu pectoris, opět katetrizován a doporučen aortokoronární bypass (CABG). Ten nemocný dlouho odmítal a nakonec zemřel náhle po téměř dvou letech od prvního IM. Dalším ukazatelem, z kterého byl složen primární cíl studie, je vznik nefatálního akutního IM. Akutní IM jsme dělili na STEMI, NSTEMI a periprocedurální. STEMI mělo celkem šest pacientů, z toho dva ve skupině konzervativní a čtyři ve skupině preventivní PCI. NSTEMI prodělalo devět a periprocedurální IM při preventivní PCI definovaný na základě trojnásobného zvýšení CKMB celkem čtyři pacienti. Periprocedurální IM byl řídkou příhodou většinou u mladších pacientů. Jejich prognóza ale byla dále nekomplikovaná. Naopak pacienti, kteří prodělali během sledování CMP, měli osud špatný. Dva ze tří nemocných s CMP zemřeli.
Tab. 3 ukazuje statistické zhodnocení výskytu primárního složeného cíle a jeho součástí. Ve skupině konzervativní léčby dva pacienti zemřeli na CMP a jeden s odstupem po IM, proto celkový počet pacientů se sledovanou klinickou příhodou je v této skupině o tři nižší. Rozdíly mezi oběma skupinami nejsou v primárním složeném ukazateli ani v jeho jednotlivých částech statisticky významné.
Tab. 3. Klinické příhody tvořící primární složený ukazatel. 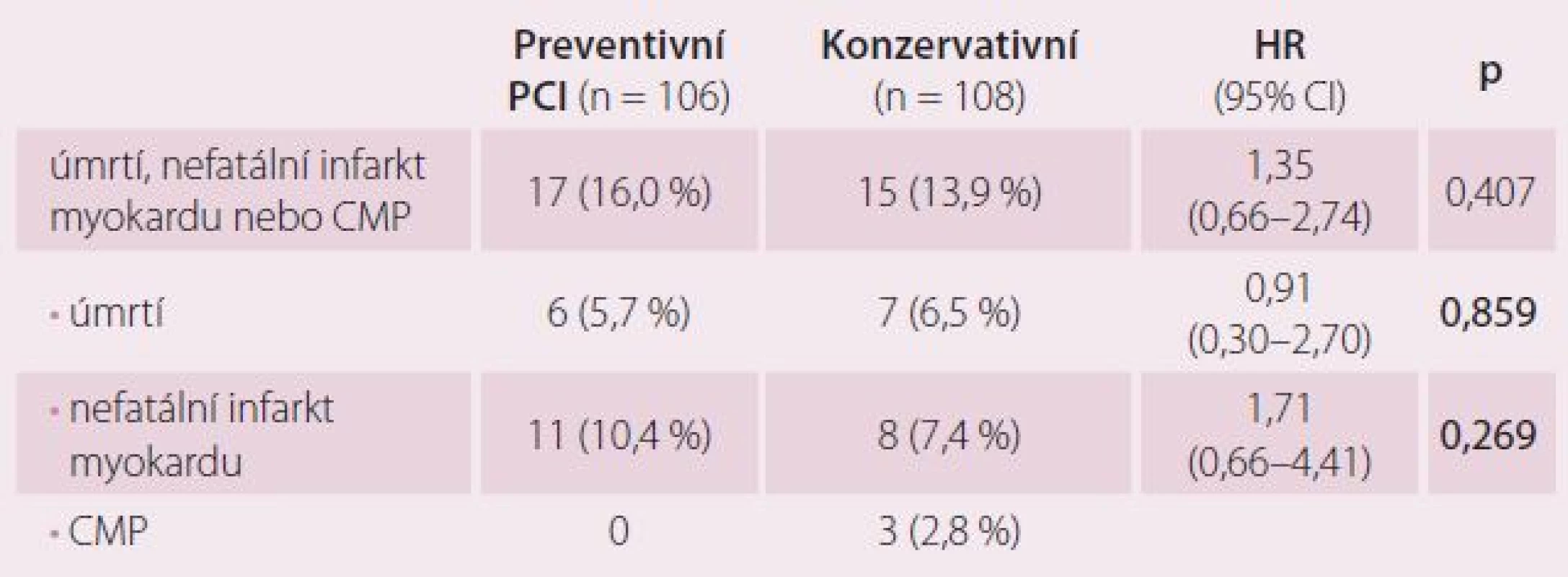
CMP – cévní mozková příhoda , PCI – perkutánní koronární intervence, HR – hazard ratio Graf 1 zobrazuje rozdíly mezi skupinami v primárním složeném ukazateli pomocí Kaplan ‑ Meierových křivek. Na základě log rank testu (p = 0,407) nejsou rozdíly mezi skupinami statisticky významné.
Graf 1. Kaplan Meierovy křivky pro primární složený ukazatel. Intention to treat analýza. 
Primární ukazatel – složený z úmrtí, nefatálního infarktu myokardu a cévní mozkové příhody. Sekundární cíle studie ukazuje tab. 4. Na kardiovaskulární příčinu zemřeli čtyři pacienti ve skupině preventivní PCI a tři pacienti ve skupině konzervativní. Pacienti ve skupině PCI měli o 75 % nižší riziko změny léčebné skupiny než nemocní ve skupině konzervativní, což je statisticky významný rozdíl. Celkem 19 pacientů (18 %) ze skupiny konzervativní mělo v průběhu sledování revaskularizovanou neinfarktovou tepnu. Naopak ve skupině randomizované k preventivní PCI bylo pět pacientů (5 %), kterým nebyla PCI provedena. Důvodem toho bylo ve dvou případech úmrtí nemocného v době čekání na PCI, v jednom případě posunutí termínu PCI v důsledku krvácení a její následné odmítnutí pacientem, ve dvou případech se pacienti k PCI nedostavili a přáli si, aby byli léčeni konzervativně. Dvakrát více pacientů ve skupině konzervativní mělo v průběhu sledování revaskularizovanou neinfarktovou (Prague‑13) tepnu než ve skupině preventivní PCI. Přibližně stejný počet revaskularizací připadal na infarktovou a neinfarktovou tepnu. Neinfarktová (non‑culprit) stenóza, na základě které byl pacient zařazen do studie, ani v jednom případě u celkem 108 pacientů nevedla ke vzniku STEMI a pouze u jednoho nemocného ke vzniku NSTEMI. Tento nemocný měl pozitivní ukazatele nekrózy myokardu doprovázené stenokardiemi, nález na Prague ‑ 13 stenóze byl ale stejný jako při první koronarografii.
Tab. 4. Sekundární cíle studie (preventivní PCI vs. konzervativní léčba). 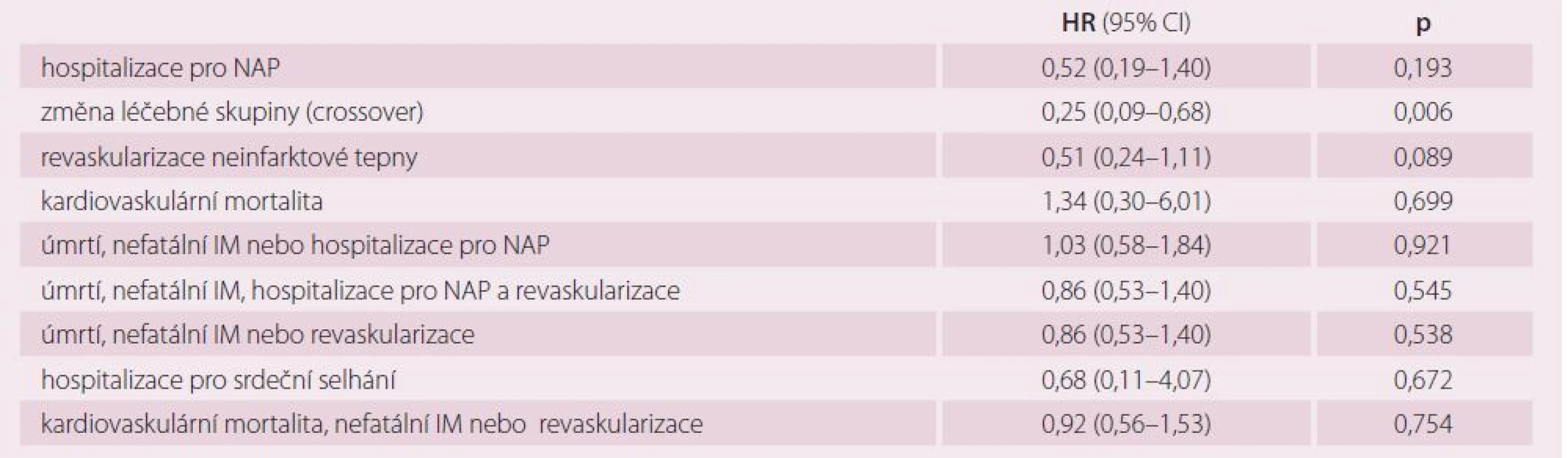
NAP – nestabilní angina pectoris, IM – infarkt myokardu, HR – hazard ratio Diskuze
Studie Prague‑13 u nemocných se STEMI léčených pPCI neprokázala význam preventivní PCI na významné stenóze neinfarktové tepny provedené ve druhém sezení ve srovnání s konzervativním přístupem.
Podmínkou zařazení do studie bylo mimo jiné přesvědčení intervenčního kardiologa, že obě léčebné možnosti jsou pro pacienta bezpečné. Dalším požadavkem byla nepřítomnost limitující anginy pectoris více než jeden měsíc před pPCI. To vedlo k významnému výběru nemocných, kdy bylo do studie zařazeno pouze 7,4 % pacientů přicházejících k pPCI. Pouze 10 % pacientů mělo známou ischemickou chorobu srdeční v předchorobí, průměrná Killip třída při IM byla 1,1 a ejekční frakce levé komory 49 %, tedy jen mírně snížená. Celková mortalita v celém souboru nemocných byla během sledování pouze 6 %. V naší studii byli tedy zařazeni jen málo rizikoví pacienti. Původně jsme předpokládali zařadit 708 pacientů při dvouletém sledování, aby rozdíly v primárním cíli mohly být statisticky významné. Pro pomalý nábor jsme se rozhodli prodloužit sledování na téměř dvojnásobnou dobu. Přesto náš soubor na prokázání rozdílu ve sledovaných klinických cílech (úmrtí, nefatální IM, CMP) nebyl dostatečně velký. Nevýhodou studie je dále nízký podíl lékových stentů, nicméně jejich zastoupení odpovídá reálné praxi v obou zemích v době provádění studie. Rutinní použití lékových stentů při pPCI se stalo normou v ČR až v roce 2014. Jelikož nejsou známa data o snížení mortality a reinfarktu při použití lékových stentů ve srovnání s normálními stenty, nepředpokládáme při jejich širším používání ani výrazné ovlivnění výsledků naší studie.
Studie PRAMI jako první velká, prospektivní, randomizovaná studie prokázala výhody okamžité revaskularizace neinfarktových stenóz oproti konzervativnímu přístupu [21]. Její závěry byly v rozporu s dosud zavedenou praxí, kdy se více tepen při STEMI řešilo PCI jen v případě kardiogenního šoku, nejednoznačnosti infarktové tepny a při pokračující ischemii i po ošetření předpokládané infarktové tepny [2 – 5]. Každopádně studie PRAMI nám poskytla informace o vhodnosti když ne okamžité kompletní revaskularizace, tak aspoň jejího dokončení v průběhu hospitalizace pro IM. V nedávno prezentované studii CVLPRIT, která dopadla příznivě pro skupinu preventivní PCI, byla také většina PCI na neinfarktových stenózách (59 %) provedena v průběhu pPCI [22]. Na základě studie PRAMI, CVLPRIT a částečně Prague ‑ 13, ve které dva pacienti, kteří čekali na preventivní PCI, zemřeli, můžeme doporučit dokončení kompletní revaskularizace v rámci jedné hospitalizace. Studie PRAMI, CVLPRIT a DANAMI3 - PRIMULTI [23] byly hodnoceny jako pozitivní proto, že prokázaly statisticky významné snížení primárního kombinovaného klinického cíle, který kromě mortality a nefatálního IM zahrnoval i refrakterní anginu pectoris (PRAMI), srdeční selhání a ischemií podmíněnou revaskularizaci (CVLPRIT) a ischemií podmíněnou revaskularizaci neinfarktové tepny (DANAMI3 – PRIMULTI). Naše studie měla primární cíl složený pouze z celkové mortality a nefatálního IM. Zajímavé je proto srovnání výskytu celkové mortality nebo nefatálního IM ve studiích mezi sebou, jak vidíme v tab. 5. Z tabulky vyplývá, že celková mortalita je v obou sledovaných skupinách (preventivní PCI vs. konzervativní léčba) prakticky stejná (35 vs. 40 pacientů). Určitá tendence ve prospěch preventivní PCI je patrná pouze ve vzniku nefatálního IM. Počet nefatálních IM byl ve studii Prague ‑ 13 ovlivněn čtyřmi periprocedurálními infarkty, které ve studiích PRAMI a částečně i CVLPRIT vzhledem k jejich designu nebyly diagnostikovány. Provádíme‑li PCI na neinfarktové tepně ihned po pPCI na infarktové tepně, tak se eventuální nárůst ukazatelů nekrózy myokardu v důsledku postižení myokardu v povodí neinfarktové tepny skryje v nárůstu způsobeném akutním IM. Výsledky naší studie jsou také zkresleny náhodným výskytem CMP v konzervativní skupině, které se objevily u třech pacientů více než jeden rok po IM. Jestliže odmyslíme tři pacienty s CMP (dva z nich zemřeli) a čtyři pacienty s prognosticky zcela nevýznamným periprocedurálním IM, tak máme v naší studii výskyt kombinovaného ukazatele celkové mortality a nefatálního IM 13 vs. 12 (PCI vs. konzervativní). Studie PRAMI a CVLPRIT zahrnovaly rizikovější pacienty než studie Prague ‑ 13. Například studie PRAMI zařadila 465 pacientů z 2 428 nemocných se STEMI, tj. 19,2 %. Budeme‑li např. do studie ve větším počtu zařazovat nemocné s 99 % non‑culprit stenózou v proximálním úseku tepny, kteří navíc měli i anginu pectoris v předchorobí, tak je pravděpodobné, že se někdy v budoucnu pro bolesti na hrudi dostanou do nemocnice a budou indikováni k rekoronarografii. V řadě případů bude tato tepna ošetřena pomocí PCI, a pacient se tak dostane do skupiny opakované revaskularizace a ovlivní to primární cíl (CVLPRIT). Podobně to platí pro refrakterní anginu, která byla součástí primárního cíle ve studii PRAMI. Můžeme se na to dívat i tak, že pacient, který má pouze bolesti na hrudi a nemá IM, není vlastně moc ohrožen. Preventivní PCI bychom tak mohli klidně odložit, pacienty pečlivě sledovat a PCI na non‑culprit lézi provést jedině tehdy, když se jednoznačné stenokardie objeví. K vyvrácení tohoto přístupu je nutné prokázat vliv preventivní PCI neinfarktové stenózy na mortalitu a IM. Výsledky publikovaných metaanalýz k tomu nestačí [24 – 31]. Ve studii PRAMI měli všichni pacienti PCI neinfarktové stenózy v rámci jednoho výkonu s ošetřením infarktové tepny při pPCI, ve studii CVLPRIT jich bylo 59 %. U malého procenta pacientů pozorujeme více než jednu infarktovou lézi a randomizace takových pacientů do skupiny konzervativní může negativně ovlivnit jejich prognózu [32 – 35]. V základním souboru všech nemocných se STEMI ve studii PRAMI bylo jen 13 (0,5 %) pacientů, kteří mimo studii měli ošetřeny dvě infarktové věnčité tepny v rámci pPCI. V běžné praxi je takových pacientů jistě více. Jestliže se v rámci primárního cíle pohybujeme v malých číslech v rámci jednotek, tak každý takový pacient studii negativně ovlivní. Velká většina pracovišť intervenční kardiologie je přesvědčena o vhodnosti ošetřování kritických stenóz pomocí PCI. Přesto je ale nejasné, jak přistupovat ke stenózám hraničním nebo málo významným (angiograficky 40 – 80 %, FFR 0,75 – 0,85). Další studie by se měly zaměřit především na tyto stenózy a nikoli je pouze přiřadit ke stenózám kritickým a řešit je podobně.
Tab. 5. Srovnání studií PRAMI, CVLPRIT, DANAMI3-PRIMULTI a Prague-13 (PCI vs. konzervativní skupina). 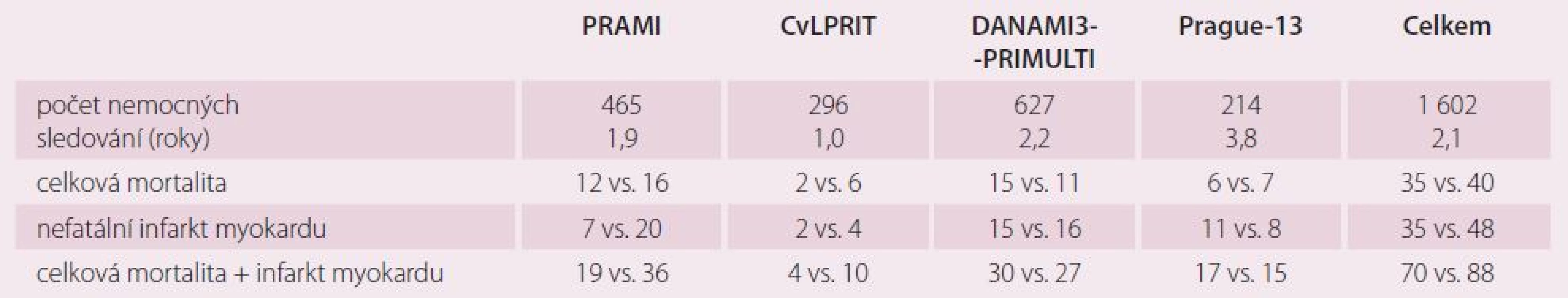
Za zásadní považujeme zjištění, že sledované Prague ‑ 13 stenózy nevedly ani v jednom případě ke vzniku STEMI a pouze snad u jednoho pacienta způsobily NSTEMI. Zde jsme ale progresi této léze angiograficky nedokumentovali. Všechny ostatní IM byly způsobeny buď de novo lézí na různých místech koronárního stromu, nebo lézí související s implantovanými stenty, tj. restenózou nebo trombózou ve stentu. Základní podmínkou vstupu do studie bylo přesvědčení intervenčního kardiologa o stabilitě neinfarktové stenózy. Z literatury totiž víme, že v řadě případů je v době akutního IM nestabilních lézí více [32 – 35]. Výsledky naší studie prokazují, že naprostá většina z nich ale dlouhodobě stabilní byla. Údaj o počtu pacientů s progresí neinfarktové stenózy do IM nám v publikovaných studiích většinou chybí. V současnosti probíhá velká mezinárodní studie COMPLETE s podobným primárním klinickým cílem jako studie Prague ‑ 13, která by nám měla definitivně odpovědět na otázku, zda preventivní PCI neinfarktových stenóz snižuje mortalitu a riziko vzniku IM.
Závěr
Studie Prague ‑ 13 u nemocných se STEMI léčených pPCI neprokázala význam preventivní PCI na významné stenóze neinfarktové tepny provedené ve druhém sezení ve srovnání s konzervativním přístupem. Preventivní PCI nevedla ke snížení celkové mortality ani k zabránění vzniku nefatálního IM u málo rizikových nemocných.
Podpořeno grantem IGA MZ ČR pod registračním číslem NT11412 - 5/ 2010.
Doručeno do redakce: 22. 6. 2015
Přijato po recenzi: 20. 7. 2015
MUDr. Ota Hlinomaz, CSc.
www.fnusa.cz
ota.hlinomaz@fnusa.cz
Zdroje
1. Keeley EC, Boura JA, Grines CL. Primary angioplasty versus intravenous thrombolytic therapy for acute myocardial infarction: a quantitative review of 23 randomised trials. Lancet 2003; 361 : 13 – 20.
2. O’Gara PT, Kushna FG, Ascheim DD et al. 2013 ACCF/ AHA Guideline for the management of 1st ‑ elevation myocardial infarction: executive summary: a report of the American College of Cardiology Foundation/ American Heart Association Task Force on Practice Guidelines. Circulation 2013; 127 : 529 – 555. doi: 10.1161/ CIR.0b013e3182742c84.
3. Steg G, James SK, Atar D et al. The Task Force on the management of ST‑segment elevation acute myocardial infarction of the European Society of Cardiology (ESC). ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST‑segment elevation. Eur Heart J 2012; 33 : 2569 – 2619. doi: 10.1093/ eurheartj/ ehs215.
4. Windecker S, Kolh P, Alfonso F et al. 2014 ESC/ EACTS Guidelines on myocardial revascularization. The Task Force on Myocardial Revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio ‑ Thoracic Surgery (EACTS). Eur Heart J 2014; 35 : 3541 – 3619. doi: 10.1093/ eurheartj/ ehu278.
5. Patel MR, Dehmer GJ, Hirshfeld JW et al. ACCF// SCAI/ STS/ AATS/ AHA/ ASNC 2009 Appropriateness Criteria for Coronary Revascularization: A Report of the American College of Cardiology Foundation Appropriateness Criteria Task Force, Society for Cardiovascular Angiography and Interventions, Society of Thoracic Surgeons, American Association for Thoracic Surgery, American Heart Association, and the American Society of Nuclear Cardiology: Endorsed by the American Society of Echocardiography, the Heart Failure Society of America, and the Society of Cardiovascular Computed Tomography. Circulation 2009; 119 : 1330 – 1352. doi: 10.1161/ CIRCULATIONAHA.108.191768.
6. Bangalore S, Faxon DP. Coronary intervention in patients with acute coronary syndrome: does every culprit lesion require revascularization? Curr Cardiol Rep 2010; 12 : 330 – 337. doi: 10.1007/ s11886 ‑ 010 ‑ 0115 ‑ 8.
7. Di Mario C, Mara S, Flavio A et al. Single vs. multivessel treatment during primary angioplasty: results of the multicentre randomised HEpacoat for cuLPrit or multivessel stenting for Acute Myocardial Infarction (HELP AMI) Study. Int J Cardiovasc Intervent 2004; 6 : 128 – 133.
8. Qarawani D, Nahir M, Abboud M et al. Culprit only versus complete revascularization during primary PCI. Int J Cardiol 2008; 123 : 288 – 292
9. Corpus RA, House JA, Marso SP et al. Multivessel percutaneous coronary intervention in patients with multivessel disease and acute myocardial infarction. Am Heart J 2004; 148 : 493 – 500.
10. Khattab AA, Abdel ‑ Wahab M, Röther C et al. Multi‑vessel stenting during primary percutaneous coronary intervention for acute myocardial infarction: a singlecenter experience. Clin Res Cardiol 2008; 97 : 32 – 38.
11. Rigattieri S, Biondi ‑ Zoccai G, Silvestri P et al. Management of multivessel coronary disease after ST elevation myocardial infarction treated by primary angioplasty. J Interv Cardiol 2008; 21 : 1 – 7.
12. Kornowski R, Mehran R, Dangas G et al. Prognostic impact of staged vs. "one ‑ time" multivessel percutaneous intervention in acute myocardial infarction: analysis from the HORIZONS ‑ AMI (harmonizing outcomes with revascularization and stents in acute myocardial infarction) trial. J Am Coll Cardiol 2011; 58 : 704 – 711.
13. Ochala A, Smolka GA, Wojakowski W et al. The function of the left ventricle after complete multivessel one‑stage percutaneous coronary intervention in patients with acute myocardial infarction. J Invasive Cardiol 2004; 16 : 699 – 702.
14. Vlaar PJ, Mahmoud KD, Holmes DR Jr. et al. Culprit vessel only vs. multivessel and staged percutaneous coronary intervention for multivessel disease in patients presenting with ST‑segment elevation myocardial infarction: a pairwise and network meta‑analysis. J Am Coll Cardiol 2011; 58 : 692 – 703. doi: 10.1016/ j.jacc.2011.03.046.
15. Abe D, Sato A, Hoshi T et al. Initial culprit ‑ only versus initial multivessel percutaneous coronary intervention in patients with ST‑segment elevation myocardial infarction: results from the Ibaraki Cardiovascular Assessment Study registry. Heart Vessels 2014; 29 : 171 – 177. doi: 10.1007/ s00380 ‑ 013 ‑ 0342 ‑ 1.
16. Varani E, Balducelli M, Aquilina M et al. Single or multivessel percutaneous coronary intervention in ST‑elevation myocardial infarction patients. Catheter Cardiovasc Interv 2008; 72 : 927 – 933. doi: 10.1002/ ccd.21722.
17. Hannan EL, Samadashvili Z, Walford G et al. Culprit vessel percutaneous coronary intervention versus multivessel and staged percutaneous coronary intervention for ST‑segment elevation myocardial infarction patients with multivessel disease. JACC Cardiovasc Interv 2010; 3 : 22 – 31. doi: 10.1016/ j.jcin.2009.10.017.
18. Dambrink JH, Debrauwere JP, Hof AW et al. Non ‑ culprit lesions detected during primary PCI: treat invasively or follow the guidelines? EuroIntervention 2010; 5 : 968 – 975.
19. Politi L, Sgura F, Rossi R et al. A randomised trial of target ‑ vessel vs. multi‑vessel revascularisation in ST‑elevation myocardial infarction: major adverse cardiac events during longterm follow‑up. Heart 2010; 96 : 662 – 667. doi: 10.1136/ hrt.2009.177162.
20. Manari A, Varani E, Guastaroba P et al. Long‑term outcome in patients with ST segment elevation myocardial infarction and multivessel disease treated with culprit ‑ only, immediate, or staged multivessel percutaneous revascularization strategies: Insights from the REAL registry. Catheter Cardiovasc Interv. 2014; 84 : 912 – 922. doi: 10.1002/ ccd.25374.
21. Wald DS, Morris JK, Wald NJ et al. Randomized trial of preventive angioplasty in myocardial infarction. N Engl J Med 2013; 369 : 1115 – 1123. doi: 10.1056/ NEJMoa1305520.
22. Gershlick AH, Khan JN, Kelly DJ et al. Randomized trial of complete versus lesion ‑ only revascularization in patients undergoing primary percutaneous coronary intervention for STEMI and multivessel disease: the CvLPRIT trial. J Am Coll Cardiol 2015; 65 : 963 – 972. doi: 10.1016/ j.jacc.2014.12.038.
23. Engstroem T. The third Danish study of optimal acute treatment of patients with ST‑segment elevation myocardial infarction primary PCI in multivessel disease DANAMI3 – PRIMULTI. San Diego: ACC 2015.
24. El ‑ Hayek GE, Gershlick AH, Hong MK et al. Meta‑Analysis of Randomized Controlled Trials Comparing Multivessel Versus Culprit ‑ Only Revascularization for Patients With ST‑Segment Elevation Myocardial Infarction and Multivessel Disease Undergoing Primary Percutaneous Coronary Intervention. Am J Cardiol 2015; 115 : 1481 – 1486. doi: 10.1016/ j.amjcard.2015.02.046.
25. Bainey KR, Mehta SR, Lai T et al. Complete vs culprit ‑ only revascularization for patients with multivessel disease undergoing primary percutaneous coronary intervention for ST‑segment elevation myocardial infarction: A systemic review and meta‑analysis. Am Heart J 2014; 167 : 1 – 14. doi: 10.1016/ j.ahj.2013.09.018.
26. Sarathy K, Nagaraja V, Kapur A et al. Target ‑ vessel versus multivessel revascularisation in st ‑ elevation myocardial infarction: a meta‑analysis of randomised trials. Heart Lung Circ 2014; 24 : 327 – 334. doi: 10.1016/ j.hlc.2014.10.013.
27. Moretti C, D'Ascenzo F, Quadri G et al. Management of multivessel coronary disease in STEMI patients: a systematic review and meta‑analysis. Int J Cardiol 2015; 179 : 552 – 557. doi: 10.1016/ j.ijcard.2014.10.035.
28. Yeh RW, Drachman DE. Culprit only, multivessel, or staged multivessel intervention in STEMI: new insights or insurmountable methodologic obstacles? Catheter Cardiovasc Interv 2014; 84 : 923 – 924. doi: 10.1002/ ccd.25673.
29. Widimsky P, Holmes DR. How to treat patients with ST‑elevation acute myocardial infarction and multi‑vessel disease? Eur Heart J 2011; 32 : 396 – 403. doi: 10.1093/ eurheartj/ ehq410.
30. Bailey SR. Revascularization for ST segment elevation MI: advances in treatment of multivessel disease in STEMI. Catheter Cardiovasc Interv 2014; 84 : 857 – 858.
31. Pollack A, Mohanty BD, Handa R et al. Preventive Stenting in Acute Myocardial Infarction. JACC Cardiovasc Interv 2015; 8 : 131 – 138. doi: 10.1016/ j.jcin.2014.09.006.
32. Goldstein JA, Demetriou D, Grines CL et al. Multiple complex coronary plaques in patients with acute myocardial infarction. N Engl J Med 2000; 343 : 915 – 922.
33. Takano M, Inami S, Ishibashi F et al. Angioscopic follow‑up study of coronary ruptured plaques in nonculprit lesions. J Am Coll Cardiol 2005; 45 : 652 – 658.
34. Ambrose JA, D'Agate DJ. Plaque rupture and intracoronary thrombus in nonculprit vessels: an eyewitness account. J Am Coll Cardiol 2005; 45 : 659 – 660.
35. Glaser R, Selzer F, Faxon DP et al. Clinical progression of incidental, asymptomatic lesions discovered during culprit vessel coronary intervention. Circulation 2005; 111 : 143 – 149.
Štítky
Detská kardiológia Interné lekárstvo Kardiochirurgia Kardiológia
Článok vyšiel v časopiseKardiologická revue – Interní medicína
Najčítanejšie tento týždeň
2015 Číslo 3- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Statinová intolerance
- Co dělat při intoleranci statinů?
-
Všetky články tohto čísla
- Bezdrátová kardiostimulace – budoucnost nebo fikce?
- Novinka v intervenční terapii srdečního selhání se zachovalou ejekční frakcí levé komory
- Novinky v koronárních intervencích
- Mnohočetné postižení věnčitých tepen diagnostikované při pPCI pro STEMI: kompletní revaskularizace nebo konzervativní léčba. Studie Prague‑ 13.
- Erratum - Přímé versus nepřímé metody stanovení intenzity zatížení v kardiovaskulární rehabilitaci
- Farmakologická a nefarmakologická léčba fibrilace síní – současný pohled
- Léčebné postupy u námahové anginy pectoris
- Srdeční zástava a poresuscitační péče
- Komentovaná zkrácená verze evropských doporučení pro diagnostiku a management akutní plicní embolie z roku 2014
- Co přinesla nová evropská guidelines pro trvalou kardiostimulaci a srdeční resynchronizační léčbu (2013) v oblasti diagnostiky arytmií pomocí dlouhodobého monitorování EKG – současné technické aspekty a typy dlouhodobého monitorování EKG
- Fixní trojkombinace antihypertenziv a subklinické orgánové poškození – kazuistika
- Studie IMPROVE‑ IT u pacientů s diabetes mellitus
- Studie TECOS – efekt sitagliptinu na kardiovaskulární příhody u diabetes mellitus 2. typu
- Co zaznělo v HOT lines na ČKS 2015
- Co zaznělo na ESC 2015
- 500 transplantací srdce v Brně
- 25th European Meeting on Hypertension and Cardiovascular Protection, Milan 2015
- Zemřel prof. MUDr. Miloš Štejfa, DrSc., FESC28. 5. 1929– 20. 5. 2015
- Vzpomínka na prof. Miloše Štejfu
- Kardiologická revue – Interní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Srdeční zástava a poresuscitační péče
- Léčebné postupy u námahové anginy pectoris
- Bezdrátová kardiostimulace – budoucnost nebo fikce?
- Novinka v intervenční terapii srdečního selhání se zachovalou ejekční frakcí levé komory
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



