-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Jak nejlépe blokovat renin-angiotenzinový systém u nemocných s hypertenzí a diabetes mellitus?
The best method of renin-angiotensin-aldosterone system blockade in patients with hypertension and diabetes mellitus?
The aim of this article is to evaluate the efficacy and safety of different methods of blockade of the renin-angiotensin-aldosterone system (RAAS) in patients with type 2 diabetes. It is not entirely clear how to best and most effectively block the RAAS system in diabetic patients due to the lack of data from randomised clinical trials. Knowledge about treatment methods in this group of patients is obtained only from subgroup analyses and metaanalyses, where results may be less reliable. Combination therapy with ACE inhibitors and ARBs could more effectively block the RAAS, but present findings demonstrate conflicting results, particularly as regards the safety of patients.
Keywords:
diabetes mellitus type 2. – hypertension – renin-angiotensin-aldosterone system
Autoři: J. Špác
Působiště autorů: II. interní klinika LF MU a FN U sv. Anny v Brně
Vyšlo v časopise: Kardiol Rev Int Med 2016, 18(1): 13-16
Kategorie: Kardiologická revue
Motto: Metaanalýza je jako párek nebo klobása – nikdo, kromě řezníka, neví, co obsahuje.
Souhrn
Cílem článku je zhodnotit účinnost a bezpečnost různých způsobů blokády systému renin-angiotenzin-aldosteron (RAAS) u nemocných s diabetem 2. typu. Jak nejvhodněji a nejúčinněji blokovat systém RAAS u diabetiků, není zcela jasné, protože chybí údaje z randomizovaných klinických studií u diabetiků. Znalosti o způsobu léčby u této skupiny nemocných jsou získávány jen z analýz podskupin a z metaanalýz, jejichž výsledky mohou být méně spolehlivé. Kombinační terapie s ACE inhibitory a sartany by mohla lépe blokovat RAAS, ale dosavadní poznatky ukazují rozporuplné výsledky, zvláště pokud se týká bezpečnosti nemocných.
Klíčová slova:
diabetes mellitus 2. typu – hypertenze – renin-angiotenzin-aldosteron systém
Systém renin-angiotenzin-aldosteron (RAAS) je zásadním regulačním mechanizmem k udržení homeostázy a zajištění optimální regulace krevního tlaku (TK), vodního a minerálního prostředí a perfuze tkání v podmínkách s nízkým obsahem sodíku. V dávné minulosti byl RAAS podmínkou přežití, ale v moderní civilizaci s vysokou spotřebou sodíku se působení RAAS systému jeví jako přítěž a v řadě patologických situací (např. hypertenze, srdeční nedostatečnost či diabetes mellitus (DM)) spojených s chronickým zvýšením aktivity presorických systémů je škodlivé.
V problematice inhibice RAAS je stále mnoho nejasností vzhledem k tomu, že tento systém je komplexní s tkáňovou a cirkulující složkou, obsahuje klasickou i alternativní cesty aktivace a je spojen s metabolizmem vazodilatačních mediátorů. V klinické praxi jsou v současnosti dvě lékové skupiny zaměřené na blokádu nadměrně aktivovaného RAAS – ACE inhibitory (ACEI – inhibitory enzymu konvertujícího angiotenzin – inhibují proteázu ACE) a blokátory angiotenzinogenového receptoru typu 1 – nazývané také sartany. Nadějně vypadající skupina přímých inhibitorů reninu byla stažena z běžné praxe pro výskyt vedlejších účinků hlavně na ledvinné funkce a ze stejného důvodu není doporučována kombinace sartanů a ACEI. Běžně používané betablokátory vedou jen k neúplné inhibici systému RAAS.
Patofyziologický podklad blokády RAAS – rozdíly mezi sartany a ACE
Inhibice osy RAAS pomocí inhibitorů ACE a sartanů se v některých patofyziologických aspektech liší, účinek sartanů, a ACEI není proto plně srovnatelný.
Hlavní rozdíly jsou v následujících bodech:
- Proteáza ACE vedle konverze angiotenzinu I(Ang I) na angiotenzin II (Ang II) omezuje též degradaci důležitého vazodilatačního a natriuretického peptidu – bradykininu (obr. 1). Působením ACEI se zvýší nabídka bradykininu s aktivací jeho receptoru. Antihypertenzní účinek ACEI je ve srovnání se sartany mírně výraznější a tento jev se může podílet na rozdílné účinnosti na kardiovaskulární (KV) systém [1].
- Obě lékové skupiny ACE a sartany rozdílně ovlivňují hladiny Ang I, která je vysoká při léčbě ACEI, a hladiny Ang II zvyšující se naopak po podání sartanů. Vzhledem k tomu, že oba angiotenziny jsou metabolizovány na řadu dalších biologicky aktivních peptidů, je i tento aspekt významný. Angiotenzin konvertující enzym 2 (ACE 2) vede k přeměně Ang II na Ang (1 – 7) a k přeměně Ang I na Ang (1 – 9). Ang (1 – 7) je heptapeptid, který má vazodilatační, antifibrotický a natriuretický účinek. ACE 2 není blokován ACEI. Rozdílný farmakodynamický účinek sartanů a ACEI tak může být podmíněn stimulací receptorů pro Ang II typu AT2 (zprostředkující vazodilataci a mitogenní účinek) a AT3 (stimulující aktivaci trombocytů) a působením Ang (1 – 7) při použití sartanů [2].
- Mechanizmem účinku sartanů je účinnější blokáda receptorů Ang II (AT1). Konverze Ang Ina Ang II je zprostředkována vedle ACE též nespecifickými tkáňovými proteázami (katepsin, chymáza – tzv. alternativní cesta RAAS systému) a za patologických stavů význam nespecifických tkáňových proteáz roste. Aktivují se zpětné vazby vedoucí k vyšší produkci reninu a jeho vazbám na ledvinné receptory.
Obr. 1. Schéma RAAS systému – klasická, alternativní cesta a bradykininový systém. 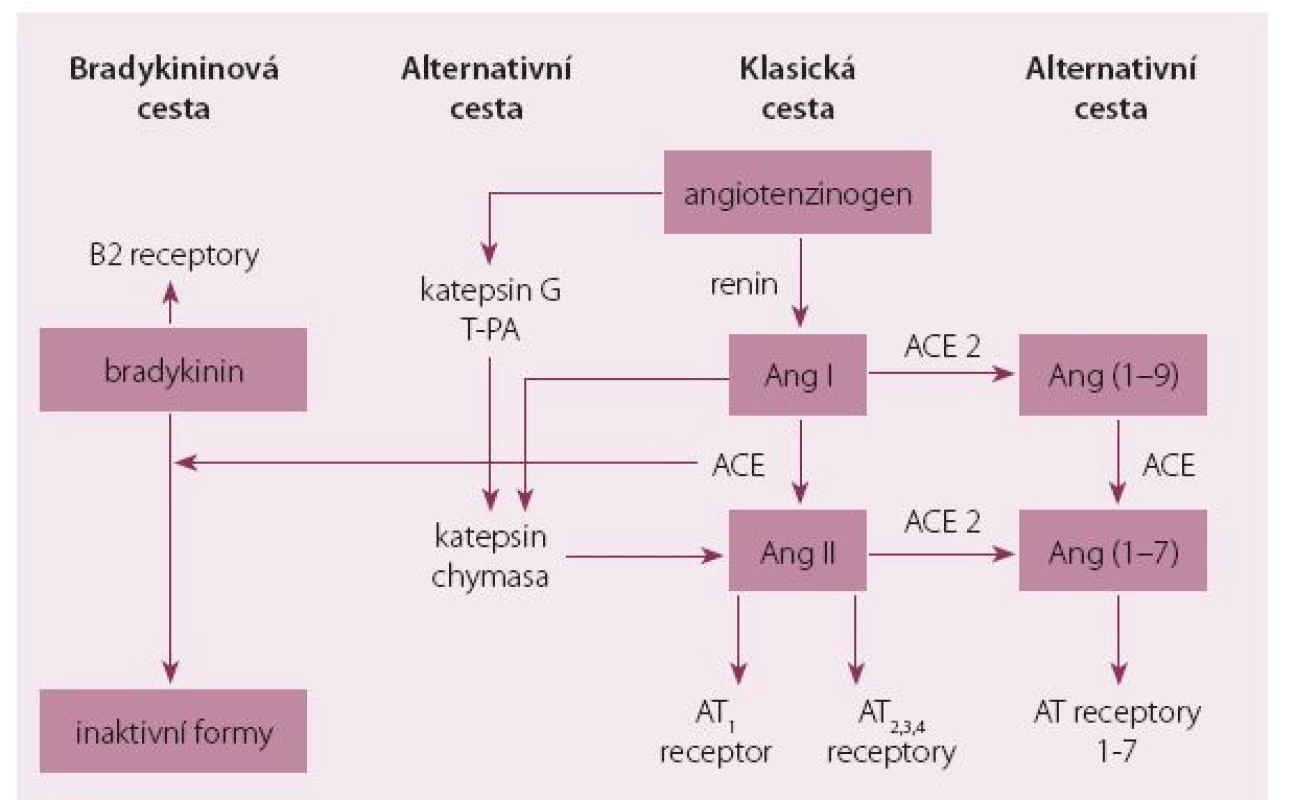
Obecně má inhibice RAAS kardio - a nefroprotektivní vliv, i když z farmakologického pohledu je jasné, že tyto dvě lékové skupiny mají odlišný vliv na řadu biologických ukazatelů. I tím může být ovlivněn výsledek léčby (tab. 1). Na základě prací sledujících antihypertenzní účinek farmakoekvivalentních dávek sartanů a ACEI bylo konstatováno, že díky zvýšení nabídky natriureticky a vazodilatačně působícímu bradykininu jsou ACEI na snížení TK i na úpravu endoteliální dysfunkce mírně účinnější.
Tab. 1. Ovlivnění jednotlivých složek RAAS ACE inhibitory a sartany. 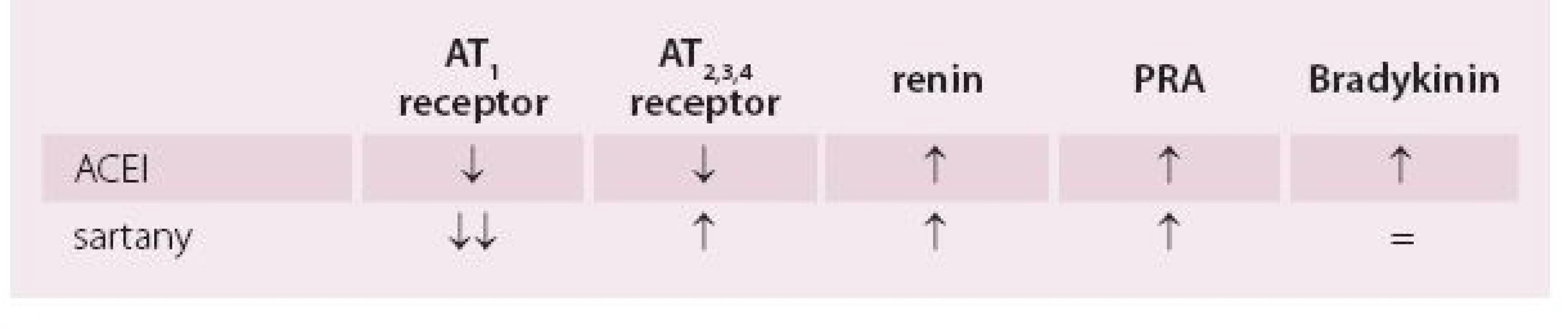
Z pohledu praktického klinického použití jsou obě skupiny dle doporučených postupů při léčbě hypertenze rovnocenné. Také při použití v indikaci sekundární prevence aterosklerózy jsou ACEI a sartany považovány za rovnocenné. Výsledky klinických studií v indikaci prevence či zpomalení progrese diabetické i nediabetické nefropatie jsou u obou skupin srovnatelné, i když v některých studiích vedla léčba sartany ke snížení renálních funkcí ve srovnání s placebem. U chronického srdečního selhání (SS) jsou výhodnější ACEI a sartany indikujeme pouze při nemožnosti podat ACEI. Doklady o příznivém vlivu sartanů na mortalitu a morbiditu jsou u chronického SS výrazně menší (studie ELITE II, VALHEFT, CHARM).
Blokáda RAAS u nemocných s hypertenzí a nemocných s vysokým rizikem aterosklerózy nebo jejími komplikacemi
Obě lékové skupiny, jak ACEI, tak sartany, jsou mezi pěti základními lékovými skupinami, které byly Evropskou i Českou hypertenzní společností označeny jako léky první volby v léčbě hypertenze, a jsou používány při zahájení léčby u velké části nemocných.
Největší studie ONTARGET porovnávající ACEI ramipril a zástupce ze skupiny sartanů telmisartan u 25 000 nemocných s manifestním KV onemocněním nebo u vysoce rizikových nemocných nezjistila žádné rozdíly v KV a celkové mortalitě mezi ramiprilem a telmisartanem [3]. Sartany měly zcela srovnatelnou účinnost s ACEI s výhodou menšího výskytu vedlejších účinků a lepší compliance. Studie LIFE byla jedinou, která prokázala výhody sartanů (losartan) oproti jiné aktivní léčbě hypertenze, i když zde byla léčba losartanem srovnávána oproti nedostatečně dávkovanému atenololu a řada nemocných léčených losartanem měla diuretikum [4]. Ve studii VALUE nebyl zjištěn rozdíl v účinnosti valsartanu nebo amlodipinu na KV ukazatele, sekundární parametr výskyt infarktu myokardu (IM) byl mírně vyšší u skupiny léčené valsartanem [5]. Teprve metaanalýza vlivu sartanů z roku 2011 vyvrátila podezření, že u nemocných léčených sartany může být vyšší výskyt IM [6]. Také další randomizované klinické studie srovnávající vliv placeba + běžné ostatní léčby oproti sartanům nemají příliš povzbuzující výsledky (tab. 2).
Tab. 2. Přehled randomizovaných studií s placebem + ostatní běžnou léčbou oproti některému typu sartanu. 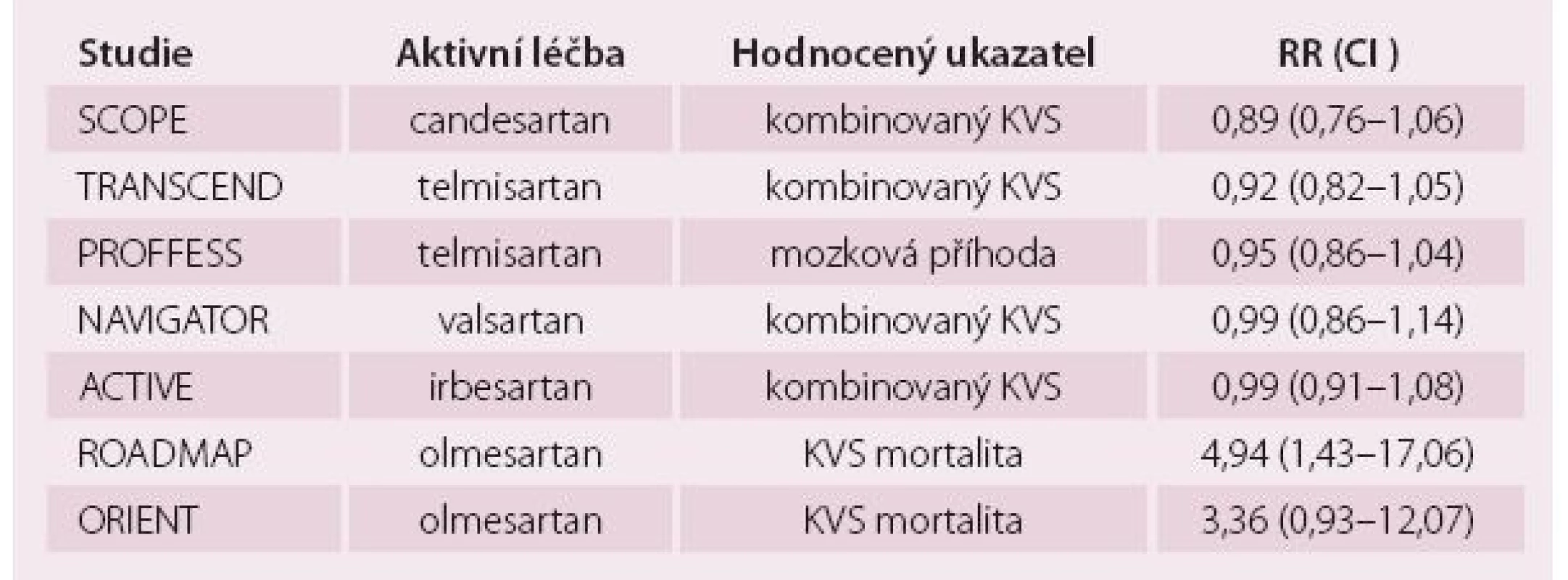
KVS – kardiovaskulární ukazatel, RR – relativní riziko Van Varková et al v roce 2012 provedli metaanalýzu u více než 150 000 pacientů s léčenou hypertenzí v klinických studiích provedených po roce 2000. Zjistili, že ke snížení celkové mortality vede jen léčba ACEI (o 5 % oproti kontrolní skupině, která měla placebo ve 33 %, a ostatní léčeni jinými antihypertenzivy). KV mortalita se snížila o 7 %. U sartanů nebylo snížení statisticky významné a celková mortalita nebyla ovlivněna, i když rozdíl mezi oběma lékovými skupinami nedosahoval statistické významnosti [7]. Této metaanalýze je vytýkáno především nezahrnutí některých, z pohledu sartanů zásadních studií, jako je např. studie ONTARGET.
Savarese et al v roce 2013 provedli další metaanalýzu 26 randomizovaných studií více než 100 000 pacientů u vysoce rizikových pacientů bez SS. Jak ACEI, tak sartany snižovaly kombinovaný cílový ukazatel (IM, cévní mozkové příhody (CMP) a KV mortalitu), snížily výskyt CMP a nově vzniklý DM. Celkovou mortalitu a výskyt IM však snižovaly jen ACEI [8]. Porovnávané soubory nemocných mezi oběma lékovými skupinami ovšem nebyly homogenní, proto srovnání v této metaanalýze má jen omezenou výpovědní hodnotu pro praxi. Autoři proto považují sartany za cennou alternativu pro pacienty nesnášející ACEI. Jsou tyto údaje přenostitelné také na nemocné s diabetes mellitus?
Blokáda RAAS u diabetiků s hypertenzí
Studie MEDINA provedená českými autory ukázala, že asi 4/ 5 diabetiků s hypertenzí potřebují k dosažení cílových hodnot TK kombinaci antihypertenziv [9]. Experimentální práce ukázaly, že blokátor systému RAAS by měl být vždy součástí kombinace vzhledem k jeho výjimečnému nefroprotektivnímu účinku. Dochází k dilataci především eferentních arteriol, klesá proteinurie a zpomaluje se progrese diabetické nefropatie. Příznivě ovlivňuje centrální aortální tlak spojený se změnami tuhosti cév, které jsou u diabetiků silně vyjádřeny. Inhibitory RAS systému jsou metabolicky neutrální a v experimentu mají kromě svého hypotenzního účinku ještě další příznivé vlastnosti, které se mohou podílet na jejich protektivních vlastnostech. Studie Ravida et al ukázala, že diabetici s proteinurií i při normálních hladinách TK mají prospěch z dlouhodobé léčby enalaprilem [10]. Nefroprotektivita u diabetiků 2. typu byla následně v roce 2000 v klinické studii prokázána pro ACEI [11] a později i pro losartan [12], irbesartan [13] a valsartan. Blokáda RAAS snižuje inzulinovou rezistenci, která je patofyziologickým podkladem metabolického syndromu a diabetu 2. typu [14]. Předpokládaným mechanizmem je zlepšení perfuze svalstva a pankreatických buněk a také přímý vliv Ang II na pankreatické betabuňky v rámci lokálního RAAS pankreatu.
Otázka, zda u nemocných s hypertenzí a DM jsou výhodnější ACEI nebo blokátory A1 receptorů, je zatím nezodpovězena. Nebyla provedena žádná randomizovaná studie na diabetické populaci zabývající se touto otázkou, všechna data máme jen z analýzy podskupin nemocných. Obě lékové skupiny – ACEI a sartany – mají pravděpodobně stejný vliv na prevenci vzniku DM, jak ukazují dvě velké metaanalýzy. Ve srovnání s diuretiky se incidence nově vzniklého DM snížila o 20 – 30 %. Jejich vliv na snížení KV ukazatelů a celkové mortality se nezdá tak homogenní, jak bychom mohli usuzovat z preklinických a experimentálních studií. V roce 2014 byla uveřejněna metaanalýza 35 studií, která posoudila zvláště vliv ACEI a sartanů na celkovou mortalitu, KV úmrtí a větší KV příhody u pacientů s DM [15]. Primárním cílem metaanalýzy byl vliv ACEI a sartanů na celkovou mortalitu, KV úmrtí a KV příhody. Do metaanalýzy byly zařazeny jen klinické studie trvající nejméně 12 měsíců s podskupinami diabetiků. Celkem u 32 827 nemocných v 23 z 35 nalezených studií se porovnával vliv ACEI oproti placebu nebo jiné aktivní léčbě. Celkem 13 studií porovnalo sartany s kontrolami bez léčby u 23 867 pacientů. ACEI snížily celkovou mortalitu o 13 %, KV mortalitu o 17 % a velké KV příhody jako KV úmrtí, nefatální IM, CMP a revaskularizace myokardu nebo SS více než sartany, jak ukazuje obr. 2.
Obr. 2. Výsledky metaanalýzy Chenga et al srovnávající relativní změny při léčbě hypertoniků s DM pomocí ACE inhibitorů a sartanů [15]. ![Výsledky metaanalýzy Chenga et al srovnávající relativní změny při léčbě hypertoniků s DM pomocí ACE inhibitorů a sartanů [15].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/928f677e7c12313cfdccd37d318686b9.jpg)
V porovnání s jinými antihypertenzivy nesnížily výrazněji riziko CMP u diabetiků ani ACEI ani sartany. Metanalýza má své slabé stránky – porovnávané klinické studie s ACEI a sartany nejsou ekvivalentní – skupina ACE studií byla mnohem větší než skupiny léčené sartany (23 oproti 13) s více nemocnými (32 827 oproti 23 867). Také charakteristika a stupeň rizika nemocných byl v jednotlivých studiích různý. U nemocných s vyšší hodnotou TK a s vyšším KV rizikem je vliv léčby aktivní látkou samozřejmě větší a výsledky přesvědčivější. Je také možné, že u nemocných s méně pokročilou formou onemocnění můžeme více ovlivnit průběh onemocnění než u nemocných s pokročilou formou onemocnění (podobný jev je znám z diabetologie). Obě lékové skupiny – ACEI a sartany – nejsou homogenní, obě skupiny mají různé zástupce s odlišnými farmakokinetickými i farmakodynamickými vlastnostmi. Metaanalýzy předpokládají „class efekt“ lékových skupin, nicméně jak jednotlivé ACEI, tak sartany mají velmi rozdílné vlastnosti. Také uspořádání klinických studií v obou skupinách bylo odlišné – různé cílové hodnoty TK, různá taktika léčby, různé věkové složení nemocných apod. Studie s ACEI jsou z let 1992 – 2005, studie ze sartany z let 2001 – 2011. Většina nemocných s DM vyžaduje vícečetnou antihypertenzní medikaci, ta byla na konci minulého tisíciletí jiná než o deset let později. Také vyšší procento nemocných bylo léčeno statiny a prokazovat větší účinnost léčby u nemocných s dokonalejší léčbou rizikových faktorů je těžší než u nemocných méně intenzivně léčených. Metaanalýzy také mohou zahrnovat klinické studie, kde bylo selhání aktivní léčby způsobeno neadekvátním uspořádáním studie a nikoli selháním testovaného léku. Porovnání dvou lékových skupin na základě metaanalýz je nespolehlivé a přednost jedné z lékových skupin lze prokázat pouze v randomizované zaslepené studii [16].
Výsledky metaanalýzy ukazují, že lékem první volby u diabetiků by měly být ACEI, které jsou také výhodnější u nemocných se SS či po překonané KV či CMP. Menší účinnost sartanů v některých indikacích je vyvážena jejich lepší snášenlivostí, zejména významně nižší je výskyt kašle a angioedému, což vede ke zlepšení compliance k léčbě s méně častým přerušením léčby.
Dvojitá blokáda RAAS
Do kombinované léčby ACEI a sartany u nemocných s DM a hypertenzí se vkládaly velké naděje vzhledem k popisovanému pozitivnímu vlivu blokády RAAS na proteinurii. Některé menší práce ukázaly, že přidání sartanu k ACEI je lepší než zdvojnásobení dávky ACEI. Velká randomizovaná studie s touto kombinací u nemocných normoalbuminurických nebo mikroalbuminurických (ONTARGET) měla neutrální výsledek s nárůstem vedlejších účinků, studie u nemocných s proteinurickou diabetickou nefropatií (VA NEPHRON a ALTITUDE) byly předčasně ukončeny z důvodu nárůstu hyperkalemie a akutního poškození ledvin, resp. z nárůstu mozkových příhod ve větvi s kombinační léčbou RAAS systému. Všechny výše uvedené studie jsou ale napadány hlavně nefrology kvůli metodologickým nedostatkům těchto klinických studií. Věk nemocného, stupeň hypertenze, množství proteinurie a sekvence léčby (nejprve léčba ACEI a posléze přidání sartanů) jsou pravděpodobně zásadními parametry při výběru této léčby a v klinických studiích nebyly dle kritiků tyto parametry zcela zohledněny. Svoji roli sehrává u diabetiků i přítomnost autonomní dysfunkce. Myšlenka co nejúčinnější blokády RAAS kombinační léčbou nebyla opuštěna. Někteří se domnívají, že u mladších nemocných s vyššími hodnotami TK s proteinurií nemusí být tato léčba nepříznivá. Nedávno vyšla metaanalýza 157 randomizovaných studií u 43 256 nemocných s chronickým onemocněním ledvin a DM a výsledky duální kombinace RAAS se nezdají tak špatné, jak se jeví při pohledu na velké randomizované studie [17]. Nejlepší nefroprotektivní potenciál měla kombinace inhibitorů RAAS a sartanů (snížení relativního rizika o 38 %, na druhém místě monoterapie sartany (o 23 %). Účinek byl nezávislý na TK. Žádná kombinace nezlepšila oproti placebu celkovou mortalitu. Hyperkalemie a akutní poškození ledvin se vyskytovaly v menší míře. Dle odhadů z této metaanalýzy by se na 1 000 nemocných léčených kombinací ACEI a sartany po dobu jednoho roku zabránilo třem selháním ledvin a zlepšila by se albuminurie u 90 nemocných. Vzniklo by ale 38 případů akutního poškození ledvin a 65 případů hyperkalemie. Menší metaanalýza španělských autorů zahrnující devět klinických studií s 11 543 nemocnými ukázala neutrální vliv na mortalitu s nárůstem výskytu hyperkalemie a hypotenze, bez zvýšeného výskytu akutního poškození ledvin [18]. K podobným výsledkům došla i metaanalýza dvojité blokády RAAS u nemocných s chronickým onemocněním ledvin [19].
doc. MU Dr. Jiří Špác, CSc.
www.fnusa.cz
jiri.spac@fnusa.cz
Doručeno do redakce: 19. 1. 2016
Přijato po recenzi: 3. 2. 2016
Zdroje
1. Ceconi C, Francolini G, Olivares A et al. Angiotensin-converting enzyme (ACE) inhibitors have different selectivity for bradykinin binding sites of human somatic ACE. Eur J Pharmacol 2007; 577 : 1 – 6.
2. Crackower MA, Sarao R, Oudit GY et al. Angiotensin-converting enzyme 2 is an essential regulator of heart function. Nature 2002; 417 : 822 – 828.
3. Yusuf S, Teo KK, Pogue J et al. The ONTARGET Investigators. Telmisartan, ramipril, or both in patients at high risk for vascular events. N Engl J Med 2008; 358 : 1547 – 1559. doi: 10.1056/ NEJMoa0801317.
4. Lindholm LH, Ibsen H, Dahlöf B et al. Cardiovascular morbidity and mortality in patients with diabetes in the Losartan Intervention For Endpoint reduction in hypertension study (LIFE): a randomised trial against atenolol. Lancet 2002; 359 : 1004 – 1010.
5. Julius S, Kjeldsen SJ, Weber M et al. The VALUE Trial Group. Outcomes in hypertensive patients at high cardiovascular risk treated with regimens based on valsartan or amlodipine: the VALUE randomised trial. Lancet 2004; 363 : 2022 – 2031.
6. Bangalore S, Kumar S, Wetterslev J et al. Angiotensin receptor blockers and risk of myocardial infarction: meta-analyses and trial sequential analyses of 147,020 patients from randomised trials. BMJ 2011; 342: d2234. doi: 10.1136/ bmj.d2234.
7. van Vark LC, Bertrand M, Akkerhuis KM et al. Angiotensin-converting enzyme inhibitors reduce mortality in hypertension: a meta-analysis of randomized clinical trials of renin-angiotensin-aldosterone system inhibitors involving 158,998 patients. Eur Heart J 2012; 33 : 2088 – 2097. doi: 10.1093/ eurheartj/ ehs075.
8. Savarese G, Constanzo P, Cleland JG et al. A meta-analysis reporting effects of angiotensin-converting enzyme inhibitors and angiotensin receptor blockers in patiens without heart failure. J Am Coll Cardiol 2013; 61 : 131 – 142. doi: 10.1016/ j.jacc.2012.10.011.
9. Špinar J, Vítovec J, Souček M. Anti-hypertensive strategies in patients with MEtabolic parameters, DIabetes mellitus and/ or NephropAthy (the MEDINA study). Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2013; 158 : 412 – 421. doi: 10.5507/ bp.2013.053.
10. Ravid M, Land R, Rachmani R et al. Long term renoprotective effect of angiotensin-converting enzyme inhibition in non-insulin-dependent diabetes mellitus: a 7 - year follow-up study. Arch Intern Med 1996; 156 : 286 – 289.
11. The Heart Outcomes Prevention Evaluation Study Investigators. Effects of ramipril on cardiovascular and microvascular outcomes in people with diabetes mellitus: results of the HOPE study and MICRO-HOPE substudy. Lancet 2000; 355 : 253 – 259.
12. Brenner BM, Cooper ME, de Zeeuw D et al. Effects of losartan on renal and cardiovascular outcomes in patients with type 2 diabetes and nephropathy. N Engl J Med 2001; 345 : 861 – 869.
13. Lewis EJ, Hunsicker LG, Clarke WR et al. Renoprotective effect of the angiotensin-receptor antagonist irbesartan in patients with nephropathy due to type 2 diabetes. N Engl J Med 2001; 345 : 851 – 860.
14. Jandeleit-Dahm KA, Tikellis C, Reid CM et al. Why blockade of the renin-angiotensin system reduces the incidence of new-onset diabetes. J Hypertens 2005; 23 : 463 – 443.
15. Cheng J, Zhang W, Zhang X et al. Effect of angiotensin-converting enzyme inhibitors and angiotensin ii receptor blockers on all-cause mortality, cardiovascular deaths, and cardiovascular events in patiens with diabetes mellitus: a meta-analysis. JAMA Intern Med 2014; 174 : 773 – 785. doi: 10.1001/ jamainternmed.2014.348.
16. Václavík J, Slíva J. Inhibitory ACE, nebo sartany v léčbě hypertenze: zbytečná diskuze. Cor Vasa 2014; 56 : 477 – 479.
17. Palmer SC, Mavridis D, Navarese E et al. Comparative efficacy and safety of blood pressure-lowering agents in adults with diabetes and kidney disease: a network meta analysis. Lancet 2015; 385 : 2047 – 2056. doi: 10.1016/ S0140-6736(14)62459-4.
18. Catala Lopez F, Macias Saint-Gerons D. Diabetes mellitus and risks of dual blockade of the renin-angiotensin-aldosterone system. Rev Esp Cardiol 2013; 66 : 403 – 415. doi: 10.1016/ j.rec.2012.11.010.
19. Susantitaphong P, Sewaralthahab K, Balk EM et al. Efficacy and safety of combined vs. single renin-angiotensin - aldosterone system blockade in chronic kidney disease: a meta-analysis. Am J Hypertens 2013; 26 : 424 – 441. doi: 10.1093/ ajh/ hps038.
Štítky
Detská kardiológia Interné lekárstvo Kardiochirurgia Kardiológia
Článok vyšiel v časopiseKardiologická revue – Interní medicína
Najčítanejšie tento týždeň
2016 Číslo 1- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Statinová intolerance
- Genetický podklad a screening familiární hypercholesterolémie
- Metabolit živočišné stravy produkovaný střevní mikroflórou zvyšuje riziko závažných kardiovaskulárních příhod
-
Všetky články tohto čísla
- Jak nejlépe blokovat renin-angiotenzinový systém u nemocných s hypertenzí a diabetes mellitus?
- Infekční komplikace u pacientů s akutním srdečním selháním – přehled
- Přidružená onemocnění a jejich význam pro prognózu akutního srdečního selhání – AHEAD score
- Kardiálna kachexia
- Tělesný trénink a rehabilitace u srdečního selhání
- Kvalita života pacientů s akutní dekompenzací chronického systolického srdečního selhání hodnocená pomocí standardizovaných dotazníků
- Hyperurikémia, kardiovaskulárne choroby a srdcové zlyhávanie
- Antikoagulace, antiagregace nebo obojí u pacientů s ischemickou chorobou srdeční a fibrilací síní
- Místo sitagliptinu v léčbě pacientů s diabetem 2. typu po studii TECOS
- Na jaké hodnoty snižovat systolický krevní tlak? Studie SPRINT
- prof. MUDr. Jiří Vítovec, CSc., FESC (*25. 2. 1951)
- Evropský konsenzus k otázkám aterogenní dyslipidemie a kombinační léčbě statinem a fibrátem
- Inhibitory protonové pumpy – nové molekuly, nové poznatky
- Nové pohledy na patofyziologii, diagnostiku a léčbu srdečního selhání se zachovanou ejekční frakcí
- Kardiologická revue – Interní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Inhibitory protonové pumpy – nové molekuly, nové poznatky
- Antikoagulace, antiagregace nebo obojí u pacientů s ischemickou chorobou srdeční a fibrilací síní
- Kardiálna kachexia
- Hyperurikémia, kardiovaskulárne choroby a srdcové zlyhávanie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



