-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Pozdní následky kardiotoxicity
Late consequences of cardiotoxicity
Advances in oncological treatment have led to improved survival of patients with cancer, but have also increased morbidity and mortality due to the treatment side effects. Cardiovascular diseases are among the most frequent of these side effects, and there is a growing concern that they may lead to premature morbidity and death among cancer survivors. This may be caused by cardiotoxicity, which involves the direct effects of cancer treatment on heart function and structure, or by accelerated development of cardiovascular diseases, especially in the presence of traditional cardiovascular risk factors. The most common side effects of anti-cancer treatment include vasospastic and thromboembolic ischaemia, arterial hypertension, arrhythmia, and cardiac dysfunctions that may lead to heart failure. Although the issues related to cardio-oncology have received increasing attention in recent years, many aspects of both radiation-induced and cancer drug-induced cardiovascular disease remain to be fully elucidated. Furthermore, the inability to predict the long-term consequences of cardiovascular side effects of cancer treatment leads to under - or over-diagnosis of cardiovascular diseases, sometimes resulting in the failure to prevent adverse events and sometimes leading to inappropriate interruption of a potentially life-saving cancer treatment.
Keywords:
late cardiotoxicity – chemotherapy – radiotherapy – cardio-oncology
Autori: L. Elbl
Pôsobisko autorov: Privátní kardiologická ambulance, Brno
Vyšlo v časopise: Kardiol Rev Int Med 2017, 19(1): 22-29
Súhrn
Rozvoj onkologické léčby vede ke zlepšení přežívání onkologických nemocných, ale zároveň ke zvýšené morbiditě a mortalitě v důsledku léčby vedlejších nežádoucích účinků. Kardiovaskulární (KV) onemocnění jsou nejčastějším vedlejším následkem terapie a jsou narůstajícím problémem, který může vést k předčasným klinickým komplikacím a úmrtí přežívajících onkologických nemocných. Jedná se o důsledek kardiotoxicity, která je následkem léčby nádoru nebo akcelerací přítomného KV onemocnění, zvláště za přítomnosti rizikových faktorů. Protinádorová léčba je nejběžnější příčinou kardiotoxicity, která nejčastěji zahrnuje vznik ischemie, arteriální hypertenze, arytmií a srdečních dysfunkcí vedoucích ke vzniku srdečního selhání. Ačkoli se problematika kardio-onkologie v posledních letech výrazně rozvíjí, řada aspektů vzniku KV poškození radioterapií či chemoterapií musí být objasněna. Stále nejsme schopni přesně předpovědět vývoj pozdních vedlejších následků onkologické léčby, což může vést k podhodnocení či nadhodnocení diagnostických kritérií příslušných KV komplikací. Tato situace může někdy vést k neadekvátnímu ovlivnění či předčasnému přerušení léčby nádoru.
Klíčová slova:
pozdní kardiotoxicita – chemoterapie – radioterapie – kardio-onkologieÚvod
V posledních 30 letech se výrazně snížila mortalita a prodloužilo se přežívání pacientů se zhoubnými nádory díky včasné diagnostice, novým léčebným strategiím a pokroku v chirurgické léčbě nádorů. Dlouhodobé přežívání nemocných je na druhé straně doprovázeno možností klinické manifestace poškození jiných orgánových systémů vlastní protinádorovou terapií. Jedná se především o poškození kardiovaskulárního (KV) systému. KV choroby jsou v současné době na druhém místě v dlouhodobé morbiditě a mortalitě nemocných po onkologické léčbě. Konvenční terapie a cílená léčba nádorů jsou spjaty se zvýšeným rizikem poškození srdce, které zahrnuje poškození funkce levé komory (LK) srdeční, rozvoj srdečního selhání (SS), dále vznik arteriální hypertenze (AH), plicní arteriální hypertenze (PAH), vazospastické a tromboembolické ischemie a celého spektra srdečních arytmií. Léčba spolu se změnou životního stylu může akcelerovat vznik metabolického syndromu (MS).
Některé pozdní následky mohou být ireverzibilní a vedou k progresi srdečního poškození, jiné mají jen dočasný průběh bez dlouhodobých následků. Vedle farmakoterapie nádorových onemocnění se jako významný rizikový faktor časného a pozdního poskožení srdečních struktur (radiation-induced heart disease – RIHD) manifestuje i radioterapie, která se projevuje poškozením perikardu, myokardu, chlopenního aparátu, vznikem arytmií či ischemické choroby srdeční (ICHS). Výskyt těchto komplikací je podmíněn kumulací rizikových faktorů (tab. 1).
Tab. 1. Rizikové faktory kardiotoxicity. 
Onkologové tak stojí před problémem vlastní léčby, která může svými vedlejšími následky negativně ovlivnit další přežívání nemocných i přes úspěchy léčebných režimů.
Nová disciplina kardio-onkologie vznikla za účelem optimalizovat péči o onkologicky nemocné, kteří jsou ve fázi léčby nebo v období po úspěšné terapii, abychom zamezili neočekávaným komplikacím, popřípadě včas zahájili terapii pozdních KV následků [1 – 3].
Epidemiologie kardiotoxicity onkologické léčby
Nádorové a srdeční choroby patří k nejčastějším příčinám morbidity a mortality v industriálních zemích. I přesto můžeme mít důvod k optimizmu, neboť pokrok v prevenci, diagnostice a léčbě těchto onemocnění vedl ke zvýšení šancí onkologických nemocných na přežití u řady nádorů. Pětileté přežití pacientek s časným stadiem karcinomu prsu bylo v roce 1990 asi 78 %, zatímco v roce 2012 88 %. Podobné nálezy byly popsány u nemocných s hematologickými malignitami a testikulárním karcinomem. Předpokládá se, že v příští dekádě se zvýší dlouhodobé přežívání onkologických nemocných o dalších 30 %. V USA se odhaduje, že v roce 2022 bude žít asi 18 milionů pacientů, kteří prodělali léčbu onkologického onemocnění. Tito nemocní s sebou nesou další ekonomické a medicínské riziko manifestace pozdního KV poškození. Je zde riziko přímé (myokardiální toxicita, ischemie, hypertenze, arytmie) a nepřímé (negativní změna životního stylu) (tab. 2). KV choroby jsou velmi častou příčinou úmrtí onkologických nemocných, u žen nad 50 let věku po terapii karcinomu prsu dokonce častější příčinou než vlastní nádorové onemocnění. U dospělé populace není vždy jasné, zda výskyt KV chorob souvisí s protinádorovou terapií nebo jde o proces související s věkem, tak jak je tomu v běžné populaci. Jiné údaje poskytují dlouhodobé pediatrické studie, které prokázaly v období 15 – 25 let po terapii 15násobné zvýšení výskytu chronického SS (CHSS), 10násobné zvýšení výskytu KV onemocnění, 9násobné zvýšení výskytu cévních mozkových příhod (CMP) a 8,2násobné zvýšení srdečních úmrtí ve srovnání s normální populací. Tyto údaje mají velký význam pro dospělou populaci, která stojí po onkologické terapii jednak tváří v tvář pozdním následkům terapie a zárovneň možným komplikacím, které souvisejí s věkem [1].
Tab. 2. Základní rizikové faktory kardiotoxicity. 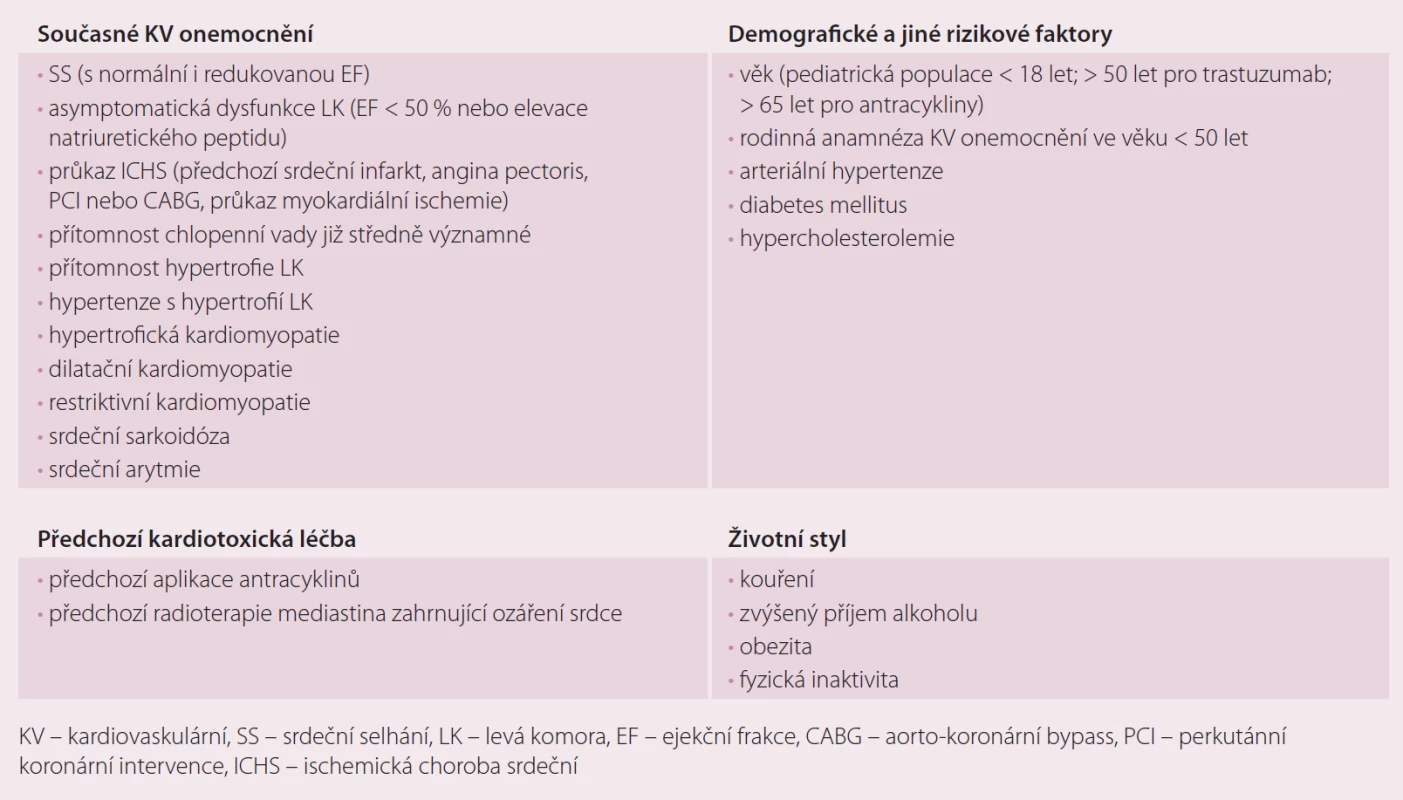
Chronické srdeční selhání
Srděční dysfunkce a vznik SS patří mezi nejzávažnější vedlejší následky onkologické léčby a nejčastěji se označují termínem kardiotoxicita. Konvenční cytostatika, jako jsou antracykliny, antimetabolity a cyklofosfamid, mohou vést k trvalému poškození myocytu s dalším vývojem dysfunkce LK a klinickým rozvojem CHSS. Antracykliny, běžně užívané v léčbě hematologických malignit i solidních tumorů u dětí i v dospělosti, jsou nejznámějším a snad nejvíce studovaným lékem spouštějícím významné a progredující SS LK. Riziko SS u doxorubicinu je závislé na kumutativní dávce (KD) a přítomnosti rizikových faktorů. Zvyšuje se s KD antracyklinu: 3 – 5 % při 400 mg/ m2, 7 – 26 % při 550 mg/ m2 a 18 – 48 % po podání KD 700 mg/ m2. Kumulativní incidence CHSS v průběhu 10 let od terapie antracykliny je popsána v 38 %, v 32,5 % u režimů bez antracyklinu, v 29 % bez cytostatik. Pravděpodobnost vzniku CHSS se během každých dalších 10 let zdvojnásobuje. Dlouhodobě přežívající pacienti léčení v dětském věku antracykliny a ozářením na mediastinum mají 15× vyšší riziko CHSS oproti kontrolám během dalšího života. U dospělých pacientů ve vyšším věku léčených pro maligní lymfom je v přítomnosti dalších rizikových faktorů incidence CHSS 17 % během 5 let po terapii (tab. 3).
Tab. 3. Výskyt CHSS u jednotlivých protinádorových farmak. 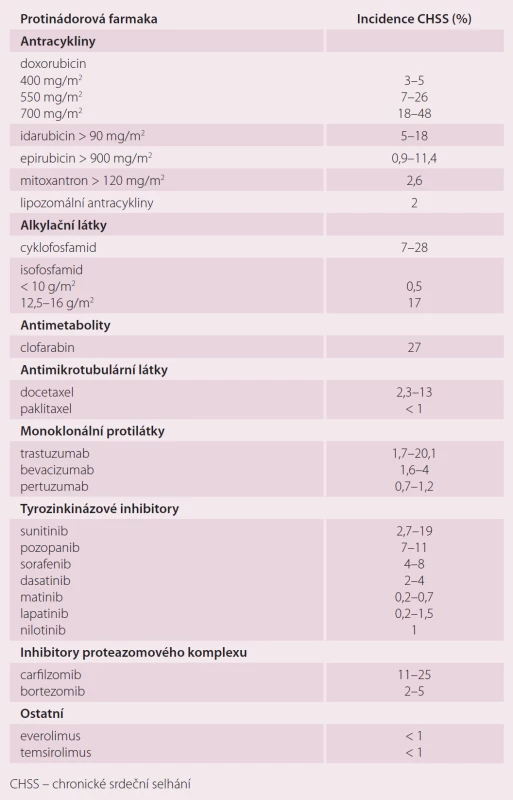
Ateroskleróza periferních a koronárních cév (HR 1,31 a 1,58), diabetes mellitus (HR 1,74), AH (HR 1,45), plicní emfyzém a chronická bronchitida (HR 1,68) reprezentují další přídatné rizikové faktory a prediktory vývoje CHSS. Riziko SS zůstává po podání antracyklinů zvýšené i při vyloučení starších nemocných s komorbiditami.
Vznik CHSS je popsán i po podání jiných tradičních protinádorových léků, jakými jsou cyklofosfamid (7 – 28 %) a docetaxel (2,3 – 13 %). Léky používané k cílené terapii vykazují kardiotoxický poteciál. Monoklonální protilátky a inhibitory tyrozinkinázy: blokátory receptoru 2 pro lidský epidermální růstový faktor (HER2) (trastuzumab, pertuzumab), blokátory receptoru pro vaskulární endoteliální růstový faktor (VEGF) (bevacizumab, sunitinib, sorafenib) a blokující aktivitu Abl kinázy (imatinib, nilotinib, dasatinib) mohou vést k rozvoji SS.
Nejintenzivněji je studován a monitorován trastuzumab užívaný v terapii karcinomu prsu u HER2 pozitivních pacientek. Na rozdíl od kardiotoxicity antracyklinů může být poškození funkce LK po trastuzumabu reverzibilní. Kardiotoxicita trastuzumabu je akcelerována rizikovými faktory: věk > 50 let, přítomnost AH nebo srdečního onemocnění, hodnota ejekční frakce LK před terapií 50 – 55 % nebo nižší, předchozí podání antracyklinů. Zavedení adjuvantní terapie trastuzumabem snížilo u časných stadií onemocnění rekurenci o 50 % a mortalitu o 33 %. Na druhé straně analýza pěti klinických studií poukázala na výskyt symptomatického SS v 0 – 3,9 %, tam kde byl lék přidán k tradiční terapii. Další dlouhodobá sledování neprokázala v průběhu 8 – 10 let zvýšení frekvence CHSS, naopak se zdá, že poškození může být reverzibilní. Současné klinické randomizované studie léčby časných klinických stadií karcinomu prsu zvažují duální blokádu HER2 receptoru pertuzumabem a trastuzumabem. Zatím se nezvažují speciální kardiologická opatření, pokud nebudou vyhodnoceny výsledky studií (adjuvantní studie Aphinity, neoadjuvantní Neosphere a Tryphaena). Předběžné výsledky neoadjuvantní studie Tryphaena naznačují nízký výskyt asymptomatické a symptomatické dysfunkce LK ve všech studovaných ramenech.
Srdeční dysfunkce byla popsána u inhibitorů angiogeneze bevacizumabu (1,6 – 4 %) a sunitinibu (2,7 – 19 %), inhibitoru receptoru VEGF sorafenibu (4 – 8 %), v menší míře i u ostatních preparátů. Vzhledem k tomu, že blokují řadu receptorů, je obtížné stanovit, přes který mediátor je spouštěna kardiotoxicita. Pravděpodobně se na dysfunkci myokardu podílí vyčerpání energetických zásob s periferní vazokonstrikcí vedoucí k neúměrnému zvýšení afterloadu.
Problémem v současnosti je stanovení reverzibility dysfunkce LK. Pro CHSS je nutný časový faktor, tedy vyhodnocení jen dlouhodobých prospektivních studií. Dále je nutné sjednotit definici kardiotoxicity. Tato nejednotnost ovlivňuje validitu dat metaanalýz. Poškození myocytu onkologickou léčbou připomíná omráčení (stunning) či hibernaci myokardu, jak je známe u ICHS. Je nutno znát přesně hranici mezi reverzibilitou a ireverzibilitou poškození, často je tato hranice stanovena jen arbitrárně. Pohled na dříve popsanou ireverzibilitu antracyklinové kardiomyopatie se mění s časnou diagnostikou myokardiální dysfunkce a její moderní léčbou [1,3].
Hypertenze
AH se řadí k nejčastějším komorbiditám u dospělých onkologických pacientů. Její výskyt po chemoterapii je popisován mezi 19 a 47 % onkologické populace. Tím dosahuje úrovně incidence v běžné populaci. Je samozřejmě otázkou, zda existuje kauzalita mezi oběma patologickými stavy, resp. s podáním specifické medikace. V každém případě je AH významným rizikovým faktorem kardiotoxicity onkologické léčby [4].
Nejvíce údajů máme k dispozici o výskytu AH při cílené biologické léčbě nádorů. Tato terapie významně zasahuje do angiogeneze. U takto léčených nemocných byl zaznamenán signifikantní nárůst AH s jejími komplikacemi. Mezi hlavní mechanizmy vzniku AH patří snížení produkce NO ve stěně arteriol, zvýšení hladiny endotelinu-1, porucha angiogeneze vede ke kapilární rarefakci vedoucí k redukci efektivního kapilárního řečiště. K těmto faktorům se přidává i toxická angiopatie v glomerulech, stres s aktivací renin-angiotenzin-aldosteronového systému (RAAS), retence tekutin, porucha metabolizmu kalcia apod. [5].
Výskyt AH při terapii bevacizumabem byl popsán ve 4 – 35 % případů, přičemž v 1,7 % se jednalo o AH III. – IV. stadia, kdy akcelerace onemocnění byla spjata s výskytem hypertenzní encefalopatie a krvácením do centrálního nervového systému (CNS) [6].
Terapie sorafenibem vede v 17 – 43 % případů k AH III. – IV. stadia u 1,4 – 38 % pacientů. Metaanalýza na 4 599 pacientech léčených sorafenibem prokázala incidenci hypertenze v 23,4 %, přičemž orgánové komplikace byly přítomny u 30,7 % takto léčených nemocných [7].
Podobně byla popsána incidence AH při léčbě sunitinibem u 5 – 24 % nemocných již v průběhu prvních 4 týdnů terapie. U 17 % se jednalo o stadium III [8].
AH v souvislosti s podáním biologické léčby je významně doprovázena akcelerací choroby do vyšších stadií s orgánovými komplikacemi. V roce 2016 byla provedena metaanalýza 72 randomizovaných studií z databází (EMBASE, PubMed, Cochrane library) zahrnující 30 013 nemocných, kterým byla aplikována terapie inhibitory tyrozinkinázy (blokátory receptoru pro endoteliální růstový faktor – VEGF) u různých nádorových onemocnění. Incidence AH v souvislosti s terapií bez ohledu na vývojové stadium byla 4,4 %, přičemž stadium III – IV bylo přítomno ve 23 %. Relativní riziko vzniku AH se lišilo v závislosti na druhu preparátu (patrně záleží na typu receptoru, který blokuje pro inhibici VEGF), typu tumoru, doprovodné medikaci a stadiu klinické studie [9].
V terapii AH indukované biologickou léčbou je zapotřebí více než jednoho antihypertenziva. Léky první linie jsou inhibitory ACE a sartany [6].
Arytmie
V průběhu aplikací léčebných režimů dochází k výskytu řady arytmií, které ani nemusí být diagnostikovány. Až u 60 % onkologických pacientů dochází k indukci síňových i komorových extrasystol, k paroxysmům fibrilace síní či supraventrikulárních tachykardií, k přechodným poruchám vedení vzruchu v průběhu léčby. Vznik arytmií může vedle účinku cytostatika podpořit porucha vnitřního prostředí, rozvrácení mineralogramu, anémie, doprovodné KV onemocnění, popřípadě jeho destabilizace. V dalším období se na výskytu arytmií podílí právě vývoj doprovedného KV onemocnění, věk pacienta, fibrotické změny dané věkem či radioterapií, amyloidóza srdce, případná tumorózní infiltrace srdce a pozdní změny v myokardu navozené chemoterapií.
Bradyarytmie
Významné bradyarytmie až AV blokáda III. stupně a zástava srdce byly popsány po dlouhodobém monitorování nemocných léčených taxany a thalidomidem.
Paklitaxel působí přímo na Purkyněho vlákna nebo zprostředkovaně přes autonomní nervový systém. Vede ke vzniku reverzibilních bradykardií u 0,1 – 31 % nemocných, kterým byl podán. Rizikoví jsou především kardiaci se strukturálním srdečním onemocněním a s konkomitantní bradykardizující medikací. Popsány jsou případy, které si vyžádaly implantaci kardiostimulátorů [6,10].
Thalidomid vede k síňovým arytmiím a významným bradykardiím v 5 – 55 % případů. Mechanizmus jeho účinku není zcela znám. Působí pravděpodobně centrálně sedativním efektem, aktivací vagové větve vegetativního nervového systému nebo cestou navození hypofunkce štítné žlázy. Tímto lékem je léčena řada pacientů s mnohočetným myelomem. Mnohdy se jedná o starší nemocné s další kardiologickou medikací. Pokud je thalidomid jedinou léčebnou alternativou, je nutno redukovat dávky doprovodné bradykardizující medikace, sledovat funkci štítné žlázy, popřípadě při vzniku symptomatických bradyarytmií implantovat kardiostimulátor [6,10].
Prodloužení QT intervalu
Prodloužení QT intervalu je spjato s rizikem výskytu maligních komorových arytmií a náhlé smrti. Asi u 16 – 36 % onkologických nemocných dochází v průběhu terapie k prodloužení QT intervalu ve srovnání se vstupní EKG křivkou. Nemusí se jednat jen o vlastní efekt léků, ale k tomuto nálezu mohou přispět doprovodná strukturální onemocnění srdce, kombinace doprovodné léčby, která sama mnohdy prodlužuje QT interval, poruchy vnitřního prostředí.
Mezi léky s největším potenciálem pro prodloužení QT intervalu patří vorinostat (3,5 – 6 % případů), arsenic trioxide (26 – 93 % případů) a inhibitory tyrozinkinázy (1 – 16 % případů). U nejačastěji užívaného dasatinibu (Sprycel) bylo prodloužení QT popsáno v 1 – 3 % případů. Korigovaný QT interval QTc ≤ 440 ms je považován za normální, prodloužený je u mužů > 450 ms a u žen > 470 ms. Nárůst QTc ≥ 60 ms ve srovnání s bazální klidovou EKG křivkou nebo nad hodnotu QTc 500 ms v souvislosti s podáním chemoterapie je považován za riziko vzniku maligní arytmie [6,10].
Fibrilace síní
Fibrilace síní (FS) je velmi častou arytmií s prevalencí v populaci 1 – 4 %, která se zvyšuje nad 13 % u osob nad 80 let věku. Arytmie je nejčastěji spjata s hypertenzí, ICHS, SS, chronickým renálním selháním, demencí, diabetes mellitus a onemocněním štítné žlázy. FS ohrožuje pacienta kardioembolizací, na prvním místě embolizací do CNS. Na základě kritérií CHA2DS2-VASc a HAS-BLED je jako prevence kardioembolizmu do managementu FS zavedena celoživotní antikoagulační terapie. Arytmie může být přítomna před diagnózou onkologického onemocnění, může vzniknout kdykoli v průběhu terapie. Nevyšší riziko vzniku je během prvních 90 dnů po stanovení diagnózy malignity. Některé studie ukázaly, že její vznik může předcházet diagnóze onkologického onemocnění. Z dánského registru vyplývá vyšší riziko asi 2,5% výskytu malignity během prvních 3 měsíců po vzniku arytmie. Většinou se jednalo již o metastatický proces. Autoři považují FS za možný marker okultní malignity a doporučují v diagnostickém programu pacienta s recentní FS provést i onkologický screening [11,12]. Vznik arytmie v období po onkologické terapii nemusí být překvapivý. Je ale velmi obtížné stanovit příčinnou souvislost. Vedle běžných rizikových faktorů v populaci je nutno myslet na rizikové faktory, které si s sebou pacient po onkologické léčbě bere do dalšího života: chronické změny na srdci po radioterapii mediastina, pozdní kardiotoxicita především antracyklinů, autonomní dysfunkce, stavy po operaci hrudníku pro malignitu. Je nutno myslet i na poruchu funkce štítné žlázy po radioterapii [13].
Plicní arteriální hypertenze
V letech 2008 – 2010 byl popsán výskyt prekapilární PAH u nemocných léčených pro chronickou myeloidní leukemii (CML) dasatinibem. PAH byla diagnostikována u 0,45 % nemocných ve francouzském registru, vyskytuje se 8 – 48 měsíců po podání léku. Mechanizmus vzniku není přesně znám, dasatinib vede k retenci tekutin a způsobuje mimo jiné i výskyt pleurálních výpotků. Vyšší výskyt byl popsán u žen. Běžné KV rizikové faktory nemají asociaci ke vzniku PAH. Zdá se, že po vysazení léku se mohou hemodynamické parametry upravovat, i když bylo popsáno i úmrtí na selhání pravého srdce při PAH. Problémem je přesná hemodynamická invazivní diagnostika PAH u hematoonkologických pacientů, běžně se používá nepřímé echokardiografické monitorování [14]. V roce 2015 byla zveřejněna metaanalýza 11 studií pacientů léčených dasatinibem a prokázala výskyt PAH v 0,2 % v době od 1 měsíce do 7 let od nasazení terapie. Po vysazení léků došlo u 94 % pacientů k výraznému zlepšení klinického stavu nebo i k vymizení PAH [15].
Ischemická choroba srdeční
Vznik ischemie myokardu s klinickým obrazem anginy pectoris, srdečního infarktu či arytmií byl popsán u některých léků a u radioterapie mediastina [3].
V řadě případů byly přítomny běžné rizikové faktory ICHS nebo v průběhu léčby podpořily klinickou manifestaci komplikace vycházející z lokality tumoru (mediastinální tumory, tumory srdce, metastázy tumoru či infiltrace, mikroembolizace do koronárních tepen apod.), dále poruchy vnitřního prostředí, hemokoagulace, mineralogramu apod.
Mechanizmus, jakým působí terapie na vznik ischemie, je různorodý: od indukce vazospazmů, aktivace prokoagulačního stavu přes poškození endotelu koronárních cév. Pro chronické následky hovoří poškození endoteliálních buněk, akcelerace rizikových faktorů (dyslipidemie) či fibrotické změny v myokardu. Klinická manifestace ICHS je popsána během terapie nebo jako pozdní následek léčby fluoropirimidiny, cisplatinou, cílenou biologickou léčbou a radioterapií na mediastinum [1 – 3]. Přehled je uveden v tab. 4.
Tab. 4. Onkologická léčba vedoucí k manifestaci ICHS. 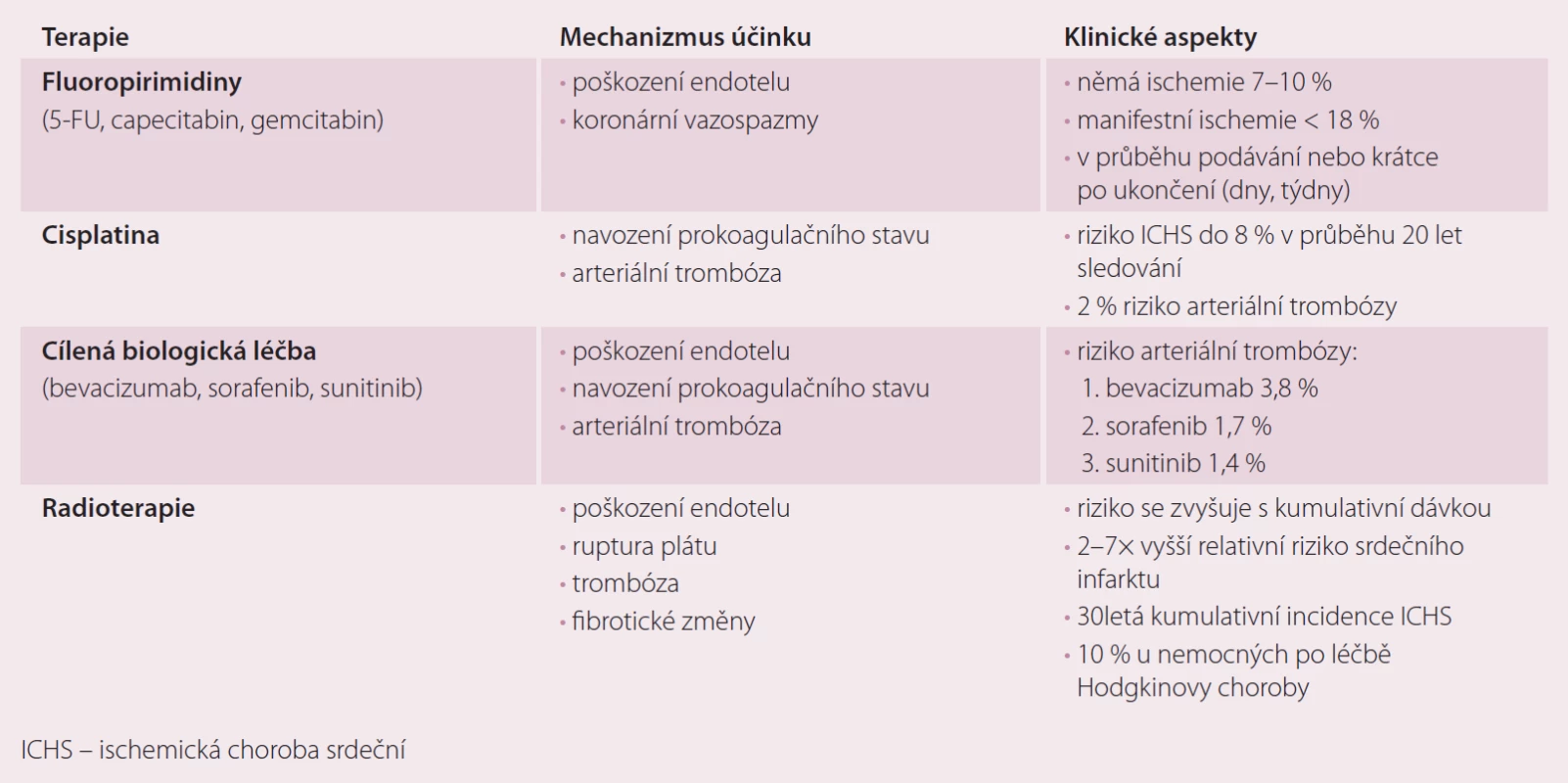
Radioterapie
Radioterapie je nedílnou součástí léčby řady nádorových onemocnění v kombinaci s farmakologickou léčbou. Tato léčba významně zlepšila prognózu nemocných s Hodgkinovou nemocí, maligními lymfomy a u žen s karcinomem prsu s pětiletým přežíváním 80 – 90 %. Tím ale došlo k odhalení pozdního poškození KV systému u nemocných ozařovaných na mediastinum, velké krční cévy či oblast abdominální aorty. Ve srovnání s neozařovanými onkologickými pacienty je po ozařování mediastina absolutní riziko poškození KV systému do 5 let po terapii asi o 2 % vyšší a o 23 % vyšší po 20 letech od ukončení terapie [2,16].
Srdeční myocyty jsou s ohledem na ukončenou mitotickou aktivitu relativně rezistentní vůči iradiaci, ale výrazně senzitivní jsou endoteliální buňky. K jejich poškození dochází nejen na základě oxidačního stresu indukovaného radioterapií, ale též současným působením konvenčních rizikových faktorů, jakými jsou kouření, dyslipidemie, diabetes mellitus apod. Dnes se obecně označuje poškození srdce radioterapií termínem RIHD (radiation-induced heart disease) a tvoří již samostatnou klinickou jednotku [2,16].
Rizikové faktory RIHD jsou shrnuty v tab. 5. Mezi konvenční rizikové faktory řadíme hypertenzi, diabetes mellits, kouření a dyslipidemii. Vysoce rizikový pacient pro RIHD je ten, u kterého je přítomen nejméně jeden z faktorů uvedených v tab. 5.
Tab. 5. Rizikové faktory pro poškození srdce radioterapií. 
Ischemická choroba srdeční
Studie u nemocných léčených pro Hodgkinovu nemoc a ozařovaných na mediastinum prokázaly v 10 % ICHS v období 20 let po terapii s mediánem diagnózy 9 let. U všech nemocných byl přítomen minimálně jeden konvenční rizikový faktor. Metaanalýzy studií pacientek léčených pro karcinom prsu ukazují na vyšší výskyt KV úmrtí u ozařovaných žen, na vyšší riziko manifestace ICHS v závislosti na celkové dávce ozáření a době od ukončení terapie. Nárůst relativního rizika ICHS je 7,4 %/ 1 Gy bez zjevného stropu.
Distribuce aterosklerotických změn koreluje s expozicí vůči iradiaci. Klinická manifestace a léčba ICHS se neliší od běžné populace. Výsledky intervenčních studií prokázaly větší náročnost revaskuralizačních zákroků po ozařování především v důsledku fibrotických změn, poškození některých arterií užívaných k revaskularizaci (art mammaria interna apod.) a poškození plic. Až u 40 % pacientů bylo nutno při chirurgické revaskularizaci provádět i zákroky na poškozeném chlopenním aparátu. Jen jedna studie prokázala vyšší krátkodobou i dlouhodobou mortalitu u pacientů s RIHD po kardiochirurgickém zákroku ve srovnání s normální populací [2,16].
Poškození chlopní
Téměř u 81 % nemocných s RIHD dochází k poškození chlopenních aparátů. Projevuje se změnou tvaru, fibrotickým ztluštěním a v pozdní fázi dochází k předčasné kalcifikaci. Nejdříve se vyvíjí nedomykavost chlopně a v poslední fázi, asi po 20 letech od ozáření, obraz stenoinsuficience. Postiženy jsou především chlopně levého srdce. Dysfunkce chlopně nebývá klinicky významná, až 70 % pacientů je asymptomatických. Radioterapie zvyšuje riziko vzniku chlopenní vady 7×. U 30 % pacientů má po ozáření poškození chlopně jasně progredující charakter. Střední doba vzniku chlopenní vady po ukončeném ozařování je uváděna 11,5 let a do vzniku symptomů 16,5 let. Vznik fibrotických změn a ztluštění mezi kořenem aorty a předním mitrálním cípem je považován za nezávislý rizikový faktor náhlých úmrtí u RIHD. Kardiochirurgická léčba je u nemocných po ozařování mediastina doprovázena vyšší dlouhodobou mortalitou, a to 45 % po operaci jedné chlopně a 61 % u dvou chlopní ve srovnání s 13 a 17 % u nemocných bez ozáření. Určitou nadějí jsou katetrizační náhrady nyní používané u aortální chlopně (TAVI) [2,16].
Poškození perikardu
Poškození perikardu je velmi častým následkem ozařování s velkým klinickým spektrem: akutní perikarditida, perikardiální výpotky, tamponáda, konstriktivní perikarditida. Sekční nálezy prokázaly u 70 – 90 % onkologických nemocných po radioterapii různá poškození perikardu.
Pozdní následky jsou charakterizovány přítomností různého množství perikardiálního výpotku, který bývá většinou asymptomatický. Tyto nálezy monitorujeme běžnými metodami, nejčastěji echokardiografií. Většinou se výpotky resorbují do 2 let, ale v řadě případů dlouhodobě perzistují. Perikardiocentéza se provádí u symptomatických jedinců, někdy i jen při echokardiografickém nálezu hemodynamické významnosti. Závažnou komplikací je konstriktivní perikarditida vedoucí k SS. Je popsána až ve 20 % případů po ozařování s časovým mediánem 11 let po terapii. Stripping perikardu je velmi riziková metoda s ohledem na globální změny po radiaci. Ve studii se 163 pacienty bylo po strippingu perikardu jen 27 % přežití v dalším průběhu 7 let. Převažuje příklon ke konzervativní terapii [2,16].
Poškození myokardu
Poškození mikrovaskulární cirkulace radiací vede k chronické ischemii, tím k myokardiální fibróze a následně k poruše diastolické a systolické funkce levé komory. Vzniká obraz dilatační nebo restriktivní kardiomyopatie. V dřívějších dobách byly tyto změny popisovány až u 50 % pacientů. Riziko narůstá již po 5 letech po ozáření. V současné době při znalosti rizikových faktorů a jiné technice a metodice ozařování klesá výskyt kardiomyopatií pod 5 %. Většinou se dnes pozoruje porucha diastolické funkce LK, a to asi u 14 % nemocných ozařovaných pro Hodgkinovu nemoc. Léčba se neliší od jiných forem kardiomyopatií [2,16].
Arytmie
Mezi nejčastější arytmie po ozáření myokardu patří poruchy atrioventrikulárního vedení, raménkové blokády, sick sinus syndrom. Dalším nálezem je prodloužení QTc intervalu popsané až u 12,5 % pacientů po ozáření. Poruchy vedení a abnormit ST segmentu byly popsány již po 6 měsících od ukončené radioterapie, po 10 letech převažoval nález ST depresí [2,16].
Není jednoduché stanovit vztah mezi radioterapií a pozdním výskytem arytmií. Existují některá kritéria, která tuto asociaci podporují v případě atrioventrikulárních blokád:
- celková dávka ozáření zasahující myokard > 40 Gy,
- doba po ozáření > 10 let,
- předchozí poškození perikardu,
- výskyt raménkové blokády,
- vztah ke kardiálním či mediastinálním lézím.
Metabolický syndrom
MS je soubor rizikových faktorů, které se často vyskytují společně a vznikají velmi pravděpodobně na podkladě inzulinové rezistence. Jeho přítomnost je spjata s 2 – 3násobným rizikem vzniku ICHS ve srovnání s normální populací. Základními komponenty syndromu jsou nadváha, hypertenze, snížená inzulinová senzitivita a porucha lipidogramu. Rozvoj MS způsobuje zvýšený výskyt ICHS u nemocných léčených pro karcinom prostaty, kteří mají androgen-deprivační terapii, u nemocných po léčbě testikulárního karcinomu (TC) a u pediatrických malignit.
Nemocní léčeni pro TC cisplatinovými preparáty mají vyšší prevalenci MS oproti běžné mužské populaci s vývojem 3 – 5 let po terapii a MS je spojen s poklesem hladiny testosteronu. Dětští pacienti léčeni pro hematologické malignity nebo mozkové tumory radioterapií jsou ohroženi MS v důsledku hormonální dysfunkce po ozáření (mozek, štítná žláza, gonády). U pacientů léčených pro karcinom prostaty se může vyvíjet nadváha, porucha lipidogramu a porucha inzulinové senzitivity časně během 3 – 6 měsíců po zahájení antiandrogenní terapie. V poslední době byl popsán vyšší výskyt některých komponent MS, jako je nadváha a změny v lipidogramu u pacientek léčených pro karcinom prsu. Tyto změny souvisejí se zavedenou hormonální terapií a se vznikem předčasné menopauzy pro adnexektomii.
V poslední řadě je nutno zmínit jako významný faktor pro vývoj MS vedle onkologické terapie i kvalitu života a životní styl po prodělané terapii. Nesmíme zapomenout na vznik AH, kterou indukují některé protinádorové léky, aniž by samy ovlivnily metabolickou složku a jsou významným kofaktorem vzniku MS [17].
Závěr
V průběhu posledních 10 let vidíme řadu iniciativ vedoucích k řešení problému pozdní kardiotoxicity onkologické léčby. Onkologické a kardiologické společnosti (European Society for Medical Oncology, American College of Cardiology, ASCO, European Society of Cardiology, Canadian Cardiovascular Society) uznaly, že se jedná o společný zájem a vznikl obor kardio-onkologie, byly položeny základy k praktickým guidelines, která by měla sjednotit dosti roztříštěný pohled na tuto problematiku. Klinickovědní disciplína kardio-onkologie vznikla za účelem optimalizace péče o pacienty s nádorovým onemocněním, kteří podstupují terapii nebo jsou v období života po úspěšné léčbě.
Ačkoli již tyto aktivity sklízejí první ovoce, zůstává řada nevyřešených problémů a nezodpovězených otázek: Jsme opravdu schopni predikovat rozvoj pozdní kardiotoxicity? Jaká je nejlepší prevence? Jak máme monitorovat pacienty s vysokým rizikem vzniku pozdní kardiotoxicity? Která ze současných strategií je nejlepší?
Zodpovězení těchto dotazů je urgentní s ohledem na nárůst výskytu nádorových onenocnění v populaci a na narůstající počet osob, které mají v anamnéze prodělanou onkologickou léčbu.
Doručeno do redakce: 11. 2. 2017
Přijato po recenzi: 23. 2. 2017
prof. MU Dr. Lubomír Elbl, CSc.
www.kardiolesna.cz
lelbl@seznam.cz
Zdroje
1. Curigliano G, Cardinale D, Dent S et al. Cardiotoxicity of anticancer treatments: epidemiology, detection, and management. Cancer J Clin 2016; 66(4): 309 – 325. doi: 10.3322/ caac.21341.
2. Cuomo JR, Sharma GK, Conger PD et al. Novel concepts in radiation-induced cardiovascular disease. World J Cardiol 2016; 8(9): 504 – 519.
3. Zamorano JL, Lancellotti P, Rodriguez Muñoz D et al. 2016 ESC Position Paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines. Eur Heart J 2016; 37(36): 2768 – 2801. doi: 10.1002/ ejhf.654.
4. Albini A, Pennesi G, Donatelli F et al. Cardiotoxicity of anticancer drugs: the need for cardio-oncology and cardio-oncological prevention. J Natl Cancer Inst 2010; 102(1): 14 – 25. doi: 10.1093/ jnci/ djp440.
5. Jain M, Townsend RR. Chemotherapy agents and hypertension: a focus on angiogenesis blockade. Curr Hypertens Rep 2007; 9(4): 320 – 328.
6. Yeh ET, Bickford CL. Cardiovascular complications of cancer therapy. J Am Coll Cardiol 2009; 53(24): 2231 – 2247. doi: 10.1016/ j.jacc.2009.02.050.
7. Wu S, Chen JJ, Kudelka A et al. Incidence and risk of hypertension with sorafenib in patients with cancer: a systematic review and meta-analysis. Lancet Oncol 2008; 9(2): 117 – 123. doi: 10.1016/ S1470-2045(08)70003-2.
8. Chu TF, Rupnick MA, Kerkela R et al. Cardiotoxicity associated with thyrosin kinase inhibitor sunitinib. Lancet 2007; 370(9604): 2011 – 2019.
9. Liu B, Ding F, Liu Y et al. Incidence and risk of hypertension associated with vascular endothelial growth factor receptor tyrosine kinase inhibitors in cancer patients: a comprehensive network meta-analysis of 72 randomized controlled trials involving 30,013 patients. Oncotarget 2016; 7(41): 67661 – 67673. doi: 10.18632/ oncotarget.11813.
10. Bovelli D, Plataniotis G, Roila F. Cardiotoxicity of chemotherapeutic agents and radiotherapy-related heart disease: ESMO Clinical Practice Guidelines. Ann Oncol 2010; 21 (Suppl 5): 277 – 282. doi: 10.1093/ annonc/ mdq200.
11. Conen D, Wong JA, Sandhu RK et al. Risk of malignant cancer among women with new-onset atrial fibrillation. JAMA Cardiol 2016; 1(4): 389 – 396. doi: 10.1001/ jamacardio.2016.0280.
12. Ostenfeld EB, Erichsen R, Pedersen L et al. Atrial fibrillation as a marker of occult cancer. PLoS One 2014; 9(8): e102861. doi: 10.1371/ journal.pone.0102861.
13. Ferreira C, Providência R, Ferreira MJ et al. Atrial fibrillation and non-cardiovascular diseases: a systematic review. Arq Bras Cardiol 2015; 105(5): 519 – 526. doi: 10.5935/ abc.20150142.
14. Montani D, Bergot E, Gunther S et al. Pulmonary arterial hypertension in patients treated by dasatinib. Circulation 2012; 125(17): 2128 – 2137. doi: 10.1161/ CIRCULATIONAHA.111.079921.
15. Shah NP, Wallis N, Farber HW et al. Clinical features of pulmonary arterial hypertension in patients receiving dasatinib. Am J Hematol 2015; 90(11): 1060 – 1064. doi: 10.1002/ ajh.24174.
16. Madan R, Benson R, Sharma DN et al. Radiation induced heart disease: Pathogenesis, management and review literature. J Egypt Natl Canc Inst 2015; 27(4): 187 – 193. doi: 10.1016/ j.jnci.2015.07.005.
17. Aleman BM, Moser EC, Nuver J et al. Cardiovascular disease after cancer therapy. EJC Suppl 2014; 12(1): 18 – 28. doi: 10.1016/ j.ejcsup.2014.03.002.
Štítky
Detská kardiológia Interné lekárstvo Kardiochirurgia Kardiológia
Článok vyšiel v časopiseKardiologická revue – Interní medicína
Najčítanejšie tento týždeň
2017 Číslo 1- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Intermitentní hladovění v prevenci a léčbě chorob
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Kardiotoxicita protinádorových léčiv v experimentu
- Problematika kardiotoxicity primární léčby pacientek s karcinomem ovaria
- Pozdní následky kardiotoxicity
- Kardiotoxicita – současná doporučení
- Kardiotoxicita u hematoonkologických pacientov
- Rivaroxaban – farmakologický profil
- Edoxaban – farmakologický profil
- Diuretika a antagonisté mineralokortikoidních receptorů v terapii chronického srdečního selhání se sníženou ejekční frakcí levé komory
- Moderní antitrombotická léčba po AKS – využíváme ji dostatečně?
- COSYREL – lék pro pacienty s ischemickou chorobou srdeční a srdečním selháním
- Betablokátory v registru chronického srdečního selhání FAR NHL
- Kardiotoxicita – základní pojmy a mechanizmy
- Manuál ambulantního specialisty-kardiologa
- Kardiologická revue – Interní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Diuretika a antagonisté mineralokortikoidních receptorů v terapii chronického srdečního selhání se sníženou ejekční frakcí levé komory
- COSYREL – lék pro pacienty s ischemickou chorobou srdeční a srdečním selháním
- Rivaroxaban – farmakologický profil
- Pozdní následky kardiotoxicity
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



