-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Monoklonální gamapatie nejasného významu s nízkým a vysokým stupněm rizika: výstupy z analýz RMG registru České myelomové skupiny pro praxi.
Monoclonal gammopathy of undetermined significance with low and high risk degree: outputs from analyses RMG of register of Czech myeloma group for practice
Aim:
The primary end point was to estimate the cumulative risk of hematologic disorders occurring during the follow-up of our cohort. The secondary end points were: to validate known clinical models suggested by the Mayo Clinic group and the Spanish PETHEMA group for the risk of progression from MGUS to MM or related malignancies and to establish a new risk model by the Czech Myeloma Group (CMG model) with better prediction of low-risk MGUS group.Results:
1887 MGUS persons were followed with median 4 years. Malignancies developed in 8.6 % (162/1887) cases; MM occurred in 77.2 % (125/162) of persons. The risk of progression was 1.5 % at 1 year, 7.6 % at 5 years and 16.5 % at 10 years after diagnosis. The key predictors factors of progression were as follows: age ≥ 69 years, serum M - protein concentration ≥ 15 g/L, bone marrow plasma cells > 5 %, pathological sFLC ratio (< 0.26 or >1.65), immunoparesis of polyclonal immunoglobulins and levels of serum hemoglobin at baseline < 120 g/L . Distribution of MGUS persons according to risk groups based on the Mayo Clinic model confirmed predictive power of Mayo Clinic model based on our data although isotype of M - protein was not found as independent predictor. At 10 years, no-risk group had 4.9 % risk of progression compared to 16.3 %, 24.6 %, and 54.9 % in groups with 1, 2 or 3 risk factors, respectively (p< 0.001). Immunoparesis instead of DNA aneuploidy was used together with the presence of abnormal plasma cells (aPCs) to validate the modified PETHEMA model. The rates of progression at 2 years were 1.6 %, 8.1 % and 28.0 % for groups with neither, one or both risk factors, respectively (p< 0.001). Based on the 5 parameters with independent predictive value in the univariate analysis we proposed a new CMG model. At 10 years, risk group with 4-5 risk factors had 1.6 %, 16.9 %, 22.9 %, 39.4 % and 52.3 %, retrospectively (p< 0.001).Conclusion:
In the large cohort of MGUS persons, we confirmed validity of previously considered clinical models for the risk of progression from MGUS to MM by the Mayo Clinic group and the Spanish PETHEMA group (model used for SMM). New CMG model for the risk of progression from MGUS to MM or related malignancies was established with an advantage for better identification of MGUS persons at low risk (87 % of persons with risk of progression below 10 % in 5 years) as well as few persons at the highest risk of progression.Keywords:
multiple myeloma, monoclonal gammopathy of undetermined significance, risk factors.
Autoři: V. Sandecká 1; R. Hájek 2; Z. Adam 1; I. Špička 3; V. Ščudla 4; E. Gregora 5; J. Radocha 6; L. Walterová 7; P. Kessler 8; D. Adamová 9; K. Valentová 10; I. Vonke 11; L. Ulmanová 12; D. Starostka 13; M. Wróbel 14; L. Brožová 15; Jiří Jarkovský 15
; A. Mikulášová 16; L. Říhová 17; M. Almaši 17
; S. Ševčíková 16; M. Krejčí 1; J. Straub 3; J. Minařík 4; P. Pavlíček 5; L. Pour 1; P. Všianská 17; S. Okutabe 16; M. Penka 17; V. Maisnar 6*
Působiště autorů: Interní hematologická a onkologická klinika FN Brno 1; Klinika hematoonkologie, FN Ostrava 2; I. Interní klinika - klinika hematologie, VFN Praha 3; Hemato-onkologická klinika, FN Olomouc 4; Interní hematologická klinika, FN Královské Vinohrady Praha 5; IV. interní hematologická klinika, FN Hradec Králové 6; Oddělení klinické hematologie, Krajská nemocnice Liberec 7; Oddělení hematologie a transfuziologie, Nemocnice Pelhřimov 8; Hematologicko-transfúzní oddělení, Slezská nemocnice v Opavě 9; Oddělení klinické hematologie, Thomayerova nemocnice Praha 10; Oddělení klinické hematologie, Nemocnice České Budějovice 11; Hematologicko-transfúzní oddělení, Klaudiánova nemocnice Mladá Boleslav 12; Oddělení klinické hematologie, Nemocnice s poliklinikou Havířov 13; Oddělení klinické hematologie komlexního onkologického centra Nový Jičín 14; Institut biostatistiky a analýz, Masarykova univerzita Brno 15; Babak Myeloma Group, Katedra patologické fyziologie, Masarykova Univerzita Brno 16; Oddělení klinické hematologie, FN Brno 17
Vyšlo v časopise: Klin. Biochem. Metab., 23 (44), 2015, No. 2, p. 53-59
* v zastoupení České myelomové skupiny
Souhrn
Cíl studie:
Primárním cílem bylo stanovení rizika progrese do nádorového onemocnění. Sekundárním cílem byla validace již známých klinických modelů transformace MGUS do MM popsaných Mayo klinikou a Španělskou studijní PETHEMA skupinou a vytvoření vlastního rizikového CMG modelu s pokud možno lepší identifikací nízce rizikové skupiny osob s MGUS.Typ studie:
Observační retrospektivní studiePracoviště:
Interní hematologická a onkologická klinika FN BrnoVýsledky:
Medián doby sledování MGUS pacientů byl 4 roky. Transformace do maligního onemocnění byla pozorována u 8,6 % (162/1887) sledovaných osob s MGUS; mnohočetný myelom se vyskytl v 77,2 % (125/162) případech. Při 1, 5 a 10letém sledování od stanovení diagnózy bylo riziko progrese pro osoby s MGUS bez ohledu na rizikové faktory 1,5 %, 7,6 % a 16,5 % jednotlivě. Jako klíčové faktory predikce maligní transformace byly identifikovány: věk ≥ 69 let, koncentrace M-proteinu v séru ≥ 15 g/l , infiltrace kostní dřeně plazmocyty > 5 %, patologický FLC poměr, imunoparéza a hodnota hemoglobinu < 120 g/l. Lze konstatovat, že i na našem souboru osob s MGUS byla potvrzena síla modelu Mayo kliniky, i když podtyp M-proteinu nebyl prokázán jako nezávislý prognostický faktor maligní transformace. Při 10letém sledování, skupina osob s MGUS bez rizikového faktoru (referenční skupina) měla 4,9 % risk progrese v maligní onemocnění, ve srovnání s 16,3 %, 24,6 %, a 54,9 % rizikem v skupinách s 1, 2 nebo 3 rizikovými faktory, jednotlivě (p< 0,001). K validaci PETHEMA modelu jsme využili místo vyšetření DNA aneuploidie imunoparézu v kombinaci s vyšetřením přítomnosti aberantních plazmocytů (aPCs) pomocí flowcytometrie. Poměr progrese při 2letém sledování byl 1,6 %, 8,1 % a 28,0 % pro skupinu se žádným, jedním nebo oběma rizikovými faktory, jednotlivě (p< 0,001). Na základě univariantní analýzy, ve které pět faktorů prokázalo signifikantní prediktivní hodnotu maligní transformace jsme vytvořili nový rizikově-stratifikační - CMG model. Riziko progrese pro MGUS skupinu se 4-5 rizikovými faktory při 10letém sledování činilo 1,6 %, 16,9 %, 22,9 %, 39,4 % a 52,3 %, jednotlivě (p< 0,001).Závěr:
Lze konstatovat, že na jednom z dosud největších sledovaných souborů osob s MGUS jsme potvrdili platnost již známých klinických modelů určujících riziko maligní transformace, které byly popsány Mayo klinikou a Španělskou studijní skupinou. Nový CMG model přinesl jasnou identifikaci nízce rizikové MGUS skupiny (87 % osob s rizikem progrese 10 % při 5letém sledování) a rovněž i vysoce-rizikové skupiny s omezeným počtem pacientů.Klíčová slova:
mnohočetný myelom, monoklonální gamapatie nejasného významu, rizikové faktory.Úvod
Termín monoklonální gamapatie nejasného významu (MGUS) je definován na základě přítomnosti monoklonálního proteinu (M-proteinu), který lze detegovat v séru nebo v moči pacienta a současně nejsou splněna diagnostická kritéria mnohočetného myelomu (MM), Waldenströmovy makroglobulinémie (WM), primární AL-amyloidózy (AL) či jiného maligního lymfoproliferativního onemocnění [1]. Diagnóza MGUS je stanovena „per exclusionem“, to znamená, na základě splnění všech laboratorních kritérií a po vyloučení jiné monoklonální gamapatie, případně jiného zhoubného B-lymfoproliferativního onemocnění. Pro stanovení diagnózy MGUS platí kritéria dle International Myeloma Working Group z roku 2003. Hodnota sérového M-proteinu pod 30 g/l, infiltrace kostní dřeně klonálními plazmocyty pod 10 % a nepřítomnost orgánového postižení - CRAB [2]. Riziko progrese MGUS do MM nebo jiného lymfoproliferativního onemocnění je asi 1 % za rok (0,9 - 2,4 %). Riziko nádorové transformace se zvyšuje s délkou sledování [3]. V současné době existují dva klinické modely predikující progresi MGUS do MM. Jde o Mayo model využívající hodnotu a typ sérového M-proteinu a poměr volných lehkých řetězců v séru (sFLC poměr). Kumulativní risk maligní transformace při přítomnosti 0, 1, 2, 3 rizikových faktorů při 20letém sledování osob s MGUS byl 5 %, 21 %, 37 % a 58 %, jednotlivě [3]. Na druhé straně je model španělské studijní skupiny PETHEMA založený na množství aberantních plazmocytů v kostní dřeni (aPCs/BMPC) ≥ 95 % a DNA aneuploidii. Kumilativní risk maligní transformace při přítomnosti 0, 1 a 2, rizikových faktorů byl při 5letém sledování osob s MGUS 2 %, 10 % a 46 %, jednotlivě [4].
Pacienti a metody
V době od 5/2007 do 6/2013 bylo v České republice do Registru monoklonálních gamapatií (RMG) retrospektivně i prospektivně zařazeno 2028 osob s MGUS. Z nich bylo celkem analyzováno 93 % (1887/2028). Z analýzy bylo vyřazeno 4,7 % (95/2028) osob, u kterých neproběhla validace dat a 2,2 % (46/2028) osob s chybějícími klíčovými daty.
Výsledky
Základní charakteristiky 1887 osob s MGUS shrnuje Tabulka 1. Medián doby sledování od stanovení diagnózy byl 4 roky (rozpětí 0,0 – 34,8). Průměrný věk sledovaných osob byl 63 let (rozpětí 22 - 93). Hodnota M-proteinu v séru kolísala od neměřitelných hodnot po 35,9 g/l (medián 5,8 g/l). V čase diagnózy byla pouze u 12,4 % (230/1856) osob hodnota M-proteinu ≥ 15 g/l. Nejčastějším podtypem M-proteinu byl IgG, který se vyskytl v 69,6 % (1307/1879) případů. FLC poměr byl stanoven u 80,2 % (1513/1887) osob, abnormální hodnota (ĸ/λ poměr < 0,26 nebo >1,65) byl detegován u 43,4 % (657/1513) sledovaných osob. Hodnoty polyklonálních imunoglobulinů byly vyšetřeny u 87,3 % (1648/1887) osob, přičemž imunoparéza (snížení polyklonálních imunoglobulinů v séru: IgA < 0,61 g/l, IgG < 7,67 g/l, IgM < 0,5 g/l) bylo detegováno u 25,2 % (416/1648) sledovaných osob s MGUS.
Tab. 1. Clinical characteristics of MGUS patients at diagnosis 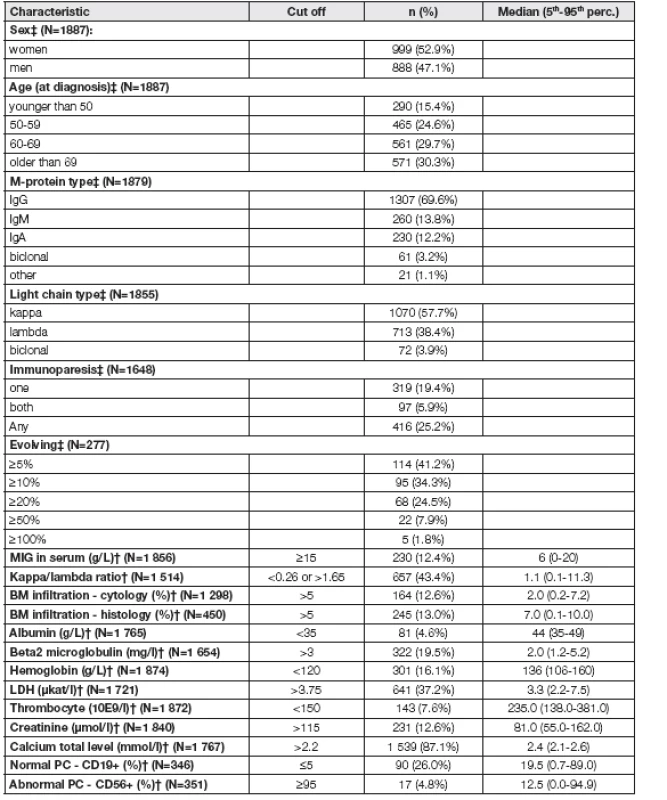
‡ described by n (%) from valid N † described by n (%) for abnormal category from valid N and median (5th-95th percentile) Immunoparesis: IgA < 0.61 g/l, IgG < 7.67 g/l, IgM < 0.5 g/l; Evolving: % increase of M-protein at 3 years in comparison with diagnosis (only patients with MIG in serum > 5 g/L included) K transformaci do maligního onemocnění došlo u 8,6 % (162/1887) sledovaných osob s MGUS. Nejčastějším typem nádorového onemocnění byl MM, který se vyskytl v 77,2 % (125/162) případech. Podrobný přehled malignit zaznamenaných v námi sledovaném souboru zobrazuje Celkové riziko progrese bylo 1,6 % za rok. Při 1, 2, 3 a 5letém sledování od stanovení diagnózy činilo riziko progrese pro osoby s MGUS bez ohledu na rizikové faktory 1,5 %, 2,8 %, 7,6 % a 16,5 %, jednotlivě. Klíčové faktory predikce maligní transformace s příslušným „hazard ratio“ (HR) byly: věk ≥ 69 let (HR 2,55 [95 % CI: 1,49 – 4,97]; p< 0,001), koncentrace M-proteinu v séru ≥ 15 g/l (HR 3,58 [95 % CI: 2,58 – 4,97]; p< 0,001), infiltrace kostní dřeně plazmocyty > 5 % (BMPC) (HR 3,24 [95 % CI: 2,19 – 4,80]; p< 0,001), patologický FLC poměr (HR 3,26 [95 % CI: 2,09 – 5,08]; p< 0,001), imunoparéza (HR 2,78 [95 % CI: 1,99 – 3,90]; p< 0,001) a hodnota hemoglobinu < 120 g/l (HR 2,00 [95 % CI: 1,38 – 2,91]; p<0,001), viz Tabulka 2. Dobu do progrese pro jednotlivé rizikové faktory zobrazuje Obr. 2.
Figure 1: (A) Type of progression (B) Time to progression 
Figure 2. Time to progression according to risk factors: age at diagnosis (A), MIG in serum (g/L) (B), sFLC (C), hemoglobin (g/L) (D), bone marrow infiltration - cytology (%) (E), immunoparesis (F) 
Dalším klíčovým bodem naší analýzy bylo ověření platnosti již známých klinických modelů predikce maligní transformace dle Mayo a PETHEMA modelu. Distribuci MGUS osob do rizikových skupin podle Mayo klinického modelu zobrazuje tabulka 3. Lze konstatovat, že i na našem souboru osob s MGUS byla potvrzena síla modelu Mayo kliniky, i když podtyp M-proteinu nebyl prokázán jako nezávislý prognostický faktor maligní transformace. Při 10letém sledování měla skupina osob s MGUS bez rizikového faktoru (referenční skupina) 4,9 % riziko maligní transformace při srovnání s 16,3 %, 24,6 %, a 54,9 % rizikem ve skupinách s 1, 2 nebo 3 rizikovými faktory, jednotlivě (p< 0,001). MGUS skupiny osob s 1, 2 a 3 rizikovými faktory měly při srovnání s referenční skupinou bez žádného rizikového faktoru hazard ratio (HR) 2,59 ([95 % CI: 1,39 - 4,84]; p= 0,003), 4,79 ([95 % CI: 2,56-8,93]; p< 0,001) a 12,97 ([95 % CI: 5,52-30,48];p< 0,001), jednotlivě. K validaci PETHEMA modelu jsme využili místo vyšetření DNA aneuploidie imunoparézu v kombinaci s vyšetřením přítomnosti aberantních PCs pomocí průtokové cytometrie. Poměr maligní progrese při 2letém sledování byl 1,6 %, 8,1 % a 28,0 % pro skupiny se žádným, jedním nebo oběma rizikovými faktory, jednotlivě (p< 0,001). MGUS skupiny s jedním a dvěma rizikovými faktory ve srovnání s referenční skupinou bez žádných rizikových faktorů měly HR 3,98 ([95 % CI: 1,60-9,91]; p= 0,003) a 14,23 ([95 % CI: 2,86-70,76]; p< 0,001), jednotlivě (viz Tabulka 3).
Tab. 2. Univariate Cox proportional hazards model of progression into MM or related disorders for all risk factors 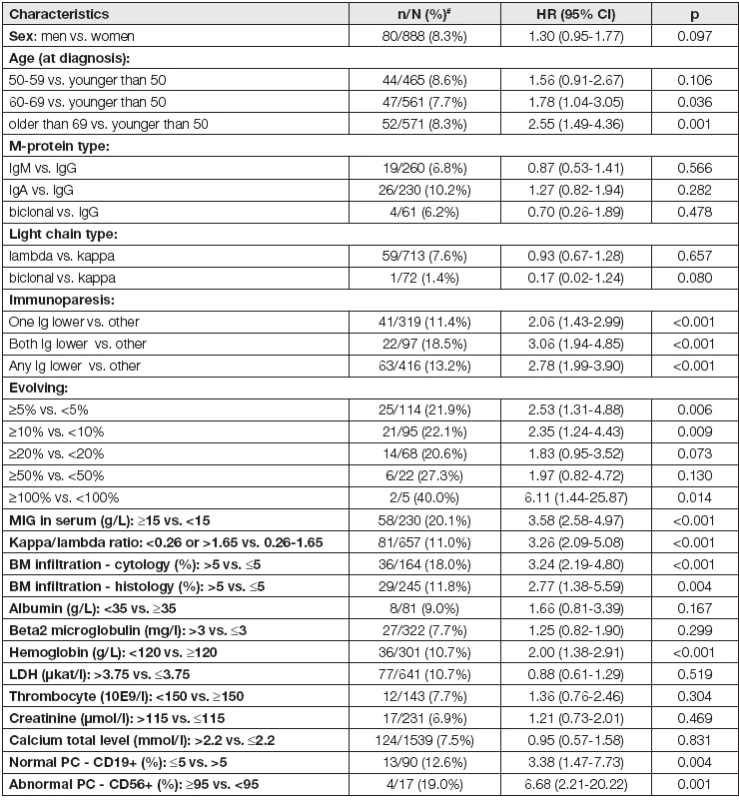
# n/N (%) of progression for the non-reference category Immunoparesis: IgA < 0.61 g/l, IgG < 7.67 g/l, IgM < 0.5 g/l; Evolving: % increase of M-protein at 3 years in comparison with diagnosis (only patients with MIG in serum> 5 g/L included) Na základě univariantní analýzy, ve které pět faktorů prokázálo signifikantní prediktivní hodnotu maligní transformace (imunoparéza, kvantita M-proteinu v séru ≥ 15 g/l, BMPC > 5 %, patologický FLC poměr a hodnota hemoglobinu < 120 g/l) jsme vytvořili nový rizikově-stratifikační CMG model. Z celkového počtu 956 osob s MGUS, které byly zahrnuty do této analýzy, 32,5 % (311/956) tvořily osoby s nejnižším rizikem (referenční skupina), 32,1 % (307/956) s jedním rizikovým faktorem, 22,0 % (210/956) se dvěma rizikovými faktory, 9,7 % (93/956) se třemi rizikovými faktory a 3,7 % (35/956) osoby se 4-5 rizikovými faktory. Progrese do maligního onemocnění byla pozorována v 0,6 %, 6,8 %, 11,9 %, 14 % a 31,4 % u osob s 1, 2, 3 resp. 4-5 rizikovými faktory, jednotlivě (p< 0,001). Skupina osob se 4-5 rizikovými faktory měla HR 63krát vyšší [95 % CI:(13,99 – 285,36); p< 0,001] při srovnání s referenční MGUS skupinou. Riziko progrese pro MGUS skupinu se 4-5 rizikovými faktory bylo při 10letém sledování 1,6 %, 16,9 %, 22,9 %, 39,4 % a 52,3 %, jednotlivě (p< 0,001) (Tabulka 3).
Tab. 3. Current clinical risk models and their comparison 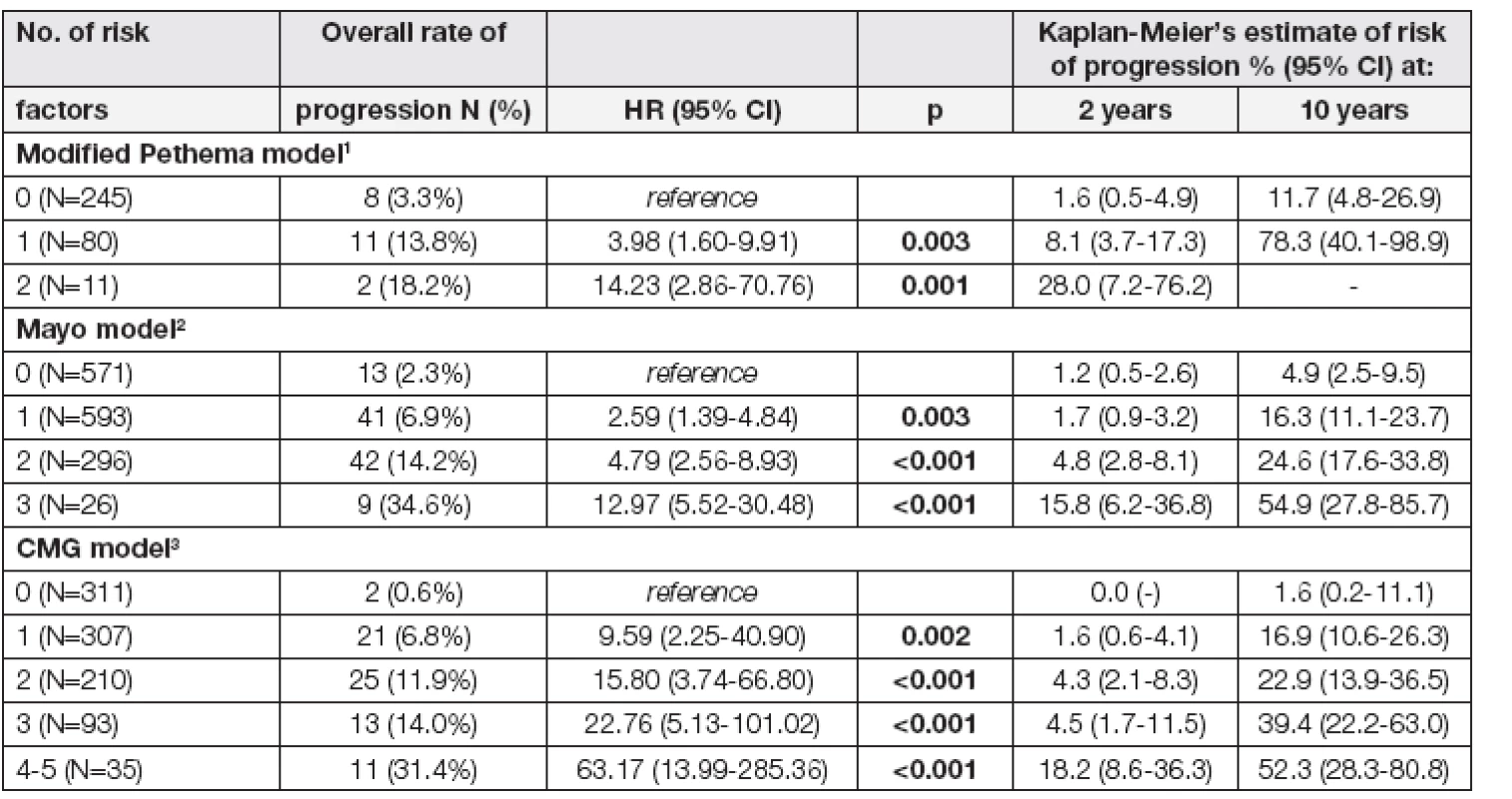
1 Immunoparesis: Any, CD56+ aPC: ≥95% 2 MIG in serum≥15 g/L, Kappa/lambda ratio <0.26 or >1.65, M-protein type: non-IgG 3 MIG in serum≥15 g/L, Kappa/lambda ratio <0.26 or >1.65, BM infiltration - cytology>5%, Hemoglobin<120 g/L, immunoparesis: Any Diskuse
Monoklonální gamapatie nejasného významu je klinicky němý, bezpříznakový stav, vyznačující se pozvolnou, klonální a nezhoubnou proliferací plazmatických buněk, produkující homogenní M - protein. Tento stav je však potenciálně maligní [5]. Současná analýza, která proběhla v České republice je postavena na sledování jednoho z největších souborů osob s MGUS na světě. Do naší analýzy bylo zahrnuto celkem 1887 osob s MGUS, přičemž transformace v maligní onemocnění byla pozorována v 16,5 % (162/1887) případů. Limitujícím číslem naší analýzy je délka sledování (medián 4 roky; rozpětí 0,0 – 34,8), přičemž jenom 12,1 % (229/1887) osob bylo sledováno více něž 10 let. Podobně jako ve studii s 1384 osobami s MGUS z jihovýchodní Minessoty, jsme i my potvrdili, že vstupní kvantita M-proteinu v séru sehrává důležitou roli v predikci transformace do nádorového onemocnění. Osoby, u kterých byla při stanovění diagnózy kvantita M - proteinu vyšší něž 15 g/l, měli HR 3,58krát vyšší při srovnání s osobami, u kterých M-protein v séru nepřesáhl tuto hodnotu [1]. Procentuální zastoupení plazmocytů v kostní dřeni byl další rizikový faktor predikce rizika maligní transformace, stejně jako ve studii, která byla popsána Baldinim et al [6] a Cesanem et al. [7]. MGUS osoby s BMPC infiltrací 5 až 10 % měli HR 3,24krát vyšší něž osoby s infiltrací BMPC pod 5 %. Nicméně, je třeba řící, že procentuální zastoupení plazmocytů v kostní dřeni je hodnota, která není zcela objektivní, protože závisí jak na kvalitě odběru, tak na odečítajícím lékaři.
V současnosti je FLC poměr jedním z nejslibnějších prognostických faktorů, které jsou využívány v rámci predikce maligní transformace MGUS [3]. V naši studii měly osoby s abnormálním poměrem HR 3,26krát vyšší než osoby s normálním FLC poměrem, což odpovídá dalším, již publikovaným studiím [1, 3, 8]. Španělská studijní skupina potvrdila, že imunoparéza sehrávala klíčovou roli při predikci rizika u asymptomatického mnohočetného myelomu (SMM), ale význam v predikci rizika u diagnózy MGUS byl hraniční [4]. V našem souboru sledovaných osob se imunoparéza vyskytla v 25,2 % (416/1648) případech, přičemž byl potvrzen její význam v predikci rizika jak coby separovaného, tak inkorporovaného faktoru do rizikových modelů. Osoby se snížením jednoho imunoglobulinu měly HR dvakrát vyšší a osoby se snížením dvou imunoglobulinů dokonce třikrát vyšší než osoby bez imunoparézy. Na rozdíl od již zmíněné klinické studie z jihovýchodní Minessoty, byla jak v univariantní, tak multivariantní analýze v rámci naší studie hodnota hemoglobinu pod 120 g/l potvrzena jako nezávislý faktor predikce maligní transformace. Na místě je ale opatrnost při tomto tvrzení, protože souvislost hodnoty hemoglobinu s jinými nemocemi je více něž jasná. Klíčovým bodem této analýzy byla také validace již známých rizikových modelů, popsaných Mayo klinikou a španělskou studijní skupinou. Kromě podtypu M-proteinu, u kterého jak coby separovaného, tak inkorporovaného faktoru maligní transformace jsme v naši analýze jeho prediktivní sílu neprokázali, jsme jinak platnost rizikových modelů uznávaných světem potvrdili. K tomu je však nutné dodat, že pro validaci PETHEMA modelu jsme použili model pro SMM, a to z důvodu chybějících dat o DNA aneuploidii v České republice. Nový CMG model, který jsme vytvořili na základě námi provedené analýzy, na rozdíl od jiných rizikových modelů ve světě zcela jasně identifikuje osoby s MGUS s nízkým a vysokým rizikem progrese. Z celkového počtu osob sledovaných v našem souboru, již 86,6 % (828/956) bylo označeno za osoby s nízkým rizikem, přičemž riziko progrese bylo 5,6 % při 5letém sledování. Dle očekávání jen 3,7 % (35/956) osob bylo označeno za osoby s nejvyšším rizikem, u nichž riziko progrese při 5letém sledování přesáhlo 31 %. MGUS skupina, která měla 4-5 rizikových faktorů, měla 63krát vyšší riziko progrese při porovnání s referenční skupinou.
Závěr
Lze konstatovat, že na jednom z dosud největších sledovaných souborů osob s MGUS jsme potvrdili platnost již známých klinických modelů využívaných pro určení rizika maligní transformace, které byly popsány Mayo klinikou a španělskou studijní skupinou. Nový CMG model přináší jasnou identifikaci nízce rizikové MGUS skupiny, která by měla být sledována nejprve v intervalu 6 měsíců, a pokud jde o stabilní stav bez známek progrese, pak stačí již pouze 1x ročně.
Vytvořeno s podporou grantů NT13492-4, NT14575-3 a EU FP7/2007-2013; grant 278570.
Do redakce došlo 22. 3. 2015
Adresa pro korespondenci:
Mgr. Viera Sandecká Interní hematologická a onkologická klinika FN Brno
Jihlavská 20
625 00 Brno
e-mail: vierkabj@yahoo.com
Zdroje
1. Kyle, R. A., Therneau, T. M., Rajkumar, S. V. et al. A long - term study of prognosis in monoclonal gammopathy of undetermined significance. N. Engl. J. Med. 2002, 346(8), p. 564-569.
2. Criteria for the classification of monoclonal gammopathies, multiple myeloma and related disorders: a report of the International Myeloma Working Group. Br. J. Haematol. 2003, 121(5), p. 749-757.
3. Rajkumar, S. V., Kyle, R. A., Therneau, T. M. et al. Serum free light chain ratio is an independent risk factor for progression in monoclonal gammopathy of undetermined significance. Blood 2005, 106(3), p. 812-817.
4. Perez-Persona, E., Vidriales, M. B., Mateo, G. et al. New criteria to identify risk of progression in monoclonal gammopathy of uncertain significance and smoldering multiple myeloma based on multiparameter flow cytometry analysis of bone marrow plasma cells. Blood 2007, 110(7), p. 2586-2592.
5. Kyle, R. A., Therneau, T. M., Rajkumar, S. V. et al. Long-term follow-up of 241 patients with monoclonal gammopathy of undetermined significance: the original Mayo Clinic series 25 years later. Mayo Clin. Proc. 2004, 79(7), p. 859-66.
6. Baldini, L., Guffanti, A., Cesana, B. M. et al. Role of different hematologic variables in defining the risk of malignant transformation in monoclonal gammopathy. Blood 1996, 87, p. 912-918.
7. Cesana, C., Klersy, C., Barbarano, L. et al. Prognostic factors for malignant transformation in monoclonal gammopathy of undetermined significance and smoldering multiple myeloma. J. Clin. Oncol. 2002, 20, p. 1625–1634.
8. Dispenzieri, A., Kyle, R. A., Therneau, T. M. et al. Immunoglobulin free light chain ratio is an independent risk factor for progression of smoldering (asymptomatic) multiple myeloma. Blood 2008, 111(2), p. 785-789.
Štítky
Biochémia Nukleárna medicína Nutričný terapeut
Článok vyšiel v časopiseKlinická biochemie a metabolismus
Najčítanejšie tento týždeň
2015 Číslo 2
-
Všetky články tohto čísla
- Nové doporučení odborných společností klinické biochemie a kardiologie
- Problematika stanovení monoklonálního imunoglobulinu u nemocných s AL amyloidózou
- Stanovení párů těžkých/lehkých řetězců imunoglobulinu u nemocných s nově diagnostikovanou Waldenströmovou makroglobulinémií
- Srovnání konvenční radiografie s celotělovou magnetickou rezonancí a analýza parametrů kostního metabolismu u nemocných s mnohočetným myelomem
- Monoklonální gamapatie nejasného významu s nízkým a vysokým stupněm rizika: výstupy z analýz RMG registru České myelomové skupiny pro praxi.
- Metabolismus cholesterolu u obézních pacientů s diabetes mellitus 1. typu - vliv redukce hmotnosti
- Vztah metabolického syndromu k hospitalizovanosti a mortalitě hemodialyzovaných pacientů – krátké sdělení
- Doporučení ČSKB: Používání kardiálních troponinů při podezření na akutní koronární syndrom
- Stanovisko ke stanovení hemoglobinu ve stolici kvantitativní analýzou
- Klinická biochemie a metabolismus
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Stanovisko ke stanovení hemoglobinu ve stolici kvantitativní analýzou
- Doporučení ČSKB: Používání kardiálních troponinů při podezření na akutní koronární syndrom
- Nové doporučení odborných společností klinické biochemie a kardiologie
- Monoklonální gamapatie nejasného významu s nízkým a vysokým stupněm rizika: výstupy z analýz RMG registru České myelomové skupiny pro praxi.
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



