-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Liečba rekurentného karcinómu ovária – retrospektívna analýza
Treatment of Recurrent Ovarian Cancer – a Retrospective Study
Backgrounds:
Treatment of recurrent ovarian cancer is not standardized. Pre-clinical tests have confirmed the synergistic effect of gemcitabine and platinum, which can break through drug resistance to platinum. Therefore, efficacy of a combined gemcitabine and platinum-based regimen can be expected not only in therapy platinum-sensitive but also in platinum-resistant disease. Surgery – so-called secondary (eventually tertiary) cytoreductive surgery, should be considered in recurrent disease before planning the chemotherapy.Patients and methods:
This is a retrospective analysis of 58 patients with recurrent ovarian cancer treated with a gemcitabine and platinum-based regimen (GP) as the second or third-line chemotherapy. Some of the patients underwent secondary cytoreductive surgery before starting the systemic treatment. The aim of the study was to detect the response rate, progression-free survival and overall survival in the whole group of patients and in subgroups with platinum-sensitive and platinum-resistant disease. Another aim was to detect the correlation between secondary cytoreductive surgery and the efficacy of chemotherapy.Results:
Systemic treatment (GP) has helped to achieve a response rate of 53.5%, with time to progression 10 months and overall survival 23.5 months. A better response rate, progression free survival and overall survival were achieved in the group of patients with platinum-sensitive disease compared to patients with platinum-resistant disease, but this difference was not statistically significant. 20 patients underwent effective secondary cytoreductive surgery before the systemic treatment. Patients who underwent effective secondary cytoreductive surgery had a statistically better response rate (RR: 80% vs 39.5%), longer progression-free survival (PFS: 13.5 m vs 9 m, p = 0.006) and longer overall survival (OS: 40 m vs 16.9 m, p = 0.006) when compared to patients without secondary cytoreductive surgery.Conclusion:
We have confirmed the efficacy of a gemcitabine and platinum-based regimen in the therapy of recurrent ovarian cancer, in both platinum-sensitive and platinum-resistant disease. An important prognostic factor in the whole group of patients was the realization of effective secondary cytoreductive surgery.Key words:
recurrent ovarian cancer – gemcitabine – carboplatin – cisplatin – surgical treatment
Autoři: M. Tkáčová 1,2; B. Belohorská 1,2; K. Ševčíková 1,2; L. Heľpianska 1; D. Ondruš 1; M. Ondrušová 3; S. Špánik 1,2
Působiště autorů: I. onkologická klinika LF UK, Bratislava, Slovenská republika 1; Interná- onkologická klinika OÚSA, Bratislava, Slovenská republika 2; Ústav experimentálnej onkológie SAV, Bratislava, Slovenská republika 3
Vyšlo v časopise: Klin Onkol 2010; 23(2): 115-123
Kategorie: Původní práce
Souhrn
Východiská:
Liečba rekurentného karcinómu ovária nie je štandardizovaná. Predklinické testy dokázali synergický účinok gemcitabínu a platiny, ktorý môže prelomiť rezistenciu na platinu. Preto sa predpokladá účinnosť kombinovaného režimu gemcitabín a platina nielen v liečbe platina senzitívneho, ale aj v liečbe platina rezistentného ochorenia. Pred plánovanou chemoterapiou by sa malo zvážiť operačné riešenie recidívy ochorenia, tzv. sekundárna (príp. terciárna) chirurgická cytoredukcia.Pacienti a metódy:
Ide o retrospektívnu analýzu súboru 58 pacientok s rekurentným karcinómom ovária liečených režimom gemcitabín a platinový derivát (GP) v druhej alebo tretej línii chemoterapie. U určitej skupiny pacientok pred systémovou liečbou bola vykonaná sekundárna cytoredukcia. Cieľom analýzy bolo zistiť liečebnú odpoveď, čas do progresie ochorenia a celkové prežívanie pacientok v celom súbore a v podskupinách s platina senzitívnym a platina rezistentným ochorením. Ďalším cieľom bolo zistiť koreláciu medzi sekundárnou chirurgickou cytoredukciou a efektivitou chemoterapie.Výsledky:
Systémovou liečbou GP sa v celom súbore dosiahla liečebná odpoveď 53,5 % s časom do progresie ochorenia 10 mesiacov a celkovým prežívaním 23,5 mesiaca. Pri porovnaní skupín s platina senzitívnym a platina rezistentným ochorením bola dokázaná lepšia liečebná odpoveď, dlhší čas do progresie ochorenia a celkové prežívanie u pacientok s platina senzitívnym ochorením, avšak rozdiel nebol štatisticky signifikantný. U 20 pacientok bola pred systémovou liečbou vykonaná efektívna sekundárna chirurgická cytoredukcia. Pacientky s efektívnou sekundárnou cytoredukciou mali štatisticky lepšiu liečebnú odpoveď (RR: 80 % vs 39,5 %), dlhší čas do progresie ochorenia (PFS: 13,5 m vs 9 m, p = 0,006) a dlhšie celkové prežívanie (OS: 40 m vs 16,9 m, p = 0,006) ako pacientky bez sekundárnej cytoredukcie. Záver: Potvrdili sme účinnosť režimu gemcitabín a platinový derivát v liečbe rekurentného karcinómu ovária, a to v skupine pacientok s platina senzitívnym, ako aj v skupine s platina rezistentným ochorením. Významným prognostickým faktorom v celom súbore bolo vykonanie efektívnej sekundárnej chirurgickej cytoredukcie.Kľúčové slová:
rekurentný karcinóm ovária – gemcitabín – karboplatina – cisplatina – chirurgická liečbaÚvod
Zhubné nádory vaječníka majú v rámci nádorov ženských pohlavných orgánov osobitné zastúpenie, a to z viacerých dôvodov: chýba jednoznačná detekovateľná in situ forma nádoru, neexistujú účinne aplikovateľné spôsoby screeningu a samotný nádor sa často manifestuje v klinicky pokročilom štádiu s nepriaznivou prognózou.
Incidencia zhubných nádorov ovária značne varíruje medzi jednotlivými krajinami sveta (obr. 1). Vo všeobecnosti sa vyššie hodnoty incidencie zaznamenávajú vo vyspelých v porovnaní s rozvojovými krajinách, čo je obdobná paralela ako pri zhubných nádoroch prsníka. Najvyššie hodnoty štandardizovanej incidencie (na svetovú štandardnú populáciu – nad 13/ 100 000) sa opakovane zaznamenávajú u belošiek v USA, v Európe sú najvyššie hodnoty na Islande (16,2/ 100 000), vo Švédsku (15,2) v Českej republike (14,2), v Írsku (13,5) a v Dánsku (13,3). Najnižšie hodnoty štandardizovanej incidencie sú v ázijských krajinách, napr. v Číne a v Japonsku (pod 7/ 100 000) [1 – 2]. Rozdiely vo výskyte ochorenia sa vysvetľujú jednak rozdielmi v kompletnosti zozbieraných dát v jednotlivých krajinách sveta, ale s väčšou pravdepodobnosťou sa tu uplatňuje vplyv odlišných počtov hysterektómií a ooforektómií v jednotlivých krajinách, ako aj aplikácia orálnych kontraceptív a priemerná parita žien. Slovenská republika (SR) sa hodnotami štandardizovanej incidencie 13,1/ 100 000 žien v roku 2005 zaraďuje medzi krajiny so stredným výskytom tohto ochorenia. Zhubné nádory vaječníka tvoria v jednotlivých krajinách sveta 2 – 8 % všetkých zhubných nádorov u žien, na Slovensku sa v roku 2005 podieľali počtom 539 chorých 4,3 % na všetkých zhubných nádoroch (graf 1) [3].
Obr. 1. Incidencia karcinómu ovária vo svete. 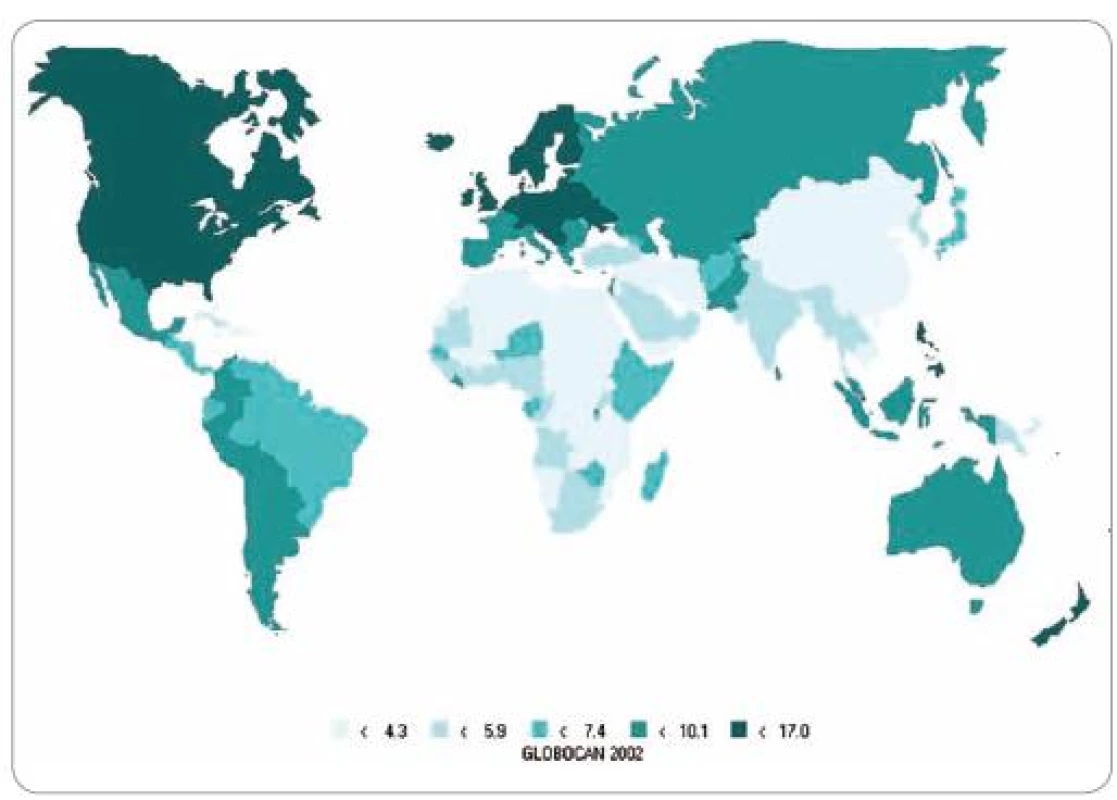
Vo väčšine vyspelých štátov sveta, vrátane SR, zostáva incidencia nádorov ovária za posledných 25 rokov pomerne stabilizovaná, aj keď sa zaznamenal vzostup ochorenia u starších a pokles u mladších žien. Pokles počtov ochorení v mladších vekových skupinách sa pripisuje protektívnemu vplyvu v súčasnosti široko aplikovaných orálnych kontraceptív. Nádory ovária sú zriedkavé pred 40. rokom života, a pokiaľ sa v tomto období vyskytnú, ide v 90 % o nádory z germinatívnych buniek. Vekovo špecifická incidencia epitelových nádorov začína prudko stúpať po 40. roku života, s kulmináciou medzi 65. a 79. rokom života [2]. Celkovo má krivka vekovo ‑ špecifickej incidencie v SR stúpajúci trend od 30. – 40. roku života, s kulmináciou v 7. decéniu a následným miernym poklesom výskytu ochorenia.
Najvyššie hodnoty mortality sa celosvetovo zaznamenávajú v USA, v európskych krajinách s vysokou incidenciou a naopak, najnižšie hodnoty v Ázii [4]. Zaujímavý je pokles mortality v európskych krajinách (vrátane SR), kde boli jej hodnoty vysoké začiatkom 50. rokov uplynulého storočia, hoci v ostatných krajinách s mortalitou v polovici uplynulého storočia nízkou, má v súčasnosti vzostupný trend [4]. V SR v poslednom štatisticky spracovanom roku 2005 zomrelo 266 žien s karcinómom ovária, čo predstavuje štandardizovanú mortalitu 6/ 100 000 žien (graf 1).
Graf 1. Incidencia a mortalita na karcinóm ovária na Slovensku. Počet prípadov na 100 000 obyvateľov. 
Až 70 % pacientok s karcinómom ovária má v čase stanovenia diagnózy pokročilé štádium ochorenia, preto toto ochorenie predstavuje celosvetovo závažný medicínsky a spoločenský problém. Liečba pokročilého karcinómu ovária pozostáva z radikálnej operácie a následnej štandardnej chemoterapie v schéme paklitaxel a karboplatina. Približne u 70 % pacientok s pokročilým karcinómom ovária, ktoré po prvolíniovej liečbe dosiahli kompletnú remisiu, dôjde k recidíve ochorenia [5]. Pravdepodobnosť vzniku recidívy závisí od štádia ochorenia v čase stanovenia diagnózy [6]. Vyššia pravdepodobnosť vzniku recidívy ochorenia je pri vyššom štádiu karcinómu ovária v čase diagnózy, pri mucinóznom alebo svetlobunkovom karcinóme ovária, u starších pacientok so zlým stavom telesnej výkonnosti, s reziduálnym tumorom >1 cm po primárnej radikálnej operácii, alebo ak nebola v prvej línii použitá platina [7].
Liečebný postup u rekurentného karcinómu ovária nie je štandardizovaný. U určitej skupiny pacientok do úvahy prichádza opakovať chirurgický zákrok, realizovať tzv. sekundárnu (príp. terciárnu) cytoredukciu. Ide o radikálny operačný výkon u pacientok po skončení primárnej liečby, ktorého úlohou je odstrániť perzistujúci tumor alebo odstrániť recidívu ochorenia [7]. Po operácii je indikovaná druholíniová chemoterapia, rovnako ako u pacientok bez chirurgického odstránenia recidívy ochorenia. Druholíniová chemoterapia v súčasnosti nezabezpečí žiadnu reálnu šancu na vyliečenie pacientok s rekurentným karcinómom ovária. Jej hlavnými cieľmi sú predĺženie celkového prežívania, zlepšenie alebo ústup symptómov ochorenia a zlepšenie kvality života. Aj keď sa druholíniovou chemoterapiou dosiahne liečebná odpoveď, u väčšiny pacientok nastane rekurencia ochorenia a budú pokračovať v liečbe ďalšími líniami chemoterapie. Preto sa rekurentný karcinóm ovária v súčasnosti považuje za chronické ochorenie [8]. Výber systémovej liečby rekurentného karcinómu ovária závisí od dĺžky intervalu bez liečby platinou. Viacerí autori [8 – 9] zistili, že časový interval bez liečby platinou je dôležitý prediktívny faktor liečebnej odpovede. V súčasnosti sa v klinickej praxi používa delenie rekurentného karcinómu ovária na platina senzitívny (Pt ‑ senzitívny) a platina rezistentný (Pt ‑ rezistentný). Za Pt ‑ senzitívny rekurentný karcinóm ovária sa označuje ten, ak recidíva ochorenia nastane po dobe > 6 mesiacov od skončenia prvolíniovej liečby. Ak recidíva nastane po dobe < 6 mesiacov, rekurentný karcinóm ovária sa označuje ako Pt ‑ rezistentný. Pre liečbu Pt ‑ senzitívneho rekurentného karcinómu ovária sa odporúča použitie kombinovaného režimu s platinovým derivátom (platinový derivát s paklitaxelom, pegylovaným doxorubicínom, príp. gemcitabínom), v závislosti od reziduálnej toxicity po štandardnej prvolíniovej liečbe. Pre liečbu Pt ‑ rezistentného karcinómu ovária sa odporúča použitie nie ‑ platinových cytostatík, ktorých liečebná odpoveď varíruje od 14 do 34 % [10]. Ide o skupinu pacientok so zlou prognózou ochorenia, u ktorých hlavným cieľom liečby je paliácia symptómov ochorenia. V klinickej praxi sa najčastejšie používa monoterapia topotekánom, pegylovaným doxorubicínom, paklitaxelom a gemcitabínom. Určitou alternatívou v liečbe rekurentného karcinómu ovária je aj kombinácia gemcitabín a platinový derivát, a to v liečbe Pt - senzitívneho, ako aj Pt - rezistentného ochorenia. Na základe predklinických in vitro testov sa zistil synergický účinok gemcitabínu a platiny, ktorý môže prelomiť rezistenciu na platinu, a to inhibíciou enzymatického komplexu ERCC1. Daný enzymatický komplex zodpovedá za opravu poškodenej DNK a jeho„overexpresia“ je prítomná u pacientok s Pt ‑ rezistentným karcinómom ovária [10 – 11].
V tejto retrospektívnej analýze sme sledovali efektivitu kombinovaného režimu gemcitabín a platinový derivát v liečbe rekurentného karcinómu ovária a jej zmenu po vykonaní sekundárnej chirurgickej cytoredukcie. Primárnym cieľom bolo zistiť liečebnú odpoveď (response rate – RR) kombinovaného režimu (GP), čas do progresie ochorenia (progression free survival – PFS) a celkové prežívanie (overall survival – OS). Sekundárnym cieľom bolo zistiť, ako sekundárna cytoredukcia ovplyvňuje efektivitu kombinovaného režimu.
Materiál a metódy
Ide o retrospektívnu analýzu súboru pacientok s rekurentným karcinómom ovária liečených v OUSA v období rokov 2003 – 2008. Do súboru bolo zaradených 58 pacientok s rekurentným karcinómom ovária liečených kombinovanou chemoterapiou gemcitabín a platinový derivát (GP) v druhej alebo tretej línii. Použili sme dva režimy: gemcitabín 1 000 mg/ m2 podávaný v deň 1, 8 a karboplatina AUC4/ 5 podávaná v deň 1 alebo gemcitabín 1 000 mg/ m2 podávaný v deň 1, 8 a cisplatina 75 mg/ m2 podávaná v deň 1. Chemoterapia sa podávala každé tri týždne. Všetky pacientky v sledovanom súbore dostali minimálne dva plné cykly kombinovanej chemoterapie. Platinový derivát sa zvolil podľa predchádzajúcej hematologickej toxicity a komorbidity (neuropatia, nefropatia). Súbežne s chemoterapiou sa aplikovala štandardná antiemetická a hydratačná liečba.
U určitej podskupiny pacientok sa pred systémovou liečbou (GP) indikoval chirurgický výkon s cieľom odstrániť čo najväčšie množstvo tumoróznej masy. Ak bolo možné vykonať cytoredukciu, ktorá viedla k objektívnemu zmenšeniu tumoru, operáciu sme považovali za efektívnu. Tzv. open - close operáciu, kde bol peroperačne nález hodnotený ako inoperabilný, sme považovali za neefektívnu. Liečebnú odpoveď, čas do progresie a celkové prežívanie sme hodnotili v celom súbore, v podskupine pacientok s Pt ‑ senzitívnym, Pt ‑ rezistentným ochorením a následne sme ich porovnali. Efektivitu GP sme porovnávali aj v podskupinách pacientok po sekundárnej chirurgickej cytoredukcii a bez sekundárnej cytoredukcie, ktoré sme neskôr rozdelili aj na základe senzitivity na platinu. Do skupiny pacientok s Pt ‑ senzitívnym karcinómom ovária sme zaradili pacientky, u ktorých nastala recidíva ochorenia po ≥ 6 mesiacoch od skončenia prvolíniovej liečby. V skupine s Pt ‑ rezistenným karcinómom ovária boli pacientky, u ktorých nastala recidíva ochorenia po < 6 mesiacoch od skončenia prvolíniovej liečby, pacientky s Pt ‑ perzistentným ochorením, ktoré čiastočne odpovedali na prvolíniovú liečbu, a pacientky s Pt ‑ refraktérnym ochorením, ktoré na prvolíniovú liečbu neodpovedali. Vzhľadom na podobnú odpoveď na liečbu platinovým derivátom a pre ľahšie hodnotenie výsledkov sme celú túto skupinu označili ako Pt ‑ rezistentní. Liečebná odpoveď sa hodnotila na základe fyzikálneho vyšetrenia, hladiny markeru CA 125 a CT vyšetrenia. Ako liečebnú odpoveď (RR) sme hodnotili kompletnú remisiu (KR) a parciálnu remisiu (PR) ochorenia. Stabilizáciu ochorenia (stable disease – SD) a progresiu ochorenia (PG) sme za liečebnú odpoveď nepovažovali.
Výpočty boli vykonané v štatistickomsoftwere Statistica (StatSoft, Inc. (2009). STATISTICA (data analysis software system), version 9.0. www.statsoft.com) Pre hodnotenie celkového prežívania a času do progresie ochorenia bol použitý Kaplan ‑ Meierov odhad krivky prežívania. Porovnanie prežívania (času do progresie) medzi dvoma skupinami pacientok bolo vykonané log‑rank testom. Porovnanie podielu pacientok s liečebnou odpoveďou (RR) a bez liečebnej odpovede (SD + PG) v jednotlivých skupinách bolo vykonané Fisherovým testom. Všetky štatistické testy boli obojstranné a boli vykonané na hladine významnosti a = 0,05.
Výsledky
Do súboru bolo zaradených 58 pacientok s mediánom veku 53 rokov. Základné charakteristiky súboru uvádza tab. 1. Najčastejší histologický typ v sledovanom súbore bol serózny adenokarcinóm. Väčšina pacientok mala v čase stanovenia diagnózy pokročilé štádium ochorenia. Primárna optimálna radikálna operácia sa vykonala u 13 pacientok (22,4 %), primárna suboptimálna radikálna operácia sa vykonala u 41 pacientok (70,7 %). U štyroch pacientok sa žiadna radikálna operácia nevykonala, malígny proces sa verifikoval cytologickým alebo histologickým vyšetrením. Väčšina pacientok bola liečená štandardnou prvolíniovou chemoterapiou v schéme paklitaxel a karboplatina. V sledovanom súbore malo Pt ‑ senzitívny karcinóm ovária 32 pacientok (55,2 %), Pt ‑ rezistentný karcinóm ovária malo 26 pacientok (44,8 %). Z celého súboru sa u 27 pacientok indikovala sekundárna chirurgická cytoredukcia, z toho u 20 pacientok sa vykonala efektívne a 7 pacientok neefektívne. U 31 pacientok (53,5 %) sa neindikovalo operačné odstránenie recidívy ochorenia. Všetky pacientky sa liečili kombinovanou chemoterapiou gemcitabín a platinový derivát. Najčastejšie sa použil režim gemcitabín a cisplatina (n = 31; 53,5 %), v 6 prípadoch sa platinový derivát zmenil počas liečby pre nežiaduce účinky. Pacientky v sledovanom súbore dostali priemerne 6,5 cyklov.
Tab. 1. Charakteristika sledovaného súboru. 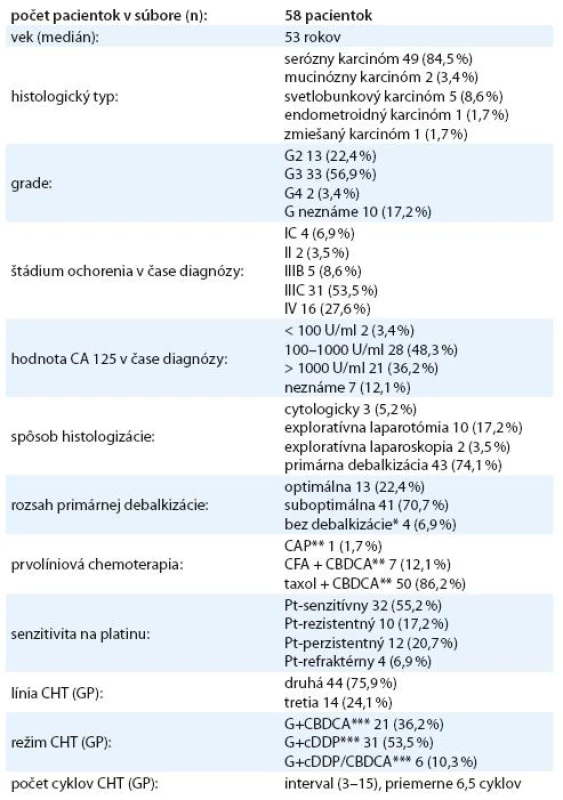
* malígny proces verifi kovaný histologickým alebo cytologickým vyšetrením ** CAP – cyklofosfamid, adriamaycín, cisplatina, CBDCA – karboplatina, CF – cyklofosfamid *** G – gemcitabín, CBDCA – karboplatina, cDDP – cisplatina Kombinovanou chemoterapiou sa v ce-lom súbore dosiahla liečebná odpoveď (RR) 53,5 % (tab. 2). Kompletnú odpoveď na liečbu malo 16 pacientok (27,6 %), parciálnu remisiu ochorenia 15 pacientok (25,9 %), stabilizáciu ochorenia štyri pacientky (6,9 %) a progresiu ochorenia malo 23 pacientok (39,7 %). Čas do progresie ochorenia v celom súbore bol 10 mesiacov (graf 2) a celkové prežívanie bolo 23,5 mesiaca (graf 3). U 36 pacientok (62,1 %) sa vyskytla hematologická toxicita s následnou úpravou režimu (vynechanie dňa 8 alebo redukcia dávky) alebo odkladom liečby. Nehematologická toxicita bola zriedkavá (neuropatia 8,6 %, nauzea a vomitus 6,9 %, hepatotoxicita 1,7 %, ototoxicita 1,7 %). V skupine pacientok s Pt ‑ senzitívnym karcinómom ovária sa dosiahla lepšia liečebná odpoveď ako v podskupine pacientok s Pt ‑ rezistentným ochorením (RR: 65,6 % vs 38,5 %). Rozdiel nebol štatisticky významný, mal však trend dosiahnuť štatistickú významnosť (p = 0,063, tab. 3). Čas do progresie ochorenia a celkové prežívanie bolo dlhšie v skupine s Pt ‑ senzitívnym karcinómom ovária v porovnaní s Pt ‑ rezistentným ochorením (PFS 12 vs 8 mesiacov, p = 0,335; OS 35,6 vs 15 mesiacov, p = 0,099) (tab. 2). Efektivitu kombinovaného režimu sme hodnotili aj vo vzťahu k sekundárnej cytoredukcii (tab. 4). Pacientky po sekundárnej cytoredukcii mali štatisticky významne vyššiu liečebnú odpoveď ako pacientky bez sekundárnej operácie (tab. 5), čo sa prejavilo aj v štatisticky signifikantne dlhšom PFS (13,5 vs 9 mesiacov; p = 0,006) a OS (40 vs 16,9 mesiacov; p = 0,006) (graf 4, 5).Pri podrobnejšej analýze podskupiny pacientok s vykonanou sekundárnou cytoredukciou sa nezistil štatisticky významný rozdiel v PFS medzi pacientkami s Pt ‑ senzitívnym a s Pt ‑ rezistentným ochorením (PFS 15 vs 10 mesiacov; p = 0,466), avšak dokázalo sa štatisticky lepšie celkové prežívanie u pacientok s Pt ‑ senzitívnym ochorením (OS – vs 24,5 mesiacov; p = 0,036), aj keď medián v tejto skupine nebol dosiahnutý. V podskupine bez sekundárnej cytoredukcie sa nedokázal štatisticky významný rozdiel v čase do progresie ochorenia (PFS 10 vs 6 mesiacov; p = 0,272), ani v celkovom prežívaní (OS 20 vs 13 mesiacov; p = 0,147) medzi pacientkami s Pt ‑ senzitívnym a Pt ‑ rezistentným karcinómom ovária. Pri porovnaní pacientok s Pt ‑ senzitívnym ochorením, ktoré podstúpili efektívnu sekundárnu cytoredukciu, a pacientok s Pt ‑ senzitívnym ochorením, ktoré ju nepodstúpili, sa zistil štatisticky dlhší čas do progresie ochorenia (PFS 15 vs 10 mesiacov; p = 0,013, graf 6) a štatisticky dlhšie celkové prežívanie (OS – vs 20 mesiacov; p = 0,0008, graf 7) pre pacientky po sekundárnej cytoredukcii. Pacientky s Pt ‑ rezistentným ochorením po sekundárnej cytoredukcii mali dlhší čas do progresie a celkové prežívanie ako pacientky s Pt ‑ rezistentným ochorením bez sekundárnej cytoredukcie, ale nedokázal sa štatisticky významný rozdiel, aj keď mal trend dosiahnuť štatistickú významnosť (p = 0,065). Nedokázaný rozdiel je pravdepodobne spôsobený príliš malým počtom pacientok v jednotlivých podskupinách.
Graf 2. Čas do progresie ochorenia v celom súbore. 
Graf 3. Celkové prežívanie od začiatku liečby gemcitabín + platina. 
Graf 4. Čas do progresie podľa sekundárnej cytoredukcie. 
Graf 5. Celkové prežívanie od začiatku liečby gemcitabín + platina podľa sekundárnej cytoredukcie. 
Graf 6. Čas do progresie ochorenia u pacientok s Pt-senzitívnym karcinómom ovária podľa sekundárnej cytoredukcie. 
Graf 7. Celkové prežívanie u pacientok s Pt-senzitívnym karcinómom ovária podľa sekundárnej cytoredukcie. 
Diskuzia
V priebehu posledných dekád sa liečba karcinómu ovária zmenila. Napriek veľkému entuziazmu pre optimálne radikálne chirurgické výkony a agresívnu adjuvantnú chemoterapiu so zámerom úplného vyliečenia u väčšiny pacientok nie je možné tento cieľ dosiahnuť. U 70 % pacientok s chirurgicky potvrdenou kompletnou remisiou ochorenia po primárnej liečbe sa vyskytne rekurencia ochorenia [12]. Od 80. rokov sa kľúčovým liekom pre liečbu karcinómu ovária stala platina, so zlepšením liečebnej odpovede na 50 – 80 % a predĺžením celkového prežívania na 12 – 30 mesiacov [9]. Pri liečbe rekurentného karcinómu ovária je dôležitým prediktívnym faktorom senzitivita na platinu [9]. U pacientok s platina senzitívnym rekurentným karcinómom ovária sa platinovou liečbou môže dosiahnuť až 70 % liečebných odpovedí [10]. Viaceré klinické štúdie [13 – 15] potvrdili superioritu kombinovaného režimu s karboplatinou v porovnaní s monoterapiou karboplatinou v liečbe Pt ‑ senzitívneho karcinómu ovária. Klinická štúdia AGO - OVAR 2.5 [14] porovnávala režim gemcitabín a karboplatina s monoterapiou karboplatinou v liečbe rekurentného Pt ‑ senzitívneho karcinómu ovária. Pri mediáne follow‑up 17 mesiacov bola liečebná odpoveď pre GP 47,2 % a čas do progresie ochorenia bol 8,6 mesiaca. V ramene s monoterapiou karboplatinou bola RR 30,9 % a PFS 5,8 mesiaca. V ramene s kombinovaným režimom sa častejšie vyskytovala hematologická toxicita.
Tab. 2. Efektivita kombinovaného režimu GP. 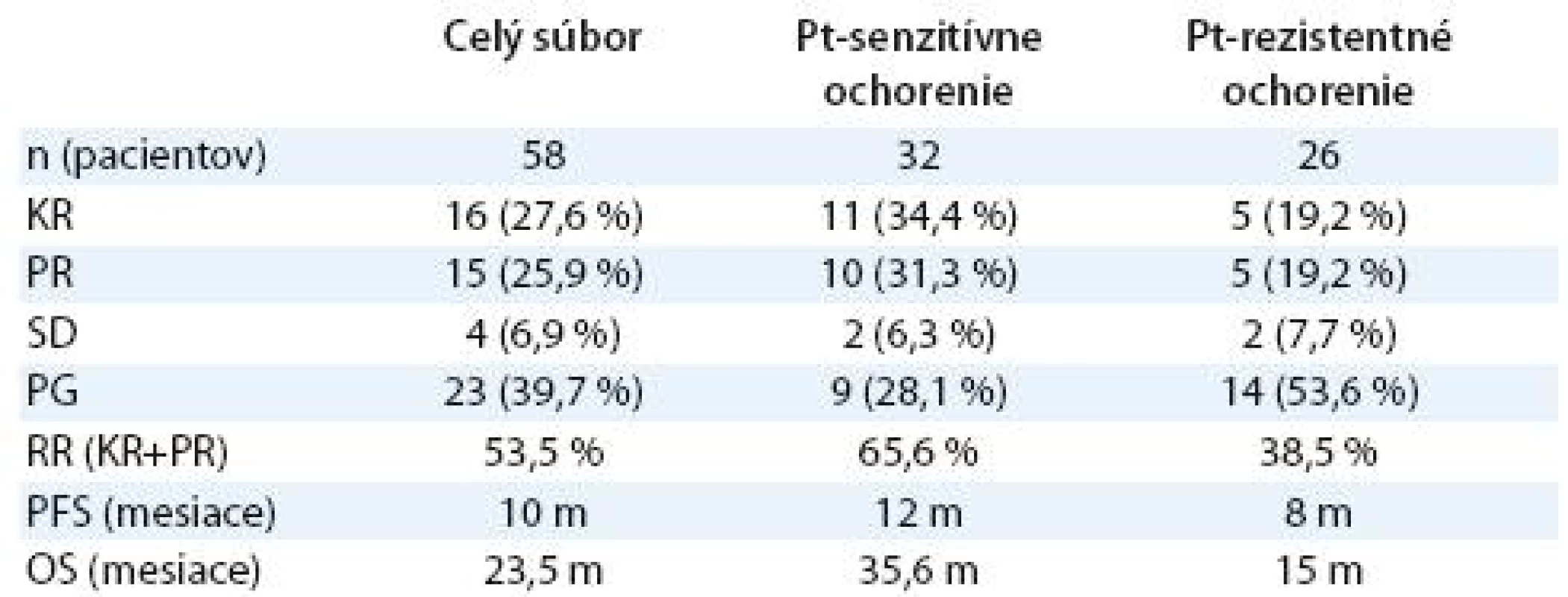
Tab. 3. Liečebná odpoveď u pacientok s Pt-senzitívnym a Pt-rezistentným ochorením, p = 0,063. 
Tab. 4. Efektivita kombinovaného režimu a sekundárna cytoredukcia. 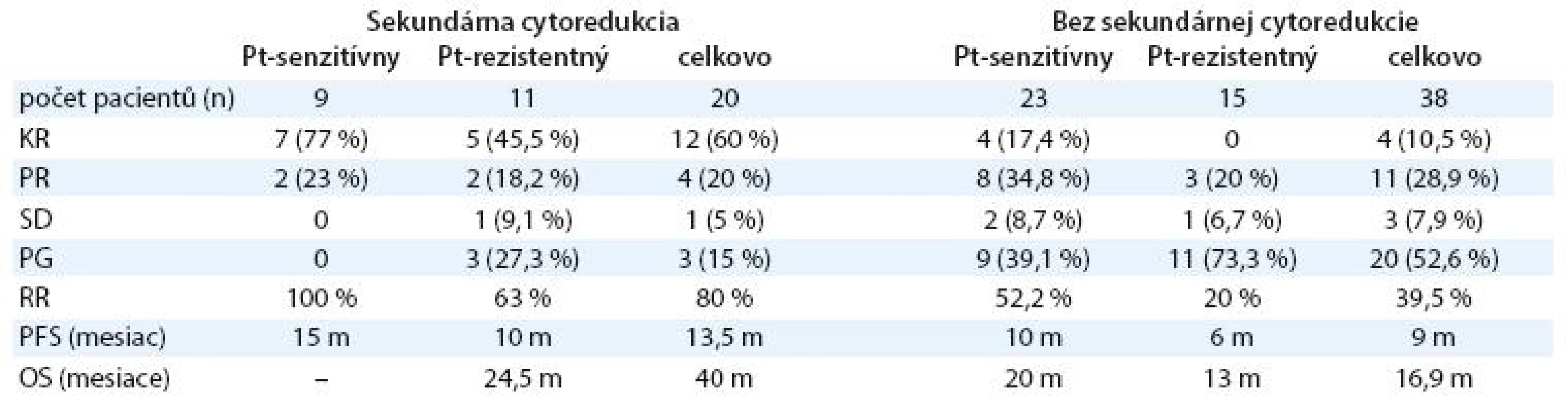
Tab. 5. Liečebná odpoveď u pacientok so sekundárnou cytoredukciou a bez sekundárnej cytoredukcie podľa senzitivity ochorenia na platinu. 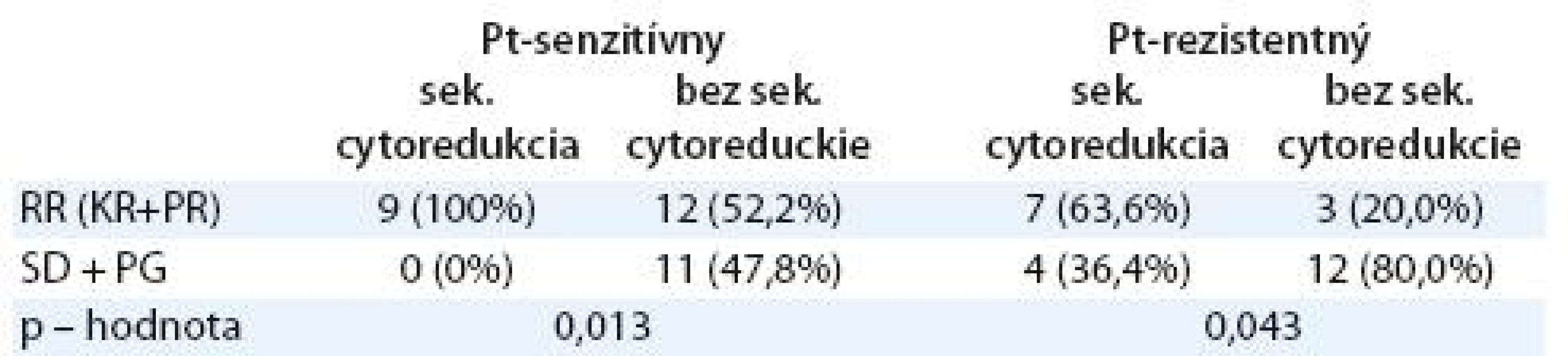
V našom súbore v skupine pacientok s platina senzitívnym ochorením sa dosiahla liečbou GP liečebná odpoveď takmer 66 % s mediánom PFS 12 mesiacov a mediánom OS takmer 36 mesiacov. Hematologická toxicita bola častá aj v nami sledovanom súbore.
Pri liečbe Pt ‑ rezisteného karcinómu ovária monoterapiou karboplatinou sa dosiahne liečebná odpoveď len 10 % [7]. Limitovanú účinnosť vykazujú aj ostatné cytostatiká, ktoré sa používajú v monoterapii: topotekán RR 12,4 % [16], perorálny etoposid RR 27 % [17], gemcitabín RR 15 – 20 % [18]. Efektivitu kombinovaného režimu gemcitabín a platina v liečbe Pt ‑ rezistentného karcinómu ovária sledovali autori Rose [11] a Nagourney [19]. Kombinovaným režimom (gemcitabín 750 mg/ m2 a cisplatina 30 mg/ m2) sa dosiahla liečebná odpoveď 43 – 57 % s časom do progresie ochorenia 6 mesiacov pre obidve štúdie [11,19]. V klinickej štúdii Villella [12] bola sledovaná efektivita gemcitabínu (1 000 mg/ m2, deň 1, 8) a cisplatiny (75 mg/ m2, deň 1) alebo karboplatiny (AUC 5, deň 1) v liečbe rekurentného karcinómu ovária. Liečba sa podávala každé tri týždne, s mediánom 6 cyklov. Do súboru bolo zaradených 29 pacientok s rekurentným karcinómom ovária. Interval bez liečby platinou bol 0 – 65 mesiacov, s mediánom 12 mesiacov. V celom súbore sa dosiahla liečebná odpoveď 55 %. Z celého súboru malo platina rezistentný karcinóm ovária 19 pacientok (66 %). V tejto podskupine sa dosiahla liečebná odpoveď 42 %.
Tieto výsledky sú porovnateľné s výsledkami v nami sledovanom súbore, kde liečebná odpoveď v celom súbore bola 53,5 % a v podskupine s Pt ‑ rezistentným karcinómom ovária 38,5 %.
V súčasnosti prebieha klinická štúdia GOG 126L fáza II [20], ktorá hodnotí režim GP v liečbe rekurentného Pt ‑ rezistentného karcinómu ovária, jej výsledky by mohli prispieť k zlepšeniu terapeutického postupu.
Analýzou sledovaného súboru sme potvrdili, že sekundárna cytoredukcia zlepšuje liečebnú odpoveď kombinovaného režimu, predlžuje čas do progresie ochorenia ako aj celkové prežívanie, čo sa ukázalo ako štatisticky významné v celej skupine pacientok so sekundárnou cytoredukciou ako aj v podskupine s Pt ‑ senzitívnym karcinómom ovária. Nedokázal sa štatisticky signifikantný rozdiel v PFS u pacientok po sekundárnej cytoredukcii pri delení na základe senzitivity na platinu. Avšak sa dokázalo štatisticky významne dlhšie prežívanie pacientok po sekundárnej cytoredukcii s Pt ‑ senzitívnym ochorením v porovnaní s pacientkami s Pt ‑ rezistentným ochorením. Rovnako sa nedokázal štatisticky významný rozdiel účinnosti chemoterapie v skupine pacientok s Pt ‑ rezistentným ochorením s sekundárnou cytoredukciou alebo bez nej.
Význam operačného riešenia recidívy, príp. perzistencie ochorenia spočíva v zmenšení tumoru, eliminácii potenciálne chemorezistentných buniek, v odstránení zle prekrvených tumoróznych más, čo zlepší distribúciu chemoterapie a jej liečebnú odpoveď [5]. Podľa viacerých autorov má sekundárna cytoredukcia význam, ak je vykonaná optimálne, to znamená s reziduom < 1 cm [21]. Agresívne cytoredukčné výkony s reziduom > 1 cm nie sú opodstatnené v paliatívnej liečbe. Podľa analýzy Leitaa a Chia [5] u všetkých pacientok s jedným miestom výskytu recidívy bez ohľadu na dĺžku času bez liečby, tak ako u pacientok s časom bez liečby > 30 mesiacov, bez ohľadu na počet miest výskytu recidívy, by sa malo zvážiť operačné riešenie recidívy. U pacientok s karcinomatózou peritonea a časom bez liečby < 12 mesiacov by sa operačné riešenie recidívy nemalo zvažovať, pretože by neprinieslo benefit v zmysle predĺženia celkového prežívania. Odporúčania pre vykonanie sekundárnej cytoredukcie uvádza tab. 6 [5]. Klinickou štúdiou DESKTOP ‑ OVAR [18] sa potvrdil benefit sekundárnej cytoreduckie v zmysle predĺženia prežívania, ak sa vykonala optimálne, s reziduom < 1 cm. Pre jej dosiahnutie boli dôležité tieto prediktívne faktory: stav telesnej výkonnosti, FIGO štádium v čase diagnózy, veľkosť reziduálneho tumoru po primárnej radikálnej operácii, prítomnosť ascitu > 500 ml a interval bez príznakov ochorenia > 6 mesiacov. Či dané prediktívne faktory určia vhodnú skupinu pacientok na vykonanie optimálnej sekundárnej cytoredukcie, overí prospektívna klinická štúdia AGO - DESKTOP II [22]. V súčasnosti prebieha klinická štúdia GOG 213 [5], ktorej cieľom je určiť význam operácie pri prvej rekurencii ochorenia. Do štúdie sa zaraďujú pacientky, u ktorých sa vyskytla rekurencia ochorenia po > 6 mesiacoch od skončenia prvolíniovej liečby. Pacientky sú randomizované do ramena so sekundárnou cytoredukciou a bez nej. Následne sú randomizované do dvoch ramien s liečbou paklitaxel/ karboplatina alebo paklitaxel/ karbopatina/ bevacizumab. Výsledky tejto štúdie môžu byť prínosom pri rozhodovaní o terapeutickom postupe u pacientok s rekurentným karcinómom ovária.
Tab. 6. Odporúčania pre sekundárnu cytoredukciu. DFS (disease free survival) – doba bez ochorenia. 
Záver
Kombinovaná chemoterapia gemcitabín a platinový derivát predstavuje efektívnu alternatívu pri výbere liečby rekurentého karcinómu ovária. Jej účinnosť je značná nielen v liečbe Pt ‑ senzitívneho, ale aj v liečbe Pt ‑ rezistentného karcinómu ovária. Pred plánovanou systémovou liečbou rekurentného karcinómu ovária je nutné zvážiť operačné riešenie recidívy ochorenia, zvlášť u pacientok, u ktorých dôjde k recidíve ochorenia po > 6 mesiacoch od skončenia prvolíniovej liečby. Efektívne chirurgické riešenie recidívy ochorenia zvýši účinnosť pooperačnej chemoterapie a zlepší prežívanie pacientok.
Poďakovanie
Ďakujem všetkým spolupracovníkom a hore menovaným spoluautorom za pomoc a odborný prínos pri realizácii tejto práce.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, pruducts, or services used in the study.Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.MUDr. Marcela Tkáčová
I. onkologická klinika LF UK a OÚSA
Heydukova 10
812 50 Bratislava
Slovenská republika
e-mail: lickovamarcela@yahoo.com
Zdroje
1. Parkin DM, Whelan SL, Ferlay J et al (eds). Cancer Incidence in Five Continents. Vol. VIII. Lyon: IARC Scientific Publication 2002; 155.
2. Gertig D, Hunter D. Ovarian cancer. In: Adami HO, Hunter D, Trichopoulos D (eds). Textbook of cancer epidemiology. New York: Oxford University Press 2002 : 378 – 399.
3. Safaei Diba C, Pleško I, Obšitniková A et al. Incidencia zhubných nádorov v Slovenskej republike 2005. Národný onkologický register SR. NCZI 2009.
4. Zatonski W, Smans M, Tyczynski J et al (eds). Atlas of cancer mortality in Central Europe. Lyon: IARC Scientific Publication 1996; 134 : 86 – 89.
5. Leitao MM, Chi DS. Surgical management of recurrent ovarian cancer. Semin Oncol 2009; 36(2): 106 – 109.
6. Relapsed/ Refractory ovarian cancer: Decision points in diagnosis and new treatment strategies (CD ‑ ROM). Clinical care options, LLC, 2006.
7. Heľpianska L et al. Karcinóm ovária. Bratislava 2006 : 12 – 15, 31 – 37, 63 – 77, 94 – 113.
8. Bukowski RM, Ozols RF, Markman M. The managment of recurrent ovarian cancer. Sem Oncol 2007; 34 (2 Suppl 2): 8 – 13.
9. Copeland LJ. Epithelial Ovarian Cancer. In: DiSaia PJ, Creasman WT (eds). Clinical Gynecologic Oncology. 7th ed. Mosby Elsevier 2007 : 313 – 395.
10. Lorusso D, Di Stefano A, Fanfani F et al. Role of gemcitabine in ovarian cancer treatment. Ann Oncol 2006; 17 (Suppl 5): 188 – 194.
11. Rose PG, Mossbruger K, Fusco N et al. Gemcitabine reverse cisplatin resistance: Demonstration of activity in platinum – and multidrug‑rezistent ovarian and peritoneal carcinoma. Gynecol Oncol 2003; 88(1): 17 – 21.
12. Villella J, Marchette D, Odunsi K et al. Response of combination platinum and gemcitabine chemotherapy for recurrent epithelial ovarian cancer. Gynecol Oncol 2004; 95(3): 539 – 545.
13. Parmar MK, Ledermann JA, Colombo N et al. Paclitaxel plus platinum‑based chemotherapy versus conventional platinum‑based chemotherapy in women with relapsed ovarian cancer: the ICON4/ AGO - OVAR - 2.2 trial. Lancet 2003; 361(9375): 2099 – 2106.
14. Pfisterer J, Plante M, Vergote I et al. Gemcitabine plus carboplatin compared with carboplatin in patients with platinum ‑ sensitive recurrent ovarian cancer: an intergroup trial of AGO ‑ OVAR, the NCICCTG, and the EORTC GCG. J Clin Oncol 2006; 24(29): 4699 – 4707.
15. González ‑ Martin AJ, Calvo E, Bover I et al. Randomized phase II trial of carboplatin versus paclitaxel and carboplatin in platinum ‑ sensitive recurrent advanced ovarian carcinoma: A GEICO (Group Espanol de Investigacion en Cancer de Ovario) study. Ann Oncol 2005; 16(5): 749 – 755.
16. Bookman MA, Malmström H, Bolis G et al. Topotecan for the treatment of advanced epithelial ovarian cancer: an open ‑ label phase II study in patients treated after prior chemotherapy that contained cisplatin or carboplatin and paclitaxel. J Clin Oncol 1998; 16(10): 3345 – 3352.
17. Rose PG, Blessing JA, Mayer AR et al. Prolonged oral etoposide as second‑line chemotherapy for platinum‑resistant and platinum ‑ sensitive ovarian carcinoma: a Gynecologic Oncology study. J Clin Oncol 1998; 16(2): 405 – 410.
18. Markman M, Webster K, Zanotti K et al. Phase 2 trial of single‑agent gemcitabine in platinum ‑ paklitaxel refractory ovarian cancer. Gynecol Oncol 2003; 90(3): 593 – 596.
19. Nagourney RA, Brewer CA, Radecki S et al. Phase II trial of gemcitabine plus cisplatin repeating doublet therapy in previously treated, relapsed ovarian cancer patients. Gynecol Oncol 2003; 88(1): 35 – 39.
20. Tewari D, Monk BJ, Hunter M et al. Gemcitabine and cisplatin chemotherapy is an active combination in the treatment of platinum‑resistant ovarian and peritoneal carcinoma. Invest New Drugs 2004; 22(4): 475 – 80.
21. Tesařík Z. Kontroverze v moderní léčbě pokročilého ovariálního karcinómu. Klin Onkol 2002; 15(4): 136 – 141.
22. Harter P, du Bois A, Hahmann M et al. Arbeitsgemeinschaft Gynaekologische Onkologie Ovarian Committee; AGO Ovarian Cancer Study Group. Surgery in recurrent ovarian cancer: The Arbeitsgemeinschaft Gynaekologische Onkologie (AGO) DESKTOP OVAR trial. Ann Surg Oncol 2006; 13(12): 1702 – 1710.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2010 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Nízkodávková rádioterapia v liečbe plantárnej fasciitídy
- Naše skúsenosti s analýzou génu PTEN u pacientov s podozrením na Cowdenovej syndróm
- Liečba rekurentného karcinómu ovária – retrospektívna analýza
- Onkologové využívají komunikační systém pro videokonference
- Vakcinace proti lidskému papillomaviru v ČR
- Zápis ze schůze výboru České onkologické společnosti dne 23. 3. 2010 v Plzni
- In memoriam – za doc. MU Dr. Zdeňkem Churým, CSc.
- Linhartová V.Kapitoly z dějin Masarykova onkologického ústavu v Brně.Brno: Masarykův onkologický ústav 2010. 91 s. ISBN 978-80-86793-14-6.
- Použití lenalidomidu v léčbě mnohočetného myelomu
- Soudobý pohled na léčbu jaterních metastáz kolorektálního karcinomu
- Radioterapie lůžka prostaty – kdy a co léčit?
- Cirkulujúce nádorové bunky u rakoviny prsníka – prehľad
- Detekce sentinelové uzliny u pacientek s karcinomem endometria s využitím hysteroskopie
- Monitorace efektivity chirurgické léčby maligních pleurálních výpotků
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Nízkodávková rádioterapia v liečbe plantárnej fasciitídy
- Radioterapie lůžka prostaty – kdy a co léčit?
- Detekce sentinelové uzliny u pacientek s karcinomem endometria s využitím hysteroskopie
- Naše skúsenosti s analýzou génu PTEN u pacientov s podozrením na Cowdenovej syndróm
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



