-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Šestileté sledování pacienta s mnohočetnou angiomatózou postihující skelet, břišní i hrudní dutinu a stěnu trávicí trubice
Six-year Follow-up of a Patient with Multiple Angiomatosis Involving Skeleton, Thoracic and Abdominal Cavities and the Gut Wall
Backgrounds:
Multiple angiomatosis is a rare disease causing angiomatous lesions in multiple organs and tissues with a risk of life-threatening haemorrhage.Observation:
A young man was diagnosed with multiple angiomatosis at the age of 28 after two years of back and abdominal pain. Laparotomy revealed multiple spongy lesions mostly within the retroperitoneal space. Also, an involvement of the gut wall, bones and mediastinum was evident. After 6 years of treatment, the disease has been stabilized. Bone pain ceased with a significant contribution of zoledronate. Using CT and MR imaging, the effectiveness of antiangiogenic drugs was evaluated. Furthermore, treatment response was evaluated using laboratory values for coagulation and blood count, as angiomatous proliferation is known to be associated with disseminated intravascular coagulation and anaemia.Results:
Baseline laboratory examination revealed elevated D-dimer (more than 20 µg/mL), low fibrinogen (1.4 g/L), and the presence of fibrin monomers. After treatment with 6 mil. IU of interferon-alpha thrice weekly, there was only partial improvement in D-dimer (17.2 µg/mL) and fibrinogen (1.5 g/L) concentrations but fibrin monomers remained positive. After thalidomide (100 mg daily), D-dimer decreased to 6.1 µg/mL and fibrinogen levels increased to 1.9 g/L with the disappearance of fibrin monomers. CT scanning showed significant regression of angiomatous lesions. Progressive neuropathy was the reason to lower the dose of thalidomide by half and this caused D-dimer to rise again. Switching to lenalidomide 10 mg daily led to an increase in D-dimer to 10.8 µg/mL and decrease in haemoglobin concentration to 124 g/L. Fibrin monomers became positive again. Combined therapy with thalidomide (50 mg/day) and lenalidomide (10 mg days 1–21 in 28-day cycles) has led to stabilisation of the disease. Median concentration of haemoglobin increased to 131 (84–141) g/l. The median of D-dimer decreased to 9.3 (8.0–17) µg/mL.Conclusion:
Thalidomide in the dose of 100 mg daily led to better stabilisation of the disease than interferon-alpha. However, lowering the dose because of adverse effects failed to be effective sufficiently. Lenalidomide 10 mg daily was well-tolerated but insufficient to improve D-dimer and haemoglobin concentrations. Therefore, for further treatment we have decided to use the combination of lenalidomide and thalidomide in doses of 10 mg and 50 mg, respectively because both drugs have desirable antiangiogenic activities with different adverse effect profiles. On this therapy, the patient’s disease has been stable for 9 months.Key words:
angiomatosis – zoledronate – thalidomide – interferon alpha – lenalidomide – disseminated intravascular coagulation
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
29. 11. 2011Accepted:
3. 7. 2011
Autoři: Z. Adam 1; M. Matýšková 1; M. Tomíška 1; Z. Řehák 2; R. Koukalová 2; L. Křikavová 3; L. Pour 1; M. Krejčí 1; P. Szturz 1; L. Zahradová 1; M. Mechl 3; M. Moulis 4; J. Vaníček 5; Č. Neuman 6; M. Navrátil 1; K. Veselý 7; R. Hájek 1; J. Mayer 1
Působiště autorů: Interní hematoonkologická klinika, LF MU a FN Brno 1; PET CT oddělení, Masarykův onkologický ústav, Brno 2; Radiologická klinika, LF MU a FN Brno 3; Ústav patologické anatomie, LF MU a FN Brno 4; Klinika zobrazovacích metod, LF MU a FN u sv. Anny Brno 5; Chirurgická klinika, LF MU a FN Brno 6; I. patologicko-anatomický ústav, LF MU a FN u sv. Anny Brno 7
Vyšlo v časopise: Klin Onkol 2012; 25(1): 47-62
Kategorie: Kazuistiky
Souhrn
Východiska:
Mnohočetná angiomatóza je raritní onemocnění s postižením více orgánů a tkání angiomatózními útvary s rizikem smrtelného krvácení.Popis případu:
V popisovaném případě byly postiženy kosti, pleurální i peritoneální dutina a trávicí trubice. Pacient dlouhodobě dostává zoledronát, již po druhé dávce zoledronátu vymizely bolesti kostní. Účinnost antiangiogenních léků jsme hodnotili dle CT a MRI zobrazení. Protože angiomatózní proliferace je spojena s chronickou diseminovanou intravaskulární koagulací (DIC) a anemizací, hodnotíme léčebnou odpověď také dle krevního obrazu a dle koncentrace fibrinogenu, D-dimerů a průkazu solubilních fibrinových monomerů.Výsledky:
Před léčbou byly hodnoty D-dimerů vyšší než 20 µg/ml, fibrinogen 1,4 g/l a byly přítomné solubilní fibrinové monomery. Při léčbě interferonem alfa 6 mil. j. 3× týdně s redukcí dávky po 10 měsících se zvýšil medián koncentrace fibrinogenu na 1,5 (1,2–2,0) g/l, poklesl medián hodnoty D-dimerů na 17,2 (13,4–20,0) µg/ml, stále byly přítomné fibrinové monomery. Při terapii thalidomidem (100 mg/den) poklesl medián D-dimerů na 6,07 (4,71–10,21) µg/ml a zvýšil se medián hodnoty fibrinogenu na 1,9 g/l, solubilní fibrinové monomery nebyly průkazné. Dle CT zobrazení se výrazně zmenšily angiomatózní masy. Progredující neuropatie byla důvodem pro snížení dávky thalidomidu na 50 mg/den, při níž se ale zvýšily D-dimery. Při podávání lenalidomidu 10 mg/den se zvýšil medián koncentrace D-dimerů na 10,8 (8,8–17,35) µg/ml a poklesla hodnota hemoglobinu na medián 124 (117–135) g/l. Opět byl pozitivní průkaz solubilních fibrinových monomerů. Při léčbě kombinací thalidomidu (50 mg denně) a lenalidomidu (10 mg 1.–21. den ve 28denních cyklech) byl pacient stabilní po dobu 9 měsíců. Medián koncentrace hemoglobinu se zvýšil na 131 (84–141) g/l a snížil se medián hodnoty D-dimerů na 9,3 (8,0–17) µg/ml.Závěr:
Thalidomid 100 mg/den stabilizoval mnohočetnou angiomatózu lépe než interferon alfa. Thalidomid 50 mg/den již neudržel stabilitu nemoci. Lenalidomid v dávce 10 mg byl excelentně tolerován, ale tato dávka nedostačovala pro udržení stabilně nízkých hodnot D-dimerů a normální koncentrace hemoglobinu. Kombinace lenalidomidu v dávce 10 mg a thalidomidu v dávce 50 mg stabilizovala stav po dobu 9 měsíců. Při použití thalidomidu a lenalidomidu se sčítá antiangiogenní účinek. Díky odlišnosti nežádoucích účinků obou léků je tolerance této kombinace dobrá.Klíčová slova:
angiomatosis – zoledronát – thalidomid – interferon alfa – lenalidomid – diseminovaná intravaskulární koagulaceÚvod
Vaskulární neoplazie zahrnují heterogenní skupinu cévních proliferací skládajících se z endoteliálních buněk, hladké svaloviny a pericytů, které dohromady vytvářejí ložiska arteriálních, kapilárních, venózních nebo lymfatických cest, tak jak je uvádí tab. 1. Do skupiny s agresivnějším chováním patří vzácné případy takzvané angiomatózy, což je klinický i patologicko-anatomický termín pro velké neohraničené a někdy i vícečetné hemangiomy tvořící cévní tumory, které prorůstají orgány a tkáněmi a postupně progredují. Ačkoliv gastrointestinální angiomatóza je obvykle benigní, přesto může být příčinou náhlého úmrtí způsobeného nezastavitelným krvácením nebo střevní obstrukcí.
Následujícím popisem případu chceme upozornit na tyto vzácné a obtížně diagnostikovatelné případy. Symptomy angiomatózy lze přirovnat k chameleonovi, neboť se liší dle toho, který orgán je postižen. Relativně konstantním příznakem provázejícím angiomatózu většího rozsahu je chronická stabilní diseminovaná intravaskulární koagulace s nízkou koncentrací fibrinogenu, zvýšenými D-dimery a případně s protaženými koagulačními časy a sníženým počtem trombocytů, obvykle bez zřetelných krvácivých projevů. Pokud tento typ koagulopatie zjistíme, je nutno v první radě pomýšlet na cévní neoplazie.
Popis případu
Klinický průběh a výsledky vyšetření
S mnohočetnou angiomatózou jsme se setkali u mladého muže, narozeného roku 1977. Stručně shrneme jeho anamnézu: V osmi letech prodělal nekomplikovanou apendektomii. V roce 1992 (15 let) vznikla náhle hydrokéla ve varleti vlevo a o rok později vpravo, řešena chirurgicky. Pak se mu vedlo opět dobře. První problémy související s angiomatózou se objevily v dubnu 2003 (26 let). Začal pociťovat bolesti v bederní páteři, zprvu jen při námaze, později i v klidu. Původ bolestí byl zprvu vysvětlován sportem, byly provedeny „opichy“ a rehabilitační léčba, vše bez efektu. Když se tato obvyklá léčba bolestí zad minula účinkem, byl odeslán na rentgenový snímek páteře, na němž byl abnormální nález hodnocený jako kostní dysplazie nebo Pagetova choroba. A s tímto podezřením, plynoucím z rentgenového snímku, byl poslán na ortopedickou kliniku. V roce 2003 vyslovili radiodiagnostici na základě MRI páteře podezření na vícečetnou kostní formu angiomatózy (obr. 1–3). Bylo to poprvé, kdy se v dokumentaci nemocného objevil termín angiomatóza. Pro nejasný obraz na snímku páteře a pánve byla provedena první excize a histologické vyšetření kosti, bez jasného závěru. S cílem ověřit toto podezření byla provedena v říjnu 2003 angiografie tepen v oblasti pánve, která neprokázala nic patologického, a nepotvrdila tedy podezření plynoucí z MRI obrazu skeletu.
Obr. 1. T2 vážený obraz, sagitální obraz bederní páteře. V oblasti obratlových těl je patrná nehomogenně skvrnitá struktura s převažujícím vyšším signálem, který svědčí pro patologickou infiltraci kostní dřeně. 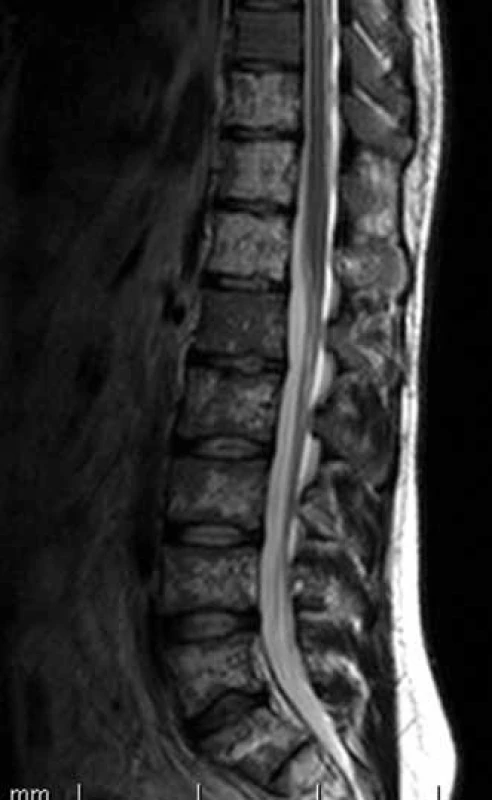
Obr. 2. T1 vážený obraz, sagitální obraz bederní páteře. Nehomogenní signál z kostní dřeně obratlových těl s převažujícími okrsky nízkých intenzit ve srovnání s intenzitami meziobratlových plotének, které svědčí pro abnormální strukturu kostní dřeně. Páteřní kanál je volný. 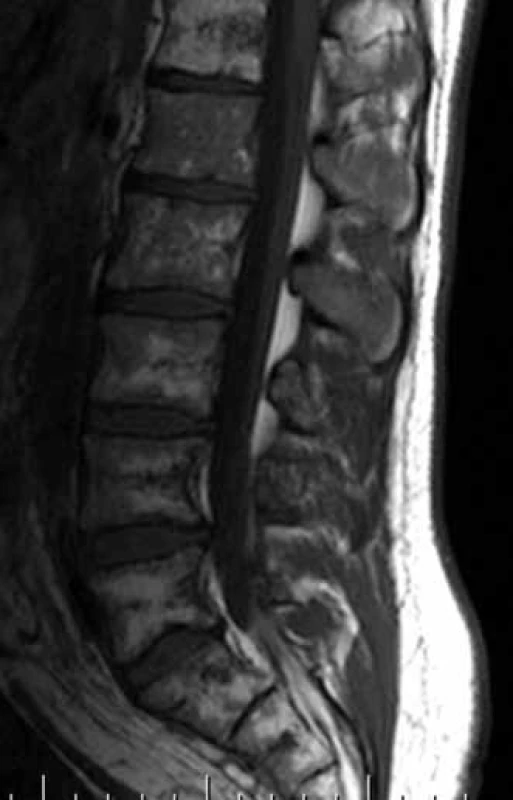
Obr. 3. T2 vážený obraz, koronární obraz sakroiliakálního skloubení. Patrná je infiltrace kosti křížové (nehomogenně zvýšený signál) a dále též ilické kosti přilehlé sakroiliakálnímu skloubení vlevo. 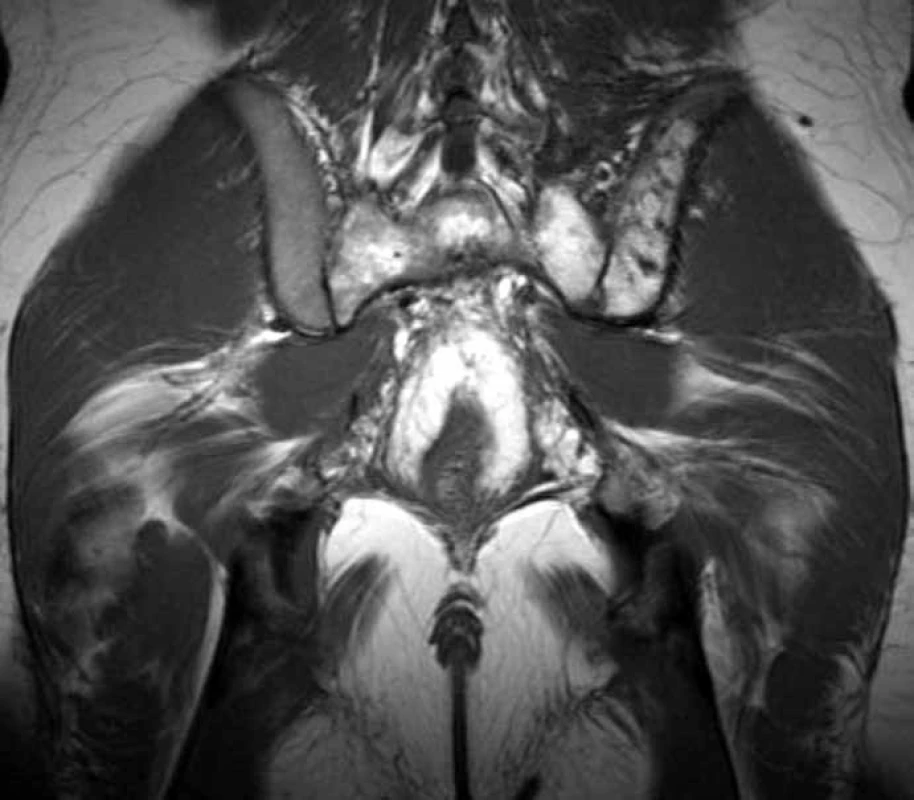
V prosinci 2003 byla provedena punkce pánve pod CT kontrolou ze suspektního ložiska, bez jednoznačného diagnostického závěru. Nejasné kostní postižení, které způsobovalo bolesti, zůstávalo pořád bez jasného pojmenování.
V únoru 2004 provedli ortopedové další excizi z lopaty kosti kyčelní. Výsledek histologie byl zavádějící, vzorek byl hodnocen jako fibróza kostní dřeně, a vzniklo tak podezření na primární myelofibrózu.
Vyslovené podezření na myelofibrózu bylo důvodem, proč byl pacient poslán na Interní hematoonkologickou kliniku v Brně. V březnu 2004 byla provedena standardní vyšetření prováděná pro diagnostiku myelofibrózy, která však tuto nemoc nepotvrdila. Hodnoty krevního obrazu, koagulace a fibrinogenu byly zcela v normě. Aspirační hodnocení kostní dřeně ze sternální punkce (myelogram) bylo bez patologie. Hematologické vyšetření bylo ukončeno v květnu 2004 se závěrem: „myelofibróza ani jiné krevní onemocnění nepotvrzeno“.
Vzhledem k tomu, že současně s bolestmi v zádech se objevily nespecifické tlakové bolesti v oblasti břišní dutiny, začal mladý muž docházet na gastroenterologické pracoviště. Byly provedeny opakované kolonoskopie, první 20. 5. 2003. V oblasti levého tračníku byly patrné červené makuly s centrálním projasněním. V terminálním ileu pouze nodulární hyperplazie. První histologie při kolonoskopii byla odebrána v roce 2003. Závěr zněl: Mírná folikulární lymfoidní hyperplazie s lehce nadlimitní zánětlivou celulizací. Dále provedena gastroskopie bez jasně patologického makroskopického a mikroskopického nálezu. Nález na střevě přináší obr. 4 a 5.
Obr. 4. Nález na střevě při kolonoskopii. 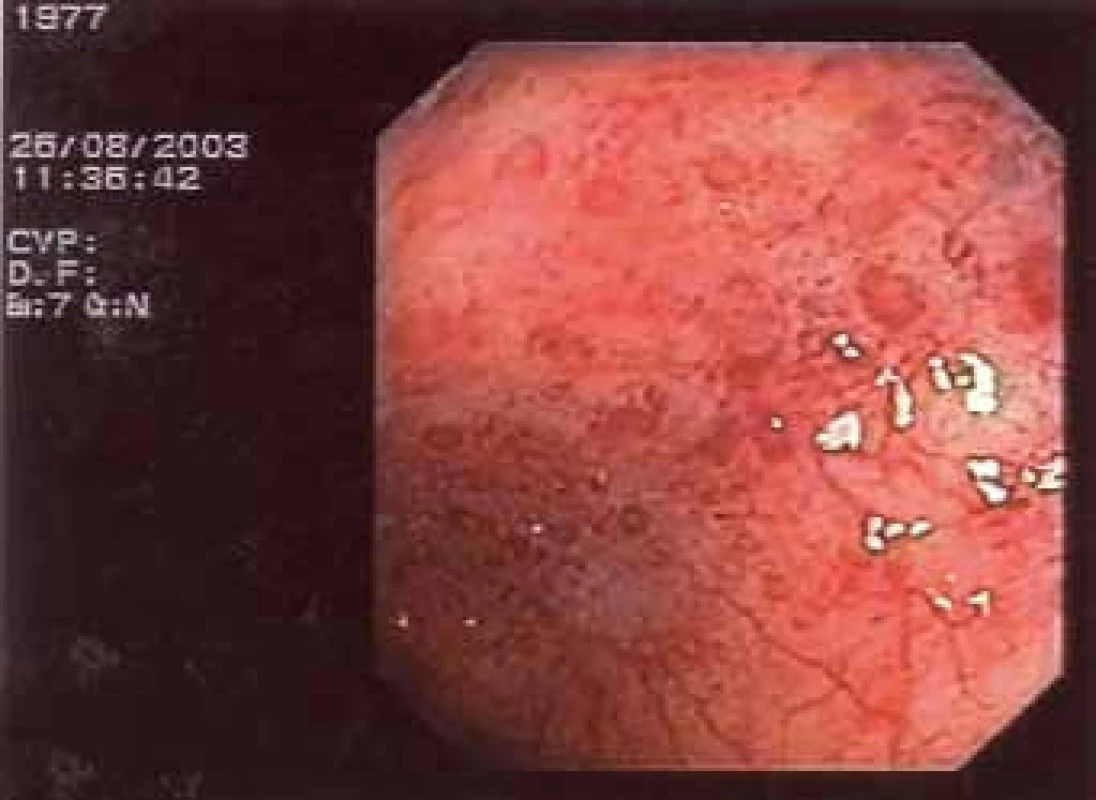
Obr. 5. Nález na střevě při kolonoskopii. 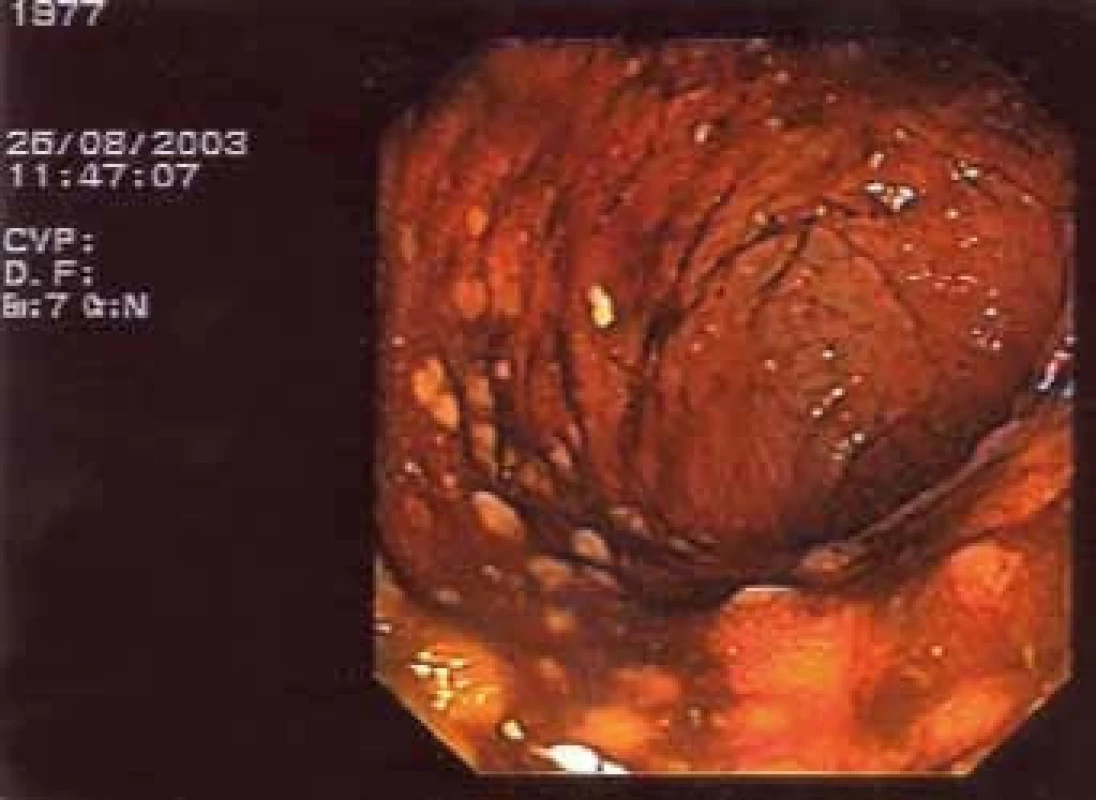
Počátkem roku 2005 došlo ke zhoršení zdravotního stavu, bolesti v zádech se zhoršovaly, objevily se otoky nohou a sideropenická anémie.
V květnu 2005 byl přijat na naše pracoviště se závažnou anémií vyžadující transfuze. Dalším překvapivým nálezem byla hypoproteinemie. Okultní krvácení nebylo potvrzeno, vstřebávací křivka železa byla normální, a tak začala léčba preparáty železa. Proteinurie nebyla potvrzena, a proto se předpokládaly ztráty bílkovin zažívacím traktem. Opakovala se kolonoskopie se závěrem: „Obraz lehké nodulární hyperplazie na céku, v colon descendens pod lienální flexurou byl popsán okrsek skrvnité hyperemie o průměru 3 cm. V sigmoideu drobná aftózní ložiska s hyperemickým lemem. Histologicky opět nespecifické změny.“
Pro nejasný stav byla v květnu 2005 odebrána uzlina z třísla. Ta však nevysvětlila nejasný nález na CT břišní dutiny z května 2005 (obr. 6, 7, 12, 13), a proto byla v květnu 2005 provedena laparotomie. Po otevření dutiny břišní byl překvapující nález velkých hemangiomatózních uzlů v oblasti mezenteria a retroperitonea. Potíže nemocného shrnuje tab. 1.
Obr. 6, 7. CT vyšetření břicha po intravenózní aplikaci jodové kontrastní látky ze dne 9. 5. 2005 – před zahájením léčby. Šipka ukazuje na patologickou infiltraci v retroperitoneu, která je hypodenzní a postkontrastně se nesytí. 
Tab. 1. Příznaky angiomatózy u popisovaného pacienta. 
Operační nález z probatorní laparotomie
Peritoneální dutina bez výpotku. Revize tenkých kliček: asi do poloviny orálního jejuna patrná atypická struktura, zesílená granulovaná stěna, další tenké střevo normálního charakteru. Provedena enterotomie a odběr stěny v celé síle na histologii. Mezenterium příslušné takto změněnému střevu je zesílené, hmatné uzliny a houbovitá tkáň s dilatovanými cévami.
Revize podjaterní krajiny: celá stěna žlučníku prorostlá vaskulární tkání, ligamentum hepatoduodenale infiltrované, patrná dilatovaná cévní pleteň. Játra palpačně i vizuálně bez patologií, slezina normální velikosti a struktury.
Maximum změn nacházíme v retroperitoneu, z něhož se vyklenuje tkáň houbovité struktury, ze které prosvítají uzly charakteru hemangiomů a procházející cévy průměru 0,5–1,0 cm. Tyto změny sestupují až k ilickým svazkům. Dále je jimi prostoupeno téměř celé mesokolon. Volný úsek jen od hepatické flexury do poloviny příčného tračníku. Směrem k lienální flexuře cévní změny patrny i při okraji střeva. Mesosigma již celé prostoupené, nedovoluje manipulaci se střevem, ale přesto patrny cévní malformace i na stěně břišní směrem k lopatě kosti kyčelní. Za vzestupným tračníkem hmatná stejná tkáň jako v retroperitoneu.
Žaludek bez výraznějších patologií, v oblasti pyloru až k duodenu začínají obdobné patologické změny s dilatovanými žilami. Nad žaludkem v retroperitoneu stejný nález angiomatózy. Odběr histologie z retroperitonea hrozí exsanguinací, a proto neproveden. Odebrána část tkáně, adheze mezi žlučníkem a duodenem, kterým probíhá dilatovaná céva. Dále na stěně pyloru zvoleno jedno místo s dilatovanou cévou a mezi stehy byla provedena excise. Došlo k masivnímu arteriálnímu krvácení. Stavěno prošitím stěny žaludku. Od dalších odběrů ustoupeno, kontrola hemostázy, drén k pyloru, sutura laparotomie. Operační diagnóza: angiomatosis retroperitonei, vesicae feleae a mesocoli.
Shrnutí všech bioptických vyšetření
U daného pacienta byla histologicky vyšetřena excize stěny žaludku s přiléhajícími měkkými tkáněmi, provedena biopsie levé kosti kyčelní, biopsie tříselné uzliny, opakovaně trepanobiopsie z kosti kyčelní a opakovaně mikroexcize ze sliznice duodena.
Diagnostická byla excize stěny žaludku, provedená při explorativní laparotomii. Histologicky nalezena vaskulární proliferace postihující stěnu žaludku a přiléhající měkké tkáně. Ložisko bylo tvořeno spletí krevních cév různého charakteru a kalibru: cévy byly venózního nebo kapilárního typu, přítomny i kavernózní prostory, vše náhodně roztroušené. Ojediněle zastiženy byly také typické klastry malých cév, radiálně vycházejících z centrálně lokalizované větší žíly. V korelaci s klinickým nálezem byla stanovena diagnóza angiomatózy.
Stejná vaskulární proliferace byla zjištěna i v oblasti intertrabekulárních prostorů spongiózní kosti, získané biopsií levé kosti kyčelní. V této lokalizaci byla proliferace provázena sekundární myelofibrózou.
V tříselné uzlině nalezena jako následek cirkulačních změn tzv. vaskulární transformace sinusů, morfologicky neodlišitelná od angiomatózy.
V opakovaných trepanobiopsiích z kosti kyčelní a v opakovaných mikroexcizích sliznice duodena nebyly nalezeny žádné patognomické změny ve vztahu k angiomatóze.
Léčba
Vstupní CT obraz před léčbou dokumentují obr. 6, 7, 12, 13. Ta byla zahájena 23. června 2005 interferonem alfa (Introna) a zoledronátem (Zometa). Pacient má po celou dobu normální funkci ledvin, takže nebylo nutné podle ní upravovat dávky léků.
Zoledronát
Indikací pro léčbu zoledronátem byly osteolytické destrukce kostí způsobené angiomatózními hmotami. Zoledronát byl po celou dobu podáván ve standardní dávce 4 mg nitrožilní infuzí v intervalech 28 týdnů po dobu prvních čtyř let. Od pátého roku jsme změnili dávkování na 1× za 2 měsíce. Bolesti kostí vymizely po 2 měsících léčby zoledronátem a po dobu 5 let jsme nepozorovali žádné nežádoucí účinky zoledronátu.
Interferon alfa
Interferon alfa (Introna) byl zpočátku podáván v dávce 6 milionů jednotek 3× týdně. Po prvních potížích byla tato dávka interferonu alfa tolerována po několik měsíců relativně dobře, ale s postupem času se intenzita nežádoucích účinků (nechuť k jídlu, fatigue, deprese) zintenzivnila natolik, že po 10 měsících bylo nutné dávku interferonu alfa snížit na 3 miliony jednotek 3× týdně. Tuto dávku interferonu nemocný snášel zpočátku dobře, ale s postupem času se i tato dávka ukázala jako problematická a zatěžující (tab. 2).
V průběhu léčby, v září 2005, se objevila život ohrožující hematemeza. Mladý muž byl přijat na jednotku intenzivní péče. Konzervativní léčba nevedla k zastavení krvácení, proto bylo přistoupeno k angiografii a embolizaci žaludeční tepny. První MRI vyšetření mediastina bylo provedeno 26. 8. 2005 (obr. 14, 15) a první kontrolní CT vyšetření dne 17. 10. 2005 s nálezem mírné regrese patologické infiltrace (obr. 8, 9).
Obr. 8, 9. CT vyšetření břicha po intravenózní aplikaci jodové kontrastní látky ze dne 17. 10. 2005 – po zahájení léčby. Patrna je regrese retroperitoneální infiltrace (šipka), která se zmenšila z hlediska objemu, její denzity však zůstávají nezměněné. 
Tab. 2. Hodnoty koagulačních parametrů a krevního obrazu před léčbou a v průběhu léčby. 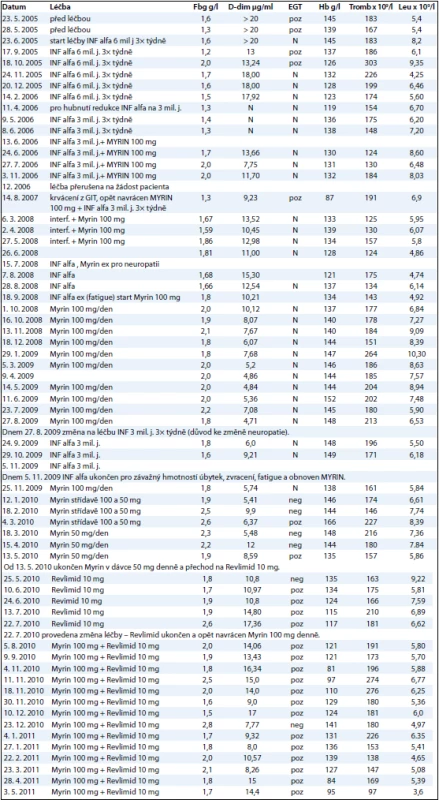
Fbg = fibrinogen (normální hodnoty 1,88–3,5 g/l); D-Dim = D-dimery (normální hodnoty 0,0–0,50 μg/ml); EGT = etanolgelifikační test, prokazující solubilní fibrinové monomery, Hb = hemoglobin (normální hodnota 130–176 g/l); Tromb = trombocyty (normální hodnota 150–350 x 109); Leu = leukocyty (normální hodnota 4–10 x 109) INF alfa = interferon alfa Při kontrolním vyšetření bylo patrné pouze částečné zmenšení rozsahu patologických hmot na CT zobrazení dutiny břišní a hrudní. Bolesti kostí však ustaly velmi záhy, již po dvou měsících.
Thalidomid (Myrin)
Vzhledem k malému účinku léčby interferonem alfa a nutnosti snížit jeho dávku z 6 na 3 miliony jednotek jsme zvažovali, kterým dostupným lékem potencovat tuto léčbu. Po domluvě s pacientovou zdravotní pojišťovnou byl od června 2006 přidán další lék s prokázaným inhibičním vlivem na angiogenezu – thalidomid (Myrin), v dávce 100 mg denně.
Jak interferon alfa, tak thalidomid mají nežádoucí účinky, které se zintenzivňují v závislosti na délce léčby. Interferon alfa byl zpočátku dobře tolerován i v dávce 6 milionů jednotek, posléze pro výrazný úbytek hmotnosti, patologickou únavu (fatigue) a depresi musel být snížen na 3 miliony jednotek. Postupně se nežádoucí účinky i této dávky staly nesnesitelnými. Stejně tak thalidomid (Myrin), zpočátku velmi dobře tolerovaný, začal být po měsících léčby problematický kvůli postupnému zhoršování neuropatie.
Proto, jak je zřetelné z přehledné tab. 2, dávky i složení léčby se v čase měnily dle převládajících nežádoucích účinků toho či onoho preparátu. Pro nežádoucí účinky 100 mg thalidomidu jsme začali testovat nižší dávky: střídání 100 a 50 mg/den a posléze 50 mg/den. Při snížení dávky thalidomidu se však začaly postupně zvyšovat hodnoty D-dimerů.
Lenalidomid 10 mg v monoterapii
V květnu roku 2010 jsme pro výrazné nežádoucí účinky (závažná neuropatie) přerušili podávání thalidomidu a přešli jsme na aplikaci lenalidomidu (Revlimid), který má také výrazný inhibiční vliv na angiogenezi, nezpůsobuje však neuropatii. Zvolili jsme nejnižší dostupnou dávku, 10mg tablety 1× denně, ve stejném schématu jako u mnohočetného myelomu v rámci udržovací léčby, tedy denní podávání10 mg/den po dobu 3 týdnů s týdenní pauzou před další dávkou lenalidomidu.
Intenzita neuropatických potíží po změně léčby – nahrazení thalidomidu preparátem lenalidomid – poklesla.
Lenalidomid v kombinaci s thalidomidem
Protože ke konci monoterapie lenalidomidem se mírně navýšila hodnota D-dimerů a také nepatrně poklesla koncentrace hemoglobinu, rozhodli jsme se pro kombinovanou léčbu thalidomidem v nízké dávce 50 mg denně s lenalidomidem. Oba léky se shodují v tom, že mají antiantiogenní působení, ale jejich nežádoucí účinky jsou různé. Tolerance této léčby byla dobrá. Při uvedené dávce nedocházelo k žádnému poklesu neutrofilů, pacient subjektivně tuto léčbu snášel dobře a díky ní byl jeho stav dlouhodobě stabilizovaný až do poslední kontroly počátkem května 2011.
Hodnocení účinku léčby
CT a MRI vyšetření
Rozsah angiomatózních hmot je viditelný na MRI i na CT zobrazení mediastina a břišní dutiny. Vyhodnocení dosažené léčebné odpovědi bylo provedeno měsíc po jejím ukončení, v lednu 2007 (obr. 10, 11, 16, 17). Byla prokázána výrazná regrese patologických tkání v břišní dutině a v mediastinu na pouhé reziduální hmoty. Pro hodnocení léčebné odpovědi u angiomatózy jsme nenalezli kritéria. Pokud bychom se vyjadřovali v termínech používaných u solidních nádorů, lze dle zobrazovacích vyšetření hodnotit léčebný efekt jako parciální remisi nemoci; kompletní remise nebylo dosaženo, protože rezidua byla stále zřetelná, i když již nevelká. Vzhledem k mnohočetnosti ložisek není možné hodnotit míru zmenšení v procentech a přesná kvantifikace míry zmenšení všech ložisek není tedy možná.
Obr. 10, 11. CT vyšetření břicha po intravenózní aplikaci jodové kontrastní látky ze dne 29. 1. 2007 – po léčbě – již jen zcela minimální rezidua patologických hmot v retroperitoneu (šipka), a to především paraaortálně vpravo v úrovni hlavy pankreatu. 
PET/CT vyšetření s nitrožilním podáním kontrastu
O přínosu PET/CT pro diagnostiku angiomatózy nejsou žádné publikace. CT komponenta PET/CT vyšetření umožňuje velmi dobře detekovat četné hemangiomy patrné v obratlích hrudní páteře (v obratlích Th7-8, Th10-12) a v bederní páteři (v obratlích L4-S1) a dále v levé kosti kyčelní. PET komponenta PET/CT vyšetření detekuje v místech s destrukcí kosti hemangiomy se sníženou akumulací fluorodeoxyglukózy. Míra akumulace fluorodeoxyglukózy je v místech postižení obratlů hemangiomovými hmotami nižší, než je normální (fyziologická) akumulace fluorodeoxyglukózy v nepostižených obratlích (obr. 18).
Dále při PET/CT zobrazení jsou viditelné nepravidelné (cárovité) hypodenzní (hemangiomatózní) infiltráty prostupující mediastinem, břišní dutinou; jsou viditelné v jaterním hilu a prostupují kaudálně celé retroperitoneum. Metabolická aktivita tohoto infiltrátu (míra akumulace fluorodeoxyglukózy) je srovnatelná s pozadím obr. 19. Lze tedy říct, že ani kostní postižení, ani infiltrát v mediastinu, retroperitoneu nevykazovaly patologicky zvýšenou akumulaci fluorodeoxyglukózy, kterou běžně vídáme u většiny ložisek maligní etiologie.
Obr. 12, 13. CT vyšetření hrudníku po intravenózní aplikaci jodové kontrastní látky ze dne 6. 5. 2005 – před zahájením léčby – hypodenzní patologická infiltrace mediastina retrosternálně, paratracheálně a subkarinálně (šipky), která má stejné denzitní charakteristiky jako infiltrace v retroperitoneu. 
Obr. 14, 15. MR vyšetření mediastina ze dne 26. 8. 2005, T1 vážený obraz v sagitální (obr. 14) a koronární (obr. 15) rovině – po zahájení léčby – patologická tkáň v předním mediastinu retrosternálně má v T1 smíšeně nízký signál a je jednoznačně ohraničena oproti okolnímu tuku (šipka). Oboustranná infiltrace paravertebrálně navazuje na obratlová těla, která mají abnormální strukturu (Th 8, 10, 12), což je obraz hemagiomatózy postihující skelet i měkké tkáně. 
Laboratorní známky aktivity procesu
Intenzivní proliferace angiomatózních struktur je spojená s tvorbou specifických působků, například vaskulárního endoteliálního růstového faktoru (VEGF). Tyto hodnoty však nejsou rutinně vyšetřovány. Proliferace angiomatózních struktur však způsobuje diseminovanou intervaskulární koagulaci (DIK) s následným snížením hodnot fibrinogenu, výrazným navýšením hodnot D-dimerů a přítomností solubilních fibrinových monomerů. V závažných případech dojde i k poklesu počtu trombocytů.
Tento chronicky probíhající DIK v angiomatózních masách není ovlivnitelný aplikací heparinu, jak popisuje literatura a jak jsme ověřili u tohoto pacienta. Aplikace nízkomolekulárního heparinu vůbec tyto hodnoty neovlivnila, zůstávaly stejné jak během jeho podávání, tak i po ukončení jeho aplikace.
Obr. 16, 17. CT vyšetření hrudníku po intravenózní aplikaci jodové kontrastní látky ze dne 1. 2. 2007 – po léčbě – patrná je podstatná regrese mediastinálních infiltrátů subkarinálně, s pouze malými reziduy paratracheálně. 
Patologické hodnoty koagulace však byly ovlivnitelné léky inhibujícími angiogenezu, jak vyplývá z tab. 2.
Při úspěšné léčbě interferonem alfa (Introna) a thalidomidem (Myrin) se snížily hodnoty D-dimerů (stanovené testem STA LIATEST DDI firmy Stago), zvýšila se hodnota fibrinogenu a vymizely fibrinové monomery prokazované etanolgelifikačním testem. Zároveň se stabilizovala hodnota hemoglobinu.
Uvedené koagulační parametry spolu s hodnotou hemoglobinu nyní používáme k průběžnému hodnocení aktivity jednotlivých typů léčby, byť s jistým omezením, protože organizmus člověka i onemocnění angiomatózou se vyvíjejí v čase.
Před zahájením léčby byly hodnoty D-dimerů vyšší než 20 µg/ml, hodnota fibrinogenu byla snížená na 1,4 g/l a byly prokazatelné solubilní fibrinové monomery etanolgelifikačním testem.
Při terapii interferonem alfa (Introna) v dávce 6 mil. j. 3× týdně, po 10 měsících snížené na 3 mil. j. 3× týdně byl medián koncentrace fibrinogenu 1,5 (1,2–2,0) g/l, medián hodnoty D-dimerů 17,2 (13,4–20,0) µg/ml, etanolgelifikační test nebyl vždy vyšetřen, pokud však byl vyšetřen, tak zůstával pozitivní. První léčba interferonem probíhala od 23. 6. 2005 až do 13. 6. 2006.
Při monoterapii thalidomidem (Myrin) v dávce 100 mg (18. 9. 2008 až 27. 8. 2009) byl medián hodnoty D-dimerů 6,07 (4,71–10,21) µg/ml, medián hodnoty hemoglobinu 144 g/l, medián hodnoty fibrinogenu 1,9 g/l, etanolgelifikační test nebyl prováděn.
Při použití 50 mg Myrinu (18. 3. 2010 až 13. 5. 2010) je zřetelné postupné narůstání hodnot D-dimerů.
Při použití lenalidomidu (Revlimid) v dávce 10 mg došlo ke zvýšení hodnoty D-dimerů na medián 10,8 (10,8––17,35) µg/ml a poklesla hodnota hemoglobinu, medián 124 (117–135) g/l. Byl pozitivní průkaz fibrinových monomerů etanolgelifikačním testem.
Při léčbě kombinací thalidomidu (50 mg denně) a lenalidomidu (10 mg 1.–21. den ve 28denních cyklech) byl pacient stabilní po dobu 9 měsíců. Medián koncentrace hemoglobinu se zvýšil na 131 (84–141) g/l. Medián hodnoty D-dimerů se snížil na 9,3 (8,0–17) µg/ml. Vše uvedené shrnuje tab. 2.
Obr. 6. PET/CT vyšetření s podáním i.v. kontrastu provedené v září 2010. Jsou patrny četné hemagiomy patrné v obratlích Th (Th7,8 a Th10-12) a LS (L4-S1) páteře a levé kosti kyčelní, v těchto místech detekujeme sníženou metabolickou aktivitu, která nedosahuje ani fyziologické aktivity v okolních nepostižených obratlích (obr. 18). 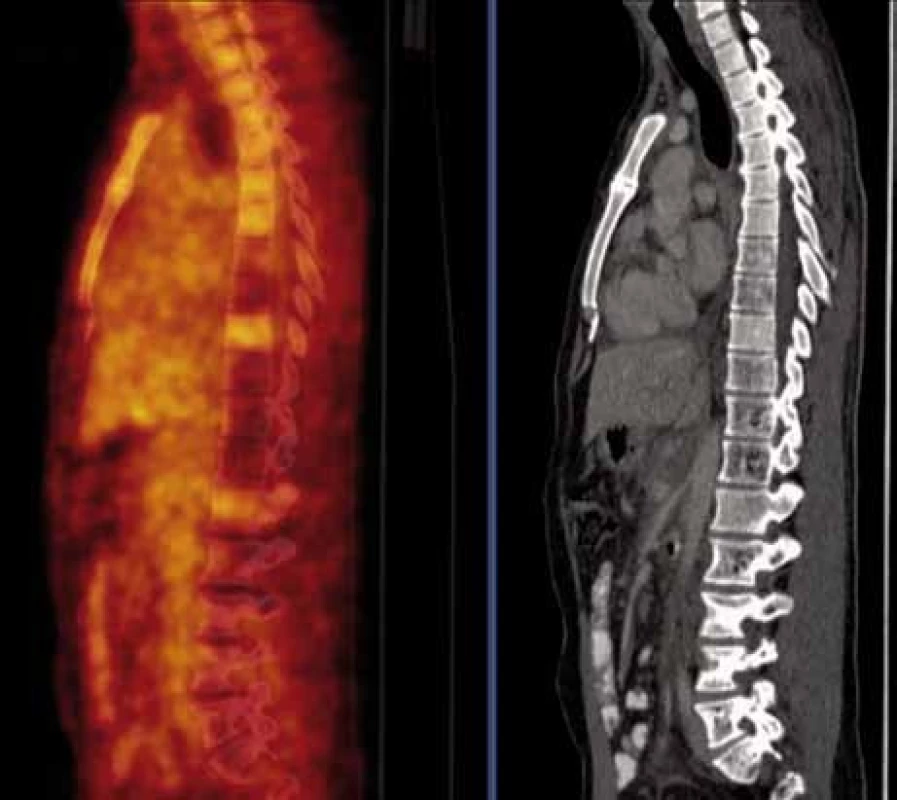
Diskuze
Mnohočetná angiomatóza diagnostikovaná v dospělosti je velmi vzácným onemocněním, o němž lze získat informace z popisu případů, nikoliv z klinických studií. Údaje o incidenci mnohočetné angiomatózy jsme v literatuře nenašli [1–6].
Příznaky angiomatózy
Hemangiomy mohou v dospělosti postihnout kterýkoliv orgán a projevit se v kterémkoliv věku. Expandující hemangiomy mohou způsobit jak lokální kompresi, tak destrukci okolí a mohou být zjevné jako viditelný či hmatný patologický útvar [7–11].
Pokud vzniknou významné arteriovenózní zkraty, mohou být příčinou hyperkinetického oběhu a někdy i srdečního selhání.
V případech, kdy tyto cévní neoplazie postihují dlouhé kosti a obratle, způsobují bolesti pohybového aparátu. Osteolytická ložiska patrná na rentgenovém snímku mohou připomínat mnohočetný myelom [12].
Je-li hemangiom dostatečně velký, může být příčinou permanentní lokalizované intravaskulární koagulace s konzumpcí koagulačních faktorů, snížením fibrinogenu a trvalým zvýšením D-dimerů. Někdy dochází i k sekvestraci destiček a k trombocytopenii. Klasický Kasabachův-Merittové syndrom je popisován jako hypokoagulace s deficitem trombocytů [13,14].
Nejzávažnější a vždy akutní komplikací je krvácení z hemangiomu, které může být smrtelné. V této kritické a život ohrožující situaci se ukázal přínosným rekombinantní faktor VIIa [15].
Místo angiomatózy v rámci WHO klasifikace cévních neoplazií
V tab. 3 informujeme o současné WHO klasifikaci cévních neoplazií. Rozlišuje vaskulární malformace, benigní, semimaligní a maligní vaskulární tumory. Angiosarkomy jsou velmi vzácné a vyskytují se ve věku kolem 60–70 let. Vyznačují se velmi agresivním chováním. Dříve zmiňované dělení hemangiomů na kapilární, kavernózní a smíšené ztratilo význam, protože v sobě neobsahuje prognostickou informaci. Termíny hemangiom či lymfangiom se používají pro ložiskové, dobře ohraničené procesy. V posledních letech byly popsány některé markery, které umožní odlišit proliferativní a neproliferativní hemangiomy [16,17].
Termín angiomatóza se používá pro víceložiskové a nepřesně ohraničené cévní tumory, které prorůstají více orgány a prostupují více tkáněmi.
Angiomatóza může postihovat oblast gastrointestinálního traktu, střevní stěnu, mezenterium, retroperitoneum a břišní orgány, například játra. Ačkoliv gastrointestinální angiomatóza je obvykle benigní, může být příčinou náhlého úmrtí způsobeného nezastavitelným krvácením nebo střevní obstrukcí. Kavernózní střevní hemangiomy někdy vytvářejí polyploidní útvary, postihují celé střevo, ale i okolní tkáně a orgány. Přibližně dvě třetiny případů angiomatózy jsou diagnostikovány v prvních dvou dekádách života a téměř všechny případy se projeví do 40 let [11–14,18–22] (tab. 3).
Detekce hemangiomů a angiomatózy zobrazovacími metodami
Sonografie
Hemangiomy je možné zviditelnit sonograficky, zobrazují se jako hyperechogenní noduly s nepatrným posteriorním akustickým zvýrazněním, lze je prokázat dopplerovským vyšetřením. Vzhledem k difuznímu růstu angiomatózních hmot však v tomto případě sonografické vyšetření nevedlo k rozpoznání této nemoci.
Tab. 3. Diferenciální diagnostika reaktivních a neoplastických vaskulárních lézí [7,23]. ![Diferenciální diagnostika reaktivních a neoplastických vaskulárních lézí [7,23].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/26b74a1abcac09e511d8966c8a9867f6.png)
Tab. 4. Přehled léčebných postupů použitých při léčbě hemangiomů. 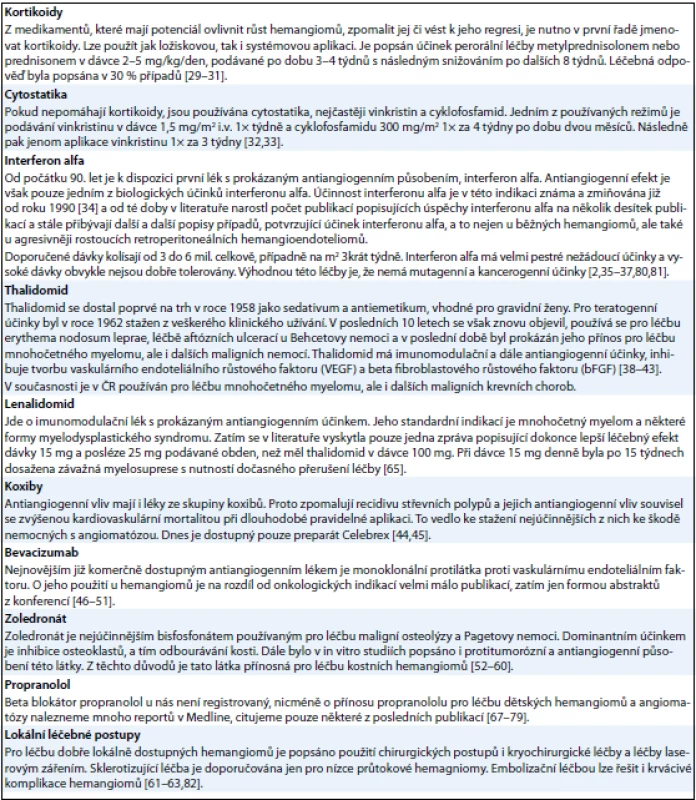
CT zobrazení
Při CT se zobrazují jako hypodenzní ložiska s denzitou odpovídající cévním strukturám, které lze potvrdit typickým sycením po aplikaci kontrastní látky (obr. 2, 6, 7, 13).
MRI zobrazení
Velmi dobře se znázorňují pomocí MRI zobrazení. V T1 váženém obraze mají hemangiomy nízkou intenzitu signálu, zatímco při T2 zobrazení vykazují vysokou intenzitu, která umožní velmi dobře odlišit hemangiomatózní struktury od ostatních orgánů [18–21,24–27].
PET/CT zobrazení
O zobrazení angiomatózy při PET/CT vyšetření není dostatek údajů. V naší kazuistice postižené obratle vykazovaly velmi nízkou metabolickou aktivitu (až výpadek aktivity neboli fotopenii), tedy výrazně nižší aktivitu než u okolních zdravých obratlů. V takovém případě byl předpoklad nálezu metabolicky neaktivní struktury. Tak nízkou aktivitu vykazují solitární hemangiomy, kostní cysty nebo nejčastěji iatrogenní útlum metabolizmu v kostní dřeni po provedené radioterapii. Většina benigních kostních tumorů vykazuje aktivitu spíše na úrovni fyziologické aktivity, tedy mohou být svou aktivitou k nerozeznání od zdravých tkání.
Obr. 7. PET/CT vyšetření s podáním i.v. kontrastu provedené v září 2010. Mediastinem, jaterním hilem a kaudálněji celým retroperitoneálním prostorem se spolu s cévami pruhovitě táhne „cárovitě“ hypodenzní (hemagiomatózní) infiltrát, jehož metabolická aktivita je srovnatelná s pozadím. Lze tedy říct, že ani kostní postižení, ani infiltrát v mediastinu, retroperitoneu nevykazoval patologickou míru konzumpce FDG, kterou běžně vídáme u většiny ložisek maligní etiologie. 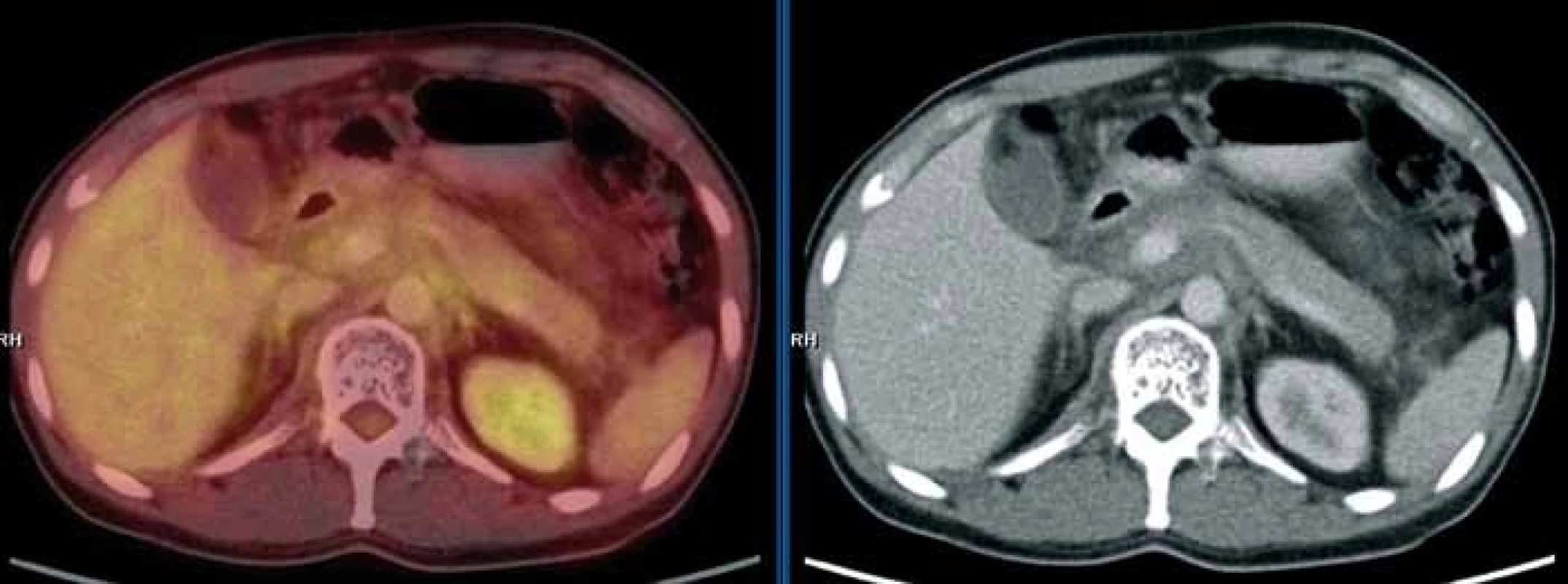
Problémy s rozpoznáním diagnózy u popisovaného pacienta
U popsaného případu mladého muže nebyly v mládí přítomny žádné kožní hemangiomy a ani při apendektomii v dětství nebyla v břišní dutině nalezena žádná patologická angiomatózní ložiska.
První příznaky mnohočetné angiomatózy způsobila destrukce obratlů a pánve pozvolně progredujícími hemangiomy, které již dva roky před operačně potvrzenou diagnózou tvořily vysoce suspektní obrazy pro tuto diagnózu na MRI zobrazení.
Logický krok ortopedů bylo provedení excize z nejasného ložiska. Odběr z lopaty kosti kyčelní byl patology mylně interpretován jako myelofibróza s podezřením na primární myelofibrózu. Musíme zdůraznit, že při odběrech malého vzorku materiálu při biopsii kosti je stanovení diagnózy angiomatózy téměř nemožné. V literatuře se uvádí, že při histologickém vyšetření kosti postižené agresivně rostoucím hemangiomem bývá v histologickém preparátu vždy výrazné fibrózní stroma, které v důsledku krvácení bývá plné depozit hemosiderinu. Pouze v případě, že se provede speciální imunohistochemie – znázornění endoteliálních povrchů pomocí přítomnosti znaků CD31 a CD34 – je možné vyslovit podezření na hemangiom [12].
První příznaky angiomatózy (bolesti kostí) a první pokus o histologickou diagnózu z kostní excize tedy nevedly k objasnění diagnózy.
Pacient však trpěl i břišním dyskomfortem, byla diagnostikována hypoalbuminemie a také hypochromní anémie. Zažívací potíže byly důvodem k opakovaným endoskopickým vyšetřením. Je zřejmé, že u pacienta dočasně docházelo nejen ke ztrátám krve a železa zažívacím traktem, ale také ke ztrátám bílkovin. Makroskopický obraz střevní sliznice byl sice abnormální, ale nedovolil žádnou jasnou diagnózu, ani biopsie sliznice nepomohla objasnit etiologii viditelných změn. Podobné komplikace popisují i další autoři [7,13,18,28,64,65]. Nicméně nemůžeme přesně vysvětlit, proč v určité době došlo k hypoalbuminemii a co přesně způsobilo změny ve střevním lumen.
V roce 2005 však byla u pacienta nalezena zvětšená uzlina v třísle. Z diagnostických důvodů byla exstirpována a následovalo CT mediastina a břicha v rámci diferenciální diagnostiky lymfadenopatie.
Překvapením byly nejasné infiltrativní změny v oblasti mediastina a břicha. Ty vedly k probatorní laparotomii a makroskopickému i histologickému stanovení diagnózy.
Léčebné postupy u hemangiomů a angiomatózy
Pro léčbu angiomatózy neexistují žádné oficiálně doporučované postupy. Informace o tom, co je možné těmto nemocným nabídnout, lze najít pouze formou popisů jednotlivých případů, v nichž je popsána léčba, které měla u jednotlivého pacienta či malého souboru pacientů nějaký efekt. Přehled publikovaných léčebných možností stručně uvádí tab. 4.
V našem případě jsme záměrně nepoužívali prednison, neboť pacient měl opakovaně život ohrožující hematemezu.
Z tohoto relativně nevelkého výběru léků s prokázaným antiangiogenním účinkem jsme vybrali interferon alfa a zoledronát.
Při první CT kontrole provedené přibližně po 5měsíční léčbě byla patrná regrese patologických hmot, ale pořád ještě byly hmoty dosti zřetelné (obr. 8, 9). Přesnější vyjádření léčebné odpovědi v procentech zmenšení patologické tkáně vzhledem k difuznosti projevů není reálné.
Co se týká kostních projevů, vedla léčba interferonem a zoledronátem k vymizení bolestí do 2 měsíců od zahájení léčby. Postižení skeletu angiomatózními hmotami je však velmi rozsáhlé, takže je nutné pokračovat v aplikaci zoledronátu i po vymizení bolestí, a to dlouhodobě. V prvních 4 letech to bylo v měsíčních intervalech, nyní ve dvouměsíčních.
Vzhledem k neúplné regresi patologických hmot jsme po 5měsíční léčbě interferonem alfa zvažovali další léčebné možnosti.
Zcela horkou novinkou je protilátka proti vaskulárnímu endoteliálnímu růstovému faktoru (anti VEGF) bevacizumab, firemním názvem Avastin. V roce 2011 jsme však v literatuře nenašli žádnou zmínku o použití tohoto léku u angiomatózy. A tak jsme do kombinace zvolili thalidomid, lék, který má také antiangiogenní působení, ale který v žádném z případů nevede ke krvácivým komplikacím.
Kombinovanou léčbu thalidomid, interferon a zoledronát měl náš mladý muž jen 6 měsíců, pak byla provedena kontrola metodou CT. Překvapujícím výsledkem bylo téměř kompletní vymizení patologických hmot na CT zobrazení. Tento excelentní nález na CT a touha mít vlastní děti vedly mladého muže k žádosti o přerušení léčby, neboť thalidomid má známé teratogenní účinky, interferon alfa sice nemá mutagenní ani teratogenní účinky, ale mimo jiné způsobuje určitou míru fatigue čili patologické únavy.
Bohužel při přerušení léčby došlo k recidivě angiomatózy do původních rozměrů. A ani ne za rok od přerušení léčby přivedla mladého muže masivní hematemeza zpět na JIP našeho pracoviště. CT potvrdilo recidivu, a tedy nutnost trvalé léčby s cílem udržet stabilitu nemoci. Nemáme zatím lék, který by ji eradikoval.
Zoledronát je tolerován excelentně a bez problémů. Původní dávka interferonu alfa musela být pro patologickou únavu (fatigue), úbytek hmotnosti a depresi snížena ze 6 mil. jednotek na 3 mil. jednotek. Ale i dávka 3 miliony jednotek vedla po více měsících k tak intenzivním nežádoucím účinkům, že bylo nutné jej vynechat. Thalidomid v dávce 100 mg dlouhodobě udržel stabilitu nemoci. Ale v průběhu této léčby se zintenzivňují jeho nežádoucí účinky – zhoršují se nepříjemné projevy neuropatie, a tak jsme zkusili snížit dávku na 50 mg/den. Při této dávce však začala narůstat koncentrace D-dimerů a z toho usuzujeme, že thalidomid v této dávce nemá potenciál dlouhodobě udržet stabilní angiomatózu bez progrese a s ní spojených krvácivých projevů. V podobném případě mnohočetných angiodysplazií střevního traktu byla nemoc zcela kontrolována dávkou 100 mg, zatímco při dávce 50 mg recidivovalo krvácení [64].
V rámci akce CUP jsme mohli otestovat vliv lenalidomidu na tuto nemoc. Lenalidomid je derivát odvozený od thalidomidu, který má na angiogenezu podobné inhibiční účinky jako thalidomid, ale liší se nežádoucími účinky. Zatímco u thalidomidu je převažujícím nežádoucím účinkem neurotoxicita, je u lenalidomidu převažujícím nežádoucím účinkem myelosuprese, zatímco neurotoxicitu tento lék nevyvolává. Zvolili jsme nejnižší dostupné dávkování lenalidomidu 10 mg denně. Tato dávka je standardně používána u pacientů s mnohočetným myelomem v rámci udržovací léčby. V rámci indukční léčby se však u mnohočetného myelomu podává 25 mg denně po 3 týdny s týdenní pauzou před dalším cyklem. Tuto vyšší dávku jsme nepoužili z obavy, aby její dlouhodobé podávání nevedlo k myelosupresi. Našemu pacientovi jsme tedy po seznámení a podepsání informovaného souhlasu s aplikací registrovaného léčiva a nestandardní indikací podali lenalidomid (Revlimid) v dávce 10 mg.
Při použité dávce lenalidomidu se však postupně zvyšovaly hodnoty D-dimerů, a že toto zvyšování hodnoty D-dimerů je klinicky signifikatní, jsme usoudili z poklesu hodnoty hemoglobinu, který byl s vysokou pravděpodobností způsoben krevními ztrátami, a ne myelosupresivním vlivem lenalidomidu, protože hodnoty leukocytů a trombocytů se při používání lenalidomidu oproti hodnotám v době užívání thalidomidu nijak signifikantně neměnily. Při Myrinu 100 mg denně byl medián počtu leukocytů 7,57 (4,92–10,3) × 109/l a trombocytů 144 (143–213) × 109/l, při lenalidomidu byl medián počtu leukocytů 6,89 (5,81–9,22) × 109/l a trombocytů 166 (163–210) × 109/l.
Z této zkušenosti soudíme, že lenalidomid (Revlimid) v dávce 10 mg není u této nemoci tak účinný jako Myrin v dávce 100 mg.
Ve světovém písemnictví jsme našli pouze jednu zprávu o úspěšném podání lenalidomidu v indikaci mnohočetného postižení střeva hereditární hemorrhagickou teleangiodysplazií. V této zprávě se udává, že léčbu zahájili 10 mg lenalidomidu, které postupně zvýšili na 15 mg denně. Po 15 týdnech museli tuto léčbu přerušit pro cytopenii a po úpravě krvetvorby přešli na dávku 15 mg a posléze 25 mg ob den a uvádějí, že při této dávce lenalidomidu má pacient menší krevní ztráty než při 100 mg thalidomidu [65]. Dále se lenalidomid osvědčil u další nemoci z této skupiny chorob – u multifokálního epiteloidního hemangioendoteliomu [66].
Vzhledem k pozitivním zahraničním zkušenostem s lenalidomidem u angiomatózy jsme u tohoto pacienta přistoupili ke kombinované léčbě thalidomid (v redukované dávce 50 mg denně) a lenalidomid (10 mg 1.–21. den ve 28denních cyklech). Oba léky se shodují v žádoucím antiangiogenním účinku, ale mají odlišné nežádoucí účinky. Od zahájení této kombinované léčby v září 2010 až do poslední kontroly počátkem května 2011 byl pacient stabilní, bez známek krvácení až do května roku 2011. Kombinovaná léčba thalidomidem a lenalidomidem představuje nový léčebný postup u pacientů s mnohočetnou angiomatózou.
Závěr
Mnohočetná angiomatóza je agresivní, byť nemaligní cévní onemocnění. Pro léčbu byl standardně používán prednison a interferon alfa. V případě opakované hematemezy nejsou glukokortikoidy bezpečné. Kombinace interferonu alfa se zoledronátem a thalidomidem však vedla k objektivní léčebné odpovědi dle CT zobrazení a dle poklesu hodnoty D-dimerů a ke vzestupu koncentrace fibrinogenu.
Dle koagulačních parametrů, které vypovídají o intenzitě diseminované intravaskulární koagulace, lze za velmi účinnou léčbu považovat thalidomid v dávce 100 mg, při nižší dávce již docházelo k nárůstu těchto parametrů.
Interferon alfa v dávce 6 mil. jednotek 3× týdně, po čase redukované na 3 miliony jednotek 3× týdně, je dle uvedených parametrů méně účinný než thalidomid, byť příznivý účinek monoterapie interferonem alfa je nesporný.
Při léčbě lenalidomidem (Revlimid) v dávce 10 mg 1.–21. den ve 28denních cyklech došlo k postupnému vzestupu hodnoty D-dimerů a poklesu koncentrace hemoglobinu, z čehož usuzujeme, že lenalidomid (Revlimid) v dávce 10 mg denně má u této nemoci menší efekt než thalidomid 100 mg denně.
Léčba kombinací lenalidomidu (10 mg denně 1.–21. den ve 28denních cyklech) a thalidomidu (v redukované dávce 50 mg denně) vedla ke stabilizaci nemoci.
Poděkování
Léčba pacienta se uskutečnila za laskavé podpory firmy Celgene s.r.o. z projektu Compassionate Use Program, určeného pro pacienty se vzácnými hematoonkologickými onemocněními.
Tato publikace vznikla v rámci aktivit následujících grantů: grantu IGA ČR NT 12215-4 a dále pak grantů MŠMT MSM0021622434, LC06027 a grantů IGA MZd ČR NT11154, NT12130, NT12215, NS10408 a výzkumného záměru MZd ČR FUNDIN MZ0MOU2005.
This publication was prepared as a part of the Internal Grant Agency of the CR grants NT 12215-4, the Ministry of Education, Youth and Sports of the CR grants MSM0021622434, LC06027 and the Ministry of Health of the Czech Republic’s Internal Grant Agency grants IGA MZd NT11154, NT12130, NT12215, NS10408 and research programme FUNDIN MZ0MOU2005.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
prof. MUDr. Zdeněk Adam, CSc.
Interní hematoonkologická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: z.adam@fnbrno.cz
Obdrženo: 29. 11. 2010
Přijato: 3. 7. 2011
Zdroje
1. Haggstrom AN, Drolet BA, Baselga E et al. Hemangioma Investigators Group. Prospective study of infantile hemangiomas: demographic, prenatal and perinatal characteristics. J Pediatr 2007; 150(3): 291–294.
2. Kalousová J. Komplexní léčba hemangiomatózy jater. Čes Slov Pediat 1994; 49(11): 698–699.
3. Bláhová K, Mottl M, Tůma S. Hemangiomatóza jater u tříměsíčního kojence. Čes Slov Pediat 1991; 46 : 434–436.
4. Mottl H, Koutecký J, Buncová M et al. Sdružený výskyt preaurikulárního hemangiomu s hemangiomatózou tenkého střeva a mesenteria. Čes Slov Pediat 1985; 40 : 523–526.
5. Mottl H. Teleangiektatický hemangiom: Difúzní hemangiomatóza mesenteria a střeva. Čes Slov Pediat 1985; 40 : 523–526.
6. Srbová J. Hemangiomatóza. Sestra 2005; 15(1): 46.
7. Langner C, Thonhofer R, Hagenbarth K et al. Diffuse Hämangiomatose von Leber und Milz bei Erwachsenen. Pathologe 2001; 22(6): 424–428.
8. Ito K, Ichiki T, Ohi K et al. Pulmonary capillary hemangiomatosis with severe pulmonary hypertension. Circ J 2003; 67(9): 793–795.
9. Kawasaki K, Ito T, Tsuchiya T et al. Is angiomatosis an intrinsic pathohistological features of massive osteolysis? Report of an autopsy case and review of the literature. Virchows Arch 2003; 442(4): 400–406.
10. Dufau JP, Tourneau A, Audouin J et al. Isolated diffuse hemangiomatosis of the spleen with Kasabach-Merrit-like syndrome. Histopathology 1999; 35(4): 337–344.
11. Kairi-Vassilatou E, Grapsa D, Kontogianni-Katsarou K et al. Clinicopathological features of unusual vascular leasions of the pelvis, retroperitoneum and colon in females: a report of five cases and review of the literature. Eur J Gynaecol Oncol 2006; 27(3): 250–255.
12. Bölke E, Gripp S, Peiper M et al. Multifocal epithelia hemangioendotelioma: a case report of a clinical chemeleon. Eur J Med Res 2006; 11 : 1–15.
13. Marinis, A, Kairi E, Theodosopoulos T et al. Right colon and liver hemangiomatosis: a case report and review of literature. World J Gastroenterol 2006; 12(39): 6405–6407.
14. Moon WS, Yy HC, Lee JM et al. Diffuse hepatic hemangiomatosis in an adult. J Korean Med Sci 2000; 15(4): 471–474.
15. Blatný J, Štěrba J, Magnová O. Léčba život ohrožujícího krvácení u kojence s hemangiomatózou a s projevy Kasabacha-Merritové pomocí rekombinantního faktoru VIIA. Čes Slov Pediat 2002; 57(7): 401–402.
16. Werner JA, Eivazi B, Folz BJ et al. State of the Art zur Klassifikation, Diagnostik und Terapie von zervikofazialen Hämangiomen und vaskulären Malformationen. Laryngorhinootologie 2006; 85(12): 883–891.
17. Neuman J, Rosioreanu A, Schuss A et al. Radiology-pathology conference: sclerosing hemangioma of the lung. Clin Imaging 2006; 30(6): 409–412.
18. Levy AD, Abbott RM, Rohrmann CA Jr et al. Gastrointestinal hemangiomas: imaging findings pathologic correlation in pediatric and adult patients. AJR Am J Roentgenol 2001; 177(5): 1073–1081.
19. Scafidi DE, McLeary MS, Young LW. Diffuse neonatal gastrointestinal hemangiomatosis: CT finding. Pediatr Radiol 1998; 28(7): 512–514.
20. Hsu RM, Horton KM, Fishman EK. Diffuse cavernous hemangiomatosis of the colon: findings on three-dimensional CT colonography. AJR Am J Roentgenol 2002; 179(4): 1042–1044.
21. Djouhri A, Arrivé L, Bouras T et al. Diffuse cavernous hemangioma of the rectosigmoid colon: imaging findings. J Comput Assist Tomogr 1998; 22(6): 851–855.
22. Lyon DG, Mantia AG. Large-bowel hemangiomas. Dis Colon Rectum 1984; 27(6): 404–414.
23. Weiss SW, Goldblum JR. Enzinger and Weiss’s Soft Tissue Tumors. 4th ed. Philadelphia, PA: Mosby 2001 : 891–914.
24. Bank ER, Hernandez RJ, Byrne WJ. Gastrointestinal hemangiomatosis in children: demonstration with CT. Radiology 1987; 165(3): 657–658.
25. Park DD, Ricketts RR. Infantile gastrointestinal hemangioma as a couse of chronic anemia. South Med J 1992; 85(2): 201–203.
26. Caseiro-Alves F, Brito J, Araujo AE et al. Liver haemangioma: common and uncommon findings and how to improve the differential diagnosis. Eur Radiol 2007; 17(6): 1544–1554.
27. Goodman P, Dominquez R, Castillo M. Diffuse neonatal hemagniomatosis: imaging finding in two patients. Comput Med Imaging Graph 1992; 16(2): 117–120.
28. Lin CH, Hsieh HF, Yy JC et al. Spontaneous rupture of a large exogastric hemangioma complicated by hemoperitoneum and sepsis. J Formos Med Assoc 2006; 105(12): 1027–1030.
29. Mulliken JB, Boon LM, Takahashi et al. Pharmacologic therapy for endangering hemangiomas. Curr Opin Dermatol 1995; 2 : 109–113.
30. Hasan Q, Tan ST, Gush J et al. Steroid therapy of a proliferating hemangioma: histochemical and molecular changes. Pediatrics 2000; 105(1 Pt 1): 117–120.
31. Uysal KM, Olgun N, Erbay A et al. High-dose oral methylprednisolone therapy in childhood hemangiomas. Pediatr Hematol Oncol 2001; 18(5): 335–341.
32. Hurvitz SA, Hurvitz CH, Sloninsky L et al. Successful treatment with cyclophosphamide of life-threatening diffuse hemangiomatosis involving the liver. J Pediatr Hematol Oncol 2000; 22(6): 527–532.
33. Gottschling S, Schneider G, Meyer S et al. Two infants with life-threatening diffuse neonatal hemangiomatosis treated with cyclophosphamide. Pediatr Blood Cancer 2006; 46(2): 239–242.
34. White CW. Treatment of hemangiomatosis with recombinant interferon alpha. Semin Hematol 1990; 27 (3 Suppl 4): 15–22.
35. Takahashi A, Ogawa C, Kanazawa T et al. Remission induced by interferon alpha in a patient with massive osteolysis and extension of lymph-hemangiomatosis: a severe case of Gorham-Stout syndrome. J Pediatr Surg 2005; 40(3): E47–E50.
36. Nevolová P, Bláhová K, Kabelka Z. Úspěchy léčby rozsáhlé hemangiomatózy u 17měsíčního dítěte po podání interferonu alfa. Ref Výběr Dermatovenereol 1996; 2 : 83.
37. Harper L, Michael JL, Enjolras O et al. Successful management of a retroperitoneal kaposiform hemangioendothelioma with Kasabach-Merritt phenomenon using alpha-interferon. Eur J Pediatr Surg 2006; 16(5): 369–372.
38. D’Amato RJ, Loughnan MS, Flynn E et al. Thalidomide is an inhibitor of angiogenesis. Proc Natl Acad Sci USA 1994; 91(9): 4082–4085.
39. Kenyon BM, Browne F, D’Amato RJ. Effects of thalidomide and related metabolites in a mouse corneal model of neovascularization. Exp Eye Res 1997; 64(6): 971–978.
40. Or R, Feferman R, Shoshan S. Thalidomide reduces vascular density in granulation tissue of subcutaneously implanted polyvinyl alcohol sponges in quinea pigs. Exp Hematol 1998; 26(3): 217–221.
41. Bauer KS, Dixon SC, Figg WD. Inhibition of angiogenesis by thalidomide requires metabolic activation, which is species dependent. Biochem Pharmacol 1998; 55(11): 1827–1834.
42. Rajkumar SV, Witzig TE. A review of angiogenesis and antiangiogenic therapy with thalidomide in multiple myeloma. Cancer Treat Rev 2000; 26(5): 351–362.
43. Vacca A, Scavelli C, Montefusco V et al. Thalidomide downregulates angiogenic genes in bone marrow endothelial cells of patients with active multiple myeloma. J Clin Oncol 2005; 23(23): 5334–5346.
44. Ma L, del Soldato P, Wallace JL. Divergent effects of new cyclooxygenase inhibitors on gastric ulcer healing: Shifting the angiogenic balance. Proc Natl Acad Sci USA 2002; 99(20): 13243–13247.
45. Masferrer JL, Leahy KM, Koki AT et al. Antiangiogenic and antitumor activities of cyclooxygenase-2 inhibitors. Cancer Res 2000; 60(5): 1306–1311.
46. Gilheeney SW, Scott, RM, Turner C et al. Treatment of Von Hippel Lindau associated hemangioblastoma in pediatric patients with bevacizumab (Avastin). Neurolo-Oncology 2007; 9(2): Abstract 168.
47. Nelson SC, Bostrom BC. Successful use of bevacizumab in life threatening steroid-resistant infantile hepatic hemangioendotelioma. Pediatr Blood Cancer 2007; 48: Abstract 611.
48. Ramasamy-Karthik Stehen L, Jackie C et al. Bevacizumab for POEMS syndrome. Blood 2006; 108(11 part 2): Abstract 366B.
49. Ziemssen F, Voelker M, Inhoffen W et al. Combined treatment of juxtapapillary retinal capillary haemagnioma with intravitreal bevacizumab and photodynamic therapy. Eye 2007; 21(8): 1125–1126.
50. von Buelow M, Pape S, Hoerauf H. Systemic bevacizumab treatment of a juxtapappillary retinal haemangioma. Acta Ophthalmol Scand 2007; 85(1): 114–116.
51. Meyerle CB, Freund KB, Iturralde D et al. Intravitreal bevacizumab (Avastin) for retinal angiomatous proliferation. Retina 2007; 27(4): 451–457.
52. Li EC, Davis LE. Zoledronic acid: a new parenteral bisphosphonate. Clin Ther 2003; 25(11): 2669–2708.
53. Wood JM, Bonjean K, Ruetz S et al. Novel antiangiogenic effects of the bisphosphonate compound zoledronic acid. J Pharmacol Exp Ther 2002; 302(3): 1055–1061.
54. Hasmim M, Bieler G, Rüegg C. Zoledronate inhibits endothelial cell adhesion, migration and survival through the suppression of multiple, prenylation-dependent signaling pathways. J Thromb Haemost 2007; 5(1):166–173.
55. Bellahcène A, Chaplet M, Bonjean K et al. Zoledronate inhibits alphavbeta3 and alphavbeta5 integrin cell surface expression in endothelial cells. Endothelium 2007; 14(2): 123–130.
56. Giraudo E, Inoue M, Hanahan D. An amino-bisphosphonate targets MMP-9–expressing macrophages and angiogenesis to impair cervical carcinogenesis. J Clin Invest 2004; 114(5): 623–633.
57. Croucher PI, De Hendrik R, Perry MJ et al. Zoledronic acid treatment of 5T2MM-bearing mice inhibits the development of myeloma bone disease: evidence for decreased osteolysis, tumor burden and angiogenesis, and increased survival. J Bone Miner Res 2003; 18(3): 482–492.
58. Fournier P, Boissier S, Filleur S et al. Bisphosphonates inhibit angiogenesis in vitro and testosterone-stimulated vascular regrowth in the ventral prostate in castrated rats. Cancer Res 2002; 62(22): 6538–6544.
59. Adam Z, Ševčík P, Vorlíček J et al. Kostní nádorová choroba. Praha: Grada 2004.
60. Wood J, Bonjean K, Ruetz S et al. Novel antiangiogenic effects of the bisphosphonate compound zoledronic acid. J Pharmacol Exp Ther 2002; 302(3): 1055–1061.
61. Loo WJ, Lanigan SW. Recent advances in laser therapy for the treatment of cutaneous vascular disorders. Lasers Med Sci 2002; 17(1): 9–12.
62. Winter H, Dräger E, Sterry W. Sclerotherapy for treatment of hemangiomas. Dermatol Surg 2000; 26(2): 105–108.
63. Geh JL, Geh VS, Jemec B et al. Surgical treatment of periocular hemangiomas: a single-center experience. Plast Reconstr Surg 2007; 119(5): 1553–1562.
64. Heidt J, Langers AM, van der Meer FJ et al. Thalidomide as treatment for digestive tract angiodysplasias. Neth J Med 2006; 64(11): 425–428.
65. Bowcock SJ, Patrick HE. Lenalidomide to control gastrointestinal bleeding in hereditary haemorrhagic telangiectasia: potential implications for angiodysplasias? Br J Haematol 2009; 146(2): 220–222.
66. Sumrall A, Fredericks R, Berthold A et al. Lenalidomide stops progression of multifocal epithelioid hemangioendothelioma including intracranial disease. J Neurooncol 2010; 97(2): 275–277.
67. Kim LH, Hogeling M, Wargon O et al. S. Propranolol: useful therapeutic agent for the treatment of ulcerated infantile hemangiomas. J Pediatr Surg 2011; 46(4): 759–763.
68. Cushing SL, Boucek RJ, Manning SC et al. Initial experience with a multidisciplinary strategy for initiation of propranolol therapy for infantile hemangiomas. Otolaryngol Head Neck Surg 2011; 144(1): 78–84.
69. Erbay A, Sarialioglu F, Malbora B et al. Propranolol for infantile hemangiomas: a preliminary report on efficacy and safety in very low birth weight infants. Turk J Pediatr 2010; 52(5): 450–456.
70. Bonanno C, Paccanaro M, Fontanellilea A. Propranolol for severe hemangioma of infancy. J Cardiovasc Med (Hagerstown) 2011; 12(1): 73.
71. Jadhav VM, Tolat SN. Dramatic response of propranolol in hemangioma: report of two cases. Indian J Dermatol Venereol Leprol 2010; 76(6): 691–964.
72. Arneja JS, Pappas PN, Shwayder TA et al. Management of complicated facial hemangiomas with beta-blocker (propranolol) therapy. Plast Reconstr Surg 2010; 126(3): 889–895.
73. Holmes WJ, Mishra A, Gorst C et al. Propranolol as first-line treatment for rapidly proliferating infantile haemangiomas. J Plast Reconstr Aesthet Surg 2011; 64(4): 445–451.
74. Truong MT, Perkins JA, Messner AH et al. Propranolol for the treatment of airway hemangiomas: a case series and treatment algorithm. Int J Pediatr Otorhinolaryngol 2010; 74(9): 1043–1048.
75. Mazereeuw-Hautier J, Hoeger PH, Benlahrech S et al. Efficacy of propranolol in hepatic infantile hemangiomas with diffuse neonatal hemangiomatosis. J Pediatr 2010; 157(2): 340–342.
76. Vanlander A, Decaluwe W, Vandelanotte M et al. Propranolol as a novel treatment for congenital visceral haemangioma. Neonatology 2010; 98(3): 229–231.
77. Löffler H, Kosel C, Cremer H et al. Propranolol therapy to treat problematic hemangiomas: a new standard therapy makes its debut. Hautarzt 2009; 60(12): 1013–1016.
78. Lawley LP, Siegfried E, Todd JL. Propranolol treatment for hemangioma of infancy: risks and recommendations. Pediatr Dermatol 2009; 26(5): 610–614.
79. Mihál V, Novák Z, Hůlková E et al. Kdy je indikována léčba infantilních hemangiomů propranololem? Pediatr Praxi 2011; 12(2): 108–110.
80. Mihál V, Michálková K Novák Z. Kapilární hemangiom sleziny. Pediatr praxi 2003; 4 : 214–216.
81. Justová E, Pazdera J Michál V. Systémové terapie interferonem u nemocných s nádory z vazoformní tkáně a infantilní fibromatózy. Čes Slov Pediat 1998; 143(2): 53–55.
82. Justová E, Mihál V, Pazdera J. Sklerotizace v terapii nádorů z vazoformativní tkáně Pediatr Praxi 2007; 3 : 173–175.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2012 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Nejasný stín na plicích – kazuistika
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Srovnávací proteomická analýza krevní plazmy pacientů s mnohočetným myelomem léčených režimy s bortezomibem
- Identifikácia molekulárnych markerov u detí s akútnou myeloblastovou leukémiou (AML)
- Editorial
- Využitie elektroimpedančnej tomografie v diagnostike karcinómu prsníka
- Výskyt malignit a dispenzarizace dárců krvetvorných buněk – výsledky sledování Hematologicko-onkologického oddělení FN Plzeň a Českého národního registru dárců dřeně
- Šestileté sledování pacienta s mnohočetnou angiomatózou postihující skelet, břišní i hrudní dutinu a stěnu trávicí trubice
- Nové možnosti vzdělávání českých chirurgů v onkochirurgii
- Erratum
- Recenze
- Tematický seznam publikací vydaných v Klinické onkologii v roce 2011
- Žilní vstupy v onkologii
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Žilní vstupy v onkologii
- Využitie elektroimpedančnej tomografie v diagnostike karcinómu prsníka
- Identifikácia molekulárnych markerov u detí s akútnou myeloblastovou leukémiou (AML)
- Šestileté sledování pacienta s mnohočetnou angiomatózou postihující skelet, břišní i hrudní dutinu a stěnu trávicí trubice
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy









