Výskyt malignit a dispenzarizace dárců krvetvorných buněk – výsledky sledování Hematologicko-onkologického oddělení FN Plzeň a Českého národního registru dárců dřeně
The Incidence of Malignancies and Surveillance of Hematopoietic Stem Cells Donors – the Results of the Haemato-Oncology Department University Hospital in Plzen (Pilsen) and Czech National Marrow Donors Registry Observation
Backgrounds:
Granulopoesis colony-stimulating factor filgrastim is used to mobilize peripheral stem cells but there are concerns regarding an elevated risk of haematological malignancies. We analyzed the incidence of malignancies and the system of haematopoietic stem cells donor surveillance.
Patients and Methods:
prospective observation of sibling donors of the Haemato-Oncology Department University Hospital in Plzen (Pilsen) and of unrelated donors of the Czech National Marrow Donors Registry (CNMDR) in 2001–2010.
Results:
No malignancy was observed in a group of 344 unrelated CNMDR donors, providing 753 person-years; one case of chronic lymphocytic leukaemia manifested 6 years after bone marrow donation, with leukaemia clone retrospectively detected by DNA analysis in blood samples taken prior to the marrow donation. Acute myeloid leukaemia, non-Hodgkin lymphoma, renal and colorectal carcinoma were observed in a group of 84 peripheral stem cells sibling donors, providing 337 person-years observation. The respective incidence of the two haematologic malignancies was 593 cases and the expected incidence rate was 143 per 100,000. The sibling (related) donors age was significantly higher: 48 (16–75) vs. 31 (20–42) years, (p < 0.0001). Significantly more lost-to-follow-up donors were among the related donors (32% vs. 3%, p < 0.0001), even though active surveillance system was implemented.
Conclusion:
The development of malignancies in hematopoietic stem cells donors can naturally be expected. Related (sibling) donors are at higher risk because of their generally older age, and higher susceptibility to haematological malignancies developed within the family. The contribution of filgrastim exposure needs to be further investigated. The follow-up cooperation with related (sibling) donors is limited.
Key words:
filgrastim – incidence – grafts donors – acute myeloid leukaemia – lymphoma
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Submitted:
30. 6. 2011
Accepted:
23. 8. 2011
Autoři:
S. Vokurka; V. Koza; A. Jungová; J. Navrátilová; T. Svoboda; P. Jindra; K. Steinerová; M. Hrabětová; R. Výrutová; L. Novák
Působiště autorů:
Hematologicko-onkologické oddělení, FN Plzeň
Vyšlo v časopise:
Klin Onkol 2012; 25(1): 42-46
Kategorie:
Původní práce
Souhrn
Východiska:
Růstový faktor granulopoézy filgrastim je využíván jako mobilizační prostředek před odběry periferních krvetvorných buněk a vedou se polemiky o riziku rozvoje hematologických malignit. Analyzovali jsme výskyt malignit a systém dispenzarizace dárců po odběrech krvetvorných buněk.
Soubor pacientů a metody:
Prospektivní sledování příbuzenských dárců Hematologicko-onkologického oddělení FN Plzeň a nepříbuzenských dárců Českého národního registru dárců dřeně (ČNRDD) v období 2001–2010.
Výsledky:
U 344 dárců ČNRDD při sledování 753 osobo-let byl zastižen pouze rozvoj chronické lymfatické leukemie u jednoho dárce kostní dřeně 6 let po odběru s tím, že retrospektivně byl klon leukemie prokázán analýzou DNA ve vzorku krve dárce již v době před odběrem dřeně. U 84 příbuzenských dárců periferních krvetvorných buněk při sledování 337 osobo-let byly zastiženy akutní myeloidní leukemie, non-hodgkinský lymfom, karcinom ledviny a kolorekta. Korespondující incidence hematologických malignit zde byla 593 případů, přičemž očekávaná incidence byla 143/100 000. Věk příbuzenských dárců byl signifikantně vyšší: 48 (16–75) vs 31 (20–42) let, (p < 0,0001). Významně více nedispenzarizovaných dárců bylo příbuzenských i při aktivním systému poodběrového sledování: 32 % vs 3 % (p < 0,0001).
Závěr:
Výskyt malignit u dárců krvetvorných buněk lze přirozeně předpokládat s tím, že u příbuzenských dárců je riziko vyšší s ohledem na jejich obecně vyšší věk. U příbuzenských dárců je nutné počítat také s obecně vyšším rizikem hematologických malignit při rodinném výskytu. Vliv filgrastimu na vývoj hematologických malignit vyžaduje další analýzy a není zatím evidentní. Spolupráce s příbuzenskými dárci v rámci dispenzarizace je omezená.
Klíčová slova:
filgrastim – incidence – dárci tkání – leukemie myeloidní akutní – lymfom
Úvod
Alogenní transplantace krvetvorných buněk jsou významnou součástí léčby hematologických malignit a akutních leukemií především. U dospělých pacientů jsou jako hlavní štěpy krvetvorných buněk využívány kostní dřeň (KD), která se odebírá dárcům v celkové anestezii z lopaty kosti kyčelní, a dále periferní krvetvorné buňky (PKB), které se odebírají dárcům prostřednictvím leukaferézy z periferní krve po předchozí stimulaci filgrastimem – růstovým faktorem granulopoézy (G-CSF, granulocyte colony-stimulating factor, Neupogen®). V souvislosti s používáním filgrastimu se objevují polemiky o možném zvýšeném riziku rozvoje hematologických malignit. Bylo zjištěno, že krátkodobá aplikace G-CSF dárcům indukovala chromozomální tetraploidii v malé části zralých myeloidních buněk v krvi [1], genetické alterace v lymfocytech [2] a aneuploidii [3]. V roce 2006 publikoval Bennett et al [4] dva případy rozvoje akutní myeloidní leukemie (AML) u příbuzenských dárců PKB, jejichž sourozenci trpěli rovněž AML, ze souboru 200 dárců stimulovaných filgrastimem. V rozsáhlé retrospektivní analýze EBMT – the European Group for Blood and Marrow Transplantation – bylo u dárců zastiženo 20 hematologických malignit (392/100 000), z nichž 8 bylo po dárcovství KD a 12 po dárcovství PKB, přičemž zjištěná incidence nepřekročila incidenci v běžné populaci v odpovídající věkové skupině, a z nepříbuzenských dárců došlo k rozvoji AML pouze u jednoho dárce KD [5]. Mezi 4 015 dárci PKB amerického registru NMDP – National Marrow Donor Program – bylo zaznamenáno 20 případů malignit bez případu leukemie nebo lymfomu [6] a bez incidencí převyšujících běžný výskyt v populaci.
Rozhodli jsme se analyzovat výsledky dispenzarizace a výskyt malignit po odběrech krvetvorných buněk u příbuzenských dárců Hematologicko-onkologického oddělení (HOO) FN Plzeň a porovnat je s nepříbuzenskými dárci Českého národního registru dárců dřeně (ČNRDD).
Metodika a soubor
Analýza dat získaných prospektivně v období 1/2001–12/2010 v rámci dispenzarizace příbuzenských (sourozeneckých) dárců krvetvorných buněk HOO a nepříbuzenských dárců registru ČNRDD.
Odběr krvetvorných buněk všech dárců probíhal v odběrovém centru HOO FN Plzeň vždy po předchozím informovaném souhlasu a lékařském vyšetření dárce a po stanovení jeho způsobilosti a únosnosti k dárcovství a odběru podle platných právních norem ČR [7] a doporučení a standard WMDA – World Marrow Donors Association [8] a JACIE//EBMT – Joint Accreditation Committee-ISCT and European Group for Blood and Marrow Transplantation [9]. Péče o dárce v rámci HOO a ČNRDD a bezpečnost medicínské a laboratorní praxe rovněž odrážely nároky legislativy ČR a požadavky WMDA a JACIE/EBMT.
Kostní dřeň (KD) byla odebírána dárcům v celkové anestezii na chirurgickém operačním sále z lopaty kosti kyčelní v množství nepřekračujícím objem 20 ml kostní dřeně a krve na 1 kg hmotnosti dárce, maximálně však 1 500 ml (předem byl dárcům zajištěn odběr autotransfuze). Periferní krvetvorné buňky (PKB) byly odebírány dárcům leukaferézou z periferní krve cestou dialyzační kanyly zavedené do femorální žíly nebo cestou periferních žil po předchozí stimulaci filgrastimem (Neupogen inj., fa Amgen) v dávce 10 µg/kg/den s.c. po dobu pěti dní před odběrem.
Po odběru byli všichni dárci poučeni o systému poodběrové dispenzarizace ve spolupráci s jednotlivými dárcovskými centry ČNRDD, HOO FN Plzeň nebo se svými praktickými lékaři podle místa bydliště a byli poučeni o vhodnosti dodržení pravidelných kontrol zdravotního stavu v základních intervalech 1 týden, 1 měsíc, 6 měsíců a 1 rok po odběru (dárci KD alespoň v intervalu 6 měsíců a 1 rok). V rámci ČNRDD bylo od roku 2005 doplněno další sledování dárců v intervalu jednoho roku po celkovou dobu 5 let. Původní systém pasivního sledování byl od roku 2003 v ČNRDD a od roku 2008 na HOO nahrazen systémem aktivním, kdy regionální dárcovská centra ČNRDD, respektive transplantační koordinátor HOO, aktivně sledují plánované termíny návštěv a dárcům je v případě potřeby připomínají. Příbuzenským dárcům HOO byl v roce 2009 navíc odeslán specifický dotazník pro doplnění informací o aktuálním zdravotním stavu.
Porovnání charakteristik souborů bylo provedeno s využitím programu GraphPad InStat a byly použity základní statistické testy Fisher’s exact two-tailed test pro kategoriální data a unpaired t-test pro data kontinuální. Rozdíly mezi skupinami byly testovány na hladině významnosti 95 % a hodnoty p < 0,05 byly považovány za statisticky významné.
Výsledky
V období 2001–2010 bylo do dispenzarizace zařazeno 137 příbuzenských dárců (45 % žen) HOO FN Plzeň, přičemž dárců KD bylo 12 s mediánem věku 33 (16–59) let a dárců PKB bylo 125 s mediánem věku 50 (16–75) let. Průběh plánované dispenzarizace nebyl dodržen z důvodu nezájmu nebo odmítnutí u 7/12 (58 %) dárců KD a 41/125 (33 %) dárců PKB. Po doplňujícím přičtení dalších dárců, kteří ještě navíc odpověděli na retrospektivní dotazník o zdravotním stavu z roku 2009, byly údaje o poodběrovém zdravotním stavu dostupné u 23 dárců KD a 84 dárců PKB, s celkovým mediánem doby sledování 6 (1–13) let, což souhrnně odpovídalo hodnotě 199 osobo-let sledování ve skupině dárců KD a 337 osobo-let u PKB příbuzenských dárců.
V období 2001–2010 bylo do krátkodobé jednoleté dispenzarizace zařazeno 360 dárců ČNRDD (29 % žen), přičemž dárců KD bylo 172 s mediánem věku 29 (19–54) let a dárců PKB 188 s mediánem věku 31 (19–55) let. Do dlouhodobé 5leté dispenzarizace bylo zařazeno celkem 127 KD a 121 PKB dárců. Dispenzarizace nebyla realizována u 6/172 (3,5 %) dárců KD a 10/188 (5 %) PKB. Celkem byly údaje o poodběrovém sledování zdravotního stavu dostupné u 166 KD a 178 PKB dárců, s celkovým mediánem doby sledování 3 (1–5) let, což souhrnně odpovídalo hodnotě sledování 309 osobo-let ve skupině dárců KD a 444 osobo--let u PKB nepříbuzenských dárců.
Statisticky signifikantně více nedispenzarizovaných dárců bylo při původním pasivním systému poodběrového sledování dárců ve srovnání s aktuálním systémem aktivním, a to jak v rámci ČNRDD, tak i HOO. Současně bylo také statisticky signifikantně více nedispenzarizovaných dárců ve skupině příbuzenských i při zajištěném aktivním systému poodběrového sledování. Přesné údaje jsou pro přehlednost uvedeny v tab. 1.
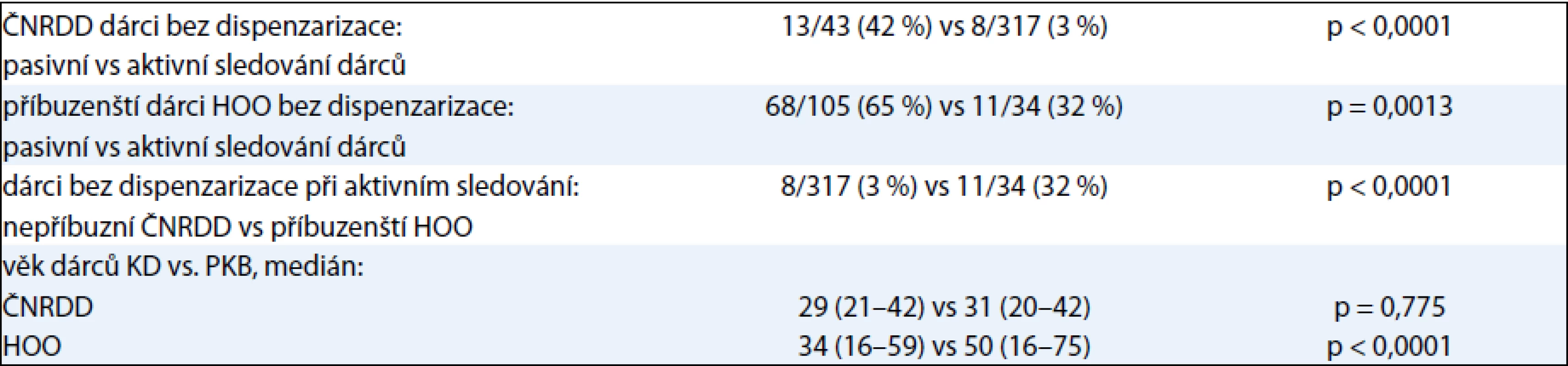
Při srovnání příbuzenských vs nepříbuzenských dárců registru byl statisticky významný rozdíl v mediánu věku [48 (16–75) vs 31 (20–42) let, p < 0,0001] a také v zastoupení žen dárkyň (45 % vs 29 %, p < 0,0001).
Ve skupině nepříbuzenských dárců ČNRDD nebyl během sledování zastižen žádný rozvoj malignity kromě případu dárce KD, u kterého došlo za šest let po odběru k manifestaci chronické lymfocytární leukemie (CLL), přičemž retrospektivní analýzou DNA byla prokázána přítomnost populace klonu CLL ve vzorcích krve dárce již v období před odběrem kostní dřeně (P. Jindra – osobní sdělení), a tento případ nelze tedy dávat do souvislosti s dárcovstvím. Žádná malignita nebyla pozorována ani v malé skupině 23 příbuzenských dárců KD.
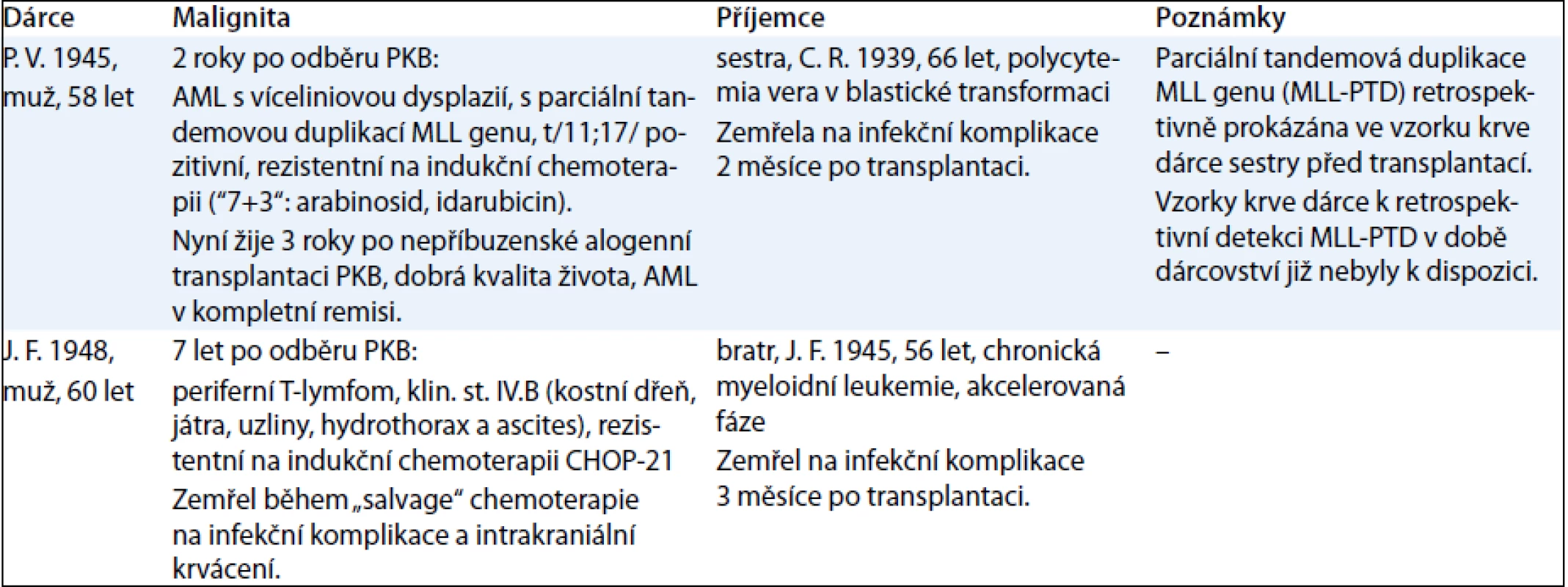
Ve skupině 84 příbuzenských PKB dárců, respektive 337 osobo-let sledování s mediánem věku 50 (16–75) let byl zastižen případ AML, non-hodgkinského lymfomu (periferní T-lymfom), karcinomu ledviny a kolorekta. Korespondující incidence dvou hematologických malignit v této skupině dárců vztažená na 100 000 osobo-let byla 593 případů, přičemž očekávaná incidence (současně onemocnění AML a non-hodgkinského lymfomu) je 143/100 000 v bělošské populaci věku 20–75 let podle údajů National Cancer Institute registru SEER [10]. Bližší údaje o hematologických malignitách, příbuzenském dárci a příjemci jsou uvedeny v tab. 2, přesnější klinicko-patologické údaje o dvou výše uvedených nehematologických malignitách nejsou k dispozici s ohledem na retrospektivní a dotazníkový charakter informace o jejich výskytu.
Diskuze
V souvislosti s používáním filgrastimu – růstového faktoru granulopoézy (G-CSF, granulocyte colony-stimulating factor, Neupogen®) – se objevují polemiky o potenciálním riziku rozvoje hematologických malignit. Dosavadní pozorování dokládají výskyt hematologických i nehematologických nádorových onemocnění jak u dárců PKB, tak i KD, přičemž zřetelně více u dárců příbuzenských, nicméně bez prokazatelné souvislosti s vlastním aktem dárcovství, respektive s aplikací filgrastimu v rámci přípravy k odběru PKB [4–6]. Za bezpečné je považováno také podávání filgrastimu při mobilizaci krvetvorných buněk periferní krve přímo u pacientů s akutní myeloidní leukemií [11].
Provedli jsme analýzu nepříbuzenských dárců z registru ČNRDD a dárců příbuzenských (sourozeneckých) z našeho pracoviště HOO FN Plzeň. Výsledky sledování je však nutné interpretovat s přihlédnutím k několika zásadním okolnostem. Soubory dárců jsou především poměrně malé a v případě dárců příbuzenských byla významná nedostupnost v poodběrovém sledování. Ve srovnání s výsledky ČNRDD je patrné, že i přes zavedení aktivního systému sledování na HOO je účast příbuzenských dárců na poodběrovém sledování značně problematická a zatížená jejich nechutí spolupracovat, převážně z psycho-sociálních důvodů, které bude vhodné samostatně sledovat a vyhodnotit.
Dalším významným faktorem, který přispívá ke zvýšenému výskytu malignit ve skupině příbuzenských dárců, je jistě také jejich vyšší věk, který souvisí s vyšším věkem jejich transplantovaných sourozenců a preferencí štěpů PKB v léčbě těchto starších pacientů, kde jsou intenzivní předtransplantační přípravné režimy nahrazeny režimy s redukovanou toxicitou (např. protokol Flu/Mel s fludarabinem a melfalanem). Přirozeně lze očekávat, že ve starší věkové skupině dárců bude i vyšší záchyt případných malignit, jak dokládají analýzy dat onkologických registrů [10,16] a českého registru akutních leukemií ALERT [12], kde je incidence akutních leukemií ve starší populaci několikanásobná ve srovnání s mladými jedinci. Při hodnocení výsledků našeho pozorování je nutné přihlédnout také k faktu, že sourozenci pacientů s hematologickými malignitami mají rovněž 2–5násobně vyšší riziko rozvoje stejného onemocnění než běžná populace [13–15], což by nejspíše odpovídalo i poměru námi zjištěné incidence s údaji očekávané incidence v populaci (593 vs 143/100 000).
Závěr
Výskyt hematologických a nehematologických malignit u dárců krvetvorných buněk lze přirozeně předpokládat s tím, že u příbuzenských dárců je riziko onemocnění vyšší s ohledem na jejich obecně vyšší věk a současně i fakt určité genetické rodinné zátěže. Vliv filgrastimu na vývoj hematologických malignit vyžaduje další analýzy, pro které bude nutné zajistit aktivní sledování na velmi početných skupinách dárců KD a PKB, příbuzenských i nepříbuzenských. K naplnění tohoto cíle bude potřebná mezinárodní spolupráce, prospektivní definované sledování a dlouhodobá dispenzarizace dárců, která je však zřetelně zatížena omezenou spoluprací ze strany příbuzenských dárců.
Poděkování
Dárcovská centra Českého národního registru dárců dřeně: Transfuzní oddělení a krevní banka FN Brno, Transfuzní oddělení nemocnice České Budějovice, Transfuzní oddělení FN Hradec Králové, Transfuzní oddělení nemocnice Liberec, Transfuzní oddělení nemocnice Most, Imunologický ústav FN a LF UP Olomouc, Transfuzní oddělení Ostrava, Hematologicko-onkologické oddělení Plzeň, Oddělení hematologie, biochemie a krevní transfuze ÚVN Střešovice Praha, Transfuzní oddělení Masarykovy nemocnice Ústí nad Labem.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
MUDr. Samuel Vokurka, Ph.D.
Hematologicko-onkologické oddělení
Fakultní nemocnice Plzeň
Alej Svobody 80
304 60 Plzeň
e-mail: vokurka@fnplzen.cz
Obdrženo: 30. 6. 2011
Přijato: 23. 8. 2011
Zdroje
1. Kaplinsky C, Trakhtenbrot L, Hardan I et al. Tetraploid myeloid cells in donors of peripheral blood stem cells treated with rhG-CSF. Bone Marrow Transplant 2003; 32(1): 31–34.
2. Nagler A, Korenstein-Ilan A, Amiel A et al. Granulocyte colony-stimulating factor generates epigenetic and genetic alterations in lymphocytes of normal volunteer donors of stem cells. Exp Hematol 2004; 32(1): 122–130.
3. Marmier-Savet C, Larosa F, Legrand F et al. G-CSF-induced aneuploidy does not affect CD34+ cells and does not require cell division. Blood 2010; 115(4): 910–911.
4. Bennett CL, Evens AM, Andritsos LA et al. Haematological malignancies developing in previously healthy individuals who received haematopoietic growth factors: report from the Research on Adverse Drug Events and Reports (RADAR) project. Br J Haematol 2006; 135(5): 642–650.
5. Halter J, Kodera Y, Ispizua AU et al. Severe events in donors after allogeneic hematopoietic stem cell donation. Haematologica 2009; 94(1): 94–101.
6. Confer DL, Miller JP. Long-term safety of filgrastim (rhG-CSF) administration. Br J Haematol 2007; 137(1): 77–78.
7. Nařízení vlády, kterým se provádí zákon č. 285/2002 Sb., o darování, odběrech a transplantacích tkání a orgánů a o změně některých zákonů (transplantační zákon), č. 436/2002 Sb. a Vyhláška Ministerstva zdravotnictví, kterou se stanoví bližší podmínky posuzování zdravotní způsobilosti a rozsah vyšetření žijícího nebo zemřelého dárce tkání nebo orgánů pro účely transplantací (vyhláška o zdravotní způsobilosti dárce tkání a orgánů pro účely transplantací), č. 437/2002 Sb.
8. The World Marrow Donor Association (WMDA). Worldmarrow.org. Last update: 2011 June 06, cited 2011 June 23. Available from: http://www.worldmarrow.org/.
9. The Joint Accreditation Committee-ISCT (Europe) & EBMT (JACIE-EBMT). Jacie.org. Last update: 2011 June 22, cited 2011 June 25. Available from: http://www.jacie.org/.
10. The Surveillance, Epidemiology, and End Results (SEER) Program of the National Cancer Institute, Cancer statistics, Database: Incidence – SEER 17 (2000–2008). Last update 2011 May 5, cited 2011 June 16. Available from: http://www.seer.cancer.gov/.
11. Doubek M, Mayer J. Filgrastim a akutní myeloidní leukemie. Klin Onkol 2003; 16(4): 161–167.
12. Indrák K, Papajík T, Faber E et al. Kritická analýza dat o akutních a chronických leukémiích v Národním onkologickém registru České republiky. Klin Onkol 2007; 20 (Suppl 1): 132–141.
13. Pottern LM, Linet M, Blair A et al. Familial cancers associated with subtypes of leukemia and non-Hodgkin’s lymphoma. Leuk Res 1991; 15(5): 305–314.
14. Segel GB, Lichtman MA. Familial (inherited) leukemia, lymphoma, and myeloma: an overview. Blood Cells Mol Dis 2004; 32(1): 246–261.
15. Wang SS, Slager SL, Brennan P et al. Family history of hematopoietic malignancies and risk of non-Hodgkin lymphoma (NHL): a pooled analysis of 10 211 cases and 11 905 controls from the International Lymphoma Epidemiology Consortium (InterLymph). Blood 2007; 109(8): 3479–3488.
16. Dušek L, Mužík J, Gelnarová E et al. Incidence a mortalita nádorových onemocnění v České republice. Klin Onkol 2010; 23(5): 311–324.
Štítky
Detská onkológia Chirurgia všeobecná OnkológiaČlánok vyšiel v časopise
Klinická onkologie

2012 Číslo 1
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
- Tramadol a paracetamol v tlumení poextrakční bolesti
- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
Najčítanejšie v tomto čísle
- Žilní vstupy v onkologii
- Využitie elektroimpedančnej tomografie v diagnostike karcinómu prsníka
- Identifikácia molekulárnych markerov u detí s akútnou myeloblastovou leukémiou (AML)
- Šestileté sledování pacienta s mnohočetnou angiomatózou postihující skelet, břišní i hrudní dutinu a stěnu trávicí trubice
