-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Žilní vstupy v onkologii
Venous Access Devices in Oncology
Specific anti-cancer therapy is administered mainly via the parenteral route, Adequate venous access is, therefore, a topical issue in oncology In some patients on long-term therapy, the peripheral venous system is extensively burdened We present an overview of risk factors associated with parenteral application of medicins We provide a comparison of different types of venous access devices and discuss recommendations on general indications for permanent venous access devices We suggest an approach to the choice of the most appropriate venous access device for an oncology patient available to date We present our experience with PICC (peripherally implanted central catheters) implantations used in 30 oncology patients in our centre In addition to venous ports, PICCs represent another safe method of permanent venous access with low rate of complications Indications for the use of a specific permanent venous access device (PICC or port) partly overlap and evidenced-based recommendations are lacking However, we discuss the few suggestions that have been formulated on this issue
Key words:
venous catheterization – vascular access ports – chemotherapy – cancer
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
1. 5. 2011Accepted:
15. 9. 2011
Autori: V. Maňásek; R. Soumarová; I. Kociánová; M. Maňásková
Pôsobisko autorov: Komplexní onkologické centrum, Nový Jičín
Vyšlo v časopise: Klin Onkol 2012; 25(1): 9-16
Kategória: Přehledy
Súhrn
Téma zajištění adekvátního žilního vstupu v onkologii je velmi aktuální, neboť specifická protinádorová farmakoterapie je vedena dominantně parenterální formou Periferní žilní systém je navíc v některých případech při dlouhodobé léčbě výrazně zatěžován Shrnujeme rizika ve spojitosti s podáváním léčiv do cévního řečiště, srovnáváme různé druhy žilních přístupů a zabýváme se obecně indikacemi pro zajištění permanentních žilních vstupů S ohledem na současné zkušenosti předkládáme návod pro výběr optimálního žilního vstupu v onkologii Podrobněji prezentujeme naše zkušenosti se zaváděním PICC (periferní cestou implantovaných centrálních katetrů) u 30 onkologických pacientů léčených v našem centru PICC jsou vedle venózních portů další bezpečnou modalitou zabezpečení trvalého žilního vstupu, a to při minimálním počtu komplikací Indikace pro výběr daného permanentního žilního vstupu (PICC nebo port) se částečně překrývají, evidentní doporučení pro výběr konkrétního permanentního vstupu chybí Nicméně jisté indicie se nabízejí a v tomto sdělení se nad nimi zamýšlíme
Klíčová slova:
žilní katetrizace – žilní porty – chemoterapie – zhoubné nádoryÚvod
U 90 % hospitalizovaných pacientů je v dnešní době využívána intravenózní terapie. Jde převážně o hydratační podporu, iontovou substituci, podávání protiinfekčních látek a cytostatik, parenterální výživu a podávání specifických léčiv. V USA je každoročně zavedeno nejméně 7 milionů centrálních žilních katetrů [1]. Mnoho látek má přitom nevyhovující vlastnosti pro periferní aplikaci – hlavně pH, osmolalitu nebo chemickou strukturu. Klinický výzkum prokázal, že látky s pH pod 5,0 a nad 9,0 způsobují endoteliální poškození intimy, stejně tak roztoky hypotonické či hypertonické (převážně při osmolalitě větší než 500 mosm/l). Dle Infusion Nursing Standards of Practice (INS) je v těchto případech doporučeno podání léčiv do centrálního řečiště. V tab. 1 a 2 jsou příklady některých běžně užívaných látek s jejich vlastnostmi (pH, osmolalita). Mezi další indikace pro zajištění centrálního řečiště patří parenterální výživa s obsahem > 10 % glukózy nebo > 5 % aminokyselin, podávání endotel iritujících léčiv, nutnost katetru s více než jedním lumen, dialýza nebo aferéza, měření centrálního žilního tlaku, nitrožilní léčba trvající déle než 3 měsíce [2]. Specifickou a velmi obávanou komplikací je paravazace cytostatika při aplikaci do periferního žilního řečiště. Je známo, že kupříkladu paravazace antracyklinů může vést k rozsáhlé nekróze tkání, která vyžaduje chirurgickou intervenci. Nicméně řada dalších cytostatik má potenciál způsobit při extravazaci závažná poškození. Jsou vypracovány speciální postupy týkající se opatření při paravazaci, nejsou však tématem tohoto sdělení. U onkologického pacienta podstupujícího protinádorovou léčbu je tedy často optimální podání léčiv do centrálního řečiště. Dle standardů INS je striktně doporučeno podávat do centrálního řečiště především „zpuchýřující cytostatika“. V případě, že jsou cytostatika podávána do periferní žíly, měla by se střídat místa aplikace při každém cyklu a vést dokumentace o místech podání, aby nedocházelo k opakované aplikaci ve stejné lokalitě [2].
Tab. 1. pH některých běžně užívaných léčiv. 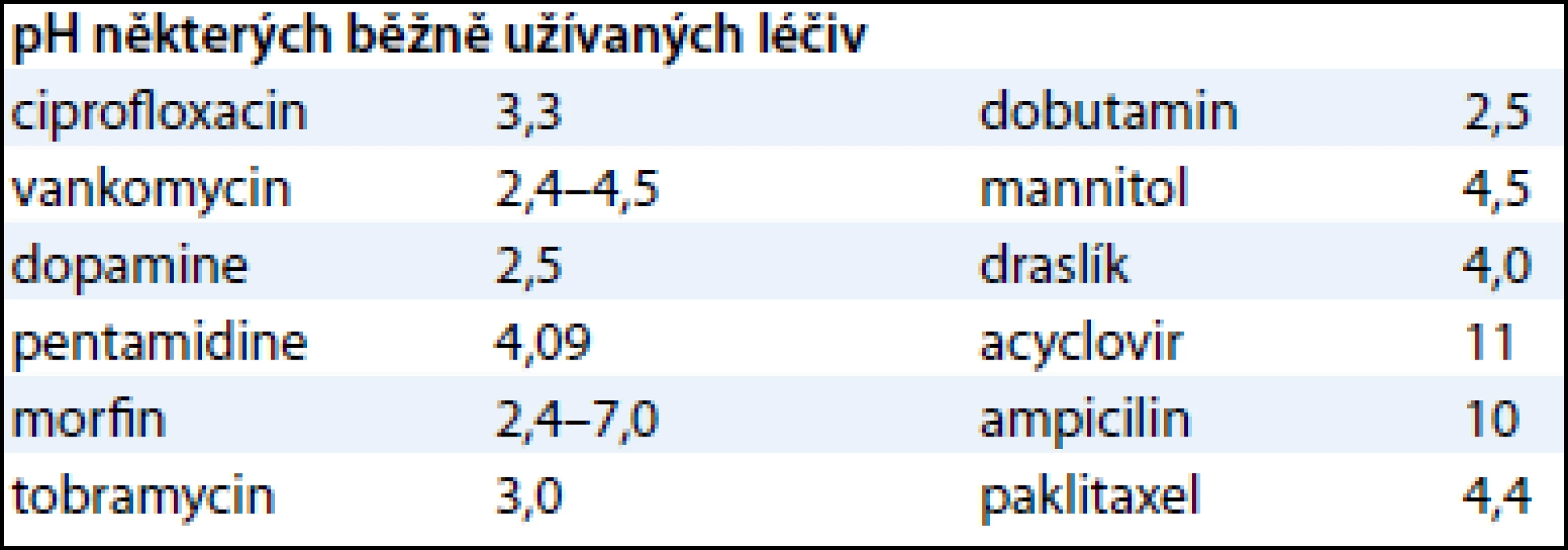
Tab. 2. Látky s osmolalitou nevhodnou pro periferní aplikaci. 
K zajištění žilního přístupu slouží řada katetrů, pro něž je obecně užívána anglická zkratka VAD (vascular access device). Každá skupina má své výhody i nevýhody, které je třeba znát a s nimiž je třeba počítat při výběru pro žilní přístup. Jednoznačná doporučení pro výběr typu VAD v konkrétních klinických situacích chybí. Pacienti jsou o způsobech podávání protinádorové léčby informováni mnohdy nedostatečně a těm, kteří vyžadují nitrožilní léčbu po dobu týdne a déle, není v převážné většině případů rutinně nabídnuta možnost zavedení žilních vstupů se střednědobou nebo dlouhodobou životností.
Žilní vstupy dělíme obecně na krátkodobé, střednědobé a dlouhodobé. Jiné rozdělení vychází z umístění konce katetru, čímž jsou zároveň definovány centrální nebo periferní katetry. U centrálních katetrů je konec umístěn v dolní třetině horní duté žíly, srdeční síni, anebo horním úseku dolní duté žíly.
Pro krátkodobou léčbu (obvykle myslíme do šesti dnů) můžeme užít konvenční periferní kanyly, např. u nás známé „flexily“. Je nutná výměna max. po 72–96 hod a slouží k podávání léčiv o pH v rozmezí 5,0–9,0 a osmolalitě do 500 mosm/l. Pro podání léčiv volíme nejčastěji periferní žíly v oblasti předloktí, protože zavedení periferního žilního vstupu je zpravidla snadné a časově nenáročné. Delší životnost mají tzv. midline katetry (2–4 týdny) a díky jejich délce (zhruba 15–30 cm) nedochází k iritaci periferních žil menšího kalibru. Konec midline katetru je zpravidla umístěn ve v. axillaris, případně ve v. subclavia, nesplňují tedy kritéria pro centrální katetr.
V některých situacích je výhodné a mnohdy i nezbytné podání léčiva do centrálního řečiště. Jedná se především o aplikaci látek s vlastnostmi, které je znevýhodňují pro periferní podávání (viz výše), anebo se jedná o léčbu, která je dlouhodobá, a opakovaná punkce periferních žil je nežádoucí. Indikací bývá mnohdy rovněž absolutní insuficience periferie, která může mít rozličné důvody. K zajištění přístupu do centrálního žilního řečiště existuje několik možností – CVK (centrální venózní kanyla) – netunelizovaná nebo tunelizovaná, PICC (peripherally implanted central catheter) a venózní port. V tab. 3 jsou shrnuty typy VAD a jejich základní charakteristiky. V tomto článku budou prezentovány zkušenosti našeho pracoviště týkající se problematiky permanentních žilních vstupů.
Tab. 3. Druhy VAD (vascular access device) a jejich charakteristiky (archiv autora). 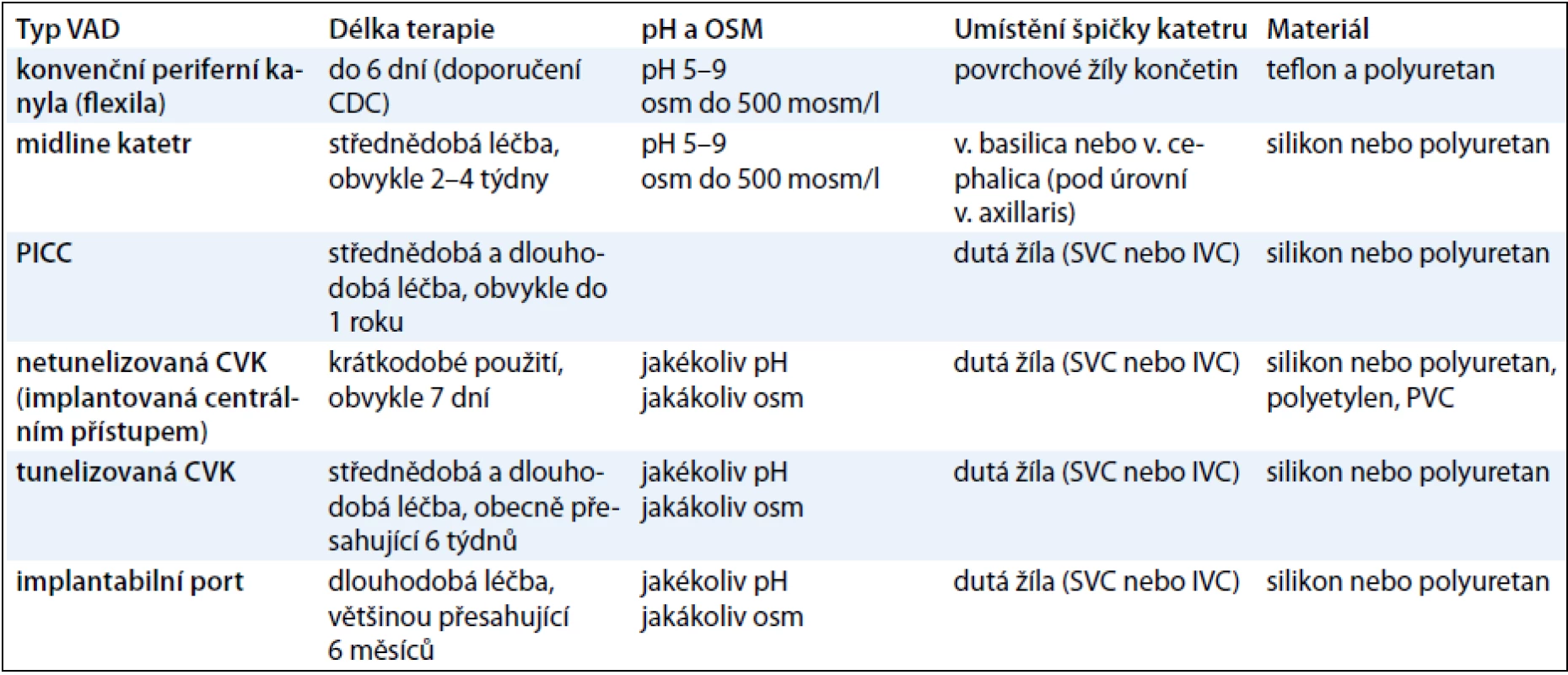
CDC = centers for disease control and prevention, SVC = superior vena cava, IVC = inferior vena cava, CVK = centrální venózní katetr, PICC = periferní cestou implantovaný katetr (peripherally implanted central catheter) Netunelizovaná centrální venózní kanyla je užívána k léčbě, která obvykle nepřesahuje deset dní, nicméně při optimální ošetřovatelské péči lze u vybraných pacientů kanylu ponechat i déle. Lékař však musí počítat s narůstajícím rizikem infekčních komplikací, které jsou v přímé úměře k délce zavedení CVK. Použití centrální žilní netunelizované kanyly by mělo být vyhrazeno pouze pro hospitalizované pacienty [2]. Nejčastěji je ke kanylaci využívána v. jugularis interna (VJI) a v. subclavia (VS), ve specifických situacích případně v. femoralis (VF). Tento typ VAD využíváme především k terapii infekčních komplikací (febrilní neutropenie, sepse), krátkodobé nutriční parenterální přípravě např. v perioperačním období a při některých typech chemoterapie (převážně kontinuální režimy s 5-fluorouracilem, podávání antracyklinů atd.) u pacientů, kteří nemají zajištěn permanentní žilní vstup. Časné komplikace spojené s kanylací centrální žíly jsou obecně známé (pneumothorax, punkce tepny a krvácení, hemothorax, poškození nervových struktur, primární malpozice aj.) a lze je významně redukovat použitím ultrazvukové navigace při kanylaci. Zavedení centrální kanyly „naslepo“ je samozřejmě metodou volby a v rukou zkušeného lékaře jsou rizika minimalizována, nicméně provádíme-li kanylaci centrálního žilního systému elektivně, nabízí se využít ultrazvukové navigace. Řada společností vydala jasná doporučení pro využívání ultrazvukové navigace při zavádění centrálních kanyl (Association for Vascular Access, National Institute for Clinical Excellence – UK aj.) [2]. Jednoznačně bychom se k použití ultrazvuku klonili u pacienta s nevhodnými anatomickými, popř. hemokoagulačními poměry, anebo při nejistotě o průběhu cév či primárně neúspěšné punkci „naslepo“. Mezi hlavní pozdní komplikace patří infekce kanyly se vznikem katetrové sepse a trombóza.
Další možností je zavedení tunelizované CVK, kterou obecně využíváme pro léčbu přesahující šest týdnů. Obvykle implantujeme Hickmanův nebo Broviacův katetr. Riziko infekčních komplikací je významně nižší. Asi nejčastější indikací pro zavedení tunelizované CVK je domácí parenterální výživa. Na našem pracovišti někdy využíváme „částečnou tunelizaci“, kdy prostou CVK zavádíme infraklavikulárním přístupem cestou vena subclavia přes vytvořenou kožní řasu, kdy lze dosáhnout alespoň několikacentrimetrové tunelizace. Takto implantovanou CVK nemůžeme jistě zařadit do spektra tunelizovaných katetrů v pravém smyslu slova, nicméně dle našich zkušeností je životnost CVK rozhodně delší.
Možností zajištění permanentního žilního vstupu je dále zavedení implantabilního venózního portu, který je indikován pro dlouhodobou léčbu, optimálně pro pacienty vyžadující intermitentní terapii po dobu přesahující 6 měsíců. Zaváděním portů se většinou zabývají lékaři s odborností jako intervenční radiolog, chirurg, případně anesteziolog. V našem centru implantuje porty klinický onkolog a naše zkušenosti jsou velmi dobré. Nejčastěji volíme supraklavikulární přístup do cévního řečiště, občas přístup infraklavikulární laterální, kanyla portu je zavedena cestou VJI nebo VS. Zavedením ze supraklavikulárního přístupu předcházíme vzniku „pinch-off syndromu“ s obstrukcí katetru, jehož příčinou je nejčastěji komprese mezi klavikulou a prvním žebrem. K tomu může naopak dojít při infraklavikulárním přístupu via vena subclavia.
Metodou volby pro střednědobou a případně i dlouhodobou terapii je implantace PICC (peripherally implanted central catheter). Jedná se o typ permanentního žilního vstupu, který se zavádí za ultrazvukové navigace do některé z žil na paži – v. basilica, v. cephalica nebo v. brachialis. Konec katetru je umístěn na přechodu horní duté žíly v pravou síň, tedy v centrálním řečišti. PICC má osvědčení Food and Drug Administration (FDA) pro používání na dobu až 1 roku, nicméně existují i data o delší životnosti katetru, která závisí na mnoha faktorech (typu použitého materiálu, technice inzerce, spolupráci pacienta a především optimálním ošetřování).
Vlastní zkušenosti
Implantace PICC jsme v našem centru zahájili v květnu 2010. Za aseptických kautel je vybraná žíla punktována přímo za ultrazvukové navigace (obr. 1, 2). Při průniku jehly do lumen cévy se na jejím konci objeví krev (obr. 3), Seldingerovou technikou je následně po vodiči zasunut zaváděcí sheat a po extrakci mandrénu pak katetr do požadované vzdálenosti. Sheat je následně odstraněn rozlomením a „svlečením“ ze zavedeného katetru, jako je tomu například u zavádění katetru portu. Definitivně zavedený katetr je znázorněn na obr. 4. Na obr. 5 je znázorněn obvyklý ultrazvukový obraz mediální strany paže, kdy a. brachialis zpravidla dopovází jedna nebo dvě vv. brachiales, mediálněji a zpravidla povrchněji je uložena v. basilica. Na obr. 6 je zobrazen celý displej ultrazvukového přístroje, ze kterého je zřejmá výhoda okamžitého porovnání průměru a hloubky cévy s měrnou stupnicí umístěnou v pravé části obrazovky. Pacient během výkonu zaujímá polohu vleže s paží v abdukci. Obecně se uvádí, že nejvhodnější je pro účely zavedení PICC vena basilica vzhledem k jejímu vhodnému průměru a přímému průběhu. Vena cephalica je většinou užší, navíc při zavedení na přední straně paže nad hlavou musculus biceps brachii může být katetr mechanicky nadměrně namáhán při ohybu paže a je vyšší riziko případného poškození jemného katetru. Při implantaci via v. brachialis provádíme punkci velmi blízko tepny, a proto je punkce riziková. Nicméně anatomické poměry jsou značně individuální. Optimální je provádět zákrok v lokální anestezii, neboť samotná punkce a zavádění sheatu mohou být bolestivé [3]. V případě punkce žíly malého kalibru se každopádně dle našich zkušeností snažíme infiltrovat podkoží co nejméně, neboť žíla jinak kolabuje a punkce je obtížná; lokální anestezii raději nahrazujeme mírnou sedací. Ideální je rovněž provádět zákrok za skiaskopické kontroly k okamžitému ověření polohy špičky katetru, kdy se redukuje riziko primární malpozice a lékař má jistotu o správném uložení konce katetru. Je nutné rovněž počítat se změnou polohy konce katetru, ke které dojde po změně pozice paže z abdukce do addukce. Konec katetru má tendenci posunout se v addukci paže kaudálněji, přibližně o 20 mm [4]. Nicméně ze zkušeností při zavádění portů a CVK víme, že při vertikalizaci pacienta dochází naopak k mírnému povytažení katetru kraniálně, takže definitivní poloha může být variabilní. Opatrnosti je rovněž třeba u pacientů s ;rozsáhlou mediastinální masou tumoru, kde je vyšší riziko malpozice a jsou nutné kontroly polohy katetru v průběhu léčby [5]. Z technických a organizačních důvodů provádíme na našem pracovišti skiagram až po zavedení katetru, délku stanoví lékař předem orientačním naměřením vzdálenosti mezi místem vpichu a předpokládaným ústím horní duté žíly. V případě, že je PICC zaveden příliš krátce (např. do v. axillaris, v. subclavia, v. brachiocephalica), může v budoucnu docházet k ;obtížím při aspiraci krve, neboť dochází k přisátí konce katetru na žilní stěnu. Se správným uložením konce katetru však nebývá zpravidla větší problém.
Obr. 1. Názorná animace punkce za ultrazvukové navigace. 
Obr. 2. Punkce za ultrazvukové navigace. 
Obr. 3. Návrat krve svědčící o úspěšné punkci žíly. 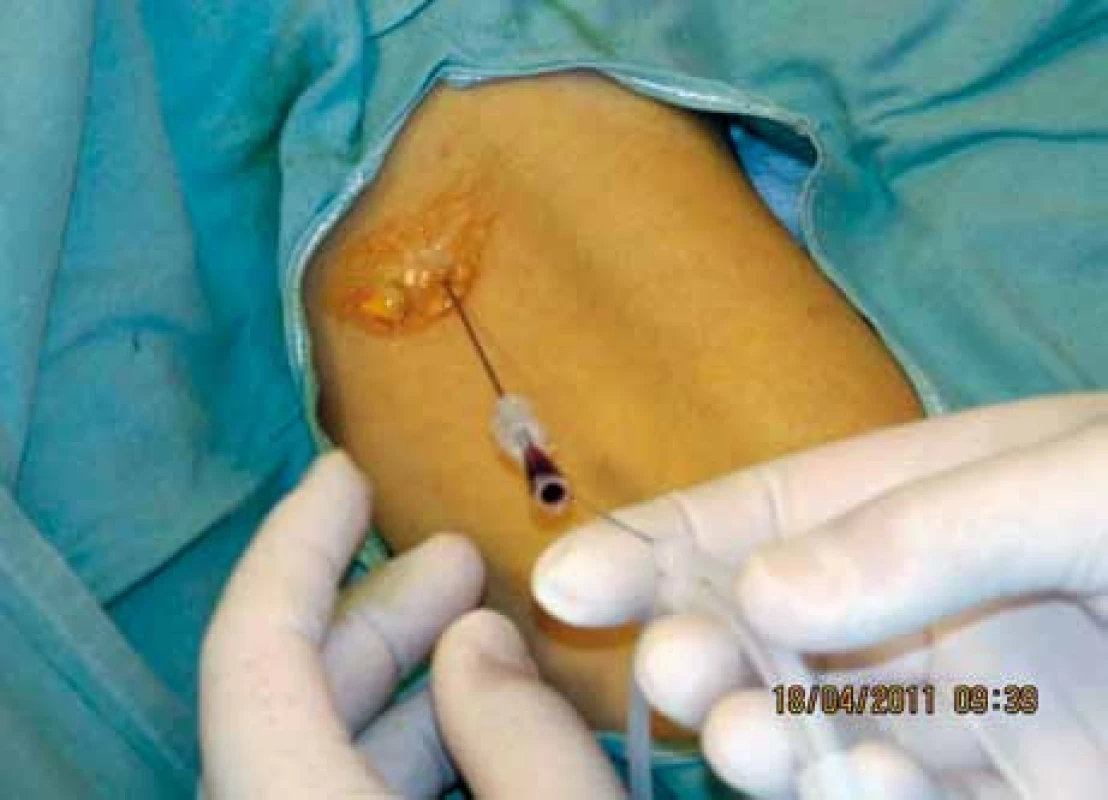
Obr. 4. PICC u pacientky s plicním karcinomem, zaveden cestou v. basilica l. sin. 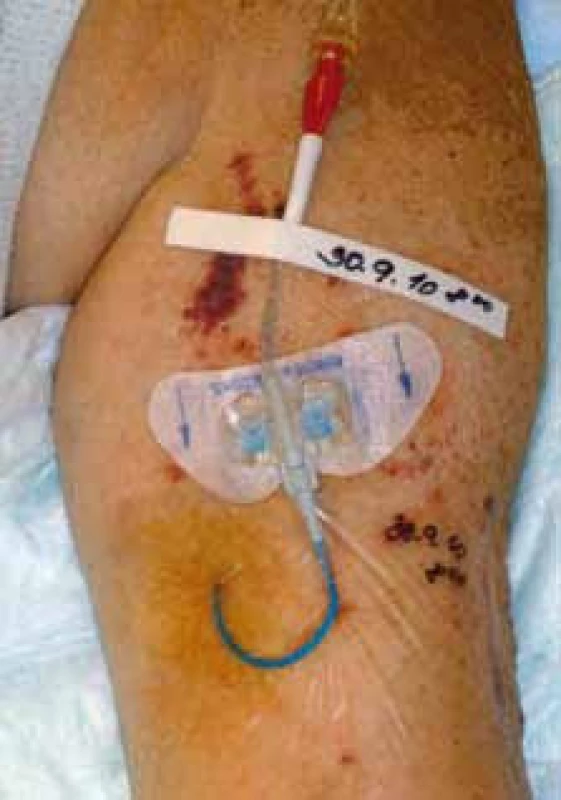
Obr. 5. Ultrazvukový obraz cév paže. Vpravo a. brachialis se dvěma sousedícími vv. brachiales, vlevo v. basilica. 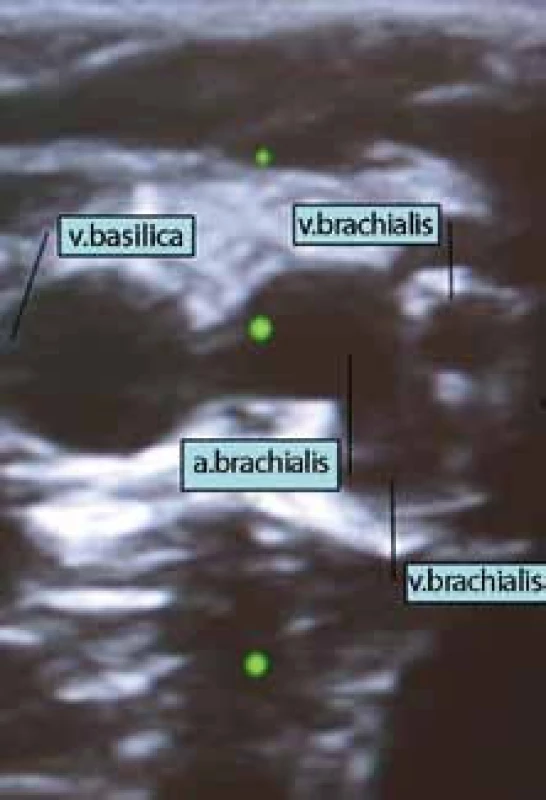
Obr. 6. Displej ultrazvukového přístroje. Vpravo patrná a. brachialis, vlevo v. basilica při částečné kompresi. V pravé části displeje měrná stupnice, umožňující okamžité určení průměru žíly a její hloubky. 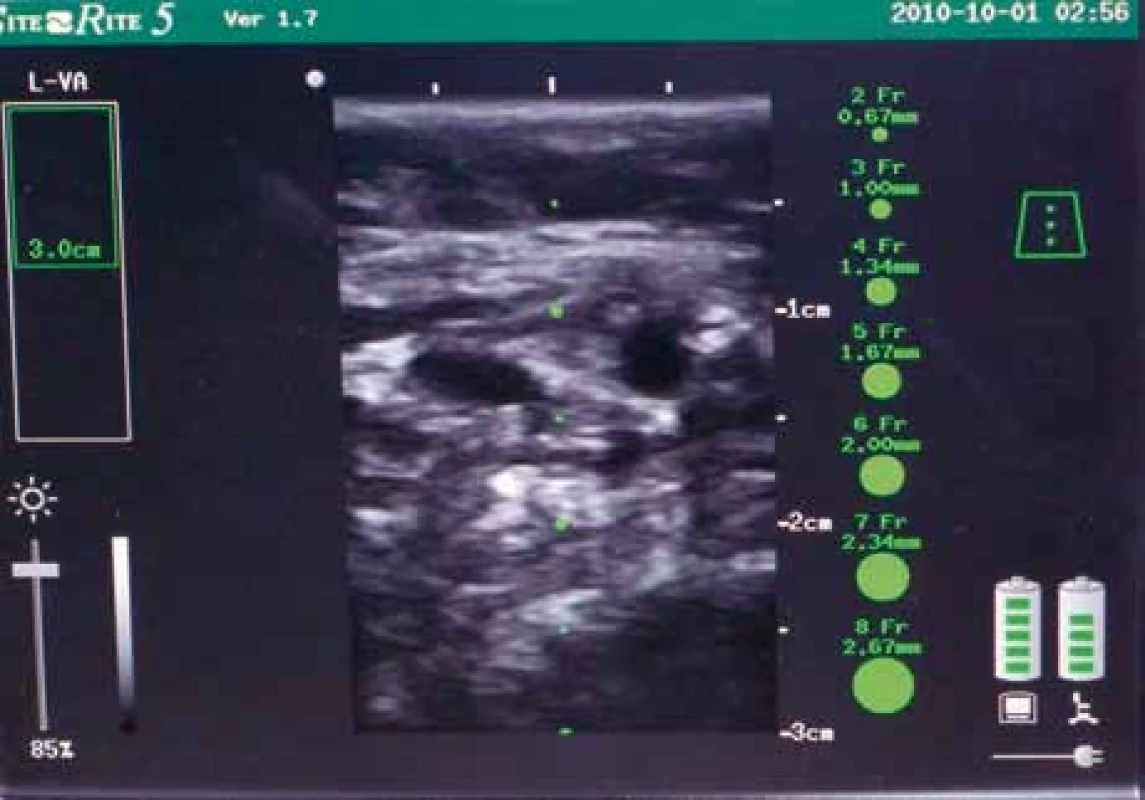
V případě, že je nutné zajistit žilní vstup na krátkou dobu a pacient má koagulopatii, případně je přítomna trombocytopenie, využíváme punkci VJI za ultrazvukové navigace. Není-li ultrazvuk k dispozici, bezpečnější se nám dříve jevila punkce VF, ovšem s vědomím rizika většího nebezpečí infekčních komplikací. Každopádně implantace PICC se staly suverénní metodou pro zajištění žilního vstupu, neboť rizika jsou v případě poruch koagulace významně minimalizována. PICC jsou rovněž adekvátní alternativou ke klasickým CVK i u pacientů podstupujících intenzivní hematologickou terapii včetně autologní transplantace krvetvorby nebo u kriticky nemocných pacientů [6,7]. Žilní vstup je kryt sterilně průhlednou fólií, pacient může provozovat běžnou hygienu, je možné i případné koupání. Pacienti obecně zavedení PICC vítají, neboť odpadá nutnost opakovaných venepunkcí.
Hlavní zásadou je používat při manipulaci s katetrem stříkačku o objemu 10 ml a větší, jinak hrozí porušení chlopně s následnou malfunkcí katetru. Opatrnosti je rovněž třeba u kontrastního CT vyšetření, kdy objem podané kontrastní látky v krátkém čase může poškodit jemný silikonový katetr. Je-li PICC poškozen vně cévy, lze vyměnit uzávěrový mechanizmus a PICC je nadále funkční. Pro účely CT vyšetření je tedy vhodnější použít jiný vstup. V současnosti jsou již dostupné speciální PICC katetry od různých výrobců, které mohou být bezpečně použity i pro účely kontrastního CT vyšetření [1]. Samozřejmostí je nezavádět PICC na straně axilární disekce, při radioterapii na danou oblast, u lymfedému a infekce kůže v místě vpichu. Aktuálně rovněž převládá doporučení nezavádět PICC u pacientů, u kterých se v budoucnu počítá s mechanickou náhradou ledvinných funkcí. Je otázkou, zda se vyvarovat zavedení PICC např. u mladých diabetiků z důvodu preventivního šetření žilního systému.
V našem centru jsme zavedli od května 2010 do doby psaní tohoto článku 30 PICC katetrů. V grafu 1 a 2 je výčet diagnóz pacientů, u kterých jsme indikovali implantaci, a důvod zavedení PICC. Nejčastějším důvodem bylo podávání specifické protinádorové léčby, mezi další indikace patřila parenterální výživa, substituce krevních derivátů a podávání dalších léčiv. Pokud to bylo možné, volili jsme pro účely PICC v. basilica, v případě, že nebyla basilická véna dostatečně široká, přiklonili jsme se k punkci via v. cephalica nebo v. brachialis. Co se týká periimplantačních komplikací, došlo jedenkrát k punkci brachiální tepny, jedenkrát došlo k primární malpozici katetru do VJI, jedenkrát se nepodařilo PICC zavést. Všechny komplikace se však vyskytly v době zavádění nové metody na našem pracovišti, tedy v době seznamování se s technikou implantace. Dosud jsme ani u jednoho pacienta nezaznamenali rozvoj katetrové sepse, u dvou pacientů bylo nutné provést během následné péče ošetření inflamace v okolí vpichu, u dvou pacientek docházelo po několika měsících k iritaci kůže se vznikem mikrobiálního ekzému pod krytím, a proto jsme je následně indikovali k zavedení portu. U jedné pacientky, kde byl PICC zaveden via v. basilica, došlo k rozvoji trombózy horní končetiny, avšak v oblasti v. cephalica a v. axillaris. Vzhledem k nemožnosti užít pro žilní vstup druhostrannou končetinu (šlo o pacientku s karcinomem prsu) a probíhající chemoterapii jsme se rozhodli PICC ponechat a sledovat vývoj trombózy na terapeutické dávce nízkomolekulárního heparinu. Došlo k regresi otoku a parciální regresi trombózy, PICC je nadále plně funkční a pacientka podstupuje ambulantní terapii. Zaznamenali jsme celkem sedm epizod perforace katetru v místě připojení na uzávěrový mechanizmus, z toho dvakrát při kontrastním CT vyšetření. Jeden pacient si opravu katetru nepřál, takže byl extrahován, u všech ostatních byl katetr po výměně uzávěrového mechanizmu nadále plně funkční. K perforaci katetru došlo v naprosté většině případů u pacientů s nadváhou při katetru zavedeném via v. cephalica, neboť docházelo k mechanickému namáhání katetru při kontrakcích hlavy bicepsu. Stěžejní je správné připevnění PICC ke kůži tak, aby se při pohybu končetinou nikde nezalamoval, je třeba přizpůsobit se konstituci pacienta a nalézt vhodnou polohu. Ve srovnání s literárně uváděnými daty máme výrazně menší počet komplikací (flebitida, trombóza, dyskomfort pacienta). Domníváme se, že vysvětlením je fakt, že všechny PICC zavádíme vždy striktně v oblasti žil paže. PICC totiž na jiných pracovištích v zahraničí zavádějí speciálně školené sestry, mnohdy technikou „naslepo“ a v oblasti antekubitální jamky nebo předloktí, kde je logicky komplikací více [8]. PICC byl u nás dosud implantován 30 pacientům, jedenkrát bylo zavedení neúspěšné. Explantaci jsme dosud provedli u 16 pacientů. Důvodem pro extrakci katetru bylo úspěšné ukončení terapie, destrukce katetru při kontrastním CT vyšetření, explantace na žádost pacienta, samovolná extrakce katetru, výměna za port, zbývající pacienti exitovali. Průměrná délka zavedení PICC byla u těchto pacientů 86,6 dne. Nicméně u dvou pacientů došlo k neočekávanému exitu do 4 dní od zavedení PICC (v jednom případě šlo o pacientku s difuzním velkobuněčným lymfomem, u které se rozvinul refrakterní septický šok po prvním cyklu chemoterapie, ve druhém případě se jednalo o pacientku s tumorem pankreatu, která zemřela na akutní plicní embolii). Kdybychom tyto případy nezahrnuli do statistického vyhodnocení, byla by celková průměrná délka používání PICC 98,4 dne. U dalších 13 pacientů je PICC nadále používán, v době psaní tohoto článku byla cca u dvou třetin z nich průměrná délka zavedení delší než 60 dní. Soubor našich pacientů je samozřejmě malý, a proto nejsou data zatím jistě statisticky signifikantní.
Graf 1. Onkologické diagnózy pacientů, u kterých byl zaveden PICC. 
Diskuze
Mezi hlavní výhody PICC patří bezpečnost (odpadá riziko periimplantačních komplikací, které jsou popisovány při kanylaci centrální žíly klasickými přístupy), nižší riziko trombózy a katetrové sepse. Není potřeba aplikovat heparinovou zátku, protože katetr je vybaven speciální chlopní, která uzavírá lumen a zabraňuje zpětnému toku krve. Ventil se otevře při aplikaci nebo aspiraci katetrem. K proplachům je užíván fyziologický roztok. Dříve používané PICC bez chlopně vykazovaly statisticky vyšší riziko trombotických a infekčních komplikací [9]. Chlopeň je umístěna buď distálně na konci katetru v žíle, anebo proximálně při vstupu do těla. Katetry s proximálně uloženou chlopní mají pravděpodobně menší riziko infekčích komplikací a okluzí [10]. Další výhodou je, že PICC se nemusí šít ke kůži, katetr je k ní přilepen speciálním mechanizmem na mediální straně paže (obr. 4). Po zavedení PICC odpadá nutnost opakovaného zavádění CVK a zhotovování skiagramu k ověření polohy kanyly při každém cyklu chemoterapie. Zejména u pacientů s koagulačními poruchami je zabezpečení žilního přístupu rizikové a PICC je bezpečnou variantou zajištění permanentního vstupu. Máme zkušenost s bezpečným zavedením PICC u pacientky s trombocytopenií 5 × 109/l. V časopise Journal of Thrombosis and Haemostasis byl uveřejněn článek, ve kterém autoři srovnávají PICC vs periferní žilní linky u pacientů vyžadujících nitrožilní terapii po dobu více než 5 dní. Průměrný počet venepunkcí ve skupině pacientů s PICC byl 1,36 vs 8,25 ve skupině pacientů, u kterých byla zajištěna periferní kanyla. Spokojenost s PICC vs periferní linkou byla 96,8 %, resp. 79,3 % [11].
Mezi hlavní komplikace PICC patří především nemožnost zavedení katetru (naprostá insuficience periferního žilního systému, trombóza, obliterace žíly). Stejně jako u každého jiného žilního vstupu může dojít k punkci tepny, k následné flebitidě, trombóze, krvácení a infekci. Je nutno vytvořit zkušený tým, který je schopen PICC zavádět, a edukovat personál stran dlouhodobé péče o katetr, který je v typickém případě zaveden několik týdnů či měsíců. Mnoho studií se zabývalo výskytem komplikací v souvislosti s PICC u onkologických pacientů. Data jsou velmi různorodá a v zásadě lze konstatovat, že studie z 90. let minulého století a začátku tohoto století prokazovaly velkou míru komplikací, převážně infekčních [12–14]. Až třetina PICC musela být předčasně ukončena z důvodu komplikací [13]. Optimálně by měl být průměr žíly alespoň čtyřikrát širší než průměr PICC, aby bylo redukováno riziko trombózy. U katetrů průměru 4 Fr. bylo v jedné studii riziko trombózy 1 %, u 5 Fr. 6,6 % a u 6 Fr. 9,8 % [15]. Průměr dnes běžně používaných katetrů je 3–4 Fr. Některá retrospektivní data naznačují, že u hematoonkologických pacientů je vyšší riziko trombózy u PICC ve srovnání s klasickými centrálními kanylami [16]. Ve studii čínských autorů u pacientek s karcinomem prsu byla zase úspěšně testována infuzní premedikace dexamethazonem a lidocainem před implantací PICC s cílem redukovat mechanickou flebitidu [17]. S vývojem nových materiálů a vypracováním všeobecných doporučení pro implantaci a manipulaci s PICC však byla rizika minimalizována.
V metaanalýze 223 prospektivních studií sledujících riziko infekce ve spojitosti s různými typy VAD je nejvyšší riziko u netunelizovaných CVK, v sestupném pořadí následuje tunelizovaná CVK, periferní kanyla, nejnižší riziko je u PICC a samozřejmě u portů, kde je průměrné riziko katetrové infekce na 1 000 zavedených dnů jen 0,2 %. Při průkazu katetrové sepse je doporučeno odstranění katetru a systémové podávání antibiotik po dobu minimálně 10 dní. V případě, že u pacienta není možnost zavedení jiného žilního vstupu, může zůstat katetr in situ, nicméně podmínkou je kombinovaná terapie širokospektrými antibiotiky a používání antibiotické zátky [18]. V prospektivní randomizované studii byly testovány netunelizované centrální kanyly impregnované minocyclinem a rifampinem se slibnými výsledky redukce rizika katetrové sepse, nicméně srovnání bylo provedeno oproti ramenu s neimpregnovanými netunelizovanými kanylami v délce zavedení několik týdnů [19]. V dnešní době je vypracována řada postupů a návodů zabývajících se prevencí a řešením katetrových infekcí [20].
Na pracovištích, která mají rozsáhlé zkušenosti se zaváděním permanentních žilních vstupů, jsou užívány i netradiční přístupy do centrálního systému. Mezi ně patří např. kanylace via v. brachiocephalica, v. renalis, v. intercostalis, v. azygos a v. hemiazygos. Jsou užívány i různé přístupy do dolní duté žíly ; – translumbální, transhepatický i transrenální. Zcela ojedinělým přístupem je rovněž využití přítomnosti kolaterálního oběhu, někdy značně rozšířeného v případě maligních onemocnění. Na odborných konferencích jsou např. zmínky o kanylaci perigastrických kolaterál u pacienta s bronchogenním karcinomem při nemožnosti využití standardního žilního přístupu [21].
V České republice je nitrožilní terapie vedena dominantně cestou periferních žil, a to především v onkologii, což není v některých případech optimální. Je zarážející, že velká část pacientů indikovaných k zavedení portu nebo PICC je odeslána až po destrukci periferního řečiště. Stále sice přibývá pracovišť, kde se venózní porty implantují, nicméně ve srovnání s nejvyspělejšími státy jsme v počtu zavedených portů na počet obyvatel stále daleko pozadu.
PICC se v ČR zavádí jen na několika málo pracovištích a jsme přesvědčeni, že do obecného povědomí se tato metoda bude dostávat čím dál víc, neboť má široké uplatnění, a to jak v léčbě intenzivní, tak v léčbě paliativní.
Závěr
Indikací k zavedení permanentního žilního vstupu by měla být rozvaha přihlížející ke strategii léčby (typ nádorového onemocnění, charakter chemoterapie, délka trvání aj.) a vlastnostem daného pacienta (nedostatečný povrchový žilní systém, strach z jehel aj.), nikoliv devastace periferního žilního systému. Indikace pro výběr daného permanentního žilního vstupu (PICC nebo port) se částečně překrývají, evidentní doporučení pro výběr konkrétního permanentního vstupu chybí. Nicméně jisté indicie se nabízejí. PICC volíme hrubě orientačně u plánované léčby v délce trvání do 3, případně 6 měsíců, u pacientů v horším výkonnostním stavu, v paliativní a symptomatické péči, u pacientů s poruchou krevního srážení apod. Průměrná délka zavedení PICC činí v našem centru cca 3 měsíce. Výhody PICC jsme ocenili především u pacientů s hemokoagulačními poruchami a u pacientů v trombocytopenii, při nutnosti parenterální alimentace a v případě naprosté insuficience periferie. PICC jsou výhodné rovněž u režimů s vyšším výskytem trombocytopenií (myelosupresivní cytostatické režimy obecně, karboplatina, gemcitabin aj.) Rutinně nabízíme PICC pacientům s germinálními nádory při chemoterapii BEP a nemocným se spinocelulárním karcinomem anu, vhodné je dále použití u pacientů s karcinomem jícnu při konkomitantní neoadjuvantní radiochemoterapii, kdy je nutné zajištění centrálního vstupu a není přitom mnohdy předem jasné, zda bude po operaci následovat další chemoterapie, anebo bude chirurgická intervence definitivním řešením. Iniciální indikace k implantaci portu by byla v těchto případech unáhlená a neekonomická. Žádoucí je zavedení PICC u všech diagnóz, kdy jsou malignitou postiženy měkké tkáně v oblasti krku a opakované punkce v této oblasti nejsou vhodné, o to víc v nepříznivém terénu po předchozí radioterapii. Podstatným faktorem je však vždy délka plánované léčby a přání pacienta. Port je naopak ideální pro ambulantně léčené pacienty, pro léčbu trvající déle než 6 měsíců, adjuvantní režimy apod. Kontinuální režimy s 5-fluorouracilem by měly být aplikovány striktně do centrálního systému, volba permanentního vstupu je v tomto případě individuální a odvíjí se od charakteru onemocnění. Máme dobré zkušenosti jak s aplikací do portu, tak při podávání cestou PICC. Klademe velký důraz na podpůrnou léčbu v onkologii a možnost zajištění trvalého žilního vstupu přímo na našem pracovišti (ať už formou PICC, anebo portu) je výhodou. Jsme přesvědčeni, že nitrožilní léčbu můžeme podávat bezpečněji, šetrněji, a je-li permanentní žilní vstup zvolen indikovaně, lze dokladovat i benefit ekonomický.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
MUDr. Viktor Maňásek
Komplexní onkologické centrum a Onkologické oddělení
Nemocnice Nový Jičín, a.s.
Purkyňova 2138/16
741 01 Nový Jičín
e-mail: viktor.manasek@onkologickecentrum.cz
Obdrženo: 1. 5. 2011
Přijato: 15. 9. 2011
Zdroje
1. Tilton H. How to fine-tune your PICC care. RN 2006; 69(9): 30–5; quiz 36, 44.
2. Gallieni M, Pittiruti M, Biffi R. Vascular access in oncology patients. CA Cancer J Clin 2008; 58(6): 323–346.
3. Fry C, Aholt D. Local anesthesia prior to the insertion of peripherally inserted central catheters. J Infus Nurs 2001; 24(6): 404–408.
4. Forauer AR, Alonzo M. Change in peripherally inserted central catheter tip position with abduction and adduction of the upper extremity. J Vasc Interv Radiol 2000; 11(10): 1315–1318.
5. Tamburro RF, Conner DT, Proctor KE et al. The effect of a mediastinal mass on the initial positioning of a peripherally inserted central venous catheter. J Infus Nurs 2003; 26(2): 92–96.
6. Harter C, Ostendorf T, Bach A et al. Peripherally inserted central venous catheters for autologous blood progenitor cell transplantation in patients with haematological malignancies. Support Care Cancer 2003; 11(12): 790–794.
7. Griffiths VR, Philpot P. Peripherally inserted central catheters (PICCs): do they have a role in the care of the critically ill patient? Intensive Crit Care Nurs 2002; 18(1): 37–47.
8. Simcock L. No going back: advantages of ultrasound-guided upper arm PICC placement. JAVA 2008; 13(4): 191–197.
9. Hoffer EK, Borsa J, Santulli P et al. Prospective randomized comparison of valved versus nonvalved peripherally inserted central vein catheters. AJR Am J Roentgenol 1999; 173(5): 1393–1398.
10. Hoffer EK, Bloch RD, Borsa JJ et al. Peripherally inserted central catheters with distal versus proximal valves: prospective randomized trial. J Vasc Interv Radiol 2001; 12(10): 1173–1177.
11. Periard D, Monney P, Waeber G et al. Randomized controlled trial of peripherally inserted central catheters vs. peripheral catheters for middle duration in-hospital intravenous therapy. J Thromb Haemost 2008; 6(8): 1281–1288.
12. Cheong K, Perry D, Karapetis C et al. High rate of complications associated with peripherally inserted central venous catheters in patients with solid tumours. Intern Med J 2004; 34(5): 234–238.
13. Walshe LJ, Malak SF, Eagan J et al. Complication rates among cancer patients with peripherally inserted central catheters. J Clin Oncol 2002; 20(15): 3276–3281.
14. Yap YS, Karapetis C, Lerose S et al. Reducing the risk of peripherally inserted central catheter line complications in the oncology setting. Eur J Cancer Care (Engl) 2006; 15(4): 342–347.
15. Grove JR, Pevec WC. Venous thrombosis related to peripherally inserted central catheters. J Vasc Interv Radiol 2000; 11(7): 837–840.
16. Cortelezzi A, Fracchiolla NS, Maisonneuve P et al. Central venous catheter-related complications in patients with hematological malignancies: a retrospective analysis of risk factors and prophylactic measures. Leuk Lymphoma 2003; 44(9): 1495–1501.
17. Yi S, Wang Y, Li D et al. Influence of PICC catheter pretreatment on the mechanical phlebitis in breast cancer patients receiving chemotherapy. Chinese J Clin Oncol Rehab 2007; 1.
18. Hachem R, Raad I. Prevention and management of long-term catheter related infections in cancer patients. Cancer Invest 2002; 20(7–8): 1105–1113.
19. Hanna H, Benjamin R, Chatzinikolaou I et al. Long-term silicone central venous catheters impregnated with minocycline and rifampin decrease rates of catheter-related bloodstream infection in cancer patients: a prospective randomized clinical trial. J Clin Oncol 2004; 22(15): 3163–3171.
20. Miller DL, O’Grady NP. Guidelines for the prevention of intravascular catheter-related infections: recommendations relevant to interventional radiology. J Vasc Interv Radiol 2003; 14 (9 Pt 2): S355–S358.
21. Gebauer B. Uncommon approaches in venous access. Macova 4th Multidisciplinary advanced course on venous access. London, 20th–22nd October 2010 [online]. Available from www.evanetwork.info/uploads/macova_iv-draft_agenda.pdf.
22. Cardiaccarestaffing.com [online]. 2008. Cardiac care staffing. Available from http://cardiaccarestaffing.com/piccline.html.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2012 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
-
Všetky články tohto čísla
- Srovnávací proteomická analýza krevní plazmy pacientů s mnohočetným myelomem léčených režimy s bortezomibem
- Identifikácia molekulárnych markerov u detí s akútnou myeloblastovou leukémiou (AML)
- Editorial
- Využitie elektroimpedančnej tomografie v diagnostike karcinómu prsníka
- Výskyt malignit a dispenzarizace dárců krvetvorných buněk – výsledky sledování Hematologicko-onkologického oddělení FN Plzeň a Českého národního registru dárců dřeně
- Šestileté sledování pacienta s mnohočetnou angiomatózou postihující skelet, břišní i hrudní dutinu a stěnu trávicí trubice
- Nové možnosti vzdělávání českých chirurgů v onkochirurgii
- Erratum
- Recenze
- Tematický seznam publikací vydaných v Klinické onkologii v roce 2011
- Žilní vstupy v onkologii
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Žilní vstupy v onkologii
- Využitie elektroimpedančnej tomografie v diagnostike karcinómu prsníka
- Identifikácia molekulárnych markerov u detí s akútnou myeloblastovou leukémiou (AML)
- Šestileté sledování pacienta s mnohočetnou angiomatózou postihující skelet, břišní i hrudní dutinu a stěnu trávicí trubice
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




