-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
MikroRNA vstupují do klinického testování
Autoři: O. Slabý 1,2
Působiště autorů: Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno 1; Středoevropský technologický institut, skupina Molekulární onkologie II – solidní nádory, Brno 2
Vyšlo v časopise: Klin Onkol 2012; 25(2): 139-142
Kategorie: Aktuality v onkologii
MikroRNA (miRNA) tvoří početnou skupinu endogenních krátkých nekódujících RNA, přibližně 18–25 nukleotidů dlouhých, které tlumí translaci vazbou na cílové mRNA. Počet miRNA neustále narůstá, poslední verze databáze miRBase (verze 18 z listopadu 2011) zahrnuje více než 1 000 anotovaných miRNA v lidském genomu a předpokládá se, že toto číslo se ještě významně navýší, protože mnoho miRNA stále čeká na svou experimentální validaci. Na základě bioinformatických predikcí se předpokládá, že miRNA mají potenciál regulovat až polovinu kódujících genů v lidském genomu a každá miRNA může regulovat řádově stovky cílových mRNA [1]. Sekvence miRNA jsou vysoce sekvenčně konzervované i napříč ne zcela příbuznými organizmy, což naznačuje jejich podíl na esenciálních biologických procesech. Dnes už je obecně akceptováno, že miRNA hrají zásadní role v procesech, jako jsou vývoj, diferenciace, proliferace či apoptóza, a podílejí se na regulaci kmenových vlastností buněk, imunitního systému nebo nádorové transformaci. MiRNA byly objeveny před 17 lety týmem Victora Ambrose. Tato výzkumná skupina popsala, že lin-4, známý gen podílející se na vývoji hlístice Caenorhabditis elegans nekóduje protein, ale místo toho vede ke vzniku 22 nukleotidů dlouhé RNA, která, jak se následně ukázalo, interaguje s mRNA genu pro lin-14 a tlumí jeho translaci [2]. Tato fascinující forma regulace genové exprese, kdy se malá RNA váže na jinou RNA, byla přehlížena více než 30 let. MiRNA zůstávaly nedetekovány, pravděpodobně proto, že snahy „lovců genů“ se soustředily především na dlouhé mRNA, krátké RNA z tohoto hlediska nepředstavovaly zajímavý cíl. Protože funkce miRNA nebyla známa, byly tyto krátké RNA původně považovány za odpadní RNA. Od původní práce popisující funkci lin-4 u hlístice již bylo nabyto mnoho nových poznatků o fungovaní robustní post-transkripční regulační sítě miRNA, až v roce 2006 získali Andrew Z. Fire a Craig C. Mello Nobelovu cenu za fyziologii nebo medicínu za popis jevu RNA interference a způsobu, jak miRNA regulují genovou expresi [3].
Enormní zájem odborné veřejnosti o tuto problematiku nejlépe demonstruje nárůst počtu nových prací indexovaných každoročně v databázi PubMed v průběhu posledních 10 let. Přibližně třetina těchto prací je vždy věnována studiu miRNA u nádorových onemocnění (obr. 1). Těchto v součtu přibližně šest tisíc prací poukázalo nejen na zcela zásadní význam miRNA v molekulární patologii nádorových onemocnění, ale i na jejich možné využití v klinické praxi, a to jak v diagnostice, tak v terapii [4,5]. Získané poznatky vedly k vytvoření biotechnologických společností zaměřených na diagnostiku založenou výhradně na detekci miRNA, jako je například Rosetta Genomics (http://www.rosettagenomics.com/), ale také farmaceutických společností vyvíjejících nové léky cílící miRNA (tab. 1). K nejvýznamnějšímu momentu v této oblasti došlo v září roku 2010, kdy první lék na bázi miRNA vstoupil do fáze 2 klinického hodnocení [5].
Obr. 1. Počet nových publikací v databázi medicínských informací PubMed při zadání klíčového slova „microRNA” nebo kombinace „microRNA” a „cancer”. 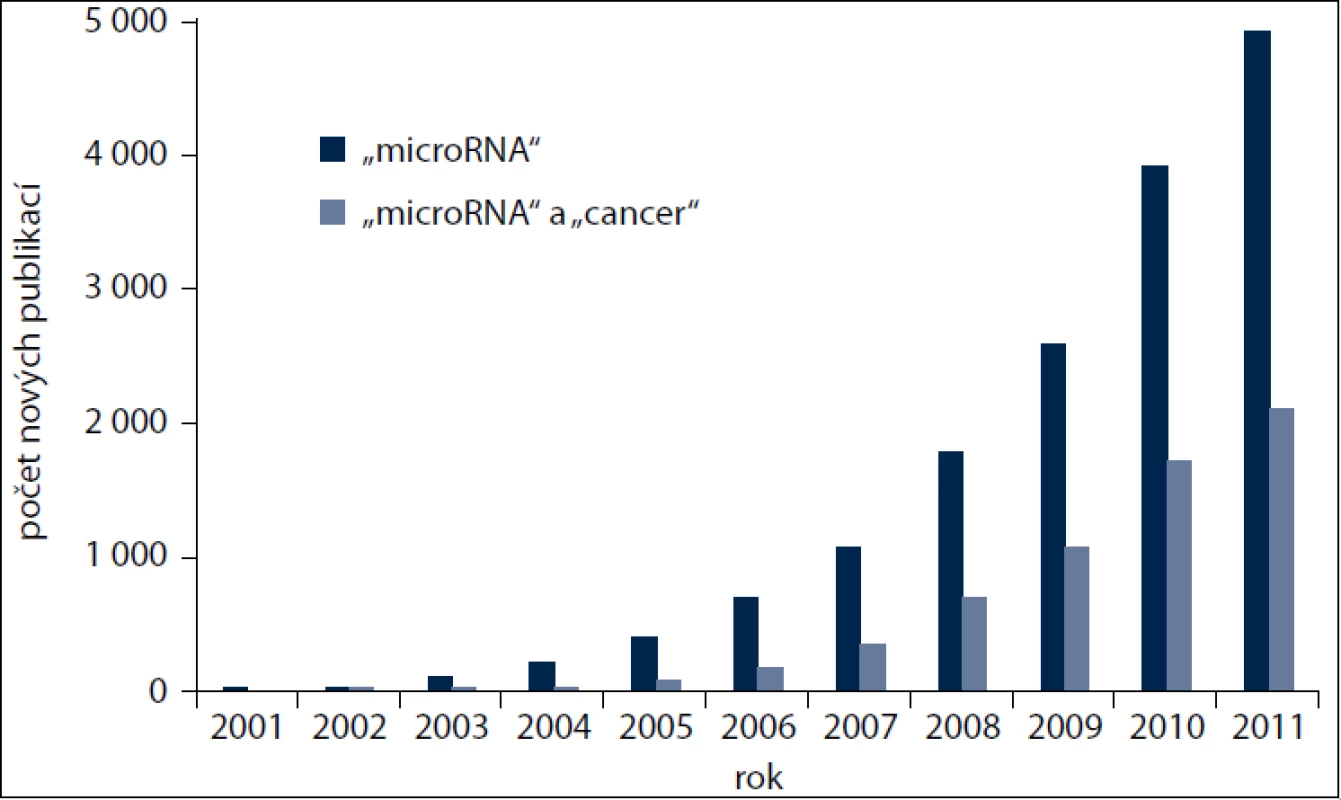
Tab. 1. Přehled nejvýznamnějších farmaceutických společností zabývajících se vývojem léčiv cílených na miRNA. 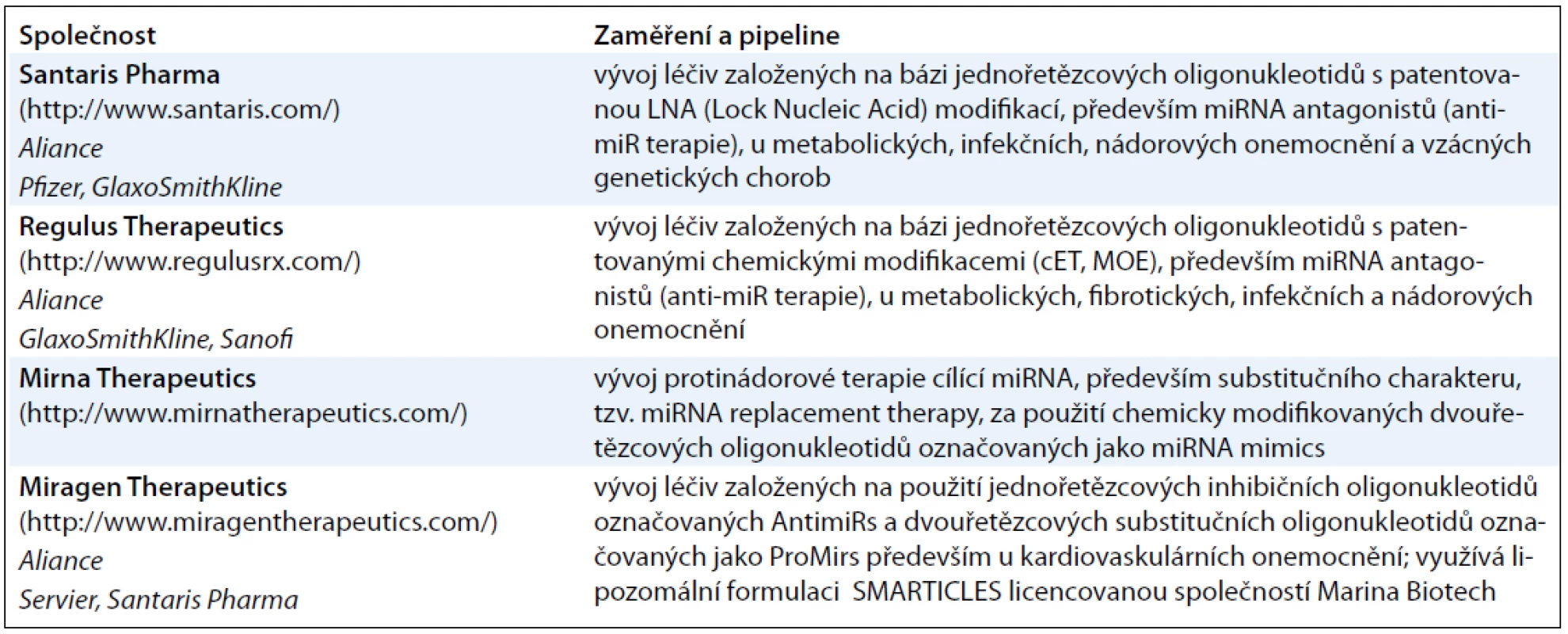
V závislosti na funkci miRNA a jejím stavu v nádorové tkáni existují dvě základní strategie, jak cílit miRNA v terapii nádorových onemocnění: inhibiční (využití antagonistů – anti-miRs) a substituční (využití miRNA mimics).
Antagonisté miRNA (anti-miRs) jsou vytvářeny s cílem tlumit endogenní miRNA, u kterých došlo v nádorové tkáni k patologické aktivaci. Tento přístup je koncepčně podobný jiným inhibičním lékům, které cílí produkt jednoho genu, jako jsou například malé interferující RNA (siRNA) nebo nízkomolekulární inhibitory, a zahrnuje identifikaci miRNA specifické pro dané onemocnění (terapeutický cíl) a vývoj nové molekuly s dostatečnou specificitou a inhibiční aktivitou. Během tohoto procesu může tato miRNA sloužit jako biomarker farmakokinetických a farmakodynamických vlastností vyvíjeného antagonisty. Nejvíce užívaná strategie k tlumení miRNA je založena na použití jednořetězcových oligonukleotidů s komplementární sekvencí k cílové miRNA. Cukr-fosfátová páteř těchto antagonistů je chemicky modifikovaná tak, aby zvýšila jejich afinitu k cílové miRNA a zlepšila jejich farmakokinetické vlastnosti, především je chránila před degradačním účinkem nukleáz (2-O-methylace, LNA – Lock Nucleic Acids, fosforothioatová vazba a další). Výsledná molekula většinou kombinuje více typů modifikací. Dle typu modifikací pak byly tyto oligonukleotidy historicky označovány jako antagomiRs, anti-miRs apod., dnes je pro antagonisty obecně používán termín anti-miR. Vývojem antagonistů miRNA se zabývají především společnosti Santaris Pharma, Regulus Therapeutics a miRagen Therapeutics. Produkt dánské společnosti Santaris Pharma miravirsen (SPC3649) úspěšně ukončil fázi 2a klinického hodnocení v léčbě hepatitidy typu C (HCV). Miravirsen je LNA-antimiRTM oligonukleotid cílící miR-122, která je specifická pro jaterní buňky a je nezbytná k replikaci HCV. Vzhledem k tomu, že miravirsen na rozdíl od konvenčních antivirotik působí na hostitele, a nikoliv virus samotný, je pravděpodobnost vzniku rezistence nízká. Oligonukleotidy nejsou metabolizovány přes CYP450, nýbrž nukleázami, což významně eliminuje problém s lékovými interakcemi [5,7]. V oblasti využití antagonistů miRNA v protinádorové terapii je doposud nejdále společnost Regulus Therapeutics, která úspěšně ukončuje preklinické testování anti-miR-21 v léčbě multiformního glioblastomu a hepatocelulárního karcinomu [8,9]. MiR-21 je jednou z nejvíce studovaných onkogenních miRNA, která byla poprvé popsána právě na modelu multiformního glioblastomu. Regulus Therapeutics má patentované dvě vlastní chemické modifikace – 2’-methoxyethyl (MOE) a 2’, 4’-constrained 2’O-ethyl (cEt), které významně vylepšují farmakokinetický profil jejich anti-miRs. Na využití antagonistů miRNA v terapii kardiovaskulárních onemocnění se zaměřuje společnost miRagen Therapeutics (tab. 2).
Tab. 2. Přehled miRNA sloužících jako terapeutické cíle. 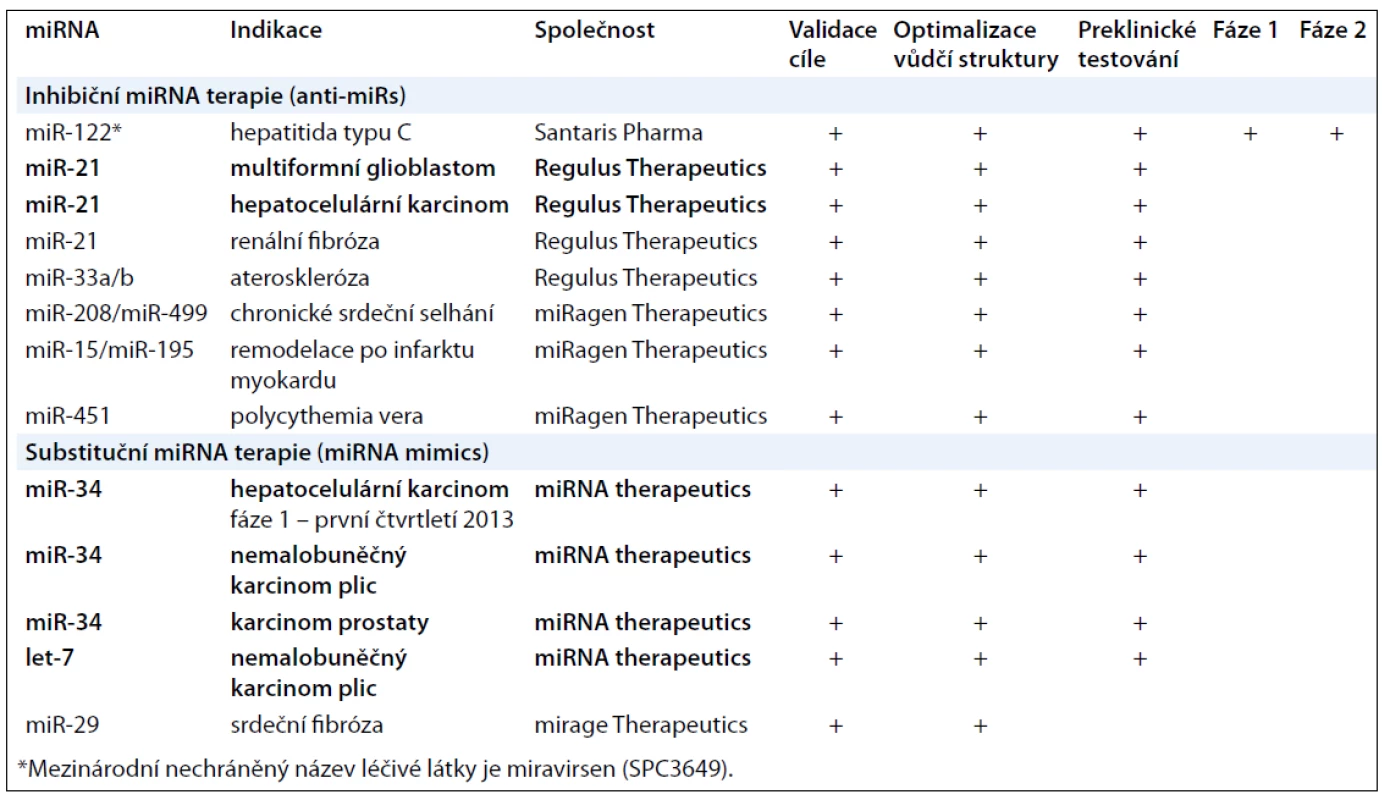
Vzhledem k tomu, že u nádorových onemocnění pozorujeme globální snížení hladin miRNA, je pro terapii nádorových onemocnění podstatně zajímavější druhá, substituční strategie, cílící miRNA, jejichž hladiny jsou v poškozené tkáni snížené. Tato strategie představuje možnost terapeuticky substituovat funkci nádorově supresorových miRNA. Z tohoto hlediska může tento typ terapie upomínat na klasickou genovou terapii, ale nízká molekulová hmotnost miRNA umožňuje jejich podání v podobě krátkých dvouřetězcových oligonukleotidů bez nutnosti použití virových vektorů známých z genové terapie. Tyto dvouřetězcové oligonukleotidy (miRNA mimics) sdílí stejnou sekvenci s endogenní miRNA, a předpokládá se proto, že budou regulovat zcela identický soubor cílových genů. Předpokladem jejich účinku je funkční komplex miRISC (microRNA Induced Silencing Complex), který je multiproteinovým efektorovým komplexem zodpovědným za realizaci funkce miRNA. MiRISC inkorporuje vedoucí řetězec z dvouřetězcové miRNA mimic a tlumí translaci cílových mRNA, zatímco druhý řetězec je degradován. V tomto případě jsou terapeutickou látkou vlastní miRNA a východisko jejich terapeutického užití je založeno spíše na jejich pozměněné hladině v nádorové tkáni než na vybraných cílových genech, které regulují. Cílem substituční terapie není ovlivňovat konkrétní patologickou signální dráhu, ale pouze navodit fyziologický stav ve smyslu navýšení hladin dané miRNA. Uchopit celou šíři regulačních efektů dané miRNA není totiž dost dobře možné, avšak vzhledem k tomu, že stav, který navozujeme, je fyziologický, nevede tato substituce k významným vedlejším účinkům. Informace o signálních drahách a konkrétních genech regulovaných danou miRNA mají samozřejmě svou hodnotu z důvodu lepšího pochopení mechanizmu účinku, nepřímého monitorování aktivity dané miRNA a designování klinických studií. Pěkným příkladem využití miRNA v tomto kontextu je let-7, nádorově supresorová miRNA, jejíž snížené hladiny byly pozorovány u mnoha solidních nádorů. Nejlépe popsanou cílovou molekulou let-7 je onkogen KRAS [10]. Dalo by se tedy předpokládat, že nádorově supresorová funkce let-7 spočívá právě v regulaci onkogenu KRAS. Při utlumení onkogenu KRAS pomocí siRNA v nádorových buňkách dojde k výraznému snížení jejich růstu, nicméně obnovení hladin let-7 vede k mnohonásobně vyššímu protinádorovému účinku [11]. To znamená, že k dosažení tohoto efektu muselo dojít pomocí regulace dalších, v této chvíli neznámých cílových genů. Na vývoj miRNA mimics v terapii nádorových onemocnění se zaměřuje společnost Mirna Therapeutics, která využívá exkluzivní licenci společnosti Marina Biotech na SMARTICLES<sup>®</sup> lipozomální formulaci terapeutických oligonukleotidů. Mirna Therapeutics v současné době úspěšně ukončuje preklinické testování substituce nádorově supresorové miR-34, mezi jejíž cílové geny patří například onkogeny BCL2, MET a CDK4, navíc je transkripčně regulována nádorovým supresorem p53 a podílí se na realizaci jím indukované buněčné smrti. MiR-34 mimic je preklinicky testován u nemalobuněčného karcinomu plic [12], karcinomu prostaty [13] a hepatocelulárního karcinomu. U hepatocelulárního karcinomu je plánován vstup do klinického hodnocení na první čtvrtletí roku 2013. U nemalobuněčného karcinomu plic Mirna Therapeutics preklinicky testuje také let-7 mimic.
Přestože existuje řada výzev, které je třeba v oblasti terapie cílící miRNA řešit, například specifické doručení léku do tkáně či jeho účinné prostupování buněčnou membránou, došlo během posledních tří let v oblasti vývoje léčiv na cílených miRNA k významnému rozvoji. Byly založeny nové farmaceutické společnosti, již existující uzavíraly význačné alianční dohody s velkými farmaceutickými společnostmi (Pfizer, GSK, Sanofi), které do nich investovaly významné finanční obnosy. První klinická studie fáze 2 s použitím antagonisty miRNA byla úspěšně provedena u hepatitidy typu C, další klinické hodnocení fáze 1 je plánováno na začátek roku 2013, kdy bude testován miR-34 mimic u pacientů s hepatocelulárním karcinomem. Problematika miRNA se tak významně posouvá od laboratorního stolu k lůžku pacienta a je potřeba ji v tomto kontextu také vnímat.
RNDr. Ondřej Slabý, Ph.D.
Klinika komplexní onkologické péče
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: on.slaby@gmail.com
Obdrženo: 2. 4. 2012
Zdroje
1. Slaby O (ed). MicroRNAs in Solid Cancer: From Biomarkers to Therapeutic Targets. New York: Nova Science Publishers 2012.
2. Lee RC, Feinbaum RL, Ambros V. The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14. Cell 1993; 75(5): 843–854.
3. Slaby O, Svoboda O, Michalek J et al. MicroRNAs in colorectal cancer: translation of molecular biology into clinical application. Mol Cancer 2009; 8 : 102.
4. Iorio MV, Croce CM. MicroRNA dysregulation in cancer: diagnostics, monitoring and therapeutics. A comprehensive review. EMBO Mol Med 2012; 4(3): 143–159.
5. Garzon R, Marcucci G, Croce CM. Targeting microRNAs in cancer: rationale, strategies and challenges. Nat Rev Drug Discov. 2010; 9(10): 775–789.
6. Bader AG, Brown D, Stoudemire J et al. Developing therapeutic microRNAs for cancer. Gene Ther 2011; 18(12): 1121–1126.
7. Lanford RE, Hildebrandt-Eriksen ES, Petri A et al. Therapeutic silencing of microRNA-122 in primates with chronic hepatitis C virus infection. Science 2010; 327(5962): 198–201.
8. Medina PP, Nolde M, Slack FJ. OncomiR addiction in an in vivo model of microRNA-21-induced pre-B-cell lymphoma. Nature 2010; 467(7311): 86–90.
9. Moore LM, Zhang W. Targeting miR-21 in glioma: a small RNA with big potential. Expert Opin Ther Targets 2010; 14(11): 1247–1257.
10. Esquela-Kerscher A, Trang P, Wiggins JF et al. The let-7 microRNA reduces tumor growth in mouse models of lung cancer. Cell Cycle 2008; 7(6): 759–764.
11. Yu F, Yao H, Zhu P et al. let-7 regulates self renewal and tumorigenicity of breast cancer cells. Cell 2007; 131(6): 1109–1123.
12. Wiggins JF, Ruffino L, Kelnar K et al. Development of a lung cancer therapeutic based on the tumor suppressor microRNA-34. Cancer Res 2010; 70(14): 5923–5930.
13. Liu C, Kelnar K, Liu B et al. The microRNA miR--34a inhibits prostate cancer stem cells and metastasis by directly repressing CD44. Nat Med 2011; 17(2): 211–215.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článek Klinický registr GISTČlánek Editorial
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2012 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
-
Všetky články tohto čísla
- Prognostický význam morfologického hodnocení u mnohočetného myelomu
- Ionizujúcim žiarením indukované dlhodobé zmeny v hipokampe za experimentálnych podmienok
- Paliativní chirurgická léčba nádorů pankreatu a periampulární oblasti
- Tyreopatie u žien s karcinómom prsníka
- Gastrointestinální stromální tumor duodena projevující se akutním krvácením do horního zažívacího traktu a léčený klínovitou resekcí
- Klinický registr GIST
- MikroRNA vstupují do klinického testování
- Informace z České onkologické společnosti
- Novinky v diagnostice a léčbě primárních nádorů mozku – závěry mezioborového setkání „Winter GLIO TRACK Meeting“ 2012
- Editorial
- Agresívna fibromatóza: geneticko-biologické korelácie
- Agresívna fibromatóza: klinické aspekty
- Změny imunologické reaktivity u onkologických pacientů
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Agresívna fibromatóza: geneticko-biologické korelácie
- Agresívna fibromatóza: klinické aspekty
- Paliativní chirurgická léčba nádorů pankreatu a periampulární oblasti
- Tyreopatie u žien s karcinómom prsníka
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



