-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Tyreopatie u žien s karcinómom prsníka
Thyroid Disorders in Women with Breast Cancer
Aim:
Increasing prevalence of non-malignant thyroid disorders in women with breast cancer has been known for several decades; it is said to be associated with a better prognosis of the cancerous disease.
The aim of this work was to analyse associations between thyropathies found in women with breast cancer and particular prognostic factors.Patients and Methods:
A group of 110 women with breast cancer were tested for autoimmune thyroiditis (AIT) and functional changes of the thyroid gland. Presence of thyroid-peroxidase autoantibodies (TPOAb), serum levels of thyroid-stimulating hormone (TSH) and free thyroxine (FT3, FT4) were determined after the surgery but before adjuvant cancer treatment (radiotherapy, chemotherapy or hormone therapy) initiation. Conventionally evaluated prognostic factors of breast cancer, including histological grading and molecular predictive factors (i.e. the status of the hormone receptors and the human epidermal growth factor receptor) were assessed – these were divided into four basic categories.Results and Conclusions:
The incidence of AIT and subclinical hypothyroidism in the study group was 37.3% and 20%, respectively, i.e. higher than in the general population. The only correlation found was between thyropathies and the specific prognostic factors was that with G1 breast cancer grading.Key words:
breast cancer – autoimmune thyroiditis – hypothyroidism – thyroid-stimulating hormone – free thyroxine – thyroid peroxidase – estrogen receptor – progesterone receptor – HER2 receptor
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
4. 8. 2011Accepted:
13. 10. 2011
Autoři: E. Hajtmanová 1; P. Muríň 1; I. Kinclová 1; A. Hajtman 2; M. Péč 3; Ľ. Kostková 1; M. Kočišová 1
Působiště autorů: Onkologické centrum, UN Martin, Slovenská republika 1; Súdno-lekárske pracovisko Úradu pre dohľad nad zdravotnou starostlivosťou, pobočka Martin, Slovenská republika 2; Ústav lekárskej biológie, JLF UK Martin, Slovenská republika 3
Vyšlo v časopise: Klin Onkol 2012; 25(2): 124-129
Kategorie: Původní práce
Souhrn
Cieľ:
Zvýšený výskyt nezhubných ochorení štítnej žľazy u žien s karcinómom prsníka, známy už niekoľko desiatok rokov, je spájaný s lepšou prognózou zhubnej nádorovej choroby.
Cieľom práce je analýza výskytu tyreopatií u žien so zhubným nádorom prsníka a ich vzťah k vybraným prognostickým faktorom.Súbor pacientok a metódy:
V súbore 110 žien s karcinómom prsníka sme zisťovali výskyt autoimunitných tyreoiditíd (AIT) a funkčných zmien štítnej žľazy. Protilátky proti tyreoperoxidáze (TPOAb), sérové hladiny tyreostimulačného hormónu (TSH) a voľného tyroxínu (FT3, FT4) boli vyšetrované v období po operácii, pred adjuvantnou onkologickou liečbou (rádioterapiou, chemoterapiou alebo hormonoterapiou). Výsledky sme vyhodnotili vo vzťahu k štandardne vyšetrovaným prognostickým faktorom karcinómu prsníka – k histologickému gradingu a k molekulovým prognosticko-prediktívnym faktorom (k stavu hormónových receptorov a receptora pre ľudský epidermálny rastový faktor), rozdeleným do štyroch základných skupín.Závery:
Výskyt 37,3 % AIT a 20 % subklinickej hypotyreózy v našom súbore potvrdzuje vyššiu incidenciu tyreopatií u žien s karcinómom prsníka oproti zdravej populácii. Korelácia zistených tyreopatií bola štatisticky významná k prognosticky najpriaznivejšiemu stupňu malignity karcinómu prsníka G1. Závislosť medzi tyreopatiami a molekulovými prognostickými faktormi v sledovanom súbore nebola signifikantná.Kľúčové slová:
karcinóm prsníka – autoimunitná tyreoiditída – hypotyreóza – tyreostimulačný hormón – voľný tyroxín – tyreoperoxidáza – estrogénový receptor – progesterónový receptor – HER2 receptorÚvod
Výskyt nezhubných ochorení štítnej žľazy u žien s karcinómom prsníka je predmetom záujmu už niekoľko desiatok rokov. V mnohých publikáciách boli analyzované súvislosti medzi tyreopatiami a zhubným nádorom prsníka. Už v štúdii z roku 1950 Ellerker uvádza, že karcinóm prsníka sa vyskytuje zriedka u žien s hypertyreózou, ale je častý u žien s hypotyreózou [1]. Hoci Beatson publikoval použitie extraktov štítnej žľazy pri liečbe metastatického karcinómu prsníka už pred viac ako sto rokmi, možné súvislosti, diskutované niekoľko desaťročí, ostávajú stále kontroverzné. Výsledky ďalších štúdií naznačujú klinický, ale zatiaľ biologicky nepotvrdený vzťah medzi nezhubnými chorobami štítnej žľazy a rizikom invazívneho karcinómu prsníka [2].
Cieľom našej práce bolo analyzovať výskyt tyreopatií u žien so zhubným nádorom prsníka v regióne Martin a okolie. Všetky pacientky boli vyšetrené po operačnej liečbe ešte pred adjuvantnou onkologickou liečbou (rádioterapiou, chemoterapiou alebo hormonoterapiou), ktorá by mohla ovplyvniť výsledok. Sledovali sme u nich prítomnosť protilátok proti tyreoperoxidáze (TPOAb), sérové hladiny TSH a voľného FT3, FT4. Na základe predpokladu, že funkcia štítnej žľazy môže ovplyvniť vznik a vývoj zhubnej nádorovej choroby, sme vyhodnotili vzťah AIT a funkčných zmien štítnej žľazy k štandardne vyšetrovaným prognostickým faktorom karcinómu prsníka – k histologickému gradingu a k molekulovým prognosticko-prediktívnym faktorom, a to k stavu hormónových estrogénových (ER) a progesterónových (PR) receptorov a receptora pre ľudský epidermálny rastový faktor (human epidermal growth factor receptor 2, HER2), rozdelených do štyroch základných skupín.
Materiál a metódy
Do štúdie boli zaradené všetky ženy s diagnózou karcinómu prsníka, liečené v Onkologickom centre Univerzitnej nemocnice Martin (OC UNM) v období od októbra 2010 do apríla 2011. Všetky pacientky pochádzali z geografickej oblasti Martin a okolie. Do súboru boli zaradené pacientky, ktoré absolvovali chirurgickú liečbu – kvadrantektómiu/mastektómiu s extirpáciou regionálnych lymfatických uzlín. Histopatologickým vyšetrením bol u všetkých verifikovaný invazívny duktálny karcinóm prsníka a určený stupeň malignity. Do štúdie neboli zaradené pacientky, ktoré nemali vyšetrené všetky hodnotené parametre FT3, FT4, TSH, TPOAb, ER, PR a HER2 pred začatím adjuvantnej liečby. Na základe uvedených inklúznych a exklúznych kritérií bol získaný súbor 110 pacientok (tab. 1).
Tab. 1. Charakteristika súboru. 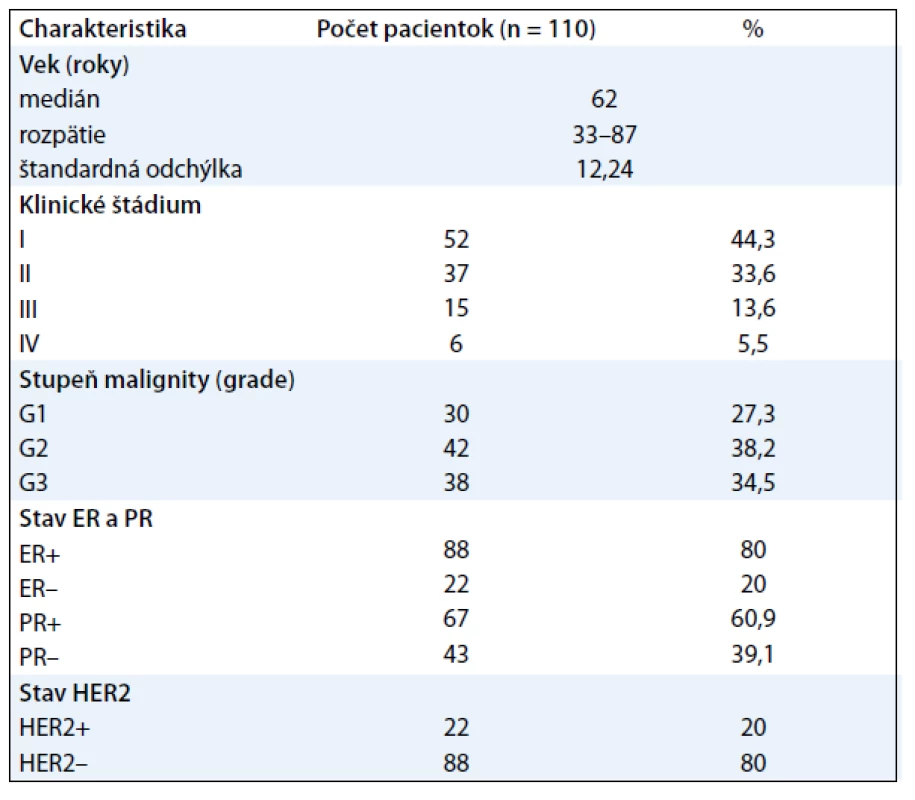
Podľa stavu vyšetrených estrogénových, progesteronových receptorov (ER, PR) a receptora HER2 [3] boli pacientky rozdelené do 4 skupín:
- karcinómy s luminálnou diferenciáciou A (ER/PR+, HER2–),
- karcinómy s luminálnou diferenciáciou B (ER/PR+, HER2+),
- karcinómy HER2/neu pozitívne (ER–, PR–, HER2+),
- karcinómy triple negatívne (ER–, PR–, HER2–).
Rozdelenie karcinómov s luminálnou diferenciáciou B na podtypy podľa aktuálneho klinicko-patologického rozdelenia St. Gallen 2011 [4] nebolo použité pre obmedzenie vyšetrenia Ki-67 na našom pracovisku.
Všetky pacientky mali vyšetrené sérové hladiny tyreostimulačného hormónu (TSH), voľného tyroxínu (FT3, FT4) a protilátky proti tyreoperoxidáze (TPOAb). Vyšetrenia boli vykonané na pracovisku Klinickej biochémie UNM metódou chemiluminiscencie. Referenčné intervaly fyziologických hodnôt pracoviska boli stanovené pre TSH: 0,34–3,6 mIU/l, FT3 : 3,9–6,7 pmol/l, FT4 : 7,86–16 pmol/l, TPOAb: 0–9 IU/ml. Všetky odbery boli vykonané v čase po operačnej liečbe, pred adjuvantnou onkologickou liečbou (rádioterapiou, chemoterapiou alebo hormonoterapiou).
Funkcia štítnej žľazy bola hodnotená podľa hodnôt sérových hladín TSH, FT4, FT3:
- TSH, FT4 v medziach normy – normálna funkcia štítnej žľazy (eutyreóza),
- TSH zvýšené, FT4 normálne – znížená funkcia, bez klinických príznakov (subklinická hypotyreóza),
- TSH zvýšené, FT4 znížené – znížená funkcia štítnej žľazy úplne rozvinutá (manifestná hypotyreóza),
- TSH znížené, FT4 normálne – zvýšená funkcia, bez klinických príznakov (subklinická hypertyreóza),
- TSH znížené, FT4 zvýšené – klinicky rozvinutá zvýšená funkcia (manifestná hypertyreóza).
Diagnosticky najvýznamnejší je vzťah FT4 a TSH, stanovenie celkového trijódtyronínu a jeho voľnej frakcie FT3 má zväčša spresňujúcu hodnotu.
Analýza dát a štatistické zhodnotenie
Na zistenie štatistickej významnosti rozdielu počtov žien v jednotlivých skupinách bol použitý pomer šancí (OR – Odds Ratio) s 95% intervalom spoľahlivosti (95% CI – Confidence Interval). Ak 95% CI nezahŕňa jednotku, rozdiel je štatisticky signifikantný. Na určenie miery rozdielu bol použitý Chí kvadrát test. Za signifikantné boli považované výsledky na hladine významnosti P < 0,05.
Na štatistickú analýzu bol použitý software MS Excel a SPSS Statistics 17.0.
Výsledky
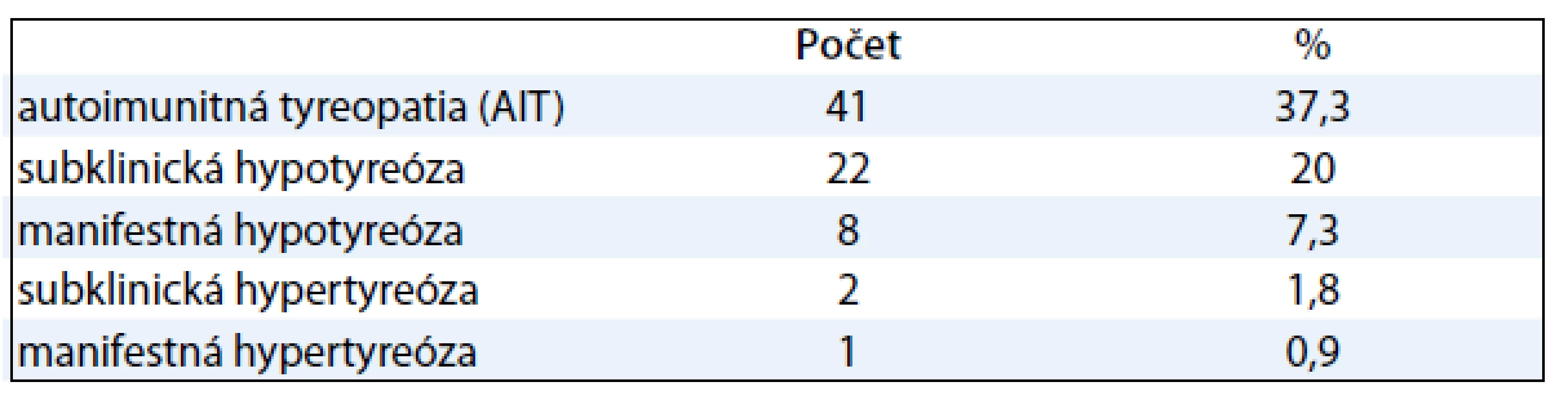
Výskyt tyreopatií sme v sledovanom súbore 110 pacientok zistili u 51 žien (46 %). Výskyt AIT a jednotlivých funkčných porúch štítnej žľazy ukazuje tab. 2.
Pozitivitu protilátok TPOAb sme v sledovanej skupine zistili u 37,3 % žien, čo je významne vyššia hodnota oproti 10 %, uvádzaným pre zdravú populáciu [5].
Frekvencia subklinickej hypotyreózy je udávaná v 2–5 % našej populácie a u žien vyššieho veku (nad 60 rokov) sa vyskytuje až v 10–15 % [6,7]. V sledovanom súbore sme subklinickú hypotyreózu zistili u 20 % žien.
Výskyt manifestnej hypotyreózy sa udáva v našej populácii u 5–10 % žien a s vekom stúpa až do 20 % [7,8]. V našom súbore sme hypotyreózu potvrdili len u 7,3 % žien.
V sledovanom súbore sme subklinickú hypertyreózu zistili u 1,8 % a manifestnú hypertyreózu u 0,9 % žien.
Percentuálny výskyt AIT, subklinickej a manifestnej hypotyreózy v závislosti od vekovej kategórie, je znázornený v grafe 1. Výsledné hodnoty potvrdzujú zvyšovanie počtu AIT so stúpajúcim vekom pacientok. Pomalá progresia autoimunitného procesu spôsobuje tiež stúpanie výskytu hypotyreózy s vekom, ako to vidno aj na našom grafe. Do súvisu s týmto procesom možno dať aj absenciu subklinickej hypotyreózy vo vekovej kategórii nad 80 rokov. Pokles výskytu tyreopatií vo vekovej kategórii od 70 do 79 rokov bol spôsobený malým počtom pacientok v porovnaní s počtom v ostatných vekových kategóriách.
Graf 1. Incidencia AIT, subklinickej a manifestnej hypotyreózy v závislosti od veku. 
V tab. 3 bola štatisticky vyhodnotená závislosť medzi AIT, hypotyreózou a stupňom malignity karcinómu prsníka. Pre malý počet pacientok s manifestnou hypotyreózou sme vyhodnocovali pacientky so subklinickou a manifestnou hypotyreózou ako jednu skupinu. Štatisticky významná závislosť bola potvrdená medzi obidvoma skupinami tyreopatií a prognosticky najpriaznivejším stupňom malignity karcinómu prsníka G1.
Tab. 3. Korelácia AIT, funkcie štítnej žľazy a stupňa malignity karcinómu prsníka. 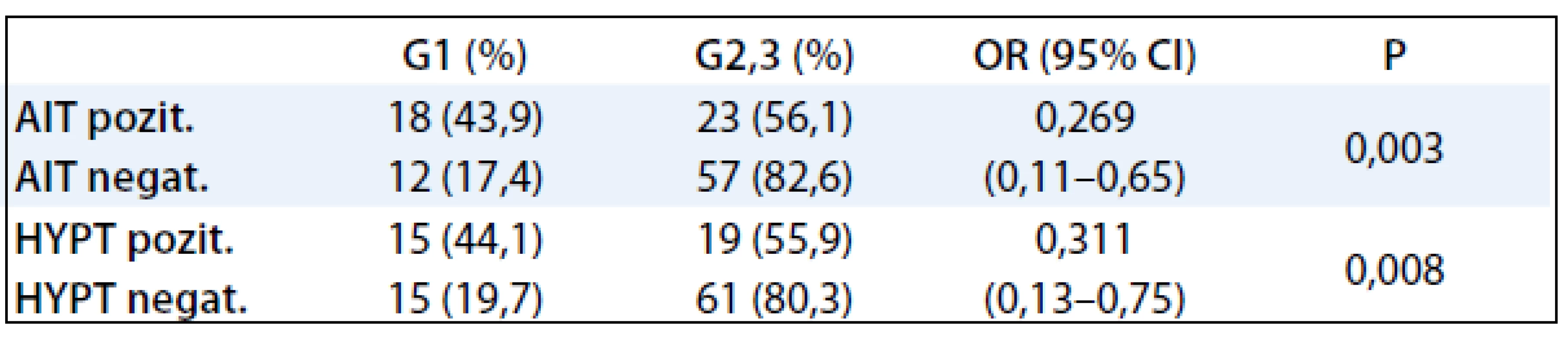
V tab. 4 nebola zistená štatisticky signifikantná závislosť medzi AIT, hypotyreózou a molekulovými prognosticko-prediktívnymi faktormi karcinómu prsníka. Percentuálne zastúpenie pacientok v jednotlivých skupinách, uvedených v tabuľke, je porovnateľné s údajmi.
Tab. 4. Korelácia AIT, funkcie štítnej žľazy a molekulových prognosticko-prediktívnych faktorov karcinómu prsníka. 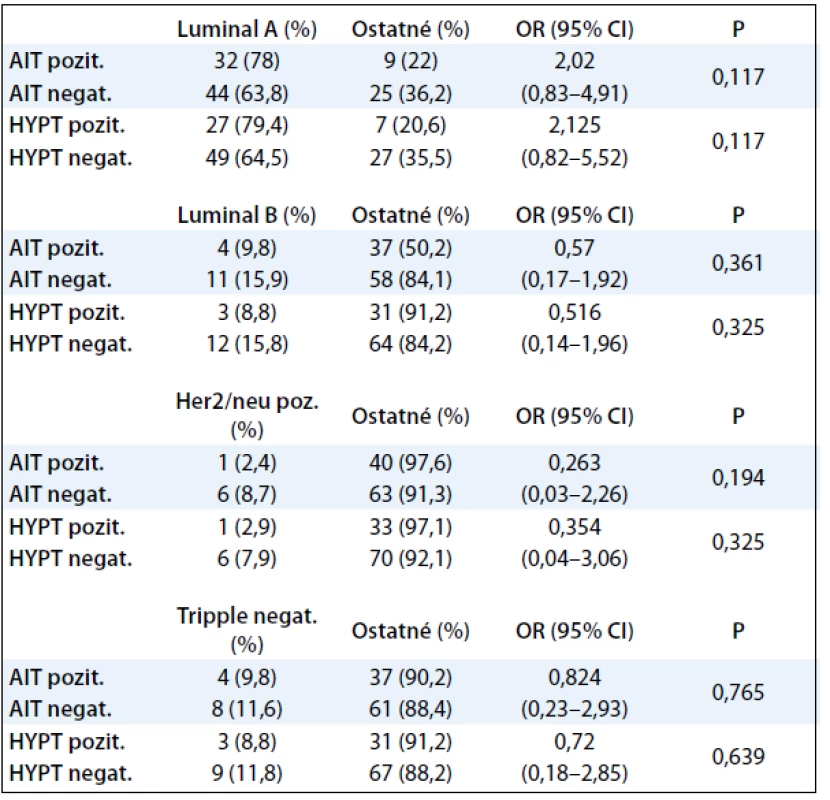
IT: autoimunitná tyreopatia, OR: pomer šancí, CI: interval spoľahlivosti, P: P hodnota Chí kvadrát test, HYPT: hypotyreóza, G1: grading karcinómu 1, G2,3: grading karcinómu 2 alebo 3 Diskusia
V priebehu posledných 50 rokov bolo publikovaných mnoho štúdií o vzťahu medzi rakovinou prsníka a nezhubnými chorobami štítnej žľazy. Väčšina z nich potvrdila vyšší výskyt tyreopatií u žien s karcinómom prsníka, možné súvislosti sú však stále predmetom diskusií. V posledných rokoch bolo publikovaných viacero prác, zaoberajúcich sa úlohou jódu v patogenéze autoimunitných tyreopatií, nezhubných a zhubných nádorov štítnej žľazy a rakoviny prsníka. Bolo dokázané, že vychytávanie a prenos jódu z intersticiálnej tekutiny do vnútra tyreocytu umožňuje membránový transportný proteín – natrium-jodidový symportér – jodidová pumpa (NIS). Expresia NIS bola dokázaná okrem tyreocytov aj v tkanive prsníka, žalúdka, slinných žľazách a iných tkanivách [9,10]. Význam antioxidačnej funkcie jódu v kancerogenéze štítnej žľazy, prsníka a žalúdka potvrdzujú viaceré práce [11,12]. Antiproliferatívne účinky jódu, viazaného s molekulami lipidov v nontyroidálnych tkanivách, pozorované na zvieracích modeloch, si však vyžadujú ďalší výskum [13,14]. Vzhľadom na významnú úlohu príjmu jódu v patogenéze tyreopatií sme vybrali sledovaný súbor žien z jednej geografickej oblasti – Martin a okolie, s predpokladaným rovnakým príjmom jódu.
Výskyt sledovaných parametrov funkcií štítnej žľazy (TSH, T3, T4) a tyreoidovej autoimunity (TPOAb) bol v našom súbore žien podstatne vyšší oproti priemerným hodnotám, uvádzaným pre zdravú populáciu žien v oblastiach s normálnym príjmom jódu.
TPOAb je definovaný ako marker autoimunitného ochorenia štítnej žľazy [15]. Prítomnosť protilátok proti tyreoperoxidáze bola v našom súbore zistená u 37,3 % žien, čo bola hodnota podobná publikovaným údajom 28–34 % [16,17], získaným za podobných podmienok – po chirurgickej liečbe a pred akoukoľvek adjuvantnou liečbou, ktorá by mohla podľa niektorých autorov ovplyvniť hodnotené parametre [18–20]. Giustarini et al potvrdili vo svojej práci významný vzťah medzi autoimunitným postihnutím štítnej žľazy a rakovinou prsníka. Pozitivitu protilátok proti tyreoperoxidáze TPOAb zistili u 33,3 % žien so zhubným nádorom prsníka oproti 20 % v skupine žien s benígnym ochorením prsníka a 8 % v kontrolnej skupine zdravých žien. Súbor žien s rakovinou prsníka bol vyšetrovaný ešte pred operačnou liečbou, čím bol vylúčený aj možný vplyv operačného stresu a anestézie [21]. Je totiž známe, že stres má vplyv na imunitný systém prostredníctvom neuroendokrinného systému a môže vyvolať alebo zhoršiť autoimunitné ochorenia [22,23].
Zvýšená hladina protilátok proti tyreoperoxidáze je spájaná s lepšou prognózou karcinómu prsníka [2,16]. V analýze prežitia skupiny 142 žien Smyth et al potvrdili, že prítomnosť protilátok TPOAb (titre ≥ 0,3 U/ml) je spojená s dlhším bezrelapsovým intervalom a dlhším celkovým prežívaním žien s rakovinou prsníka. Hodnotu tohto prognostického efektu prirovnávajú k prognostickým faktorom, ako je stav axilárnych lymfatických uzlín alebo k veľkosti nádoru [17]. Tento predpoklad sme si overovali v našom súbore žien prostredníctvom vzťahu medzi pozitivitou TPOAb a prognostickými faktormi karcinómu prsníka – histologickým gradingom, stavom hormónových receptorov a receptorom HER2.
Určenie stupňa malignity (grade) je stanovenie rastového a invazívneho potenciálu príslušného nádoru a proliferačnej aktivity jeho parenchýmových buniek. Nádory G1 sú dobre diferencovanými nádormi s tendenciou k plnej diferencovateľnosti (podobnosti s dospelými bunkami tkaniva, z ktorého vychádza) vo viac ako ¾ nádorových buniek podľa Brodersovho systému [24]. V našej štúdii bol potvrdený štatisticky signifikantný vzťah medzi skupinou pacientok s AIT prognosticky najpriaznivejším stupňom malignity G1 (P = 0,003). Nižší grading ochorenia je potvrdený ako pozitívny prognostický faktor u karcinómov prsníka [24].
Karcinóm prsníka je onkologické ochorenie, charakterizované heterogénnym morfologickým obrazom i klinickým priebehom. Za fenotypickú variabilitu sú zodpovedné genetické a epigenetické zmeny, vedúce k narušeniu rovnováhy medzi bunkovou proliferáciou, apoptózou, diferenciáciou, starnutím a mechanizmami kontrolujúcimi tieto bunkové procesy. Okrem tradičných prediktívne prognostických faktorov (veľkosť nádoru, stav lymfatických uzlín...) sa v poslednej dobe začal uplatňovať aj molekulárny profil nádorových buniek prsníka a expresia niektorých špecifických proteínov. Z molekulových prognosticko-prediktívnych faktorov sa z veľkého počtu potenciálnych parametrov vyselektovali tri markery: stav hormónových receptorov – estrogénových ER, progesterónových – PR a receptora pre ľudský epidermálny rastový faktor HER2. Na základe štatistických metaanalýz boli definované štyri základné skupiny: karcinómy s luminálnou diferenciáciou A (ER/PR+, HER2–), ktoré tvoria najpočetnejšiu skupinu, ďalej pomerne malá skupina karcinómov s luminálnou diferenciáciou B (ER/PR+, HER2+), skupina nádorov HER2/neu pozitívnych (ER–, PR–, HER2+) a vzácna skupina vysoko agresívnych nádorov, tzv. triple negatívnych (ER–, PR–, HER2–). Luminálne A karcinómy prsníka sú charakterizované nízkou proliferačnou aktivitou, dobrou diferenciáciou s nízkym percentom recidív. Luminálne B karcinómy prsníka majú vyššiu proliferačnú aktivitu s horšou diferenciáciou a prejavujú sa početnejšími recidívami. Skupina nádorov HER2/neu pozitívnych je charakterizovaná zvýšenou proliferačnou aktivitou s významne kratším bezrelapsovým intervalom a kratším celkovým prežívaním, bez ohľadu na postihnutie lymfatických uzlín. Triple negatívne karcinómy prsníka sú charakteristické agresívnym priebehom s častejším postihnutím lymfatických uzlín a celkove zlou prognózou [25–27]. Vzťah medzi pozitivitou tyreoperoxidázy a jednotlivými typmi karcinómu prsníka – luminálnym A, luminálnym B, HER2/neu pozitívnym a triple negatívne nebol v našom súbore štatisticky významný. Aj napriek tomu, že počet luminálnych karcinómov typu A bol v oboch skupinách pomerne vysoký, široký interval spoľahlivosti v skupine s AIT i v skupine s hypotyreózou negatívne ovplyvnil výsledok. Na presnejšie potvrdenie hypotézy by bolo potrebné rozšíriť počet sledovaných pacientok.
Autoimunitné tyreopatie sú najdôležitejšou príčinou primárnej hypotyreózy v krajinách s normálnym príjmom jódu, čo má veľký klinický význam. Najčastejšou príčinou hypotyreózy je chronická lymfocytárna tyreoiditída – diagnózu potvrdí pozitivita TPOAb a/alebo ultrazvuk štítnej žľazy [28]. Ide o chronické ochorenie s pomalou progresiou, pričom sa pacientky dostávajú časom z eutyroidnej fázy do hypotyreózy [29]. Nález vyšších hodnôt TSH v sére, a to aj v rozmedzí referenčných hodnôt, spolu s pozitívnymi protilátkami TPOAb naznačuje rýchlejší vývoj ochorenia [17]. Najvhodnejším parametrom na identifikáciu hypotyreózy je hladina TSH a inverzný vzťah TSH a FT4. Výskyt subklinickej hypotyreózy 20 % v našom súbore žien bol výrazne vyšší oproti frekvencii 2–5 % v populácii zdravých žien a hodnotám 10–15 % u žien vyššieho veku [6,7]. Výskyt 7,3 % klinickej hypotyreózy bol však v našom súbore žien v rozmedzí hodnôt, udávaných pre zdravú populáciu. Možné vysvetlenie tohto výsledku si vyžaduje sledovanie hormonálneho profilu štítnej žľazy vo väčšom súbore.
Hormóny štítnej žľazy zohrávajú významnú úlohu vo fyziologických procesoch a majú zásadný význam pre metabolické procesy, rast a dozrievanie tkanív. Z toho vyplýva, že funkcia štítnej žľazy môže ovplyvniť vznik a vývoj zhubnej nádorovej choroby [30] a hormóny štítnej žľazy podľa tejto hypotézy stimulujú rast zhubného nádoru [31]. Hypotyreóza by tak mohla viesť k zníženiu rizika ich vzniku a k priaznivejšej prognóze pacientov so zhubnou nádorovou chorobou [30]. Významnú ochrannú úlohu hypotyreózy, ako nezávislého rizikového faktora karcinómu prsníka podporila Gailova multidimenzionálna logistická regresná analýza [32]. Pacientky s primárnou hypotyreózou mali až 61% zníženie rizika vzniku invazívneho ochorenia. Hodnota tejto analýzy však bola obmedzená použitím retrospektívnych dát. Signifikantná korelácia medzi hypotyreózou a prognosticky najpriaznivejším stupňom malignity karcinómu prsníka G1 v našej práci potvrdzuje tento predpoklad.
Názory na populačný skríning tyreoidovej dysfunkcie sú v súčasnosti nejednotné. Väčšina odborných spoločností podporuje skríning u vysoko rizikových skupín, ako sú ženy s rodinnou anamnézou tyreopatie, autoimunitnej choroby, predchádzajúcej tyreoidovej dysfunkcie, symptómami suponujúcimi hypo - a hypertyreózu alebo diabetes mellitus typu 1 [33]. V mnohých publikovaných prácach potvrdzujúcich zvýšený výskyt tyreopatií u žien s karcinómom prsníka je aj táto skupina žien označovaná ako riziková a vhodná pre skríning tyreoidovej dysfunkcie [16,17,21,34].
Zvýšený výskyt tyreopatií u žien s karcinómom prsníka, potvrdený v našom súbore, bol podnetom pre vyšetrovanie hormonálneho profilu štítnej žľazy u každej pacientky s touto diagnózou, liečenou na našom pracovisku. Všetky pacientky s patologickými parametrami tyreoidovej funkcie boli vyšetrené a sú v endokrinologickej starostlivosti. Predmetom nášho ďalšieho sledovania bude podrobnejšia analýza parametrov tyreoidovej dysfunkcie a autoimunity v súvislosti s jednotlivými modalitami adjuvantnej onkologickej liečby.
Záver
Zhubné nádorové ochorenia prsníka sú sprevádzané zvýšeným výskytom autoimunitných tyreopatií a dysfunkcií štítnej žľazy, čo potvrdili aj výsledky našej práce. Aj keď stále chýbajú dôkazy o biologickom vzťahu medzi týmito chorobnými jednotkami, frekventovanými hlavne u starších žien, skríningové vyšetrenie tyreoidových protilátok a sérových hladín hormónov štítnej žľazy má v tejto rizikovej skupine žien svoje opodstatnenie. Diagnostikované tyreopatie je potrebné dispenzarizovať aj v prípade eutyreózy a pravidelne kontrolovať funkciu štítnej žľazy. Predíde sa tým komplikáciám z neskorého podchytenia hypotyreózy (medzi ktorými dominujú hyperlipoproteinémia, poruchy kognitívnych funkcií, depresia, vzostup telesnej hmotnosti, akcelerácia artériosklerózy a vyššia mortalita z kardiovaskulárnych a všetkých iných príčin), kombinovaným toxicitou onkologickej liečby [24,33]. Podľa Giustariniho je vhodné vykonávať vyšetrenie ešte pred operáciou, aby v prípadoch hypotyreózy bolo možné zahájiť substitučnú liečbu ešte pred operačným výkonom [21]. Zvýšený výskyt zhubných nádorov prsníka bol potvrdený aj v opačnom prípade – u žien s benígnym ochorením štítnej žľazy, čo potvrdzuje užitočnosť vyšetrení prsníka aj v tejto skupine žien [35].
Korelácia AIT a hypotyreózy u žien sledovaného súboru bola signifikantná len so stupňom malignity karcinómu prsníka G1, čo potvrdzuje, že morfologická klasifikácia zostáva základným kameňom stanovenia správnej diagnózy a spôsobu onkologickej liečby. Korelácia s molekulovými prognostickými faktormi nebola v našej analýze štatisticky významná. Výsledok bol ovplyvnený, okrem iných faktorov, aj malým počtom pacientok v jednotlivých skupinách. Priaznivejšiu prognózu karcinómu luminálneho typu A a B však potvrdzujú mnohé štúdie z posledných rokov. Molekulárny profil nádorových buniek karcinómu prsníka a expresia niektorých špecifických proteínov sa ukazujú ako nezávislé prognostické a prediktívne faktory, rozširujúce liečebné možnosti karcinómu prsníka hlavne v oblasti biologickej terapie.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
MUDr. Eva Hajtmanová, PhD.
Onkologické centrum
Univerzitná nemocnica Martin
Kollárova 2
036 59 Martin
Slovenská republika
e-mail: hajtmanova@unm.sk
Obdrženo: 4. 8. 2011
Přijato: 13. 10. 2011
Zdroje
1. Cristofanilli M, Yamamura Y, Kau SW et al. Thyroid hormone and breast carcinoma. Primary hypothyroidism is associated with a reduced incidence of primary breast carcinoma. Cancer 2005; 103(6): 1122–1128.
2. Smyth PP. The thyroid, iodine and breast cancer. Breast Cancer Res 2003; 5(5): 235–238.
3. Carvalho ST, Stiepcich MM, Fregnani JH et al. Evaluation of prognostic factors in stage IIA breast tumors and their correlation with mortality risk. Clinics (Sao Paulo) 2011; 66(4): 607–612.
4. Goldhirsch A, Wood WC, Coates AS et al. Panel members. Strategies for subtypes-dealing with the diversity of breast cancer: highlights of the St. Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2011. Ann Oncol 2011; 22(8): 1736–1747.
5. Podoba J. Najčastejšie tyreopatie v ambulanciii praktického lekára. Via Pract 2005; 2(5): 230–235.
6. Hrnčiar J. Racionálna diagnostika funkčných porúch štítnej žľazy v klinickej praxi. Interní Med 2006; 1 : 18–23.
7. Zamrazil V. Subklinické tyreopatie. Interní Med 2004; 6 : 295–299.
8. Vargová V, Pytliak M, Mechírová V. Hypotyreóza u seniorov. Čes Ger Rev 2010; 8(1–2): 22–26.
9. Riedel C, Dohán O, De la Vieja A et al. Journey of the iodide transporter NIS: from its molecular identification to its clinical role in cancer. Trends Biochem Sci 2001; 26(8): 490–496.
10. Kogai T, Taki K, Brent GA. Enhancement of sodium/iodine symporter expression in thyroid and breast cancer. Endocr Relat Cancer 2006; 13(3): 797–826.
11. Venturi S, Donati FM, Venturi A et al. Role of iodine in evolution and carcinogenesis of thyroid, breast and stomach. Adv Clin Path 2000; 4(1): 11–17.
12. Smyth PP. Role of iodine in antioxidant defence in thyroid and breast disease. Biofactors 2003; 19(3–4): 121–130.
13. Cann SA, van Netten JP, Glover DW et al. Iodine accumulation in extrathyroidal tissues. J Clin Endokrinol Metab 1999; 84(2): 821–822.
14. Cann SA, van Netten JP, van Netten C. Hypothesis: iodine, selenium and the development of breast cancer. Cancer Causes Control 2000; 11(2): 121–127.
15. Kuijpens JL, Nyklíctek I, Louwman MW et al. Hypothyroidism might be related to breast cancer in post-menopausal women. Thyroid 2005; 15(11): 1253–1259.
16. Turken O, Narln Y, Demlrbas S et al. Breast cancer in association with thyroid disorders. Breast Cancer Res 2003; 5(5): R110–R113.
17. Smyth PP, Shering SG, Kilbane MT et al. Serum thyroid peroxidase autoantibodies, thyroid volume, and outcome in breast carcinoma. J Clin Endocrinol Metab 1998; 83(8): 2711–2716.
18. Cutuli B, Quetin P, Rodier JF et al. Severe hypothyroidism after chemotherapy and locoregional irradiation for breast cancer. Radiother Oncol 2000; 57(1): 103–105.
19. Majkowska-Młynarczyk A, Kinalski M, Zaczek-Kucharska E. The thyroid gland function assessment in women after mastectomy and chemotherapy during breast cancer therapy. Endokrynol Pol 2007; 58(5): 397–402.
20. Zidan J, Rubenstein W. Effect of adjuvant tamoxifen therapy on thyroid function in postmenopausal women with breast cancer. Oncology 1999; 56(1): 43–45.
21. Giustarini E, Pinchera A, Fierabracci P et al. Thyroid autoimmunity in patients with malignant and benign breast diseases before surgery. Eur J Endocrinol 2006; 154(5): 645–649.
22. Sternberg EM. Neuroendocrine regulation of autoimmune/inflammatory disease. J Endocrinol 2001; 169(3): 429–435.
23. Strieder TG, Prummel MF, Tijssen JG et al. Risk factors for and prevalence of thyroid disorders in a cross-sectional study among healthy female relatives of patients with autoimmune thyroid disease. Clin Endocrinol (Oxf) 2003; 59(3): 396–401.
24. Galbavý Š. Nové „markery a prognostické faktory“ z pohľadu patológa. Onkológia 2006; 1(3): 151–154.
25. Kajo K, Plank L. Význam analýzy génovej expresie v predpovedi prognózy a liečebnej odpovede pri karcinóme prsnej žľazy. Onkológia 2008; 3(4): 224–229.
26. Chen XS, Ma CD, Wu JY et al. Molecular subtype approximated by quantitative estrogen receptor, progesterone rceptor and Her2 can predict the prognosis of breast cancer. Tumori 2010; 96(1): 103–110.
27. Yang Q, Chen J, Li HJ et al. Clinical features and prognosis analysis of different breast cancer molecular subtypes . Zhonghua Zhong Liu Za Zhi 2011; 33(1): 42–46.
28. Jiskra J. Racionální diagnostika a léčba nemocí štítné žlázy. Med Pro Praxi 2010; 7(4): 167–172.
29. Podoba J. Tyreopatie v ambulancii praktického lekára, alebo ako zvládnuť ich súčasnú „epidémiu“? Via Pract 2009; 6(4): 142–146.
30. Hercbergs A. The thyroid gland as an intrinsic biologic response-modifier in advanced neoplasia-a novel paradigm. In Vivo 1996; 10(2): 245–247.
31. Davis FB, Tang HY, Shih A et al. Acting via a cell surface receptor, thyroid hormone is a grow factor for glioma cells. Cancer Res 2006; 66(14): 7270–7275.
32. Gail MH, Benichou J. Validation studies on a model for breast cancer risk. J Natl Cancer Inst 1994; 86(8): 573–575.
33. Grigerová M, Podoba J. Subklinické poruchy štítnej žľazy. Lek Obz 2010; 59(11): 444–448.
34. Jiskra J, Límanová Z, Barkmanová J et al. Prevalence autoimunitních tyreopatií u žen s karcinomem prsu ve srovnání s kolorektálním karcinomem. Klin Onkol 2003; 16(3): 149–153.
35. Muller I, Pinchera A, Fiore E et al. High prevalence of breast cancer in patients with benign thyroid diseases. J Endocrinol Invest 2010; 15(11): 1253–1259.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článek EditorialČlánek Klinický registr GIST
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2012 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Prognostický význam morfologického hodnocení u mnohočetného myelomu
- Ionizujúcim žiarením indukované dlhodobé zmeny v hipokampe za experimentálnych podmienok
- Paliativní chirurgická léčba nádorů pankreatu a periampulární oblasti
- Tyreopatie u žien s karcinómom prsníka
- Gastrointestinální stromální tumor duodena projevující se akutním krvácením do horního zažívacího traktu a léčený klínovitou resekcí
- Klinický registr GIST
- MikroRNA vstupují do klinického testování
- Informace z České onkologické společnosti
- Novinky v diagnostice a léčbě primárních nádorů mozku – závěry mezioborového setkání „Winter GLIO TRACK Meeting“ 2012
- Editorial
- Agresívna fibromatóza: geneticko-biologické korelácie
- Agresívna fibromatóza: klinické aspekty
- Změny imunologické reaktivity u onkologických pacientů
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Agresívna fibromatóza: geneticko-biologické korelácie
- Agresívna fibromatóza: klinické aspekty
- Paliativní chirurgická léčba nádorů pankreatu a periampulární oblasti
- Tyreopatie u žien s karcinómom prsníka
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy