-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Neoplastické účinky indometacínu v N-metyl-N-nitrozoureou indukovanej mamárnej karcinogenéze u samíc potkanov
Neoplastic Effect of Indomethacin in N-methyl-N-nitrosourea Induced Mammary Carcinogenesis in Female Rats
Background:
High levels of prostaglandins found in many neoplastic tissues, especially in colon cancer and breast cancer, suggest a role of cyclooxygenase in the process of carcinogenesis.Material and methods:
The aim of this study was to analyse the chemopreventive potential of non-steroidal inflammatory drug indomethacin and its combination with pineal hormone melatonin in rat mammary carcinogenesis induced by N-methyl-N-nitrosourea. Indomethacin was administered 3 times a week and melatonin 4 times a week, both substances in a concentration of 20 µg/ml of drinking water. Chemoprevention began approximately 2 weeks before carcinogen administration and lasted until the end of the experiment 25 weeks later.Results:
Indomethacin administered alone and in combination with melatonin stimulated the growth of mammary tumors. We found a significant increase in the average tumor volume caused by indomethacin alone by 126%, and in combination with melatonin by 104% compared to the control group. Indomethacin administered alone increased the incidence of tumors by 21.5% (also in combination with melatonin) and reduced the tumor latency by 17 days compared to controls. Melatonin alone significantly reduced tumor volume in comparison with control animals. During the long-term administration, both substances were well tolerated by animals.Conclusion:
Indomethacin, a predominant cyclooxygenase inhibitor-1, showed significant neoplastic effects in the prevention of N-methyl-N-nitrosourea induced rat mammary carcinogenesis. This finding is in strong contrast to our previous experiment, where indomethacin in 7,12-dimethylbenz(a)anthracene-induced rat mammary carcinogenesis revealed marked antineoplastic effects.Key words:
rats – mammary carcinogenesis – chemoprevention – indomethacin – melatoninSubmitted:
23. 2. 2012Accepted:
30. 4. 2012
Autoři: P. Kubatka 1; K. Kalická 2; B. Bojková 2; I. Ahlers 2; E. Ahlersová 2; M. Péč 1
Působiště autorů: Ústav lekárskej biológie, Jesseniova lekárska fakulta, Univerzita Komenského, Martin, Slovenská republika 1; Katedra fyziológie živočíchov, Ústav biologických a ekologických vied, Prírodovedecká fakulta, Univerzita P. J. Šafárika, Košice, Slovenská republika 2
Vyšlo v časopise: Klin Onkol 2012; 25(5): 359-363
Kategorie: Původní práce
Souhrn
Východiská:
Vysoké hladiny prostaglandínov zistené v mnohých neoplastických tkanivách, hlavne u rakoviny hrubého čreva a prsníka, poukazujú na úlohu cyklooxygenázy v procese karcinogenézy.Materiál a metódy:
Cieľom tejto štúdie bolo analyzovať chemopreventívny potenciál samostatne aplikovaného nesteroidného antiflogistika indometacínu a jeho kombinácie s pineálnym hormónom melatonínom v mamárnej karcinogenéze samíc potkanov indukovanej pomocou N-metyl-N-nitrozourey. Indometacín bol podávaný 3-krát a melatonín 4-krát v týždni, obe látky v koncentrácii 20 µg/ml pitnej vody. Chemoprevencia začala približne 2 týždne pred aplikáciou karcinogénu a trvala do ukončenia experimentu ďalších 25 týždňov.Výsledky:
Indometacín aplikovaný samostatne, ale aj v kombinácii s melatonínom stimuloval rast mamárnych tumorov, čo sa prejavilo signifikantným nárastom priemerného objemu nádorov o 126 %, resp. 104 % voči kontrolnej skupine. Samostatne podaný indometacín zvýšil incidenciu nádorov o 21,5 % (rovnako aj v kombinácii s melatonínom) a skrátil latenciu nádorov o 17 dní voči kontrole. Samotný melatonín znížil signifikantne objem nádorov porovnaním s kontrolnými zvieratami. Obe látky boli zvieratami počas dlhodobej aplikácie dobre tolerované.Záver:
Indometacín, prevažný inhibítor cyklooxygenázy-1, prejavil signifikantné neoplastické účinky v prevencii N-metyl-N-nitrozoureou indukovanej mamárnej karcinogenézy u potkanov. Toto zistenie je v ostrom protiklade s našim predchádzajúcim experimentom, v ktorom sme mamárnu karcinogenézu u potkanov indukovali 7,12-dimetylbenzantracénom, pričom indometacín v tomto prípade preukázal veľmi výrazné chemopreventívne účinky.Kľúčové slová:
potkany – mamárna karcinogenéza – chemoprevencia – indometacín – melatonínÚvod
Často používaným modelom pre štúdium pôsobenia chemopreventívnych látok na proces vzniku rakoviny prsníka je experimentálna mamárna karcinogenéza u samíc potkanov indukovaná rôznymi chemokarcinogénmi, najčastejšie N-metyl-N-nitrozoureou (NMU) a 7,12-dimetylbenz(a)antracénom (DMBA). Dôležitým faktorom chemoprevencie rakoviny ostáva výber vhodnej substancie, ktorá by bola účinná a umožnila by dlhodobú aplikáciu. Nesteroidné antiflogistiká (NSAIDs) predstavujú dôležitú skupinu farmák, ktoré potláčajú prejavy zápalového procesu (bolesť, edémy atď.). Mechanizmus ich účinku je založený na potláčaní syntézy prostanoidov inhibíciou aktivity cyklooxygenázy (COX) a/alebo lipoxygenázy. Boli identifikované najmenej dve COX izoformy. COX-1 je konštitutívne exprimovaná v takmer všetkých druhoch buniek a zabezpečuje syntézu nízkych hladín prostanoidov, ktoré sú nevyhnutné na udržiavanie homeostázy. COX-2 je prevažne induktívna izoforma, uplatňujúca sa hlavne pri patologických stavoch (napr. zápaly, neoplázie). Zvýšená aktivita COX-2 izoformy bola zistená napr. u karcinómov hrubého čreva, pažeráka, žalúdka, ale tiež prsníka [1,2].
Výsledky epidemiologických štúdií poukazujú na zreteľný chemopreventívny účinok NSAIDs u viacerých typov nádorových ochorení, konkrétne u rakoviny hrubého čreva [3], prsníka [4], prostaty [5] a pľúc [6]. Pri pravidelnom užívaní ibuprofenu bol pozorovaný pokles incidencie rakoviny prsníka o 50 %, u aspirínu o 40 % [4]. Aplikácia niektorého NSAIDs (každodenné užívanie minimálne 2 mesiace) znamenalo signifikantný 24% pokles rizika rakoviny prsníka [7]. Rovnako štúdie na laboratórnych zvieratách priniesli dôkazy o chemopreventívnych účinkoch NSAIDs u viacerých druhov neoplázií vrátane mliečnej žľazy [8,9]. Naša skupina v experimentoch so samicami potkanov zaznamenala chemopreventívny účinok indometacínu (INDO), prevažného inhibítora COX-1, v DMBA indukovanej mamárnej karcinogenéze [10] a prevažných COX-2 inhibítorov nimezulidu [11] a diklofenaku (zaslané na publikovanie) v NMU indukovanej karcinogenéze mliečnej žľazy. V rovnakom experimentálnom modeli s použitím NMU sme pozorovali antineoplastické účinky vysoko selektívnych inhibítorov COX-2 – rofekoxibu [12], etorikoxibu [13] a celekoxibu [14]. Stabilný antineoplastický účinok celekoxibu bol dokázaný aj v ďalších experimentoch. Celekoxib aplikovaný v potrave vykázal signifikantný antitumorový účinok v mamárnej karcinogenéze potkanov [15], ale aj u nádorov hrubého čreva potkanov [16], resp. močového mechúra potkanov a myší [17]. Tieto fakty poukazujú na reálnu možnosť využitia NSAIDs v prevencii nádorových ochorení, vrátane rakoviny prsníka.
V našom predchádzajúcom experimente, kde sme testovali preventívne účinky INDO v modeli DMBA-indukovanej karcinogenézy samíc potkanov, sme zaznamenali jeho veľmi výrazné antitumorózne účinky [10]. Cieľom tejto štúdie bolo potvrdiť chemopreventívne účinky INDO aj v modeli mamárnej karcinogenézy indukovanej pomocou NMU. Kombinovanou aplikáciou INDO s pineálnym hormónom melatonínom, u ktorého sa predpokladaná antineoplastický účinok [18], sme chceli dosiahnuť aditívne pôsobenie oboch látok v chemoprevencii mamárnych nádorov.
Materiál a metódy
V experimentálnej práci sme použili samice potkanov kmeňa Sprague-Dawley (AnLab, Praha, Česká republika) vo veku 33–37 dní o telesnej hmotnosti 120–140 g v celkovom počte 60 kusov. Po prijatí na pracovisko boli zvieratá umiestnené po 5 kusov v plexitových klietkach a adaptované na štandardné podmienky zvieratníka: teplotu 23 ± 2 °C, relatívnu vlhkosť 60–70 %, umelý svetelný režim svetlo : tma – 12 : 12 hod. Zvieratá boli kŕmené diétou typu MP (Top-Dovo, Dobrá Voda, Slovenská republika) a napájané pitnou vodou ad libitum. Mamárna karcinogenéza bola indukovaná u všetkých zvierat. Karcinogén NMU bol rozpustený vo fyziologickom roztoku a podaný intraperitoneálne (0,5 ml roztoku na zviera) v dvoch dávkach po 50 mg/kg hmotnosti zvieraťa medzi 48. a 58. postnatálnym dňom. Použili sme dva druhy chemopreventívnych látok: INDO a MEL. Schému podávania chemopreventívnych látok sumarizuje tab. 1. INDO (Léčiva, Praha, Česká republika) bol podávaný 3-krát v týždni v koncentrácii 20 µg/ml pitnej vody. Na prípravu 1 litra roztoku bolo rozpustených 20 mg INDO v 3,1 ml 60 % etanolu a doplnených pitnou vodou do požadovaného objemu. MEL v koncentrácii 20 µg/ml bol podávaný 4-krát v týždni medzi 15.00 a 08.00 hod. Od 08.00 do 15.00 hod zvieratá pili pitnú vodu. Čerstvý roztok MEL sa pripravoval 4-krát do týždňa, pre získanie 1 litra roztoku sme rozpustili 20 mg MEL v 0,4 ml 30% etanolu a doplnili do požadovaného objemu pitnou vodou. Obe chemopreventívne látky sme začali podávať približne 2 týždne pred prvou aplikáciou NMU a následne boli aplikované ďalších 25 týždňov až do ukončenia experimentu (obr. 1). Boli použité 4 skupiny zvierat: kontrolná skupina (KONT) bez prevencie (20 zvierat), skupina s INDO (20 zvierat), skupina s MEL (17 zvierat) a skupina INDO + MEL (20 zvierat).
Obr. 1. Usporiadanie experimentu. 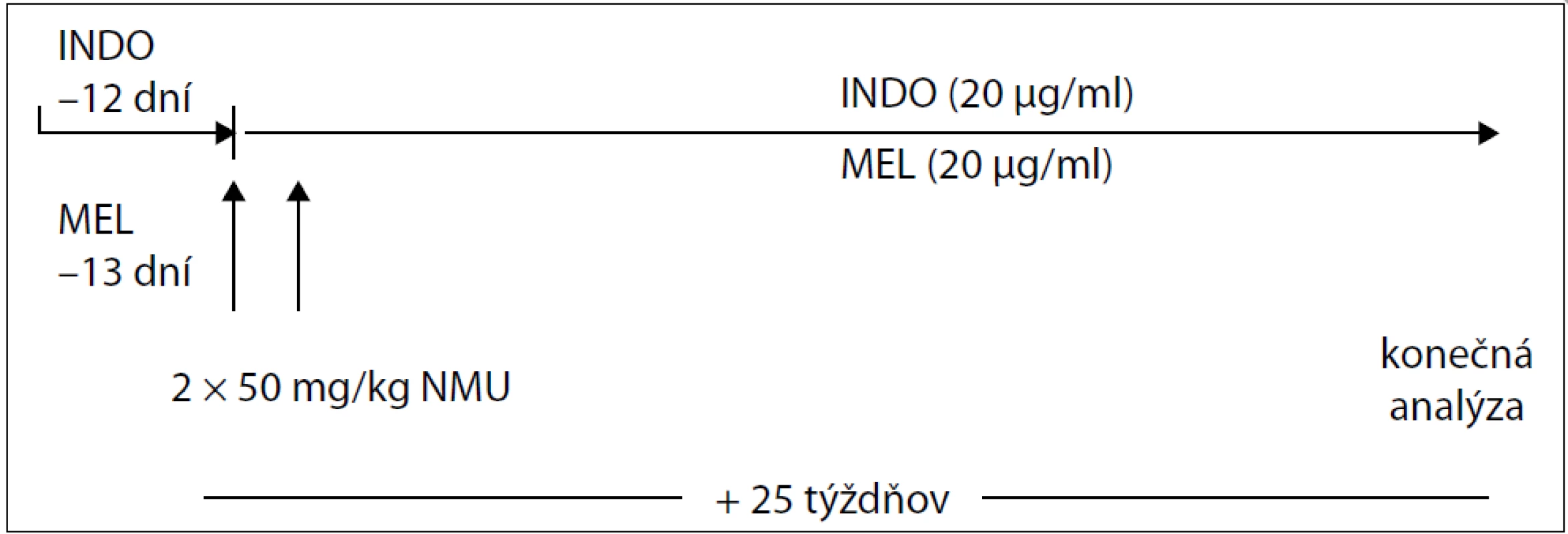
Tab. 1. Schéma podávania chemopreventívnych látok. 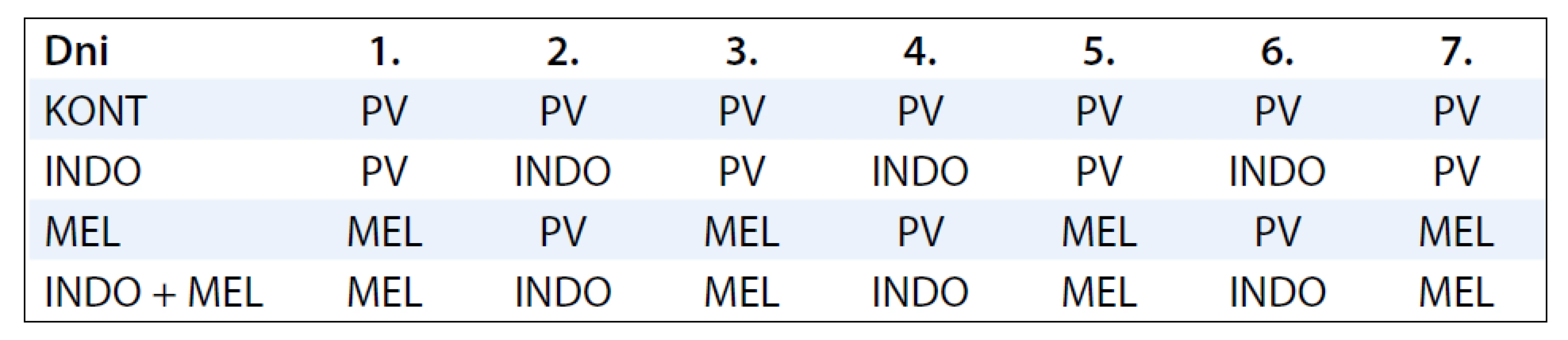
KONT – kontrolná skupina, PV – pitná voda, INDO – indometacín, MEL – melatonín Zvieratá boli raz do týždňa palpované a vážené. Palpáciou sme zisťovali výskyt, počet, lokalizáciu a veľkosť palpovateľných tumorov. V poslednom, 25. týždni experimentu, boli zvieratá usmrtené rýchlou dekapitáciou, mamárne nádory boli vypitvané a zvážené, rozmery nádorov zaznamenané. Vzorky tkaniva mamárnych nádorov boli zafixované v 10% roztoku formalínu a vybrané súbory boli odoslané na histologické vyšetrenie. V jednotlivých experimentálnych skupinách boli hodnotené základné parametre mamárnej karcinogenézy: incidencia nádorov ako percentuálne zastúpenie nádorových zvierat, frekvencia nádorov na skupinu, resp. na zviera, latenčná perióda určená obdobím od podania karcinogénu až po objavenie sa prvého nádoru u zvieraťa, priemerný objem nádorov a kumulatívny objem nádorov určený súčtom objemov nádorov v skupine. Bol sledovaný vplyv chemopreventíva na príjem potravy a vody, na prírastok telesnej hmotnosti. Individuálne hmotnosti zvierat boli zaznamenávané od začiatku prevencie do ukončenia pokusu. Príjem vody a potravy za 24 hod sme u potkanov zisťovali v 12. a 13. týždni od podania prvej dávky karcinogénu.
Incidencia nádorov bola porovnávaná Mann-Whitney U-testom, na hodnotenie rozdielov ostatných parametrov sme použili jednocestnú analýzu variancie alebo Kruskal-Wallisov test. Objemy nádorov sme počítali podľa vzťahu: V = π . (S1)2. S2/12, kde S1 a S2 predstavujú priemery nádoru, pričom S1 < S2.
Experiment prebiehal v súlade s požiadavkami zákona Slovenskej republiky č. 115/1995 § 24 o starostlivosti a používaní laboratórnych zvierat.
Výsledky
Hodnoty incidencie, latencie, frekvencie a objemu mamárnych nádorov sumarizuje tab. 2. INDO aplikovaný samostatne zvýšil signifikantne (p < 0,001) objem nádorov o 126 % voči kontrole. Tento neoplastický účinok INDO bol potvrdený aj ďalším parametrom – nárastom kumulatívneho objemu nádorov. INDO spôsobil nesignifikantný nárast incidencie o 21,5 % a skrátenie latencie o 17 dní voči kontrole. MEL aplikovaný v kombinácii s INDO významnejšie neovplyvnil parametre mamárnej karcinogenézy, s výnimkou latencie, kde táto kombinácia predĺžila latenciu o 15 dní voči skupine so samostatne podávaným INDO. MEL aplikovaný samostatne spôsobil signifikantný 29,5% pokles priemerného objemu nádorov v porovnaní s kontrolami. Mierne antineoplastické účinky samotného MEL boli pozorované aj v poklese frekvencie nádorov. Histologická typizácia mamárnych tumorov preukázala vysoké zastúpenie adenokarcinómov (vyše 90 %) s najhojnejším výskytom kribriformných a papilárnych lézií. Chemoprevencia nezmenila pomer malígnych k benígnym nádorom.
Tab. 2. Účinky indometacínu, melatonínu a ich kombinácie v prevencii experimentálnej mamárnej karcinogenézy. 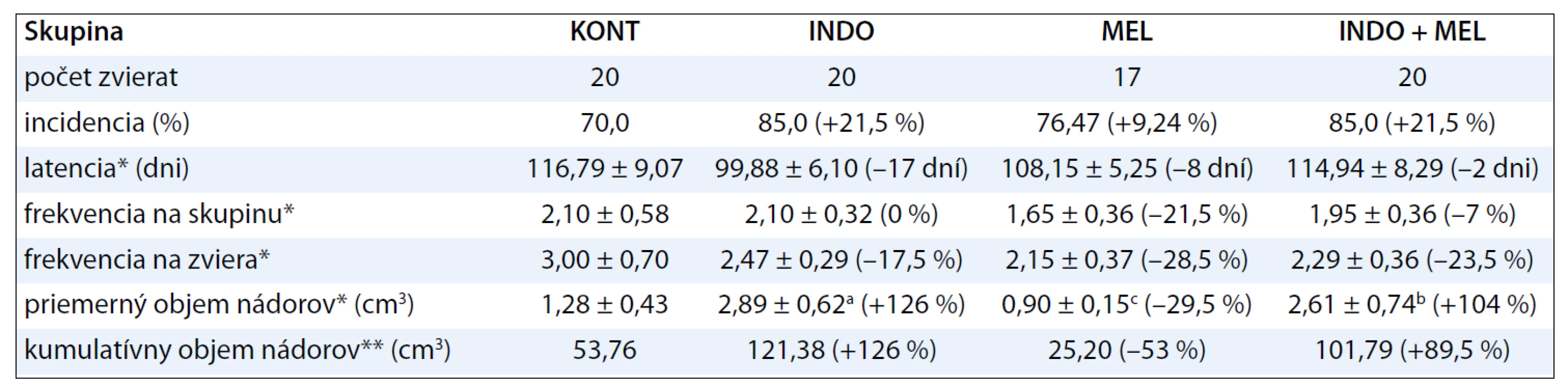
*Údaje sú vyjadrené ako priemery ± SEM. **Údaje sú vyjadrené ako suma objemov nádorov. Hodnoty v zátvorkách predstavujú percentuálnu odchýlku voči kontrolnej skupine. KONT – kontrolná skupina bez chemoprevencie, INDO – indometacín (20 μg/ml pitnej vody), MEL – melatonín (20 μg/ml pitnej vody). Signifikantný rozdiel, ap <0,001 vs KONT, bp < 0,01 vs KONT, cp < 0,05 vs KONT. Prírastok telesnej hmotnosti nebol vplyvom chemoprevencie ovplyvnený. Priemerný denný príjem potravy a vody sa u liečených potkanov nelíšil od kontrol. Priemerná denná dávka INDO na potkana bola 0,56 mg, MEL 0,51 mg, u kombinácie chemopreventív 0,61 mg INDO a 0,57 mg MEL. Chemopreventívne látky boli zvieratami dobre tolerované, u liečených zvierat sme nepozorovali makroskopické zmeny na sledovaných orgánoch (pečeň, žalúdok, črevá, obličky, pľúca).
Diskusia
V našom predchádzajúcom experimente s DMBA-indukovanou mamárnou karcinogenézou, INDO v koncentrácii 20 µg/ml pitnej vody (10–8 M) pozitívne ovplyvnil všetky sledované parametre – u liečených zvierat sme v porovnaní s kontrolou zaznamenali až 88 % pokles frekvencie nádorov, nárast latencie nádorov o 59 dní, pokles incidencie nádorov o 63 % a pokles priemerného objemu nádorov o 17 %. INDO (10–8 M) v tomto experimente v prevencii NMU--indukovanej mamárnej karcinogenézy naopak prejavil zreteľné tumor-promočné účinky. Jedným z možných vysvetlení tohto prekvapivého výsledku môže byť poznatok, že u NMU-indukovaných mamárnych tumorov potkanov sú hladiny COX-2 proteínov v bunkách tumoru približne 3-násobne vyššie ako hladiny COX-1 [19], a preto INDO, ako prevažný inhibítor COX-1, nebol v tomto experimente účinný. V rozsiahlom experimente McCormick et al [20] zisťovali, či chemopreventívny účinok INDO v mamárnej karcinogenéze u potkanov podávaného v dvoch dávkach – 25 mg/kg alebo 50 mg/kg potravy (nižšia dávka je rovnaká ako dávka v našich experimentoch) je závislý na dávke karcinogénu (DMBA) a tiež, či je založený aj na inhibícii iniciačnej alebo promočnej fázy neoplastického procesu. Výsledky tejto štúdie poukázali na protektívne účinky INDO aplikovaného v oboch schémach – tak v iniciačnej, ako aj v promočnej fáze karcinogenézy. Vplyv INDO bol závislý od použitej dávky, ako aj od dávky karcinogénu. Na druhej strane niektorí autori zaznamenali stimuláciu proliferácie tumorov INDO aj u DMBA-indukovanej karcinogenézy [21,22], a tiež v pokusoch in vitro [23]. INDO u DMBA-indukovanej mamárnej karcinogenézy pravdepodobne pôsobí lokálne – inhibíciou kooxidácie polycyklických aromatických uhľovodíkov [24] a systémovo – stimuláciou NK-buniek, potencovaním bunkami sprostredkovanej cytotoxicity závislej na protilátkach [25] a moduláciou aktivity supresorových T-buniek [26]. Neoangiogenéza stimulovaná prostaglandínmi môže byť s INDO potlačená [27]. Antitumorová účinnosť INDO je pravdepodobne závislá nielen od jeho dávky, ale aj od štádia karcinogenézy. Zdá sa, že len iniciácia a skoré štádium promócie tumoru sú rozhodujúce pre ovplyvnenie tumorigenézy, zatiaľ čo v neskoršom promočnom štádiu je proliferácia buniek už stimulovaná. V nám dostupnej literatúre sme nenašli práce o vplyve INDO na NMU-indukovanú mamárnu karcinogenézu. Nimezulid, selektívny inhibítor COX-2, v našom experimente s NMU-indukovanou mamárnou karcinogenézou signifikantne redukoval incidenciu, frekvenciu a prírastok objemu nádorov [11]. Zreteľný tumorsupresívny účinok NIM (aplikovaného v potrave), podobne ako v našom pokuse, zaznamenali Nakatsugi et al [28] v experimente s 2-amino 1-metyl-6-fenylimidazolom (4,5-b/pyridín)-indukovanou mamárnou karcinogenézou. Naopak, v druhom našom experimente – s indukciou karcinogenézy pomocou DMBA – sa chemopreventívny vplyv NIM vôbec neprejavil [11]. Účinok INDO aj NIM v mamárnej karcinogenéze u potkanov je zrejme závislý na druhu induktora karcinogénneho procesu. Vzhľadom na mechanizmus antineoplastického účinku NSAIDs (inhibujú produkciu imunosupresívnych PGE2, inhibujú neoangiogenézu, stimulujú apoptózu), sa táto skupina farmák javí ako perspektívna v prevencii mamárnej karcinogenézy. Je potrebné naďalej testovať účinok NSAIDs v závislosti od dávky, spôsobu a doby aplikácie, od druhu a účinnosti karcinogénu, ako aj od výberu modelového zvieraťa (napr. rôzne kmene samíc potkanov).
Z farmakodynamického hľadiska majú inhibítory COX-1 (napr. aspirín, ibuprofen, INDO) širokú škálu nežiaducich účinkov na organizmus. V snahe vyhnúť sa týmto účinkom spôsobených dlhodobým užívaním, bolo potrebné vyvinúť blokátory syntézy prostaglandínov, ktoré by nespôsobovali žalúdočné erózie, dysfunkciu krvných doštičiek a neovplyvňovali by prietok krvi v obličkách. U selektívnych inhibítorov COX-2 sú tieto nežiaduce účinky značne redukované, avšak niekoľko nedávnych klinických štúdií poukázalo na zjavný nárast výskytu tromboembolických komplikácií spojených s ich užívaním [29,30]. Aktuálne epidemiologické štúdie sumarizujú rozsiahle retrospektívne údaje o pacientoch s dlhodobou (nad 5 rokov) aplikáciou NSAIDs. Ibuprofen bol účinnejší ako kyselina acetylsalicylová, pričom spôsobil až 49% pokles incidencie karcinómu prsníka [31]. Priemerný 36% pokles incidencie nádorových ochorení a 39% pokles rizika karcinómu prsníka bol pozorovaný u pacientov s dlhodobou aplikáciou NSAID [32]. Agrawal a Fentiman [33] a Takkouche et al [34] informovali o približne 20% znížení výskytu neoplázie, vrátane rakoviny prsníka, s použitím rôznych typov NSAIDs bez rozdielu. Výsledky s dlhodobým podávaním vysoko selektívnych inhibítorov COX-2 boli sľubné [35], avšak zvýšená incidencia tromboembolizmu u pacientov liečených týmito farmakami znamenala stiahnutie týchto liečiv z klinickej praxe s výnimkou celekoxibu.
Záver
INDO v tejto štúdii preukázal zreteľné neoplastické účinky v karcinogenéze mliečnej žľazy u potkanov, čím sme nepotvrdili jeho výrazné antineoplastické účinky pozorované v našom predchádzajúcom experimente s dimetylbenzantracénom indukovanou mamárnou karcinogenézou. Napriek tomu, že sme v tomto pokuse pozorovali mierne antineoplastické účinky samostatne podávaného MEL, jeho kombinácia s INDO nezvrátila nepriaznivé účinky tohto nesteroidného antiflogistika. Domnievame sa, že je potrebné naďalej testovať účinok NSAIDs v závislosti od dávky, spôsobu a doby aplikácie, od druhu a dávky použitého karcinogénu, ako aj od výberu modelového zvieraťa (napr. rôzne kmene samíc potkanov). Podávanie vybraných NSAIDs aplikovaných v najnižšej možnej dávke spolu s chemoterapiou alebo rádioterapiou u pacientov pri liečbe niektorých typov nádorov predstavuje sľubnú cestu pre klinické využitie. Okrem toho dlhodobá aplikácia NSAIDs u pacientov s artrózou, ktorí majú tiež aterosklerotické komplikácie alebo diabetes 2. typu (súčasné užívanie statínov, resp. perorálnych antidiabetík s in vivo dokázaným antineoplastickým pôsobením) prináša zaujímavú možnosť využitia takejto kombinácie liečiv v onkologickej praxi s cielom znížit riziko viacerých typov neoplázií.
Projekt bol podporený grantovou agentúrou Ministerstva školstva Slovenskej republiky VEGA č. 1/7397/20.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
doc. RNDr. Peter Kubatka, PhD.
Ústav lekárskej biológie
Jesseniova lekárska fakulta
Univerzita Komenského, Martin
Malá Hora 4
036 01 Martin
Slovenská republika
Obdrženo: 23. 2. 2012
Přijato: 30. 4. 2012
Zdroje
1. Cuzick J, Otto F, Baron JA et al. Aspirin and non-steroidal anti-inflammatory drugs for cancer prevention: an international consensus statement. Lancet Oncol 2009; 10(5): 501–507.
2. Fosslien E. Molecular pathology of cyclooxygenase-2 in neoplasia. Ann Clin Lab Sci 2000; 30(1): 3–21.
3. Thun MJ, Namboodiri MM, Heath CW Jr. Aspirin use and reduced risk of fatal colon cancer. N Engl J Med 1991; 325(23): 1593–1596.
4. Harris RE, Kasbari S, Farrar WB. Prospective study of nonsteroidal anti-inflammatory drugs and breast cancer. Oncol Rep 1999; 6(1): 71–73.
5. Nelson JE, Harris RE. Inverse association of prostate cancer and non-steroidal anti-inflammatory drugs (NSAIDs): results of a case-control study. Oncol Rep 2000; 7(1): 169–170.
6. Harris RE, Beebe-Donk J, Schuller HM. Chemoprevention of lung cancer by non-steroidal anti-inflammatory drugs among cigarette smokers. Oncol Rep 2002; 9(4): 693–695.
7. Cotterchio M, Kreiger N, Sloan M et al. Nonsteroidal anti-inflammatory drug use and breast cancer risk. Cancer Epidemiol Biomarkers Prev 2001; 10(11): 1213–1217.
8. Jang TJ, Jung HG, Jung KH, O MK. Chemopreventive effect of celecoxib and expression of cyclooxygenase-1and cyclooxygenase-2 on chemically-induced rat mammary tumours. Int J Exp Pathol 2002; 83(4): 173–182.
9. Suzui N, Sugie S, Rahman KM et al. Inhibitory effects of diallyl disulfide or aspirin on 2-amino-1-methyl-6-phenylimidazo[4,5-b]pyzridine-induced mammary carcinogenesis in rats. Jpn J Cancer Res 1997; 88(8): 705–711.
10. Mocikova-Kalicka K, Bojkova B, Adamekova E et al. Preventive effect of indomethacin and melatonin on 7, 12-dimethybenz/a/anthracene-induced mammary carcinogenesis in female Sprague-Dawley rats. A preliminary report. Folia Biol (Praha) 2001; 47(2): 75–79.
11. Kubatka P, Kalicka K, Chamilova M et al. Nimesulide and melatonin in mammary carcinogenesis prevention in female Sprague-Dawley rats. Neoplasma 2002; 49(4): 255–259.
12. Kubatka P, Ahlers I, Ahlersová E et al. Chemoprevention of mammary carcinogenesis in female rats by rofecoxib. Cancer Lett 2003; 202(2): 131–136.
13. Orendas P, Ahlers I, Kubatka P et al. Etoricoxib in the prevention of rat mammary carcinogenesis. Acta Vet (Brno) 2007; 76(4): 613–618.
14. Orendas P, Kassayova M, Kajo K et al. Celecoxib and melatonin in prevention of female rat mammary carcinogenesis. Neoplasma 2009; 56(3): 250–256.
15. Harris RE, Alshafie GA, Abou-Issa H et al. Chemoprevention of breast cancer in rats by celecoxib, a cyclooxygenase 2 inhibitor. Cancer Res 2000; 60(8): 2101–2103.
16. Kawamori T, Rao CV, Seibert K et al. Chemopreventive activity of celecoxib, a specific cyclooxygenase-2 inhibitor, against colon carcinogenesis. Cancer Res 1998; 58(3): 409–412.
17. Grubbs CJ, Lubet RA, Koki AT et al. Celecoxib inhibits N-butyl-N-(4-hydroxybutyl)-nitrosamine-induced urinary bladder cancers in male B6D2F1 mice and female Fischer-344 rats. Cancer Res 2000; 60(20): 5599–5602.
18. Cos S, González A, Martínez-Campa C et al. Melatonin as a selective estrogen enzyme modulator. Curr Cancer Drug Targets 2008; 8(8): 691–702.
19. Hamid R, Singh J, Reddy BS et al. Inhibition by dietary menhaden oil of cyclooxygenase-1 and 2 in N-nitrosomethylurea-induced rat mammary tumors. Int J Oncol 1999; 14(3): 523–528.
20. McCormick DL, Madigan MJ, Moon RC. Modulation of rat mammary carcinogenesis by indomethacin. Cancer Res 1985; 45(4): 1803–1808.
21. Noguchi M, Taniya T, Koyasaki N et al. Effects of the prostaglandin synthetase inhibitor indomethacin on tumorigenesis, tumor proliferation, cell kinetics, and receptors contents of 7,12-dimethylbenz(a)anthracene-induced mammary carcinoma in Sprague-Dawley rats fed a high - or low-fat diet. Cancer Res 1991; 51(10): 2683–2689.
22. Noguchi M, Ohta N. Influences of high dietary fat and/or indomethacin on tumor proliferation and cell kinetics of 7,12-dimethylbenz(a)anthracene-induced mammary carcinomas in rats. In Vivo 1993; 7(1): 53–58.
23. Noguchi M, Erashi M, Miyazaki I et al. Effects of indomethacin with or without linoleic acid on human breast cancer cells in vitro. Prostaglandins Leukotr Essent Fatty Acids 1995; 52(6): 381–386.
24. McCormick DL, Moon RC. Indomethacin inhibits mammary carcinogenesis in rats. Proc Int Assoc Breast Cancer Res 1983; 1 : 43.
25. Kohl S, Jansen DM, Loo LS. Indomethacin enhancement of human natural killer cytotoxicity to herpes simplex virus infected cells in vitro and in vivo. Prostaglandins Leukot Med 1982; 9(2): 159–166.
26. Shimamura T, Hashimoto K, Sasaki S. Feedback suppression of the immune response in vivo. I. Immune B cells induce antigen-specific suppressor T cells. Cell Immunol 1982; 68(1): 104–113.
27. Gołab J, Kozar K, Kamiński R et al. Interleukin 12 and indomethacin exert a synergistic, angiogenesis-dependent antitumor activity in mice. Life Sci 2000; 66(13): 1223–1230.
28. Nakatsugi S, Ohta T, Kawamori T et al. Chemoprevention by nimesulide, a selective cyclooxygenase-2 inhibitor, of 2-amino-1-methyl-phenylimidazo[4,5-b]pyridine (PhIP)-induced mammary gland carcinogenesis in rats. Jpn J Cancer Res 2000; 91(9): 886–892.
29. Howard PA, Delafontaine P. Nonsteroidal anti-inflammatory drugs and cardiovascular risk. J Am Coll Cardiol 2004; 43(4): 519–525.
30. Kearney PM, Baigent C, Godwin J et al. Do selective cyclo-oxygenase-2 inhibitors and traditional non-steroidal anti-inflammatory drugs increase the risk of atherothrombosis? Meta-analysis of randomised trials. BMJ 2006; 332(7553): 1302–1308.
31. Harris RE, Beebe-Donk J, Doss H et al. Aspirin, ibuprofen, and other non-steroidal anti-inflammatory drugs in cancer prevention: a critical review of non-selective COX-2 blockade. Oncol Rep 2005; 13(4): 559–583.
32. Harris RE. Cyclooxygenase-2 /COX-2/ and the inflammogenesis of cancer. In: Harris RE (ed). Inflammation in the Pathogenesis of Chronic Diseases. New York: Springer 2007 : 93–126.
33. Agrawal A, Fentiman IS. NSAIDs and breast cancer: a possible prevention and treatment strategy. Clin Pract 2008; 62(3): 444–449.
34. Takkouche B, Regueira-Méndez C, Etminan M. Breast cancer and use of non-steroidal anti-inflammatory drugs: a meta-analysis. J Natl Cancer Inst 2008; 100(2): 1439–1447.
35. Harris RE, Beebe-Donk J, Alshafie GA. Reduction in the risk of human breast cancer by selective cyclooxygenase-2 (COX-2) inhibitors. BMC Cancer 2006; 6 : 27.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článek EditorialČlánek Sarkómy maternice – prehľadČlánek Klinický registr TULUNGČlánek Soutěž o nejlepší práci
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2012 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Editorial
- Mutace BRAF: nový přístup k cílené léčbě melanomu
- Hmotná podstata genetických informací – nukleové kyseliny
- Dabrafenib: nový inhibitor hyperaktivní kinázy B-RAF
- Sarkómy maternice – prehľad
- Prognostické faktory konvenčního osteosarkomu dospělých pacientů
- Neoplastické účinky indometacínu v N-metyl-N-nitrozoureou indukovanej mamárnej karcinogenéze u samíc potkanov
- Predoperačná rádioterapia lokálne pokročilého karcinómu rekta: klinické výsledky krátkodobej a dlhodobej liečby s alebo bez konkomitantnej chemoterapie
- Význam stanovovania expresie DNA reparačných mechanizmov u nemalobunkového karcinómu pľúc
- Septické komplikace intravenózních portových systémů – kazuistiky a přehled literatury
- Klinický registr TULUNG
- Další pozitivní studie u karcinomu ovaria
- Instrukce pro autory – příprava příspěvku k publikování v časopisu Klinická onkologie
- Instrukce pro autory – odeslání příspěvku k publikování v časopisu Klinická onkologie
- Onkologie v obrazech: Generalizovaný Kaposiho sarkom
- Soutěž o nejlepší práci
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Prognostické faktory konvenčního osteosarkomu dospělých pacientů
- Sarkómy maternice – prehľad
- Septické komplikace intravenózních portových systémů – kazuistiky a přehled literatury
- Mutace BRAF: nový přístup k cílené léčbě melanomu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



