-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Význam stanovovania expresie DNA reparačných mechanizmov u nemalobunkového karcinómu pľúc
Importance of Expression of DNA Repair Proteins in Non-Small-Cell Lung Cancer
Background:
Proteins XRCC1 and ERCC1 are involved in DNA repair. XRCC1 plays a role in DNA base excision repair and ERCC1 in nucleotide excision repair pathway. Higher expression profile of both proteins in cancer cells may contribute to development of drug resistance. ERCC1 is involved in removal of platinum adducts and might be a potential predictive and prognostic marker in NSCLC (non-small-cell lung cancer) treated with a cisplatin-based regimen. The purpose of study was determination of XRCC1 and ERCC1 levels and their correlation with basic clinicopathological parameters in NSCLC.Patients and Methods:
In this study, 107 tumor samples diagnosed as NSCLC were immunohistochemically examined for expression of XRCC1 and ERCC1 proteins. Our results were compared to basic clinicopathological parameters: type of tumor, tumor grade and stage of disease. For statistical analysis, the chi-square test was used.Results:
In squamous cell carcinoma and large cell carcinoma samples, the XRCC1 protein level was twofold higher (60% of positive samples) than in adenocarcinoma samples (35.5% of positive samples). We have found statistical correlation between XRCC1 protein expression and type of tumor (p = 0.0306). On the other hand, the statistical importance between the protein level versus grade and stage was not found. In the case of the ERCC1 protein, we observed the highest protein level in adenocarcinoma (64.5%) and squamous cell carcinoma (62.5%) samples. Next, we determined a significant difference in content of XRCC1 versus ERCC1 (35.5% vs 64.5%) in adenocarcinoma samples. Statistical chi-square test did not reveal any correlation between ERCC1 status and clinicopathological parameters.Conclusion:
According to our results, XRCC1 represents an important mechanism of DNA repair in squamous cell and large cell carcinomas. Besides that, expression of XRCC1 was in correlation with type of tumor. In patients with adenocarcinoma and squamous cell carcinoma, we could assume increased resistance to platinum-based therapy because of high expectation of ERCC1 protein expression. However, its levels did not correlate with monitored clinicopathological parameters. The ERCC1 protein will be possibly an independent prognostic factor in NSCLC. To prove a true survival benefit of patients with expression of ERCC1, prospective validation of ERCC1 before clinical implication is needed in the future.Key words:
DNA repair proteins – non-small-cell lung carcinoma – immunohistochemistrySubmitted:
29. 5. 2012Accepted:
14. 7. 2012
Autoři: S. Rybárová 1; J. Muri 2; I. Hodorová 1; J. Vecanová 1; M. Benický 3; D. Piovarči 2; P. Janík 2; J. Mihalik 1; L. Mirossay 4
Působiště autorů: Ústav anatómie, LF UPJŠ, Košice, Slovenská republika 1; Národný ústav tuberkulózy, pľúcnych chorôb a hrudníkovej chirurgie, Vyšné Hágy, Slovenská Republika 2; Oddelenie patológie, UN L. Pasteura, Košice, Slovenská republika 3; Ústav farmakológie, LF UPJŠ, Košice, Slovenská republika 4
Vyšlo v časopise: Klin Onkol 2012; 25(5): 370-374
Kategorie: Původní práce
Souhrn
Úvod:
Proteíny XRCC1 a ERCC1 plnia funkciu pri oprave poškodenej DNA. Proteín XRCC1 zohráva úlohu v bázovej excíznej reparácii, kým proteín ERCC1 v nukleotidovej excíznej reparácii. Zvýšená expresia týchto proteínov sa za podmienok nádorového bujnenia podieľa na vzniku liekovej rezistencie. Proteín ERCC1 je dávaný do súvisu so vznikom rezistencie na liečbu platinovými derivátmi.Pacienti a metódy:
V práci sme použili 107 vzoriek karcinómov pľúc od pacientov s nemalobunkovým karcinómom. Vo vzorkách sme imunohistochemickou metódou detegovali expresiu DNA reparačných proteínov XRCC1 a ERCC1. Nami detegovanú expresiu proteínov sme porovnali s týmito klinickopatologickými parametrami: histopatologický typ nádoru, grade a TNM štádium ochorenia.Výsledky:
Hladiny proteínu XRCC1 boli vo vzorkách skvamocelulárneho a veľkobunkového typu dvojnásobne vyššie (60 % pozitívnych vzoriek) v porovnaní so vzorkami adenokarcinómu (35 % pozitívnych vzoriek). Použitím chí-kvadrátového testu sme ďalej zistili, že vzťah proteín XRCC1 vs typ nádoru bol štatistický významný, nakoľko p = 0,0306. Pri porovnaní expresie proteínu s gradingom a stagingom sme však štatistickú významnosť nepotvrdili. V prípade proteínu ERCC1 sme pozorovali u adenokarcinómu a skvamocelulárneho karcinómu vysokú expresiu proteínu ERCC1. Táto dosahovala hodnoty 64,5 % u adenokarcinómu a 62,5 % u skvamocelulárneho typu. U adenokarcinómu sme ďalej zistili podstatný rozdiel v obsahu proteínov ERCC1 (64,5 % pozitívnych vzoriek) vs XRCC1 (35,5 % pozitívnych vzoriek). V prípade vzoriek veľkobunkového typu bola pozitivita ERCC1 približne rovnaká (45,5 % pozitívnych vzoriek vs 54,5 % negatívnych prípadov). Pri použití chí--kvadrátového testu sme nezaznamenali štatistickú významnosť ani v jednom zo sledovaných parametrov (typ, grading, staging).Záver:
Zdá sa, že proteín XRCC1 by mohol predstavovať významný mechanizmus DNA reparácie u skvamocelulárneho a veľkobunkového typu. Okrem toho, jeho expresia bola v korelácii s typom nádoru. V prípade proteínu ERCC1 by sme u pacientov s adenokarcinómom a skvamocelulárnym typom mohli predpokladať zvýšenú rezistenciu na liečbu platinovými derivátmi vďaka vysokej pravdepodobnosti expresie proteínu. Ak by sme však tento predpoklad chceli potvrdiť, potrebovali by sme podstatne zväčšiť náš súbor pacientov. Hladiny ERCC1 však nekorelovali so žiadnymi nami sledovanými klinickopatologickými parametrami. Tento proteín bude pravdepodobne predstavovať u NSCLC prognosticky nezávislý faktor.Kľúčové slová:
DNA reparačné proteíny – nemalobunkový karcinóm pľúc – imunohistochémiaÚvod
Štandardnú súčasť liečby väčšiny karcinómov vrátane karcinómu pľúc predstavuje aj v súčasnosti chemoterapia, pričom veľký terapeutický problém spôsobuje rezistencia a toxicita na mnohé cytostatiká. Cieľom snaženia sa výskumných tímov dnes je objaviť hlavnú príčinu mechanizmu vzniku liekovej rezistencie a cielene nasmerovať terapiu. Dôkazom sú významné výsledky získané cielenou liečbou napr. adenokarcinómu pľúc použitím inhibítorov tyrozínkinázovej aktivity EGFR [1].
Jedným z mechanizmov zodpovedných za rezistenciu je aj proces DNA reparácie. U človeka bolo identifikovaných vyše 150 génov asociovaných s DNA reparáciou a 5 hlavných biochemických ciest opravy. Medzi ne patria bázová excízna reparácia (base excision repair = BER) a nukleotidová excízna reparácia (nucleotide excision repair = NER). Za normálnych okolností slúžia tieto DNA reparačné mechanizmy na kontrolu poškodení DNA, čo je proces nevyhnutný na udržanie genetickej integrity a stability. Defekty v DNA reparácii sú tak v konečnom dôsledku zodpovedné za rozvoj nádorového bujnenia, ale aj za vznik metabolických porúch a predčasného starnutia. Na druhej strane zvýšená reparačná schopnosť v nádorových bunkách je nežiaduca, keďže zvýšená oprava defektov DNA spôsobených použitím antineoplastických látok poškodzujúcich DNA vedie k už spomínanej rezistencii na cytostatickú liečbu [2,3].
Bázová excízna reparácia (BER) je hlavným mechanizmom pre opravu alkylačných a oxidačných poškodení DNA [4]. Kľúčovou zložkou BER je proteín XRCC1 (proteín X-žiarenie reparujúcej cross-komplementujúcej skupiny 1). Tento proteín plní úlohu koordinátora všetkých enzymatických krokov BER a moduluje aktivitu zahrnutých proteínov [4,5]. Je zapojený zároveň do opravy jednoreťazcových zlomov [6] vznikajúcich počas endogénnych reakcií alebo pôsobením exogénnych činiteľov. XRCC1 pôsobí pri týchto procesoch ako molekulárny šaperón alebo kostrový proteín, ktorý stabilizuje a aktivuje ostatné reparačné enzýmy [7]. Na zvyšovaní rizika vzniku nádorového bujnenia sa podieľajú mnohé polymorfizmy proteínu XRCC1. Avšak dva z nich si zasluhujú v tejto súvislosti najväčšiu pozornosť. Je to polymorfizmus Arg194Trp a variant Arg399Gln. Polymorfizmus Trp194 je dávaný do súvisu so zvýšením BER kapacity, kým Gln399 variant bol asociovaný s redukciou reparačnej kapacity [8–10]. Bunky, ktoré vykazujú defektný gén XRCC1, majú zvýšenú senzitivitu na ionizačné žiarenie, UV, peroxid vodíka a mitomycín [7].
Nukleotidová excízna reparácia (NER) odstraňuje objemné DNA addukty vznikajúce pôsobením početných karcinogénov (aflatoxín, benzopyrén), ionizujúceho žiarenia a UV radiácie, pričom vzniká štrukturálna deformácia DNA.
Proteín ERCC1 (excision repair cross--complementation group 1 enzyme) zohráva dôležitú úlohu v nukleotidovej excíznej reparácii, ktorá rozpoznáva a odstraňuje addukty platina – DNA [11–13]. Vzťah medzi expresiou ERCC1 a klinickou odpoveďou na liečbu derivátmi platiny skúmalo niekoľko štúdií, predovšetkým u gastrointestinálnych malignít. Boli identifikované 2 polymorfizmy ERCC1. Jeden v kodóne 118 a exóne 4, kde spôsobuje substitúciu cytozínu za tymín, pričom k zámene aminokyseliny nedochádza. Tento polymorfizmus sa dáva do súvislosti so zníženými hladinami mRNA a proteínu, ktoré môžu spôsobiť rozdielnu odpoveď na cisplatinu. Druhý polymorfizmus v pozícii 8092 vedie k substitúcii cytozínu za adenín. Jeho úloha v súvislosti so senzitivitou a toxicitou na deriváty platiny bola retrospektívne študovaná u mnohých nádorov, vrátane karcinómu pľúc avšak s protichodnými výsledkami [14–17]. Dôležitosť ERCC1 v rezistencii karcinómu pľúc na platinové deriváty však potvrdzujú viaceré klinické údaje.
Pacienti a metódy
Cieľom našej práce bola imunohistochemická analýza expresie proteínov XRCC1 a ERCC1 v 107 vzorkách nemalobunkového karcinómu pľúc vo vzťahu k týmto základným klinickopatologickým parametrom: histopatologický typ nádoru, grade a TNM štádium ochorenia (stage). Údaje sme získali od pacientov, ktorí podstúpili radikálnu resekciu (lobektómiu alebo pulmonektómiu a lymfadektómiu) v Národnom ústave tuberkulózy, pľúcnych chorôb a hrudníkovej chirurgie vo Vyšných Hágoch. Pacienti, ktorí boli do štúdie zahrnutí nám poskytli informovaný súhlas. Patologická diagnóza bola stanovená na základe kritérií WHO [18] a pokročilé štádia boli hodnotené podľa TNM klasifikácie [19].
Nemalobunkové karcinómy pľúc sme rozdelili podľa histopatologického typu nasledovne: adenokarcinóm – 48 vzoriek, skvamocelulárny karcinóm – 48 vzoriek, veľkobunkový karcinóm v počte 11 vzoriek. Proteín XRCC1 sme imunohistochemicky detegovali použitím myšej monoklonovej protilátky proti XRCC1 (Ab-3 klon 144, Lab Vision Corporation). Na dôkaz ERCC1 sme použili taktiež primárnu myšiu monoklonovú protilátku – ERCC1 prediluted antibody (SPM243), (ABCAM, Inc.). Na detekciu naviazanej primárnej protilátky sme použili univerzálny detekčný kit (Universal detection kit LSAB + KIT/HRP, Dako). Tento obsahoval sekundárnu biotinylovanú protilátku (LINK) a streptavidín peroxidázu (LABEL). Ako chromogén sme použili DAB (diamínobenzidín). Jadrá buniek boli dofarbené hematoxylínom. Správnosť použitej metodiky sme kontrolovali vynechaním primárnej protilátky a jej nahradením základným premývacím pufrom na jednej vzorke, v každom farbenom súbore. Ostatné kroky ostali plne zachované. Výsledky boli vyhodnocované v svetelnom mikroskope tromi nezávislými hodnotiteľmi. Expresiu proteínu sme určili semikvantitatívnou metódou a použili sme nasledovnú škálu od 0 do 3+. 0 % pozitívnych buniek = negatívny výsledok (–); 1–10 % = 1+; 11–90 % = 2+; 91–100 % = 3+. Za pozitívne vzorky sme považovali len tie, ktoré boli ohodnotené na 2+ a 3+, t. j. percento pozitívnych buniek bolo nad 10 %. Vzorky, ktoré boli hodnotené na (–) a 1+, sme považovali za negatívne, keďže pozitivita bola pod 10 %. Na štatistické vyhodnotenie výsledkov sme použili chí-kvadrátový test. Hodnota p < 0,05 bola štatisticky významná.
Výsledky
V našej práci sme použili 107 vzoriek pacientov s nemalobunkovým karcinómom pľúc, v ktorých sme nepriamou imunohistochemickou metódou detegovali expresiu proteínov XRCC1 a ERCC1. Vzorky sme si rozdelili podľa histopatologického typu, gradingu a stagingu ochorenia. Presnú charakteristiku a počty vzoriek v jednotlivých skupinách udáva tab. 1.
Tab. 1. Charakteristika vzoriek NSCLC u 107 pacientov. 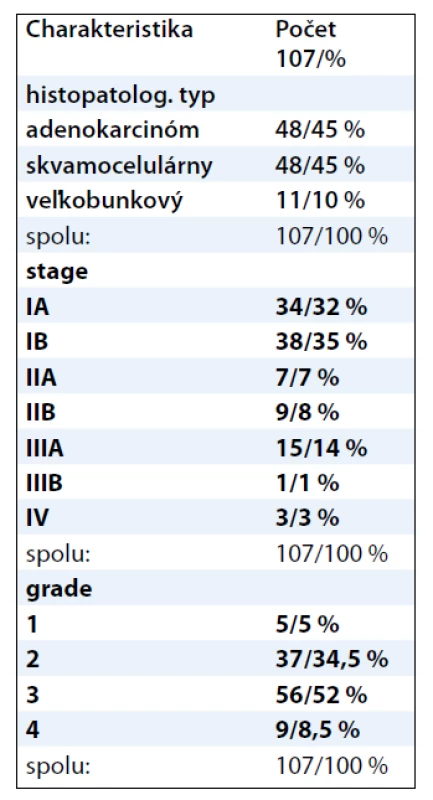
Pozitívna reakcia sa v prípade oboch proteínov prejavila výrazným tmavohnedým sfarbením jadier nádorových buniek. Hnedé sfarbenie bolo dosiahnuté použitím chromogénu – DAB. Vzorky, ktoré nevykazovali prítomnosť proteínu, mali jadrá sfarbené hematoxylínom na modro.
Proteín XRCC1
Vzorky adenokarcinómu, v porovnaní so vzorkami skvamocelulárneho a veľkobunkového karcinómu, obsahovali pomerne nízke hladiny proteínu XRCC1. Expresia proteínu bola detegovaná v 35,5 % prípadov. Vzorky ostatných dvoch typov (skvamocelulárneho a veľkobunkového) vykazovali skoro dvojnásobné hodnoty (nad 60 %).
Pri štatistickom porovnávaní expresie proteínu XRCC1 s typom nádoru sme zistili, že hodnota p = 0,0306 (chí-kvadrátový test, p < 0,05). Z uvedeného vyplýva, že expresia proteínu XRCC1 je v korelácii s typom nádoru. Presné údaje udáva tab. 2.
Tab. 2. Vzťah proteínu XRCC 1 k typu nádoru. 
Tiež sme porovnávali a štatisticky vyhodnocovali expresiu proteínu XRCC1 vo vzťahu k gradingu a stagingu ochorenia. Získané hodnoty však neboli v tomto prípade štatisticky významné.
Proteín ERCC1
Expresiu proteínu ERCC1 sme taktiež vyhodnocovali vo vzťahu k typu nádoru, gradingu a stagingu ochorenia. Na rozdiel od proteínu XRCC1 sme pozorovali u adenokarcinómu a skvamocelulárneho karcinómu vysokú expresiu proteínu ERCC1. Táto dosahovala hodnoty 64,5 % u adenokarcinómu a 62,5 % u skvamocelulárneho typu. U adenokarcinómu sme ďalej zistili podstatný rozdiel v obsahu proteínov ERCC1 (64,5 % pozitívnych vzoriek) vs XRCC1 (35,5 % pozitívnych vzoriek).
V prípade vzoriek veľkobunkového typu bola pozitivita ERCC1 približne rovnaká (45,5 % pozitívnych vzoriek vs 54,5 % negatívnych prípadov). Údaje sú uvedené v tab. 3.
Tab. 3. Vzťah proteínu ERCC 1 k typu nádoru. 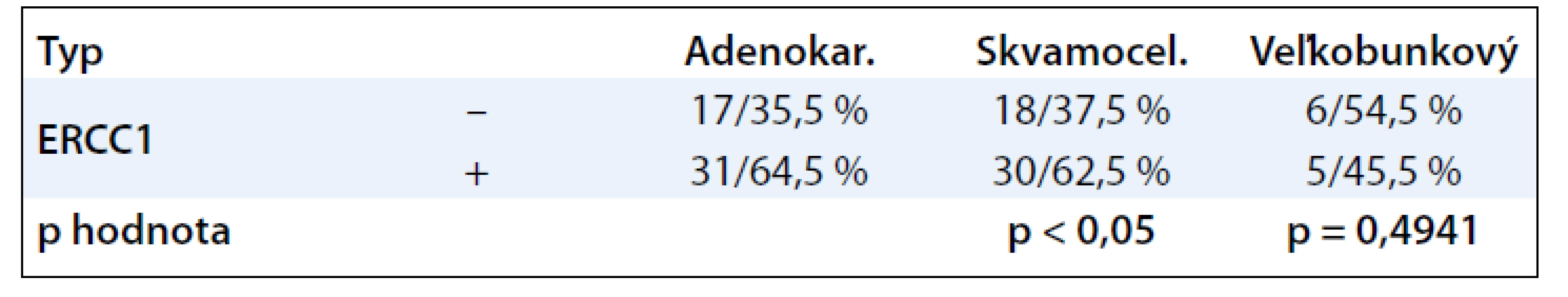
Pri použití štatistického testu sme nezaznamenali štatistickú významnosť ani v jednom zo sledovaných parametrov (typ, grading, staging). Zdá, sa že proteín ERCC1 bude teda predstavovať u NSCLC nezávislý prognostický faktor.
Diskusia
Voľba cytotoxickej chemoterapie sa u karcinómu pľúc dnes zakladá na charakteristike pacienta a nádoru (histológia a rozsah ochorenia, vek a celkový stav pacienta). DNA reparačné gény a ich polymorfizmy sú vhodnými kandidátmi, ktorí by mohli určovať účinnosť chemoterapie a následne slúžiť ako prognostické faktory ochorenia. Nízka reparačná kapacita (nízka expresia DNA reparačných proteínov) v tkanive favorizuje karcinogénny proces, ale naopak zvyšuje senzitivitu na lieky. V praxi to znamená, že kým reparačná schopnosť chráni tkanivo pred malígnym procesom, na druhej strane tá istá príčina v podmienkach nádorového bujnenia zvyšuje liekovú rezistenciu.
Proteín XRCC1 je členom DNA reparačného mechanizmu BER (bázová excízna reparácia) a jeho prognostická hodnota alebo vzťah k liekovej rezistencii nie je zatiaľ úplne preštudovaný.
V našej štúdii sme na 107 vzorkách NSCLC zistili, že daný proteín sa najčastejšie overexprimuje u skvamocelulárneho a veľkobunkového typu, kým u adenokarcinómu sú jeho hodnoty približne o polovicu nižšie. V prvých dvoch spomínaných typoch bude bázová excízna reparácia predstavovať zrejme významný mechanizmus DNA reparácie pri jej poškodení cytostatikami. Okrem toho sme zistili, že prítomnosť XRCC1 je v korelácii s histopatologickým typom nádoru (p = 0,0306, p < 0,05) nie však s gradingom a stagingom ochorenia. Naše výsledky čiastočne potvrdzujú aj Giachino et al [20], ktorí podobne ako my nenašli koreláciu XRCC1 so stagingom ochorenia, ale na rozdiel od nás ani s typom nádoru. Bolo zistené, že proteín XRCC1 by mohol slúžiť ako prognostický marker u pacientov s NSCLC, ale v III. štádiu ochorenia [21]. My sme tento poznatok nepotvrdili. Možným dôvodom z našej strany by mohol byť aj pomerne malý počet vzoriek so štádiom III, ktoré sme mali k dispozícii.
Viaceré práce sa zameriavajú na expresiu DNA reparačných proteínov v súvislosti s vývojom ochorenia. Kang et al [21] uvažujú, že expresia týchto proteínov nie je stabilná a môže sa meniť v závislosti od statusu nádorových buniek. Porovnanie ich expresie pre - a versus post - chemoterapii by mohlo priniesť zaujímavé údaje týkajúce sa prípadných zmien ich hladín vyvolaných chemoterapiou. Nemenej zaujímavé sú aj poznatky týkajúce sa polymorfizmov génu XRCC1 a vzťah ku karcinómu pľúc. Bol dokázaný protektívny efekt genotypu Gln399Gln pri vzniku karcinómu pľúc [22]. Rôzne polymorfizmy jeho génu sú spojené s rozdielnym rizikom vzniku karcinómu pľúc v závislosti od etnických skupín [23]. Príčiny týchto zreteľných diferencií medzi jednotlivými etnikami dnes ešte nie sú známe, ale mohli by mať súvis s ďalšími genetickými alebo environmentálnymi faktormi.
Viaceré predklinické štúdie uvádzajú, že proteín ERCC1 je dôležitým prediktívnym a/alebo prognostickým indikátorom nádorov. Tieto práce poukazujú na jeho význam pri terapii platinovými derivátmi [24,25]. Zvýšená expresia proteínu je v priamom súvise so vznikom rezistencie na liečbu na báze platiny.
V posledných rokoch je zvýšená pozornosť venovaná vzťahom medzi expresiou ERCC1 a správaním sa nádorových buniek, resp. prežívaním pri rozdielnych typoch nádorov. Výsledky týchto skúmaní sú však veľmi protichodné a navzájom sa vyvracajú. To iste súvisí s metodickými rozdielnosťami pri spracovaní a stanovovaní expresie a s nedostatkom štandardizácie.
My sme našimi výsledkami zistili pomerne vysoké a vyrovnané hladiny ERCC1 u adenokarcinómu a skvamocelulárneho typu. Pri porovnaní prítomnosti oboch proteínov v tých istých vzorkách sme našli markantné rozdiely v expresii oboch proteínov u adenokarcinómu. Kým proteín XRCC1 bol exprimovaný v 35,5 % vzoriek, proteín ERCC1 sme detegovali až v 64,5 % prípadov. Napriek tomu, že vysoká expresia ERCC1 by mohla svedčiť o zvýšenej rezistencii na liečbu platinovými derivátmi, na potvrdenie tejto hypotézy by sme potrebovali podstatne zväčšiť náš súbor pacientov. Potom by sme mohli u týchto pacientov predpokladať zvýšenú rezistenciu na liečbu platinovými derivátmi.
Štatistickú významnosť medzi expresiou proteínu ERCC1 a typom nádoru, gradingom a stagingom sme však nepotvrdili. Usudzujeme preto, že proteín ERCC1 bude predstavovať nezávislý prognostický marker pri terapii NSCLC. Existujú však najnovšie práce, ktoré potvrdzujú istý vzťah skúmaného proteínu s daktorými klinickopatologickými parametrami. Konkrétne práca autorov Tepeli et al [26] udáva štatistickú významnosť pri hodnotení vzťahu ERCC1 so stagingom ochorenia. Štúdia obsahovala 91 vzoriek pacientov s NSCLC. Autori dokázali štatisticky významný vzťah medzi ERCC1 a stagingom ochorenia.
Najnovšia štúdia – meta-analýza, autorov Hubner et al [27] udáva, že vysoká expresia proteínu ERCC1 môže nepriaznivo vplývať na celkové prežívanie pacientov s NSCLC, ktorí sú liečení platinovými derivátmi. Na druhej strane ale, nemá vplyv na výsledok liečby inej, ako je liečba derivátmi platiny.
Z dôvodu významného ovplyvňovania terapie na báze platiny expresiou proteínu ERCC1, je ERCC1 status kritickým parametrom pri výbere liečebného protokolu. Autori Vilmar et al [28] zdôrazňujú nutnosť prísnej selekcie pacientov na základe expresie ERCC1 a presnosť metodológie. Je potrebné štandardizovať imunohistochemickú metódu na dôkaz ERCC1 na proteínovej úrovni. Bolo by žiaduce, aby sa ešte pred akýmkoľvek rozhodnutím o ďalšom postupe dala predpokladať klinická odpoveď pacienta v súvislosti s liečbou.
Nádej pre onkologických pacientov s nádormi rezistentnými na štandardnú terapiu predstavuje použitie inhibítorov DNA reparácie, z ktorých mnohé sa už testujú v klinických skúškach [29,30].
Záver
DNA reparačné proteíny u onkologických pacientov s nemalobunkovým karcinómom pľúc môžu slúžiť ako prediktory účinnej chemoterapie.
Poďakovanie
Za laboratórnu prácu by sme sa chceli poďakovať kolektívu laborantiek Ústavu anatómie.
Táto práca vznikla za finančnej podpory grantovej agentúry ministerstva školstva Slovenskej republiky VEGA: 1/0224/12; 1/0925/11; 1/0928/11.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
doc. MVDr. Silvia Rybárová, PhD.
Ústav anatómie
LF UPJŠ Košice
Šrobárova 2
040 01 Košice
Slovenská republika
e-mail: silvia.rybarova@upjs.sk
Obdrženo: 29. 5. 2012
Přijato: 14. 7. 2012
Zdroje
1. Svoboda M, Fabian P, Slabý O et al. Cílená léčba bronchoalveolárního plicního adenokarcinomu inhibitory tyrozinkinázové aktivity EGFR: kazuistika klinicky promptní a výrazné odpovědi a přehled literatury. Klin Onkol 2010; 23(4): 224–230.
2. Fortini P, Pascucci B, Parlanti E et al. The base excision repair: mechanisms and its relevance for cancer susceptibility. Biochimie 2003; 85(11): 1053–1071.
3. Kweekel DM, Gelderblom H, Guchelaar J. Pharmacology of oxaliplatin and the use of pharmacogenomisc to individualize therapy. Cancer Treat Rev 2005; 31(2): 90–105.
4. Christmann M, Tomicic MT, Roos WP et al. Mechanisms of human DNA repair: an update. Toxicology 2003; 193(1–2): 3–34.
5. Campalans A, Marsin S, Nakabeppu Y et al. XRCC1 interactions with multiple DNA glycosylases: a model for its recruitment to base excision repair. DNA Repair 2005; 4(7): 826–835.
6. Caldecott KW. XRCC1 and DNA strand break repair. DNA Repair 2003; 2(9): 955–969.
7. Thompson LH, West MG. XRCC1 keeps DNA from getting stranded. Mutat Res 2000; 459(1): 1–18.
8. Duell EJ, Wiencke JK, Cheng TJ et al. Polymorphisms in the DNA repair genes XRCC1 and ERCC2 and biomarkers of DNA damage in human blood mononuclear cells. Carcinogenesis 2000; 21(5): 965–971.
9. Matullo G, Palli D, Peluso M et al. XRCC1, XRCC3, XPD gene polymorphisms, smoking, and p32-DNA adducts in a sample of healthy subjects. Carcinogenesis 2001; 22(9): 1437–1445.
10. Wang Y, Spitz MR, Zhu Y et al. From genotype to phenotype: correlating XRCC1 polymorphisms with mutagen sensitivity. DNA Repair 2003; 2(8): 901–908.
11. Mu D, Hsu DS, Sancar A. Reaction mechanism of human DNA repair excision nuclease. J Biol Chem 1996; 271(14): 8285–8294.
12. Sancar A. Mechanisms of DNA excision repair. Science 1994; 266(5193): 1954–1956.
13. Zamble DB, Mu D, Reardon JT et al. Repair of cisplatin--DNA adducts by the mammalian excision nuclease. Biochemistry 1996; 35(31): 10004–10013.
14. Isla D, Sarries C, Rosell R et al. Single nucleotide polymorphisms and outcome in docetaxel-cisplatin-treated advanced non-small-cell lung cancer. Ann Oncol 2004; 15(8): 1194–1203.
15. Ryu JS, Hong YC, Han HS et al. Association between polymorphisms of ERCC1 and XPD and survival in non--small-cell lung cancer patients treated with cisplatin combination chemotherapy. Lung Cancer 2004; 44(3): 311–316.
16. Suk R, Gurubhagavatula S, Park S et al. Polymorphisms in ERCC1 and grade 3 or 4 toxicity in non-small cell lung cancer patients. Clin Cancer Res 2005; 11(4): 1534–1538.
17. Zhou W, Gurubhagavatula S, Liu G et al. Excision repair cross-complementation group 1 polymorphism predicts overall survival in advanced non-small cell lung cancer patients treated with platinum-based chemotherapy. Clin Cancer Res 2004; 10(15): 4939–4943.
18. Goldstraw P. IASLC Manual – Staging Manual in Thoracic Oncology. Orange Park, FL: Editorial Rx Press 2009.
19. Groome PA, Bolejack V, Crowley JJ et al. The IASLC Lung Cancer Staging Project: validation of the proposals for revision of the T, N and M descriptors and consequent stage groupings in the forthcoming (seventh) edition TNM classification of malignant tumours. J Thorac Oncol 2007; 2(8): 694–705.
20. Giachino D, Ghio P, Regazzoni S et al. Prospective assessment of XPD Lys751Gln and XRCC1 Arg399Gln single nucleotide polymorphisms in lung cancer. Clin Cancer Res 2007; 13(10): 2876–2881.
21. Kang CH, Jang BG, Kim DW et al. The prognostic significance of ERCC1, BRCA1, XRCC1, and betaIII-tubulin expression in patients with non-small cell lung cancer treated by platinum - and taxane-based neoadjuvant chemotherapy and surgical resection. Lung Cancer 2010; 68(3): 478–483.
22. Matullo G, Dunning AM, Guarrera S et al. DNA repair polymorphisms and cancer risk in non-smokers in a cohort study. Carcinogenesis 2006; 27(5): 997–1007.
23. Kiyohara C, Takayama K, Nakanishi Y. Association of genetic polymorphisms in the base excision repair pathway with lung cancer risk: a meta-analysis. Lung Cancer 2006; 54(3): 267–283.
24. Olaussen KA, Mountzios G, Soria JC. ERCC1 as a risk stratifier in platinum-based chemotherapy for non-small--cell lung cancer. Curr Opin Pulm Med 2007; 13(4): 284–289.
25. Reed E. ERCC1 and clinical resistance to platinum-based therapy. Clin Cancer Res 2005; 11(17): 6100–6102.
26. Tepeli E, Caner V, Büyükpınarbaşılı N et al. Expression of ERCC1 and its clinicopathological correlations in non-small cell lung cancer. Mol Biol Rep 2012; 39(1): 335–341.
27. Hubner RA, Riley RD, Billingham LJ et al. Excision repair cross-complementation group 1 (ERCC1) status and lung cancer outcomes: a meta-analysis of published studies and recommendations. PLoS One 2011; 6(10): e25164.
28. Vilmar A, Santorini-Rugiu E, Sørensen JB. ERCC1, toxicity and quality of life in advanced NSCLC patients randomized in a large multicentre phase III trial. Eur J Cancer 2010; 46(9): 1554–1562.
29. Madhusudan S, Hickson ID. DNA repair inhibition: a selective tumour targeting strategy. Trends Mol Med 2005; 11(11): 503–511.
30. Ding J, Miao ZH, Meng LH et al. Emerging cancer therapeutic opportunities target DNA-repair systems. Trends Pharmacol Sci 2006; 27(6): 338–344.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článek EditorialČlánek Sarkómy maternice – prehľadČlánek Klinický registr TULUNGČlánek Soutěž o nejlepší práci
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2012 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Editorial
- Mutace BRAF: nový přístup k cílené léčbě melanomu
- Hmotná podstata genetických informací – nukleové kyseliny
- Dabrafenib: nový inhibitor hyperaktivní kinázy B-RAF
- Sarkómy maternice – prehľad
- Prognostické faktory konvenčního osteosarkomu dospělých pacientů
- Neoplastické účinky indometacínu v N-metyl-N-nitrozoureou indukovanej mamárnej karcinogenéze u samíc potkanov
- Predoperačná rádioterapia lokálne pokročilého karcinómu rekta: klinické výsledky krátkodobej a dlhodobej liečby s alebo bez konkomitantnej chemoterapie
- Význam stanovovania expresie DNA reparačných mechanizmov u nemalobunkového karcinómu pľúc
- Septické komplikace intravenózních portových systémů – kazuistiky a přehled literatury
- Klinický registr TULUNG
- Další pozitivní studie u karcinomu ovaria
- Instrukce pro autory – příprava příspěvku k publikování v časopisu Klinická onkologie
- Instrukce pro autory – odeslání příspěvku k publikování v časopisu Klinická onkologie
- Onkologie v obrazech: Generalizovaný Kaposiho sarkom
- Soutěž o nejlepší práci
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Prognostické faktory konvenčního osteosarkomu dospělých pacientů
- Sarkómy maternice – prehľad
- Septické komplikace intravenózních portových systémů – kazuistiky a přehled literatury
- Mutace BRAF: nový přístup k cílené léčbě melanomu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



