-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Význam mikroRNA u glioblastomových kmenových buněk
The Relevance of MicroRNAs in Glioblastoma Stem Cells
Glioblastoma multiforme is the most common intracranial malignity of astrocyte origin in adults. Despite complex therapy consisting of maximal surgical resection, adjuvant concomitant chemoradiotherapy with temozolomide followed by temozolomide in monotherapy, the median of survival ranges between 12 and 15 months from diagnosis. This infaust prognosis is very often caused by both impossibility of achieving of sufficient radical surgical resection and tumor resistance to adjuvant therapy, which relates to the presence of glioblastoma stem cells. Similarly to normal stem cells, glioblastoma stem cells are capable of self ‑ renewal, differentiation, and unlimited slow proliferation. Their resistance to conventional therapy is also due to higher expressions of DNA repair enzymes, antiapoptotic factors and multidrug transporters. Therefore, targeting these unique properties could be a novel promising therapeutic approach leading to more effective therapy and better prognosis of glioblastoma multiforme patients. One of the approaches how to successfully regulate above ‑ mentioned properties is targeted regulation of microRNAs (miRNAs). These small non‑coding RNA molecules post‑transcriptionally regulate expression of more than 2/ 3 of all human genes that are also involved in stem cell associated signaling pathways. Moreover, deregulated expression of some miRNAs has been observed in many cancers, including glioblastoma multiforme.
Key words:
cancer stem cells – glioblastoma multiforme – microRNA
This study was supported by grant of Internal Grant Agency of the Czech Ministry of HealthNo. NT13514-4/2012 and project „CEITEC – Central European Institute of Technology“ (CZ.1.05/1.1.00/02.0068).
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.Submitted:
12. 5. 2015Accepted:
10. 9. 2015
Autoři: R. Kleinová 1; O. Slabý 1,2; J. Šána 1,2
Působiště autorů: CEITEC – Středoevropský technologický institut, MU, Brno 1; Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno 2
Vyšlo v časopise: Klin Onkol 2015; 28(5): 338-344
Kategorie: Přehledy
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amko2015338Souhrn
Multiformní glioblastom je nejčastější intrakraniální malignitou astrocytárního původu dospělé populace. I přes absolvování komplexní terapie skládající se z maximální možné chirurgické resekce, adjuvantní konkomitantní chemoradioterapie s temozolomidem a následného podání temozolomidu v monoterapii se medián přežití pacientů pohybuje pouze mezi 12 a 15 měsíci od stanovení diagnózy. Za touto špatnou prognózou stojí jednak velmi často nemožnost dosažení dostatečně radikální chirurgické resekce a dále značná rezistence nádoru k adjuvantní léčbě, jež je v současné době velmi často dávána do souvislosti s přítomností tzv. glioblastomových kmenových buněk. Tyto buňky, stejně jako normální kmenové buňky, disponují několika unikátními vlastnostmi, jako jsou schopnost sebeobnovy, diferenciace a neomezeného, avšak pomalého buněčného dělení. Jejich rezistence ke konvenční terapii pak zcela jistě souvisí i se zvýšenou expresí DNA reparačních enzymů, antiapoptotických faktorů a mnohočetných lékových transportérů. Cílené ovlivnění těchto unikátních vlastností by proto mohlo být novým slibným terapeutickým přístupem vedoucím k zefektivnění léčby a zlepšení prognózy pacientů s multiformním glioblastomem. Jednou z možností, jak úspěšně ovlivňovat zmíněné vlastnosti, je cílená regulace mikroRNA (miRNA). Tyto krátké nekódující molekuly RNA posttranskripčně reprimují expresi více než 2/ 3 celkového počtu lidských genů, jež jsou mimo jiné součástí signálních drah spojovaných právě s kmenovými vlastnostmi buněk. Mimoto pozměněné hladiny některých miRNA byly pozorovány u mnoha nádorových onemocnění, včetně multiformního glioblastomu.
Klíčová slova:
nádorové kmenové buňky – multiformní glioblastom – mikroRNAÚvod
Multiformní glioblastom (glioblastoma multiforme – GBM) patří do skupiny high‑grade astrocytomů a s incidencí 3,55 nových případů na 100 000 lidí ročně se řadí mezi nejčastěji se vyskytující intrakraniální malignity [1]. Tento nádor je tvořen rychle rostoucí masou málo diferencovaných astrocytů, která často prorůstá do okolní tkáně. Bývá velmi silně vaskularizován, špatně ohraničen a často inklinuje k nekrózám. Léčba je založena na maximální možné chirurgické resekci tumoru následované konkomitantní chemoradioterapií s temozolomidem (TMZ) a adjuvantním TMZ v monoterapii [2]. I přes tuto vysoce intenzivní léčbu je prognóza pacientů infaustní s mediánem celkového přežití (overall survival – OS) přibližně 12–15 měsíců od stanovení diagnózy [3].
Podle současných studií je jedním z důvodů špatné prognózy mnoha nádorových onemocnění malá populace nádorových buněk vyznačující se unikátními vlastnostmi, jako jsou schopnost sebeobnovy, diferenciace a neomezené proliferace. Tyto buňky disponují rovněž zvýšenou rezistencí k podávané léčbě, a stojí tak pravděpodobně za vznikem časných recidiv. Pro svoji podobnost se zdravými kmenovými buňkami bývají označovány jako nádorové kmenové buňky (carcinoma stem cells – CSCs) nebo také tumor iniciující buňky (tumor ‑ initiating cells – TICs) [4]. Cílená regulace CSCs by tedy na základě současných poznatků mohla významně zefektivnit terapii mimo jiné i u GBM, kde byly tyto buňky mnohokrát pozorovány [5].
Jedna z možností, jak efektivně zasahovat do biologie CSCs, je skrze cílenou regulaci mikroRNA (miRNA), krátkých nekódujících RNA, které jsou schopné vazbou na cílovou molekulu mediátorové RNA (mRNA) posttranskripčně regulovat genovou expresi. Bylo prokázáno, že jsou tyto 18 – 25 nukleotidů dlouhé molekuly zapojené v regulaci většiny důležitých buněčných procesů, jako je proliferace, diferenciace, apoptóza anebo řízení buněčného cyklu. Není proto divu, že změna v expresi několika miRNA často vede na úrovni buňky k fatálním následkům ústícím až v její maligní transformaci [6]. MiRNA hrají klíčovou roli rovněž v biologii CSCs, kde se podílejí na udržování jejich jedinečných vlastností. Předpokládá se tedy, že by cílené ovlivnění konkrétních miRNA v CSCs mohlo vést ke ztrátě „stem‑like“ fenotypu těchto buněk, což by v klinickém důsledku mohlo zefektivnit terapii, prodloužit čas do progrese onemocnění, a tedy i OS pacientů s prognosticky nepříznivými nádorovými onemocněními, mezi které se zcela jistě řadí i GBM [7].
Historie a biologie CSCs
Teorie CSCs je poměrně novým pohledem na nádorovou transformaci. Její kořeny však sahají až do 1. poloviny 20. století, kdy bylo zjištěno, že nádorová tkáň vykazuje značnou buněčnou heterogenitu a že dokonce i jednotlivé buňky jsou schopné iniciovat vznik nového nádoru [8]. Další výzkumy pak ukázaly, že některé nádorové buňky jsou multipotentní, a tedy schopné diferenciace do více buněčných podtypů [9].
Přímé důkazy o existenci CSCs však přinesly až na začátku 90. let 20. století nové technologie, jako je metoda FASC (fluorescence‑activated cell sorting) a přístupy založené na transplantaci buněk do imunodeficientních myší. V roce 1994 Lapidot et al vyizolovali z akutní myeloidní leukemie na základě exprese markerů hematopoetických buněk (CD34+CD38– ) buněčnou populaci, která vykazovala vysoce tumorogenní vlastnosti. Tyto buňky dnes označujeme jako nádorové kmenové (CSCs) nebo tumor iniciující (TICs) buňky [10]. Ovšem až v roce 2003 se podařilo poprvé vyizolovat CSCs i ze solidního nádoru, konkrétně z karcinomu prsu. Tyto buňky exprimující stejně jako normální kmenové buňky povrchové markery CD44+CD24– / low byly po implantaci do imunodeficientních myší schopné iniciovat růst nového nádoru [11]. Poté následovaly studie, které potvrdily existenci CSCs i v dalších typech nádorových onemocnění: kolorektálním karcinomu, melanomu a u nádorů mozku včetně GBM [12 – 15].
Teorie CSCs předpokládá, že jsou buňky nádoru, stejně jako v případě normální zdravé tkáně hierarchicky uspořádány, přičemž na vrcholu stojí malá populace buněk dnes známá jako CSCs. Jejich původ je však doposud zahalen mnoha nejasnostmi. Nejčastěji diskutovanou teorií je, že vznikají ze somatických kmenových buněk tkáně, ze které se nádor vyvinul. Tuto hypotézu podporuje fakt, že somatické kmenové buňky jsou jedny z nejdéle žijících buněk. Jsou tedy vystaveny delšímu působení genotoxických vlivů než ostatní buňky a díky tomu se u nich mohou nakumulovat mutace vedoucí až k nádorové transformaci. Podle jiných autorů za vznikem CSCs stojí dediferenciace progenitorových nebo více diferencovaných nádorových buněk, kdy vlivem mutací získávají tyto buňky vlastnosti buněk kmenových [16,17].
Mezi tyto unikátní vlastnosti patří i schopnost sebeobnovy a diferenciace. CSCs jsou tedy stejně jako jejich nenádorové analogy schopny asymetrického dělení, při kterém vzniká jedna buňka mateřského fenotypu a jedna buňka diferencovaná. Mechanizmy zajišťující správnou funkci těchto vlastností podléhají v normálních kmenových buňkách přísné regulaci. Právě mutace, které do těchto schopností a signalizačních drah s nimi souvisejících zasahují, jsou jedním z předpokladů neoplastické transformace [17,18]. V tomto kontextu jsou nejčastěji zmiňovány signální dráhy Wnt, Notch a Hedgehog [19 – 22].
Přítomnost CSCs do značné míry vysvětluje nízkou efektivitu konvenční terapie u některých nádorových onemocnění. Tato terapie je totiž zaměřena především na rychle se dělící buňky nádoru. Avšak jak již bylo zmíněno, CSCs se většinu času vyskytují v tzv. klidovém stadiu buněčného cyklu, a tedy rychlost jejich proliferace není tak rapidní. To poskytuje buňce dostatečný čas, aby opravila poškozenou DNA, v čemž jí navíc významně pomáhají zvýšené hladiny DNA reparačních enzymů a ABC transportérů (transportéry lékové rezistence) [17,18]. Dokonce bylo zjištěno, že CSCs, kterým se podařilo uniknout chemoterapii, byly více rezistentní a tuto vlastnost následně předávaly i svým dceřiným buňkám. Tato skutečnost tak koresponduje s faktem, že rekurentní tumory bývají často k léčbě méně citlivé než primární nádor [23].
Glioblastomové kmenové buňky
Glioblastomové kmenové buňky (glioblastoma stem cells – GSCs) pocházejí pravděpodobně z neurálních kmenových buněk. Nasvědčuje tomu i skutečnost, že poprvé byly z GBM tkáně vyizolovány na základě exprese povrchového glykoproteinu CD133, jehož přítomnost je typická pro normální neurální kmenové buňky (neural stem cells – NSCs). GSCs, stejně jako NSCs rostou v bezsérovém mediu jako suspenzní sférické buněčné kolonie neboli neurosféry a vyznačují se expresí stejných identifikujících markerů [12,15,24]. Historicky nejvíce používaným markerem GSCs je již zmiňovaný CD133, který se však na základě posledních studií jeví jako nepříliš specifický [14,25,26]. Mnohem větší specificita je v současné době připisována molekule CD15 [27] a cytoskeletálnímu proteinu nestinu, jehož exprese se mimo jiné u gliomů ukázala být negativním prognostickým faktorem. V dnešní době se ale nabízí i další možnosti izolace GSCs nevyžadující použití povrchových markerů. Zajímavým způsobem identifikace této buněčné populace je kupříkladu již zmiňovaný fakt, že GSCs jsou pomalu se dělící buňky. Fluorescenční barvivo PKH ‑ 26 se naváže na povrch cytoplazmatické membrány buněk a s každým následným buněčných dělením se jeho množství na buňce sníží o polovinu. Dceřiné buňky proto vykazují nižší fluorescenční aktivitu než buňka mateřská. Pomocí FASC lze tedy následně identifikovat GSCs jako nejvíce fluorescenčně aktivní buňky v suspenzi [28]. Jiný způsob izolace GSCs je založen na schopnosti buněk aktivně se zbavovat škodlivých látek. Jde o metodu izolace tzv. side population, u které byla detekována zvýšená hladina ABC transportérů a jež rovněž disponuje kmenovými vlastnostmi [29].
Pro GSCs je typická perivaskulární lokalizace a jejich výskyt byl také objeven v okolí nekrotických ložisek, což dokládá fakt, že je stem‑like fenotyp těchto buněk značnou mírou závislý na okolním mikroprostředí. Často diskutován je vliv hypoxie na chování GSCs [30]. Hypoxie indukuje expresi HIF (hypoxia inducible factor), který zvyšuje schopnost sebeobnovy jak GSCs, tak i non‑GSCs. Zatímco HIF1α je exprimován i neurálními kmenovými buňkami, HIF2α je typický pouze pro GSCs, což z něj v podstatě činí ideální terapeutický cíl [31].
Správná identifikace a izolace GSCs je tedy klíčovým krokem pro další výzkum. Jejich eliminace, případně diferenciace by mohla mít velký terapeutický význam a mohla by přinést novou naději pacientům postiženým GBM.
Význam miRNA v regulaci kmenových vlastností GSCs
MiRNA jsou krátké molekuly RNA se značným potenciálem regulovat genovou expresi. Podle současných výzkumů tvoří geny pro miRNA asi 3 % lidského genomu, ale jsou schopny ovlivňovat expresi až 60 % kódujících lidských genů [32,33]. Jejich regulační efekt se tedy samozřejmě uplatňuje ve většině důležitých buněčných procesů, jako je proliferace, diferenciace, apoptóza, buněčný cyklus a stejně tak udržování kmenových vlastností buněk [6]. Regulační schopnosti miRNA jsou tak zapojeny i do biologie GSCs, což činí z těchto molekul ohnisko zájmu mnoha výzkumných kolektivů. Cílená regulace miRNA, které jsou zapojeny do řízení kmenových vlastností GSCs, by totiž mohla být využita jako nový efektní přístup léčby nádorových chorob, včetně GBM [7].
Tato strategie však v sobě skrývá mnohá úskalí. GSCs jsou velmi blízké NSCs a mechanizmy udržující jejich kmenovost jsou často stejné či podobné u obou těchto buněčných populací. Důležité tedy je, aby léčba zaměřující se na GSCs cílila opravdu jenom na tyto buňky. Lang et al proto za použití metody hlubokého sekvenování identifikovali miRNA, které jsou rozdílně exprimované mezi těmito buněčnými populacemi, a tím získali sadu potenciálních terapeutických cílů pro cílenou léčbu, která cílí pouze na GSCs, a nikoli na NSCs. Signifikantně zvýšenou hladinu v GSCs vykazovaly miR ‑ 10a, miR ‑ 10b a miR ‑ 140 - 5p. Naopak snížená exprese byla detekována u miR ‑ 874 a miR ‑ 124. Jako přímý cíl miR ‑ 10a a miR ‑ 10b byl identifikován nádorový supresor CSMD1 (CUB and SUSHI multiple domain protein 1), jehož ztráta nebo snížená hladina byly zaznamenány i u jiných typů nádorů [34,35]. Tento transmembránový protein je podle některých studií zapojen do signalizace TGF‑β (transforming growth factor β), jež patří mezi hlavní regulátory kmenovosti a rovněž se podílí na mechanizmech buněčného růstu a apoptózy [36,37]. Regulační vliv této miRNA byl popsán také pro další geny zapojené v nádorové transformaci, jako je PTEN (phosphatase and tensin homolog), STAT3 (signal transducer and activator of transcription 3), SDC ‑ 1 (syndecan 1), TIAM1 (T ‑ cell lymphoma invasion and metastasis 1), NF ‑ 1 (neurofibromin 1). Inhibice miR ‑ 10b v GSC a GBM buňkách měla za následek výrazné snížení proliferace, migrace, invazivity a buněčného růstu, a to zejména v případě GSC [38].
Mezi přímé cíle nádorově supresorové miR ‑ 124 pak patří jednak známý onkogen NRAS (neuroblastoma RAS viral ( v ‑ ras) oncogene homolog), jenž je zapojen do procesu proliferace, diferenciace a schopnosti přežívání buněk, a dále serin/ treonin kináza PIM3 (Pim ‑ 3 proto ‑ oncogene, serine/ threonine kinase) modující buněčný cyklus [34]. MiR ‑ 124 byla rovněž identifikována jako cíl transkripčního faktoru REST (RE1 - silencing transcription factor), jednoho z hlavních represorů neurální diferenciace. Mezi její další cílové molekuly totiž patří fosfatáza SCP ‑ 1 (sarcoplasmic calcium‑binding protein 1), která výrazně potlačuje neurální diferenciaci [39,40]. Silber et al rovněž potvrdili zapojení miR ‑ 124 spolu s miR ‑ 137 do procesu diferenciace, a to jak v NSCs, tak i v mozkových CSCs. Obě tyto miRNA ovlivňují proliferaci GBM buněčných linií prostřednictvím přímé inhibice cyklin dependentní kinázy 6 (CDK6), která se skrze fosforylaci proteinu Rb (retinoblastoma) podílí na řízení buněčného cyklu [41]. Bylo rovněž zjištěno, že supresorová miR ‑ 137 vykazuje v GBM z důvodu hypermetilace svého promotoru sníženou hladinu. Exprese této molekuly pak narůstá s mírou diferenciace NSCs i GSCs. Po transfekci pre‑miR ‑ 137 do GSCs klesá u těchto buněk schopnost sebeobnovy, tvoření neurosfér a rovněž exprese markerů kmenových buněk Oct4 (POU class 5 homeobox 1), Nanog (Nanog homeobox), Sox2 (SRY (sex determining region Y) - box 2) a Shh (Sonic hedgehog). MiR ‑ 137 reguluje kmenové vlastnosti GSCs skrze svůj přímý cíl RTVP ‑ 1 (GLI pathogenesis‑related 1 – GLIPR ‑ 1), jehož exprese přímo koreluje se stupněm malignity astrocytomů. RTVP ‑ 1 zvyšuje expresi CXCR ‑ 4 (chemokine (C ‑ X ‑ C motif) receptor 4), který je zapojen v signalizaci SHH ‑ GLI ‑ Nanog, a tím přispívá ke zvýšení schopnosti sebeobnovy buněk [42]. Tumorogenní a invazivní marker CXCR ‑ 4 je přímým cílem klastru miR ‑ 302 - 367, a proto se i tato skupina miRNA pravděpodobně podílí na inhibici sebeobnovy, invazivity a infiltrace GBM iniciujících buněk. Mechanizmus tohoto působení je pak rovněž připisován ovlivnění signální dráhy SHH ‑ GLI ‑ Nanog, ve které, jak už bylo uvedeno, je CXCR ‑ 4 zapojen. Po zvýšení hladiny miR ‑ 302 - 367 v GSCs došlo k poklesu schopnosti tvořit neurosféry a naopak ke zvýšení exprese astrocytárního markeru GFAP (glial fibrillary acidic protein), což dokládá zapojení tohoto klastru i do procesu diferenciace [43]. Další miRNA zapojená do procesu diferenciace je miR ‑ 128. Po jejím zvýšení dochází k indukci diferenciace, a tudíž poklesu markerů kmenovosti, jako je Nestin nebo Sox2. Jejími přímými cíli jsou známé mitogenní tyrozinkinázy EGFR (epidermal growth factor receptor) a PDGFRα (platelet ‑ derived growth factor receptor, α polypeptide), u nichž už v předešlých studiích byl prokázán inhibiční vliv na neurální diferenciaci [44 – 46].
Aldaz et al se zaměřili na identifikaci molekul miRNA, jejichž exprese se během diferenciace GSCs mění, a tudíž se dá předpokládat jejich přímé zapojení do tohoto procesu. Míra exprese miR ‑ 93 a miR ‑ 106 se během diferenciace snižovala, naopak u miR ‑ 21, miR ‑ 29a, miR ‑ 29b, miR ‑ 221 a miR ‑ 222 se zvyšovala. Inhibice miR ‑ 221/ 222 v diferencujících GSCs měla za následek nárůst exprese proteinu nestin, ale pokles astrocytárních (GFAP) a neurálních markerů (neuron ‑ specific class III beta‑tubulin – TUJ1). Tento trend nebyl pozorován v případě miR ‑ 29a/ b. Jejich zvýšení v GSCs nevyvolalo žádné změny v expresi markerů kmenovosti ani v diferenciaci, ale vedlo k prokazatelnému snížení viability a zvýšení apoptózy. MiR ‑ 29a/ b jsou do procesu apoptózy zapojeny skrze svůj přímý cíl, antiapoptický protein Mcl ‑ 1 patřící do rodiny apoptických regulátorů Bcl ‑ 2. Překvapením studie bylo zjištění výrazné prodiferenciační role miR ‑ 21, mnohými studiemi postulovanou jako miRNA se silně onkogenními vlastnostmi. Po zvýšení této miRNA v GSCs opět došlo ke snížení exprese nestinu a nárůstu TUJ1 a GFAP. Jejím přímým cílem byl určen SPRY1 (sprouty homolog 1, antagonist of FGF signaling (Drosophila) ), který byl již dříve popsaný jako inhibitor neurální diferenciace v myších embryonálních kmenových buňkách [47]. MiR ‑ 221/ 222 i miR ‑ 21 jsou všeobecně známé pro své onkogenní vlastnosti [48,49]. Ve výše popsané studii však autoři polemizují, že pokud by léčba cílila na tyto miRNA, neměla by požadovaný efekt zabraňující vzniku recidiv právě kvůli zapojení těchto miRNA do procesu diferenciace [47]. Schraivogel et al se zaměřili na rozdíly v expresním profilu miRNA mezi CD133+ a CD133 – buňkami. CD133, jak již bylo uvedeno, je jedním z nejpoužívanějších markerů pro identifikaci a izolaci GSCs. MiR ‑ 9/ 9*, miR ‑ 15b, miR ‑ 17 - 5p, miR ‑ 106 vykazovaly nejvyšší expresi u CD133+ buněk, miR ‑ 221/ 222, miR ‑ 27, miR ‑ 21 zase u CD133– buněk. Cílená inhibice miR ‑ 9/ 9* a miR ‑ 17 - 5p vedla k redukci CD133+ buněk a jejich schopnosti tvořit neurosféry. Jako možný cíl těchto dvou miRNA byl identifikován transkripční faktor CAMTA1 (calmodulin binding transcription activator 1), který indukuje expresi krátkého sekretovaného proteinu NPPA (natriuretic peptide A) a jeho receptoru, jež se podílejí na inhibici proliferace [50]. Jiná výzkumná skupina zase uvedla, že k nejvíce sníženým miRNA v CD133+ oproti CD133– buňkám patří miR ‑ 125b, jež je zapojena do řízení proliferace. Jejím přímým cílem je totiž člen rodiny E2F (E2F transcription factor), což jsou významní regulátoři buněčného cyklu. Po zvýšení její hladiny v CD133+ buňkách došlo k represi exprese nestinu a CD133 a schopnosti těchto buněk tvořit neurosféry [51]. Exprese miR ‑ 17 - 92 se během diferenciace snižuje, což dokládá jejich význam v udržování kmenových vlastností GSCs. Tento klastr je zapojen v řízení proliferace a apoptózy skrze své cíle CDKN1A (cyclin‑dependent kinase inhibitor 1A), E2F1 a PTEN. Jako přímý cíl této molekuly byl rovněž určen růstový faktor pojivové tkáně CTFG (connective tissue growth factor), který váže VEGFA (vascular endothelial growth factor A) a tím přispívá k inhibici nádorové angiogeneze [52]. Zapojení miRNA v regulaci biologických vlastností a exprese vybraných markerů u GSCs je shrnuto na obr. 1, resp. tab. 1.
Obr. 1. Zapojení miRNA v regulaci biologických vlastností GSCs. 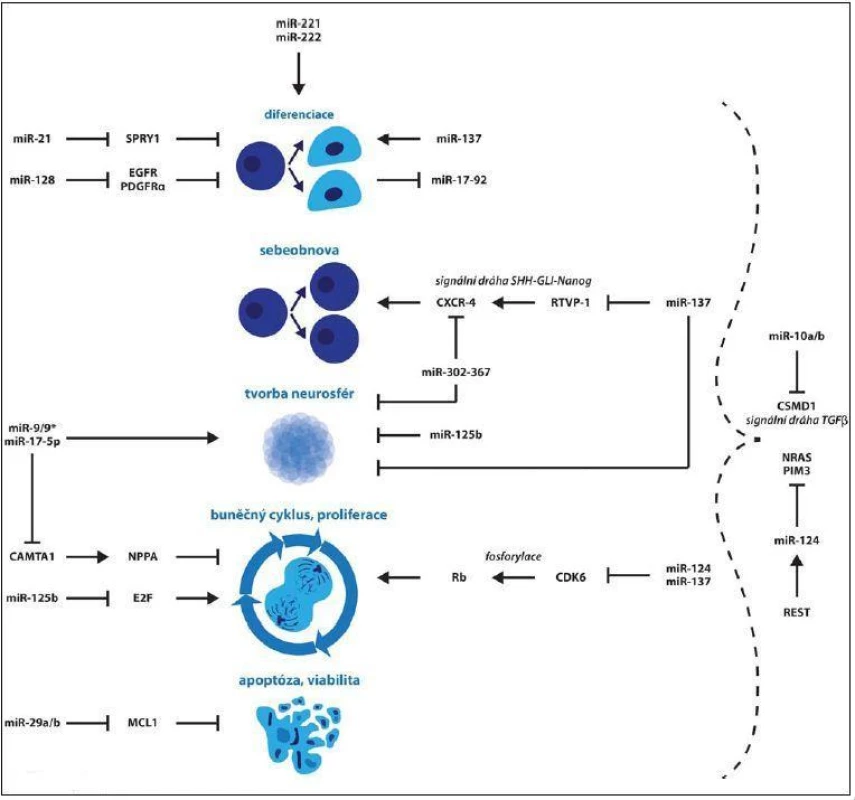
↓ aktivace, ┴ represe Tab. 1. Zapojení miRNA v regulaci exprese vybraných markerů u GSCs. 
↑ zvýšení exprese sledovaného markeru, ↓ snížení exprese sledovaného markeru GSCs – glioblastoma stem cells Význam miRNA v chemoradiorezistenci GBM
Léčba GBM je založena na maximální možné chirurgické resekci tumoru následované konkomitantní chemoradioterapií s TMZ. Tato adjuvantní terapie však téměř ve všech případech selhává a u pacientů dochází k časnému relapsu onemocnění způsobeného pravděpodobně přítomností rezistentních GSCs. Právě molekuly miRNA byly mnohokrát popsány jako regulátory chemoradiorezistence u mnoha nádorových onemocnění včetně GBM. Z tohoto pohledu skrývá ve svém působení značný terapeutický potenciál miR ‑ 211, která výrazně zvyšuje senzitivitu GBM buněk k chemoradioterapii. Tato miRNA mimo jiné cílí MMP ‑ 9 (matrix metallopeptidase 9), čímž výrazně přispívá ke snížení invazivity a migrace GSCs. Samotná radioterapie způsobila nárůst MMP ‑ 9, a tím i invazivity a migrace. V kombinaci s miR ‑ 211 a inhibitorem MMP ‑ 9 však došlo k jejich výraznému snížení a rovněž ke zvýšení apoptózy. Inhibice MMP ‑ 9 vede i k indukci apoptózy skrze iniciační kaspázu 9. Předešlými studiemi bylo zjištěno, že samotné podání TMZ vede k navýšení mnohočetných lékových transportérů v plazmatické membráně, které jsou schopny aktivní exkrece škodlivých látek ven z buňky. Buňky vystavené společnému působení TMZ, miR ‑ 211 a MMP ‑ 9 inhibitoru toto zvýšení nevykazovaly, což dokládá značné ambice této miRNA v budoucí cílené léčbě [53]. Další miRNA, která by se mohla podílet na regulaci mnohočetných lékových transportérů a tím i chemorezistence GSCs je miR ‑ 328 [54]. Jako cíl této miRNA byl totiž určen ABCG2 (ATP‑binding cassette, sub‑family G), který rovněž patří do rodiny mnohočetných lékových transportérů a významnou mírou přispívá k lékové rezistenci buněk [55]. Přítomnost tohoto transportéru je charakteristická pro tzv. side ‑ population buňky, jež disponují zvýšenou tumor iniciační kapacitou, schopností sebeobnovy a multipotence, tedy vlastnostmi typickými pro kmenové buňky [54]. Zvýšení senzitivity GSCs k chemoterapii způsobuje také inhibice miR ‑ 21. Tato miRNA se účastní regulace apoptózy skrze Bax (Bcl ‑ 2‑associated X protein) a Bcl ‑ 2 (B ‑ cell CLL/ lymphoma 2). Její inhibice způsobuje nárůst proapoptického Bax na úkor antiapoptického Bcl ‑ 2, což má za následek celkové zvýšení apoptózy GSCs. Zhang et al zjistili, že tento efekt se v kombinaci inhibice miR ‑ 21 a podání TMZ ještě znásobuje [56].
Závěr
Přestože je GBM nádorové onemocnění s velmi nízkou incidencí, jedná se o velmi agresivní malignitu do značné míry rezistentní ke konvenční terapii, a tedy s infaustní prognózou. Z tohoto důvodu je mu v poslední době vědeckými pracovníky věnována stále větší pozornost ve snaze objevit nové terapeutické přístupy umožňující překlenout zmiňovanou necitlivost k léčbě a prodloužit tak OS pacientů s tímto onemocněním. Nadějným terapeutickým cílem se zdají být GSCs, jež jsou pravděpodobně jednou z příčin biologicky nepříznivého chování tumoru. Jejich cílené ovlivnění prostřednictvím miRNA, přirozených regulátorů genové exprese, by pak mohlo vést k zvýšení senzitivity GBM k adjuvantní terapii, významnému prodloužení času do progrese onemocnění, a tedy i zlepšení celkové prognózy pacientů.
Práce byla podpořena grantovým projektem IGA MZ ČR NT13514-4/2012 a projektem „CEITEC – Středoevropský technologický institut“ (CZ.1.05/1.1.00/02.0068).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Mgr. Jiří Šána
Klinika komplexní onkologické péče
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: sana.jiri@gmail.com
Obdrženo: 12. 5. 2015
Přijato: 10. 9. 2015
Zdroje
1. Ohgaki H, Kleihues P. Population‑based studies on incidence, survival rates, and genetic alterations in astrocytic and oligodendroglial gliomas. J Neuropathol Exp Neurol 2005; 64(6): 479 – 489.
2. Fadrus P, Lakomý R, Hübnerová P et al. Intrakraniální nádory – diagnostika a terapie. Interni medicina pro praxi 2010; 12(7 – 8): 376 – 381.
3. Lakomý R, Fadrus, P, Slampa P et al. Multimodal treatment of glioblastoma multiforme: results of 86 consecutive patients diagnosed in period 2003 – 2009. Klin Onkol 2011; 24(2): 112 – 120.
4. Stopschinski BE, Beier CP, Beier D. Glioblastoma cancer stem cells – from concept to clinical application. Cancer Lett 2013; 338(1): 32 – 40. doi: 10.1016/ j.canlet.2012.05.033.
5. Lima FR, Kahn SA, Soletti RC et al. Glioblastoma: therapeutic challenges, what lies ahead. Biochim Biophys Acta 2012; 1826(2): 338 – 349. doi: 10.1016/ j.bbcan.2012.05.004.
6. Jansson MD, Lund AH. MicroRNA and cancer. Mol Oncol 2012; 6(6): 590 – 610. doi: 10.1016/ j.molonc.2012.09.006.
7. Liu C, Tang DG. MicroRNA regulation of cancer stem cells. Cancer Res 2011; 71(18): 5950 – 5954. doi: 10.1158/ 0008 ‑ 5472.CAN ‑ 11 ‑ 1035.
8. Furth J. Transmission of myeloid leukemia of mice: its relation to myeloma. J Exp Med 1935; 61(3): 423 – 446.
9. Kleinsmith LJ, Pierce GB Jr. Multipotentiality of Single Embryonal Carcinoma Cells. Cancer Res 1964; 24 : 1544 – 1551.
10. Lapidot T, Sirard C, Vormoor J et al. A cell initiating human acute myeloid leukaemia after transplantation into SCID mice. Nature 1994; 367(6464): 645 – 648.
11. Al ‑ Hajj M, Wicha MS, Benito ‑ Hernandez A et al. Prospective identification of tumorigenic breast cancer cells. Proc Natl Acad Sci USA 2003; 100(7): 3983 – 3988.
12. Singh SK, Clarke ID, Terasaki M et al. Identification of a cancer stem cell in human brain tumors. Cancer Res 2003; 63(18): 5821 – 5828.
13. Bongiorno MR, Doukaki S, Malleo F et al. Identification of progenitor cancer stem cell in lentigo maligna melanoma. Dermatol Ther 2008; 21 (Suppl 1): 1 – 5. doi: 10.1111/ j.1529 ‑ 8019.2008.00193.x.
14. O‘Brien CA, Pollett A, Gallinger S et al. A human colon cancer cell capable of initiating tumour growth in immunodeficient mice. Nature 2007; 445(7123): 106 – 110.
15. Singh SK, Hawkins C, Clarke ID et al. Identification of human brain tumour initiating cells. Nature 2004; 432(7015): 396 – 401.
16. Lobo NA, Shimono Y, Qian D et al. The biology of cancer stem cells. Annu Rev Cell Dev Biol 2007; 23 : 675 – 699.
17. Pardal R, Clarke MF, Morrison SJ. Applying the principles of stem ‑ cell biology to cancer. Nat Rev Cancer 2003; 3(12): 895 – 902.
18. Foreman KE, Rizzo OC, Miele L. The cancer stem cell hypothesis. In: Bagley RG (ed.). Stem cells and cancer. 1. vyd. New York: Springer 2009.
19. Arteaga CL. Inhibition of TGFbeta signaling in cancer therapy. Curr Opin Genet Dev 2006; 16(1): 30 – 37.
20. Coni S, Infante P, Gulino A. Control of stem cells and cancer stem cells by Hedgehog signaling: pharmacologic clues from pathway dissection. Biochem Pharmacol 2013; 85(5): 623 – 628. doi: 10.1016/ j.bcp.2012.11.001.
21. Abel EV, Kim EJ, Wu J et al. The notch pathway is important in maintaining the cancer stem cell population in pancreatic cancer. PLoS One 2014; 9(3). doi: 10.1371/ journal.pone.0091983.
22. Christensen J, Bentz S, Sengstag T et al. FOXQ1, a novel target of the Wnt pathway and a new marker for activation of Wnt signaling in solid tumors. PLoS One 2013; 8(3): e60051. doi: 10.1371/ journal.pone.0060051.
23. Lou H, Dean M. Targeted therapy for cancer stem cells: the patched pathway and ABC transporters. Oncogene 2007; 26(9): 1357 – 1360.
24. Reynolds BA, Weiss S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science 1992; 255(5052): 1707 – 1710.
25. Miraglia S, Godfrey W, Yin AH et al. A novel five ‑ transmembrane hematopoietic stem cell antigen: isolation, characterization, and molecular cloning. Blood 1997; 90(12): 5013 – 5021.
26. Wright MH, Calcagno AM, Salcido CD et al. Brca1 breast tumors contain distinct CD44+/ CD24 – and CD133+ cells with cancer stem cell characteristics. Breast Cancer Res 2008; 10(1): R10. doi: 10.1186/ bcr1855.
27. Son MJ, Woolard K, Nam DH et al. SSEA ‑ 1 is an enrichment marker for tumor ‑ initiating cells in human glioblastoma. Cell Stem Cell 2009; 4(5): 440 – 452. doi: 10.1016/ j.stem.2009.03.003.
28. Richichi C, Brescia P, Alberizzi V et al. Marker ‑ independent method for isolating slow ‑ dividing cancer stem cells in human glioblastoma. Neoplasia 2013; 15(7): 840 – 847.
29. Fukaya R, Ohta S, Yamaguchi M et al. Isolation of cancer stem‑like cells from a side population of a human glioblastoma cell line, SK ‑ MG ‑ 1. Cancer Lett 2010; 291(2): 150 – 157. doi: 10.1016/ j.canlet.2009.10.010.
30. Heddleston JM, Li Z, Lathia JD et al. Hypoxia inducible factors in cancer stem cells. Br J Cancer 2010; 102(5): 789 – 795. doi: 10.1038/ sj.bjc.6605551.
31. Heddleston JM, Li Z, McLendon RE et al. The hypoxic microenvironment maintains glioblastoma stem cells and promotes reprogramming towards a cancer stem cell phenotype. Cell Cycle 2009; 8(20): 3274 – 3284.
32. Friedman RC, Farh KK, Burge CB et al. Most mammalian mRNAs are conserved targets of microRNAs. Genome Res 2009; 19(1): 92 – 105. doi: 10.1101/ gr.082701.108.
33. Lim LP, Lau NC, Garrett ‑ Engele P et al. Microarray analysis shows that some microRNAs downregulate large numbers of target mRNAs. Nature 2005; 433(7027): 769 – 773.
34. Lang MF, Yang S, Zhao C et al. Genome ‑ wide profiling identified a set of miRNAs that are differentially expressed in glioblastoma stem cells and normal neural stem cells. PLoS One 2012; 7(4): e36248. doi: 10.1371/ journal.pone.0036248.
35. Kamal M, Shaaban AM, Zhang L et al. Loss of CSMD1 expression is associated with high tumour grade and poor survival in invasive ductal breast carcinoma. Breast Cancer Res Treat 2010; 121(3): 555 – 563. doi: 10.1007/ s10549 ‑ 009 ‑ 0500 ‑ 4.
36. Sakaki ‑ Yumoto M, Katsuno Y, Derynck R. TGF‑β family signaling in stem cells. Biochim Biophys Acta 2013; 1830(2): 2280 – 2296. doi: 10.1016/ j.bbagen.2012.08.008.
37. Tang MR, Wang YX, Guo S et al. CSMD1 exhibits antitumor activity in A375 melanoma cells through activation of the Smad pathway. Apoptosis 2012; 17(9): 927 – 937. doi: 10.1007/ s10495 ‑ 012 ‑ 0727 ‑ 0.
38. Guessous F, Alvarado ‑ Velez M, Marcinkiewicz L et al. Oncogenic effects of miR ‑ 10b in glioblastoma stem cells. J Neurooncol 2013; 112(2): 153 – 163. doi: 10.1007/ s11060 ‑ 013 ‑ 1047 ‑ 0.
39. Visvanathan J, Lee S, Lee B et al. The microRNA miR ‑ 124 antagonizes the anti‑neural REST/ SCP1 pathway during embryonic CNS development. Genes Dev 2007; 21(7): 744 – 749.
40. Conti L, Crisafulli L, Caldera V et al. REST controls self ‑ renewal and tumorigenic competence of human glioblastoma cells. PLoS One 2012; 7(6). doi: 10.1371/ journal.pone.0038486.
41. Silber J, Lim DA, Petritsch C et al. miR ‑ 124 and miR ‑ 137 inhibit proliferation of glioblastoma multiforme cells and induce differentiation of brain tumor stem cells. BMC Med 2008; 6 : 14. doi: 10.1186/ 1741 ‑ 7015 ‑ 6 ‑ 14.
42. Bier A, Giladi N, Kronfeld N et al. MicroRNA ‑ 137 is downregulated in glioblastoma and inhibits the stemness of glioma stem cells by targeting RTVP ‑ 1. Oncotarget 2013; 4(5): 665 – 676.
43. Fareh M, Turchi L, Virolle V et al. The miR 302 - 367 cluster drastically affects self ‑ renewal and infiltration properties of glioma ‑ initiating cells through CXCR4 repression and consequent disruption of the SHH ‑ GLI ‑ NANOG network. Cell Death Differ 2012; 19(2): 232 – 244. doi: 10.1038/ cdd.2011.89.
44. Jackson EL, Garcia ‑ Verdugo JM, Gil ‑ Perotin S et al. PDGFR alpha ‑ positive B cells are neural stem cells in the adult SVZ that form glioma‑like growths in response to increased PDGF signaling. Neuron 2006; 51(2): 187 – 199.
45. Boockvar JA, Kapitonov D, Kapoor G et al. Constitutive EGFR signaling confers a motile phenotype to neural stem cells. Mol Cell Neurosci 2003; 24(4): 1116 – 1130.
46. Papagiannakopoulos T, Friedmann‑Morvinski D, Neveu P et al. Pro‑neural miR ‑ 128 is a glioma tumor suppressor that targets mitogenic kinases. Oncogene 2012; 31(15): 1884 – 1895. doi: 10.1038/ onc.2011.380.
47. Aldaz B, Sagardoy A, Nogueira L et al. Involvement of miRNAs in the differentiation of human glioblastoma multiforme stem‑like cells. PLoS One 2013; 8(10): e77098. doi: 10.1371/ journal.pone.0077098.
48. Li W, Guo F, Wang P et al. miR ‑ 221/ 222 confers radioresistance in glioblastoma cells through activating Akt independent of PTEN status. Curr Mol Med 2014; 14(1): 185 – 195.
49. Schramedei K, Morbt N, Pfeifer G et al. MicroRNA ‑ 21 targets tumor suppressor genes ANP32A and SMARCA4. Oncogene 2011; 30(26): 2975 – 2985. doi: 10.1038/ onc.2011.15.
50. Schraivogel D, Weinmann L, Beier D et al. CAMTA1 is a novel tumour suppressor regulated by miR ‑ 9/ 9* in glioblastoma stem cells. Embo J 2011; 30(20): 4309 – 4322. doi: 10.1038/ emboj.2011.301.
51. Wu N, Xiao L, Zhao X et al. miR ‑ 125b regulates the proliferation of glioblastoma stem cells by targeting E2F2. FEBS Lett 2012; 586(21): 3831 – 3839. doi: 10.1016/ j.febslet.2012.08.023.
52. Ernst A, Campos B, Meier J et al. De ‑ repression of CTGF via the miR ‑ 17 - 92 cluster upon differentiation of human glioblastoma spheroid cultures. Oncogene 2010; 29(23): 3411 – 3422. doi: 10.1038/ onc.2010.83.
53. Asuthkar S, Velpula KK, Chetty C et al. Epigenetic regulation of miRNA ‑ 211 by MMP ‑ 9 governs glioma cell apoptosis, chemosensitivity and radiosensitivity. Oncotarget 2012; 3(11): 1439 – 1454.
54. Li WQ, Li YM, Tao BB et al. Downregulation of ABCG2 expression in glioblastoma cancer stem cells with miRNA ‑ 328 may decrease their chemoresistance. Med Sci Monit 2010; 16(10): HY27–HY 30.
55. Pan YZ, Morris ME, Yu AM. MicroRNA ‑ 328 negatively regulates the expression of breast cancer resistance protein (BCRP/ ABCG2) in human cancer cells. Mol Pharmacol 2009; 75(6): 1374 – 1379. doi: 10.1124/ mol.108.054163.
56. Zhang S, Wan Y, Pan T et al. MicroRNA ‑ 21 inhibitor sensitizes human glioblastoma U251 stem cells to chemotherapeutic drug temozolomide. J Mol Neurosci 2012; 47(2): 346 – 356. doi: 10.1007/s12031 ‑ 012 ‑ 9759 ‑ 8.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2015 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Plicní tumory
- Kombinace systematických terapií s radiací u nemalobuněčného karcinomu plic
- Metody hodnocení kvality života u žen s karcinomem prsu – přehled a základní charakteristika
- Význam mikroRNA u glioblastomových kmenových buněk
- Chirurgická liečba pľúcnych metastáz kolorektálneho karcinómu – prežívanie a prognostické faktory
- Použití prognostických indexů pro pacienty s mozkovými metastázami v denní radioterapeutické praxi – je jejich složitý výpočet ještě stále problém?
- Vyšetření párů těžkých/ lehkých řetězců imunoglobulinu (Hevylite™ assay) – přínos pro stratifikaci mnohočetného myelomu?
- Zákaz řízení – nový vedlejší účinek chemoterapie
- SOUTĚŽ NA PODPORU AUTORSKÝCH TÝMŮ PUBLIKUJÍCÍCH V ZAHRANIČNÍCH ODBORNÝCH TITULECH
-
Domácí parenterální výživa v onkologii
Díl 5 – Domácí parenterální výživa může umožnit kvalitní život - Aktuality z odborného tisku
- 100 let od narození prof. MU Dr. Jaroslava Švejdy, DrSc.
- Prof. MUDr. Jindřich Macháček, CSc., osmdesátiletý
-
Onkologie v obrazech
Radioterapie pokročilých kožních nádorů - Informace z České onkologické společnosti
- SOUTĚŽ O NEJLEPŠÍ PRÁCI
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Metody hodnocení kvality života u žen s karcinomem prsu – přehled a základní charakteristika
- Plicní tumory
- Chirurgická liečba pľúcnych metastáz kolorektálneho karcinómu – prežívanie a prognostické faktory
- Prof. MUDr. Jindřich Macháček, CSc., osmdesátiletý
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



