-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Imunoterapie uroteliálního karcinomu močového měchýře – od BCG vakcín k cílené imunoterapii
Immunotherapy of Urothelial Carcinoma of the Bladder – from BCG Vaccines to Targeted Therapy
Bladder cancer has high prevalence in men and women. Bladder cancer usually originates from urothelium. More than 75% of cases are classified as non‑muscle ‑ invasive bladder cancer. Urothelial bladder carcinoma is usually managed by transurethral resection of the bladder tumor. Role of transurethral resection of the bladder tumor is also essential in bladder cancer staging. Local prophylaxis is used in non‑muscle ‑ invasive bladder cancer to reduce risk of recurrence. While local chemoprophylaxis is sufficient in low and middle risk patients, intravesical instillation of Mycobacterium bovis bacillus Calmette‑Guerin (BCG) is preferred in high risk bladder cancer. Chemotherapy alone or in combination with locoregional treatment is used in advanced bladder cancer. New immunotherapy modalities have proven their efficacy in several clinical studies in advanced bladder cancer.
Key words:
urothelial bladder cancer – immunotherapy – BCG vaccine – checkpoint inhibitor
The author declares she has no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.Submitted:
3. 9. 2015Accepted:
23. 10. 2015
Autoři: M. Matoušková
Působiště autorů: Urocentrum Praha
Vyšlo v časopise: Klin Onkol 2015; 28(Supplementum 4): 95-102
Kategorie: Speciální část
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amko20154S95Souhrn
Zhoubné nádory močového měchýře postihují muže i ženy s vysokou prevalencí. Obvykle vycházejí z urotelu a více než 3/ 4 z nich bývají neinvazivní nádory močového měchýře. Základní léčebnou modalitu představuje transuretrální resekce tumoru. Její role je nezastupitelná při léčbě, ale i při stagingu nádorů močového měchýře. I u neinvazivních nádorů je standardem pokračovat lokální profylaxí s cílem snížení pravděpodobnosti rizika recidivy. Zatímco u nemocných s nízkým či středním rizikem bývá dostatečná lokální chemoprofylaxe, u vysoce rizikových neinvazivních nádorů preferujeme podání lokální imunoterapie pomocí Mycobacterium bovis bacillus Calmette‑Guerin (BCG) vakcíny. U pokročilých nádorů spočívá farmakologické ovlivnění v chemoterapii samostatně nebo v kombinaci s lokoregionální léčbou. Výsledky klinických studií dokládají účinnost nových přípravků z oblasti imunoterapie i pro pokročilé nádory močového měchýře.
Klíčová slova:
nádory močového měchýře – imunoterapie – BCG vakcína – kontrolní body imunitní reakceÚvod
Zhoubné nádory močového měchýře jsou 11. nejčastější malignitou na světě [1].ČR se nachází na 5. místě s incidencí 25,5/ 100 000 obyvatel, mezi ženami pak na 3. místě. Incidence je přibližně čtyřnásobně vyšší u mužů než u žen. V mortalitě patří nádorům močového měchýře 14. místo ve světovém měřítku. ČR je pak na 19. místě [1]. V incidenci i mortalitě v Evropě vede Španělsko. V roce 2012 bylo diagnostikováno více než 130 000 nádorů močového měchýře ve světě, z toho 2 210 v ČR a přibližně 34 000 pacientů na nádor zemřelo [2,3].
Uroteliální karcinomy nacházíme ve více než 90 % všech nádorů močového měchýře. Přibližně 70 % z nich nepřechází vrstvu muscularis propria, tyto nádory jsou označovány jako neinvazivní nádory močového měchýře (non-muscle invasive bladder cancer – NMIBC), před lety jsme také hovořili o „povrchových nádorech měchýře“. Mezi NMIBC jsou zastoupeny kategorie Ta (70 %), T1 (20 %) a Tis (10 %). Standardní primární léčbou je stratifikovaná transuretrální resekce tumoru (transurethral resection of bladder – TURB). Kromě vlastního terapeutického výkonu je náležité provedení nezbytné i pro nádorový staging. Přes náležitě provedenou TURB je vysoké riziko recidiv (až 70 %), ale i vysoké riziko progrese (až 30 %) do invazivních forem [4]. Z hlediska rizika recidivy a progrese jsou tumory rozděleny do skupin s nízkým, středním a vysokým rizikem (tab. 1, 2). Pro výpočet se používá nejčastěji skórovací kalkulačka EORTC, dostupná na http:/ / www.eortc.be/ tools/ bladdercalculator/ . Podle míry rizika je postupováno při adjuvatní léčbě. U pacientů s nízce rizikovými tumory jsou dostatečné endoskopické kontroly. U pacientů se středně rizikovými tumory je indikována další intravezikální chemoterapie nebo intravezikální imunoterapie Mycobacterium bovis bacillus Calmette‑Guerin (BCG) vakcínou. U pacientů s vysoce rizikovými tumory je optimální podání intravezikální imunoterapie BCG vakcínou a v případě selhání léčby BCG vakcínou nebo její nedostupnosti může být navržena cystektomie [5].
Tab. 1. Riziko recidivy neinvazivních nádorů močového měchýře podle EORTC [4]. ![Riziko recidivy neinvazivních nádorů močového měchýře podle EORTC [4].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/4038187181572f93ea1b03e9a5dc28a2.png)
LR – nádory s nízkým rizikem, MR – středně rizikové nádory, HR – nádory s vysokým rizikem Tab. 2. Riziko progrese neinvazivních nádorů močového měchýře podle EORTC [4]. ![Riziko progrese neinvazivních nádorů močového měchýře podle EORTC [4].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/8eadde2a72073f09bba3919318ef5b42.png)
LR – nádory s nízkým rizikem, MR – středně rizikové nádory, HR – nádory s vysokým rizikem Intravezikální léčba
Hledání cest, jak oddálit recidivu a progresi, vedlo k využití intravezikální léčby. Intravezikální profylaxe ke snížení recidiv začala být používána v 60. letech minulého století. Z cytotoxických látek jsou do dnešní doby v Evropě používány mitomycin C a farmorubicin, v USA ještě thiotepa. Z roku 1976 pochází první práce Moralese et al [6] s využitím BCG vakcíny u neinvazivních nádorů močového měchýře. Tato léčba se stala standardem v adjuvantní léčbě NMIBC. Při srovnání s cytotoxickými přípravky se zdá být účinnější v redukci recidiv, ale především ve snížení rizika progrese [7 – 9]. Při podání BCG vakcíny předpokládáme odpověď u 55 – 65 % papilárních nádorů a až 70 – 75 % karcinoma in situ (CIS), naopak u 30 – 45 % pacientů s NMIBC můžeme očekávat selhání BCG [7,10,11]. Přes kompletní odpověď je možné očekávat recidivu ve více než 50 % [8].
Instilace BCG vakcínou preferujeme u nemocných s vysokým rizikem recidivy a progrese a u nemocných s karcinoma in situ. U nízko a středně rizikových tumorů upřednostňujeme spíše podání lokální chemoprofylaxe. Optimální léčebný režim při intravezikální imunoprofylaxi není stále jednoznačně určen. V současné době zahajujeme podání v indukčním režimu, který zahrnuje podání šesti dávek BCG vakcíny. Na indukční režim navazuje udržovací léčba v rozsahu 1 – 3 let. Od roku 2012 došlo k celosvětovému výpadku ve výrobě BCG vakcíny. Nedostatek vedl k alternativním řešením u NMIBC a podání BCG vakcíny výhradně v indukčním režimu. Podle dostupných informací se zdá, že výroba je obnovována a BCG vakcína bude znovu k dispozici nemocným s NMIBC.
Intravezikální léčba je spojena s celou řadou nežádoucích účinků. V současnosti podávaná cytostatika mají velkou molekulovou hmotnost a prakticky se nevstřebávají do cévního řečiště. Jejich nejčastějšími vedlejšími účinky jsou chemická cystitida a iritační příznaky s ní spojené. Při aplikaci BCG je nutné počítat nejen s lokálními příznaky (hematurie, chemická cystitida, svraštělý měchýř, obstrukce ureterů), ale i lokoregionálními (epididymitis, prostatitis, absces ledviny, pánevní lymfadenitida) a systémovými život ohrožujícími stavy. Systémové reakce zahrnují febrilní stavy, flu‑like syndrom, alergické reakce, septické stavy, artralgie, cytopenie, BCG-itis či BCG hepatitis. Více než 20 % pacientů netoleruje podání BCG pro její nežádoucí účinky [9].
Pochopení mechanizmu účinku BCG (obr. 1), přestože není ještě zcela vyčerpávajícím způsobem popsán, a jeho jasných limitací je rozhodující pro zlepšení účinnosti léčby. Po instilaci BCG dochází k vazbě BCG k fibronektinu exprimovaného urotelem. Tak se mykobakterie stávají součástí normálních i nádorově změněných buněk. Důsledkem je aktivace urotelu s následnou zánětlivou reakcí močového měchýře [12]. Na povrchu uroteliálních buněk a antigen prezentujících buněk (antigen presenting cell – APC) je přítomný BCG antigen jako součást hlavního histokompatibilního komplexu (major histokompatibility complex – MHC) II. třídy, stimulující CD4+ T lymfocyty a indukující především T helper 1 (Th1) imunitní odpověď [13]. Tento komplex a robustní imunitní reakce navozená BCG dokazuje masivní krátkodobá sekrece cytokinů v moči, včetně interleukinů (IL) - 1, IL‑2, IL‑5, IL‑6, IL‑8, IL‑10, IL‑12, IL‑15, IL‑18, interferon ‑ inducible protein (IP) 10, tumor necrosis factor α (TNF α), granulocyte ‑ monocyte colony stimulating factor (GM CSF) a interferon γ (IFN - γ) [14]. Ačkoliv úloha každého z cytokinů hrajících nějakou roli v léčbě uroteliálních nádorů není zcela jasná, je zřejmé, že Th1 cytokiny (např. IFN-γ, IL‑2 a IL‑12) jsou spojeny s BCG odpovědí, naopak Th2 cytokiny (např. IL‑10 a IL‑6) korelují se selháním BCG [15]. Do příchodu BCG léčby nebyla k dispozici data podporující udržovací režimy spočívající v sérii krátkodobé reindukční léčby ve třech měsíčních intervalech, tak jak je doporučována SWOG (Southwest Oncology Group) [16].
Obr. 1. Mechanizmus účinku BCG vakcíny. 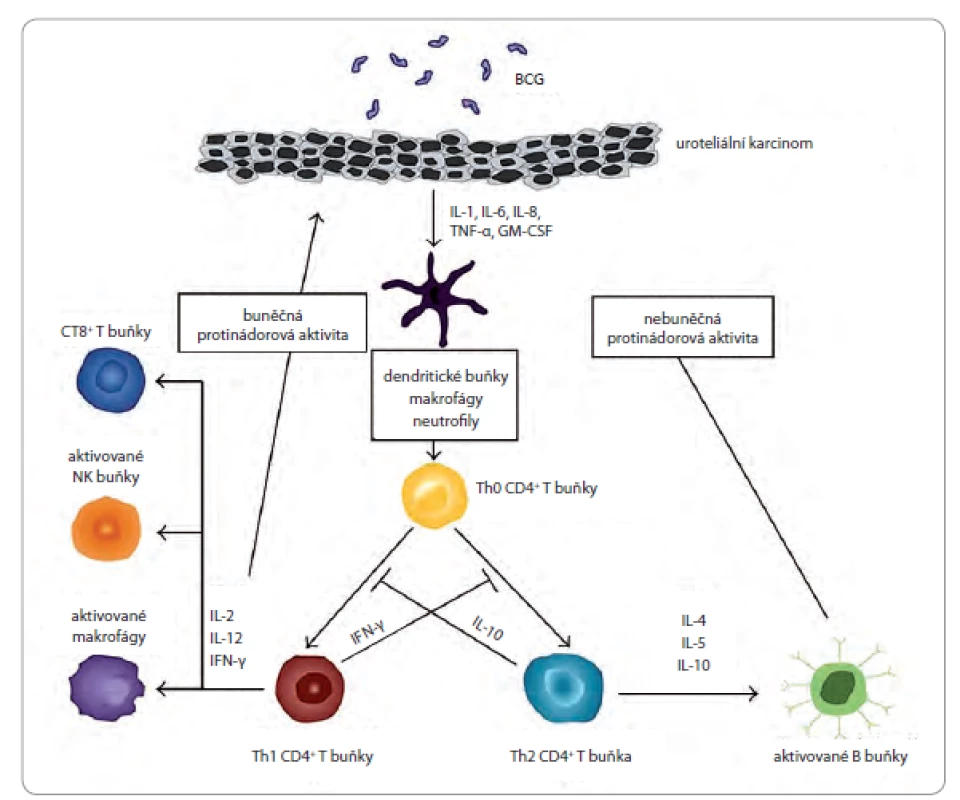
Další možností je použití interferonu α2b. Interferony jsou glykoproteiny izolované v 50. letech minulého století, ceněné pro své antivirové vlastnosti. Postupně byly izolovány tři typy IFN ‑ α (současně je celou skupinou interferonů), IFN ‑ β a IFN ‑ γ. IFN ‑ α a IFN ‑ β jsou sdruženy jako typ I interferonů, naopak IFN ‑ γ jako typ II. Receptor typ I IFN má dvě součásti, IFNAR ‑ I a IFNAR ‑ II, které postupně vážou a fosforylují JAK molekuly spouštěcí kaskádu vedoucí k transkripci [17]. Rodina IFN ‑ α vede ke stimulaci NK buněk, navozuje odpověď MHC třídy I a zvyšuje rozpoznání protilátek [18]. Protinádorové vlastnosti umožňuje přímý antiproliferační efekt a komplexní imunomodulační efekt [17]. Oba mohou být s výhodou uplatněny v léčbě nádorů močového měchýře. Dostupné v klinické praxi jsou IFN ‑ α2a a IFN ‑ α2b, více dat je k dispozici o IFN ‑ α2b, ať již samostatně, nebo v kombinaci s BCG, kde je popsáno synergní působení. Efekt BCG závisí na indukci objemu Th1 cytokinového profilu a IFN ‑ α2b může potencovat Th1 imunitní odpověď [14]. Ačkoliv teoreticky je kombinace slibná, v klinické praxi jsou výstupy smíšené.
Po dlouhá léta byl uplatňován u IFN ‑ α především jeho antiproliferativní efekt. V menší míře navodí přímo apoptózu nádorových buněk. IFN ‑ α nezávisle indukuje TNF‑related apoptosis ‑ inducing ligand (TRAIL) expresí UM ‑ UC ‑ 12 uroteliálních nádorových buněk [18,19], která následně spouští apoptózu buněk s expresí příslušného receptoru. K buněčné smrti dochází v důsledku Fas‑associated protein s FADD (death ‑ domain) závislé na aktivaci DISC (death inducing signaling complex) a následnou aktivací kaspázy ‑ 8. IFN ‑ α může stimulovat TARIL mRNA a aktivovat aktivní TRAIL protein neutrofilů a monocytů, tím indikuje apoptotickou aktivitu proti TRAIL senzitivním leukemickým buněčným liniím [18]. Apoptotický účinek IFN ‑ α však není omezen pouze na TRAIL, spíše ovlivňuje kaspázu ‑ 8 jednak cestou závislou na receptoru pro buněčnou smrt, ale i cestou nezávislou. BCG, podobně jako IFN ‑ α, prokázal, že indukuje TRAIL, a to koreluje s odpovědí pacientů na léčbu BCG. Zároveň to vyvolalo zájem o společný výzkum. Dalším přímým efektem IFN ‑ α je zvýšení cytotoxicity CD4+ T lymfocytů a zvýšení rozpoznání antigenů zvýšenou expresí MHC třídy I [19 – 21]. Rovněž bylo popsáno přímé potlačení proliferace indukcí tumor supresorových genů a inhibicí nádorových onkogenů [19,22]. Bylo popsáno i významné snížení angiogeneze v lidském urotelu při a po léčbě IFN ‑ α2b, která následovala po transuretrální resekci povrchových nádorů močového měchýře [23].
Využití monoterapie IFN ‑ α2b v léčbě karcinomu močového měchýře bylo studováno několika skupinami. Glashan publikoval v roce 1990 data z randomizované kontrolované studie zkoumající režimy IFN ‑ α2b s vysokou (100 × 106 IU) a nízkou dávkou (10 × 106 IU) u pacientů s CIS [24]. Pacienti byli léčeni jednou týdně po dobu 12 týdnů a následně jednou měsíčně po dobu jednoho roku. Úplná odpověď byla sledována u 43 % pacientů ve skupině s vysokou dávkou a u 5 % pacientů ve skupině s nízkou dávkou. U pacientů ve skupině s vysokou dávkou, kteří dosáhli úplné odpovědi, bylo 90 % pacientů bez známek onemocnění po pouhých šesti měsících sledování. Hlavními nežádoucími účinky byl flu‑like syndrom (8 % u nízké dávky a 17 % u vysoké dávky). Nevyskytovaly se ale iritační symptomy, které jsou často sledovány u léčby BCG. Když byli IFN ‑ α2b léčeni pacienti po selhání BCG léčby, u 8 z 12 pacientů došlo k rekurenci onemocnění po třech měsících sledování a pouze 1 z 12 pacientů byl bez známek onemocnění po 24 měsících [25]. Jak bylo již výše popsáno, antiproliferační a imunomodulační efekt IFN ‑ α se nabízel pro kombinaci s BCG léčbou. Klinické využití kombinace IFN ‑ α2b a BCG bylo zpočátku zkoumáno u BCG refraktorních pacientů a následně i u BCG naivních pacientů [26 – 30].
Jinou možností je podání interleukinu 2 (IL‑2), jehož objev a popis byl jedním ze zásadních objevů na poli imunologie. Před jeho objevením existovalo přesvědčení, že lymfocyty jsou diferencovány a nejsou schopny další proliferace [31,32]. Od objevu faktu, že IL‑2 zprostředkovává kontrolu růstu T lymfocytů v buněčných kulturách, byly dále odhaleny podrobnosti mechanizmu jejich fungování. Relativně časně byl uskutečněn objev, že IL‑2 zvyšuje produkci cytotoxických lymfocytů, které jsou schopny navodit lýzu nádorových buněk, zatímco ušetří zdravé buňky. Tyto IL‑2 aktivované lymfocyty dostaly označení „lymphokine‑activated killer” (LAK) a vědci se domnívali, že hrají velkou roli v protinádorové imunitní reakci [33]. Dále bylo zjištěno, že IL‑2 posiluje cytotoxickou aktivitu NK buněk a monocytů [34]. Dokonce bylo zjištěno, že IL‑2 je důležitým faktorem pro aktivaci B lymfocytů [35]. Když byly popsány cytokinové profily CD4+ Th1 a Th2 lymfocytů, bylo zjevné, že IL‑2 je cytokinem produkovaným převážně Th1 lymfocyty [36]. Právě cytotoxické protinádorové vlastnosti lymfocytů indukované IL‑2 udělaly z IL‑2 vhodnou látku pro imunologické ovlivnění nádorových onemocnění.
Zájem o využití IL‑2 u karcinomu močového měchýře stoupl poté, co několik badatelů odhalilo zvýšené hladiny IL‑2 (spolu s ostatními cytokiny) v moči pacientů léčených BCG, což naznačovalo imunomodulační účinek BCG [37]. Také bylo zdokumentováno zvýšení exprese receptoru pro IL‑2 na T lymfocytech v moči u pacientů léčených BCG [38]. Zvýšené hladiny IL‑2 v moči rovněž korelují s odpovědí na léčbu BCG. To podporuje domněnku, že Th1 cytokinový profil může souviset s příznivou odpovědí na BCG [14]. Dále také zvýšené hladiny IL‑2 pozorované u pacientů s instilovaným BCG naznačují lokální a i systémovou imunitní odpověď na léčbu [39]. Výše popsané nálezy vedly k závěru, že IL‑2 by se dal léčebně využít u karcinomu močového měchýře. Nicméně nepříznivý bezpečnostní profil systémově podávaného IL‑2 vedl k jeho využití pouze jako léčby intravezikální. Zprávy o intravezikálním použití IL‑2 odhalují významně příznivější bezpečnostní profil a prokazují i jistou míru účinnosti buď v monoterapii, či v kombinaci s BCG [40 – 43]. Den Otter et al podávali samotný IL‑2 intravezikálně po nekompletní transuretrální resekci T1 papilárního uroteliálního karcinomu, grade I – II a prokázali regresi lézí u 8 z 10 pacientů [44]. Další výzkumy se zaměřily na vývoj rekombinantního kmene BCG, který by produkoval IL‑2 [45,46]. Zvířecí modely, které tento postup využily, ukázaly, že kmeny BCG produkující IL‑2 v porovnání s normálními kmeny BCG zvýšily produkci IFN ‑ γ, vedly k příznivějšímu poměru IFN ‑ γ vůči IL‑4, vylepšily antigenspecifickou proliferaci, zvýšily protinádorovou cytotoxicitu a vedly k Th1 cytokinovému profilu i u imunosuprimovaných či IL‑4 transgenních myší (to jsou dvě podmínky, jež favorizují Th2 odpověď) [45,47]. Vzhledem k tomu, že IL‑2 hraje zásadní roli v Th1 odpovědi, dozajista zůstane v oblasti zájmu pro imunoterapii karcinomu močového měchýře.
Nemalé naděje jsou vkládány i do IL‑10 a IL‑12. Další studie potvrzující účinnost jsou ale nezbytné. Nicméně již nyní se ukazuje velký potenciál monoklonální protilátky proti IL‑10R1 (anti‑IL‑10R1 mAb), která nejenže vykazuje místní kontrolu onemocnění, ale potenciálně může navodit systémovou imunomodulaci pro prevenci metastatického karcinomu měchýře.
Systémová léčba
Na rozdíl od neinvazivních nádorů, kde je podání BCG vakcíny již dlouho považováno za standardní postup, u pokročilých nádorů možnosti imunoterapie teprve hledají své místo. Do současné doby nebyla BCG vakcína jinou látkou překonána, ať se to týká schopnosti snížit riziko rekurence onemocnění, či progrese. Naopak limitujícím faktorem BCG vakcíny je bezpečnostní profil a možnost výskytu závažné toxicity. Navíc stále existuje skupina pacientů (kolem 30 %), kteří na léčbu BCG nezareagují a dojde u nich k progresi onemocnění v invazivní formu zasahující do detruzoru.
Diskutuje se o využití genové léčby, toll‑like receptorů a agonistů, virové léčby, terapeutických vakcín, různých cytokinů či monoklonálních protilátek proti kontrolním bodům imunitní reakce (checkpoint inhibitors).
Léčba onkolytickými viry využívá modifikované viry, které způsobí sebedestrukci nádorových buněk a tak navodí vyšší imunitní odpověď právě proti nádoru. Jedním z příkladů je např. CG0070, což je onkolytický adenovirus, který rovněž exprimuje imunitní odpověď stimulující cytokin GM‑CSF. Ten dále zvyšuje protinádorovou imunitní reakci. V současné době probíhá studie fáze I/ II, která zkoumá intravezikální podání CG0070 u pacientů s CIS močového měchýře či pacientů s NMIBC s CIS měchýře, u kterých selhala léčba BCG (NCT01438112).
Využití terapeutických vakcín je stáleve stadiu výzkumu. Tyto vakcíny jsou navrženy tak, aby vybudily imunitní odpověď organizmu proti nádorově specifickým antigenům či s nádorem spojovanými antigeny. Tím dojde k posílení útoku na nádorové buňky nesoucí tyto antigeny. V současné době běží několik studií, které aktivně nabírají pacienty. Jednou z terapeutických vakcín je HS ‑ 410, vakcína vyrobená z buněčných linií lidského karcinomu močového měchýře, které byly ozářeny a změněny tak, aby exprimovaly rozpustný gp96, to je chaperon, který předkládá více nádorových antigenů imunitnímu systému a tím podporuje imunitní odpověď. Další vakcínou ve fázi časného klinického výzkumu je např. DEC ‑ 205 - NY ‑ ESO ‑ 1. Tato vakcína může pomoci vytvořit imunitní odpověď proti nádorovým buňkám, které exprimují testikulární nádorový antigen (cancer ‑ testis antigen) NY ‑ ESO ‑ 1.
Cytokiny jsou molekuly, které pomáhají kontrolovat růst a aktivitu buněk zapojených v systémové imunitní odpovědi. Jejich kombinace s monoklonálními protilátkami, tedy molekulami, které působí na specifický antigen nádoru, může zvýšit aktivitu imunitního systému. Jedním z příkladů je ALT ‑ 801 – fúzní produkt IL‑2 a protilátky rozpoznávající peptidy na povrchu nádorové buňky. Dvě studie fáze I/ II zkoušejí ALT ‑ 801 v kombinaci s gemcitabinem u pacientů NMIBC, u nichž selhala léčba BCG (NCT01625260), a v kombinaci s gemcitabinem a cisplatinou u pacientů s nádorem močového měchýře prorůstajícím do svaloviny (NCT01326871).
Asi nejblíže klinickému využití, díky úspěchům v jiných terapeutických oblastech, jsou monoklonální protilátky proti kontrolním bodům imunitní reakce. Plejáda genetických a epigenetických změn, která provází rozvoj nádorů, vytváří různorodou sadu antigenů, které imunitní systém využívá při rozpoznávání nádorových buněk od jejich normálních protějšků. V případě T lymfocytů je síla odpovědi, jež je spuštěna rozpoznáním antigenu receptorem T lymfocytů (T-cell receptor – TCR), a její kvalita závislá na rovnováze mezi kostimulačními a inhibičními signály, tj. kontrolními body imunitní reakce. V normálních podmínkách jsou tyto kontrolní body zásadní pro udržení imunitní odpovědi pod kontrolou, aby nepoškodila vlastní zdravé buňky. Kontrolní body jsou tedy zásadní v rozvoji autoimunity. Nádorové buňky naopak disponují řadou mechanizmů, díky kterým dokážou uniknout kontrole imunitního systému (obr. 2). Sníženou produkcí kostimulačních molekul dochází k anergii T lymfocytů. Dalším výsledkem změny v apoptotické signální dráze je také inhibice indukce apoptózy. Naopak vyšší expresí inhibičních molekul, jako jsou CTLA ‑ 4 (cytotoxic T‑lymphocyte‑associated antigen-4) nebo PD-1 (membránový protein programované buněčné smrti, programmed cell death ‑ 1) na T lymfocytech, vede k útlumu aktivace T lymfocytů a jejich anergizaci, což je právě přirozený mechanizmus předcházející autoimunitnímu onemocnění.
Obr. 2. Mechanizmy úniku buněk před kontrolou imunitního systému. 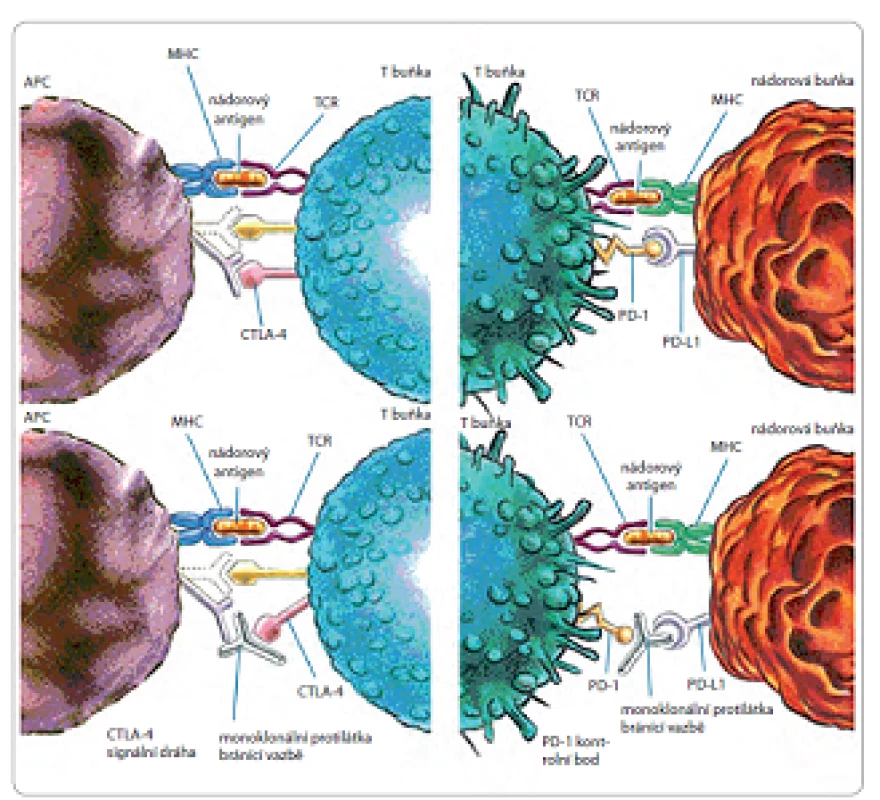
APC – antigen prezentující buňka, MHC – major histocompatibility complex, TCR – T buněčný recptor V současné době jsou do praxe uváděny monoklonální protilátky proti inhibičním molekulám CTLA ‑ 4, PD-1 a PD ‑ L1 (programmed cell death ligand 1). CTLA ‑ 4 je receptor na povrchu T lymfocytu. Pokud dojde k vazbě ligandu (CD80 nebo CD86) na CTLA ‑ 4 receptor při vazbě antigen prezentující buňky, dochází k potlačení imunitní reakce organizmu (downregulace). Protilátky, které brání vazbě ligandu na CTLA ‑ 4 receptor, tedy brání zastavení protinádorové imunitní odpovědi. Dalšími molekulami, které umíme ovlivnit, jsou PD-1 a PD ‑ L1. Signální dráha přes kontrolní bod PD-1 slouží jako jistá záložní dráha pro dráhu prostřednictvím CTLA ‑ 4. Pokud dojde k vazbě receptoru PD-1 se svým ligandem (např. PD ‑ L1), dojde rovněž k omezení imunitní odpovědi. Protilátky proti PD-1 tedy brání vazbě ligandu na tento receptor a tím zachovávají funkční protinádorovou imunitní odpověď prostřednictvím T lymfocytů. Nádorové buňky jsou také schopny vytvořit právě inhibiční molekuly PD ‑ L1 a PD ‑ L2. Protilátky proti těmto inhibičním molekulám tedy zabrání jejich vazbě na PD-1, a tím opět zachovávají funkční protinádorovou imunitní odpověď [48,49].
Následující protilátky jsou v současné době uvedeny na trh v různých indikacích či jsou blízko ke schválení. U všech probíhají i studie v léčbě karcinomu močového měchýře (tab. 3) [50].
Tab. 3. Přehled klinických studií s imunimunoterapií v léčbě zhoubných nádorů močového měchýře (podle [50]). ![Přehled klinických studií s imunimunoterapií v léčbě zhoubných nádorů močového měchýře (podle [50]).](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/1a9bc3a35ff5ada5564e78c735de0aaf.png)
BCG – bacillus Calmette-Guerin, PD-1 – programed death-1, PD-L1 – programed death-ligand-1, HSP – heat shock protein, CAR – chimérický antigenní receptor, CTLA-4 – cytotoxický T lymfocytární antigen-4, NMIBC – neinvazivní nádor močového měchýře, mBC – metastatického karcinomu prsu, TCR – T buněčný receptor, DC – dendritická buňka Atezolizumab (MPDL3280A, Roche/ /Genentech) byl testován ve studii fáze I u pacientů s dříve léčeným metastatickým karcinomem močového měchýře (NCT01375842). Výsledky z této studie jsou slibné, když 43 % pacientů s PD ‑ L1 IHC 2/ 3 dosáhlo objektivní odpovědi a u pacientů, kteří dosáhli odpovědi, byl přínos z léčby delší [51]. Další studie fáze II nedávno začala nabírat pacienty (NCT02108652). Atezolizumabu byl v červnu 2014 udělen „Breakthrough Therapy” status americkým lékovým úřadem (FDA).
Nivolumab (Opdivo, BMS) je protilátka proti PD-1 a ipilimumab (Yervoy®, BMS) je protilátka proti CTLA ‑ 4 [52]. Obě jsou v současné době testovány ve studii fáze I/ II u pacientů s různými nádory včetně nádorů močového měchýře (NCT01928394). Pacienti jsou randomizováni na léčbu nivolumabem samotným či v kombinaci s ipilimumabem.
Pembrolizumab (Keytruda®, MSD) je další protilátka proti PD-1. Pembrolizumab v monoterapii prokázal u PD ‑ L1 pozitivního pokročilého karcinomu močového měchýře celkovou míru odpovědi 24 % (n = 7/ 29). U 10 % nemocných bylo dosaženo úplné odpovědi (3/ 29). V době analýzy trvala odpověď od 16+ do 40+ týdnů, když u šesti ze sedmi pacientů odpovídajících na léčbu léčba pokračovala [53].
Durvalumab (MEDI4736, MedImmune, AstraZeneca) je IgG1 lidská monoklonální protilátka proti receptoru PD ‑ L1, která brání vazbě PD ‑ L1 na PD ‑ 1 a CD80. Durvalumab prokázal časnou (pět týdnů od zahájení) a dlouhotrvající aktivitu (> 56 týdnů) u různých typů nádorů (karcinom močového měchýře hodnocen nebyl) [54]. Durvalumab je nyní zkoušen i u karcinomu močového měchýře v monoterapii či kombinaci s tremelimumabem (protilátka proti receptoru CTLA ‑ 4) vs. standardní chemoterapie (NCT02516241).
Závěr
Imunoterapie představuje jednu z možných modalit léčby zhoubných nádorových onemocnění. Její uplatnění v urologické onkologii je spojeno s relativně dlouhou tradicí. Přes příznivou odpověď je podání BCG u neinvazivních nádorů močového měchýře u přibližně 30 % nemocných spojeno s rezistencí vůči léčbě a progresí nádorového onemocnění. Ve snaze zlepšit odpověď jsou připravovány a zkoušeny nové přípravky samostatně nebo v kombinaci se současnou imunologickou nebo cytotoxickou léčbou. Velmi slibné se zdají přípravky ze skupiny monoklonálních protilátek proti kontrolním bodům imunitní reakce. Na výsledky randomizovaných studií a event. začlenění nových přípravků do léčebného algoritmu budeme muset vyčkat.
Poděkování za připomínky MU Dr. Evě Vernerové a MU Dr. Milotovi z Ústavu imunologie 2. LF UK v Praze. MU Dr. Milota se podílel rovněž na korektuře článku.
Autorka deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Michaela Matoušková
Urocentrum Praha
Karlovo náměstí 319/3
120 00 Praha 2
e-mail: matouskova@urocentrum.cz
Obdrženo: 3. 9. 2015
Přijato: 23. 10. 2015
Zdroje
1. Ferlay J, Bray F, Forman D et al. GLOBOCAN 2008 v1.2, Cancer incidence and mortality worldwide: IARC cancer base No. 10 [monograph on the Internet]. Lyon: International Agency for Research on Cancer 2010. Available from: www.iarc.fr/ en/ publications/ eresources/ cancerbases/ index.php.
2. Globocan 2012: estimated cancer incindence, mortality and prevalence worldwide in 2012 [online]. Lyon: International Agency for Research on Cancer 2015. Available from: www.globocan.iarc.fr.
3. Nádory močového měchýře – Epidemiologie a populační data ČR [online]. Masarykova univerzita, Brno, 2015. [citováno 30. září 2015]. Dostupné z: www.uroweb.cz/ index.php?pg=dg ‑ nadory ‑ mocoveho ‑ mechyre ‑ epidemiologie ‑ ceska ‑ republika ‑ vyvoj ‑ incidence ‑ mortalitahttp:/ / www.uroweb.cz.
4. Babjuk M, Böhle A, Burger M el al. Guidelines on non‑muscle ‑ invasive bladder cancer (Ta, T1 and CIS), limited update March 2015 [monograph on the Internet]. European Association of Urology 2015. Available from: http:/ / uroweb.org/ wp ‑ content/ uploads/ EAU ‑ Guidelines ‑ Non ‑ muscle ‑ invasive ‑ Bladder ‑ Cancer ‑ 2015-v1.pdf.
5. Zhoubný novotvar močového měchýře (C67) [online]. Modrá kniha. [citováno 30. září 2015]. Dostupné z: www.linkos.cz/ informace ‑ pro‑praxi/ modra ‑ kniha/ 22 - zhoubny ‑ novotvar ‑ mocoveho ‑ mechyre‑c67/ .
6. Morales A, Eidinger D, Bruce AW. Intracavitary Bacillus Calmette Guerin in the treatment of superficial bladder tumors. J Urol 1976; 116(2): 180 – 183.
7. Lamm DL, Blumenstein BA, Crawford ED et al. A randomized trial of intravesical doxorubicin and immunotherapy with bacille Calmette ‑ Guerin for transitional ‑ cell carcinoma of the bladder. N Engl J Med 1991; 325(17): 1205 – 1209.
8. Malmström PU, Wijkström H, Lundholm C et al. 5‑year followup of a randomized prospective study comparing mitomycin C and bacillus Calmette ‑ Guerin in patients with superficial bladder carcinoma. J Urol 1999; 161(4): 1124 – 1127.
9. van der Meijden AP, Sylvester RJ, Oosterlinck W et al. Maintenance bacillus Calmette ‑ Guerin for Ta T1 bladder tumors is not associated with increased toxicity: results from a European organisation for research and treatment of cancer genito ‑ urinary group phase III trial. Eur Urol 2003; 44(4): 429 – 434.
10. Morales A, Ottenhof P, Emerson L. Treatment of residual, non‑infiltrating bladder cancer with bacillus Calmette ‑ Guerin. J Urol 1981; 125(5): 649 – 651.
11. Hall MC, Chang SS, Dalbagni G et al. Guideline for the management of nonmuscle invasive bladder cancer (stages Ta, T1, and Tis): 2007 update. J Urol 2007; 178(6): 2314 – 2330.
12. Kavoussi R, Brown JE, Ritchey JK et al. Fibronectin‑mediated Calmette ‑ Guerin bacillus attachment to murine bladder mucosa. Requirement for the expression of an antitumor response. J Clin Invest 1990; 85(1): 62 – 67.
13. Zuiverloon TC, Nieuweboer AJ, Vékony H el al. Markers predicting response to bacillus Calmette ‑ Guérin immunotherapy in high‑risk bladder cancer patients: a systematic review. Eur Urol 2012; 61(1): 128 – 145. doi: 10.1016/ j.eururo.2011.09.026.
14. Luo Y, Chen X, O‘Donnell MA. Role of Th1 and Th2 cytokines in BCG‑induced IFN ‑ γ production: cytokine promotion and simulation of BCG effect. Cytokine 2003; 21(1): 17 – 26.
15. Saint F, Patard JJ, Maille P et al. Prognostic value of a T helper 1 urinary cytokine response after intravesical bacillus Calmette ‑ Guerin treatment for superficial bladder cancer. J Urol 2002; 167(1): 364 – 367.
16. Lamm DL, Blumenstein BA, JCrissman JD et al. Maintenance bacillus Calmette ‑ Guerin immunotherapy for recurrent Ta, T1 and carcinoma in situ transitional cell carcinoma of the bladder: a randomized Southwest Oncology Group study. J Urol 2000; 163(4): 1124 – 1129.
17. Jonasch E, Haluska FG. Interferon in oncological practice: review of interferon biology, clinical applications, and toxicities. Oncologist 2001; 6(1): 34 – 55.
18. Kamat AM, Lamm DL. Immunotherapy for bladder cancer. Curr Urol Rep 2001; 2(1): 62 – 69.
19. Belardelli F, Ferrantini M, Proietti E et al. Interferon‑alpha in tumor immunity and immunotherapy. Cytokine Growth Factor Rev 2002; 13(2): 119 – 134.
20. Droller MJ, Gomolka D. Enhancement of natural cytotoxicity in lymphocytes from animals with carcinogen‑induced bladder cancer. J Urol 1983; 129(3): 625 – 629.
21. Parronchi P, De Carli M, Manetti R et al. IL‑4 and IFN (α and γ) exert opposite regulatory effects on the development of cytolytic potential by Th1 or Th2 human T cell clones. J Immunol 1992; 149(9): 2977 – 2983.
22. Slaton JW, Perrotte P, Inoue K el al. Interferon ‑ α ‑ mediated down ‑ regulation of angiogenesis‑related genes and therapy of bladder cancer are dependent on optimization of biological dose and schedule. Clin Cancer Res 1999; 5(10): 2726 – 2734.
23. Giannopoulos A, Adamakis I, Evangelou K et al. Interferon ‑ a2b reduces neo ‑ microvascular density in the ‚normal‘ urothelium adjacent to the tumor after transurethral resection of superficial bladder carcinoma. Onkologie 2003; 26(2): 147 – 152.
24. Glashan RW. A randomized controlled study of intravesical α ‑ 2b ‑ interferon in carcinoma in situ of the bladder. J Urol 1990; 144(3): 658 – 661.
25. Hudson MA, Ratliff TL. Failure of intravesical interferon‑alfa‑2b for the treatment of patients with superficial bladder cancer previously failing intravesical BCG therapy. Urol Oncol 1995; 1(3): 115 – 118.
26. Portillo J, Martin B, Hernandez R et al. Results at 43 months‘ follow‑up of a double‑blind, randomized, prospective clinical trial using intravesical interferon alpha ‑ 2b in the prophylaxis of stage pT1 transitional cell carcinoma of the bladder. Urology 1997; 49(2): 187 – 190.
27. Gan YH, Zhang Y, Khoo HE et al. Antitumour immunity of bacillus Calmette ‑ Guerin and interferon alpha in urine bladder cancer. Eur J Cancer 1999; 35(7): 1123 – 1129.
28. Luo Y, Chen X, Downs TM el al. IFN ‑ α 2B enhances Th1 cytokine responses in bladder cancer patients receiving Mycobacterium bovis bacillus Calmette ‑ Guerin immunotherapy. J Immunol 1999; 162(4): 2399 – 2405.
29. Lam JS, Benson MC, O‘Donnell MA et al. Bacillus Calmete ‑ Guérin plus interferon ‑ α2B intravesical therapy maintains an extended treatment plan for superficial bladder cancer with minimal toxicity. Urol Oncol 2003; 21(5): 354 – 360.
30. Nagabhushan TL, Maneval DC, Benedict WF et al. Enhancement of intravesical delivery with Syn3 potentiates interferon ‑ α2b gene therapy for superficial bladder cancer. Cytokine Growth Factor Rev 2007; 18(5 – 6): 389 – 394.
31. Gillis S, Smith KA. Long term culture of tumour specific cytotoxic T cells. Nature 1977; 268(5616): 154 – 156.
32. Di Sabato G, Chen DM, Erickson JW. Production by murine spleen cells of an activity stimulating the PHA responsiveness of thymus lymphocytes. Cell Immunol 1975; 17(2): 495 – 504.
33. Lotze MT, Grimm EA, Mazumder A. Lysis of fresh and cultured autologous tumor by human lymphocytes cultured in T ‑ cell growth factor. Cancer Res 1981; 41(11): 4420 – 4425.
34. Henney CS, Kuribayashi K, Kern DE et al. Interleukin‑2 augments natural killer cell activity. Nature 1981; 291(5813): 335 – 338.
35. Waldmann TA, Goldman CK, Robb RJ. Expression of interleukin 2 receptors on activated human B cells. J Exp Med 1984; 160(5): 1450 – 1466.
36. Mosmann TR, Cherwinski H, Bond MW et al. Two types of murine helper T cell clone. I. Definition according to profiles of lymphokine activities and secreted proteins. J Immunol 1986; 136(7): 2348 – 2357.
37. De Reijke TM, De Boer EC, Kurth KH et al. Urinary interleukin‑2 monitoring during prolonged bacillus Calmette ‑ Guerin treatment: can it predict the optimal number of instillations? J Urol 1999; 161(1): 67 – 71.
38. De Boer EC, De Jong WH, Steerenberg PA et al. Leukocytes and cytokines in the urine of superficial bladder cancer patients after intravesical immunotherapy with bacillus Calmette ‑ Guerine. In Vivo 1991; 5(6): 671 – 677.
39. Magno C, Melloni D, Galì A et al. The anti‑tumor activity of bacillus Calmette ‑ Guerin in bladder cancer is associated with an increase in the circulating level of interleukin‑2. Immunol Lett 2002; 81(3): 235 – 238.
40. Merguerian PA, Donahue L, Cockett AT. Intraluminal interleukin 2 and bacillus Calmette ‑ Guerin for treatment of bladder cancer: a preliminary report. J Urol 1987; 137(2): 216 – 219.
41. Huland E, Huland H. Local continuous high dose interleukin 2: a new therapeutic model for the treatment of advanced bladder carcinoma. Cancer Res 1989; 49(19): 5469 – 5474.
42. Cockett AT, Davis RS, Cos LR et al. Bacillus calmette ‑ guerin and interleukin‑2 for treatment of superficial bladder cancer. J Urol 1991; 146(3): 766 – 769.
43. Gomella LG, McGinnis DE, Lattime EC et al. Treatment of transitional cell carcinoma of the bladder with intravesical interleukin‑2: a pilot study. Cancer Biother 1993; 8(3): 223 – 227.
44. Den Otter W, Dobrowolski Z, Bugajski A et al. Intravesical interleukin‑2 in T1 papillary bladder carcinoma: regression of marker lesion in 8 of 10 patients. J Urol 1998; 159(4): 1183 – 1186.
45. O‘Donnell MA, Aldovini A, Duda RB et al. Recombinant Mycobacterium bovis BCG secreting functional interleukin‑2 enhances gamma interferon production by splenocytes. Infect Immun 1994; 62(6): 2508 – 2514.
46. Young SL, O‘Donnell MA, Buchan GS. IL‑2secreting recombinant bacillus Calmette Guerin can overcome a type 2 immune response and corticosteroid‑induced immunosupression to elicit a type 1 immune response. Int Immunol 2002; 14(7): 793 – 800.
47. Zhang X, Shi X, Li J et al. Novel immunotherapy for metastatic bladder cancer using vaccine of human interleukin‑2 surface ‑ modified MB 49 cells. Urology 2011; 78(3): 722. doi: 10.1016/ j.urology.2011.04.044.
48. Pardoll DM. The blockade of immune checkpoints in cancer immunotherapy. Nat Rev Cancer 2012; 12(4): 252 – 264. doi: 10.1038/ nrc3239.
49. Finn OJ. Immuno ‑ oncology: understanding the function and dysfunction of the immune system in cancer. Ann Oncol 2012, 23 (Suppl 8): viii6 – viii9. doi: 10.1093/ annonc/ mds256.
50. Kim JW, Tomita Y, Trepel J et al. Emerging immunotherapies for bladder cancer. Curr Opin Oncol 2015; 27(3): 191 – 200. doi: 10.1097/ CCO.0000000000000177.
51. Powels T, Eder JP, Fine GD et al. MPDL3280A (anti‑PD ‑ L1) treatment leads to clinical activity in metastatic bladder cancer. Nature 2014; 515(7528): 558 – 562. doi: 10.1038/ nature13904.
52. Tarhini A, Lo E, Minor DR. Releasing the brake on the immune system: ipilimumab in melanoma and other tumors. Cancer Biother Radiopharm 2010; 25(6): 601 – 613. doi: 10.1089/ cbr.2010.0865.
53. Plimack ER, Gupta S, Bellmunt J et al. A phase 1b study of pembrolizumab (Pembro; MK ‑ 3475) in patients (pts) with advanced urothelial tract cancer. Ann Oncol 2014; 25(5): 1 – 41. doi: 10.1093/ annonc/ mdu438.
54. Segal NH, Hamid O, Hwu W et al. A phase I multi‑arm dose‑expansion study of the anti‑programmed cell death‑ligand ‑ 1 (PD ‑ L1) antibody MEDI4736: preliminary data. Ann Oncol 2014; 25 (Suppl 4): iv361 – iv372. doi: 10.1093/ annonc/mdu342.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2015 Číslo Supplementum 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Nejasný stín na plicích – kazuistika
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Nežádoucí účinky moderní imunoterapie a jejich řešení v klinické praxi
- Terapeutický efekt a tolerance ipilimumabu u metastatického maligního melanomu v dětském věku – kazuistika
- Protinádorové zbraně imunitního systému
- Úloha regulačních T buněk v protinádorové imunitní odpovědi
- Únikové strategie nádorů pozornosti imunitního systému
- Editorial
- Role imunoterapie v dětské onkologii
- Nádorová imunoterapie: Jsme na úsvitu nové éry?
- Chimérický antigenní receptor T lymfocytů – genová terapie budoucnosti u nádorových onemocnění?
- Význam imunogenní buněčné smrti v protinádorové imunitě
- Význam imunitního systému a možnosti imunoterapie u maligního melanomu
- Imunoterapie renálního karcinomu
- Význam imunitního systému a možnosti imunoterapie u karcinomu prostaty
- Dosavadní zkušenosti a perspektivy imunoterapie bronchogenního karcinomu
- Imunoterapie u bronchogenního karcinomu a její perspektivy
- Historie imunoterapie – od Coley toxinů ke kontrolním bodům imunitní reakce
- Immunoscore a jeho prediktivní hodnota u kolorektálního karcinomu
- Imunitní systém u pacientů s nádory hlavy a krku
- Imunoterapie uroteliálního karcinomu močového měchýře – od BCG vakcín k cílené imunoterapii
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Nežádoucí účinky moderní imunoterapie a jejich řešení v klinické praxi
- Imunoterapie uroteliálního karcinomu močového měchýře – od BCG vakcín k cílené imunoterapii
- Únikové strategie nádorů pozornosti imunitního systému
- Význam imunogenní buněčné smrti v protinádorové imunitě
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



