-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Význam imunogenní buněčné smrti v protinádorové imunitě
The Concept of Immunogenic Cell Death in Antitumor Immunity
Cancer cell death can be immunogenic or nonimmunogenic depending on the initiating stimulus. The immunogenic characteristics of immunogenic cell death are mainly mediated by damage-associated molecular patterns represented by preapoptotic exposure of calreticulin and heat shock proteins (HSP70 and HSP90) from endoplasmic reticulum at the cell surface and active secretion of adenosintriphospate. Other damage-associated molecular patterns are produced in late stage apoptosis as high mobility group box 1 protein (HMGB1) into the extracellular milieu. Such signals operate on various receptors expressed by antigen presenting cells, mainly by population of dendritic cells, to stimulate the activation of antigen specific T-cell response. In this review, we describe the current known immunogenic cell death inducers and their potential to activate antitumor immune response.
Key words:
calreticulin – dendritic cell – immunogenic cell death – antitumor immune response
This work was supported by grant IGA MH CZ – NT 12402-5 and MH CZ – DRO, University Hospital Motol, Prague, Czech Republic 00064203.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.Submitted:
29. 7. 2015Accepted:
1. 10. 2015
Autoři: J. Fučíková; J. Bartůňková; R. Špíšek
Působiště autorů: Ústav imunologie, 2. LF UK a FN v Motole, PrahaSotio a. s., Praha
Vyšlo v časopise: Klin Onkol 2015; 28(Supplementum 4): 48-55
Kategorie: Obecná část
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amko20154S48Souhrn
Z imunologického hlediska lze buněčnou smrt nádorových buněk rozlišit na imunogenní a neimunogenní v závislosti na podnětu, který ji vyvolává. Imunogenní buněčná smrt na rozdíl od fyziologické apoptózy vede ke stimulaci imunitního systému pomocí molekul, které jsou označovány jako DAMPs (danger associated molecular pattern). V prvních hodinách imunogenní buněčné apoptózy dochází k rychlé translokaci chaperonového proteinu kalretikulinu a proteinů teplotního stresu 70 a 90 (heat ‑ shock – HSP70 a HSP90) z endoplazmatického retikula na buněčný povrch. Následně dochází k aktivní sekreci molekuly adenosintrifosfátu a pasivnímu uvolnění nukleárního proteinu HMGB1 do extracelulárního prostoru. Společnou vlastností těchto molekul je aktivace buněk imunitního systému, zejména pak dendritických buněk, které se řadí mezi profesionální antigen prezentující buňky, které následně aktivují protinádorovou imunitní odpověď. Cílem tohoto souhrnného článku je popsat dosud známé induktory imunogenní buněčné smrti a jejich vliv na protinádorovou imunitní odpověď.
Klíčová slova:
kalretikulin – dendritická buňka – imunogenní buněčná smrt – protinádorová imunitní odpověďÚvod
Nové poznatky v oblasti nádorové biologie ukazují, že imunitní systém je schopen rozpoznat neoplastické nádorové buňky a zničit je dříve, než se projeví jako klinicky závažné onemocnění. Složky imunity hrají důležitou roli i při léčbě klinicky detekovatelných nádorů a podporují účinek něněrých protinádorových léčiv [1]. Základním předpokladem pro rozpoznání nádorových buněk imunitním systémem je existence nádorově specifických, resp. asociovaných antigenů. Ty mohou být v menší či větší míře exprimovány nádorovou buňkou a napomáhat její identifikaci buňkami imunitního systému [2]. Z experimentů je však známo, že nádory rostoucí v imunodeficitním jedinci jsou mnohem více imunogenní než nádory rostoucí u imunokompetentního jedince. Imunitní systém totiž vyvíjí na nádorové buňky neustálý selekční tlak, který vede k výběru variant transformovaných buněk, které dokážou uniknout efektorovým mechanizmům imunitního systému. Tato hypotéza se nazývá „cancer immune editing“, tj. editace nádoru imunitním systémem a popisuje tři odlišné úrovně boje imunitního systému proti nádorovým buňkám – eliminaci transformované buňky (elimination), ustanovení rovnováhy mezi transformovanou buňkou a organizmem (equilibrium) a únik transformované buňky před kontrolou imunitním systémem (escape) [3]. V klinické praxi se nádory diagnostikují nejčastěji až ve fázi úniku. Imunitní systém přestane v této fázi detekovat nádorovou buňku jako cizího vetřelce, nebojuje s ní a dochází k progresi nádorového onemocnění. Ukazuje se, že řada klinicky používaných léčebných strategií působí částečně mechanizmem zvyšování imunogenicity nádorových buněk. Nádorové buňky, které v důsledku účinku léčebných metod zahynou tzv. imunogenní buněčnou smrtí (immunogenic cell death – ICD), aktivují imunitní mechanizmy, které tak přispívají k eliminaci nebo alespoň kontrole růstu nádoru i v jeho pokročilých stadiích.
Imunogenní buněčná smrt nádorových buněk
Z imunologického hlediska lze buněčnou smrt nádorových buněk rozlišit na imunogenní, kdy je buňka schopna indukovat specifickou imunitní odpověď, a tolerogenní, při které je naopak výsledkem tolerance k zabité buňce [4]. Apoptóza byla velice dlouho považována za imunologicky tichý typ buněčné smrti na rozdíl od nekrotické buněčné smrti. Nekróza byla označována za imunogenní, neboť při ní dochází k porušení plazmatické membrány a uvolnění buněčných komponent a prozánětlivých cytokinů. Toto dogma bylo v uplynulých 10 letech popřeno řadou prací popisujících význam imunogenní apoptózy navozené různými modalitami a upozorňujících na její význam v konceptu ICD (tab. 1) [5]. Z těchto prací vyplývá, že typ buněčné smrti neurčuje, zda jde o imunogenní smrt, rozhodující je typ podnětu, který buněčnou smrt zahájí [6]. ICD na rozdíl od fyziologické apoptózy vede ke stimulaci imunitního systému pomocí molekul, které jsou označovány jako DAMPs (danger associated molecular pattern). DAMPs mají za fyziologických podmínek řadu funkcí ovlivňujících metabolizmus, proliferaci a komunikaci buněk [7]. Pokud se nádorová buňka dostane do stresového prostředí, jsou tyto molekuly exprimovány na buněčném povrchu nebo uvolňovány do mezibuněčného prostoru v nádorovém ložisku, kde aktivují různým způsobem rozličné složky imunity a obvykle indukují protinádorovou imunitní reakci [7,8]. V prvních hodinách imunogenní buněčné apoptózy dochází k: 1. rychlé translokaci chaperonového proteinu kalretikulinu (calreticulin – CRT) [9] a proteinů teplotního stresu 70 a 90 (heat ‑ shock – HSP70 a HSP90) z endoplazmatického retikula (ER) na buněčný povrch [10]. Následně dochází k 2. aktivní sekreci molekuly ATP (adenosintrifosfát) [11] a 3. pasivnímu uvolnění nukleárního proteinu HMGB1 (high mobility group box 1) [12] do extracelulárního prostoru. Společnou vlastností těchto molekul je aktivace buněk imunitního systému, zejména pak dendritických buněk (dendritic cells – DC), které se řadí mezi profesionální antigen prezentující buňky (antigen presenting cell – APC) [13]. Význam těchto molekul pro aktivaci imunitního systému byl prokázán na mnoha in vitro modelech nádorových buněk [11,14 – 16] a v in vivo myších imunizačních experimentech [17 – 19]. Řada preklinických a retrospektivních prací dokumentuje klinický význam DAMP molekul pro predikci prognózy pacientů s nádorovými chorobami [5]. Vyšší exprese DAMP molekul na nádorových buňkách nebo jejich vyšší koncentrace v nádorovém mikroprostředí jsou spojovány s lepší prognózou onemocnění.
Induktory imunogenní buněčné smrti
Jako první induktory ICD byly popsány v letech 2002 – 2006 chemoterapeutika mitoxantron, antracykliny (doxorubicin a idarubicin) [14,16] a radioterapie [12]. V současné době je identifikována skupina chemoterapeutik a fyzikálních modalit, jejichž společnou vlastností je indukovat imunogenní smrt nádorových buněk (tab. 1) [6]. Díky mnoha biologickým a chemickým odlišnostem těchto modalit vznikl nový systém klasifikace na induktory I. a II. třídy [17]. Induktory imunogenní smrti, které způsobují stres ER nepřímo přes cytozolické proteiny, proteiny plazmatické membrány a DNA replikaci jsou označovány jako induktory I. třídy [17]. Do této skupiny řadíme něněrá chemoterapeutika (mitoxantron, antracykliny, oxaliplatina a bortezomib) a fyzikální modality (UV C záření, radioterapie a vysoký hydrostatický tlak). Naopak modality, které primárně indukují stres ER, jsou označovány jako induktory II. třídy a řadíme mezi ně zejména fotodynamickou terapii a něněré onkolytické viry [17]. Společným rysem obou skupin induktorů je přímá (II. třída) či nepřímá (I. třída) aktivace stresu ER, díky které dochází k fosforylaci eukaryotického translačního iniciačního faktoru eIF2α pomocí serin‑threonin kinázy PERK. Následuje proteolýza proteinu BAP31 mediovaná kaspázou ‑ 8 a aktivace proapoptotických proteinů BAX a BAK. Následně je CRT transportován z ER do Golgiho aparátu a pomocí exocytózy přenesen na buněčný povrch [9]. Blokace jakéhokoliv proteinu v této dráze znemožní expresi CRT, zastaví ICD a redukuje imunitní odpověď navozenou imunogenní modalitou [9].
Induktory I. třídy
Antracykliny a mitoxantron
Antracykliny jsou více než 40 let používány v terapii nádorů dětského věku, leukemií, lymfomů a také v léčbě nádorů prsu a vaječníků. Do této skupiny látek řadíme zejména doxorubicin, idarubicin a mitoxantron [18]. Antracykliny se vyznačují mnoha cytostatickými a cytotoxickými vlastnostmi zprostředkovanými zejména interkalací DNA a inhibicí DNA topoizomerázy II vedoucí k apoptóze nádorových buněk. V uplynulých 10 letech se ukázalo, že právě tento typ buněčné smrti nese klíčové znaky imunogenní apoptózy zahrnující pre‑apoptotickou expresi CRT [16], uvolnění molekuly ATP a HMGB1 ve fázi pozdní apoptózy [12]. Význam exprese a uvolnění těchto molekul byl ověřen v in vivo profylaktických imunizačních experimentech na myších modelech [12,16,19]. Exprese CRT na povrchu nádorových buněk po ošetření antracykliny předchází jakýmkoliv morfologickým znakům apoptózy a objevuje se před vystavením samotného fosfatidylserinu [16]. Po rozpoznání CRT na povrchu nádorové buňky populací APC dojde k pohlcení nádorové buňky a aktivaci APC (zejména DC). Populace DC následně aktivuje T lymfocytární protinádorovou odpověď (obr. 1) [16]. Molekula ATP produkovaná v časné fázi apoptózy zesiluje migraci monocytů a makrofágů do nádorového ložiska [20]. Molekula ATP dále vazbou na purinergní receptor P2RX7 na povrchu DC způsobí jejich maturaci díky aktivaci NALP3 inflamazomu. Aktivovaná DC následně produkuje cytokin IL‑1β nezbytný pro aktivaci antigen specifických T lymfocytů (obr. 1). V pozdních fázích apoptózy dochází k uvolňování molekuly HMGB1, která vazbou na TLR ‑ 4 receptor indukuje tzv. cross prezentaci nádorových antigenů DC [12].
Oxaliplatina
Oxaliplatina se řadí mezi platinová cytostatika. Chemicky reaktivní látky patřící do této skupiny reagují s DNA, která se jejich působením štěpí, či dochází k pevnému spojení dvou řetězců DNA. Všechny tyto změny vedou k nesprávné funkci buňky, zástavě buněčného dělení a buněčné smrti. Vedle silného cytotoxického působení se oxaliplatina (na rozdíl od cisplatiny) vyznačuje schopností navozovat ICD, což bylo demonstrováno profylaktickou vakcinací na myších modelech [21]. ICD navozená tímto platinovým derivátem je charakterizována pre‑apoptotickou expresí CRT, aktivní sekrecí ATP a post‑apoptotickým uvolněním molekuly HMGB1 (tab. 1) [21]. Léčba oxaliplatinou vede ke zvýšení exprese HLA molekul I. třídy na povrchu nádorových buněk, což napomáhá imunitnímu systému tyto buňky identifikovat a odstraňovat [22]. Z nedávno publikované studie vyplývá, že in vitro aplikace oxaliplatiny zvyšuje expresi molekuly PD ‑ L1 na povrchu plazmacytoidních DC, které následně napomáhají T lymfocytární proliferaci a indukci protinádorové odpovědi.
Tab. 1. Induktory ICD I. a II. třídy v léčbě nádorových onemocnění, jejich hlavní imunogenní vlastnosti a vliv na imunitní systém. 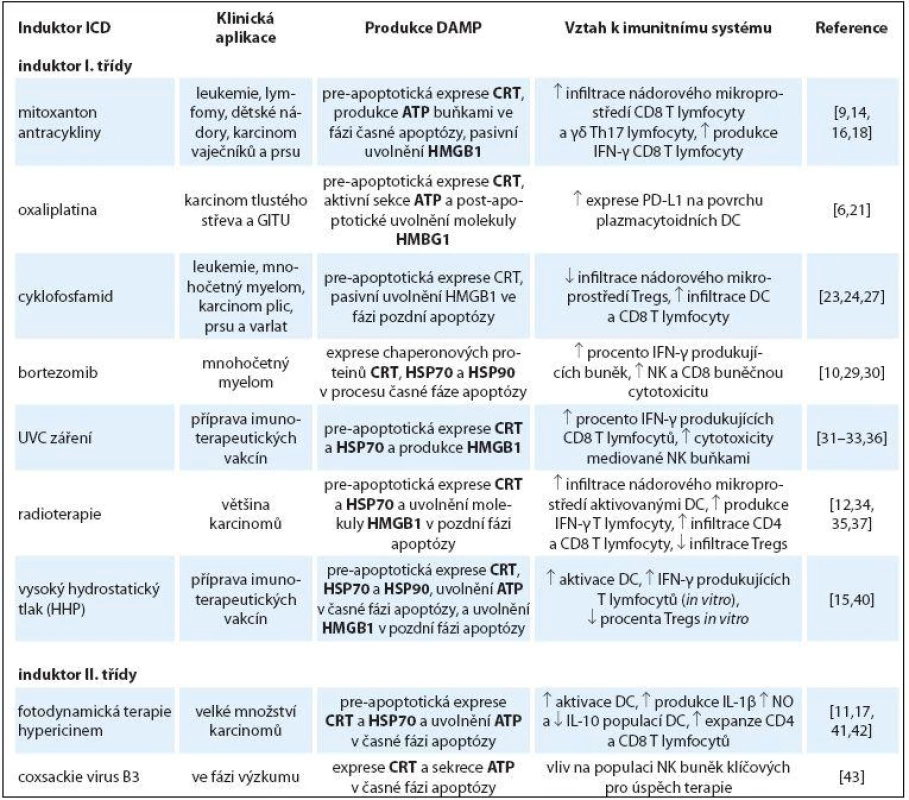
ICD – imunogenní buněčná smrt, DAMP – danger associated molecular pattern, CRT – kalretikulin, ATP – adenosintrifosfát, HMGB1 – high mobility group box 1, DC – dendritické buňky, Tregs – regulační T lymfocyty Cyklofosfamid
Cyklofosfamid (CTX) je používán v terapii nádorových onemocnění od roku 1959, kdy byl schválen americkým úřadem pro kontrolu potravin a léčiv (FDA). V porovnání s ostatními chemoterapeutiky, které patří do skupiny DNA ‑ alkylujících látek, CTX aktivuje imunitní systém a vykazuje antiangiogenní vlastnosti. Imunogenní vlastnosti CTX byly prokázány na imunokompetentních a nude myších s mezoteliomem [23]. Pouze ve skupině imunokompetentních myší docházelo k regresi nádoru a ochraně proti živým nádorovým buňkám při preventivní vakcinaci. Imunogenní vlastnosti CTX jsou charakterizovány rychlou pre‑apoptotickou expresí CRT a pasivním uvolněním molekuly HMGB1 (tab. 1) [17]. Fagocytóza nádorových buněk ošetřených CTX vede k fenotypické a funkční (produkce cytokinů IL‑1β, IL‑6 a IL‑12) aktivaci DC (obr. 1). Aplikace in vivo selektivně snižuje procento CD8α+ DC v sekundárních lymfoidních orgánech u myší, způsobuje expanzi DC v periferní krvi a zvyšuje infiltraci DC v nádorovém ložisku a ve spádové lymfatické uzlině. Ve stejné studii bylo demonstrováno, že in vitro kultivace DC získaných z CTX léčených myší s populací regulačních T lymfocytů inhibuje jejich imunosupresivní vlastnosti a dochází k aktivaci protinádorové imunitní odpovědi [24]. Další klinicky významnou vlastností CTX je schopnost navodit lymfodepleci něněrých subpopulací lymfocytů. Metronomické dávky CTX (v dávce cca 50 mg/ kg na myš; 100 mg/ den na pacienta) navozují selektivní depleci regulačních T lymfocytů v periferní krvi, lymfoidní tkáni a nádorovém ložisku [25]. U pacientů léčených CTX je však situace komplexnější a publikovaná data nejsou jednotná: při léčbě CTX dochází pouze k nesignifikantnímu snížení procenta regulačních T lymfocytů v periferní krvi. V nádorovém mikroprostředí těchto pacientů bylo identifikováno zvýšené procento CD11c+, CD68+ a CD8+ buněk a snížené procento CD25+ buněk [26]. Zároveň dochází během terapie CTX k produkci cytokinů stimulující Th1 buněčnou odpověď v periferní krvi [27]. Tento fakt vysvětluje, proč u pacientů léčených CTX dochází k infiltraci CD8 T lymfocytů do nádorového ložiska. U léčených pacientů dochází naopak ke snížení hladiny cytokinů IL‑10, TGF‑β a NO v periferní krvi.
CTX patří mezi významné ICD induktory, který se vyznačuje mnoha imunomodulačními vlastnostmi. Jeho efekt je však více než u jiných cytostatik závislý na dávce.
Bortezomib
Bortezomib, inhibitor proteazomu, byl schválen americkou FDA v roce 2003 pro léčbu pacientů s mnohočetným myelomem (Velcade). Proteazomální degradace hraje zásadní roli v proteinovém metabolizmu buňky a podílí se na řízení buněčného cyklu, reparaci genomové DNA či mezibuněčné komunikaci. Pomocí tohoto děje jsou v buňce eliminovány chybně přepsané či nesprávně sestavené proteiny. Vazbou bortezomibu na podjednotku 26S proteazomu dochází k zástavě buněčného cyklu ve fázi G2/ M vedoucí k apoptóze nádorových buněk. Imunogenní vlastnosti bortezomibu byly demonstrovány na myších léčených pomocí DC vakcíny pulzované nádorovými buňkami prsní žlázy ošetřenými bortezomibem. Takto léčené myši byly následně chráněny před formací transplantabilního nádoru [28]. Na základě těchto výsledků bylo později popsáno, že rozhodující roli v protinádorové imunitě aktivované bortezomibem má populace NK buněk a CD8 T lymfocytů [29]. Nádorové buňky ošetřené bortezomibem indukují aktivaci DC závislou na buněčném kontaktu a buněčné fagocytóze [10]. Tato stimulace je zprostředkována zejména díky expresi proteinů teplotního šoku (HSP70 a HSP90) a CRT na povrchu nádorových buněk po ošetření bortezomibem (tab. 1). Blokace proteinů teplotního stresu a CRT pomocí specifických protilátek snižuje fenotypickou aktivaci DC pouze částečně. Naopak maturace DC je silně ovlivněna při použití protilátek proti CD91 receptoru či jeho down ‑ regulací [30]. Aktivované DC následně indukují produkci IFN ‑ γ protinádorově specifickými T lymfocyty [10].
Přes zmíněné pozitivní vlastnosti bortezomibu in vitro a in vivo je třeba zmínit, že přímá aplikace bortezomibu snižuje expresi MHC (major histocompability complex) molekul na povrchu DC [29] a snižuje životnost něněrých buněk imunitního systému (populací plazmacytoidních a myeloidních DC, aktivovaných T lymfocytů a DC derivovaných z monocytů), bez významného vlivu na populaci CD3 T lymfocytů.
UVC záření
Prozánětlivé působení UVC záření v kůži bylo poprvé zmíněno před 30 lety. Později byla popsána schopnost záření aktivovat ICD pomocí profylaktických imunizačních experimentů na imunokompetentních myších modelech [31]. V závislosti na použitém modelu UVC způsobuje jak apoptotickou, tak nekrotickou smrt nádorových buněk. Z popsaných DAMP molekul klíčových pro koncept ICD UVC indukuje pre‑apoptotickou expresi CRT a HSP70 a produkci HMGB1 (tab. 1). In vitro inkubace nádorových buněk ošetřených UVC s nezralými DC vede k intenzivní fagocytóze i v porovnání s nádorovými buňkami ošetřenými γ ‑ iradiací. Tento proces vede k aktivaci DC, které indukují protinádorovou CD8 T lymfocytární odpověď (obr. 1) [32]. Významnou roli v protinádorové imunitě aktivované UVC ošetřenými nádorovými buňkami hrají i NK buňky. Případná deplece NK buněk signifikantně snižuje cytotoxické vlastnosti splenocytů [31]. UVC přímo ovlivňuje produkci klíčových cytokinů pomocí aktivace NF ‑ κB a AP ‑ 1 signalizačních drah, což bylo demonstrováno v několika experimentálních studiích [33].
Obr. 1. Indukce protinádorové odpovědi imunogenní nádorovou buňkou. 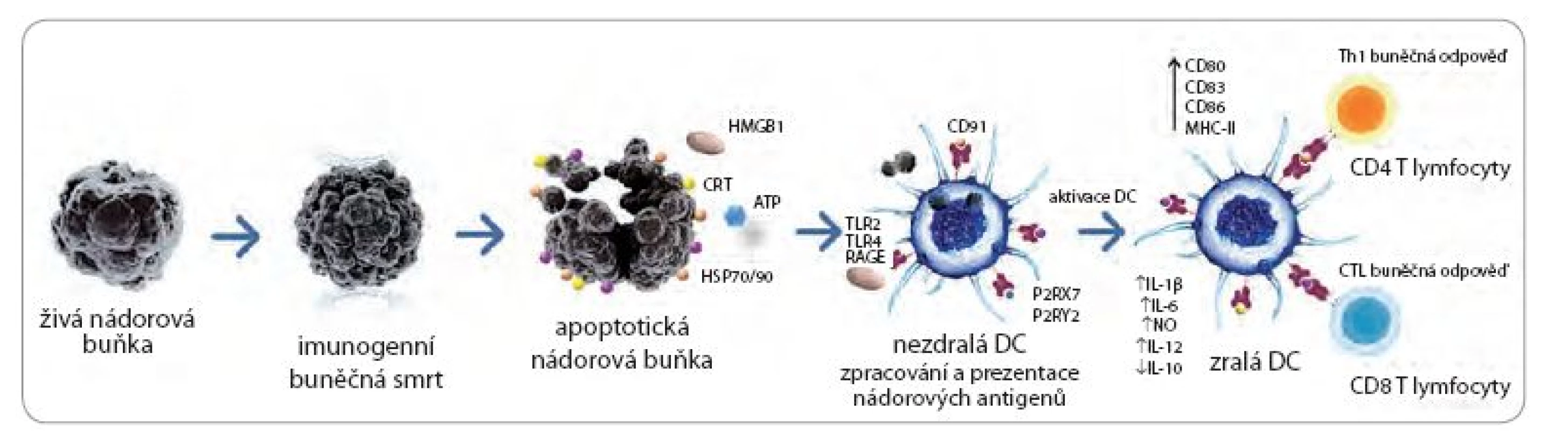
Nádorová buňka ošetřená imunogenním induktorem I. či II. třídy exprimuje a uvolňuje molekuly souhrnně označované DAMPs v různých fázích apoptózy. Mezi zmíněné DAMPs se řadí CRT, HSP70 a HSP90, HMGB1 a ATP. Tyto molekuly se váží na klíčové receptory na povrchu DC jako je TLR4 (pro HMGB1 a HSP70), P2RX7/P2RY2 (pro ATP) a CD91 (pro CRT a HSPs). Pomocí těchto interakcí dochází k intenzivní fagocytóze nádorových buněk a fenotypické (zvýšení exprese kostimulačních a povrchových molekul např. CD80, CD83, CD86 a HLA-DR) a funkční aktivaci populace DC (produkce cytokinů IL-12, IL-6 a IL-1β). Maturované DC exprimují nádorově specifi cké antigeny na povrchu MHC molekul I. a II. třídy a indukují vznik protinádorově specifi ckých CD4 a CD8 T lymfocytů. Upraveno a převzato: Sotio.com. DC – dendritické buňky, CTL – cytotoxický T lymfocyt Radioterapie
Protinádorový účinek radioterapie je založený na porušení chemických vazeb mezi lipidovými membránami, proteiny a nukleovými bázemi DNA nádorových buněk. Vysoké dávky záření způsobují poškození DNA v rozsahu, které reparační mechanizmy již nedokážou napravit, a dochází k aktivaci buněčné apoptózy. Vedle přímého vlivu radioterapie na nádorové buňky je třeba se zmínit o tzv. abskopálních (vzdálených) účincích. Mezi možné abskopální účinky radioterapie patří zpomalení růstu nádoru mediované T lymfocyty daleko od vlastního místa působení záření. Tento fenomén byl popsán u pacientů s rozličnými malignitami. Tento efekt může být vysvětlen imunogenními vlastnostmi záření, které byly prokázány in vitro u nádorových buněk, zároveň in vivo v myších modelech a v léčbě onkologických pacientů [34,35]. ICD indukovaná radioterapií je charakterizována pre‑apoptotickou expresí CRT a HSP70 a uvolněním molekuly HMGB1 v pozdní fázi apoptózy (tab. 1) [36]. Lokální vysokodávková radioterapie vede k infiltraci nádorového ložiska aktivovanými DC [37]. Zároveň bylo popsáno, že DC pulzované buňkami melanomu ošetřenými zářením analogickým radioterapii jsou schopné indukovat T lymfocytární odpověď [38]. Toto tvrzení bylo doloženo in vivo v myších modelech, kde ozářené B16 (nádorová linie melanomu) nádorové buňky aplikované v imunizačních experimentech vedly k aktivaci IFN ‑ γ produkujících splenocytů a imunitě proti živým nádorovým buňkám při profylaktické imunizaci. Z publikovaných výsledků vyplývá, že protinádorový efekt radioterapie je z části založen na T lymfocytární odpovědi. V souladu s tímto pozorováním jsou i výsledky studie, které ukazují, že ozářené nádorové buňky jsou ve větší míře rozpoznávány T lymfocyty in vitro a zvyšují účinnost adoptivní imunoterapie in vivo [39]. Radioterapie také snižuje procento regulačních T lymfocytů v periferní krvi, což je do velké míry závislé na dávce záření.
Vysoký hydrostatický tlak
Vysoký hydrostatický tlak (high hydrostatic pressure – HHP) v rozsahu 1 – 100 MPa je považován za fyziologický a působí reverzibilní morfologické změny buňky. Naopak hodnoty tlaku v rozmezí 150 – 250 MPa indukují buněčnou apoptózu jak u lidských, tak myších nádorových buněk. Nekrotická buněčná smrt je navozená HHP o hodnotách vyšších než 250 MPa [40]. Vlivem HHP dochází v nádorových buňkách k inhibici syntézy buněčných proteinů a zpomalení enzymatických funkcí. ICD navozená HHP byla nejprve popsána Gaiplem a spolupracovníky jako možná metoda ošetření nádorových buněk při výrobě protinádorové vakcíny [40]. Naše skupina v nedávno publikované studii identifikovala HHP jako induktor ICD u lidských nádorových buněk prostaty, ovarií a akutní myeloidní leukemie. Ošetření nádorových buněk HHP vede k rychlé translokaci chaperonových proteinů CRT, HSP70 a HPS90 na buněčný povrch a uvolnění molekuly ATP v prvních hodinách apoptózy. V pozdních fázích buněčné smrti dochází k uvolnění jaderného proteinu HMGB1 do okolí nádorové buňky. Exprese a uvolnění zmíněných DAMP molekul má vliv na fenotypickou i funkční maturaci DC a indukci protinádorové imunitní odpovědi, bez indukce imunosupresivní populace regulačních T lymfocytů (obr. 1) [15]. Imunogenicita nádorových buněk ošetřených HHP in vivo je předmětem profylaktických a terapeutických experimentů na myších modelech. HHP není sice technicky možné použít přímo jako léčebnou modalitu, ale je možné tento postup využít pro standardizovanou přípravu imunogenních nádorových buněk. Z tohoto důvodu byl HHP implementován do výrobního protokolu imunoterapeutické vakcíny na bázi DC. HHP je používán k ošetření nádorových buněk, které slouží jako zdroj nádorových antigenů pro aktivaci DC [25]. V současné chvíli probíhá několik klinických studií fáze II a III u karcinomu prostaty, ovarií a plic, které využívají tento výrobní postup pro zhotovení individuálního léčivého přípravku DCVAC.
Induktory II. třídy
Fotodynamická terapie
Fotodynamická terapie (PDT) představuje léčebnou metodu založenou na akumulaci fotosenzitivní látky v nádorových buňkách a její aktivaci světlem určitého spektra vedoucí k produkci reaktivních kyslíkových radikálů (reactive oxygen species – ROS). Právě produkce ROS způsobí aktivaci buněčné apoptózy v místě nádorové buňky, kde došlo k nahromadění fotosenzitivní látky. Fotodynamická terapie aktivovaná hypericinem patří mezi induktory ICD II. třídy. Hypericin je primárně akumulován v oblasti ER nádorových buněk a po aplikaci záření dochází k indukci stresu ER. Nádorové buňky ošetřené hyp ‑ PDT jsou ve zvýšené míře fagocytovány DC a způsobují jejich aktivaci [41]. Populace zralých DC následně indukuje protinádorovou T lymfocytární odpověď [41]. Takto ošetřené nádorové buňky exprimují CRT, HSP70 a aktivně sekretují ATP. Zároveň dochází k pasivnímu uvolnění HSPs do extracelulárního prostředí nádorových buněk [42]. V porovnání s ostatními popsanými ICD induktory Hyp ‑ PDT indukuje vysoce účinnou ICD, která je charakterizována zejména 1. zvýšenou expresí pre‑apoptotických DAMP molekul nádorovými buňkami v porovnání s radiotearpií a chemoterapií; 2. translokací CRT nezávislou na dalších DAMP molekulách (např. ERp57), se kterými vytváří komplexy; 3. jednoduchým způsobem přenosu DAMPs z intracelulárních kompartmentů na buněčný povrch bez zapojení většího množství mediátorů buněčných drah [17]. Mezi další významné imunostimulační vlastnosti Hyp ‑ PDT se řadí inhibice produkce cytokinů, které podporují proliferaci nádorových buněk, jako je TNF, IL‑6 a GM‑CSF. Hyp ‑ PDT zároveň snižuje produkci metaloproteinázy ‑ 9 nádorovými buňkami, enzymu, který je zodpovědný za invazivitu nádorových buněk do okolních tkání. Na druhou stranu však léčba Hyp ‑ PDT způsobuje nejen poškození nádorových buněk, ale také nevratné změny stromatu a buněk imunitního systému v celém nádorovém mikroprostředí.
Coxackie viry B3
Coxackie viry CVB3 patří do skupiny RNA onkolytických virů, které se replikují v cytosolu hostitelských buněk, kde způsobují nezvratné změny metabolizmu, homeostázy a způsobují buněčnou smrt. Produkce proteinů virových obalů hostitelskou buňkou vyvolává stres ER, díky čemuž dochází k indukci imunogenní apoptózy. Vlivem CVB3 virů dochází ke zvýšení imunogenicity nádorového mikroprostředí, zejména díky zvýšení angiogeneze a infiltrací CD8 T lymfocytů. CVB3 viry indukují expresi CRT a sekreci ATP v časné fázi apoptózy, v pozdních fázích apoptózy sice dochází k uvolnění HMGB1 z jádra do cytosolu, nedojde však k jeho uvolnění do extracelulárního prostoru (tab. 1). Analýza nádorů izolovaných z nude myší po inkubaci s CVB3 viry prokázala akumulaci makrofágů, DC buněk, granulocytů a NK buněk. Přítomnost granulocytů a NK buněk je klíčová pro úspěšnou léčbu pomocí CVB3 virů. Schopnost způsobit imunogenní smrt nádorové buňky a aktivovat imunitní systém je připisována i jiným onkolytickým virům [43].
Shrnutí
ICD nádorových buněk nepochybně hraje úlohu v aktivaci mechanizmů protinádorové imunity. V současné chvíli však stále chybí detailní identifikace vlivu induktorů buněčné smrti na imunitní systém in vivo. Používané léčebné strategie ovlivňují současně jak nádorovou buňku, tak i buňky imunitního systému. Tyto složité interakce a jejich konečný efekt jsou závislé na druhu nádoru, jeho stadiu, použité léčebné strategii i individuální reaktivitě konkrétního pacienta. Klinicky zajímavou otázkou otevřenou pro další vědeckou práci představuje role konceptu ICD v identifikaci nových biomarkerů predikujících odpověď pacientů na protinádorovou léčbu. Z tohoto důvodu je třeba data získaná převážně v in vitro pokusech a in vivo zvířecích modelech ověřit v klinických studiích, charakterizovat roli jednotlivých DAMPs u rozličných malignit a snažit se najít korelaci s klinickým průběhem onemocnění markerů ICD. Na základě těchto výsledků pak může vzniknout protinádorová terapie šitá na míru konkrétnímu pacientovi, respektující typ daného nádorového mikroprostředí, benefit aplikované terapie a individuální reaktivitu imunitního systému léčeného pacienta (obr. 2).
Obr. 2. Využití imunogenní buněčné smrti v konceptu protinádorové terapie a možné strategie navození imunogenní buněčné smrti in vivo. 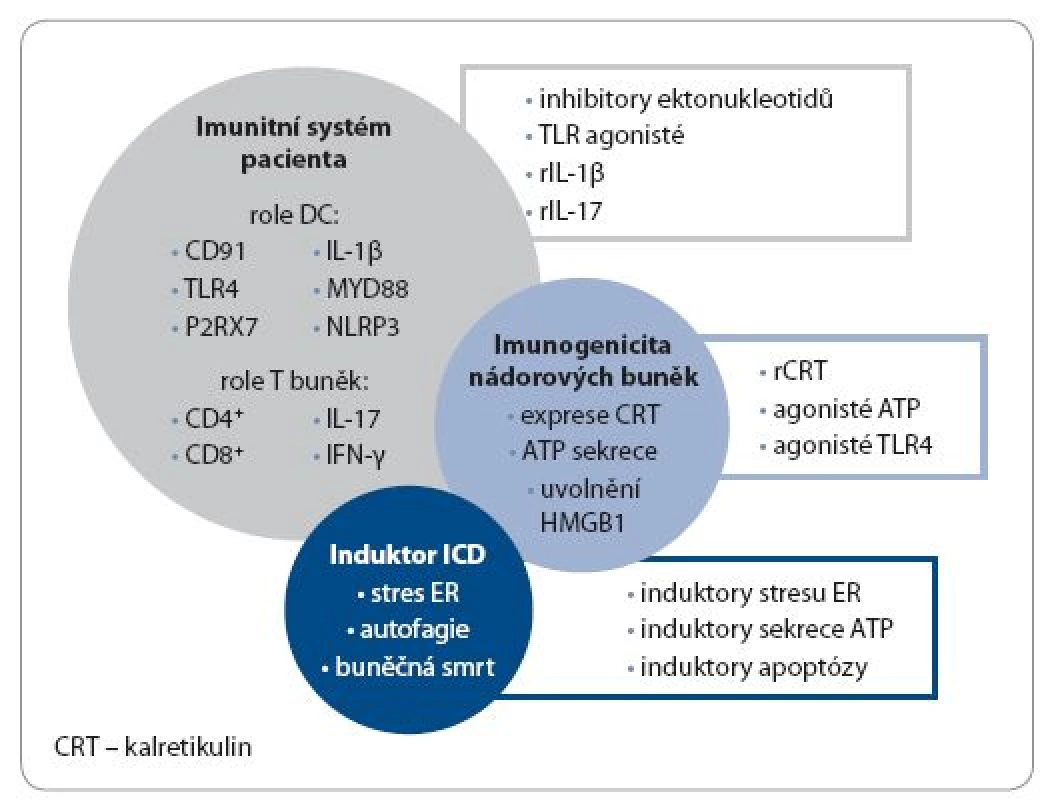
ICD je závislá na kombinaci tří faktorů: 1. typu induktoru buněčné smrti, 2. imunitním systému pacienta a 3. imunogenicitě nádorových buněk. Pouze adekvátní kombinace těchto tří parametrů navozuje optimální imunogenicitu nádorových buněk. Modality, které nejsou schopné indukovat expresi CRT jako důsledek stresu ER, uvolnění ATP na základě aktivace autofágie a HMGB1 molekuly v průběhu sekundární nekrózy, nejsou schopné indukovat ICD. Z podobného důvodu nádorové buňky defi cientní na mechanizmus exprese CRT, sekrece ATP a HMGB1 nemohou podlehnout ICD. V takových případech je možné kompenzovat tyto nedostatky pomocí rozličných přístupů, jak ukazuje obrázek, např. aplikací induktorů stresu ER přímo do nádorového ložiska, rekombinantním (r)CRT, inhibitory ektonukleotidů, agonistů P2RX7, rIL-17 a rIL-1β. Na základě těchto výsledků může vzniknout protinádorová terapie šitá na míru konkrétnímu pacientovi, respektující typ daného nádorového mikroprostředí, benefi t aplikované chemoterapie a imunitního systému léčeného pacienta. Upraveno a převzato: Kroemer et al [5]. Práce byla podpořena granty IGA MZ ČR – NT 12402-5 a MZ ČR – RVO, FN v Motole 00064203.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
PharmDr. Jitka Fučíková, Ph.D.
Ústav imunologie
2. LF UK a FN v Motolea Sotio a. s.
V Úvalu 84
150 06 Praha 5
e-mail: fucikova@sotio.com
Obdrženo: 29. 7. 2015
Přijato: 1. 10. 2015
Zdroje
1. Fridman WH, Pagès F, Sautès ‑ Fridman C et al. The immune contexture in human tumours: impact on clinical outcome. Nat Rev Cancer 2012; 12(4): 298 – 306. doi: 10.1038/ nrc3245.
2. Zitvogel L, Tesniere A, Kroemer G. Cancer despite immunosurveillance: immunoselection and immunosubversion. Nat Rev Immunol 2006; 6(10): 715 – 727.
3. Mittal D, Coutin MM, Schreiber RD et al. New insights into cancer immunoediting and its three component phases – elimination, equilibrium and escape. Curr Opin Immunol 2014; 27 : 16 – 25. doi: 10.1016/ j.coi.2014.01.004.
4. Green DR, Ferguson T, Zitvogel L et al. Immunogenic and tolerogenic cell death. Nat Rev Immunol 2009; 9(5): 353 – 363. doi: 10.1038/ nri2545.
5. Kroemer G, Galluzzi L, Kepp O et al. Immunogenic cell death in cancer therapy. Annu Rev Immunol 2013; 31 : 51 – 72. doi: 10.1146/ annurev ‑ immunol ‑ 032712 ‑ 100008.
6. Dudek AM, Garg AD, Krysko DV et al. Inducers of immunogenic cancer cell death. Cytokine Growth Factor Rev 2013; 24(4): 319 – 333. doi: 10.1016/ j.cytogfr.2013.01.005.
7. Garg AD, Nowis D, Golab J et al. Immunogenic cell death, DAMPs and anticancer therapeutics: an emerging amalgamation. Biochim Biophys Acta 2010; 1805(1): 53 – 71. doi: 10.1016/ j.bbcan.2009.08.003.
8. Garg AD, Dudek AM, Agostinis P. Cancer immunogenicity, danger signals, and DAMPs: what, when, and how? Biofactors 2013; 39(4): 355 – 367. doi: 10.1002/ biof.1125.
9. Panaretakis T, Kepp O, Brockmeier U et al. Mechanisms of pre‑apoptotic calreticulin exposure in immunogenic cell death. EMBO J 2009; 28(5): 578 – 590. doi: 10.1038/ emboj.2009.1.
10. Spisek R, Charalambous A, Mazumder A et al. Bortezomib enhances dendritic cell (DC) - mediated induction of immunity to human myeloma via exposure of cell surface heat shock protein 90 on dying tumor cells: therapeutic implications. Blood 2007; 109(11): 4839 – 4845.
11. Garg AD, Krysko DV, Verfaillie T et al. A novel pathway combining calreticulin exposure and ATP secretion in immunogenic cancer cell death. EMBO J 2012; 31(5): 1062 – 1079. doi: 10.1038/ emboj.2011.497.
12. Apetoh L, Ghiringhelli F, Tesniere A et al. The interaction between HMGB1 and TLR4 dictates the outcome of anticancer chemotherapy and radiotherapy. Immunol Rev 2007; 220 : 47 – 59.
13. Krysko DV, Vandenabeele P. From regulation of dying cell engulfment to development of anti‑cancer therapy. Cell Death Differ 2008; 15(1): 29 – 38.
14. Fucikova J, Kralikova P, Fialova A et al. Human tumor cells killed by anthracyclines induce a tumor ‑ specific immune response. Cancer Res 2011; 71(14): 4821 – 4833. doi: 10.1158/ 0008 ‑ 5472.CAN ‑ 11 ‑ 0950.
15. Fucikova J, Moserova I, Truxova I et al. High hydrostatic pressure induces immunogenic cell death in human tumor cells. Int J Cancer 2014; 135(5): 1165 – 1177. doi: 10.1002/ ijc.28766.
16. Obeid M, Tesniere A, Ghiringhelli F et al. Calreticulin exposure dictates the immunogenicity of cancer cell death. Nat Med 2007; 13(1): 54 – 61.
17. Krysko DV, Garg AD, Kaczmarek A et al. Immunogenic cell death and DAMPs in cancer therapy. Nat Rev Cancer 2012; 12(12): 860 – 875. doi: 10.1038/ nrc3380.
18. Apetoh L, Mignot G, Panaretakis T et al. Immunogenicity of anthracyclines: moving towards more personalized medicine. Trends Mol Med 2008; 14(4): 141 – 151. doi: 10.1016/ j.molmed.2008.02.002.
19. Michaud M, Martins I, Sukkurwala AQ et al. Autophagy ‑ dependent anticancer immune responses induced by chemotherapeutic agents in mice. Science 2011; 334(6062): 1573 – 1577. doi: 10.1126/ science.1208347.
20. Elliott MR, Chekeni FB, Trampont PC et al. Nucleotides released by apoptotic cells act as a find ‑ me signal to promote phagocytic clearance. Nature 2009; 461(7261): 282 – 286. doi: 10.1038/ nature08296.
21. Tesniere A, Schlemmer F, Boige V et al. Immunogenic death of colon cancer cells treated with oxaliplatin. Oncogene 2010; 29(4): 482 – 491. doi: 10.1038/ onc.2009.356.
22. Liu WM, Fowler DW, Smith P et al. Pre‑treatment with chemotherapy can enhance the antigenicity and immunogenicity of tumours by promoting adaptive immune responses. Br J Cancer 2010; 102(1): 115 – 123. doi: 10.1038/ sj.bjc.6605465.
23. Schiavoni G, Sistigu A, Valentini M et al. Cyclophosphamide synergizes with type I interferons through systemic dendritic cell reactivation and induction of immunogenic tumor apoptosis. Cancer Res 2011; 71(3): 768 – 778. doi: 10.1158/ 0008 ‑ 5472.CAN ‑ 10 ‑ 2788.
24. Nakahara T, Uchi H, Lesokhin AM et al. Cyclophosphamide enhances immunity by modulating the balance of dendritic cell subsets in lymphoid organs. Blood 2010; 115(22): 4384 – 4392. doi: 10.1182/ blood ‑ 2009 ‑ 11 ‑ 251231.
25. Podrazil M, Horvath R, Becht E et al. Phase I/ II clinical trial of dendritic ‑ cell based immunotherapy (DCVAC/ PCa) combined with chemotherapy in patients with metastatic, castration‑resistant prostate cancer. Oncotarget 2015; 6(20): 18192 – 18205.
26. Audia S, Nicolas A, Cathelin D et al. Increase of CD4+ CD25+ regulatory T cells in the peripheral blood of patients with metastatic carcinoma: a phase I clinical trial using cyclophosphamide and immunotherapy to eliminate CD4+CD25+ T lymphocytes. Clin Exp Immunol 2007; 150(3): 523 – 530.
27. Matar P, Rozados VR, Gervasoni SI et al. Th2/ Th1 switch induced by a single low dose of cyclophosphamide in a rat metastatic lymphoma model. Cancer Immunol Immunother 2002; 50(11): 588 – 596.
28. Demaria S, Santori FR, Ng B et al. Select forms of tumor cell apoptosis induce dendritic cell maturation. J Leukoc Biol 2005; 77(3): 361 – 368.
29. Schumacher LY, Vo DD, Garban HJ et al. Immunosensitization of tumor cells to dendritic cell-activated immune responses with the proteasome inhibitor bortezomib (PS ‑ 341, Velcade). J Immunol 2006; 176(8): 4757 – 4565.
30. Cirone M, Di Renzo L, Lotti LV et al. Primary effusion lymphoma cell death induced by bortezomib and AG 490 activates dendritic cells through CD91. PLoS One 2012; 7(3): e31732. doi: 10.1371/ journal.pone.0031732.
31. Begovic M, Herberman R, Gorelik E. Increase in immunogenicity and sensitivity to natural cell ‑ mediated cytotoxicity following in vitro exposure of MCA105 tumor cells to ultraviolet radiation. Cancer Res 1991; 51(19): 5153 – 5159.
32. Brusa D, Garetto S, Chiorino G et al. Post‑apoptotic tumors are more palatable to dendritic cells and enhance their antigen cross ‑ presentation activity. Vaccine 2008; 26(50): 6422 – 6432. doi: 10.1016/ j.vaccine.2008.08.063.
33. Wu S, Tan M, Hu Y et al. Ultraviolet light activates NFkappaB through translational inhibition of IkappaBalpha synthesis. J Biol Chem 2004; 279(33): 34898 – 34902.
34. Ma Y, Conforti R, Aymeric L et al. How to improve the immunogenicity of chemotherapy and radiotherapy. Cancer Metastasis Rev 2011; 30(1): 71 – 82. doi: 10.1007/ s10555 ‑ 011 ‑ 9283 ‑ 2.
35. Hodge JW, Ardiani A, Farsaci B et al. The tipping point for combination therapy: cancer vaccines with radiation, chemotherapy, or targeted small molecule inhibitors. Semin Oncol 2012; 39(3): 323 – 339. doi: 10.1053/ j.seminoncol.2012.02.006.
36. Obeid M, Panaretakis T, Joza N et al. Calreticulin exposure is required for the immunogenicity of gamma ‑ irradiation and UVC light‑induced apoptosis. Cell Death Differ 2007; 14(10): 1848 – 1850.
37. Huang J, Wang Y, Guo J et al. Radiation‑induced apoptosis along with local and systemic cytokine elaboration is associated with DC plus radiotherapy ‑ mediated renal cell tumor regression. Clin Immunol 2007; 123(3): 298 – 310.
38. Strome SE, Voss S, Wilcox R et al. Strategies for antigen loading of dendritic cells to enhance the antitumor immune response. Cancer Res 2002; 62(6): 1884 – 1889.
39. Garnett CT, Palena C, Chakraborty M et al. Sublethal irradiation of human tumor cells modulates phenotype resulting in enhanced killing by cytotoxic T lymphocytes. Cancer Res 2004; 64(21): 7985 – 7994.
40. Weiss EM, Meister S, Janko C et al. High hydrostatic pressure treatment generates inactivated mammalian tumor cells with immunogeneic features. J Immunotoxicol 2010; 7(3): 194 – 204. doi: 10.3109/ 15476911003657414.
41. Garg AD, Krysko DV, Vandenabeele P et al. Hypericin‑based photodynamic therapy induces surface exposure of damage‑associated molecular patterns like HSP70 and calreticulin. Cancer Immunol Immunother 2012; 61(2): 215 – 221. doi: 10.1007/ s00262 ‑ 011 ‑ 1184 ‑ 2.
42. Garg AD, Krysko DV, Vandenabeele P et al. DAMPs and PDT ‑ mediated photo ‑ oxidative stress: exploring the unknown. Photochem Photobiol Sci 2011; 10(5): 670 – 680. doi: 10.1039/ c0pp00294a.
43. Coffin RS. From virotherapy to oncolytic immunotherapy: where are we now? Curr Opin Virol 2015; 13 : 93 – 100. doi: 10.1016/j.coviro.2015.06.005.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2015 Číslo Supplementum 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Nejasný stín na plicích – kazuistika
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Nežádoucí účinky moderní imunoterapie a jejich řešení v klinické praxi
- Terapeutický efekt a tolerance ipilimumabu u metastatického maligního melanomu v dětském věku – kazuistika
- Protinádorové zbraně imunitního systému
- Úloha regulačních T buněk v protinádorové imunitní odpovědi
- Únikové strategie nádorů pozornosti imunitního systému
- Editorial
- Role imunoterapie v dětské onkologii
- Nádorová imunoterapie: Jsme na úsvitu nové éry?
- Chimérický antigenní receptor T lymfocytů – genová terapie budoucnosti u nádorových onemocnění?
- Význam imunogenní buněčné smrti v protinádorové imunitě
- Význam imunitního systému a možnosti imunoterapie u maligního melanomu
- Imunoterapie renálního karcinomu
- Význam imunitního systému a možnosti imunoterapie u karcinomu prostaty
- Dosavadní zkušenosti a perspektivy imunoterapie bronchogenního karcinomu
- Imunoterapie u bronchogenního karcinomu a její perspektivy
- Historie imunoterapie – od Coley toxinů ke kontrolním bodům imunitní reakce
- Immunoscore a jeho prediktivní hodnota u kolorektálního karcinomu
- Imunitní systém u pacientů s nádory hlavy a krku
- Imunoterapie uroteliálního karcinomu močového měchýře – od BCG vakcín k cílené imunoterapii
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Nežádoucí účinky moderní imunoterapie a jejich řešení v klinické praxi
- Imunoterapie uroteliálního karcinomu močového měchýře – od BCG vakcín k cílené imunoterapii
- Únikové strategie nádorů pozornosti imunitního systému
- Význam imunogenní buněčné smrti v protinádorové imunitě
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



