-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Terapeutický efekt a tolerance ipilimumabu u metastatického maligního melanomu v dětském věku – kazuistika
Therapeutic Effect and Tolerance of Ipilimumam in Metastatic Malignant Melanoma in Children – a Case Report
Background:
Malignant melanoma is a rare malignancy in the pediatric population. Etiology is usually unknown. Clinical symptoms are nonspecific, clinical behavior and biology features may differ from those in an adult population. The most important prognostic factor is spread of disease. Surgical resection is treatment of choice for localized melanoma. Advanced and metastatic melanoma is still an incurable disease.Case:
We are presenting an eight‑year ‑ old boy with metastatic malignant melanoma of unknown origin based on TP53 mutation (Li ‑ Fraumeni syndrome). He underwent surgery and adjuvant chemotherapy (temozolomide as single agent). Complete remission was achieved at the end of treatment. Two years after the end of therapy (and 31 months from diagnosis) he developed metastatic progression to the lungs. He has received immunotherapy with ipilimumab, according to our knowledge as the first child under the age of 12 in Europe. He completed three courses of ipilimumab, with irAE (immune related adverse event) grade III during the first course of anti CTLA ‑ 4. Therefore, further doses of ipilimumab were given with corticoids and antihistamines as premedication. Also, asymptomatic thyreoiditis grade II has been confirmed. The best documented treatment response is stable disease. Performance status was excellent. Three years since the first progression, he developed further massive progression to the lungs. Second line immunotherapy with anti‑PD ‑ 1 monoclonal antibody (pembrolizumab) is currently going on. So far, the overall survival of the patient is 74 months.Conclusion:
The presented case study supports the administration of immunotherapy in children younger than 12 years. Therapeutic effect has led to significant overall survival with tolerable toxicity. The problem remains significantly limited number of pediatric clinical trials using immunotherapy.Key words:
malignant melanoma – childhood cancer – immunotherapy
The author declares she has no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.Submitted:
20. 8. 2015Accepted:
23. 10. 2015
Autori: V. Bajčiová
Pôsobisko autorov: Klinika dětské onkologie LF MU a FN Brno
Vyšlo v časopise: Klin Onkol 2015; 28(Supplementum 4): 115-120
Kategória: Speciální část
doi: https://doi.org/10.14735/amko20154S115Súhrn
Východiska:
Maligní melanom je vzácný typ nádoru v dětské populaci. Příčiny vzniku často nejsou známé. Klinické příznaky jsou nespecifické, klinické chování a biologické znaky se liší od melanomu dospělé populace. Nejvýznamnějším prognostickým faktorem je rozsah nemoci. Pro lokalizovaný melanom je chirurgická resekce metodou volby, pokročilý a metastatický melanom patří mezi nevyléčitelné nemoci. Revoluční změny v léčbě melanomu přinesla protinádorová imunoterapie.Kazuistika:
Prezentujeme případ osmiletého chlapce s metastatickým maligním melanomem neznámého origa na základě mutace TP53 (Li ‑ Fraumeni syndrom). Absolvoval resekci metastázy a adjuvantní chemoterapii temozolomidem. Klinická remise byla dosažena na konci léčby. Dva roky od konce léčby byla potvrzena metastatická progrese do plic. Absolvoval imunoterapii ipilimumabem, dle našich informací jako první dítě mladší 12 let v Evropě. Celkem absolvoval indukční fázi a dvě reindukce ipilimumabu. Pro irAE (immune related adverse event) grade III byla další podání ipilimumabu s premedikací kortikoidy a antihistaminiky. Rozvinul rovněž asymptomatickou thyreoitidu. Nejlepší dokumentovaná odpověď byla stabilní nemoc. Celkový klinický stav byl excelentní. Po třech letech od první progrese dokumentována další masivní progrese v plicích, zahájil léčbu anti‑PD ‑ 1 monoklonální protilátkou (pembrolizumab), ve které aktuálně pokračuje. Celkově pacient přežívá 74 měsíců.Závěr:
Prezentovaná kazuistika podporuje podání imunoterapie u dětských pacientů mladších 12 let. Léčebný efekt vedl k výraznému prodloužení celkového přežití, toxicita je akceptovatelná. Problémem zůstává výrazně limitovaný počet klinických pediatrických studií s imunoterapií.Klíčová slova:
maligní melanom – dětské nádory – imunoterapieÚvod
Maligní melanom patří mezi velmi vzácná maligní onemocnění v období dětství a dospívání, přesto je nejčastějším typem kožního zhoubného nádoru u mladých lidí. Ze všech kožních maligních melanomů v populaci tvoří pacienti mladší 20 let pouze 1,3 – 2 % [1].
U mladé generace do 20 let věku je výrazná převaha výskytu melanomu u dívek, výjimkou jsou děti do pěti let věku, kde je maligní melanom častější u chlapců. Melanom je převážně lokalizován na horních a dolních končetinách a na trupu, kdežto u malých chlapců dominuje výskyt na hlavě a krku.
Příčina vzniku kožního maligního melanomu v dětském věku není známá. Maligní transformace může vzniknout spontánně, navíc děti mají několik dalších predispozičních a rizikových faktorů (familiární výskyt, široké spektrum benigních pigmentových névů, genetické faktory, trauma či poruchy imunity). Většina maligních melanomů u prepubertálních dětí a dospívajících vzniká de novo u zdravých jedinců, kteří nemají žádný z uvedených rizikových faktorů [1 – 3].
Klinické příznaky melanomu nejsou specifické a existuje celá řada kožních lézí v dětském věku, které mohou imitovat maligní melanom (benigní pigmentový névus, dysplastický névus, atypický blue névus, hemangiom, pyogenní granulom, veruky, Spitzové névus atd.) [2,3].
diagnostika maligního melanomu u dětí a dospívajících je svízelná, protože vzhledem k vzácnému výskytu, absenci všeobecně známých rizikových faktorů, atypické prezentaci a spoustě pigmentových névů se většinou na tuto diagnózu nemyslí.
Kazuistika
Chlapec ve věku osm let přichází na Kliniku dětské onkologie v červnu 2009 s klinickým nálezem lokalizované krční lymfadenopatie vpravo, bez systémových příznaků. Iniciálně proběhla exstirpace nejen zvětšené lymfatické uzliny, ale i přilehlých uzlin, velikost 45 × 40 × 15 mm. Histologie potvrdila metastázu maligního melanomu, tzv. animální typ, do lymfatické uzliny. Pouzdro uzliny bylo neporušené. Dalších šest uzlin bylo bez známek infiltrace. Melanom měl vysokou proliferační aktivitu s Ki-67 nad 50 %, bez angioinvaze. BRAF-V600E mutace nepotvrzena, hraniční amplifikace CCND1 (11q13) a MYB (6q13) (obr. 1). Sérové nádorové markery (LDH, NSE, S100B) byly negativní. Fototyp kůže I, na kůži několik drobných pigmentových névů v klidovém stadiu. Kompletní postoperační vyšetření včetně celotělového PET/ CT bylo negativní, neodhalilo primum melanomu ani další metastatická ložiska. Stav byl hodnocen jako pTx N2b M0, klinické stadium IIIC. Operací byla dosažena 1. kompletní klinická remise.
Obr. 1. Amplifikace genů CCND1, RREB1, MYB z tumoru. 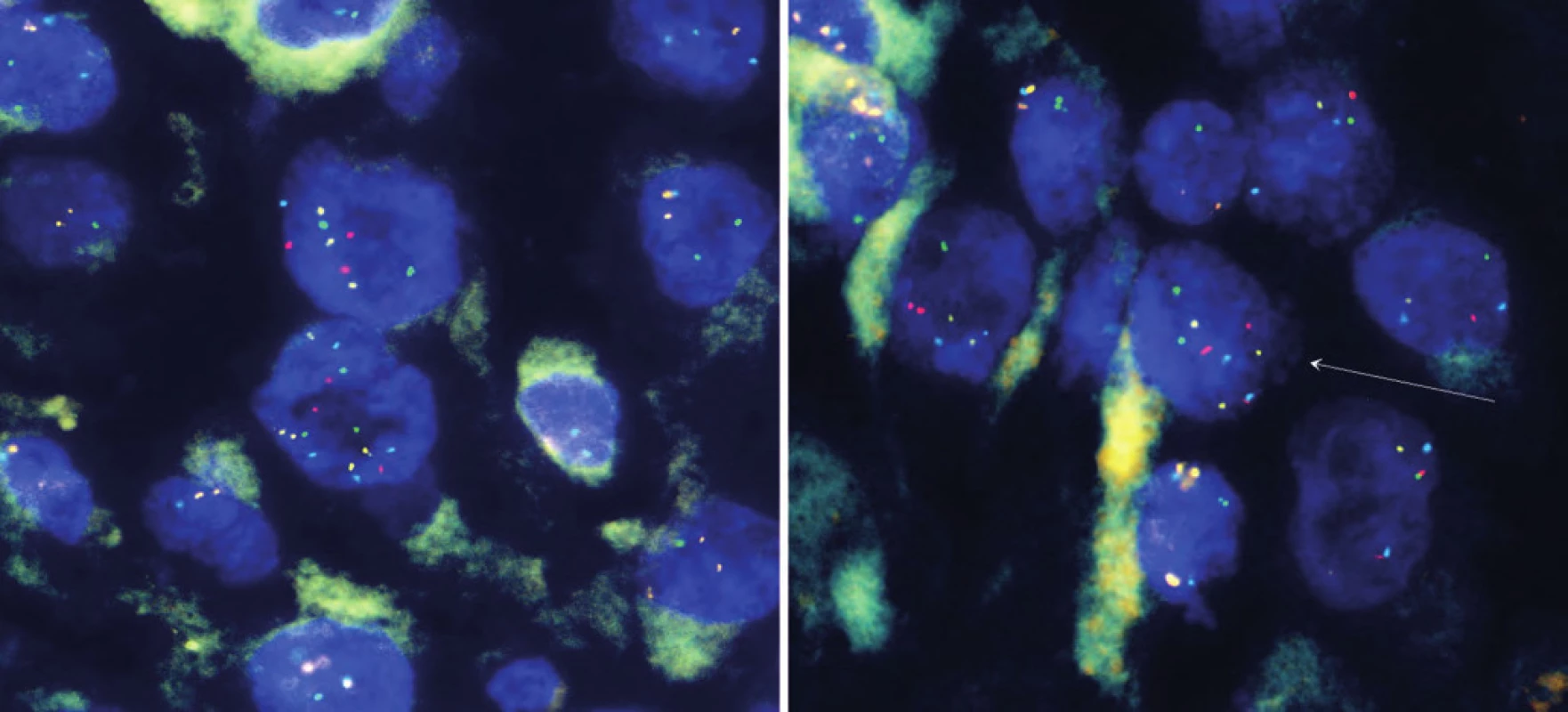
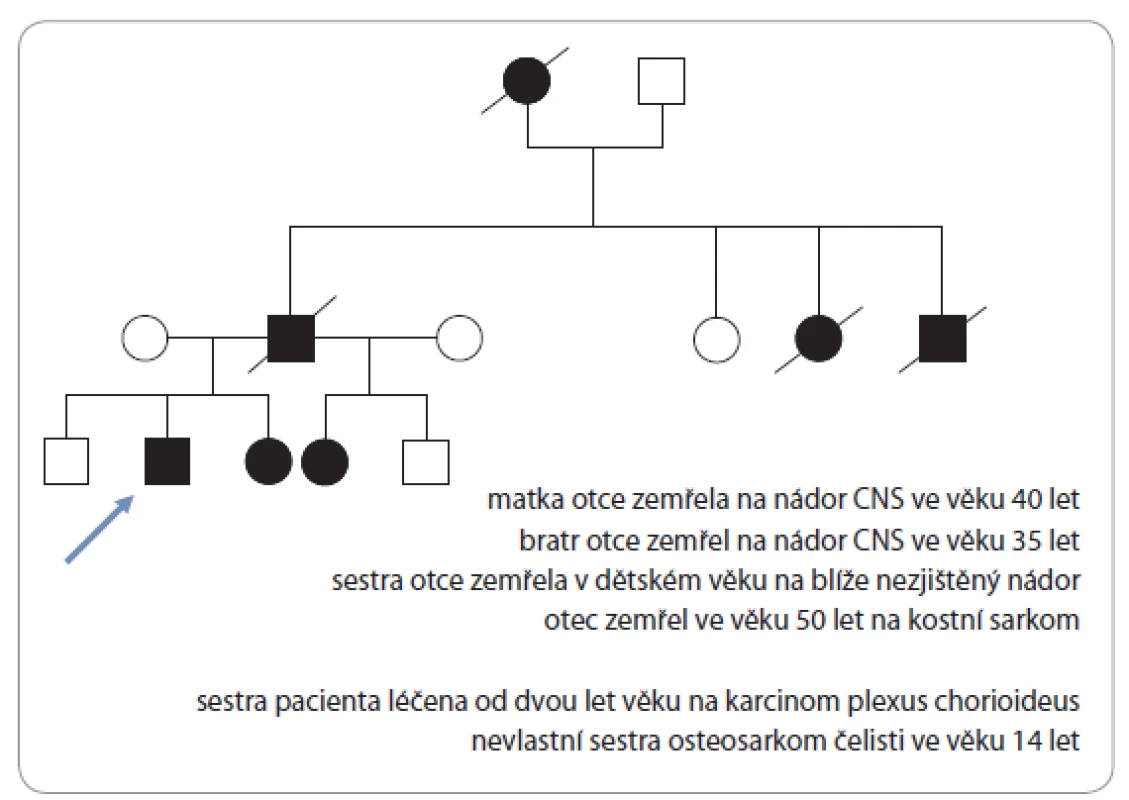
Možnou příčinu vzniku maligního melanomu u osmiletého chlapce na bázi genetické predispozice objasňuje rodinná anamnéza s potvrzenou germinální mutací TP53 genu a Li ‑ Fraumeni syndromem ze strany otce pacienta (obr. 2).
Dle v tom čase platného pediatrického protokolu CCLG (Childrens Cancer and Leukemia Group) pro pokročilý maligní melanom po operaci pacient absolvoval chemoterapii temozolomidem 200 mg/ m2 × 5 dní (6 bloků) s velmi dobrou tolerancí. Léčbu ukončil v prosinci 2009. Přešetření potvrdilo trvání 1. kompletní remise.
Dva roky od ukončení léčby (leden 2012) byla zjištěna lokální recidiva na krku vpravo, mediastinální lymfangoitida a mnohočetné bilaterální plicní metastázy (obr. 3).
Obr. 3. Lokální recidiva na krku, leden 2012. 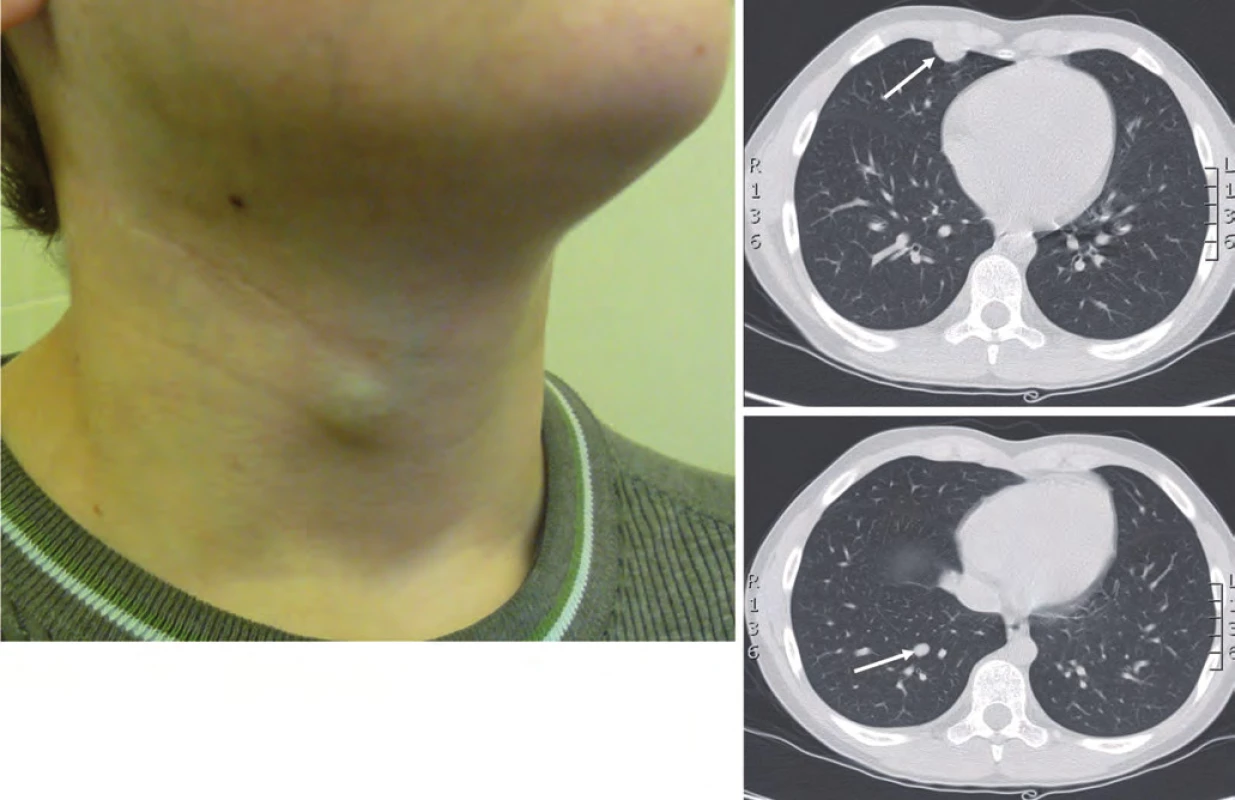
Exstirpace podkožní metastázy na krku vpravo (40 × 20 × 10 mm) potvrdila metastázu melanomu animálního typu výrazně produkující melanin. Osm regionálních lymfatických uzlin bylo bez známek infiltrace. Plicní metastázy byly operačně neřešitelné. Metastatická progrese byla 25 měsíců od ukončení léčby a 31 měsíců od diagnózy. Klinický stav pacienta byl excelentní, Lansky/ Karnofsky 100. Po náročném jednání stran udělení výjimky pro věk pod 18 let (pacient měl v tom čase 11 let) s plátci péče, SÚKL a centrem farmaceutické firmy v USA byla tato výjimka po 53 dnech jednání udělena a pacient byl zařazen do specifického léčebného programu jako první dítě v Evropě pod 12 let věku. V průběhu indukční fáze léčby 1. podání ipilimumabu proběhlo 20. 3. 2012 bez reakce. Při 2. podání pacient vyvinul hypersenzitivní reakci, třesavku, teplotu 38 °C s přechodnou hypotenzí. Hodnoceno jako irAE (immune related adverse event) grade III. Další (3. a 4.) podání ipilimumabu v rámci indukce s premedikací antihistaminiky a kortikoidy proběhlo bez reakce. Indukční fázi léčby ukončil 23. 5. 2012.
Opakované kontrolní vyšetření prokazují ústup lymfangoitidy, na CT vyšetření plicní metastázy velikostně stacionární, ale s postupným poklesem aktivity na 18 FDG PET scanu. Nejlepší dokumentovaná odpověď byla dosažena 24. týden od zahájení léčby ipilimumabem (obr. 4). Dle imunologických kritérií odpovědi na léčbu stav hodnocen jako stacionární (immune response stable disease – irSD).
Obr. 4. Nejlepší dosažená odpověď po 1. serii ipilimumabu. 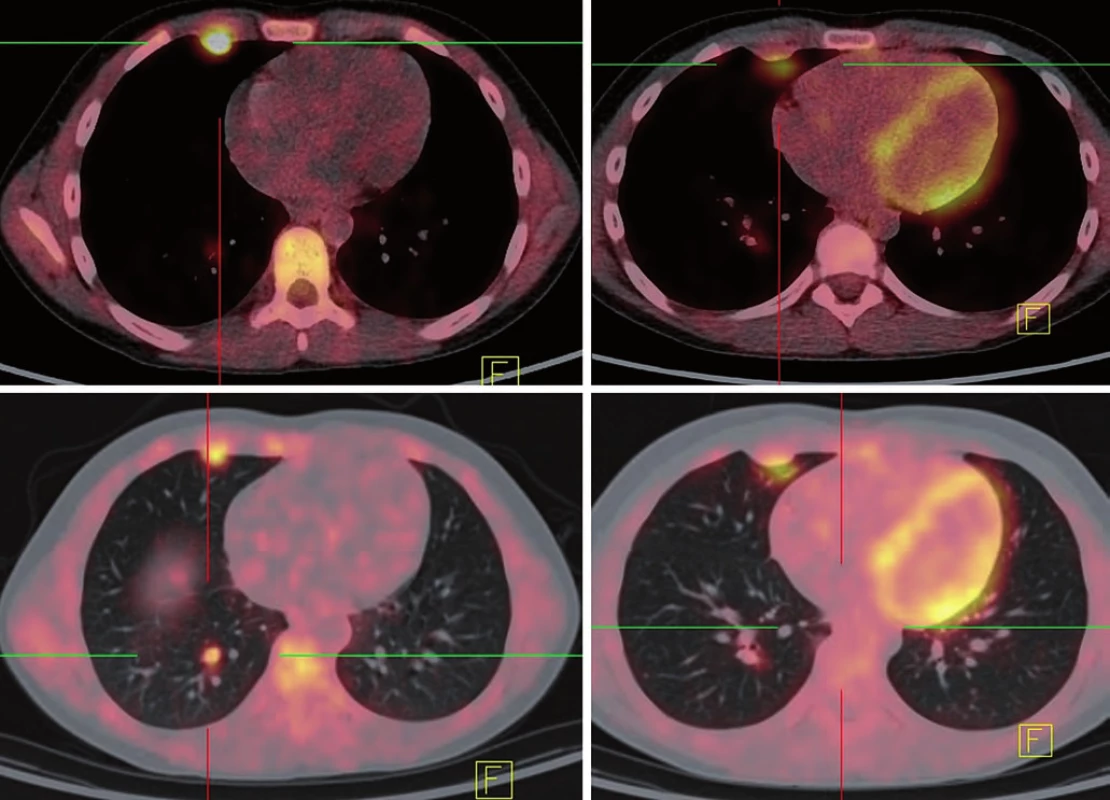
Pro nárůst aktivity na PET a mírné zvětšení plicních ložisek melanomu na CT pacient absolvoval ještě dva reindukční bloky ipilimumabu s dobrou tolerancí (leden 2013 a duben 2014).
V průběhu léčby byly monitorovány možné „immune related“ nežádoucí účinky a funkce štítné žlázy. pacient po celou dobu klinicky eutyreoidní, hormony a tyreoglobulin v normě. Na UZ vyšetření štítnice zachycena drobná hypoechogenní ložiska, stacionární v čase, vaskularizace žlázy v normě. Cytologické vyšetření prokázalo perifokální lymfocytární thyreoiditis grade II. Chlapec byl bez dalších známek autoimunitních nežádoucích reakcí.
V lednu 2015, po třech letech od první progrese, pacient přichází s teplotami do 39 °C, unavený, zchvácený, ve spádu léčen dvakrát antibiotiky pro bronchopneumonii. Na RTG plic a posléze celotělovém PET/ CT byla nalezena masivní progrese plicních ložisek více vpravo (obr. 5). V laboratoři vzestup nádorových markerů (LDH, S100B, NSE) a paraneoplastická hyperkalcemie. Ostatní orgány jsou dle PET/ CT nepostiženy. U pacienta indikujeme imunoterapii 2. linie, anti‑PD ‑ 1 monoklonální protilátku pembrolizumab v rámci specifického léčebného programu. Rodina ale volí alternativní způsob léčby (miracle mineral supplement – MMS). V dubnu 2015 přichází ve zhoršeném klinickém stavu, dušný, s další plicní progresí a masivním pleurálním výpotkem vpravo. Vyžaduje oxygenoterapii, analgoterapii, drenáž dutiny hrudní. Výpotek byl stran maligních buněk cytologicky negativní. Pro další zhoršení stavu pacient absolvoval radioterapii na oblast plicních ložisek v dávce 30 Gy (obr. 6).
Obr. 5. Progrese v plicích, leden 2015. 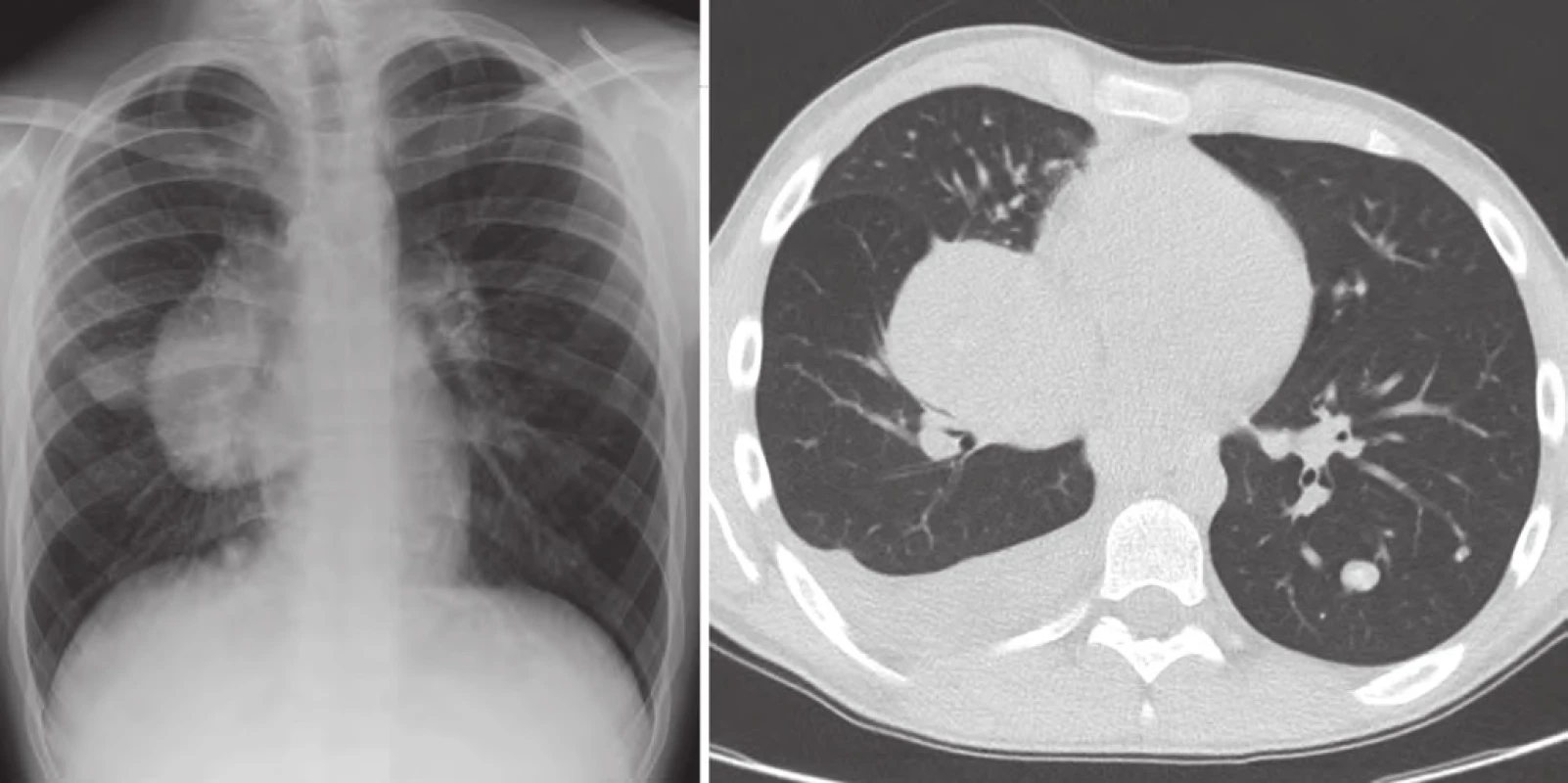
Obr. 6. Progrese v plicích a mediastinu, pleurální výpotek, duben 2015. 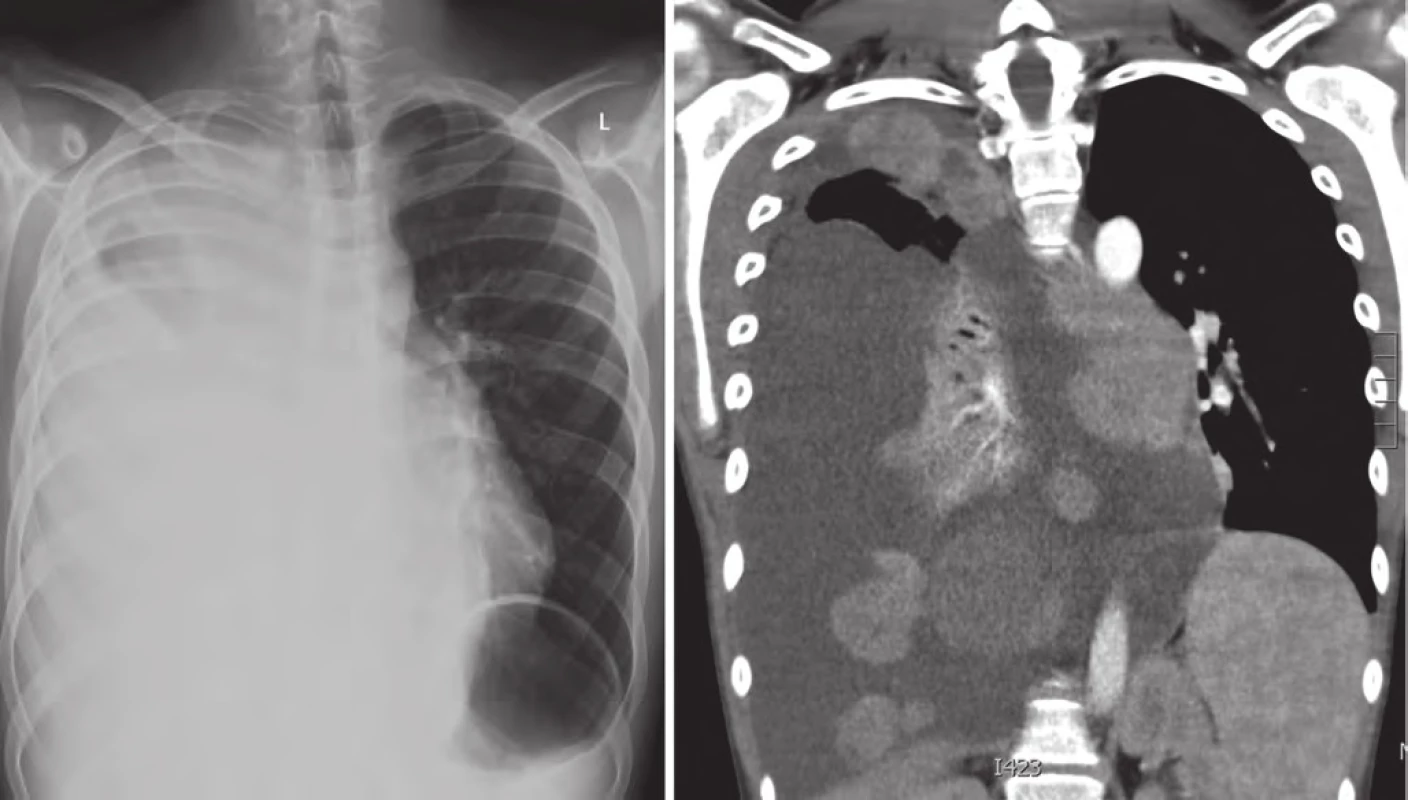
Léčbu pembrolizumabem zahájilv květnu 2015 s velmi dobrou tolerancí,bez vedlejších nežádoucích reakcí. Pozitivní klinický efekt pozorován po 3. dávcepembrolizumabu (ústup systémových příznaků, teplot, výrazné únavy, kašle a dyspnoe). V současnosti pokračuje v léčbě pembrolizumabem bez známek toxicity, opět začal chodit do školy, Lansky/ Karnofsky status 80. Celková doba přežití je 74 měsíců.
Diskuze
U maligního melanomu bez ohledu na věk výrazně platí závislost úspěšnosti léčby na časnosti záchytu. diagnostika v dětském věku není tak snadná, jak by se mohlo zdát, protože u dětí diagnostiku komplikuje množství jiných pigmentových kožních lézí, všeobecně známé rizikové faktory a expozice UV záření nejsou v dětském věku tak v popředí jako u dospělé populace [2,4,5].
Prognóza maligního melanomu závisí od více faktorů. Mezi negativní prognostické faktory patří klinické faktory (věk < 2 roky, mužské pohlaví, extrakončetinová lokalizace a pokročilá nemoc), faktory patologické (typ melanomu, jeho tloušťka, pozitivní vaskulární invaze, přítomnost ulcerace, vysoká proliferační aktivita, pozitivita sentinelové uzliny) a biologické faktory (familiárně podmíněný melanom s prokázanou mutací genu CDKN2A, BRAF-V600E mutace) [1,2,6].
Lokalizovaný maligní melanom je chirurgická nemoc, odstranění iniciálních fází melanomu vede ke skutečnému vyléčení. Pokročilý a metastatický maligní melanom je chemorezistentní a stále patří mezi nevyléčitelné nemoci. Revoluční změny v léčbě pokročilého maligního melanomu přineslo použití moderní imunoterapie v podobě monoklonálních protilátek (anti‑CTLA ‑ 4 monoklonální protilátka a anti-PD ‑ 1 monoklonální protilátka) a jejich kombinace. Ipilimumab, humánní anti-CTLA ‑ 4 protilátka, prokázala signifikantní prodloužení života u metastatického maligního melanomu [1,2,7 – 10]. Bohužel v čase onemocnění našeho pacienta byly všechny realizované klinické studie projektovány pouze pro dospělý věk s dolní věkovou hranicí 18 let a trvala absence pediatrické klinické studie s ipilimumabem, takže pro děti byla tato léčba prakticky nedostupná.
Maligní melanom je nádor s nejširším spektrem mutací signálních drah, a proto probíhá celá řada klinických studií s cílenou léčbou [1,7,11], bohužel existuje dosud pouze jediná klinická studie pro BRAF-V600E pozitivní pokročilé melanomy s vemurafenibem v dětském věku. Prognózu maligního melanomu u dětí a dospívajících je přes všechny poznatky moderní onkologie obtížné predikovat. Nejvýznamnějším prognostickým faktorem nadále zůstává především rozsah nemoci. Deset let přežívá více než 85 % dětských pacientů s lokalizovaným maligním melanomem, ale pouze 10 % s pokročilým a metastatickým maligním melanomem [1,6,7].
Závěr
Diagnostika a léčba pediatrického maligního melanomu teoreticky není zásadně odlišná od postupů doporučených v dospělé onkologii, ovšem dosud je výrazný nepoměr mezi počtem klinických studií v dospělém věku a počtem pediatrických studií. Chybí případné snížení věkové hranice pro zařazení do studie moderní imunoterapie dospělého věku. pacienti mladší 18 let nemají stejný přístup k novým lékům jako dospělí pacienti, a proto jejich šance na přežití jsou výrazně menší jenom proto, že jsou mladší. V současnosti existují pro dětskou populaci pouze tři klinické pediatrické studie s ipilimumabem a jedna klinická studie s vemurafenibem. Dolní věkový limit pro pediatrické studie s ipilimumabem je 12 let. Prezentovaná kazuistika podporuje podání ipilimumabu u dětí mladších 12 let s dobrým terapeutickým efektem a akceptovatelnou toxicitou. Imunoterapie 2. linie (anti‑PD ‑ 1 monoklonální protilátky) je nově dostupná v rámci specifického léčebného programu pro dětské pacienty s pokročilým maligním melanomem. Dosud trvá absence pediatrických klinických studií s cílenou léčbou a kombinovanou imunoterapií.
Autorka deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Viera Bajčiová, CSc.
Klinika dětské onkologie
LF MU a FN Brno
Černopolní 9
625 00 Brno
e-mail: vbajciova@fnbrno.cz
Obdrženo: 20. 8. 2015
Přijato: 23. 10. 2015
Zdroje
1. Bajčiová V. Maligní melanom u dětí a adolescentů. Onkologie 2013; 7(2): 69 – 73.
2. Réguerre Y, Afrik MF, Fraitag S et al. Melanoma in children: diagnosis and treatment specificities. Bull Cancer 2012; 99(9): 881 – 888. doi: 10.1684/ bdc.2012.1628.
3. Cordoro KM, Gusta D, Frieden IJ et al. Pediatric melanoma: results of a large cohort study and propsal for modified ABCD detection criteria for children. J Am Acad Dermatol 2013; 66(2): 913 – 925. doi: 10.1016/ j.jaad.2012.12.953.
4. Paradela S, Foncesa E, Pit ‑ Fernandéz S et al. Prognostic factors for melanoma in children and adolescents. Cancer 2010; 116(18): 4334 – 4344. doi: 10.1002/ cncr.25222.
5. Livestro DP, Kaine EM, Michaelson JS et al. Melanoma in the young: differences and similarities with adult melanoma. Cancer 2007; 110(3): 614 – 624.
6. Neier M, Pappo A, Navid F. Management of melanomas in children and young adults. J Ped Hematol Oncol 2012; 34 (Suppl 2): S51 – S54. doi: 10.1097/ MPH. 0b013e31824e3852.
7. Munzarová M. Ultrafialové záření, pigmentace a maligní melanom. Klin Onkol 1991; 4(4): 99 – 101.
8. Eckschlager T. Má imunoterapie své místo v současné dětské onkologii? Klin Onkol 2003; 16 (Suppl): 125 – 126.
9. Delyon J, Maio M, Lebbé C. The ipilimumab lesson in melanoma: achieving long‑term survival. Semin Oncol 2015; 42(3): 387 – 401. doi: 10.1053/ j.seminoncol.2015.02.005.
10. Homet Moreno B, Parisi G, Robert L et al. Anti PD ‑ 1 therapy in melanoma. Semin Oncol 2015; 42(3): 466 – 473. doi: 10.1053/ j.seminoncol.2015.02.008.
11. Liu LK, Colegio OR. Molecularly targeted therapies for melanoma. Int J Dermatol 2013; 52(5): 523 – 530. doi: 10.1111/ j.1365 ‑ 4632.2012.05829.x.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2015 Číslo Supplementum 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Nežádoucí účinky moderní imunoterapie a jejich řešení v klinické praxi
- Terapeutický efekt a tolerance ipilimumabu u metastatického maligního melanomu v dětském věku – kazuistika
- Protinádorové zbraně imunitního systému
- Úloha regulačních T buněk v protinádorové imunitní odpovědi
- Únikové strategie nádorů pozornosti imunitního systému
- Editorial
- Role imunoterapie v dětské onkologii
- Nádorová imunoterapie: Jsme na úsvitu nové éry?
- Chimérický antigenní receptor T lymfocytů – genová terapie budoucnosti u nádorových onemocnění?
- Význam imunogenní buněčné smrti v protinádorové imunitě
- Význam imunitního systému a možnosti imunoterapie u maligního melanomu
- Imunoterapie renálního karcinomu
- Význam imunitního systému a možnosti imunoterapie u karcinomu prostaty
- Dosavadní zkušenosti a perspektivy imunoterapie bronchogenního karcinomu
- Imunoterapie u bronchogenního karcinomu a její perspektivy
- Historie imunoterapie – od Coley toxinů ke kontrolním bodům imunitní reakce
- Immunoscore a jeho prediktivní hodnota u kolorektálního karcinomu
- Imunitní systém u pacientů s nádory hlavy a krku
- Imunoterapie uroteliálního karcinomu močového měchýře – od BCG vakcín k cílené imunoterapii
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Nežádoucí účinky moderní imunoterapie a jejich řešení v klinické praxi
- Imunoterapie uroteliálního karcinomu močového měchýře – od BCG vakcín k cílené imunoterapii
- Únikové strategie nádorů pozornosti imunitního systému
- Význam imunogenní buněčné smrti v protinádorové imunitě
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy