-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Průvodce mladého onkologa infuzní terapií a výživou
Díl 3 – Hypomagnezemie a hypofosfatemie. Realimentace. Kazuistika 3
Submitted:
27. 5. 2016
Autoři: F. Novák; E. Meisnerová
Působiště autorů: Nutriční ambulance, IV. interní klinika 1. LF UK a VFN v Praze
Vyšlo v časopise: Klin Onkol 2016; 29(3): 225-228
Kategorie: Aktuality v onkologii
Souhrn
Submitted:
27. 5. 2016Minerálové minimum – hypomagnezemie a hypofosfatemie
Hypomagnezemie a hypofosfatemie patří mezi minerálové poruchy, které – ač jsou časté –, unikají pozornosti. Vyšetřování hladin hořčíku a fosforu je laboratorně běžně dostupné a jejich stanovení vstupně nebo v průběhu další léčby má velký význam pro včasný záchyt uvedených poruch a správnou substituci minerálů. Přesto se tato vyšetření často neindikují. Nekorigované deficity hořčíku i fosforu potom bohužel výrazně zhoršují prognózu nemocného v důsledku zvýšeného výskytu často závažných komplikací. Potřebu monitorace hladin těchto minerálů podtrhují i velmi nespecifické projevy jejich nedostatku. U obou poruch je typická zejména svalová slabost, kterou lze snadno podcenit a svést na základní onemocnění.
Příčiny nedostatku hořčíku a fosforu můžeme obecně rozdělit do tří skupin: 1. nedostatečný příjem, resp. vstřebávání z gastrointestinálního traktu, 2. zvýšené ztráty ledvinami a 3. tělesná redistribuce těchto převážně intracelulárních minerálů. Ke ztrátám močí mohou navíc přispívat i medikamenty. Hypomagnezemie je typická pro thiazidová diuretika, ale i některé druhy chemoterapie, např. u režimů s cisplatinou nebo cetuximabem. Naopak fosfáty se zvýšeně ztrácejí při léčbě sorafenibem nebo imatinibem. Zvýšené ztráty ledvinami od ostatních příčin hypomagnezemie a hypofosfatemie poměrně snadno odlišíme průkazem vyšších močových odpadů nebo ještě lépe přímo výpočtem exkreční frakce příslušného minerálu do moči, která je v těchto případech samozřejmě vyšší.
Redistribuční poruchy rovnováhy magnezia a fosfátů jsou etiologicky nejčastější a z časového hlediska velmi zákeřné. Typicky vznikají v souvislosti s realimentací těžce podvyživených nebo jinak rizikových pacientů (tab. 1). Přesuny do intracelulárního prostoru doprovázené prudkým poklesem sérových hladin nastávají v řádu několika hodin, maximálně dnů po zahájení realimentace bez ohledu na enterální nebo parenterální cestu podávání živin. Pokud je deplece intracelulárních minerálů výrazná a realimentace příliš překotná, hrozí rozvoj realimentačního syndromu, viz níže.
Substituce magnezia je díky dobré dostupnosti řady perorálních preparátů poměrně snadná. U lehčích hypomagnezemií > 0,5 mmol/ l obvykle stačí perorálně podávat 300 – 500 mg magnezia: 1 sáček Magnosolv obsahuje 365 mg Mg2+ (15 mmol), 1 tableta Magnesium Lactate Biomedica 51 mg Mg2+ (2 mmol). Pro těžší a symptomatické hypomagnezemie (< 0,5 mmol/ l) užíváme parenterální roztoky 10% nebo 20% magnesium sulfátu (1 ampule/ 10 ml obsahuje 4 nebo 8 mmol Mg2+), obvyklá dávka je 1 – 2 ampule/ 24 hod, případně i více k dosažení úpravy hladin alespoň nad 0,4 mmol/ l. U substituce magnezia je třeba počítat s poměrně dlouhou zpětnou redistribucí do intracelulárního kompartmentu, která trvá i několik dní. Proto v úvodu léčby tolerujeme vyšší plazmatické hladiny magnezia. U perorální suplementace také musíme počítat s obecně horší dostupností magnezia z preparátů, které obsahují oxid hořečnatý, v porovnání s jinými solemi. Forma a dávkování jsou důležité, protože nevstřebané magnezium může způsobit gastrointestinální obtíže ve smyslu průjmů. Zejména laktát je dobře tolerovaný při dlouhodobé preventivní substituci.
Z farmaceutického hlediska je složitější substituce fosforu. Pro perorální ani parenterální substituci fosfátů nejsou hromadně vyráběná monokomponentní léčiva v ČR registrována, a tak jsme v praxi odkázáni především na magistraliter přípravky z lékáren. Lehké hypofosfatemie lze zvládnout perorální substitucí pomocí magistraliter kapslí s obsahem 250 mg (cca 7,5 mmol) nejčastěji sodných nebo draselných fosfátů. Případně s výhodou využíváme i potraviny se zvýšeným obsahem fosforu. Například tavené sýry díky přídavku tzv. tavicích solí obsahují podle druhu 700 – 1 200 mg fosfátů na 100 g výrobku, což představuje cca 20 – 34 mmol, tj. významně více, než by odpovídalo obsahu fosfátů v surovině (100 mg fosfátů (3 mmol)/ 100 ml mléka). Pro těžké a zejména symptomatické hypofosfatemie (< 0,32 mmol/ l v plazmě) jsou potom k dispozici jednomolární (1 mmol/ 1 ml) magistraliter 13,6% roztoky KH2PO4 nebo směs 8,7% Na2HPO4 a NaH2PO4, kterými lze podat podle potřeby dávku až 50 mmol/ 24 hod a při monitoraci v rámci pobytu na JIP i více. Pozor! Substituční formy magnezia nebo kalcia by se s fosfáty neměly kombinovat pro riziko tvorby nerozpustných sraženin, které nemusíme vždy odhalit. To platí jak pro perorální, tak i pro nitrožilní aplikace.
Nutriční minimum – realimentace
V úvodu realimentace, zejména při náhlém obnovení příjmu nutrientů a energie po delším období hladovění, dochází k významným metabolickým a hormonálním změnám. Dramatické mohou být tyto změny u pacientů s těžší, především chronickou podvýživou, u kterých je však zachován anabolický potenciál. Toto se týká pacientů napříč diagnostickým spektrem, protože průběh realimentace ovlivňuje spíše stav tělesných zásob a intenzita zánětlivé odpovědi než konkrétní diagnóza. Přívod živin s nárůstem glykemie stimuluje sekreci inzulinu, zvyšuje metabolický obrat a syntetickou aktivitu v buňkách. Přitom stoupá potřeba intracelulárních iontů, zejména fosfátů, magnezia, draslíku a mikronutrientů, které fungují jako enzymové kofaktory, to platí zejména pro vitamin B1. U rizikových pacientů v případě nevhodně vyváženého poměru živin hrozí dokonce rozvoj realimentačního syndromu. Celkový klinický obraz této závažné komplikace je především výsledkem deplece fosforu, draslíku a magnezia, karence thiaminu a retence sodíku. Pokud tento nežádoucí průběh realimentace není včas lékařem zachycen, může dojít k rozvoji řady metabolických a orgánových dysfunkcí. K těm nejzávažnějším komplikacím, jež pacienta ohrožují přímo na životě, patří zejména srdeční selhání, porucha funkce dýchacích svalů a metabolická acidóza. Realimentační syndrom je dále spojen např. s vyšším rizikem vzniku infekcí, anémií, zvýšenou tvorbou otoků, křečemi aj.
Správné zahájení a další průběh realimentace se odvíjí od individuálního zhodnocení nutričního stavu a rozpoznání pacientů s rizikem rozvoje realimentačního syndromu (tab. 1). U rizikových pacientů na úvod indikujeme redukovanou dávku makronutrientů spolu s intenzivní substitucí magnezia, kalia, fosfátů a mikronutrientů vč. zvýšené dávky vitaminu B1 (tab. 2). Jakmile se realimentační projevy zmírní, můžeme přejít k plné dávce potřebných živin. Tato situace nastává typicky do jednoho týdne od zahájení výživy. Při potřebě intenzivní realimentace indikujeme u rizikových pacientů monitoraci na lůžkách intenzivní metabolické péče.
Tab. 1. Vyhledávání pacientů ve vysokém riziku rozvoje realimentačního syndromu. 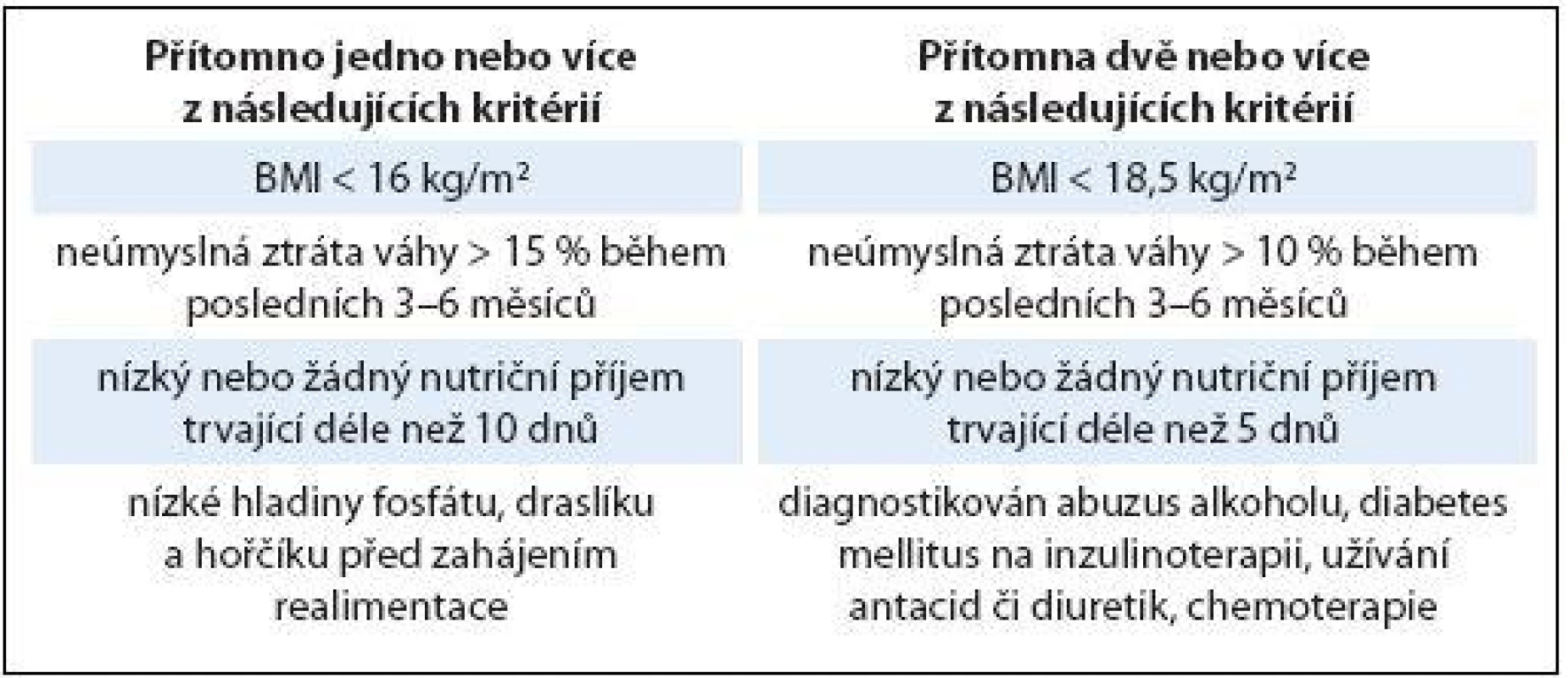
Upraveno dle [1]. Tab. 2. Realimentace u pacientů s vysokým rizikem rozvoje realimentačního syndromu. 
Upraveno dle [1]. Kazuistika 3 – případ zbytečně komplikované realimentace
Pacientka, 64 let, cirhotička s diagnostikovaným karcinomem kořene jazyka s infiltrací svalů spodiny ústní byla v době popisované urgentní události, tj. 1/ 2015, necelých 10 měsíců po radikální radioterapii. V průběhu několika měsíců od ukončené radioterapie se objevily obtíže při polykání, které se zhoršovaly. Došlo postupně k poklesu tělesné hmotnosti o 12 kg (hmotnost 42 kg, 156 cm, tj. BMI 17,3 z původních 22,3). Celkový příjem živin per os byl u pacientky dlouhodobě nedostatečný, a proto byla po půl roce odeslána do nutriční ambulance. Zde byla indikována sondová enterální výživa. Zavedení perkutánní endoskopické gastrostomie (PEG) však bylo opakovaně odkládáno z důvodu obav pacientky, resp. ošetřujícího lékaře z možných komplikací výkonu. Výsledkem bylo opakované zavádění tenkých nazogastrických sond. Enterální sondová výživa však byla často přerušována po náhodných extrakcích nebo obstrukcích sondy. Když nakonec pacientka po dvou měsících přesvědčování souhlasila se zavedením PEG, přesáhla ztráta tělesné hmotnosti již 20 % původní hodnoty. Zavedení PEG proběhlo zcela nekomplikovaně během krátké hospitalizace. Po náležité edukaci v ošetřování stomie a v aplikaci polymerní hyperkalorické enterální výživy byla pacientka druhý den po výkonu propuštěna do domácího ošetřování. Při odchodu dostala doporučení postupně navyšovat dávky enterální výživy dle tolerance tak, aby za jeden týden plynule dosáhla energetického cíle 1 750 kcal. Za tři dny od dimise kontaktoval manžel pacientky telefonicky nutriční ambulanci a oznamoval, že již včera dosáhl cílové dávky výživy a že manželka nemá žádné zažívací obtíže. Na konci telefonátu naštěstí ještě zmínil, že manželka je od propuštění stále spavější a že dnes už mu nejde dobře probudit. Na doporučení lékaře nutriční ambulance manžel okamžitě zavolal záchrannou službu a pacientka byla urgentně přivezena k hospitalizaci těžce somnolentní s výraznou svalovou slabostí a hyposaturací. Ve vstupní laboratoři byla zachycena kalemie 1,9 mmol/ l, fosfatemie 0,45 mmol/ l a magnezemie 0,49 mmol/ l. Po korekci mineralogramu pomocí infuzní léčby se stav vědomí i ostatní příznaky rychle upravily. Jako příčina stavu byl diagnostikován realimentační syndrom při příliš rychlé realimentaci a neadekvátní minerálové substituci. Enterální výživu do PEG bylo možné prakticky ihned obnovit a pacientka byla propuštěna domů již po několika dnech. Při cíleném dotazování se posléze ukázalo, že manžel aplikoval 120 % dávky, která byla plánovaná po jednom týdnu, už třetí den. Kazuistika měla naštěstí dobrý konec, ale nikdo jsme raději nedomýšleli, co by se bývalo mohlo stát, kdyby manžel nezavolal. Přitom by pravděpodobně stačilo při první dimisi neopomenout perorální substituci minerálů, vitaminů a stopových prvků.
Tato aktualita byla podpořena společností Baxter.
MUDr. František Novák, Ph.D.
Nutriční ambulance
IV. interní klinika
1. LF UK a VFN v Praze
U Nemocnice 2
128 08 Praha 2
e-mail: fnova@lf1.cuni.cz
Obdrženo: 27. 5. 2016
Zdroje
1. NICE.org.uk [online]. Nutrition support for adults: oral nutrition support, enteral tube feeding and parenteral nutrition. Available from: ww.nice.org.uk/ guidance/ cg32.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2016 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
- Nejasný stín na plicích – kazuistika
- Geriatrická křehkost a léčba bolesti
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
-
Všetky články tohto čísla
- Editorial
- História onkológie na Slovensku
- Diagnóza Lynchova syndromu od patologa
- Současné možnosti predikce odpovědi na cílenou anti-EGFR léčbu metastatického kolorektálního karcinomu
- Vyhodnocení výživových zvyklostí ve studii karcinomu pankreatu
- Vliv předoperační radiochemoterapie na hustotu CD8+ tumor infiltrujících lymfocytů adenokarcinomu rekta
- Mapování psychologického distresu po 4,5 letech u pacientek s diagnózou karcinomu prsu v porovnání se zdravou populací
- Ložisková amyloidóza v dutině nosní
- Karcinoid z pohárkových buněk apendixu metastazovaný do orbity – klinická kazuistika a přehled literatury
-
Průvodce mladého onkologa infuzní terapií a výživou
Díl 3 – Hypomagnezemie a hypofosfatemie. Realimentace. Kazuistika 3 - SOUTĚŽ NA PODPORU AUTORSKÝCH TÝMŮ PUBLIKUJÍCÍCH V ZAHRANIČNÍCH ODBORNÝCH TITULECH
- SOUTĚŽ O NEJLEPŠÍ PRÁCI
- Aktuality z odborného tisku
- MUDr. Eva Siracká, DrSc. – prvá dáma rádioterapie na Slovensku jubiluje
- Doc. MUDr. Juraj Kaušitz, CSc. – 70-ročný
-
Onkologie v obrazech
Karcinom prsu s aktivní imunoeditací a aktivací imunitní kontrolní dráhy PD-L1/ PD-1 - Informace z České onkologické společnosti
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle-
Průvodce mladého onkologa infuzní terapií a výživou
Díl 3 – Hypomagnezemie a hypofosfatemie. Realimentace. Kazuistika 3 - História onkológie na Slovensku
- Diagnóza Lynchova syndromu od patologa
- Doc. MUDr. Juraj Kaušitz, CSc. – 70-ročný
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



