-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Glycin-N-metyltransferáza a nádorová onemocnění prostaty
Glycine-N-methyltransferase and Malignant Diseases of the Prostate
Background:
Prostate cancer (PC) constitutes a heterogeneous group of diseases with high prevalence rates that are still increasing, particularly in western countries. Since 1980, prostate specific antigen (PSA) and other diagnostic approaches have been used for PC screening; however, some of these approaches are often deemed painful and cause invasive damage of tissue. Therefore, molecular approaches to PC diagnosis are attracting increasing attention, potentially providing patients with less stressful situations and providing better diagnoses and even prognostic information. Recent metabolomic and genomic studies have suggested that biomolecules can be used as diagnostic or prognostic markers or as targets for the development of novel therapeutic modalities. One of these molecules is glycine-N-methyltransferase (GNMT), an enzyme that plays a pivotal role in the biochemical conversion of glycine to sarcosine. The link between this molecule (encoded by homonymous gene – GNMT) and PC has been confirmed at several levels, and thus GNMT can be considered a promising target for the development of advanced diagnostic and/or prognostic approaches.Aim:
The aim of this study was to analyse the physiological role of GNMT and to examine in greater detail its connection with PC at different levels, including gene structure, gene expression, and metabolism, in which GNMT plays an important role, not only in controlling the methylation status of cells, but also the metabolism of folic acid and methionine. Last but not least, we discuss the importance of cellular methylation processes and the link between their aberrations and PC development.Key words:
glycine – folic acid – metabolism – methylation – sarcosine
This work was supported by GA CR 16-18917S, League against Cancer Prague (project 2022015) and Czech Ministry of Health – RVO, UH Motol 00064203.
The authors declare they have no potential confl icts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.Submitted:
9. 2. 2016Accepted:
20. 3. 2016
Autoři: Z. Heger 1,2; T. Eckschlager 3; M. Stiborová 4; V. Adam 1,2
Působiště autorů: Ústav chemie a biochemie, Agronomická fakulta Mendelovy univerzity v Brně 1; CEITEC – Středoevropský technologický institut, VUT v Brně 2; Klinika dětské hematologie a onkologie 2. LF UK a FN v Motole, Praha 3; Katedra biochemie, Přírodovědecká fakulta UK v Praze 4
Vyšlo v časopise: Klin Onkol 2016; 29(5): 331-335
Kategorie: Přehledy
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amko2016331Souhrn
Východiska:
Nádory prostaty (prostate cancer – PC) tvoří heterogenní skupinu onemocnění s vysokou mírou prevalence, jenž v populaci západních zemí neustále stoupá. Od roku 1980 je pro sledování stavu nádorového onemocnění prostaty používáno stanovení prostatického specifického antigenu (PSA) v krevním séru následované dalšími diagnostickými postupy. Avšak relativní spolehlivost těchto vyšetření je vykoupena nepříjemným, invazivním poškozením tkáně. Proto se neustále hledají molekuly, které by mohly tyto stresové situace eliminovat a zvýšit tak záchyt PC nebo dokonce poskytnout informace o vývoji a průběhu onemocnění. V nynější době ukazují metabolomické a genomické studie, že některé biomolekuly mohou být využity pro zlepšení diagnosticko-prognostických možností a/nebo mohou být dokonce vhodným cílem pro vývoj nových terapeutických modalit. Jednou z těchto biomolekul je enzym glycin-N-metyltransferáza (GNMT), jenž hraje důležitou roli v biochemické konverzi glycinu na sarkosin. Souvislost této molekuly, ale také stejnojmenného genu, který ji kóduje (GNMT), s PC byla prokázána na několika úrovních a lze ji tak považovat za jeden ze slibných cílů pro návrh nových diagnosticko-prognostických přístupů.Cíl:
Cílem práce je popsat fyziologickou roli a dále sumarizovat propojení mezi GNMT a PC, a to jak na úrovni genové struktury, genové exprese tohoto enzymu, tak na úrovni metabolizmu, který GNMT katalyzuje, čímž řídí nejen metylační status buňky, ale také metabolizmus kyseliny listové či methioninu. V neposlední řadě je též diskutována důležitost metylačních procesů v buňkách a souvislost mezi jejich aberacemi a rozvojem PC.Klíčová slova:
glycin – kyselina listová – metabolizmus – metylace – sarkosinÚvod
Hypotéza, že maligní nádor může být způsoben specifickými molekulárně - -biologickými alteracemi, byla poprvé experimentálně ověřena v roce 1911, kdy F. P. Rous prokázal, že sarkomy u kuřat mohou být indukovány bezbuněčnými filtráty získanými z tkáňové kultury kuřecího sarkomu [1]. O několik dekád později byla potvrzena virová etiologie těchto tumorů a bylo zjištěno, že za indukci Rousova sarkomu je zodpovědný unikátní virový onkogen v-src (viral-avian sarcoma oncogene) [2]. Toto zjištění vedlo k identifikaci celé řady dalších virových onkogenů, ale také jejich homologů přítomných v genomech vyšších organizmů, vč. člověka [3]. V dnešní době je již zřejmé, že za rozvoj maligních nádorů jsou zodpovědné progresivní a kumulativní alterace v genetické informaci organizmu.
Nádorová onemocnění prostaty (prostate cancer – PC) jsou heterogenní skupinou onemocnění řadící se v řadě zemí vč. ČR na první místo v počtu diagnostikovaných pacientů [4]. Je popsáno velké množství genů, proteinů či metabolitů, jež jsou přímo zapojeny do progrese prekurzorové léze v lokalizovaném či metastatickém PC [5]. I přes značné pokroky ve znalosti genových a proteinových expresních profilů u pacientů s PC nejsou komplexní změny na úrovni metabolomu stále zcela popsány. Důležitou součástí maligní transformace jsou také změny na úrovni bioenergetiky buněk. Pravděpodobně nejznámější metabolickou alterací maligních buněk je tzv. Warburgův efekt představující posun ke zvýšené glykolýze, produkci laktátu a zvýšení bioenergetických nároků [6]. U glykolýzy bylo zjištěno, že pomocí vhodných inhibitorů lze tento proces úspěšně blokovat, a tím specificky zamezit rozvoji nádorů [7]. K dnešnímu datu je již několik inhibitorů glykolýzy testováno v různých fázích pre-klinického či klinického testování a aplikace těchto preparátů směřuje především k terapiím hypoxických nádorů.
Specifické metabolické dráhy a molekuly, které v nich působí, tak mohou být vhodnými cíli nejen pro zefektivnění včasné nádorové diagnostiky, ale také prognostických a terapeutických možností. Jednou z takových molekul je i enzym glycin-N-metyltransferáza (GNMT, EC 2.1.1.20), která katalyzuje reverzibilní přeměnu glycinu na sarkosin. Tato práce si klade za cíl shrnout skutečnosti týkající se nejen tohoto enzymu a jeho role v organizmu, ale také genu, který jej kóduje, a jejich propojení s PC.
Fyziologická role GNMT
GNMT je protein vyskytující se ve velké míře především v cytoplazmě jaterních buněk (tvoří 1–3 % cytoplazmických proteinů) [8], ale také jiných tkání, vč. prostaty či pankreatu (0,4 % cytoplazmických proteinů) [9]. V buňce se GNMT skládá ze čtyř identických podjednotek tvořících tetramerní strukturu (obr. 1). Lidská GNMT je 32 kDa polypeptid složený z 292 aminokyselin [10]. Zajímavostí je, že ačkoliv má každá ze čtyř podjednotek své vlastní katalytické centrum, kvarterní organizace (struktura) proteinu je nezbytná pro správnou katalytickou aktivitu a dimery či monomery GNMT jsou katalyticky inaktivní [11]. V organizmu GNMT katalyzuje přenos metylové skupiny z S-adenosyl methioninu (SAM) na amino skupinu glycinu, čímž vzniká imino kyselina sarkosin (N-metylglycin) a S-adenosyl homocystein (SAH). Sarkosin je intermediátem v metabolické degradaci cholinu a betainu a je důležitý pro správnou funkci regulace osmózy a stabilizaci proteinů [12]. Může být také efektivně konvertován zpět na glycin aktivitou folát-dependentního enzymu sarkosindehydrogenázy (SARDH, EC 1.5.99.1) [13]. Tyto metabolické procesy jsou důležité především pro transport metylových skupin do metabolizmu kyseliny listové. Dále pak také pro zpětný přenos těchto skupin do aktivního metylového cyklu, kde jsou utilizovány pro SAM přes biosyntézu methioninu a také pro metylaci DNA a histonů katalyzovanou DNA-metyltransferázami (DNMT) (schéma 1). Z výše zmíněného lze usoudit, že funkcí GNMT je především regulace poměru SAM/SAH a také celkového metylačního potenciálu buňky.
Obr. 1. Struktura tetrameru glycin-N-metyltransferázy (GNMT), získaná z krystalografických studií při rozlišení 2.5 Å. 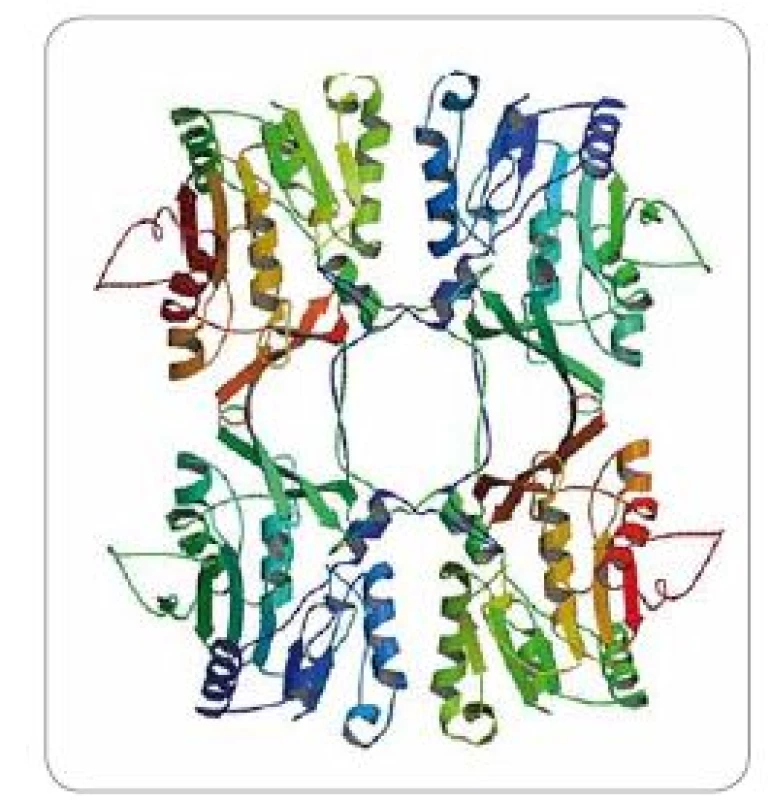
Převzato jako záznam 1BHJ z RCSB Protein Data Bank (www.rcsb.org). Schéma 1. Glycin-N-metytransferáza (GNMT) katalyzuje přeměnu S-adenosyl methioninu (SAM) na S-adenosyl homocystein (SAH) a metyluje glycin na sarkosin. 
Tato reakce slouží k regulaci poměru SAM/SAH a také k transportu a utilizaci metylových skupin mezi aktivovaným metylovým cyklem a metabolizmem kyseliny listové. Hcy – homocystein, THF – tetrahydrofolát, DNMT – DNA metyltransferáza Ačkoliv je GNMT převážně cytoplazmický protein, může působit i jako vazebný receptor polycyklických aromatických uhlovodíků 4S a také transkripční aktivátor cytochromu P450 1A1, a to v odezvě na intoxikaci benzo (a) pyrenem (B[a]P) [14]. GNMT tak brání vzniku nežádoucích aduktů aktivovaného B[a]P s DNA sekvestrací tohoto karcinogenu a snižováním jeho koncentrace. Tento jev byl pozorován in vitro i in vivo také při intoxikacích aflatoxinem B1, kdy GNMT redukuje množství aduktů DNA s aflatoxinem B1 a karcinogenitu aflatoxinu [15]. Pochody, které vedou ke změně funkcí z metabolického enzymu přes vazebný protein xenobiotik až k transkripčnímu faktoru, souvisí pouze s fosforylačním stavem GNMT [16]. Výše zmíněné zdůrazňuje význam tohoto proteinu v řadě fyziologických procesů probíhajících v organizmu, a není tedy překvapivé jeho spojení s nádorovými onemocněními prostaty.
GNMT a karcinogeneze prostatické tkáně
Ačkoliv v jaterní tkáni byla GNMT identifikována jako efektivní tumorový supresor a v řadě experimentů in vivo bylo prokázáno, že u myší s deletovanou GNMT (GNMT–/ – myši) dochází k rychlému rozvoji hepatocelulárních karcinomů [17,18], funkční role GNMT v prostatické tkáni je stále diskutabilní. Průlomová studie byla publikována v roce 2007, kdy byly porovnány vzorky DNA izolované z periferní krve pacientů s PC s DNA zdravých mužů bez onkologické historie srovnatelné věkové a etnické kategorie [19]. V této studii bylo zjištěno, že jedinci s haplotypem 10GAs/Ins/T, který má za následek zvýšenou úroveň promotorové aktivity GNMT, vykazovali výrazně nižší riziko vzniku PC ve srovnání s jedinci s haplotypem 16As/Del/C nesoucím nejnižší promotorovu aktivitu. Důležitou roli GNMT v rozvoji PC dokazuje i skutečnost, že jednonukleotidové polymorfizmy v promotorové oblasti genu GNMT jsou asociovány se zvýšeným rizikem vzniku PC [20].
Je pozoruhodné, že prevalence PC výrazně souvisí s etnicitou, přičemž nejvyšší je u Afroameričanů, následovaných Američany evropského původu a Evropany. Nejnižší prevalence PC je pozorována v asijské populaci [21]. Je tedy pravděpodobné, že existují genetické varianty indikující predispozici ke vzniku PC. Podrobná genetická analýza tak může být v klinické praxi přínosná, zejména pro vyhledání osob se zvýšeným rizikem, a tedy vhodných pro častější a detailnější screening.
Na proteinové úrovni je ale situace poněkud složitější. Jelikož je dle některých studií exprese GNMT v nádorové tkáni prostaty značně snížena [19] a stejný jev je pozorovatelný i ve většině PC tkáňových kultur, lze předpokládat, že koncentrace metabolitu, sarkosinu, by měla v těchto případech být relativně nízká. Některé studie ale demonstrují výrazně zvýšené hladiny sarkosinu ve vzorcích moči pacientů s PC. To indikuje vyšší enzymovou aktivitu GNMT v porovnání se zdravými jedinci [22]. Jiné práce dokonce tuto zvýšenou aktivitu ve tkáni PC potvrzují, přičemž byla současně detekována také snížená aktivita SARDH, což je naprosto v souladu se zvýšenou hladinou sarkosinu [23]. Dalším zajímavým zjištěním bylo, že vyřazením exprese GNMT dochází ke snížení invazivity nádorových buněk a k redukci jejich onkogenního potenciálu indukcí zástavy buněčného cyklu ve fázi G1 a dále apoptózy. Souvislost GNMT a PC byla potvrzena i v další práci, kde byla studována její exprese ve 148 vzorcích biopsií pacientů s diagnostikovaným PC [24]. Prokázaná byla vysoce významná korelace zvýšené exprese GNMT s vyšším Gleasonovým skóre, a s vyšším pT a s kratším bezpříznakovým přežitím. Tato data potvrzují multifaktoriální a složitou povahu PC, i když je jasné, že GNMT hraje důležitou roli při jeho rozvoji. K jejímu využití v diagnostice a prognostice je však nezbytné posuzovat případy individuálně a na základě korelací s hladinou důležitých metabolitů, jako je sarkosin.
Sarkosin – možný nástroj pro diagnostiku PC
Sarkosin je znám již od roku 1847, kdy jej poprvé izoloval a pojmenoval německý chemik Justus von Liebig. Dlouho byl považován za pouhý intermediát metabolizmu glycinu katalyzovaného GNMT, a to až do roku 2009, kdy Sreekumar et al provedli rozsáhlou metabolomickou studii s cílem identifikovat potenciální biomarkery PC ve vzorcích moči [22]. Koncentrace sarkosinu byly u pacientů s PC signifikantně zvýšeny a autoři uvedené studie prokázali, že stanovení jeho koncentrace umožňuje rozlišit subjekty s benigní hyperplazií, lokalizovaným a metastatickým stadiem PC. Toto zjištění následně potvrdily i některé další práce [25–28], nicméně některé další studie tyto nálezy nepotvrdily [29]. Rozdíly mezi studiemi jsou pravděpodobně způsobeny faktory, které mohou získaná data ovlivňovat, a to výběrem pacientů, odběrem, skladováním či přípravou klinických vzorků a také volbou analytické techniky používané pro stanovení sarkosinu.
GNMT a epigenetické faktory
Epigenetika se zabývá dědičnými změnami ve fenotypu, které primárně nejsou důsledkem změn v sekvenci nukleových kyselin [30]. Mezi epigenetické regulační mechanizmy se řadí posttranslační modifikace histonů, remodelace chromatinu, aktivace mikroRNA a také metylace DNA [31]. Jak již bylo zmíněno výše, je to právě GNMT, jež reguluje metylační stav buněk. Je to již více než 30 let, kdy bylo poprvé zjištěno, že metylační status benigních a maligních buněk je odlišný [32]. Důležitou metylací je např. kovalentní adice metylové skupiny na uhlík 5 cytosinu za vzniku 5-metylcytosinu (obr. 2). Tyto metylové skupiny se soustředí do velkého žlábku DNA a mohou efektivně inhibovat transkripci [33]. Metylace DNA tak pomáhá inhibovat transkripci v nekódujících oblastech genomu, jako je např. pericentromerický heterochromatin, který je tak díky velké míře metylace transkripčně inaktivní [34]. Hypermetylace může ale také indukovat neodvratné změny v genové expresi. Například metylace reparačních genů MLH1 či MGMT je může inaktivovat, což má za následek zvýšenou destabilizaci mikrosatelitů a vyšší četnost mutací [35]. Metylace může rovněž aktivovat spontánní deaminaci bází DNA, což umožňuje vyšší schopnost interakcí s karcinogeny. Je také zvýšena tvorba pyrimidinových dimerů vyvolaných UV zářením, což vede k vyšší kumulaci počtu mutací. Správná regulace metylačních procesů tak může značně ovlivňovat zdraví organizmu.
Obr. 2. Schematické znázornění metylace cytosinu na uhlíku 5 katalyzované DNA- metyltransferázami (DNMT). 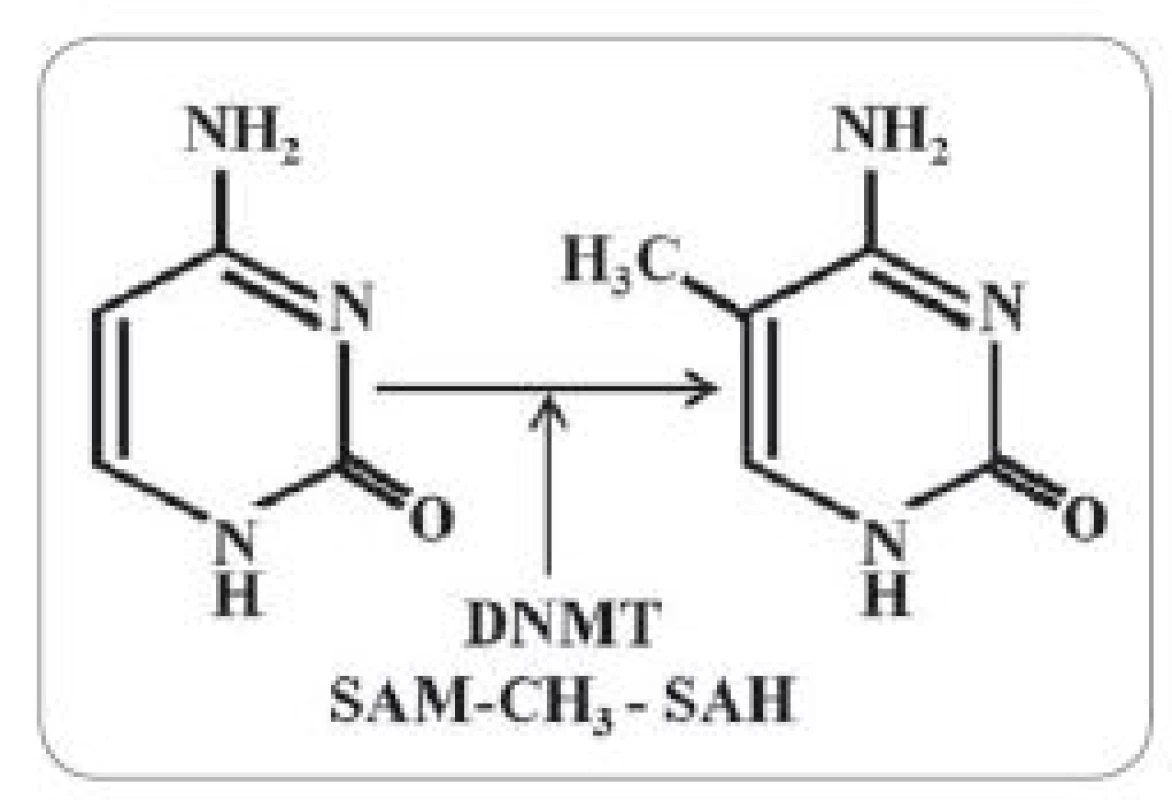
U PC je hypermetylace považována za nejlépe charakterizovanou epigenetickou abnormalitu a aberantní metylací genů spojených s PC se již zabývala řada autorů [36–38]. Důležité je i říci, že mnoho hypermetylovaných genů kóduje proteiny zapojené do důležitých buněčných procesů a také těch s tumor-supresorovou aktivitou (GST1, GSTM1, RAR β, RASSF1A, CDH1, CDKN2A/p16, TIMP-2 a další) [36]. Na druhou stranu jsou ale dobře popsány také geny, které jsou naopak hypometylované (uPA, PLAU, HPSE, CAGE, CYP1B1) [39]. Z výše zmíněného je zřejmé, že metylační status některých genů může být důležitý pro vznik a rozvoj PC, a jeho poznání tak může značně zlepšit diagnostické, prognostické či terapeutické možnosti v klinické praxi.
Závěr a výhledy do budoucnosti
Prevalence PC se v západní společnosti stále zvyšuje. Ačkoliv jsou diagnostické i terapeutické možnosti poměrně pokročilé, je PC stále příčinou úmrtí velkého množství mužů. Genomické i metabolomické studie ukazují, že některé molekuly, a mezi nimi právě GNMT, mohou hrát roli při vzniku a rozvoji PC. Multifaktoriální efekt GNMT lze pozorovat již na genové úrovni, kde byly identifikovány haplotypy se zvýšeným rizikem vzniku PC. Stejně tak byl význam tohoto proteinu demonstrován v několika studiích. S ohledem na metabolizmus katalyzovaný GNMT je nezbytné zmínit i významný intermediát tvořený tímto enzymem, sarkosin. Ten je stále předmětem diskuzí o možnostech jeho využití pro včasnou diagnostiku PC. Kromě toho GNMT významným způsobem ovlivňuje metylační status buněk. Komplexní genetická a metabolomická vyšetření zahrnující také studium metylací specifických genů tak mohou být přínosem pro klinickou praxi. Epigenomika odkrývá celou řadu slibných diagnosticko-prognostických a terapeutických cílů. Není proto překvapivé, že se výzkum na poli PC zaměřil na identifikaci epigenetických „otisků“, které mohou být využity pro rozlišení ohraničených, indolentních nádorů od agresivních forem onemocnění. Určitým nedostatkem je stále nedostupnost sledování metylačních procesů. Nicméně vývoj vysoce kvalitních a přesných sekvenačních metod nové generace může tento fakt změnit a učinit tyto analýzy dostupnějšími.
Tato práce byla podpořena GA ČR 16-18917S, Ligou proti rakovině Praha (projekt 2022015) a MZ ČR – RVO, FN v Motole 00064203.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
prof. RNDr. Vojtěch Adam, Ph.D.
Ústav chemie a biochemie Agronomická fakulta Mendelovy univerzity v Brně
Zemědělská 1
613 00 Brno
e-mail: vojtech.adam@mendelu.cz
Obdrženo: 9. 2. 2016
Přijato: 20. 3. 2016
Zdroje
1. Rous P. Transmission of a malignant new growth by means of a cell-free filtrate. JAMA 1911; 56 (198): 1445–1446.
2. Baltimor D. RNA dependent DNA polymerase in virions of RNA tumor viruses. Nature 1970; 226 (5252): 1209–1211.
3. Croce CM. Oncogenes and cancer. N Engl J Med 2008; 358 (5): 502–511. doi: 10.1056/NEJMra072367.
4. Siegel RL, Miller KD, Jemal A. Cancer statistics, 2016. CA Cancer J Clin 2016; 66 (1): 7–30. doi: 10.3322/caac.21332.
5. Abate-Shen C, Shen MM. Molecular genetics of prostate cancer. Genes Dev 2000; 14 (19): 2410–2434.
6. Warburg O. Origin of cancer cells. Science 1956; 123 (3191): 309–314.
7. Chen Z, Lu WQ, Garcia-Prieto C et al. The Warburg effect and its cancer therapeutic implications. J Bioenerg Biomembr 2007; 39 (3): 267–274.
8. Yeo EJ, Wagner C. Tissue distribution of glycine-N-methyltransferase, a major folate-binding protein of liver. Proc Natl Acad Sci U S A 1994; 91 (1): 210–214.
9. Chen YM, Chen LY, Wong FH et al. Genomic structure, expression, and chromosomal localization of the human glycine N-methyltransferase gene. Genomics 2000; 66 (1): 43–47.
10. Pattanayek R, Newcomer ME, Wagner C. Crystal structure of apo-glycine N-methyltransferase (GNMT). Protein Sci 1998; 7 (6): 1326–1331.
11. Krupenko NI, Wagner C. Transport of rat liver glycine N-methyltransferase into rat liver nuclei. J Biol Chem 1997; 272 (43): 27140–27146.
12. Kumar N, Kishore N. Structure and effect of sarcosine on water and urea by using molecular dynamics simulations: implications in protein stabilization. Biophys Chem 2013; 171 (1): 9–15. doi: 10.1016/j.bpc.2012.11. 004.
13. Cernei N, Heger Z, Gumulec J et al. Sarcosine as a potential prostate cancer biomarker – a review. Int J Mol Sci 2013; 14 (7): 13893–13908. doi: 10.3390/ijms140713 893.
14. Yen CH, Lin YT, Chen HL et al. The multi-functional roles of GNMT in toxicology and cancer. Toxicol Appl Pharmacol 2013; 266 (1): 67–75. doi: 10.1016/j.taap.2012.11. 003.
15. Liu SP, Li YS, Lee CM et al. Higher susceptibility to aflatoxin B-1-related hepatocellular carcinoma in glycine N-methyltransferase knockout mice. Int J Cancer 2011; 128 (3): 511–523. doi: 10.1002/ijc.25386.
16. Bhat R, Weaver JA, Wagner C et al. ATP depletion affects the phosphorylation state, ligand binding, and nuclear transport of the 4 S polycyclic aromatic hydrocarbon-binding protein in rat hepatoma cells. J Biol Chem 1996; 271 (51): 32551–32556.
17. Martinez-Chantar ML, Vazquez-Chantada M, Ariz U et al. Loss of the glycine N-methyltransferase gene leads to steatosis and hepatocellular carcinoma in mice. Hepatology 2008; 47 (4): 1191–1199. doi: 10.1002/hep.22 159.
18. Liao YJ, Liu SP, Lee CM et al. Characterization of a glycine N-methyltransferase gene knockout mouse model for hepatocellular carcinoma: Implications of the gender disparity in liver cancer susceptibility. Int J Cancer 2009; 124 (4): 816–826. doi: 10.1002/ijc.23979.
19. Huang YC, Lee CM, Chen M et al. Haplotypes, loss of heterozygosity, and expression levels of glycine N-methyltransferase in prostate cancer. Clin Cancer Res 2007; 13 (5): 1412–1420.
20. Ianni M, Porcellini E, Carbone I et al. Genetic factors regulating inflammation and DNA methylation associated with prostate cancer. Prostate Cancer Prostatic Dis 2013; 16 (1): 56–60. doi: 10.1038/pcan.2012. 30.
21. Gronberg H. Prostate cancer epidemiology. Lancet 2003; 361 (9360): 859–864.
22. Sreekumar A, Poisson LM, Rajendiran TM et al. Metabolomic profiles delineate potential role for sarcosine in prostate cancer progression. Nature 2009; 457 (7231): 910–914. doi: 10.1038/nature07762.
23. Khan AP, Rajendiran TM, Ateeq B et al. The role of sarcosine metabolism in prostate cancer progression. Neoplasia 2013; 15 (5): 491–501.
24. Song YH, Shiota M, Kuroiwa K et al. The important role of glycine N-methyltransferase in the carcinogenesis and progression of prostate cancer. Mod Pathol 2011; 24 (9): 1272–1280. doi: 10.1038/modpathol.2011. 76.
25. Heger Z, Cernei N, Gumulec J et al. Determination of common urine substances as an assay for improving prostate carcinoma diagnostics. Oncol Rep 2014; 31 (4): 1846–1854. doi: 10.3892/or.2014.3054.
26. Burton C, Gamagedara S, Ma YF. A novel enzymatic technique for determination of sarcosine in urine samples. Anal Methods 2012; 4 (1): 141–146.
27. Wu H, Liu TT, Ma C et al. GC/MS-based metabolomic approach to validate the role of urinary sarcosine and target biomarkers for human prostate cancer by microwave-assisted derivatization. Anal Bioanal Chem 2011; 401 (2): 635–646. doi: 10.1007/s00216-011 - 5098-9.
28. Cao DL, Ye DW, Zhang HL et al. A multiplex model of combining gene-based, protein-based, and metabolite-based with positive and negative markers in urine for the early diagnosis of prostate cancer. Prostate 2011; 71 (7): 700–710. doi: 10.1002/pros.21286.
29. Jentzmik F, Stephan C, Miller K et al. Sarcosine in urine after digital rectal examination fails as a marker in prostate cancer detection and identification of aggressive tumours. Eur Urol 2010; 58 (1): 12–18. doi: 10.1016/j.eururo.2010.01.035.
30. Suzuki MM, Bird A. DNA methylation landscapes: provocative insights from epigenomics. Nat Rev Genet 2008; 9 (6): 465–476. doi: 10.1038/nrg2341.
31. Kim JK, Samaranayake M, Pradhan S. Epigenetic mechanisms in mammals. Cell Mol Life Sci 2009; 66 (4): 596–612. doi: 10.1007/s00018-008-8432-4.
32. Goelz SE, Vogelstein B, Hamilton SR et al. Hypomethylation of DNA from benign and malignant human-colon neoplasms. Science 1985; 228 (4696): 187–190.
33. Clark SJ, Melki J. DNA methylation and gene silencing in cancer: which is the guilty party? Oncogene 2002; 21 (35): 5380–5387.
34. Saksouk N, Simboeck E, Dejardin J. Constitutive heterochromatin formation and transcription in mammals. Epigenetics Chromatin 2015; 8 (1): 3: doi: 10.1186/1756-8935-8-3.
35. Esteller M, Garcia-Foncillas J, Andion E et al. Inactivation of the DNA-repair gene MGMT and the clinical response of gliomas to alkylating agents. N Engl J Med 2000; 343 (19): 1350–1354.
36. Majumdar S, Buckles E, Estrada J et al. Aberrant DNA methylation and prostate cancer. Curr Genomics 2011; 12 (7): 486–505. doi: 10.2174/138920211797904061.
37. Hoque MO. DNA methylation changes in prostate cancer: current developments and future clinical implementation. Expert Rev Mol Diagn 2009; 9 (3): 243–257. doi: 10.1586/erm.09.10.
38. Delgado-Cruzata L, Hruby GW, Gonzalez K et al. DNA methylation changes correlate with gleason score and tumor stage in prostate cancer. DNA Cell Biol 2012; 31 (2): 187–192. doi: 10.1089/dna.2011.1311.
39. Dunn BK. Hypomethylation: one side of a larger picture. In: Verma M, Dunn BK, Umar A (eds). Epigenetics in cancer prevention: early detection and risk assessment. New York: New York Acad Sciences 2003 : 28–42.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článek SOUTĚŽ O NEJLEPŠÍ PRÁCIČlánek Aktuality z odborného tiskuČlánek Imunologická sekce ČOSČlánek Melanom plosky nohy
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2016 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- O limitech, pokroku, hybridech a sebekontrole v onkologii
- SOUTĚŽ NA PODPORU AUTORSKÝCH TÝMŮ PUBLIKUJÍCÍCH V ZAHRANIČNÍCH ODBORNÝCH TITULECH
- Glycin-N-metyltransferáza a nádorová onemocnění prostaty
- Prognostické a prediktivní faktory u adenokarcinomu pankreatu
- Léčba relabovaného a refrakterního Hodgkinova lymfomu – doporučení české studijní skupiny Hodgkinův lymfom
- Význam signálnej dráhy MITF pri regulácii proliferácie a invazivity malígneho melanómu
- Vliv nutriční podpory s vysokým obsahem bílkovin na výsledky léčby a náklady u pacientů s kolorektálním karcinomem
- Exprese ABC transportérů Pgp, MRP1 a MRP3 u maligních a benigních změn vaječníků
- Kombinovaná léčba recidivujícího maligního schwannomu
- Malígny mezotelióm tunica vaginalis testis. Klinicko-patologická analýza dvoch prípadov s prehľadom literatúry
- Hypertermická izolovaná perfuze končetin v kombinaci s tasonerminem – technika monitorování úniku perfuzátu
- Everolimus v léčbě neuroendokrinních nádorů plicního a gastrointestinálního původu – výsledky studie RADIANT-4
-
Průvodce mladého onkologa infuzní terapií a výživou
Díl 5 – Hyperkalemie. Indikace umělé výživy. Kazuistika 5 - Společnost SANDOZ/EBEWE získala cenu za přínos k bezpečnému nakládání s léky
- SOUTĚŽ O NEJLEPŠÍ PRÁCI
- Aktuality z odborného tisku
- Informace z České onkologické společnosti
- Sentinel Lymph Node in Thin and Thick Melanoma
- Imunologická sekce ČOS
- Melanom plosky nohy
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Vliv nutriční podpory s vysokým obsahem bílkovin na výsledky léčby a náklady u pacientů s kolorektálním karcinomem
-
Průvodce mladého onkologa infuzní terapií a výživou
Díl 5 – Hyperkalemie. Indikace umělé výživy. Kazuistika 5 - Melanom plosky nohy
- Léčba relabovaného a refrakterního Hodgkinova lymfomu – doporučení české studijní skupiny Hodgkinův lymfom
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



