-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Molekulární aspekty nádorů štítné žlázy se zaměřením na mikroRNA a jejich klinické souvislosti
Molecular Aspects of Thyroid Tumors with Emphasis on MicroRNA and Their Clinical Implications
Background:
Central to neoplastic transformation and tumor progression is alteration of the signaling pathways that control cell proliferation and apoptosis. The key mechanisms for this neoplastic process are genetic changes (mutations of cancer-related genes) and recently identified epigenetic changes that involve DNA methylation, chromatin remodeling (which has a profound effect on the control of gene expression), and noncoding, regulatory RNA (notably, microRNA – miRNA). MiRNAs control expression of their target gene post-transcriptionally. These molecular factors have potential as diagnostic, prognostic, and predictive molecular markers. Epithelial tumors of the thyroid gland are a histogenetically, morphologically, and pathobiologically heterogeneous group of neoplasms and require new, molecular approaches in clinical practice.Aim:
This review aims to present contemporary scientific knowledge of this molecular (genetic and epigenetic) field of sporadic thyroid tumors of follicular cell origin and their potential clinical implications. The fundamental mutations (BRAFV600E, RET/PTC, RAS, and PAX8-PPARG) in selected tumor types are described comprehensively. Special attention is paid to miRNAs, including their biogenesis, function, and expression profiles in the most common thyroid tumors – follicular adenoma, follicular carcinoma, and papillary carcinoma.Conclusion:
Thyroid cancer medicine has recently entered a new, molecular era. Comprehensive knowledge of all molecular aspects may improve diagnostics and management of thyroid neoplasms through the introduction of novel, progressive treatment strategies for this cancer. Further research on signaling pathway-related targets, standardization of methods, and evaluation of results are required.Key words:
thyroid tumors – cancerogenesis – genetics – epigenetics – microRNA
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.Submitted:
19. 10. 2016Accepted:
2. 11. 2016
Autori: M. Ludvíková 1,2; I. Kholová 3; D. Kalfeřt 4
Pôsobisko autorov: Ústav biologie, LF UK v Plzni 1; Ústav patologie, 1. LF UK a VFN v Praze 2; Pathology, Fimlab Laboratories and Faculty of Medicine and Life Science, Tampere University Hospital, Tampere, Finland 3; Klinika otorinolaryngologie a chirurgie hlavy a krku 1. LF UK a FN Motol, Praha 4
Vyšlo v časopise: Klin Onkol 2017; 30(3): 167-174
Kategória: Přehled
doi: https://doi.org/10.14735/amko2017167Súhrn
Východiska:
Podstatou nádorové transformace a progrese je narušení signálních drah regulujících buněčnou proliferaci a apoptózu. Klíčovými mechanizmy v tomto procesu jsou vedle genetických změn (mutací genů souvisejících s nádory) též nedávno odhalené změny epigenetické, které zahrnují DNA metylaci a remodelaci chromatinu (kontrolující expresi genů) a v širším hledisku i nekódující, regulační RNA (zejména mikroRNA – miRNA). MiRNA posttranskripčně regulují expresi svých cílových genů. Tyto molekulární faktory se mohou stát důležitými diagnostickými, prognostickými i prediktivními nádorovými markery. Epitelové nádory štítné žlázy představují heterogenní skupinu z hlediska histogenetického, morfologického i patobiologického a vyžadují nové, molekulární přístupy v klinické praxi.Cíl:
Cílem prezentované práce je podat přehled současných poznatků o základních molekulárních (genetických i epigenetických) mechanizmech sporadických nádorů štítné žlázy z folikulárních buněk a o jejich možných klinických souvislostech. Detailněji jsou popsány klíčové mutace (BRAFV600E, RET/PTC, RAS, PAX8-PPARG) ve vybraných typech nádorů. Zvláštní pozornost je věnována miRNA, jejich biogenezi, funkci a expresním profilům miRNA v nejčastějších nádorech štítné žlázy – folikulárních adenomech, folikulárních karcinomech a papilokarcinomech.Závěr:
Tyreoidální nádorová medicína vstoupila do nové, molekulární éry, kdy detailní poznání všech molekulárních mechanizmů může přispět ke zlepšení diagnostiky a prognózování nádorů štítné žlázy i k rozvoji nových léčebných strategií. Další studie této problematiky, standardizace metod a hodnocení výsledků jsou nutné.Klíčová slova:
nádory štítné žlázy – kancerogeneze – genetika – epigenetika – mikroRNAÚvod
Nádory štítné žlázy představují velmi heterogenní skupinu z hlediska histogenetického, morfologického i patobiologického. Ve štítné žláze se nejčastěji vyskytují nádory epitelové, které vznikají nádorovou transformací buněk folikulárních (tyreocytů) nebo parafolikulárních (C buněk). Nádory z folikulárních buněk jsou reprezentovány jednak benigním folikulárním adenomem (follicular adenoma – FA), jednak tyreoidálními karcinomy (též nazývanými non-medulární karcinomy), které jsou klasifikovány na dobře diferencované, špatně diferencované (poorly differentiated thyroid carcinoma – PDTC) a anaplastické (anaplastic thyroid carcinoma – ATC). Dobře diferencované karcinomy představují až 95 % všech tyreoidálních malignit a zahrnují karcinom folikulární (follicular thyroid carcinoma – FTC) a papilární (papillary thyroid carcinoma – PTC), které se navzájem značně liší svými morfologickými i klinicko-patologickými charakteristikami, ačkoli vznikají nádorovou transformací téže výchozí (folikulární) buňky [1]. Je známo, že klíčovou roli v nasměrování příslušného neoplastického procesu hrají molekulární mechanizmy [2]. Základem pro diagnostiku nádorů štítné žlázy je mikroskopické vyšetření, které však má vzhledem ke zvláštnostem morfologických diagnostických kritérií dobře diferencovaných karcinomů z folikulárních buněk (např. jaderné charakteristiky u PTC; kapsulární a vaskulární invaze u FTC) četné limitace. Nezanedbatelnou roli v předoperační diagnostice představuje tenkojehlová aspirační cytologie (fine needle aspiration cytology – FNAC), která vede ve 14–30 % případů k indeterminovaným výsledkům, což má za následek vyšší počet chirurgických intervencí [3–5]. Proto se hledají nové, molekulární přístupy, které by jednak napomohly ke zlepšení histopatologické diagnostiky nádorů štítné žlázy i ke zvýšení výtěžnosti FNAC, jednak posloužily k odhadu agresivity chování nádorů a k volbě správné léčebné strategie [6–9].
Je známo, že nádorová transformace a progrese je proces, při němž jsou narušeny základní regulační mechanizmy, které v buňce napomáhají k udržení homeostázy. Vztah mezi buněčnou proliferací a apoptózou je tímto procesem posunut ve prospěch buněčného dělení. Původní představa o genetické podstatě nádorového bujení spojené s mutacemi genů klíčových pro nádory jakožto základním mechanizmu kancerogeneze doznala v poslední době značného rozšíření v podobě nově odhalených epigenetických změn. Tyto změny narušují normální expresi nádorových genů, aniž by došlo k jejich mutaci, tj. změně původní sekvence nukleotidů DNA [7,10]. Štítná žláza je považována za vhodný model pro studium jednotlivých molekulárních dějů v kancerogenezi vzhledem k tomu, že jeden typ tyreoidální buňky dává vznik různým typům nádorů s odlišnými molekulárními, histomorfologickými a klinickými kritérii [11]. Cílem našeho sdělení je podat přehled současných poznatků o základních molekulárních (genetických i epigenetických) mechanizmech sporadických nádorů štítné žlázy z folikulárních buněk a o jejich možných klinických souvislostech a přispět tak k vytvoření komplexního pohledu na tyreoidální nádorovou patobiologii.
Genetika nádorů štítné žlázy
Genetické změny (genové mutace, chromozomální přestavby) jsou spojeny s odchylkami v sekvenci nukleotidů DNA. V patogenezi nádorů jsou zásadní mutace, které postihují geny podílející se na kontrole buněčného dělení, diferenciace a přežití buněk. V nádorech štítné žlázy mohou korelovat určité typy mutací nejen s histologickými subtypy nádorů, ale též s jejich agresivitou a s odpovědí na léčbu. Tyreoidální nádory vycházející z folikulárních buněk vykazují především změny ve dvou klasických signálních kaskádách, což jsou MAPK (mitogen-activated protein kinase) a PI3K/Akt signální dráha (obr. 1), které za normálních okolností regulují zejména proliferaci a diferenciaci buněk, jejich přežití a motilitu [12–14].
Obr. 1. Klíčové signální dráhy v kancerogenezi štítné žlázy. 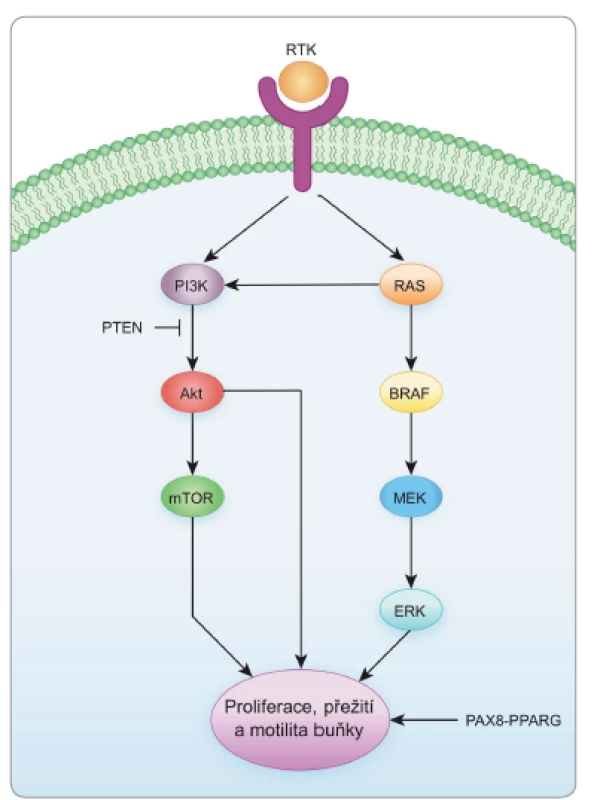
RTK – receptorová tyrozinkináza, RAS, BRAF, MEK, ERK, PI3K – signální molekuly, Akt – protein kináza B, mTOR – mechanistic target of rapamycin, PTEN – phosphatase and tensin homolog, PAX8-PPARG – onkogen vzniklý translokační přestavbou kódující fúzní protein, ┴ inhibice, → stimulace Příčinou abnormální funkce příslušných signálních drah v nádorech štítné žlázy jsou genetické a/nebo epigenetické změny genů kódujících proteiny signálních kaskád [2]. Výsledkem mutace je většinou konstitutivní aktivace genového produktu, a tím i trvalé spuštění signální dráhy s neregulovanou buněčnou proliferací a dediferenciací. Této skutečnosti je možno využít terapeuticky při blokování signálních drah [2]. V nádorech štítné žlázy z folikulárních buněk jsou nejčastěji prokazovány mutace v následujících genech: BRAF je protoonkogen kódující cytoplazmatickou serin/threoninovou kinázu uplatňující se v MAPK signální kaskádě. Nejčastější mutací je bodová mutace BRAFV600E, která způsobuje trvalou aktivaci proteinu BRAF, a tím celé signální kaskády. BRAFV600E je nejvíce zastoupenou mutací v PTC, a tedy v karcinomech štítné žlázy vůbec. Tato mutace bývá sdružena s vyšší agresivitou nádorů (především s extratyroidální invazí), horší prognózou, častějšími recidivami a úmrtím v souvislosti s nádorem. Zároveň je mutace BRAFV600E spojena s poklesem proteinů nutných pro příjem jódu (např. sodium iodide symporter – NIS, tyreoidální peroxidáza – TPO, tyreoidální transkripční faktor – TTF1, pendrin apod.), což má za následek sníženou responzibilitu těchto nádorů na léčbu jódem [2,13–16].
RET je protoonkogen (REarranged during Transfection) lokalizovaný na 10. chromozomu (10q11.2). Kóduje transmembránový tyrozinkinázový receptor s klíčovou úlohou v buněčném růstu, diferenciaci a přežití buněk. Za normálních okolností je exprimován v neuronálních buňkách, nikoli v tyreocytech, v nichž se objevuje teprve produkt mutovaného RET genu. Typ mutace genu RET rozhoduje o typu tyreoidálního nádoru. Chromozomální přestavba RET genu (RET/PTC) je často důsledkem radiace a vede ke vzniku chimérického onkoproteinu. Tento typ genetické aberace se vyskytuje asi u 15 % PTC. Bodové mutace RET genu jsou typické pro medulární karcinom štítné žlázy [2,14].
Ras je rodina genů ze skupiny protoonkogenů, které kódují malé proteiny schopné na sebe vázat GTP. Nejčastější je mutace v 61. kodonu N-RAS, která aktivuje obě výše uvedené signální dráhy. Mutace v RAS genu představují nejčastější mutace v nádorech vůbec. Tato mutace se vyskytuje u FTC (40 %), FA (20–40 %) a v 20 % folikulární varianty PTC (follicular variant of papillary thyroid carcinoma – FVPTC) [2,14].
PAX8-PPARG je onkogen vznikající translokační fúzí promotoru a velké části genu PAX8 pro transkripční faktor a kódujících exonů genu PPARG (peroxisome proliferator-activated receptor gamma). Onkogenní mechanizmus vzniklého fúzního proteinu PAX8-PPARG není ještě dokonale vysvětlen. Tato translokace se vyskytuje u části FTC, FVPTC a FA [2,14].
Mutace genů PTEN, PI3KCA (kóduje katalytickou podjednotku PI3K) a AKT se vyskytují zejména ve FTC a ATC [2].
Přehled nejčastějších genetických změn ve vybraných epitelových nádorech štítné žlázy z folikulárních buněk je shrnut v tab. 1.
Tab. 1. Přehled nejčastějších mutací ve vybraných epitelových nádorech štítné žlázy. 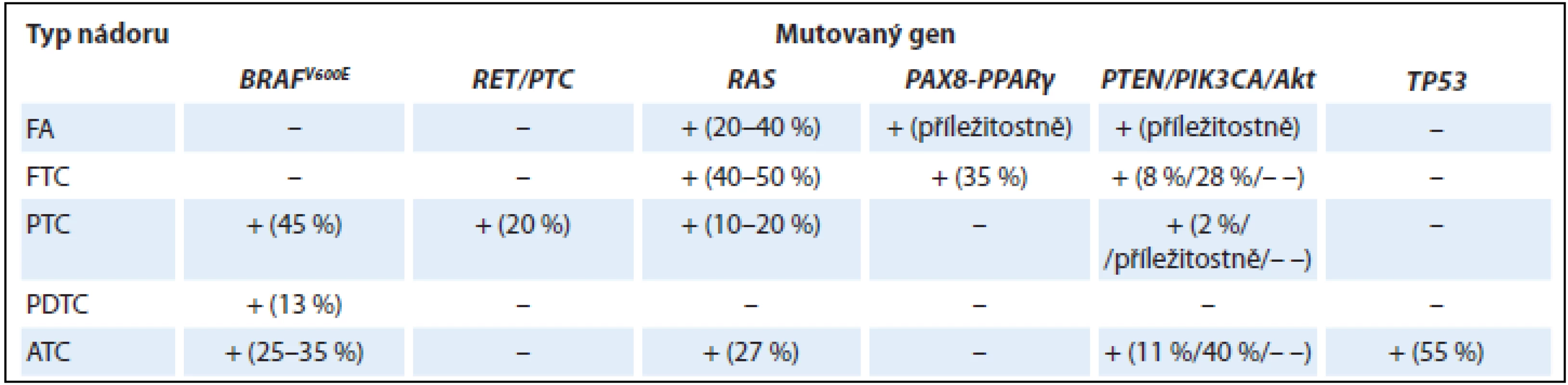
FA – folikulární adenom, FTC – folikulární karcinom, PTC – papilární karcinom, PDTC – špatně diferencovaný karcinom, ATC – anaplastický karcinom, – negativita, + pozitivita, – – nebylo hodnoceno PTC jsou charakterizovány především mutacemi BRAF a přestavbou RET/PTC, zatímco folikulární karcinomy se vyznačují mutacemi RAS a PAX8-PPARα. Variabilní zastoupení všech výše uvedených mutací u hůře diferencovaných a anaplastických karcinomů může vysvětlovat skutečnost, že tyto tumory nevznikají pouze de novo, ale mohou vznikat také dediferenciací z diferencovaných karcinomů papilárních a folikulárních (charakterizovaných zejména mutacemi BRAF a RAS). Hnacím motorem pro progresi špatně diferencovaného karcinomu do anaplastického jsou zejména mutace genů pro protein p53 (TP53) a catenin beta 1 (CTNNB1) a genu ALK [9,16]. Mutační profil s převahou mutace RAS může přispět k objasnění histogeneze a biologické podstaty FVPTC, který mikroskopicky nese znaky jak FTC, tak PTC. Onkocytární tumory jsou variantami dobře diferencovaných tyreoidálních nádorů, čemuž odpovídají i přítomné mutace. Navíc se vyznačují specifickými mutacemi mitochondriálních genů, které jsou zodpovědné za mitochondriální proliferaci (např. gen GRIM-19, který kóduje protein mitochondriálního metabolizmu) [17,18].
Epigenetika nádorů štítné žlázy
Epigenetické změny jsou reverzibilní dědičné charakteristiky, které mohou regulovat genovou expresi. Tyto změny zahrnují DNA metylaci, remodelaci chromatinu a v širším slova smyslu i produkci nekódujících (do proteinů netranslatovatelných) RNA. První dva epigenetické jevy jsou vyvolány chemickými modifikacemi nukleových kyselin či aminokyselin histonů, čímž ovlivňují expresi genů. Metylace cytozinu v DNA genů nebo jejich promotorů a metylace aminokyselin histonů vedou k transkripčnímu potlačení genové exprese. Jiné chemické změny (např. acetylace histonů) mohou mít účinek opačný. V nádorech štítné žlázy se uvedené epigenetické modifikace podílejí na umlčení např. tumor supresorových genů (např. PTEN a TIMP3 tkáňový inhibitor pro metaloproteinázy 3) nebo genů kódujících NIS, TPO a TSHR receptor pro tyreotropin), které jsou specificky exprimovány ve štítné žláze a jejichž nefunkčnost může napomáhat k selhání radioterapie [11]. White et al nedávno publikovali výsledky rozsáhlé metylační analýzy v PTC, v níž prokázali, že epigenetické změny mohou zásadním způsobem narušovat signální dráhy ve folikulárních buňkách [19]. Významným epigenetickým fenoménem v nádorech jsou také nekódující RNA, které zahrnují dlouhé nekódující RNA (long non-coding RNA – lncRNA) čítající více než 200 nukleotidů a malé RNA typu mikroRNA (miRNA) složené průměrně z 22 nukleotidů. Tyto nekódující RNA řídí expresi genů posttranskripčně [20]. O deregulacích lncRNA v nádorech štítné žlázy je dosud jen velice málo poznatků. Výzkum miRNA v nádorech v poslední době značně expanduje. MiRNA se jeví jako slibné nádorové markery a terapeutické cíle [20].
Změny epigenetických vzorců v buňkách tak mohou beze změn v sekvenci nukleotidů měnit genovou expresi, a tím zasahovat do mnoha patobiologických procesů. Důležitým znakem epigenetických jevů je jejich reverzibilita (např. vlivem malých molekul a endogenními enzymy), což může být potenciálně využitelné v cílené terapii chorobných procesů vč. nádorů [14].
MiRNA – nový hráč v patobiologii nádorů štítné žlázy
MiRNA jsou nekódující, jednovláknové regulační molekuly RNA složené z 18–25 nukleotidů, které byly poprvé odhaleny v roce 1993 u háďátka Caenorhabditis elegans [21]. Nezávisle na tomto objevu popsali Fire a Mello v roce 1998 fenomén RNA interference spočívající v umlčování genů účinkem dvouvláknové RNA [22]. Teprve dodatečně bylo zjištěno, že RNA interference je zprostředkována miRNA, která se vyskytuje též u jiných druhů vč. člověka [23]. Za tento objev obdrželi Fire a Mello v roce 2006 Nobelovu cenu [24].
Základní funkce miRNA spočívá v posttranskripční regulaci genové exprese translační represí nebo degradací cílové mediátorové RNA (messenger RNA – mRNA) [25]. Tímto způsobem je regulována více než 1/3 strukturních genů v lidském genomu. Jedna miRNA reguluje více různých mRNA a naopak jedna mRNA je ovlivňována několika typy miRNA. V současné době je u člověka známo více než 2 588 zralých miRNA (miRBase Sequence Database, Release 21, dostupná online na www.miRBase.org) a tento počet neustále roste [26]. Funkce a důsledky deregulace nově objevených miRNA nejsou dosud zdaleka probádány [27]. Deregulace miRNA je spojena s mnoha specifickými patologickými nádorovými i nenádorovými stavy [28–30].
MiRNA je díky své malé velikosti stabilní. MiRNA profily se v jednotlivých studiích mohou lišit dle povahy vzorku a použité metody. MiRNA mohou být spolehlivě stanovovány nejen v čerstvých nebo zmražených tkáních, ale též v tkáňových vzorcích fixovaných formalinem a zalitých do parafinu (formalin-fixed paraffin-embedded – FFPE) [31]. Ve štítné žláze jsou miRNA analyzovány i ve vzorcích a buňkách získaných tenkojehlovou aspirací, což může přispět k větší výtěžnosti tohoto předoperačního vyšetření [32–35]. V poslední době jsou snahy detekovat miRNA rovněž v různých biologických tekutinách, zejména v plazmě/séru. Tyto cirkulující miRNA mohou být uvolňovány z nádorových buněk buď pasivně následkem jejich poškození, nebo aktivně přes membránu v podobě membránových vezikul nebo proteinových komplexů. Několik studií se v poslední době zaměřilo na diagnostický a prognostický význam cirkulujících miRNA v různých nádorech, vč. papilokarcinomu štítné žlázy [36,37]. Yu et al referovali rozdílnou expresi miRNA let-7e u pacientů s PTC v séru a v nádorové tkáni. V séru byla signifikantně vyšší exprese let-7e oproti pacientům bez PTC, zatímco v nádoru up regulace let-7e oproti nenádorové tkáni nebyla prokázána [36]. V této oblasti zůstává ještě mnoho nezodpovězených otázek. Je nutné vyřešit, zda miRNA získané ze séra jsou spíše tkáňově specifické nebo tumor specifické či do jaké míry mohou cirkulující miRNA sloužit jako neinvazivní biomarkery pro diagnózu a prognózu nádorů nebo jako prediktory léčby. Z klinického hlediska by jistě bylo velkou výhodou této detekce zejména pacienta nezatěžující dlouhodobé monitorování profilu miRNA [37,38]. Metody používané k detekci miRNA mnohou být odlišné podle cílů stanovení, které mohou spočívat buď v analýze globálního profilu miRNA, nebo v detekci specifické miRNA či ve funkční analýze [38–40].
MiRNA řídí vývoj a regulují klíčové buněčné procesy vč. proliferace, diferenciace, motility a apoptózy [41]. Jejich exprese je tkáňově specifická a každá dysregulace miRNA může vést ke zvláštnímu chorobnému stavu. Za nejčastější příčiny deregulace je považována jednak lokalizace genů pro miRNA ve fragilních místech na chromozomech a v místech častých mutací v genomu [42,43], jednak mutace a polymorfizmy genů pro miRNA nebo pro jejich biogenezi a funkci [44]. Vztah miRNA ke vzniku a rozvoji nádorů vzhledem k významné regulační roli těchto molekul v základních biologických procesech nepřekvapuje. Abnormální exprese miRNA v nádorech spočívá ve zvýšené (up regulace) nebo snížené (down regulace) produkci ve srovnání s normální nenádorovou tkání a má dva zásadní patogenetické efekty, onkogenní a tumor supresorový. Onkogenní efekt je důsledkem negativní regulace tumor supresorových genů prostřednictvím zvýšeně produkovaných specifických onkogenních miRNA. Naopak miRNA fungují jako tumor supresorové v případě jejich redukce nebo absence, což vede k nadprodukci onkoproteinu, jehož mRNA je cílová pro příslušnou tumor supresorovou miRNA [45]. Rovněž byly popsány miRNA s duálním, onkogenním i tumor supresorovým efektem [46]. Expresní profil miRNA v nádorech je odlišný od profilu v příslušné nenádorové tkáni, a může proto představovat důležitý nádorový marker s diagnostickým a prognostickým potenciálem nebo vhodný terapeutický cíl [31,47,48].
V nádorech štítné žlázy byla dosud popsána abnormální exprese četných miRNA [20], z nichž však jen některé mají slibný klinický potenciál. Většina deregulovaných miRNA byla prokázána jen sporadicky v různých typech tyreoidálních nádorů a jejich patobiologické a klinické souvislosti nejsou dobře vysvětleny. Hu et al ve své metaanalýze prokázali v 19 studiích celkem 486 deregulovaných miRNA v tyreoidálním karcinomu, z nichž pouze 138 bylo popsáno ve více než dvou studiích. Celkem 90 miRNA vykazovalo vždy jen jeden typ deregulace (zvýšenou, nebo sníženou) a 48 miRNA se vyznačovalo v různých studiích oběma typy deregulace. V 16 studiích byla nalezena zvýšená produkce miR-221-5p a miR-222-5p a miR-146-5p v PTC [38].
Na základě těchto poznatků je velice obtížné identifikovat vhodné miRNA profily použitelné v klinické praxi. Proto jsou nutné další studie zaměřené nejen na zjištění nových typů aberantně exprimovaných miRNA, ale i na biologické funkce miRNA a jejich molekulární mechanizmy a na jejich expresi v různých vzorcích a v různých tkáních. Kromě toho je známo, že srovnávání globální exprese miRNA v různých studiích je obtížné vzhledem k variabilitě laboratorních procesů, souborů pacientů, vzorků a použitých metod. Rovněž se liší zaměření jednotlivých studií exprese miRNA v nádorech štítné žlázy a sledování různých cílů (globální nebo funkční analýza miRNA, diagnostické, prognostické nebo prediktivní souvislosti) [49].
Expresní profily miRNA v non-medulárních karcinomech štítné žlázy
V tab. 2 jsou uvedeny miRNA, které jsou nejčastěji deregulovány v hlavních typech non-medulárních karcinomů štítné žlázy [50]. V papilokarcinomu štítné žlázy bylo dosud popsáno kolem 250 deregulovaných miRNA v PTC, avšak jen malý počet z nich byl uveden ve více studiích [49]. Zjištěné expresní profily značně závisí na použité metodologii. MiR-146b, miR-221 a miR-222 jsou nejčastěji up regulované miRNA v PTC, což vedlo k původní představě o tom, že v PTC nehrají down regulované miRNA podstatnou roli. Studie založené na sekvenování však tento názor vyvrátily a snížená exprese miRNA je považována za významný projev PTC tumorigeneze a je spojena se zvýšenou agresivitou primárního tumoru a tvorbou metastáz do lymfatických uzlin. Zajímavé je rovněž zjištění, že rozdíly v expresních profilech miRNA jsou modulovány v závislosti na mutačním stavu genu BRAF; tj. u BRAFV600E pozitivních nádorů up regulované miRNA vykazují ještě vyšší expresi a naopak down regulované sníženou expresi ve srovnání s nádory BRAFV600E negativními [40,49,51,52]. Ve FTC bylo dosud popsáno méně deregulovaných miRNA než v PTC. Je nutné zdůraznit, že existuje jen ojedinělá studie miRNA ve FTC metodou hlubokého sekvenování [49]. Z klinického hlediska je zajímavé potenciální využití miRNA v diferenciální diagnóze mezi FTC a FA [53]. Málo je známo o miRNA profilu ve špatně diferencovaném karcinomu štítné žlázy, v němž Dettmer et al popsali především miR-150 a miR-23b s diagnostickým a prognostickým využitím [54]. Anaplastický karcinom štítné žlázy může vyrůstat de novo nebo z preexistujících diferencovaných karcinomů PTC a FTC, čemuž napovídá i miRNA profil up regulovaných miR-221, miR-222 a miR-146, které potencují onkogenezi [55].
Tab. 2. Časté profily miRNA ve vybraných karcinomech štítné žlázy [50]. ![Časté profily miRNA ve vybraných karcinomech štítné žlázy [50].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/2b3f11a96d475c9842a5c60837b890dd.png)
PTC – papilární karcinom štítné žlázy, FTC – folikulární karcinom štítné žlázy, PDTC – špatně diferencovaný karcinom štítné žlázy, ATC – naplastický karcinom štítné žlázy, ↑ up regulace, ↓ down regulace Potenciál genetického/epigenetického profilování nádorů štítné žlázy pro klinickou praxi
Morfologická diagnostika nádorů štítné žlázy z folikulárních buněk je založena na subjektivním hodnocení a vyznačuje se značnou variabilitou mezi jednotlivými hodnotiteli, zejména u nádorů s folikulární architektonikou. Podobně limitace vykazuje i odhad agresivity nádorů prováděný na základě klasických klinických ukazatelů. Z těchto důvodů je třeba hledat nové diagnostické a prognostické markery nádorů štítné žlázy. Mutační profil i charakter miRNA exprese se jeví jako slibný molekulární marker. Byly nalezeny mutace a chromozomální přestavby typické pro určitý typ tyreoidálního nádoru (tab. 1), některé z nich vykazují zřejmou asociaci s agresivnějším chováním (např. mutace BRAFV660E) [2,9,16]. V nádorech štítné žlázy byly prokázány určité profily miRNA, které korespondují s histologickým typem nádorů a jejich patobiologickým mechanizmem, diferenciací a prognózou [53,56,57].
Neméně důležitým hlediskem molekulárního profilování nádorů štítné žlázy je hledání vhodných kandidátních molekulárních markerů pro cílené terapeutické strategie. Úspěšný rozvoj cílené terapie tyreoidálních nádorů vyžaduje jednak identifikaci molekul kritických pro vznik a rozvoj maligního fenotypu (např. mutovaný protein, deregulovanou miRNA apod.), jednak vývoj konkrétních léčebných strategií zaměřených proti těmto cílům. Smyslem této nové terapie je její použití pouze u pacientů, kteří z ní budou mít skutečný profit. Nové potenciální terapeutické přístupy zahrnují dva směry – jednak zablokování nežádoucích patologicky aktivovaných signálních drah prostřednictvím inhibitorů, čímž dojde k přerušení stimulů vedoucích k nádorové proliferaci, dediferenciaci, invazi a angiogenezi, jednak ovlivnění epigenetických procesů (demetylační činidla, inhibitory histonové deacetylázy) za účelem obnovení funkce tumor supresorových genů nebo znovunastolení odpovědi nádoru na terapii radiojódem [6,7,9]. Li et al nedávno referovali marker miR-29a, který bývá sníženě exprimován v PTC a negativně koreluje s invazivitou nádoru. Protože miR-29a inhibuje AKT3 v signální dráze PI3K/Akt, potlačuje růst PTC. MiR-29a tak má terapeutický potenciál pro PTC [58].
Z výše uvedených důvodů je tedy další rozvoj molekulárních studií nejen v nádorech štítné žlázy žádoucí. Umožňuje nám detailně poznat všechny mechanizmy a vzájemné souvislosti mezi jevy genetickými a epigenetickými a získat vědecké odůvodnění pro cílenou terapii. Lankenau et al nedávno referovali o vztahu mezi BRAF mutací a zvýšenou expresí miR-3151, která vede ke snížení exprese p53, a tím k potlačení apoptózy. Převáží tak proliferační efekt. Tímto mechanizmem je možné ozřejmit vztah mezi BRAF mutací a TP53 inaktivací, horší chování nádorů s touto mutací a další cíl cílené terapie [59]. V roce 2005 byl zahájen projekt TCGA (The Cancer Genome Atlas) zaměřený na profilaci genové exprese, genotypizaci jednonukleotidových polymorfizmů, genomový metylační profil DNA, profil miRNA a sekvenování genů v různých nádorech. Dosavadní výsledky TCGA výzkumu v oblasti nádorů štítné žlázy přispěly především k hlubšímu molekulárnímu pochopení PTC [52]. Nejnovější údaje z TCGA dokonce navrhují na základě dosavadní molekulární analýzy novou klasifikaci PTC do dvou kategorií: BRAF-like a RAS-like [13].
Závěr
Tyreoidální nádorová medicína vstoupila do nové, molekulární éry, kdy detailní poznání všech molekulárních aspektů může přispět ke zlepšení diagnostiky a prognózování nádorů štítné žlázy i k rozvoji nových léčebných strategií. Genetické a epigenetické změny tvoří nedílný komplex podílející se na aktivaci signálních drah stěžejních pro vznik nádorů z folikulárních buněk. Významnou roli v tomto procesu hrají miRNA, jejichž profilování a srovnávání výsledků jednotlivých studií je však spojeno s mnoha obtížemi a limitacemi. Pouze dokonalé poznání všech těchto procesů nám umožní jejich implementaci do rutinní klinické praxe. Další studie této problematiky, standardizace metod a hodnocení výsledků jsou nutné.
Tato práce byla podpořena projekty Program rozvoje vědních oborů Karlovy univerzity (projekt PRVOUK č. P36) a granty VTR (Pirkanmaa Hospital District), Emil Aaltonen Foundation a Pirkanmaa Cancer Society.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. David Kalfeřt, Ph.D.
Klinika otorinolaryngologie a chirurgie hlavy a krku 1. LF UK a FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: david.kalfert@email.cz
Obdrženo: 19. 10. 2016
Přijato: 2. 11. 2016
Zdroje
1. Hedinger C, Williams ED, Sobin L. Histological Typing of Thyroid Tumours (WHO. World Health Organization. International Histological Classification of Tumours). 2nd ed. Berlin: Springer Science & Business Media 2013.
2. Xing M. Molecular pathogenesis and mechanisms of thyroid cancer. Nat Rev Cancer 2013; 13 (3): 184–199. doi: 10.1038/nrc3431.
3. Ludvíková M, Kholová I. Přehled dosavadních zkušeností s mezinárodní klasifikací tenkojehlové aspirační cytologie štítné žlázy Bethesda 2010. Cesk Patol 2014; 50 (3): 155–160.
4. Kholova I, Ludvikova M. Thyroid atypia of undetermined significance or follicular lesion of undetermined significance: an indispensable Bethesda 2010 diagnostic category or waste garbage? Acta Cytol 2014; 58 (4): 319–329.
5. Cibas ES, Ali SZ. The Bethesda System For Reporting Thyroid Cytopathology. Am J Clin Pathol 2009; 132 (5): 658–665. doi: 10.1309/AJCPPHLWMI3JV4LA.
6. Russo D, Damante G, Puxeddu E et al. Epigenetics of thyroid cancer and novel therapeutic targets. J Mol Endocrinol 2011; 46 (3): R73–R81. doi: 10.1530/JME-10-0150.
7. Catalano MG, Fortunati N, Boccuzzi G. Epigenetics modifications and therapeutic prospects in human thyroid cancer. Front Endocrinol (Lausanne) 2012; 3 : 40.
8. Menon MP, Khan A. Micro-RNAs in thyroid neoplasms: molecular, diagnostic and therapeutic implications. J Clin Pathol 2009; 62 (11): 978–985. doi: 10.1136/jcp.2008.063909.
9. Xing M, Haugen BR, Schlumberger M. Progress in molecular-based management of differentiated thyroid cancer. Lancet 2013; 381 (9871): 1058–1069. doi: 10.1016/S0140-6736 (13) 60109-9.
10. Ludvíková M, Pešta M, Holubec L Jr et al. Nové aspekty patobiologie nádorů. Cesk Patol 2009; 45 (4): 94–99.
11. Faam B, Ghaffari MA, Ghadiri A et al. Epigenetic modifications in human thyroid cancer. Biomed Rep 2015; 3 (1): 3–8.
12. Tanaka TN, Alloju SK, Oh DK et al. Thyroid cancer: molecular pathogenesis, tyrosine kinase inhibitors, and other new therapies. Am J Hematol Oncol 2015; 11 (4): 5–9.
13. Papp S, Asa SL. When thyroid carcinoma goes bad: a morphological and molecular analysis. Head Neck Pathol 2015; 9 (1): 16–23. doi: 10.1007/s12105-015-0619-z.
14. Vu-Phan D, Koenig RJ. Genetics and epigenetics of sporadic thyroid cancer. Mol Cell Endocrinol 2014; 386 (1–2): 55–66. doi: 10.1016/j.mce.2013.07.030.
15. Boufraqech M, Patel D, Xiong Y et al. Diagnosis of thyroid cancer: state of art. Expert Opin Med Diagn 2013; 7 (4): 331–342. doi: 10.1517/17530059.2013.800481.
16. Gilfillan CP. Review of the genetics of thyroid tumours: diagnostic and prognostic implications. ANZ J Surg 2010; 80 (1–2): 33–40. doi: 10.1111/j.1445-2197.2009.05173.x.
17. Máximo V, Botelho T, Capela J et al. Somatic and germline mutation in GRIM-19, a dual function gene involved in mitochondrial metabolism and cell death, is linked to mitochondrion-rich (Hurthle cell) tumours of the thyroid. Br J Cancer 2005; 92 (10): 1892–1898.
18. Máximo V, Rios E, Sobrinho-Simoes M. Oncocytic lesions of the thyroid, kidney, salivary glands, adrenal cortex, and parathyroid glands. Int J Surg Pathol 2014; 22 (1): 33–36. doi: 10.1177/1066896913517938.
19. White MG, Nagar S, Aschebrook-Kilfoy B et al. Epigenetic Alterations and Canonical Pathway Disruption in Papillary Thyroid Cancer: A Genome-wide Methylation Analysis. Ann Surg Oncol 2016; 23 (7): 2302–2309. doi: 10.1245/s10434-016-5185-4.
20. Zhang R, Hardin H, Chen J et al. Non-Coding RNAs in Thyroid Cancer. Endocr Pathol 2016; 27 (1): 12–20. doi: 10.1007/s12022-016-9417-8.
21. Lee RC, Feinbaum RL, Ambros V. The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14. Cell 1993; 75 (5): 843–854.
22. Fire A, Xu S, Montgomery MK et al. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature 1998; 391 (6669): 806–811.
23. Tuschl T, Zamore PD, Lehmann R et al. Targeted mRNA degradation by double-stranded RNA in vitro. Genes Dev 1999; 13 (24): 3191–3197.
24. Zhou X, Yang PC. MicroRNA: a small molecule with a big biological impact. Microrna 2012; 1 (1): 1.
25. Ross JS, Carlson JA, Brock G. miRNA: the new gene silencer. Am J Clin Pathol 2007; 128 (5): 830–836.
26. Cammaerts S, Strazisar M, De Rijk P et al. Genetic variants in microRNA genes: impact on microRNA expression, function, and disease. Front Genet 2015; 6 : 186. doi: 10.3389/fgene.2015.00186.
27. Rodrigues RF, Roque L, Rosa-Santos J et al. Chromosomal imbalances associated with anaplastic transformation of follicular thyroid carcinomas. Br J Cancer 2004; 90 (2): 492–496.
28. Kalfert D, Pesta M, Kulda V et al. MicroRNA profile in site-specific head and neck squamous cell cancer. Anticancer Res 2015; 35 (4): 2455–2463.
29. Vinklárek J, Novák J, Bienertová-Vašků J et al. Role mikroRNA v patofyziologii neuroblastomu a možnosti jejich využití pro diagnostiku, odhad prognózy a terapii. Klin Onkol 2014; 27 (5): 331–339. doi: 10.14735/ amko2014331.
30. Novák J, Souček M. MikroRNA a vnitřní lékařství: od patofyziologie k novým diagnostickým a terapeutickým postupům. Vnitr Lek 2016; 62 (6): 477–485.
31. Lu J, Getz G, Miska EA et al. MicroRNA expression profiles classify human cancers. Nature 2005; 435 (7043): 834–838.
32. Rossing M, Kaczkowski B, Futoma-Kazmierczak E et al. A simple procedure for routine RNA extraction and miRNA array analyses from a single thyroid in vivo fine needle aspirate. Scand J Clin Lab Invest 2010; 70 (8): 529–534. doi: 10.3109/00365513.2010.522250.
33. Agretti P, Ferrarini E, Rago T et al. MicroRNA expression profile helps to distinguish benign nodules from papillary thyroid carcinomas starting from cells of fine-needle aspiration. Eur J Endocrinol 2012; 167 (3): 393–400. doi: 10.1530/EJE-12-0400.
34. Chen YT, Kitabayashi N, Zhou XK et al. MicroRNA analysis as a potential diagnostic tool for papillary thyroid carcinoma. Mod Pathol 2008; 21 (9): 1139–1146. doi: 10.1038/modpathol.2008.105.
35. Ludvikova M, Kalfert D, Kholova I. Pathobiology of MicroRNAs and Their Emerging Role in Thyroid Fine-Needle Aspiration. Acta Cytol 2015; 59 (6): 435–444. doi: 10.1159/000442145.
36. Yu S, Liu Y, Wang J et al. Circulating microRNA profiles as potential biomarkers for diagnosis of papillary thyroid carcinoma. J Clin Endocrinol Metab 2012; 97 (6): 2084–2092.
37. Cheng G. Circulating miRNAs: roles in cancer diagnosis, prognosis and therapy. Adv Drug Deliv Rev 2015; 81 : 75–93. doi: 10.1016/j.addr.2014.09.001.
38. Hu Y, Wang H, Chen E et al. Candidate microRNAs as biomarkers of thyroid carcinoma: a systematic review, meta-analysis, and experimental validation. Cancer Med 2016; 5 (9): 2602–2614. doi: 10.1002/cam4.811.
39. Lee LW, Zhang S, Etheridge A et al. Complexity of the microRNA repertoire revealed by next-generation sequencing. RNA 2010; 16 (11): 2170–2180. doi: 10.1261/rna.2225110.
40. Saiselet M, Gacquer D, Spinette A et al. New global analysis of the microRNA transcriptome of primary tumors and lymph node metastases of papillary thyroid cancer. BMC Genomics 2015; 16 : 828. doi: 10.1186/s12864-015-2082-3.
41. Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function. Cell 2004; 116 (2): 281–297.
42. Calin GA, Sevignani C, Dumitru CD et al. Human microRNA genes are frequently located at fragile sites and genomic regions involved in cancers. Proc Natl Acad Sci U S A 2004; 101 (9): 2999–3004.
43. Marini F, Luzi E, Brandi ML. MicroRNA Role in Thyroid Cancer Development. J Thyroid Res 2011; 2011 : 407123. doi: 10.4061/2011/407123.
44. Ryan BM, Robles AI, Harris CC. Genetic variation in microRNA networks: the implications for cancer research. Nat Rev Cancer 2010; 10 (6): 389–402. doi: 10.1038/nrc2867.
45. Metias SM, Lianidou E, Yousef GM. MicroRNAs in clinical oncology: at the crossroads between promises and problems. J Clin Pathol 2009; 62 (9): 771–776.
46. Fabbri M, Ivan M, Cimmino A et al. Regulatory mechanisms of microRNAs involvement in cancer. Expert Opin Biol Ther 2007; 7 (7): 1009–1019.
47. Negrini M, Ferracin M, Sabbioni S et al. MicroRNAs in human cancer: from research to therapy. J Cell Sci 2007; 120 (Pt 11): 1833–1840.
48. Acunzo M, Romano G, Wernicke D et al. MicroRNA and cancer – a brief overview. Adv Biol Regul 2015; 57 : 1–9. doi: 10.1016/j.jbior.2014.09.013.
49. Saiselet M, Pita JM, Augenlicht A et al. MiRNA expression and function in thyroid carcinomas: a comparative and critical analysis and a model for other cancers. Oncotarget 2016; 7 (32): 52475–52492. doi: 10.18632/oncotarget.9655.
50. Pallante P, Visone R, Croce CM et al. Deregulation of microRNA expression in follicular-cell-derived human thyroid carcinomas. Endocr Relat Cancer 2010; 17 (1): F91–F104. doi: 10.1677/ERC-09-0217.
51. Mancikova V, Castelblanco E, Pineiro-Yanez E et al. MicroRNA deep-sequencing reveals master regulators of follicular and papillary thyroid tumors. Mod Pathol 2015; 28 (6): 748–757.
52. Cancer Genome Atlas Research Network. Integrated genomic characterization of papillary thyroid carcinoma. Cell 2014; 159 (3): 676–690. doi: 10.1016/j.cell.2014.09. 050.
53. Yuan ZM, Yang ZL, Zheng Q. Deregulation of microRNA expression in thyroid tumors. J Zhejiang Univ Sci B 2014; 15 (3): 212–224. doi: 10.1631/jzus.B1300192.
54. Dettmer MS, Perren A, Moch H et al. MicroRNA profile of poorly differentiated thyroid carcinomas: new diag-nostic and prognostic insights. J Mol Endocrinol 2014; 52 (2): 181–189. doi: 10.1530/JME-13-0266.
55. Fuziwara CS, Kimura ET. MicroRNA Deregulation in Anaplastic Thyroid Cancer Biology. Int J Endocrinol 2014; 2014 : 743450. doi: 10.1155/2014/743450.
56. Forte S, La Rosa C, Pecce V et al. The role of microRNAs in thyroid carcinomas. Anticancer Res 2015; 35 (4): 2037–2047.
57. Leonardi GC, Candido S, Carbone M et al. MicroRNAs and thyroid cancer: biological and clinical significance (Review). Int J Mol Med 2012; 30 (5): 991–999. doi: 10.3892/ijmm.2012.1089.
58. Li R, Liu J, Li Q et al. MiR-29a suppresses growth and metastasis in papillary thyroid carcinoma by targeting AKT3. Tumour Biol 2016; 37 (3): 3987–3996. doi: 10.1007/s13277-015-4165-9.
59. Lankenau MA, Patel R, Liyanarachchi S et al. MicroRNA-3151 inactivates TP53 in BRAF-mutated human malignancies. Proc Natl Acad Sci U S A 2015; 112 (49): E6744–E6751. doi: 10.1073/pnas.1520390112.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2017 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Nejasný stín na plicích – kazuistika
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Tři v jednom aneb onkotriády
- Soutěž o nejlepší práci
- Molekulární aspekty nádorů štítné žlázy se zaměřením na mikroRNA a jejich klinické souvislosti
- Súčasný pohľad na diagnostiku a liečbu karcinómu obličky
- Maligní melanom – od klasické histologie k molekulárně genetickému testování
- Nové léky v terapii akutní myeloidní leukemie u starších pacientů
- Mnohopočetný výskyt bazocelulárneho karcinómu – retrospektívna analýza 899 pacientov s biopticky verifikovanými léziami na jednom pracovisku
- Karcinom prsu u mladých žen – korelace klinických, histomorfologických a molekulárně-genetických nálezů karcinomu prsu u žen mladších 35 let
- Dlouhodobá kompletní odpověď metastázy kolorektálního karcinomu po biochemoterapii
- Izolovaná perfuze horní končetiny s TNF-α – dvojitá kanylace žilního systému
- SAMPUS, MELTUMP a THIMUMP – diagnostické kategorie charakterizované nejistým biologickým chováním
- Aktuality z odborného tisku
- Profesor MUDr. Luboš Petruželka, CSc. – životní jubileum
- Informace z České onkologické společnosti
- Kožní toxicita u cílené léčby dabrafenibem
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Súčasný pohľad na diagnostiku a liečbu karcinómu obličky
- SAMPUS, MELTUMP a THIMUMP – diagnostické kategorie charakterizované nejistým biologickým chováním
- Maligní melanom – od klasické histologie k molekulárně genetickému testování
- Karcinom prsu u mladých žen – korelace klinických, histomorfologických a molekulárně-genetických nálezů karcinomu prsu u žen mladších 35 let
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



