-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Súčasný pohľad na diagnostiku a liečbu karcinómu obličky
Recent Overview of Kidney Cancer Diagnostics and Treatment
The incidence of kidney cancer has increased in the majority of countries worldwide, and this disease has relatively high lethality. For many years, the Slovak Republic has been among the countries with the highest kidney cancer incidence, in particular in 2012 (according to global estimated values) in both genders, although mainly in females. In the last few years, the Czech Republic has had the highest incidence of kidney cancer worldwide. The use of imaging techniques such as ultrasound and computerized tomography has increased the detection of asymptomatic renal cell cancer. Etiological factors include lifestyle factors such as smoking, obesity, and hypertension. Nephrectomy and partial nephrectomy are the standard treatments. Locally confined tumors in stage T1 should be treated with kidney-preserving surgery. Minimally invasive surgery is often possible as long as the surgeon has the requisite experience. For patients with metastases, overall and progression-free survival can be prolonged by pharmacotherapy with VEGF and mTOR inhibitors. The resection or irradiation of metastases can be a useful palliative treatment for patients with brain or osseal metastases that are painful or increase the risk of fracture. Minimally invasive surgery and new systemic drugs have expanded the therapeutic options for patients with renal cell carcinoma. The search for new predictive and prognostic markers is now in progress.
Key words:
kidney cancer – epidemiology – risk factors – pathology – diagnosis – therapy
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.Submitted:
2. 12. 2016Accepted:
3. 1. 2017
Autoři: J. Marenčák 1; M. Ondrušová 1,2; D. Ondruš 3
Působiště autorů: Vysoká škola zdravotníctva a sociálnej práce sv. Alžbety, Bratislava 1; Pharm-In, spol. s. r. o., Bratislava 2; I. onkologická klinika LF UK a Onkologického ústavu sv. Alžbety, Bratislava 3
Vyšlo v časopise: Klin Onkol 2017; 30(3): 175-181
Kategorie: Přehled
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amko2017175Souhrn
Zhubné nádory obličky predstavujú v súčasnosti závažnú diagnózu v onkologickej urológii, predovšetkým pre rastúce hodnoty ich incidencie vo väčšine krajín sveta a pre pomerne vysokú letalitu. Slovensko sa v celosvetových odhadoch pre rok 2012 zaraďuje ku krajinám s vysokými hodnotami incidencie zhubných nádorov obličky u oboch pohlaví, najmä u žien, pričom prvenstvo v nameraných hodnotách výskytu tohto ochorenia má v posledných rokoch a u oboch pohlaví Česká republika. Použitie zobrazovacích metód, ako je ultrasonografia a počítačová tomografia, zlepšilo možnosti detekcie asymptomatického karcinómu obličky. Etiologické faktory zahŕňajú faktory životného štýlu, ako sú fajčenie, obezita a vysoký krvný tlak. Nefrektómia a parciálna nefrektómia sú štandardné liečebné procedúry. Nádory obmedzené na obličku v štádiu T1 je potrebné liečiť chirurgicky so snahou o zachovanie obličky. Minimálne invazívna chirurgia je veľakrát možná aj v iných prípadoch, pokiaľ má operatér potrebné skúsenosti. U pacientov s metastázami môže byť celkové prežívanie a prežívanie bez progresie predĺžené použitím inhibítorov VEGF a mTOR farmakoterapie. Resekcia alebo ožarovanie metastáz môže byť užitočnou paliatívnou liečbou u pacientov s metastázami do mozgu alebo v prípade kostných metastáz, ktoré sú bolestivé alebo zvyšujú riziko zlomenín. Minimálne invazívna chirurgia a nové systémové liečivá rozšírili možnosti liečby pacientov s karcinómom obličiek. V súčasnosti sa hľadajú nové prediktívne a prognostické markery karcinómu obličky.
Kľúčové slová:
karcinóm obličky – epidemiológia – rizikové faktory – patológia – diagnostika – liečbaEpidemiológia
Zhubné nádory obličky tvoria celosvetovo 2–3 % zo všetkých nádorov u dospelej populácie. Odhady pre rok 2012 indikujú ich pozíciu na 9. miesto v rebríčku všetkých nádorov u mužov a 14. miesto u žien. Zo zhubných nádorov urologickej lokalizácie sú na treťom mieste (za nádormi prostaty a močového mechúra), pričom 85–90 % zo všetkých histologických typov tvoria karcinómy z obličkových buniek (renal cell carcinoma – RCC) a 2–6 % tvoria nádory obličky v detskom veku. Zhubné nádory obličky predstavujú v súčasnosti závažnú diagnózu v onkologickej urológii, predovšetkým pre rastúce hodnoty ich incidencie vo väčšine krajín sveta [1,2] a pre pomerne vysokú letalitu [2,3].
Hodnoty incidencie zhubných nádorov obličiek v globálnom meradle varírujú viac ako 10-násobne, vyššie priemerné hodnoty sa zaznamenávajú vo vyspelých krajinách sveta v porovnaní s rozvojovými [3]. Vzostup incidencie tohto ochorenia je o niečo prudší u žien ako u mužov a u černochov v porovnaní s belochmi [4,5]. Najvyššie hodnoty incidencie zhubných nádorov obličky sa opakovane zaznamenávajú v oblastiach strednej Európy a Škandinávie, Severnej Ameriky a Austrálie, stredné hodnoty výskytu ochorenia sú v južnej Európe a v Japonsku a najnižšie v Ázii, Afrike a v oblasti Pacifiku. Geografické rozdiely v distribúcii incidencie ochorenia môžu nepriamo indikovať fakt, že riziko vývoja zhubných nádorov obličky je vyššie u belochov než u aziatov, ale môže to byť taktiež spôsobené aj rozdielnou prevalenciou rizikových faktorov spájaných so životným štýlom. Najnižšie hodnoty incidencie sú síce u Afričanov, avšak u Afro-Američanov sú naopak najvyššie. Rozdiely v geografickej a/alebo rasovej distribúcii ochorenia sú pravdepodobne ovplyvnené rôznou frekvenciou diagnostických zobrazovacích metodík a prevalenciou rizikových faktorov životného prostredia [6].
Časové trendy incidencie zhubných nádorov obličiek sa v niektorých krajinách zmenili. Po predchádzajúcom vzostupnom trende sa za posledných 10 rokov zaznamenáva pokles hodnôt u oboch pohlaví v niektorých vyspelých krajinách západnej a severnej Európy, avšak vo východnej Európe má incidencia stále vzostupný trend [7,8]. Prvenstvo v nameraných hodnotách výskytu ochorenia má v celosvetovom meradle najmä v posledných rokoch a u oboch pohlaví Česká republika (ČR). Odhad štandardizovanej incidencie priamou metódou na svetovú štandardnú populáciu (age standardized rates – world) – ASR-W pre rok 2012 predstavoval podľa IARC WHO 24,1/100 000 u mužov a 10,5/100 000 u žien [2]. Ku krajinám s vysokými, resp. stredne vysokými hodnotami incidencie ochorenia u mužov patrili v tom istom období u mužov aj pobaltské krajiny: Litva (20,5/100 000) a Estónsko (17,6/100 000), nasledované Slovenskou republikou (SR) (17,5/100 000). U žien sa v odhadoch ASR-W incidencie IARC WHO pre rok 2012 umiestnila SR na 2. mieste (hneď za ČR s ASR-W incidenciou 10,5/100 000) SR (8,7/100 000), nasledovaná USA (8,5/100 000).
Úmrtnosť na nádory obličiek sa v Európe zvyšovala od polovice 50. rokov až do konca 80., resp. začiatku 90. rokov uplynulého storočia. Následne sa zaznamenala stabilizácia, resp. pokles jej hodnôt, najmä v krajinách západnej Európy [9]. I napriek tomuto poklesu sú však hodnoty celkovej mortality v krajinách strednej a východnej Európy stále vysoké [9,10].
Podľa aktuálnych údajov Národného onkologického registra SR (zverejnených v apríli 2017) sa na Slovensku diagnostikovalo v roku 2010 [11] 679 zhubných nádorov obličiek u mužov (hrubá incidencia (CR) 25,7/100 000, štandardizovaná (ASR-W) 18,8/100 000) a 434 prípadov u žien (CR 15,5/100 000, ASR-W 9,3/100 000). Zhubné nádory obličky sa v roku 2010 podieľali 4,2 % na všetkých zhubných nádoroch diagnostikovaných v SR u mužov a 2,7 % u žien, čím sa umiestnili na 7. (muži) a 8. (ženy) mieste v rebríčku výskytu zhubných nádorov v SR (s výnimkou ne-melanómových nádorov kože).
V roku 2010 zomrelo v SR 209 mužov so zhubným nádorom obličky, čo predstavuje hrubú mortalitu 7,9/100 000 a ASR-W 5,6/100 000. V tom istom roku zomrelo v SR 114 žien so zhubným nádorom obličky, čo predstavuje hrubú mortalitu 4,1/100 000 a ASR-W 2,0/100 000 [11].
Podľa výsledkov join-point regresnej analýzy v rokoch 1978–2008 vykazovala ASR-W incidencia zhubných nádorov obličky u mužov v SR zlomové obdobie v roku 1991, z čoho vyplývali dva časové trendy: v rokoch 1978–1991 mala incidencia signifikantne rýchlejšie rastúci trend, pričom priemerný percentuálny medziročný nárast predstavoval 6,6 %, v rokoch 1991–2008 sa nárast incidencie spomalil na medziročnú hodnotu 2 %. Vývoj ASR-W incidencie u žien vykazuje podobné paralely ako u mužov, zlomové obdobie sa zaznamenalo v roku 1990, pričom incidencia mala v rokoch 1978–1990 signifikantne vzostupný trend o priemernú medziročnú hodnotu 6,6 % a v rokoch 1990–2008 sa jej nárast spomalil na hodnotu 2 % [12].
Rizikové faktory
Fajčenie, obezita a vysoký krvný tlak zvyšujú riziko vzniku a vývoja karcinómu RCC. Odhaduje sa, že fajčenie zvyšuje riziko RCC o 54 % u mužov a o 22 % u žien; pričom u oboch pohlaví existuje priama korelácia medzi denným počtom vyfajčených cigariet/dobou trvania tohto zlozvyku a incidenciou RCC. Kvantitatívne zvýšenie rizika RCC (o 24 % u mužov a o 34 % u žien) bolo zaznamenané pri vzostupe telesnej hmotnosti (body mass indexu – BMI) o 5 kg/m². Pacienti v terminálnom štádiu renálnej insuficiencie majú 4-násobne vyššie riziko vzniku a vývoja RCC. Účinná kontrola hypertenzie, eliminácia fajčenia a redukcia BMI sú najvýznamnejšie faktory primárnej prevencie RCC. Celkom 5–10 % pacientov s RCC má pozitívnu rodinnú anamnézu (napr. von Hippel-Lindauova choroba a pod.). Jedinci s podozrením na RCC na dedičnom základe by mali absolvovať aj genetické vyšetrenie [13–20].
Patológia
Histologické podtypy RCC sa líšia ich pôvodom a biologickým správaním a mali by sa stanovovať na základe aktuálnej WHO klasifikácie. Karcinóm z jasných buniek je najbežnejším podtypom (u 70 % RCC), papilárny karcinóm typ I a II je zaznamenaný u 15 % a chromofóbny podtyp u 5 % [13–16]. Fuhrmanovej histologická klasifikácia sa doteraz prijímala ako základný hodnotiaci systém a nezávislý prognostický faktor pre RCC. Medzinárodná spoločnosť pre urologickú patológiu (International Society of Urological Pathology – ISUP) nedávno navrhla iné, zjednodušené triedenie – len na základe veľkosti a tvaru jadierok (tzv. Vancouverská histologická klasifikácia) [21].
Prognóza
Renálny karcinóm je príčinou 2,6 % všetkých úmrtí na rakovinu u mužov a 2,1 % u žien. Priemerná 5-ročná miera prežívania (75 % u mužov a 77 % u žien) je vyššia v porovnaní s inými typmi zhubných nádorov. Prognóza závisí hlavne na štádiu ochorenia – pre pacientov s RCC v štádiách I, II, III a IV bolo zaznamenané 5-ročné prežitie u 97, 87, 69 a 14 % (tab. 1) [13,14]. V súčasnosti sú už k dispozícii aj multifaktoriálne prognostické modely, ktoré nielenže oveľa presnejšie predpovedajú liečebné výsledky, ale umožňujú aj optimálnejší výber terapie RCC (napr. nefrón šetriacu chirurgiu, ablačné techniky a pod.). Tieto systémy (napr. PADUA – Preoperative Aspects and Dimensions Used for an Anatomical klasifikačný systém; R.E.N.A.L. nefrometrické skóre; C index) posudzujú anatomické parametre: veľkosť nádoru, jeho exofytické/endofytické charakteristiky a lokalizáciu, blízkosť zberného obličkového systému a renálneho sinusu a pod. Avšak pri výbere najlepšieho spôsobu liečby RCC je potrebné hodnotiť anatomické parametre vždy v korelácii s funkčnými hodnotami a so skúsenosťami lekára. Zatiaľ nie je dostatok dôkazov na využitie molekulárnych markerov pre prognózovanie RCC [13–16].
Tab. 1. TNM klasifikačný systém na stanovenie štádia karcinómu obličky. 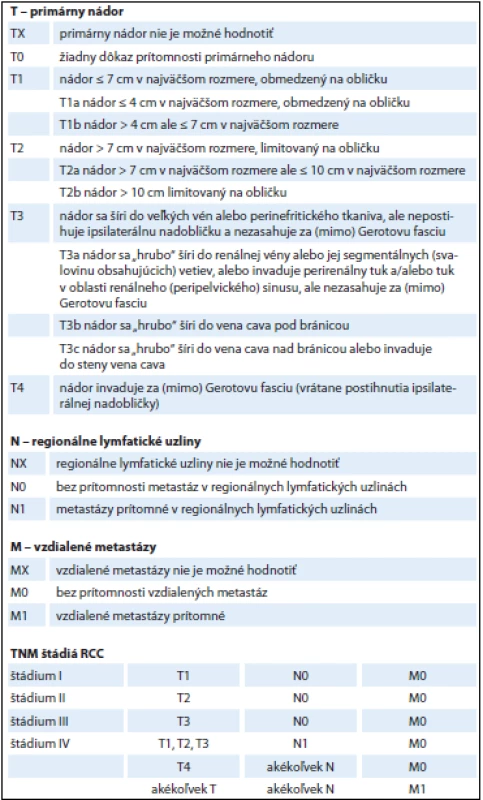
Diagnostika
Mnohé obličkové „masy“ zostanú bez príznakov až do neskorých štádií ochorenia. Viac ako 50 % RCC je zistených na základe neinvazívnych zobrazovacích postupov, napr. ultrasonografie (USG) alebo počítačovej tomografie (CT), pri objasňovaní rôznych nešpecifických príznakov a ďalších brušných ochorení. Klasická triáda (bolesti v boku, makroskopická hematúria a hmatateľná rezistencia v bruchu) je v súčasnosti vzácny (u 6–10 %) nález, ktorý koreluje s agresívnou histológiou a s pokročilým ochorením. Paraneoplastické syndrómy (napr. Stauferov a pod.) sa vyskytujú u približne 30 % pacientov so symptomatickým RCC. Niektorí symptomatickí pacienti sa prejavia príznakmi spôsobenými metastatickým ochorením, ako je napr. bolesť kostí alebo pretrvávajúci kašeľ. Pre predoperačné diagnostické zhodnotenie pacientov s primárnym RCC by sa malo urobiť CT vyšetrenie na stanovenie presného lokálneho stagingu na prípadnú plánovanú nefrón šetriacu chirurgiu (obr. 1 a 2) [18,19]. U pacientov s RCC a s podozrením na nádorové postihnutie renálnej veny a/alebo dolnej dutej žily by sa mala urobiť magnetická rezonancia (MRI). U asymptomatických jedincov s RCC > 3 cm sa odporúča vykonať aj CT hrudníka. Ak existuje klinický dôkaz kostných metastáz, je potrebné realizovať príslušné zobrazovacie štúdie, pričom nízko dávkové (low-dose) celotelové CT alebo MRI je lepšie ako scintigrafia kostí. U osôb s podozrením na mozgové metastázy je indikované kontrastné MRI hlavy [13–16].
Obr. 1. CT obraz u 72-ročného muža s pokročilým RCC ľavej obličky (označené červenou šípkou) a aj s metastázami v regionálnych lymfatických uzlin (označené červenými krížikmi); s pacientom konzultovaná cytoreduktívna nefrektómia, ktorú odmietol a preto realizovaná systémová terapia; exitus na generalizáciu procesu 9 mesiacov po stanovení diagnózy [18,19]. ![CT obraz u 72-ročného muža s pokročilým RCC ľavej obličky (označené červenou šípkou) a aj s metastázami v regionálnych lymfatických uzlin (označené červenými krížikmi); s pacientom konzultovaná cytoreduktívna nefrektómia, ktorú odmietol a preto realizovaná systémová terapia; exitus na generalizáciu procesu 9 mesiacov po stanovení diagnózy [18,19].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/3d8096ff46fbbbad4d07ac8ef77daea9.png)
Obr. 2. CT obraz u 62-ročného muža po pravostrannej nefrektómii pre zhubný nádor obličky pred 11 rokmi s nálezom RCC v strednej tretine ľavej obličky (červená šípka); urobená resekcia tumoru; pacient žije 6 rokov po druhej operácii [18,19]. ![CT obraz u 62-ročného muža po pravostrannej nefrektómii pre zhubný nádor obličky pred 11 rokmi s nálezom RCC v strednej tretine ľavej obličky (červená šípka); urobená resekcia tumoru; pacient žije 6 rokov po druhej operácii [18,19].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/e76b6657a908dc7da43cfb5e5f618d47.png)
Tkanivová biopsia sa až do nedávna považovala za kontraindikovanú u pacientov s podozrením na RCC bez metastáz. Riziko šírenia tumoru pri odbere renálneho tkaniva sa však nepotvrdilo a je zanedbateľné. Biopsia obličky je indikovaná najmä: 1. u jedincov s obličkovou „masou neistej povahy“, pretože môže ovplyvniť výber a spôsob terapie; 2. pred ablačnou terapiou (napr. kryoablácia, rádiofrekvenčná ablácia a pod.); 3. u osôb s metastatickým RCC pred systémovou terapiou a/alebo cytoredukčnou nefrektómiou, u ktorých nie je histologicky potvrdená diagnóza karcinómu obličky (ani histologický podtyp, ani či sa jedná o primárny nádor alebo metastázu z iného orgánu tela); 4. u pacientov aktívne sledovaných pre RCC. Odporúča sa odobrať min. 2 vzorky tkaniva (v podobe tenkých valcov) pod USG alebo CT kontrolou. So zavedením pojmu sentinelovej lymfatickej uzliny/uzlín pred viac ako 20 rokmi sa ďalej prepracováva metodika a technika včasnej detekcie okultných metastáz do lymfatického systému (obr. 3) [18]. Vzhľadom k tomu, že RCC má dokázané hematogénne šírenie a nepredvídateľnú lymfatickú drenáž, význam lymfadenektómie pri RCC zostáva kontroverzný. Mapovanie sentinelovej lymfatickej uzliny však môže pomôcť zistiť aberantnú drenáž pri RCC [13–20].
Obr. 3. Sentinelová lymfatická uzlina u 42-ročného muža s karcinómom obličky [18]. Po inzercii ihly pod USG kontrolou <sup>99</sup>mTc- -nanokoloid aplikovaný do nádoru; následne urobený transverzálny SPECT/CT, ktorý ukazuje parakaválne umiestnenú sentinelovú lymfatickú uzlinu (žltá šípka), ktorá bola lokalizovaná aj s pomocou prenosnej gamakamery. ![Sentinelová lymfatická uzlina u 42-ročného muža s karcinómom obličky [18]. Po inzercii ihly pod USG kontrolou <sup>99</sup>mTc- -nanokoloid aplikovaný do nádoru; následne urobený transverzálny SPECT/CT, ktorý ukazuje parakaválne umiestnenú sentinelovú lymfatickú uzlinu (žltá šípka), ktorá bola lokalizovaná aj s pomocou prenosnej gamakamery.](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/c4831be186af8ba356391b21d707d7f7.png)
Primárna liečba karcinómu obličky bez metastáz
RCC lokalizovaný na obličku by sa mal riešiť chirurgicky – pričom štandardnou terapiou je nefrektómia (podľa okolností buď totálna alebo parciálna). Štúdie nepreukázali žiadny rozdiel medzi celkovým a tumor špecifickým prežívaním medzi chirurgickou („otvorenou“) a laparoskopickou nefrektómiou. RCC obmedzený na obličku (najmä štádiá T1, ale aj T2) by sa mali riešiť operáciou zachovávajúcou aspoň časť obličky (tzv. nefrón šetriaca chirurgia). Za priaznivých okolností je možné „lokálne“ a bezpečne odstrániť aj nádor v strednej tretine obličky (obr. 4). Ukazuje sa, že pacienti s histologicky pozitívnymi okrajmi po záchovnej operácii sú vystavení zvýšenému (11,5×) riziku lokálnej recidívy, ale bez významného vplyvu na prežívanie. Veľakrát je však potrebné radikálne „kompletné“ odstránenie obličky aj s rozsiahlym tumorom (obr. 5) [18]. V prípade, že zobrazovacie vyšetrenia a peroperačný nález nenaznačujú postihnutie lymfatického systému, lymfadenektómia nie je potrebná. U pacientov s RCC a so zväčšenými lymfatickými uzlinami by naopak mala byť urobená lymfadenektómia za účelom jednak lokálnej kontroly nádorového procesu a tiež na spresnenie štádia RCC. Adrenalektómia nie je potrebná v prípade negatívnych nálezov na predoperačných zobrazovacích vyšetreniach a pri neprítomnosti postihnutia nadobličky pri operácii. Zatiaľ existuje len veľmi malý počet prospektívnych, randomizovaných klinických štúdií, ktoré sa venujú problematike chirurgickej liečby (prístup, rozsah, technika resekcie a pod.) u pacientov s lokálne obmedzeným (T1–2 N0 M0) alebo lokálne pokročilým (T3–4 N0 M0; alebo T1–4 N+ M0) RCC [13–16,21,22]. Chirurgické odstránenie nádoru obličky a trombu vo vena cava sa jednoznačne odporúča u pacientov s inak nemetastatickým RCC [13–16]. Rádiofrekvenčná ablácia tumoru alebo kryoablácia sa môže navrhnúť pacientom s malými nádormi obličiek, ktorí majú súbežne viacero iných závažných ochorení a/alebo obmedzenú životnosť (< 5 rokov). Pred každou takouto terapiou by sa mala urobiť perkutánna biopsia nádoru obličky [13–16]. V súčasnosti neexistuje jednotná definícia pojmov „aktívneho dozoru (active surveilance) “ a „pozorného vyčkávania (watchful waiting) “, ako ani žiadne objektívne kritériá na výber vhodných pacientov s RCC na takýto postup. Prospektívne randomizované štúdie ohľadom kryoablácie, rádiofrekvenčnej ablácie, ako aj koncepcie aktívneho dohľadu u jedincov s RCC zatiaľ absentujú [13–16,23]. Rádioterapia a zrejme aj chemoterapia nehrajú žiadnu úlohu v liečbe lokalizovaného alebo lokálne pokročilého RCC [13–16].
Obr. 4. Schéma resekcie zhubného nádoru obličky lokalizovaného v strednej tretine obličky s významom plánovania iniciálnej incízie s ohľadom na následný rozsah ischémie renálneho parenchýmu. 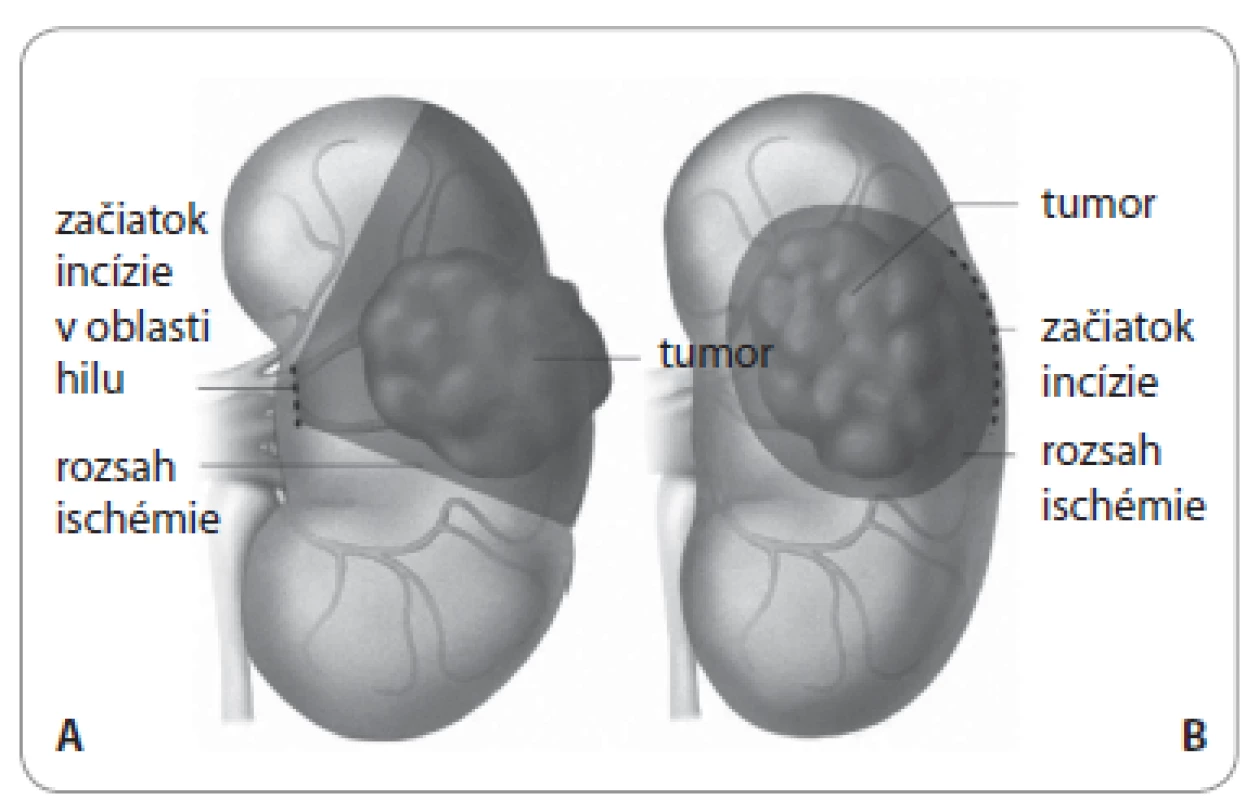
Obr. 5. Operačný preparát po radikálnej nefrektómii pre pokročilý ľavostranný RCC u 68-ročnej ženy [18]. ![Operačný preparát po radikálnej nefrektómii pre pokročilý ľavostranný RCC u 68-ročnej ženy [18].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/794c893ece5af988d903d579385b8d47.png)
Sledovanie pacientov s karcinómom obličky bez metastáz
Pacienti bez metastáz a po primárnej liečbe RCC by sa mali dispenzarizovať podľa rizikovosti. Klasifikáciu rizika RCC je potrebné urobiť na základe patologického štádia (pT a pN), stupňa diferenciácie tumoru (grading), typu liečby (resekcia vs. ablatívne techniky), histologickej pozitivity okrajov odobratého tumoru (u nefrón šetriaceho typu operácie) a pod. Pre rutinné sledovanie nie je indikované vyšetrenie pomocou pozitrónovej emisnej tomografie (PET) v kombinácii s CT, ani CT a MRI hlavy, konvenčná RTG snímka hrudníka, kostná scintigrafia. V závislosti na stupni rizika sa odporúčajú rôzne vyšetrovacie modality a časové intervaly dispenzarizácie pacientov s RCC [13,14,16].
Systémová liečba metastatického karcinómu obličky
Liečba metastatického RCC má skôr paliatívny ako kuratívny charakter. Lieky ovplyvňujúce imunitný systém (interferón, interleukín) sa používali na tento účel až do roku 2004 a ich aplikácia bola spojená s mediánom celkového prežívania 1–1,5 roka [13,14,24]. Takzvané cielené lieky sa stali dostupné v roku 2005, pričom ich využitím prišlo k výraznému predĺženiu doby prežitia. V súčasnosti sú k dispozícii jednak inhibítory VEGF (vascular endothelial growth factor) – sunitinib, sorafenib, bevacizumab, axitinib, pazopanib a pod. a tiež inhibítory mTOR (mammalian target of rapamycin inhibitor) – temsirolimus, everolimus a pod. Aktuálne využitie jednotlivých liekov ukazuje tab. 2 [13,14,16,25]. Stanovenie rizikového profilu u pacientov s metastatickým RCC podľa Motzera zhodnocuje viacero parametrov: 1. celkový stav (Karnofského index < 80); 2. časový interval od diagnózy do systémovej liečby < 12 mesiacov; 3. koncentráciu hemoglobínu (< dolná hranica referenčného rozmedzia laboratória); 4. koncentráciu korigovaného vápnika v sére (> 10 mg/dl (2,4 nmol/l); 5. koncentráciu LDH (> 1,5× horná hranica referenčného rozmedzia laboratória). Pacienti s priaznivým rizikovým profilom (bez rizikových faktorov) majú medián celkového prežívania 43,2 mesiace; jedinci so stredným rizikom (prítomnosť 1–2 rizikových faktorov) prežívajú 22,5 mesiace a osoby s nepriaznivým rizikovým profilom (≥ 3 rizikové faktory) prežívajú len 7,8 mesiace [13,14,16,26]. Výsledky schvaľovacích klinických štúdií farmák určených pre systémovú terapiu metastatického RCC sú zhrnuté v tab. 3 [13,14,16]. Ďalšie zlepšenie efektivity je možné dosiahnuť správnou sekvenčnou aplikáciou týchto medikamentov. Medzi najčastejšie vedľajšie účinky cielenej farmakoterapie RCC patria: arteriálna hypertenzia, hnačky, únava, „syndróm ruka-noha“ a pod. Doteraz sa nepreukázal významný klinický prínos kombinácie týchto liekov. Dostupné údaje zatiaľ nepodporujú použitie neoadjuvantnej alebo adjuvantnej liečby u pacientov s RCC [13,14,16].
Tab. 2. Použitie cielených liekov podľa rizikového profilu a línie liečby RCC. 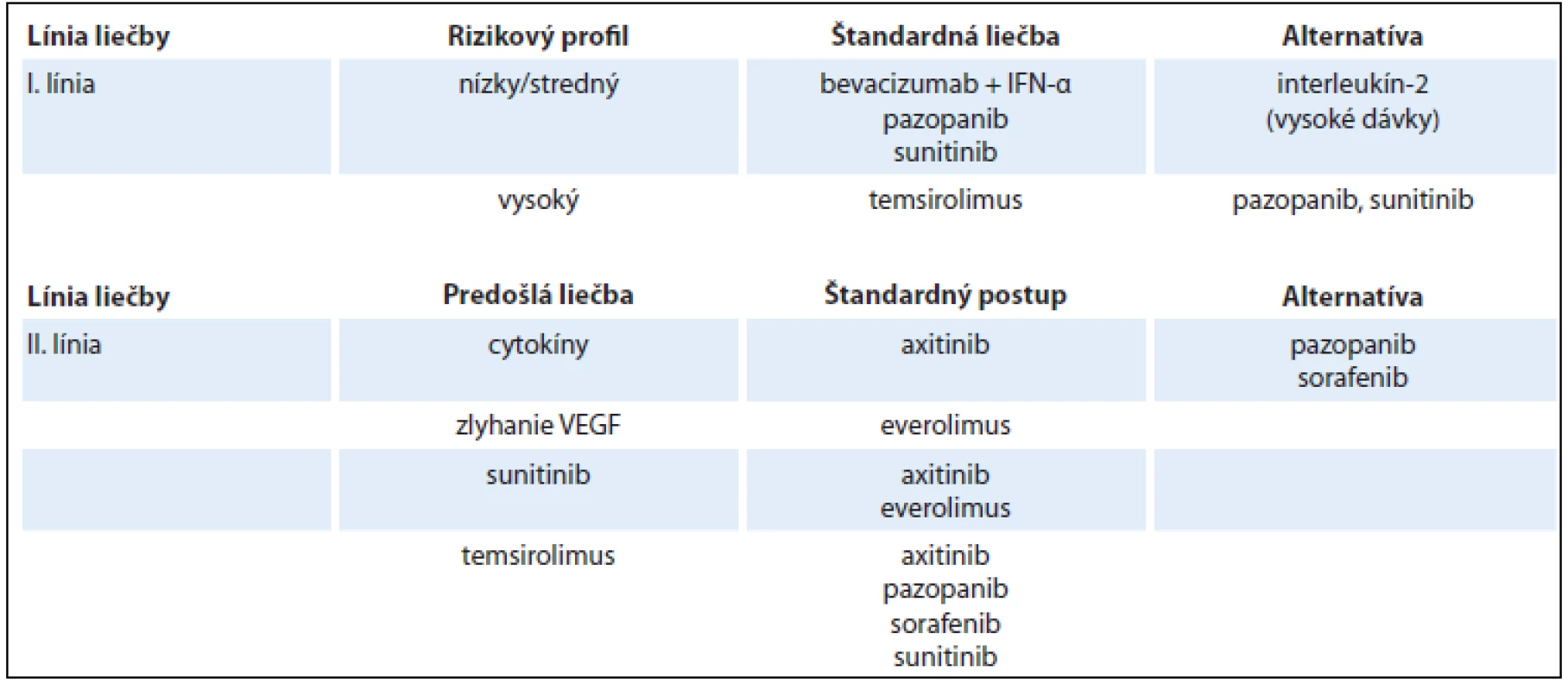
Tab. 3. Efektivita niektorých liečiv určených na cielenú farmakoterapiu RCC. 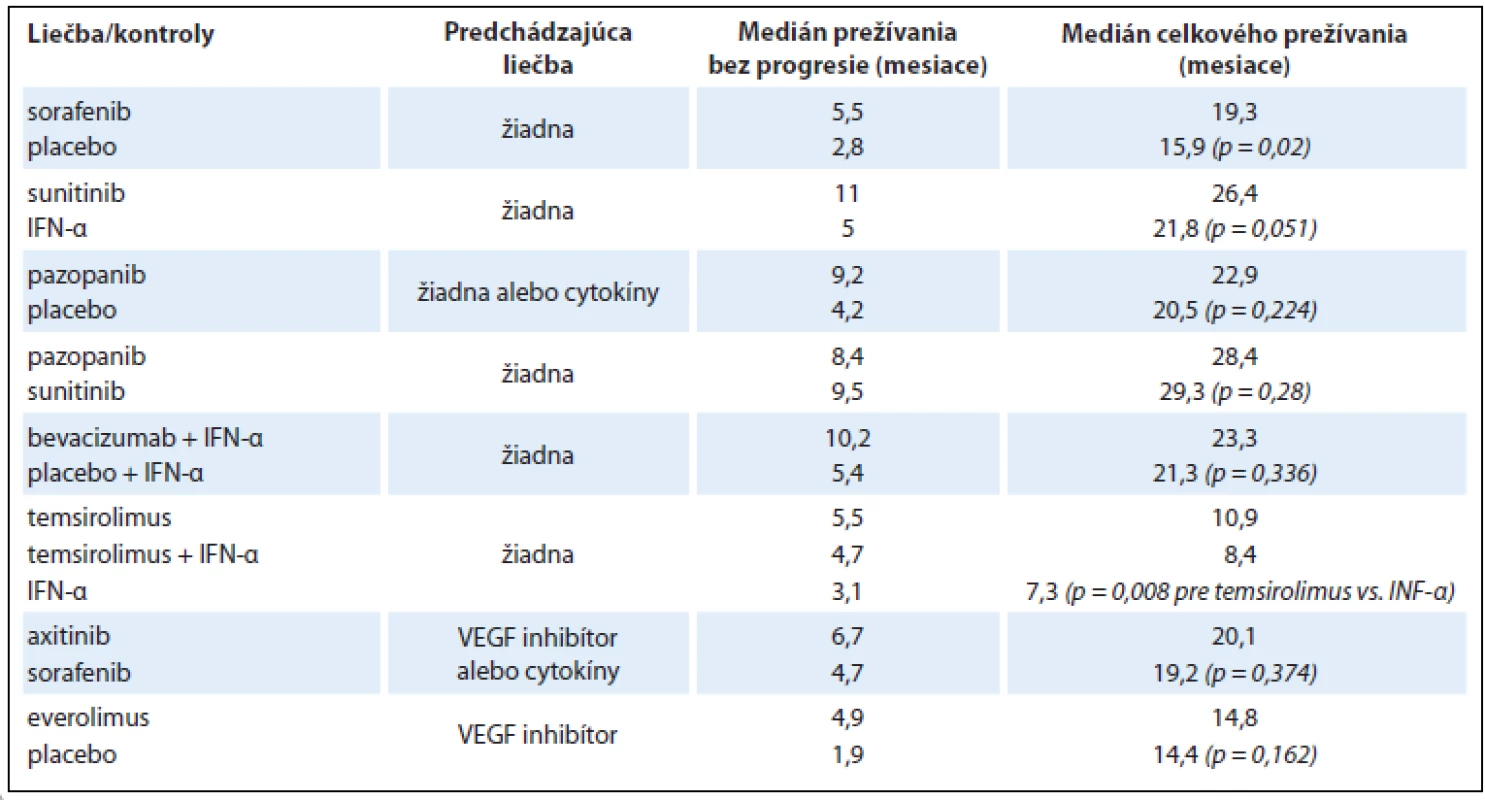
Resekcia a rádioterapia metastáz
Pacienti s metastázami v čase diagnózy RCC, ktorí sú ale v dobrom celkovom stave (Eastern Cooperative Oncology Group – ECOG 0–1) môžu mať benefit z resekcie primárneho nádoru. Vždy je však potrebné zobrať do úvahy aj ďalšie faktory, ako rozsah metastatického postihnutia, prítomnosť súbežných ochorení, aktuálne prejavy nádorového ochorenia a pod. [13,14,16]. Lokálna terapia metastáz za určitých podmienok hrá oveľa významnejšiu úlohu v manažmente RCC v porovnaní s inými druhmi zhubných nádorov. Solitárne, metachronicky vznikajúce metastázy by sa mali resekovať až do „zdravých“ okrajov (pokiaľ je to možné) a to bez ohľadu na to, ktorý orgánový systém postihujú. Najrozsiahlejšie skúsenosti a údaje sú k dispozícii u pacientov s pľúcnymi metastázami. Takýto manažment je možné využívať aj pri viacpočetných metastázach, ktoré vznikajú metachronicky v jednom orgáne/orgánovom systéme [13,14,16,27]. Rádioterapia (RT) je možnosťou voľby najmä v prípadoch RCC, kde pri primárnej chirurgickej terapii nie je možné dosiahnuť kompletné odstránenie nádoru. Využíva sa najmä externá RT, ďalej tzv. rádiochirurgia (napr. stereotaktické ožarovanie v jednom alebo vo viacerých sedeniach a pod.). Stereotaktická liečba sa uplatňuje pri kostných a mozgových metastázach. RT sa však aplikuje aj z vyslovene paliatívnych dôvodov – na redukciu bolesti a zníženie rizika patologických fraktúr kostí a tiež na lokálnu kontrolu metastáz v mozgu [13,14,16,28].
Nové perspektívy
V súčasnosti sa intenzívne skúmajú nové prognostické a prediktívne markery, ktoré by mohli byť nápomocné pri rozhodovaní o ďalšom manažmente pacientov s RCC (napr. ktoré systémové lieky a kedy použiť; indikácie a pravidlá sledovania pacientov riešených aktívnym dohľadom, efektivita adjuvantnej terapie RCC bez metastáz a pod.). Úvodná randomizovaná klinická štúdia nepreukázala žiadny benefit adjuvantnej liečby so sunitinibom alebo sorafenibom v porovnaní s placebom [29]. Dve randomizované štúdie fázy III preukázali, že jednak nivolumab aplikovaný ako 2-líniová terapia metastatického RCC bol spojený s dlhším celkovým prežívaním v porovnaní s everolimusom a cabozantinib zaznamenal dlhšie prežívanie bez progresie vs. everolimus [30,31]. Aj tieto údaje naznačujú potenciálne možnosti ako sekvenčnej, tak aj prípadnej kombinovanej cielenej farmakologickej liečby RCC.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
prof. MUDr. Dalibor Ondruš, DrSc.
I. onkologická klinika LF UK a Onkologického ústavu sv. Alžbety Heydukova 10
812 50 Bratislava
e-mail: dalibor.ondrus@ousa.sk
Obdržané: 2. 12. 2016
Prijaté: 3. 1. 2017
Zdroje
1. Scélo G, Brennan P. The epidemiology of bladder and kidney cancer. Nat Clin Pract Urol 2007; 4 (4): 205–217.
2. Ferlay J, Soerjomataram I, Dikshit R et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer 2015; 136 (5): E359–E386. doi: 10.1002/ijc.29210.
3. Forman D, Bray F, Brewster DH et al (eds). Cancer Incidence in Five Continents, vol. X. Lyon: IARC Scientific Publications 2014 : 1436.
4. McLaughlin JK, Lipworth L, Tarone RE et al. Renal Cancer, kapt. 57. In: Schottenfeld D, Fraumeni JF Jr (eds). Cancer Epidemiology & Prevention. Oxford: Oxford University Press 2006 : 1087–1100.
5. Wiklund F, Tretli S, Choueiri TK et al. Risk of bilateral renal cell cancer. J Clin Oncol 2009; 27 (23): 3737–3741. doi: 10.1200/JCO.2008.20.6524.
6. Weikert S, Ljungberg B. Contemporary epidemiology of renal cell carcinoma: perspectives of primary prevention. World J Urol 2010; 28 (3): 247–252. doi: 10.1007/s00345-010-0555-1.
7. Levi F, Ferlay J, Galeone C et al. The changing pattern of kidney cancer incidence and mortality in Europe. BJU Int 2008; 101 (8): 949–958. doi: 10.1111/j.1464 410X.2008.07451.x.
8. Chow WH, Devesa SS. Contemporary epidemiology of renal cell cancer. Cancer J 2008; 14 (5): 288–301. doi: 10.1097/PPO.0b013e3181867628.
9. Pérez-Farinós N, López-Abente G, Pastor-Barriuso R. Time trend and age-period-cohort effect on kidney cancer mortality in Europe, 1981–2000. BMC Public Health 2006; 6 : 119. doi: 10.1186/1471-2458-6-119.
10. Levi F, Lucchini F, Negri E et al. Declining mortality from kidney cancer in Europe. Ann Oncol 2004; 15 (7): 1130–1135.
11. Safaei Diba C, Hlava P (eds). Incidencia zhubných nádorov v SR 2010. Bratislava: NCZI, NOR SR 2017 : 188.
12. Ondruš D, Kaušitz J. Špeciálna onkológia. Bratislava: Solen. In press 2017.
13. Ljungberg B, Bensalah K, Bex A et al. Chronic pelvic pain. In: EAU guidelines on chronic pelvic pain. Arnhem: European Association of Urology 2016 : 1–54.
14. Ljungberg B, Bensalah K, Bex A et al. EAU guidelines on renal cell carcinoma (limited text update March 2016). EAU pocket guidelines, Arnhem: European Association of Urology 2016 : 77–97.
15. Campbell S, Lane B. Malignant renal tumors. In: Wein A, Kavoussi L, Partin A et al (eds). Campbell – Walsh Urology. 11th ed. Saunders Elsevier 2016 : 1315–1364.
16. Doehn C, Grüwald V, Steiner T et al. The diagnosis, treatment, and follow-up of renal cell carcinoma. Dtsch Arztebl Int 2016; 113 (4): 590–596. doi: 10.3238/arztebl.2016.0590.
17. Srigley JR, Delahunt B, Eble J et al. The International Society of Urological Pathology (ISUP) Vancouver Classification of renal neoplasia. Am J Surg Pathol 2013; 37 (10): 1469–1489. doi: 10.1097/PAS.0b013e318299f2d1.
18. Marenčák J. Diagnostika karcinómu obličky a stanovenie rozsahu ochorenia. Lek Listy 2010; 15 (26): 3–5.
19. Breza J, Marenčák J, Minčík I et al (eds). Nádory obličiek. 1. vyd. Bratislava: Poľana 2008 : 1–386.
20. Brouwer O, van der Poel H, Bevers R et al. Beyond penile cancer, is there a role for sentinel node biopsy in urological malignancies? Clin Transl Imaging 2016; 4 (4): 395–410.
21. MacLennan S, Imamura M, Lapitan M et al. Systematic review of oncological outcomes following surgical management of localised renal cancer. Eur Urol 2012; 61 (6): 972–993. doi: 10.1016/j.eururo.2012.02.039.
22. Bekema H, MacLennan S, Imamura M et al. Systematic review of adrenalectomy and lymph node dissection in locally advanced renal cell carcinoma. Eur Urol 2013; 64 (5): 799–810. doi: 10.1016/j.eururo.2013.04.033.
23. Smaldone M, Kutikov A, Egleston B et al. Small renal masses progressing to metastases under active surveillance: a systematic review and pooled analysis. Cancer 2012; 118 (7): 997–1006. doi: 10.1002/cncr.26369.
24. Gore ME, Griffin CL, Hancock B et al. Interferon alpha-2a versus combination therapy with interferon alpha-2a, interleukin-2, and fluorouracil in patients with untreated metastatic renal cell carcinoma (MRC RE04/EORTC GU 30012): an open-label randomized trial. Lancet 2010; 375 (4): 641–648. doi: 10.1016/S0140-6736 (09) 61921-8.
25. Heng DY, Xie W, Regan MM et al. External validation and comparison with other models of the International Metastatic Renal-Cell Carcinoma Database Consortium prognostic model: a population-based study. Lancet Oncol 2013; 14 (2): 141–148. doi: 10.1016/S1470-2045 (12) 70559-4.
26. Motzer RJ, Barrios CH, Kim TM et al. Phase II randomized trial comparing sequential first-line everolimus and second-line sunitinib versus first-line sunitinib and second-line everolimus in patients with metastatic renal cell carcinoma. J Clin Oncol 2014; 32 (12): 2765–2772. doi: 10.1200/JCO.2013.54.6911.
27. Kudelin N, Bölükbas S, Eberlein M et al. Metastasectomy with standardized lymph node dissection for metastatic renal cell carcinoma: an 11-year single-center experience. Ann Thorac Surg 2013; 96 (2): 265–271. doi: 10.1016/j.athoracsur.2013.04.047.
28. Bennani O, Derrey S, Langlois O et al. Brain metastasis from renal cell carcinoma. Neurochirurgie 2014; 60 (1): 12–16. doi: 10.1016/j.neuchi.2013.12.001.
29. Haas NB, Manola J, Uzzo R et al. Adjuvant sunitinib or sorafenib for high-risk, non-metastatic renal-cell carcinoma (ECOG-ACRIN E2805): a double-blind, placebo-controlled, randomised, phase 3 trial. Lancet 2016; 387 (12): 2008–2016. doi: 10.1016/S0140-6736 (16) 00 559-6.
30. Motzer R, Escudier B, McDermott D et al. Nivolumab versus everolimus in advanced renal-cell carcinoma. N Engl J Med 2015; 373 (11): 1803–1813. doi: 10.1056/NEJMoa1510665.
31. Choueiri T, Escudier B, Powles T et al. Cabozantinib versus everolimus in advanced renal-cell carcinoma. N Engl J Med 2015; 373 (11): 1814–1823. doi: 10.1056/NEJMoa1510016.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článek Tři v jednom aneb onkotriádyČlánek Soutěž o nejlepší práciČlánek Molekulární aspekty nádorů štítné žlázy se zaměřením na mikroRNA a jejich klinické souvislostiČlánek SAMPUS, MELTUMP a THIMUMP – diagnostické kategorie charakterizované nejistým biologickým chovánímČlánek Aktuality z odborného tisku
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2017 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Tři v jednom aneb onkotriády
- Soutěž o nejlepší práci
- Molekulární aspekty nádorů štítné žlázy se zaměřením na mikroRNA a jejich klinické souvislosti
- Súčasný pohľad na diagnostiku a liečbu karcinómu obličky
- Maligní melanom – od klasické histologie k molekulárně genetickému testování
- Nové léky v terapii akutní myeloidní leukemie u starších pacientů
- Mnohopočetný výskyt bazocelulárneho karcinómu – retrospektívna analýza 899 pacientov s biopticky verifikovanými léziami na jednom pracovisku
- Karcinom prsu u mladých žen – korelace klinických, histomorfologických a molekulárně-genetických nálezů karcinomu prsu u žen mladších 35 let
- Dlouhodobá kompletní odpověď metastázy kolorektálního karcinomu po biochemoterapii
- Izolovaná perfuze horní končetiny s TNF-α – dvojitá kanylace žilního systému
- SAMPUS, MELTUMP a THIMUMP – diagnostické kategorie charakterizované nejistým biologickým chováním
- Aktuality z odborného tisku
- Profesor MUDr. Luboš Petruželka, CSc. – životní jubileum
- Informace z České onkologické společnosti
- Kožní toxicita u cílené léčby dabrafenibem
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Súčasný pohľad na diagnostiku a liečbu karcinómu obličky
- SAMPUS, MELTUMP a THIMUMP – diagnostické kategorie charakterizované nejistým biologickým chováním
- Maligní melanom – od klasické histologie k molekulárně genetickému testování
- Karcinom prsu u mladých žen – korelace klinických, histomorfologických a molekulárně-genetických nálezů karcinomu prsu u žen mladších 35 let
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



