-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Nové léky v terapii akutní myeloidní leukemie u starších pacientů
New Drugs in the Treatment of Acute Myeloid Leukemia in the Elderly
Background:
At the time of diagnosis, most patients with acute myeloid leukemia are older than 65 years of age. Treatment of this group of patients is challenging because they become less tolerant to aggressive chemotherapy with increasing age. Less than one-third of elderly patients are considered eligible for intensive treatment; nevertheless, the survival analysis for this population remains poor. Due to numerous comorbidities and an overall deteriorating condition, most elderly patients with acute myeloid leukemia receive only palliative or best supportive care, which are associated with a high mortality rate. New therapeutic approaches are expected to improve the overall survival and quality of life of this group of patients. These promising treatments include cell kinase inhibitors, cytotoxic agents, monoclonal antibodies, and epigenetic therapy including hypomethylating agents and inhibitors of isocitrate dehydrogenase and histone deacetylase. In monotherapy, these new drugs show lower levels of toxicity than those commonly used in chemotherapy; however, they do not lead to a better long-lasting treatment response. To enhance therapeutic efficacy, combinations of the above-mentioned treatments are often used, and, during clinical trials, combinations with standard cytostatics are also common. The promising results of these studies show that even low-toxicity therapies can lead to a better overall treatment response and to longer overall survival.Aim:
This article provides a brief overview of new drugs that are evaluated for their mechanism of effect, efficacy and toxicity in therapy of patients suffering from acute myeloid leukemia.Key words:
acute myeloid leukemia – elderly – FLT3 inhibitors – epigenetic therapy – monoclonal antibodies
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.Submitted:
4. 11. 2016Accepted:
13. 12. 2016
Autori: Z. Šustková; M. Čulen; L. Semerád; I. Ježíšková; D. Dvořáková; Z. Ráčil; J. Mayer
Pôsobisko autorov: Interní hematologická a onkologická klinika LF MU a FN Brno
Vyšlo v časopise: Klin Onkol 2017; 30(3): 190-196
Kategória: Přehled
doi: https://doi.org/10.14735/amko2017190Súhrn
Východiska:
Většina pacientů je v období stanovení diagnózy akutní myeloidní leukemie starší 65 let. Terapie této skupiny nemocných je velmi obtížná, neboť spolu se zvyšujícím se věkem pacientů se zhoršuje i tolerance vůči agresivní léčbě. Intenzivní terapii je schopna podstoupit pouze necelá třetina starších pacientů a analýzy dlouhodobého přežití nejsou ani v případě této skupiny příliš uspokojivé. Většina nemocných s akutní myeloidní leukemií je vzhledem k četným komorbiditám a horšímu celkovému stavu v období stanovení diagnózy léčena paliativně či symptomaticky, což je doprovázeno vysokou mortalitou. Nové terapeutické možnosti, které mají zlepšit přežívání a kvalitu života této skupiny pacientů, zahrnují inhibitory buněčných kináz, nové cytotoxické léky, monoklonální protilátky a epigeneticky působící léky, jako jsou hypometylační látky, inhibitory isocitrát dehydrogenáz a histonových deacetyláz. Všechny tyto nové léky vykazují v monoterapii nižší toxicitu než standardně podávaná chemoterapie, nicméně jejich účinek nevede k dlouhotrvající léčebné odpovědi. Ve snaze o zvýšení terapeutické efektivity jsou proto tyto preparáty velmi často v rámci klinických studií kombinovány, časté jsou i kombinace s již standardně užívanými cytostatiky. Většina těchto klinických studií přináší optimistické výsledky poukazující na skutečnost, že i nízce toxická terapie může vést k vyššímu procentu celkové léčebné odpovědi a delšímu celkovému přežívání nemocných.Cíl:
Tento článek uvádí stručný přehled nových léků, které jsou hodnoceny v terapii pacientů s akutní myeloidní leukemií, jejich mechanizmus účinku, efektivitu a toxicitu.Klíčová slova:
akutní myeloidní leukemie – starší nemocní – FLT3 inhibitory – epigeneticky působící látky – monoklonální protilátkyÚvod
Akutní myeloidní leukemie (AML) představuje maligní klonální onemocnění krvetvorby, jehož incidence stoupá s věkem. Většina pacientů je při stanovení diagnózy AML starší 65 let, jedna třetina dokonce 75 let [1]. I přesto, že se jedná o nejpočetnější skupinu pacientů, starší nemocní představují terapeuticky nejkomplikovanější kategorii. K intenzivní léčbě je z nich indikována pouze jedna třetina a i v těchto případech je díky biologické povaze AML ve stáří jejich celkové přežití (overall survival – OS) nízké. Zbývající dvě třetiny pacientů jsou léčeny paliativně či symptomaticky. Důvodem jsou především komorbidity a horší performance status snižující toleranci vůči toxické terapii [2,3]. Ve snaze eliminovat nežádoucí účinky a zlepšit přežívání starších nemocných je vývoj nových léků zaměřen především na cílenou terapii zahrnující FLT3 (FMS like tyrosin kinase 3) inhibitory, inhibitory kináz buněčného cyklu, epigeneticky působící látky a monoklonální protilátky. Vzhledem k tomu, že tyto léky působí na více buněčných úrovních (obr. 1), jsou v rámci klinických studií kombinovány a u některých z těchto kombinací byl popsán synergistický účinek.
Obr. 1. Působení nových léků na jednotlivých buněčných úrovních. 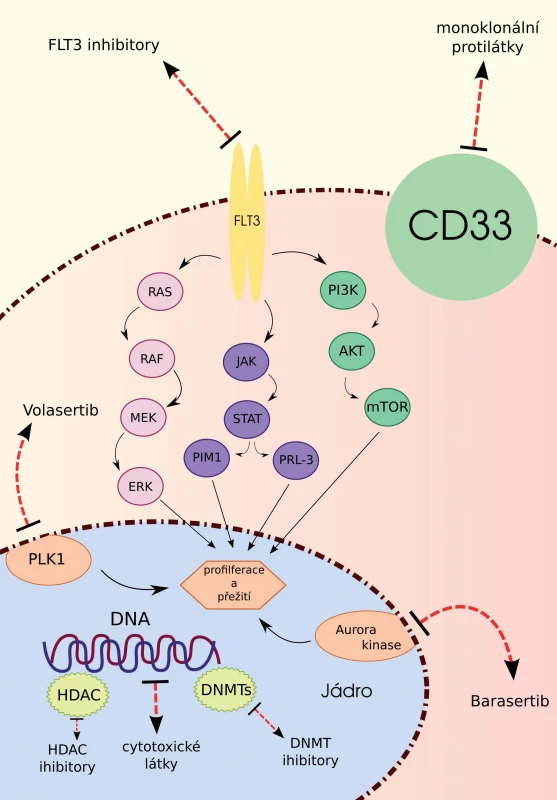
Inhibitory kináz
FLT3 inhibitory
FLT3 je transmembránový receptor s tyrozinkinázovou aktivitou, který je fyziologicky exprimován převážně na povrchu myeloidních a lymfoidních progenitorových buněk a s variabilní expresí i na zralých elementech monocytární řady. Jeho ligandem je cytokin, který spolu s dalšími růstovými faktory a interleukiny synergisticky působí cestou signálních drah MAPK/ERK, PI3K/AKT/mTOR a JAK/STAT-5 na proliferaci a diferenciaci kmenových, dendritických a NK buněk.
FLT3 představuje nejčastěji mutovaný gen u pacientů s AML. Nejčetněji zastoupenou mutací je interní tandemová duplikace (FLT3-ITD), která má za následek spontánní dimerizaci a aktivaci receptoru vedoucí k nezávislé buněčné proliferaci [4,5]. Prevalence jejího výskytu stoupá s věkem, u pacientů starších 60 let se vyskytuje v jedné čtvrtině případů. V této skupině pacientů nelze ale, vzhledem k obecně kratšímu OS, určit jasný prognostický dopad této mutace [6]. Oproti tomu u mladších nemocných s AML byl její negativní prognostický význam opakovaně prokázán. Potenciál dosažení kompletní remise onemocnění je u FLT3-ITD pozitivních pacientů sice stejný jako u pacientů s nemutovaným FLT3 (FLT3-wt), nositelé této mutace ale častěji relabují, mají horší léčebnou odpověď na záchrannou terapii a rovněž i kratší OS [7,8]. Méně častou je bodová mutace v oblasti tzv. activation loop domény, v kodonu 835, která se vyskytuje v 7 % všech případů AML a jejíž výskyt je spojen s časnějším relapsem choroby v porovnání s FLT3-wt pacienty [9].
Do výzkumu FLT3 inhibitorů a jejich využití v terapii AML byly vkládány poslední roky velké naděje. Nejdále v klinickém testování pokročily multikinázové inhibitory midostaurin, sorafenib a lestaurtinib, v ranějších fázích vývoje jsou FLT3 inhibitory druhé generace quizartinib, gilteritinib a crenolanib (tab. 1). Všechny tyto léky ale v monoterapii vedou pouze k přechodné a částečné terapeutické odpovědi [10–15]. Příčinou je především rozvoj sekundární lékové rezistence. Jako rozpoznané mechanizmy jejího vzniku byly popsány bodové mutace v oblasti kinázové domény FLT3-ITD, konkrétně v pozicích N676, F691, Y842 a D835, protektivní účinek stromálních buněk kostní dřeně, vysoké koncentrace ligandu FLT3 vyvolané aplazií dřeně po léčbě a inhibiční účinek plazmy [16–18]. Z tohoto důvodu jsou v dalších klinických studiích FLT3 inhibitory kombinovány s konvenčně užívanými cytotoxickými chemoterapeutiky, což je však doprovázeno u starších nemocných s AML zvýšenou toxicitou léčby. Naopak relativně dobře je tolerována kombinace FLT3 inhibitorů s hypometylačními látkami, nicméně tyto kombinace nejsou o moc efektivnější než užití FLT3 inhibitorů v monoterapii (tab. 2) [19–25].
Tab. 1. Přehled FLT3 inhibitorů. 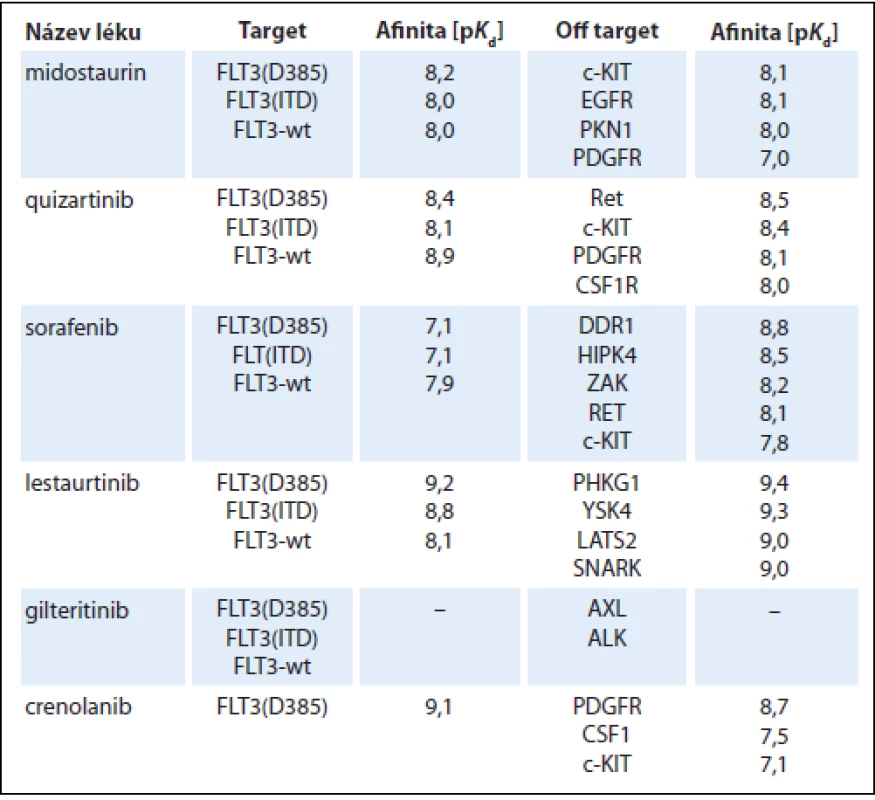
c-KIT – KIT proto-oncogene receptor tyrosin kinase, EGFR – epidermal growth factor receptor, PKN1 – protein kinase N1, PDGFR – platelet derived growth factor receptor, Ret – Ret proto-oncogene, CSF1R – colony stimulating factor 1 receptor, DDR1 – discoidin domain receptor 1, HIPK4 – homeodomain interacting protein kinase 4, ZAK – ZAK sterile alpha motif and leucine zipper containing kinase AZK, PHGK1 – phosphorylase kinase gamma 1, YSK4 – mitogen-activated protein kinase 19, LATS2 – large tumor suppressor kinase 2, SNARK – SNF-1 like kinase, AXL – AXL receptor tyrosine kinase, ALK – anaplastic lymphoma kinase Tab. 2. FLT3 inhibitory – přehled studií. 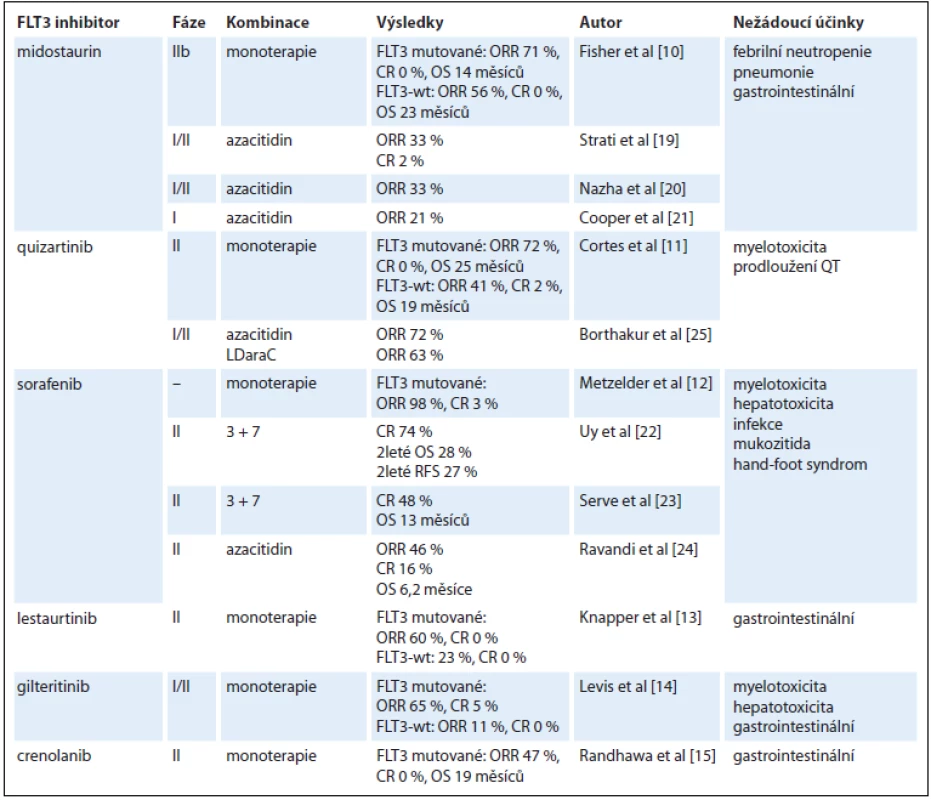
ORR – celková léčebná odpověď, CR – kompletní remise, OS – celkové přežití, RFS – přežití bez relapsu, wt – nemutovaný typ Inhibitory kináz buněčného cyklu
Mezi další kinázy, u kterých byla popsána v buněčných liniích AML aberantní exprese, patří Aurora B a polo like kináza 1 (PLK1). Fyziologicky hrají klíčovou roli v maturaci centrozomu, formaci a stabilizaci bipolárního vřeténka a v separaci chromozomů.
Myšlenka terapeutického využití PLK1 inhibitorů u pacientů s AML byla podpořena in vitro studiemi, které prokázaly v leukemických blastech výrazně vyšší expresi této kinázy v porovnání s normálními hematopoetickými progenitorovými buňkami. Leukemické blasty jsou rovněž daleko senzitivnější vůči PLK1 inhibici, která vede k výraznému omezení buněčné proliferace [26]. Slibným lékem v této skupině je volasertib, který inhibuje PLK1 již v nanomolárních koncentracích, díky čemuž má velice nízkou toxicitu, a představuje tedy vhodnou terapii pro starší nemocné. V klinických studiích byl prokázán benefit z přidání volasertibu k nízce dávkovanému cytarabinu (LDaraC), a to napříč všemi cytogenetickými skupinami. Tato kombinace vedla v porovnání s LDaraC v monoterapii k vyšší celkové léčebné odpovědi (31 vs. 13 %) a téměř dvojnásobnému OS u pacientů s vysokým cytogenetickým rizikem [27]. V současné době probíhá III. fáze této studie.
Testovaným inhibitorem Aurora B kinázy je barasertib, který prokázal v monoterapii vyšší procento léčebných odpovědí v porovnání s LDaraC u AML pacientů všech cytogenetických rizik. V porovnání se standardně užívanou paliativní terapií měl ale vyšší toxicitu, zejména se jednalo o infekční komplikace a mukozitidu gastrointestinálního traktu [28].
Epigeneticky působící látky
Dysregulace epigenetických mechanizmů, které zahrnují metylaci cytozinu nebo modifikaci histonových proteinů, hrají významnou roli v patogenezi AML, zejména u nemocných nad 60 let [29]. Tyto modifikace DNA jsou často reverzibilní a terapeutické využití hypometylačních látek, inhibitorů isocitrát dehydrogenáz a histonových deacetyláz, případně jejich kombinace představují potenciálně účinnou a netoxickou terapii pro starší AML pacienty (tab. 3) [30–39].
Tab. 3. Přehled epigeneticky působících látek. 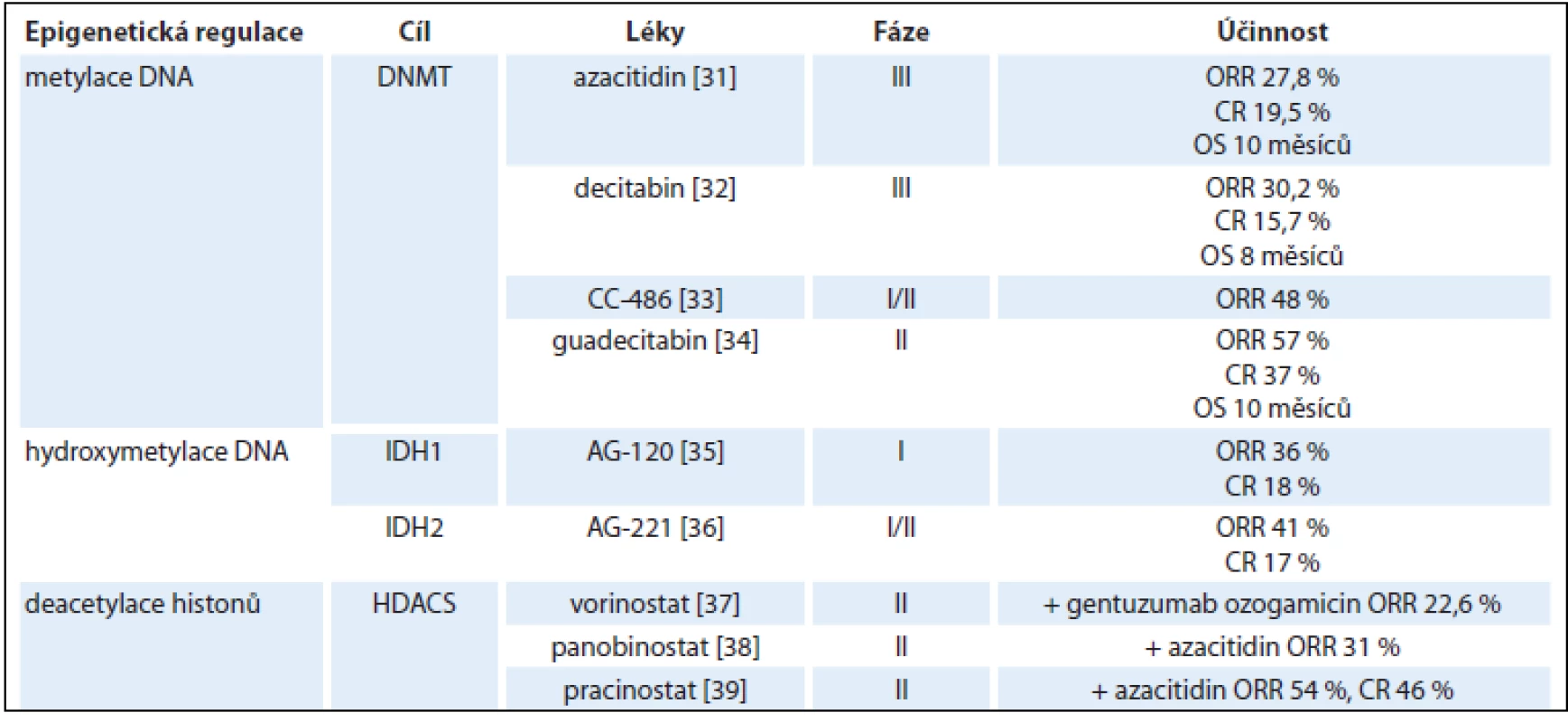
DNMT – DNA metyltransferáza, HDCA – histonové deacetylázy, ORR – celková léčebná odpověď, CR – kompletní remise, OS – celkové přežití Demetylační látky
Metylace DNA spočívá v navázání metylových skupin do 5. pozice na cytozinovém kruhu CpG dinukleotidu za přítomnosti DNA metyltransferáz. Tyto dinukleotidy se nacházejí především v oblastech promotorů genů, tedy v nekódujících, regulačních oblastech DNA. Z tohoto důvodu hraje metylace DNA významnou roli v regulaci genové exprese. U hematologických malignit se metylace DNA pohybuje v širokém rozmezí, od hypometylace vedoucí k chromozomální nestabilitě až k hypermetylaci, která má za následek potlačení transkripce tumorsupresorových genů a genů regulujících buněčný cyklus. U pacientů s AML a myelodysplastickým syndromem vysokého rizika byla hypermetylace opakovaně popsána jako negativní prognostický faktor. Mezi již v praxi rutinně používané hypometylační látky u nemocných s AML patří azacitidin a decitabin. Klinickými studiemi bylo opakovaně prokázáno, že účinnost azacitidinu je u starších pacientů srovnatelná s intenzivní terapií, toxicita je ale výrazně nižší [30,31]. Do současné doby byla jeho aplikace omezena pouze na parenterální podávání. Nové možnosti vč. udržující terapie otevírá perorální forma azacitidinu CC-486 [33]. Na rozdíl od azacitidinu decitabin nevede v porovnání s ostatními léčebnými možnostmi ke zlepšení OS u všech starších AML pacientů [32]. Benefit byl prokázán pouze u skupiny pacientů s vyšším počtem leukemických blastů v kostní dřeni [40]. Při terapii hypometylačními látkami může dojít k rozvoji rezistence či terapeutického selhání. Příčiny jejich vzniku nejsou ale zatím přesně objasněny. Jako jeden z možných mechanizmů rozvoje rezistence na decitabin byla popsána preexistující či terapeuticky vyvolaná genová nestabilita vedoucí ke snížení exprese transportních proteinů a deoxycitidinkinázy, která je nezbytná pro fosforylaci a tím aktivaci decitabinu a ke zvýšení exprese cytidindeaminázy degradující decitabin [41]. Mezi hypometylační látky druhé generace, které slibují vyšší účinnost a nižší toxicitu, patří guadecitabin, dinukleotid decitabinu a deoxyadenozinu, který díky své struktuře nepodléhá degradaci cytidindeaminázou [34]; tato látka je momentálně ve III. fázi klinického hodnocení.
Inhibitory isocitrát dehydrogenáz
Isocitrát dehydrogenázy 1 a 2 (IDH1, IDH2) představují klíčové enzymy Krebsova cyklu, které za normálních okolností katalyzují přeměnu isocitrátu na α-ketoglutarát. Jejich mutace se vyskytuje až v 27 % případů karyotypicky normálních AML a vede k produkci aberantního metabolitu 2-hydroxyglutarátu. V důsledku jeho intracelulárního hromadění dochází k inhibici α-ketoglutarát dependentních enzymů, mezi které patří TET (Ten-Eleven-Translocation) rodina a které jsou nezbytné v procesu demetylace DNA [42]. Rané fáze klinických studí s AG221 (inhibitor IDH2) a AG120 (inhibitor IDH1) přinášejí příslib účinné terapie, předběžné výsledky ukazují až 50% terapeutickou odpověď, která se zlepšuje v průběhu několika léčebných cyklů, v porovnání s cytotoxickými látkami je trvalejšího charakteru a je spojena s diferenciací a maturací leukemických blastů [35,36].
Inhibitory histonových deacetyláz
Histonové deacetylázy (HDAC) představují evolučně velmi stabilní enzymy, které regulují acetylaci histonů a tím i transkripční aktivitu. Jejich inhibice ovlivňuje přibližně 2 % genů pro regulaci buněčného cyklu, apoptózu a DNA syntézu. U starších AML pacientů byly testovány z inhibitorů histonových deacetyláz vorinostat, panobinostat a entinostat. Ani jeden z těchto léků se v monoterapii neosvědčil, terapeutické odpovědi nedosáhlo ani 5 % pacientů [37,38,43]. Nicméně jejich schopnost rozvolnit terciální strukturu chromatinu a zpřístupnit tak transkripční faktory dělá z této skupiny ideální léky do kombinace zejména s cytostatiky, jejichž mechanizmus účinku je založen na poškození DNA. Z tohoto důvodu byla u starších pacientů testována kombinace vorinostatu s gemtuzumab ozogamicinem a duální epigenetická terapie panobinostatu s azacitidinem, které ale prokázaly pouze omezenou účinnost, méně než 20 % pacientů dosáhlo kompletní remise a medián OS nepřesáhl 1,5 roku [44,45]. Naopak ale velmi pozitivní výsledky (42 % kompletních remisí, 1leté OS 62 %) přinesla II. fáze klinické studie pracinostatu s azacitidinem [46].
Cytotoxické léky
Vysoké procento starších nemocných s AML má přítomny komplexní cytogenetické změny. Pro tyto pacienty nepředstavuje cílená terapie optimální léčebné možnosti, profitují spíše z podání cytotoxických látek. Z důvodu komorbidit a nízkého performance statusu však ve většině případů nejsou právě tito pacienti indikováni k podání standardní indukční terapie a terapie LDaraC je u pacientů s nepříznivými cytogenetickými změnami neúčinná. Ve snaze o snížení extramedulární toxicity kombinované terapie cytarabinu s antracyklinem byla vyvinuta lipozomální forma těchto látek v molárním poměru 5 : 1, CPX-351, která u starších pacientů s AML skutečně vede k poklesu 60denní mortality a delšímu OS v porovnání s indukční terapií, a to i u pacientů se sekundární AML [47]. Další cytotoxické látky s terapeutickým efektem u AML jsou nukleosidová analoga sapacitabin a klofarabin. Ani jedna z těchto látek ale nepřináší v terapii starších AML pacientů lepší výsledky než standardní terapie, pouze v případě klofarabinu byla vyselektována úzká skupina pacientů ve věku 60–70 let se středním cytogenetickým rizikem a primární AML, která může mít z tohoto léku benefit [48]. U všech ostatních starších AML pacientů má v monoterapii lepší výsledky a nižší toxicitu standardně užívaná paliativní terapie LDaraC [49,50]. Co se týče kombinací s ostatními léky, jako účinná se jeví kombinace sapacitabinu s decitabinem a tato kombinace je momentálně ve III. fázi klinického hodnocení.
Monoklonální protilátky
I přesto, že monoklonální protilátky představují standardizovanou léčbu řady hematologických malignit, jejich terapeutické využití u pacientů s AML je velmi limitované. Doposud totiž nebyl nalezen vhodný antigen exprimovaný ve vysoké míře a pouze leukemickými buňkami všech subtypů AML, který by nebyl přítomen na pluripotentních kmenových buňkách a v jiných tkáních a byl by u něj znám onkogenní potenciál. Nejblíže ke splnění všech těchto kritérií je CD33 molekula, která se vyskytuje na povrchu leukemických blastů u 85–90 % pacientů s AML [51]. Anti-CD33 monoklonální protilátkou, která prošla nejvíce klinickými studiemi, je gemtuzumab ozogamicin (GO). Jedná se o humanizovanou anti-CD33 protilátku konjugovanou s antracyklinovým antibiotikem kalicheamicinem, které vyvolává poškození DNA. Účinnost a bezpečnost této protilátky v monoterapii byla hodnocena třemi klinickými studiemi [52] a na základě výsledků těchto studií byl gemtuzumab ozogamicin schválen americkou FDA (Food and Drug Administration) k terapii relabovaných AML pacientů starších 60 let. Tato registrace ale byla v roce 2010 zrušena a GO byl stažen z trhu. Novou monoklonální protilátkou, která v preklinických modelech vykazuje vyšší leukemický efekt než gemtuzumab ozogamicin, je vadastuximab talirine (SGN-CD33A), konjugát humanizované anti-CD33 protilátky s pyrrolobenzodiazepinovým dimerem [53]. V současné době probíhají I. fáze klinických studií hodnotící efekt a toxicitu této protilátky v závislosti na dávce. V preklinických studiích vykazuje rovněž vysoký antileukemický efekt bispecifická CD33/CD3 protilátka AMG-330.
Závěr
Trend individualizace onkologické péče je v popředí zájmu výzkumu nových léků již několik desítek let. Ovlivnění konkrétního patologicky změněného buněčného procesu v leukemických blastech má za cíl především snížení toxicity léčby a tím i její zpřístupnění skupině pacientů, která z důvodu vyššího věku, komorbidit a horšího biologického stavu nepředstavuje kandidáty systémové cytotoxické terapie. Všechny nové léky, které jsou nyní v rámci klinických studií hodnoceny u AML pacientů, vykazují v monoterapii nižší toxicitu než standardně podávaná chemoterapie, jejich účinek ale nevede k dlouhotrvající léčebné odpovědi. Vzájemné kombinace těchto léčiv, případně jejich kombinace s novými či již běžně užívanými cytotoxickými látkami vedou u této skupiny pacientů k již znatelnému prodloužení OS a také ke zlepšení počtu celkových léčebných odpovědí. Dá se tedy předpokládat, že již brzy se alespoň část těchto přípravků stane součástí terapeutických protokolů pro starší AML pacienty.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Zuzana Šustková
Interní hematologická a onkologická klinika LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: Sustkova.Zuzana@fnbrno.cz
Obdrženo: 4. 11. 2016
Přijato: 13. 12. 2016
Zdroje
1. Howlader N, Noone AM, Krapcho M et al. SEER Cancer Statistic Review 1975–2013, National Cancer Institute [online]. Available from: http: //seer.cancer.gov/csr/1975_2013/.
2. Alibhai SM, Leach M, Minden MD et al. Outcomes and quality of care in acute myeloid leukemia over 40 years. Cancer 2009; 115 (13): 2903–2911. doi: 10.1002/cncr.24373.
3. Juliusson G, Billstrom R, Gruber A et al. Attitude toward remission induction for elderly patients with acute myeloid leukemia influences survival. Leukemia 2006; 20 (1): 42–47.
4. Kottaridis PD, Gale RE, Frew ME et al. The presence of a FLT3 internal tandem duplication in patients with acute myeloid leukemia (AML) adds important prognostic information to cytogenetic risk group and response to the first cycle of chemotherapy: analysis of 554 patients from the United Kingdom Medical Research Council AML 10 and 12 trials. Blood 2001; 98 (6): 1752–1759.
5. Gilliand DG, James DG. The roles of FLT3 in hematopoiesis and leukemia. Blood 2002; 100 (5): 1532–1542.
6. Stirewalt DL, Kopecky KJ, Meshinchi S et al. FLT3, RAS, and TP53 mutations in elderly patients with acute myeloid leukemia. Blood 2001; 97 (11): 3589–3595.
7. Frohling S, Schlenk RF, Breitruck J et al. Prognostic significance of activating FLT3 mutations in younger adults (16 to 60 years) with acute myeloid leukemia and normal cytogenetics: a study of the AML Study Group Ulm. Blood 2003; 100 (13): 4372–4380.
8. Thiede C, Steudel C, Mohr B et al. Analysis of FLT3-activating mutations in 979 patients with acute myelogenous leukemia: association with FAB subtypes and identification of subgroups with poor prognosis. Blood 2002; 99 (12): 4326–4335.
9. Yamamoto Y, Kiyoi H, Nakamo Y et al. Activating mutation of D835 within the activation loop of FLT3 in human hematologic malignancies. Blood 2001; 97 (8): 2434–2439.
10. Fisher T, Stone MR, DeAngelo DJ et al. Phase IIB trial of oral Midostaurin (PKC412), the FMS-like tyrosine kinase 3 receptor (FLT3) and multitarget kinase inhibitor, in patients with acute myeloid leukemia and high-risk myelodysplastic syndrome with either wild type or mutated FLT3. J Clin Oncol 2010; 28 (28): 4339–4345. doi: 10.1200/JCO.2010.28.9678.
11. Cortes J, Perl A, Dombret H et al. Final results of a phase 2 open-label, monotherapy efficacy and safety study of quizartinib (AC220) in patients ≥ 60 years of age with FLT3 ITD positive or negative relapsed/refractory acute myeloid leukemia. Blood 2012; 120 (21): abstr. 48.
12. Metzelder SK, Schroder T, Finck A et al. High activity of sorafenib in FLT3-ITD-positive acute myeloid leukemia synergizes with allo-immune effects to induce sustained responses. Leukemia 2012; 26 (11): 2353–2359. doi: 10.1038/leu.2012.
13. Knapper S, Burnett AK, Littlewood T et al. A phase II of the FLT3 inhibitor Lestaurtinib (CEP701) as first-line treatment for older patients with acute myeloid leukemia not considered fit for intensive chemotherapy. Blood 2006; 108 (10): 3262–3270.
14. Levis MJ, Perl AE, Altman JK et al. Results of a first-in-human, phase I/II trial of ASP2215, a selective, potent inhibitor of FLT3/Axl in patients with relapsed or refractory (R/R) acute myeloid leukemia (AML). J Clin Oncol 2015; 33 (Suppl): abstr. 7003.
15. Randhawa JK, Kantarjian HM, Borthakur G et al. Results of a phase II of crenolanib in relapsed/refraktory acute myeloid leukemia patients (Pts) with activating FLT3 mutations. Blood 2014; 124 (21): abstr. 389.
16. Smith CC, Wang Q, Chin CS et al. Validation of ITD mutations in FLT3 as a therapeutic target in human acute myeloid leukaemia. Nature 2012; 485 (7397): 260–263. doi: 10.1038/nature11016.
17. Parmar A, Marz S, Rushton S et al. Stromal niche cells protect early leukemic FLT3-ITD+ progenitor cells againts first generation FLT3 tyrosine kinase inhibitors. Cancer Res 2011; 71 (13): 4696–4706. doi: 10.1158/0008-5472.CAN-10-4136.
18. Levis M, Brown P, Smith BD et al. Plasma inhibitory activity (PIA): a pharmacodynamic assay reveals insights into the basis for cytotoxic response to FLT3 inhibitors. Blood 2006; 108 (10): 3477–3483.
19. Strati P, Kantarjian HM, Ravandi F et al. Phase I/II trial of the combination of midostaurin (PKC412) and 5-azacytidine for patients with acute myeloid leukemia and myelodysplastic syndrome. Am J Haemat 2015; 90 (4): 276–281. doi: 10.1002/ajh.23924.
20. Nazha A, Kantarjian HM, Borthakur G et al. A phase I/II trial of combination of PKC 412 and 5-azacytidine (AZA) for the treatment of patients with refraktory or relapsed (R/R) acute myeloid leukemia (AML) and myelodysplastic syndrome (MDS). J Clin Oncol 2012; 30: abstr. 6589.
21. Cooper BW, Kindnall-Keller TL, Lazarus HM et al. Phase I study of midostaurin and azacitidine in relapsed and elderly AML. J Clin Oncol 2012; 30: abstr. 6589.
22. Uy GL, Mandrekar S, Laumann K, et al. Addition of sorafenib to chemotherapy improves the overal survival of older adults with FLT3-ITD mutated acute myeloid leukemia (AML) (ALLIANCE C11001). Blood 2015; 126 : 319.
23. Serve H, Krug U, Wagner R et al. Sorafenib in combination with intensive chemotherapy in elderly patients with acute myeloid leukemia: results from a randomized, placebo-controlled trial. J Clin Oncol 2013; 31 (25): 3110–3118. doi: 10.1200/JCO.2012.46.4990.
24. Ravandi F, Alttar ML, Grunwald MR et al. Phase 2 study of azacytidine plus sorafenib in patients with acute myeloid leukemia and FLT-3 internal tandem duplication mutation. Blood 2013; 121 (23): 4655–4662. doi: 10.1182/blood-2013-01-480228.
25. Borthakur G, Kantarjian HM, O’Brian S et al. The combination of quizartinib with azacitidine or low dose cytarabine is higly active in patients (pts) with FLT3-ITD mutated myeloid leukemias: interim report of phase I/II trial. Blood 2014; 124 : 388–388.
26. Renner AG, Dos SC, Recher C et al. Polo-like kinase 1 is overexpressed in acute myeloid leukemia and its inhibition preferentially targets the proliferation of leukemic cells. Blood 2009; 114 (3): 659–662. doi: 10.1182/blood-2008-12-195867.
27. Döhner H, Lübbert M, Fiedler W et al. Randomized, phase 2 trial of low-dose cytarabine with or without volasertib in AML patients not suitable for induction therapy. Blood 2014; 124 (9): 1426–1433. doi: 10.1182/blood-2014-03-560557.
28. Kantarjian HM, Martinelli G, Jabbour EJ et al. Stage I of a phase 2 study assessing the efficacy, safety, and tolerability of barasertib (AZD1152) versus low-dose cytosine arabinoside in elderly patients with acute myeloid leukemia. Cancer 2013; 119 (14): 2611–2619. doi: 10.1002/cncr.28113.
29. Jaiswal S, Fontanillas P, Flannick J et al. Age-related clonal hematopoiesis associated with adverse outcome. N Engl J Med 2014; 371 (26): 2488–2498. doi: 10.1056/NEJMoa1408617.
30. Quintas-Cardama A, Ravandi F, Liu-Dumlao et al. Epigenetic therapy is associated with similar survival compared with intensive chemotherapy in older patients with newly diagnosed acute myloid leukemia. Blood 2012; 120 (24): 4840–4845. doi: 10.1182/blood-2012-06-436055.
31. Dombert H, Seymour JF, Butrym A et al. International phase III study of azacitidine vs conventional care regimens in older patients with newly diagnosed AML with > 30% blasts. Blood 2015; 126 (3): 291–299. doi: 10.1182/blood-2015-01-621664.
32. Kantarjian HM, Thomas XG, Dmoszynska A et al. Multicenter, randomized, open-label, phase III trial of decitabine versus patient choice, with physician advice, of either supportive care or low-dose cytarabine for the treatment of older patients with newly diagnosed acute myeloid leukemia. J Clin Oncol 2012; 30 (21): 2670–2677. doi: 10.1200/JCO.2011.38.9429.
33. Savona MR, Gore SD, Kolibaba KS et al. CC-486 (oral azacitidin) monotherapy in patients with acute myeloid leukemia (AML). Blood 2015; 126 : 452–452.
34. Kantarjian HM, Roboz GJ, Kropf PL et al. Comparison of efficacy and safety results in 103 treatment-naïve acite myeloid leukemia (TN-AML) patients not candidates for intensive chemotherapy using 5-day and 10-day regimens of guadecitabine (SGI-110), a novel hypomethylating aagent (HMA). Blood 2013; 126 : 458–458.
35. De Botton S, Pollyea DA, Stein EM et al. Clinical safety and activity of AG-120, a first-in class, potent inhibitor of the IDH1 mutant protein, in a phase 1 study of patients with advanced IDH1-mutant hematologic malignancies. EHA Annual Meeting Abstracts 2015 (100704).
36. DiNardo CD, Stein EM, Altman J et al. AG-221, an oral, selective first-in-class, potent inhibitor of the IDH2 mutant enzyme, induced durable responses in a phase I study of IDH2 mutation-positive advanced hematologic malignancies. EHA Annual Meeting Abstracts 2015 (100170).
37. Schafer EW, Loaiza-Bonilla A, Juckett M et al. A phase 2 study of vorinostat in acute myeloid leukemia. Haematologica 2009; 94 (10): 1375–1382. doi: 10.3324/haematol.2009.009217.
38. Giles F, Fischer T, Cortes J et al. A phase I study of inravenous LBH589, a novel cinnamic hydroxamic acid analogue histone deacetylase inhibitor in patients with refractory hematologic malignancies. Clin Cancer Res 2006; 12 (15): 4628–4635.
39. Garcia-Manero G, Atallah E, Khaled SK et al. Final Results from a Phase 2 Study of Pracinostat in Combination with Azacitidine in Elderly Patients with Acute Myeloid Leukemia (AML). Blood 2015; 126 : 453.
40. Kadia TM, Thomas XG, Dmoszynska A et al. Decitabine improves outcomes in older patients with acute myeloid leukemia and higher blast counts. Am J Hematol 2015; 90 (7): E139–E141. doi: 10.1002/ajh.24036.
41. Qin T, Jelinek J, Si J et al. Mechanisms of resistance to 5-aza-2-deoxycytidine in human cancer cell lines. Blood 2009; 113 (3): 659–667. doi: 10.1182/blood-2008-02-140038.
42. Rakheja D, Konoplev S, Medeiros LJ et al. IDH mutations in acute myeloid leukemia. Hum Pathol 2012; 43 (10): 1541–1551. doi: 10.1016/j.humpath.2012.05.003.
43. Gojo I, Jiemjit A, Trepel JB et al. Phase 1 and pharmacologic study of MS-275, a histone deacetylase inhibitor, in adults with refractory and relapsed acute leukemias. Blood 2007; 109 (7): 2781–2790.
44. Walter RB, Medeiros BC, Powell BL et al. Phase II trial of vorinostat and gemtuzumab ozogamicin as induction and post remission therapy in older adults with previously untreated acute myeloid leukemia. Haematologica 2012; 97 (5): 739–742. doi: 10.3324/haematol.2011.055822.
45. Tan P, Wei A, Mithraprabhu S et al. Dual epigenetic targeting with panobinostat and azacitidine in acute myeloid leukemia and high risk myelodysplastic syndrome. Blood Cancer J 2014; 4: e170. doi: 10.1038/bcj.2013.68.
46. Garcia-Manero G, Atallah E, Khaled SK et al. Final results from a phase 2 study of pracinostat in combination with azacitidine in elderly patients with acute myeloid leukemia (AML). Blood 2015; 126 : 453–453.
47. Lancet JE, Cortes JE, Hogge DE et al. Phase II, multicenter, randomized, open label trial of CPX-351 (cytarabine: daunorubicin) liposome injection versus cytarabine and daunorubicin in patients with untreated AML 60-75 years of age. Blood 2014; 123 (21): 3239–3246. doi: 10.1182/blood-2013-12-540971.
48. Foran JM, Sun Z, Claxton DF et al. North american leukemia, intergroup phase III randomized trial of single agent clofarabine as induction and post-remission therapy and decitabine as maintenance therapy in newly-diagnosed acute myeloid leukemia in older adults (age ≥ 60 years): a trial of the ECOG-ACRIN cancer research group (E2906). Blood 2015; 126 : 23 (abstr. 217).
49. Burnett AK, Russell N, Hills LK et al. A randomised comparison of the novel nukleoside analogue sapacitabine with low-dose cytarabine in older patients with acute myeloid leukaemia. Leukemia 2015; 39 (5): 1312–1319. doi: 10.1007/s00268-015-2953-4.
50. Burnett AK, Russell NH, Hunter AE et al. Clofarabin doubles the response rate in older patients with acute myeloid leukemia but does not improve survival. Blood 2013; 122 (8): 1384–1394. doi: 10.1182/blood-2013-04-496596.
51. Taylor VC, Buckley CD, Gouglas M et al. The myeloid-specific sialic acid-binding receptor, CD33, associates with the protein-tyrosine phosphatases, SHP-1 and SHP-2. J Biol Chem 1999; 274 (17): 11505–11512.
52. Larson RA, Sievers EL, Stadtmauer EA et al. Final report of the efficacy and safety of gemtuzumab ozogamicin (Mylotarg) in patients with CD33 positive acute myeloid leukemia in firs recurrence. Cancer 2005; 104 (7): 1442–1452.
53. Kung Sutherland MS, Walter RB, Jeffrey SC et al. SGN-CD33A: a novel CD33-targeting antibodydrug conjugate using a pyrrolobenzodiazepine dimer is active in models of drug-resistant AML. Blood 2013; 122 (8): 1455–1463. doi: 10.1182/blood-2013-03-491506.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článek Tři v jednom aneb onkotriádyČlánek Soutěž o nejlepší práciČlánek Molekulární aspekty nádorů štítné žlázy se zaměřením na mikroRNA a jejich klinické souvislostiČlánek SAMPUS, MELTUMP a THIMUMP – diagnostické kategorie charakterizované nejistým biologickým chovánímČlánek Aktuality z odborného tisku
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2017 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Nejasný stín na plicích – kazuistika
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Tři v jednom aneb onkotriády
- Soutěž o nejlepší práci
- Molekulární aspekty nádorů štítné žlázy se zaměřením na mikroRNA a jejich klinické souvislosti
- Súčasný pohľad na diagnostiku a liečbu karcinómu obličky
- Maligní melanom – od klasické histologie k molekulárně genetickému testování
- Nové léky v terapii akutní myeloidní leukemie u starších pacientů
- Mnohopočetný výskyt bazocelulárneho karcinómu – retrospektívna analýza 899 pacientov s biopticky verifikovanými léziami na jednom pracovisku
- Karcinom prsu u mladých žen – korelace klinických, histomorfologických a molekulárně-genetických nálezů karcinomu prsu u žen mladších 35 let
- Dlouhodobá kompletní odpověď metastázy kolorektálního karcinomu po biochemoterapii
- Izolovaná perfuze horní končetiny s TNF-α – dvojitá kanylace žilního systému
- SAMPUS, MELTUMP a THIMUMP – diagnostické kategorie charakterizované nejistým biologickým chováním
- Aktuality z odborného tisku
- Profesor MUDr. Luboš Petruželka, CSc. – životní jubileum
- Informace z České onkologické společnosti
- Kožní toxicita u cílené léčby dabrafenibem
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Súčasný pohľad na diagnostiku a liečbu karcinómu obličky
- SAMPUS, MELTUMP a THIMUMP – diagnostické kategorie charakterizované nejistým biologickým chováním
- Maligní melanom – od klasické histologie k molekulárně genetickému testování
- Karcinom prsu u mladých žen – korelace klinických, histomorfologických a molekulárně-genetických nálezů karcinomu prsu u žen mladších 35 let
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



