-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Radionekróza horní krční míchy po protonovém ozáření u nemocné po radikální resekci ependymomu IV. komory mozkové
Radiation Necrosis in the Upper Cervical Spinal Cord in a Patient Treated with Proton Therapy after Radical Resection of the Fourth Ventricle Ependymoma
Background:
Radiation necrosis in eloquent areas of the central nervous system (CNS) is one of the most serious forms of toxicity from radiation therapy. The occurrence of radiation necrosis in the CNS is described in a wide range of 3 months to 13 years after radiation therapy. The incidence of this complication covers a wide range of 3–47%. The potential advantage of proton therapy is the ability to reduce dose to normal tissue and escalate tumor dose. Proton beams enter and pass through the tissue with minimal dose deposition until they reach the end of their paths, where the peak of dose, known as the Bragg peak, occurs. Thereafter, a steep dose fall-off is evident. Such a precisely-distributed dose should reduce the toxicity of the treatment.Patient:
A 23 year-old female patient underwent radical microsurgical resection of anaplastic ependymoma that originated from the floor of the fourth ventricle. The tumor was growing into the foramen magnum dorsally from the medulla oblongata. Taking into account the age of the patient, the localization of the tumor and the required dose of 60 Gy, proton therapy was chosen due to the lower risk of damage to the brain stem. Radiation therapy was performed using pencil beam scanning and one dorsal field. Following this course of treatment, radiation necrosis of the medulla oblongata and the upper cervical spinal cord occurred with fatal clinical impact on the patient. The article analyses possible causes of this complication and a review of the current literature is given.Conclusion:
Despite the theoretical advantages of proton therapy, no clinical benefit in CNS tumors has yet been proven in comparison with modern methods of photon therapy. Proton therapy is accompanied by many uncertainties which can cause unpredictable complications, such as radiation necrosis at the edges of the target volume. Following proton therapy, there is not only a higher incidence of radiation necrosis but it occurs both sooner and to a higher degree. In cases of high anatomical complexity, the neurosurgeon should cooperate in the creation of the radiation treatment planning to ensure its optimization.Key words:
brain tumors – ependymoma – radiation therapy – proton therapy – necrosis – radiation necrosis
This work was partially supported by research project MH CZ – DRO (Faculty Hospital in Pilsen – FNPl, 00669806).
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.Submitted:
29. 6. 2017Accepted:
25. 7. 2017
Autoři: J. Mraček 1; J. Mork 1; T. Svoboda 2; J. Ferda 3
; V. Přibáň 1
Působiště autorů: Neurochirurgická klinika LF UK a FN Plzeň 1; Onkologická a radioterapeutická klinika LF UK a FN Plzeň 3 Klinika zobrazovacích metod LF UK a FN Plzeň 2
Vyšlo v časopise: Klin Onkol 2017; 30(4): 264-272
Kategorie: Přehled
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amko2017264Souhrn
Východiska:
Radionekróza v elokventních oblastech centrálního nervového systému (CNS) patří k nejobávanějším formám toxicity radioterapie. Vznik radionekrózy v CNS je popisován v rozpětí 3 měsíce až 13 let po ozáření, její incidence se pohybuje v širokém rozmezí 3–47 %. Za potenciální výhodu protonové léčby je považována schopnost šetřit zdravou tkáň a eskalovat dávku do cílového objemu. Prostřednictvím tzv. Braggova vrcholu protonový svazek předává v určité hloubce maximální dávku záření, před Braggovým vrcholem by dávka měla být nízká a za vrcholem nulová. Výhodnější distribuce dávky by měla redukovat toxicitu léčby.Pozorování:
Prezentován je případ 23leté nemocné, které byl mikrochirurgicky radikálně odstraněn anaplastický ependymom stopkovitě vyrůstající ze spodiny IV. komory mozkové a propagující se do velkého týlního otvoru dorzálně od prodloužené míchy. S přihlédnutím k věku, lokalizaci tumoru a dávce potřebného ozáření 60 Gy byla vzhledem k předpokládanému nižšímu riziku poškození mozkového kmene zvolena protonová léčba. Proběhlo ozáření protonovým svazkem s využitím jednoho dorzálního pole a techniky tužkového skenování. Po léčbě došlo k rozvoji radionekrózy v oblasti horní krční míchy s fatálními klinickými konsekvencemi. Ve sdělení jsou analyzovány možné příčiny vzniku komplikace a je uveden přehled literatury.Závěr:
Navzdory teoretickým výhodám protonové terapie nebyl dosud v porovnání s moderními metodami fotonového záření prokázán u tumorů CNS její klinický benefit. Protonová terapie je doprovázena nejasnostmi, které mohou vyústit v neočekávané komplikace, např. radionekrózu na okraji cílového objemu. Po protonové léčbě je patrný trend vyšší incidence radionekrózy, radionekróza vzniká dříve a je těžšího stupně. U anatomicky komplexních případů by se na tvorbě ozařovacího plánu měl podílet operatér, který přispěje k jeho optimalizaci.Klíčová slova:
tumory mozku – ependymom – radioterapie – protonová léčba – nekróza – radionekrózaÚvod
Ependymomy patří mezi nejčastější primární mozkové nádory dětí a mladistvých. Standardní léčba spočívá v maximální bezpečné mikrochirurgické resekci následované radioterapií. Pokud jsou vyčerpány možnosti chirurgické a radioterapeutické, lze zvážit paliativní chemoterapii. Agresivita onkologické léčby souvisí s nádorovým stupněm diferenciace (grade II, III) a se šířením likvorovými cestami (pozitivní cytologie likvoru, implantační metastázy) [1,2].
Radioterapie je základním kamenem komplexní léčby mozkových nádorů, nicméně je doprovázena nezanedbatelnou toxicitou. Mezi nejobávanější komplikace patří radionekróza v elokventních oblastech centrálního nervového systému (CNS), zejména v mozkovém kmeni [3].
Přestože moderní vysoce konformní techniky fotonové terapie jsou schopny doručit dávku do cílového objemu s vysokou přesností, velkým dávkovým spádem, a výrazně tak snížit riziko poškození přilehlé zdravé tkáně, stále více nemocných s mozkovými nádory především dětského věku je indikováno k léčbě protonové, která by měla přinášet další potenciální benefit. Výhodná dávková distribuce daná fyzikálními vlastnostmi protonového svazku (Braggův vrchol) umožňuje šetřit okolní zdravou tkáň a má potenciál snížit incidenci pozdních vedlejších účinků [4–7].
Ve sdělení je prezentován případ nemocné s anaplastickým ependymomem IV. komory, který byl radikálně operačně odstraněn. Následná protonová léčba vedla překvapivě k rozvoji radionekrózy v oblasti horní krční míchy s fatálními klinickými konsekvencemi. Autoři předkládají možné hypotézy vzniku této závažné a neočekávané komplikace a předkládají přehled literatury.
Kazuistika
Pacientka, 23 let, s anamnézou trombofilních stavů (Leidenská mutace a mutace v genu MTHFR) byla vyšetřována pro noční parestezie dolních končetin (DKK). Při objektivním vyšetření byl zjištěn normální neurologický nález. Elektrofyziologické vyšetření ukázalo normální somatosenzorické evokované potenciály (SEP) i motorické evokované potenciály (MEP) pro horní končetiny (HKK) i DKK. Magnetická rezonance (MRI) prokázala enhancující exofytický tumor stopkatě vyrůstající ze spodiny IV. komory a propagující se do velkého týlního otvoru dorzálně od prodloužené míchy, se kterou nesouvisel (obr. 1A, B). PET/CT s fluorothymidinem (FLT) ukázalo proliferačně aktivní tumor (obr. 2). Nádor byl za kontroly peroperační elektrofyziologické monitorace radikálně mikrochirurgicky odstraněn. Vlastní nádorovou masu nesouvisející s míchou bylo možné snadno vcelku extrahovat. Lůžko tumoru bylo velmi malé (stopka), nacházelo se v oblasti calamus scriptorius spodiny IV. komory (obr. 3A–D). Operace i pooperační průběh byly bez komplikací, předoperační parestezie DKK vymizely, rána se zhojila per primam intentionem, nemocná byla propuštěna. 10. pooperační den do domácí péče. Histologickým vyšetřením byl prokázán anaplastický ependymom (grade III). MRI vyloučila implantační metastázy v páteřním kanálu a cytologické vyšetření mozkomíšního moku vyloučilo přítomnost nádorových buněk.
Obr. 1. MRI (T1 vážený obraz po podání kontrastní látky) ukazuje mírně enhancující „prstovitý“ tumor vyrůstající ze spodiny IV. komory mozkové a propagující se do velkého týlního otvoru (A). Tumor nesouvisí s prodlouženou míchou, je omýván mozkomíšním mokem (B). 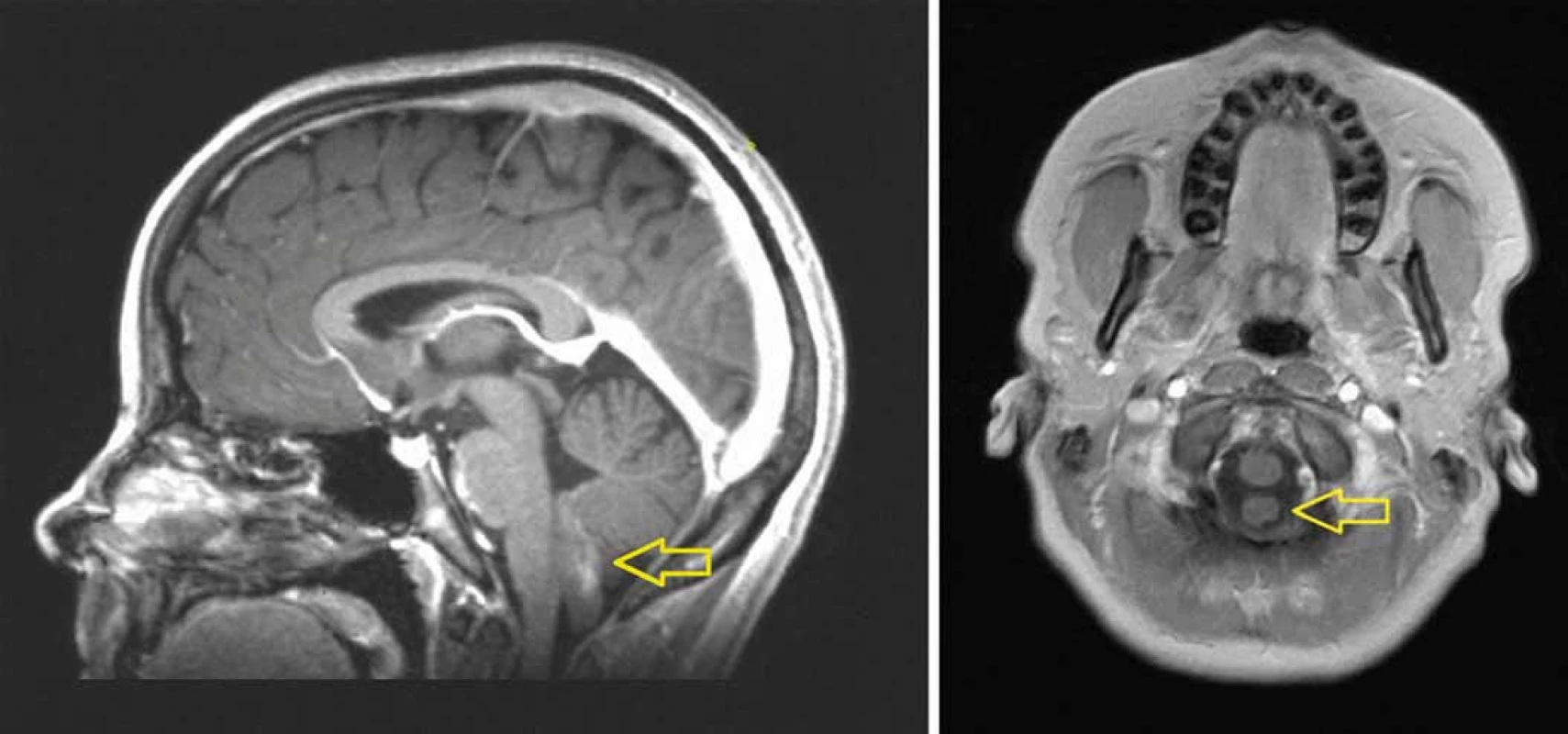
Obr. 2. PET/CT s FLT (fluorothymidin) ukazuje proliferačně aktivní tumor s nevýraznou akumulací radiofarmaka. 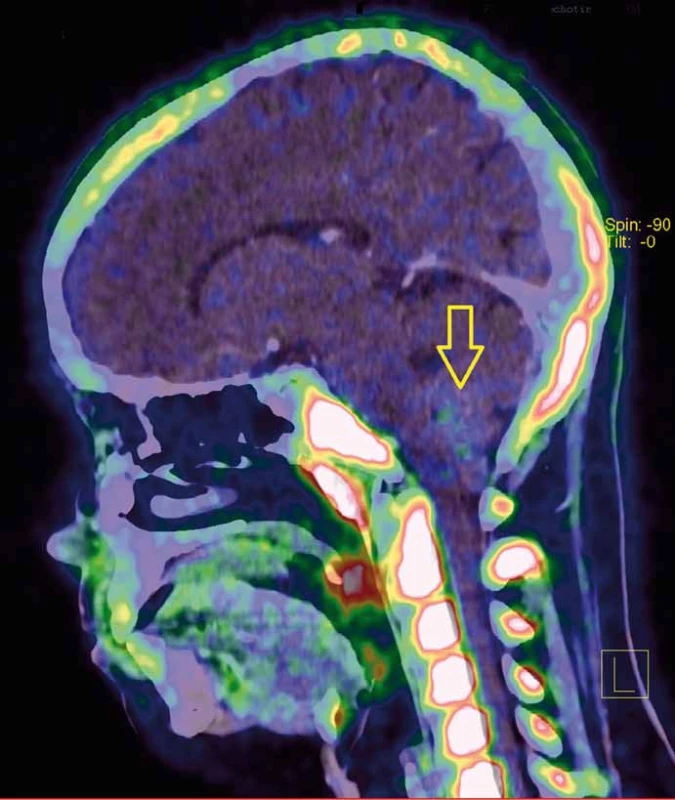
Obr. 3. Peroperační mikrofotografie. Obnažení tumoru mezi nadzdviženými mozečkovými tonzilami, před tumorem prosvítá prodloužená mícha, vlevo je patrná dominantní zadní dolní mozečková tepna (A). Nádorovou masu nesouvisející s míchou bylo možné volně vytáhnout z velkého týlního otvoru (B). Pohled na spodinu IV. komory po radikálním odstranění tumoru s malým lůžkem v oblasti calamus scriptorius (C). Intaktní mozečkové tonzily a prodloužená mícha na konci mikrochirurgické fáze operace (D). 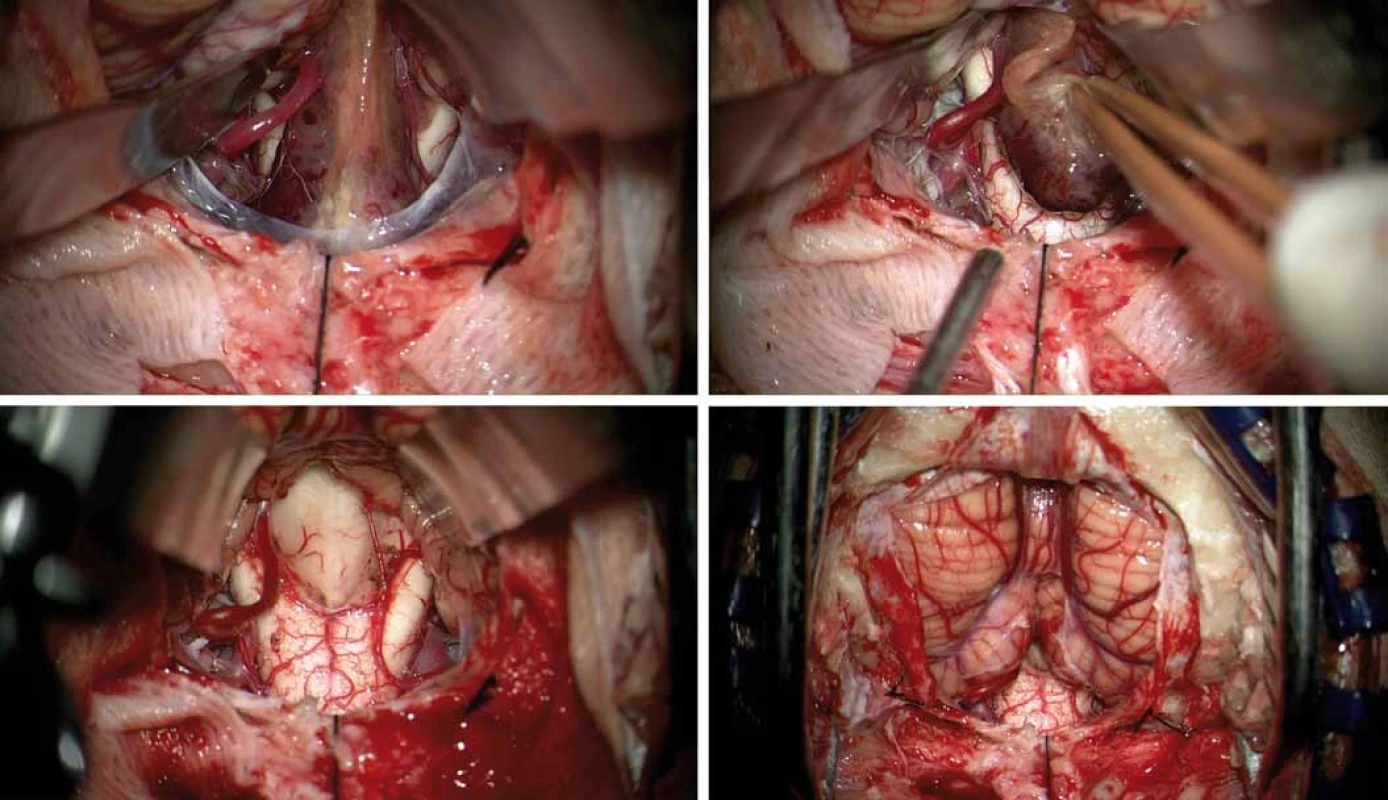
Vzhledem k věku nemocné, lokalizaci tumoru a potřebné dávce 56–60 Gy bylo z důvodů předpokládaného nižšího rizika poškození mozkového kmene preferováno ozáření protonovým svazkem. Celková doba ozařování byla 40 dní. Popis ozařovacího plánu (planning target volume – PTV) 1: lůžko tumoru, IV. komora s lemem; PTV 2: lůžko tumoru, IV. komora s lemem, redukce snižující dávku na mozkový kmen. Aplikovaná dávka do objemu PTV 1 : 48 CGE (cobalt gray equivalent) a do objemu PTV 2 : 12 CGE. Počet frakcí pro cílový objem PTV 1 : 24 a pro PTV 2 : 6. Dávka na frakci – 2 CGE a celková dávka 60 CGE pro oba cílové objemy PTV. Ozařovací technika – radioterapie protonovým svazkem technikou pencil beam scanning, jedno dorzální pole pro oba PTV, pronační poloha, fixace maskou. Vlastní ozařování proběhlo bez komplikací.
Osm měsíců po ukončení léčby se u nemocné objevily elektrizující výboje do DKK, objektivně byla zjištěna lehká spastická paraparéza s levostrannou převahou. Vyšetření MRI ukázalo nález bez recidivy v oblasti původního lůžka tumoru, avšak kaudálně v prodloužené a horní krční míše enhancující doutníkovité ložisko odpovídající radionekróze (obr. 4A, B). Vyšetření evokovaných potenciálů prokázalo zpomalené vedení centrálním motoneuronem zejména pro levou dolní končetinu (LDK), což topicky korespondovalo s grafickým i neurologickým nálezem. Nasazena byla kortikoterapie, nemocná absolvovala 19 cyklů hyperbarické oxygenoterapie. Neurologický deficit však dále progredoval, porucha hybnosti se rozšířila i na HKK, objektivně neurologicky se jednalo o těžkou spastickou kvadruparézu s převahou levostrannou a na DKK. Vyšetření PET/MRI s fluorodeoxyglukózou (FDG) provedené 12 měsíců po ozáření potvrdilo stacionární obraz radionekrózy v prodloužené a horní krční míše s počínající atrofií. Aplikace bevacizumabu (Avastin®) byla pojišťovnou zamítnuta (preparát není schválen v indikaci léčby radionekrózy), rodina si proto léčbu zpočátku hradila z vlastních prostředků a posléze prostřednictvím veřejné sbírky. Klinický stav nemocné se však stále horšil, rozvinul se těžký cushingoidní habitus, objevily se nehojící se bolestivé strie v kožních záhybech, inkontinence, nemocná byla odkázána na invalidní vozík. Kontrolní PET/MRI s FLT provedené 18 měsíců po ozáření potvrdilo nález bez recidivy tumoru v operované oblasti a regredující radionekrózu s atrofií míšní v horní krční oblasti (obr. 5A, B). MRI páteřního kanálu vyloučila diseminaci procesu. Nemocná umírá 21 měsíců po ozáření ve spádové okresní nemocnici pod obrazem septického šoku a multiorgánového selhání. Pitva na přání rodiny nebyla provedena.
Obr. 4. MRI (T2 vážený obraz) provedená 8 měsíců po protonovém ozáření. Snímky ukazují radionekrózu v prodloužené a horní krční míše (A) zasahující až do úrovně C3 (B). Radionekróza je mimo původní lokalizaci tumoru. 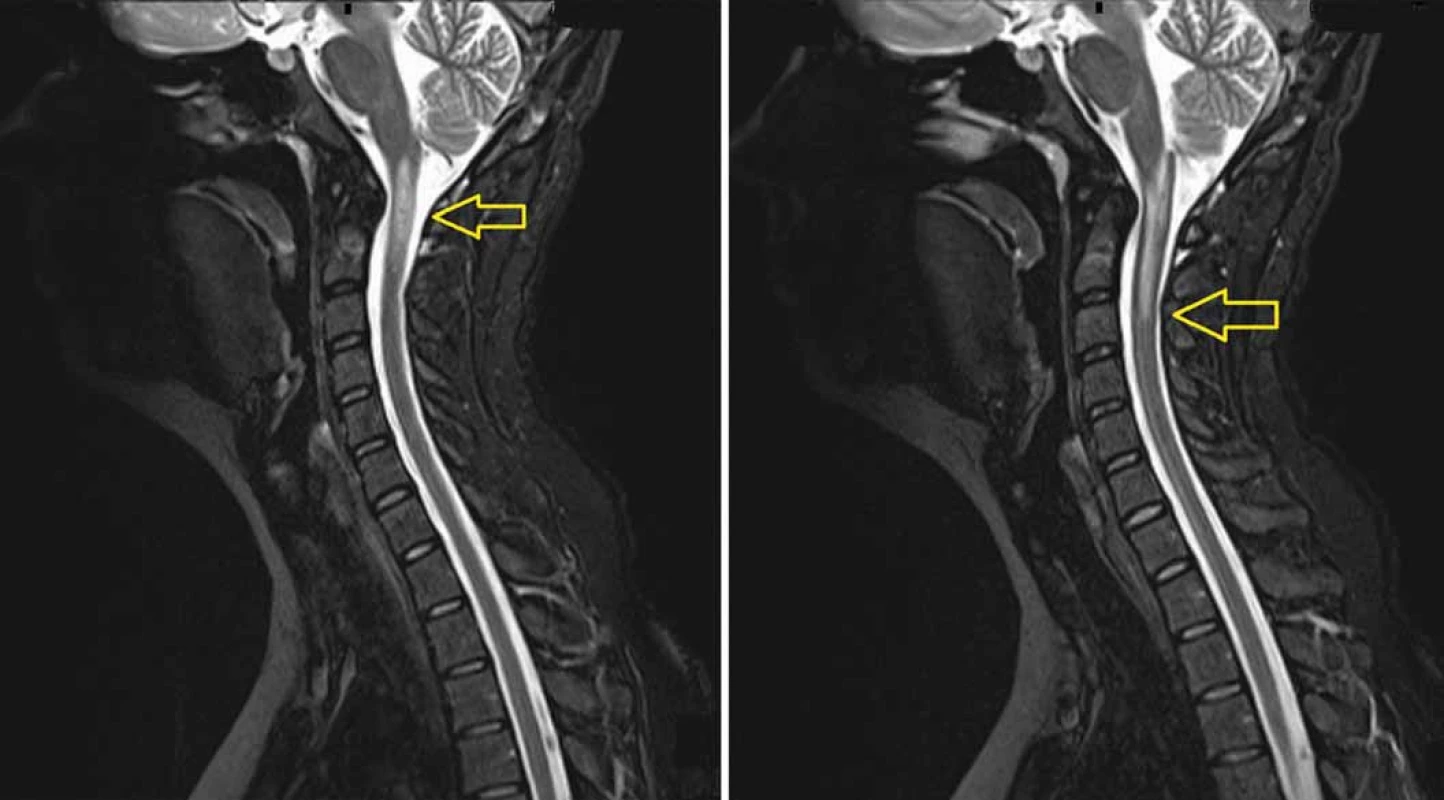
Obr. 5. PET/MRI s FLT (fluorothymidin) provedené 18 měsíců po ozáření. Vyšetření vyloučilo recidivu tumoru a ukázalo obraz regredující radionekrózy (A) s nevelkou akumulací FLT (fluorothymidin) a atrofií míšní (B). 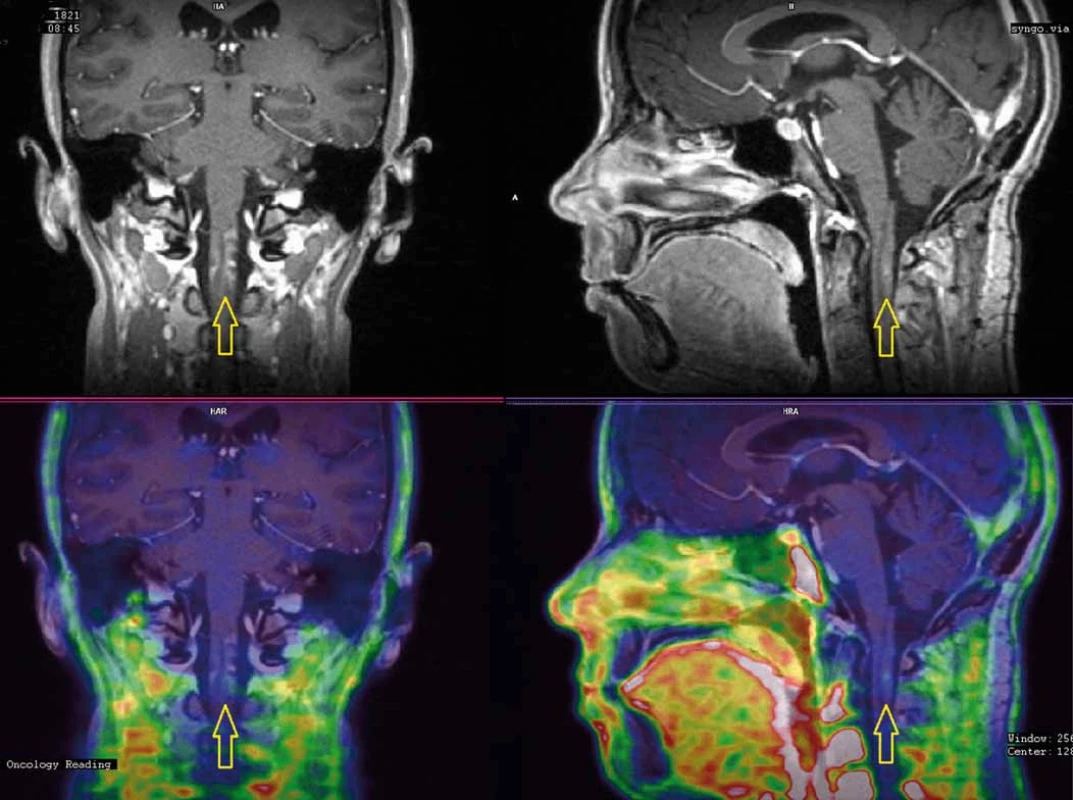
Diskuze
Radionekróza v oblasti CNS je známá a obávaná forma toxicity radioterapie. Její vznik je popisován v rozpětí 3 měsíců až 13 let po ozáření [8]. Klinické projevy se pohybují v závislosti na lokalizaci od asymptomatických radiologických nálezů přes kognitivní deficit až po těžkou výpadovou neurologickou symptomatiku a smrt [8,9]. Radiační nekróza je definována jako nová oblast sytící se kontrastní látkou na MRI, která nebyla patrná před ozářením, není v oblasti resekovaného tumoru, byla součástí ozařovaného objemu a postupně regreduje. Nádorová nekróza neboli tzv. pseudoprogrese je na rozdíl od radionekrózy typicky lokalizována v oblasti původního nádoru, resp. ozářeného rezidua [10,11]. Patogeneticky je radionekróza způsobena lézí oligodendrocytů a ischemií na úrovni mikrocirkulace iniciované lézí endotelu, následně dochází k poruše hematoencefalické bariéry, rozvoji edému a uvolnění vaskulárního endoteliálního růstového faktoru. Histopatologicky je vedle cévní léze patrná demyelinizace a nekróza bílé hmoty. Uvedené procesy postupně vedou k atrofii dané oblasti [12,13]. Léčba radionekrózy je velmi limitovaná, spočívá v aplikaci kortikoidů, bevacizumabu, hyperbarické oxygenoterapii, podáván bývá pentoxyfilin, vitamin E a výjimečně bývá indikována chirurgická resekce [13].
Rozpoznání radionekrózy je i v době moderních zobrazovacích technik svízelné. Její diagnostika je založena na vzájemné korelaci vývoje nálezu na zobrazovacích metodách a dynamiky klinických projevů. Histologické vyšetření je zastoupeno spíše výjimečně a navíc samo o sobě ani nemůže spolehlivě určit původ nekrózy [14]. V našem případě byla vzhledem k lokalizaci nálezu histologická verifikace vyloučena, přesto byla diagnóza radionekrózy nepochybná. Enhancující ložisko v míše se objevilo až 8 měsíců po ozáření, první MRI provedená 3 měsíce po operaci byla bez patologického nálezu. Při operaci byl mikroskopicky radikálně odstraněn exofyticky rostoucí nádor související s CNS pouze malou stopkou v oblasti spodiny IV. komory. Operační přístup byl mimo oblast horní krční míchy, a uvedený nález proto nemohl být vyvolán operačním zákrokem. Vyloučeny jsou proto jak pooperační změny, tak pseudoprogrese.
Z pohledu radiologického byla diferenciálně diagnosticky na prvním místě zvažována distanční recidiva nádoru. Postradiační změny v mozkové tkáni se v časné fázi na MRI projevují edémem a dále porušením hematoencefalické bariéry. Při difuzně váženém zobrazení je díky zvětšení extracelulárního prostoru difuze ve tkáni usnadněná. Dynamické zobrazení po aplikaci gadoliniové kontrastní látky se současným provedením farmakodynamické analýzy diferencují opožděný průnik kontrastní látky do tkáně, který se projevuje zvýšením parametru extracelulárního objemu, nikoli však zvýšením K-trans (transferová konstanta) nebo iAUC (initial area under the curve). Tyto nálezy patrné na provedených vyšetřeních přesvědčivě odlišily radionekrózu od rekurentního high-grade ependymomu. S odstupem měsíců se navíc objevila atrofie tkáně a úklidová gliová reakce, jejímiž projevy bylo opět sycení podanou kontrastní látkou. Vzhledem k porušení hematoencefalické bariéry a zpomalení kinetiky látek ve tkáních byla pozorována i akumulace FLT na provedeném kontrolním PET/MRI vyšetření. Neuroradiolog také jednoznačně vyloučil zánět nebo ischemii, proti kterým hovořil též pozvolný rozvoj neurologického deficitu. Vznik grafických změn časově koreloval s dynamikou neurologického deficitu. Spastická kvadruparéza potvrzená nálezem při elektrofyziologickém vyšetření (zpomalené vedení centrálním motoneuronem) topicky spolehlivě odpovídala radionekróze v horní krční míše. Výše uvedená data tudíž přesvědčivě vyloučila pochybnosti o diagnóze radionekrózy.
Protonová léčba byla u nemocné preferována před léčbou fotonovou vzhledem k potenciálu lepší protekce přilehlých fundamentálních nervových struktur (mozkový kmen) při potřebě aplikovat vysokou dávku 60 Gy. Přihlédnuto bylo také k nízkému věku nemocné. Vznik komplikace, které měla protonová léčba zabránit, byl proto velmi překvapující a frustrující.
Příčiny vzniku radionekrózy nejsou dosud spolehlivě objasněny.
Vzhledem k relativně velké vzdálenosti radionekrózy od lůžka tumoru, které mělo být cílem záření, je podezření na neadekvátní ozařovací plán. Ozařovací plán byl protonovým centrem zpětně opakovaně zkontrolován, fyzikálně nebyly zjištěny žádné nedostatky, technická chyba byla vyloučena. Přestože vlastní ozařovací plán nemáme k dispozici, dle odborné prezentace lékařů protonového centra byla oblast prodloužené a horní krční míchy na okraji cílového ozařovaného objemu. Pravděpodobně tudíž nebyla zohledněna specifická anatomická situace, kdy tumor se exofyticky propagoval do subarachnoidálního prostoru velkého týlního otvoru a s CNS souvisel pouze prostřednictvím malé stopky na spodině IV. komory. Přítomnost operatéra, který jediný měl podrobnou znalost anatomických vztahů v inkriminované oblasti, by zcela jistě napomohla při optimalizaci ozařovacího plánu.
Distanční radionekróza mohla také souviset s možnou nepřesností v cílení záření způsobenou absencí CT kontroly. CT přístroje nejsou zatím v našich podmínkách běžnou součástí protonových ozařovačů, a tudíž není možné ověřit přesné zaměření cílového objemu bezprostředně před léčbou. U moderních lineárních urychlovačů je CT jejich standardní součástí.
Individuální radiosenzitivita podmíněná různými specifickými faktory může být důvodem, proč téměř identický ozařovací plán může mít u různých nemocných rozdílnou toxicitu a terapeuticky rozdílně ovlivnit tumor [14]. Lze spekulovat, zda se trombofilní stav nemohl podílet na zvýšené radiosenzitivitě naší nemocné.
Riziko radionekrózy narůstá s velikostí ozařovaného objemu, se vzrůstající dávkou a počtem frakcí a souvisí také s podáním chemoterapie [15]. Některá chemoterapeutika zvyšují citlivost k radioterapii tak signifikantně, že se hovoří o tzv. léčbou vyvolané cerebrální nekróze (treatment related cerebral necrosis) [16,17]. Naše nemocná nebyla chemoterapií léčena, proto se tento faktor nemohl na vzniku radionekrózy podílet.
Fatální průběh nemoci potvrzuje velmi limitované možnosti terapie postradiační nekrózy [13]. Při léčbě nemocné byly použity současné doporučované léčebné postupy. Nežádoucí účinky a komplikace dlouhodobé kortikoterapie však pravděpodobně převýšily její benefit a podílely se na fatálním průběhu nemoci. Negativní dopady na klinický průběh mohlo mít i opožděné nasazení bevacizumabu z důvodů zdlouhavého a neúspěšného jednání s pojišťovnou o jeho úhradě.
Incidence radionekrózy v oblasti CNS je vzhledem k dlouhé latenci vzniku a obtížné diagnostice nejasná, dle různých studií se pohybuje v širokém rozmezí 3–47 % [15,18]. Data týkající se výskytu radionekrózy po protonové léčbě jsou velmi limitovaná a kontroverzní. Ve většině případů se jedná o práce hodnotící radionekrózu u pediatrických nemocných, popřípadě u nemocných s tumory baze lebeční. Za nejobávanější formu radionekrózy je považováno postižení mozkového kmene u dětských pacientů [14].
Indelicato et al hodnotili výskyt radionekrózy v mozkovém kmeni po protonové léčbě v souboru 313 dětí s různými mozkovými tumory. Kumulativní 2letá incidence byla 3,8 %. Rizikovým faktorem vzniku byl věk < 5 let, tumor lokalizovaný v zadní jámě a dávka na mozkový kmen přesahující 53,4 Gy. U podskupiny nemocných s tumorem v zadní jámě byla incidence radionekrózy 10,7 % [19].
Gunther et al jako jedni z mála porovnávali výskyt změn na MRI po protonové terapii a fotonové terapii s modulovanou intenzitou (intensity modulated radiation therapy) u souboru 72 dětí s ependymomem. Vyšší výskyt MRI změn byl zjištěn po protonovém záření (43 vs. 17 %) a u dětí mladších než 3 roky. Závažnější MRI nálezy byly zaznamenány po protonovém záření [20].
Giantsoudi et al hodnotili výskyt po-škození CNS po protonové terapii u 111 nemocných s meduloblastomem. Pětiletá kumulativní incidence poškození mozkového kmene byla 3,6 %. Navýšení dávky (boost) na celou zadní jámu zvýšilo riziko poškození mozkového kmene vč. horní krční míchy. V oblastech, kde vznikla většina lézí, byly zaznamenány vyšší hodnoty lineárního přenosu energie (linear energy transfer – LET) než v cílové tkáni, nicméně rozdíly relativní biologické účinnosti (relative biological effectiveness – RBE) byly statisticky nesignifikantní [21].
Kralik et al hodnotili incidenci radionekrózy po protonovém záření u 60 dětských pacientů s mozkovými tumory. Radionekróza byla prokázána téměř u třetiny nemocných (31 %), medián vzniku byl 5 měsíců. Rizikovým faktorem byla chemoterapie a diagnóza atypického teratoidního rhabdoidního tumoru. Ve většině případů byla ložiska radionekrózy malá, mnohočetná a vzdálená od oblasti chirurgické resekce [22].
McDonald et al posuzovali u souboru 66 nemocných výskyt radionekrózy v temporálních lalocích po protonovém ozáření radiorezistentních tumorů baze lebeční. Medián dávky záření byl 75,6 Gy. Pokud objem temporálních laloků vystavený dávce 60 Gy byl větší než 5,5 cm3, 3letá kumulativní incidence radionekrózy byla 15 % [23].
Menší studie přinášejí protichůdná data. Velmi vysokou incidenci radionekrózy (47 %) v souboru 17 velmi malých dětí s mozkovým nádorem po ozáření protonovým svazkem, kterému předcházela chemoterapie, popsali Sabin et al [18]. Proti tomu Freund et al zjistili v souboru 13 dětských nemocných s ependymomem nebo gliomem signifikantně vyšší riziko radionekrózy po fotonové léčbě (volumetric modulated arc therapy) než po léčbě protonové [9].
Výsledky studií testujících fotonovou léčbu na podobné populaci jako studie protonové hovoří ve prospěch fotonového záření. Největší soubor nemocných s embryonálními nádory, kteří byli léčeni fotonovým ozářením celé kraniospinální osy s navýšením dávky na zadní jámu, prezentovali Murphy et al. Pětiletá incidence radionekrózy v celém souboru byla 3,7, resp. 4,4 % při lokalizaci tumoru v zadní jámě. Rizikovým faktorem vzniku radionekrózy bylo ozáření významného objemu infratentoriálního prostoru dávkou > 50 Gy. Autoři potvrdili jednoznačný vliv dávky na vznik radionekrózy [24].
Velkou prospektivní studii dětských pacientů s ependymomem léčených vysokodávkovou fotonovou léčbou bez šetření mozkového kmene publikovali Merchant et al. Sedmiletá kumulativní incidence radionekrózy v mozkovém kmeni byla pouze 1,6 % [25].
Srovnání výskytu radionekrózy po protonové a fotonové léčbě je obtížné z důvodů odlišných populací nemocných a rozdílné léčby. Nicméně je patrný přesvědčivý trend vyššího výskytu radionekrózy po protonové léčbě. Protonová léčba je doprovázena závažnějšími stupni radionekrózy, které mají trvalé klinické následky. Navíc radionekróza po protonové léčbě vzniká časněji než po léčbě fotonové [13]. Ukazuje se, že cílová dávka mající potenciál ovlivnit nádory zadní jámy lebeční je zároveň prahovou dávkou zvýšeného rizika vzniku radionekrózy v přilehlé zdravé tkáni mozkového kmene. Výstupem řady protonových studií je kontroverzní doporučení omezit medián dávky na mozkový kmen na 53,4–54 Gy, což by mělo snížit riziko radionekrózy. Tato dávka je však nižší než v současné době doporučované dávky při ozařování tumorů zadní jámy [14].
Za hlavní výhodu protonové léčby je považována schopnost šetřit zdravou tkáň a eskalovat dávku do cílového objemu. Tato schopnost je dána specifickými fyzikálními vlastnostmi protonového svazku. Prostřednictvím tzv. Braggova vrcholu je v určité hloubce předána maximální dávka záření, před Braggovým vrcholem by dávka měla být nízká a za vrcholem pak nulová. Benefitem výhodnější distribuce dávky by měla být redukce toxicity vč. radionekrózy [4–6].
Na podkladě in vitro a preklinických experimentů bylo zjištěno, že RBE protonů kolísá v rozmezí 0,7–1,6 a dle některých zjištění může být horní hranice ještě výrazně vyšší [26–28]. V klinické praxi je však po konsenzu kalkulováno s průměrnou hodnotou RBE 1,1. Variabilita RBE protonového záření souvisí s LET. Nejvyšší LET je generován těsně před koncem doletu protonů na distálním okraji Braggova vrcholu, kde je tudíž RBE velmi pravděpodobně vyšší než na léčebném plánu a může zde zasáhnout zdravé kritické struktury. Tato situace může nastat zejména u radiorezistentních nádorů, kdy je potřeba podat vysokou dávku [6,29]. Navíc se ukazuje, že oblast s vysokou LET nemusí být soustředěna pouze na distální hraně Braggova vrcholu. Sekundární částice (neutrony) generované při protonové léčbě se podílejí na vzniku dávkové penumbry a mohou ovlivnit distribuci LET [29–31]. Široký rozptyl RBE může vést na jedné straně k nedostatečnému efektu léčby a na straně druhé souviset s neočekávanou toxicitou (nízká RBE v oblasti nádoru, vysoká RBE v normální tkáni). Klinická variabilita RBE souvisí s řadou faktorů (změna anatomických poměrů mezi frakcemi, pohyb během frakce, dávka na frakci, typ tkáně a buněk). Nejistota panuje zejména u anatomicky heterogenních a komplexních struktur, u kterých při průchodu protonového záření může dojít k negativnímu ovlivnění konformity dávkové distribuce [4,6,26–29].
Plánování protonové léčby je založeno na modelování podle odhadů a předpokladů. Nejistota ve velikosti a distribuci dodané dávky, zejména v exaktní lokalizaci distálního dávkového gradientu snižuje dozimetrické výhody protonového záření. Fotonové záření má na rozdíl od protonové terapie RBE stabilní [4–6,14,28–29].
Nicméně technologický vývoj je patrný i v oblasti protonové léčby. Moderní techniky by měly mít schopnost ovlivnit distribuci LET (posunout vysoký LET od kritických struktur), aniž by změnily distribuci dávky [29]. Moderní technika tužkového skenování (pencil beam scanning) by měla umožnit dynamicky usadit Braggův vrchol v celém rozsahu cílového objemu a trojrozměrně přizpůsobit cílovou dávku i při použití jednoho pole [32]. Na druhé straně se ukazuje, že při použití jednoho pole může tužkové skenování vést k neočekávanému předávkování zejména v oblasti první vrstvy [33].
Zásadní otázkou zůstává, proč velký potenciál protonové terapie daný teoretickými výhodami ve fyzikální rovině není podpořen přesvědčivými klinickými důkazy. Dosud nebyla publikována žádná randomizovaná studie, která by prokazovala klinický benefit protonové léčby u nádorů CNS v porovnání s moderními metodami fotonového záření [5,34]. Většina publikovaných klinických dat testujících protonovou léčbu pochází z nerandomizovaných studií. Odborná radioterapeutická obec však volá po randomizovaném výzkumu porovnávajícím benefit protonové a fotonové léčby [4–6,14,34]. Tato snaha ovšem naráží na řadu problémů a kontroverzí. Smysluplnost studií je podmíněna porovnáváním odpovídajících moderních technik protonové a fotonové léčby (intensity modulated radiotherapy vs. intensity modulated proton therapy). U dětské populace, kde jsou výhody protonové léčby všeobecně akceptovány, by randomizace byla považována za neetickou. Z tohoto důvodu se randomizované studie u pediatrických tumorů CNS pravděpodobně nikdy nedočkáme. V současné době nicméně probíhá multicentrická analýza porovnávající toxicitu protonové a fotonové léčby a řada randomizovaných studií je připravována [5,35].
Protonové záření by mělo být zváženo zejména u pediatrických tumorů CNS. Důvodem je vysoká radiosenzitivita dětských tkání a dlouhodobé přežívání dětských pacientů. Protonová léčba má potenciál snížit celkovou dávku a eliminovat tak riziko sekundárních malignit [7,36,37]. Přestože u dětských tumorů CNS je protonová léčba považována za superiorní, ani v této oblasti nebyly dosud dlouhodobé klinické výsledky publikovány [34].
Za zlatý standard je protonová léčba považována u radiorezistentních tumorů baze – chordomů a chondrosarkomů [5,32]. Přestože se uvádí, že protonová léčba umožňuje u těchto tumorů bezpečně podat vysokou dávku (74 Gy), je doprovázena nezanedbatelnou toxicitou zejména v oblasti temporálních laloků [38].
Hendikepem protonové terapie, který nelze pominout, je její cena. Prioritou veřejného zdravotnictví by mělo být provedení ekonomické analýzy u všech nových technologií. Systematický přehled ceny a nákladové efektivity (cost-effective-ness) ukázal příznivou nákladovou efektivitu protonové léčby pouze u pediatrických nádorů CNS [39].
Závěr
Protonová léčba je slibná moderní léčebná modalita, která se nachází v pionýrské fázi svého vývoje. Přes přesvědčivé teoretické výhody protonové terapie nebyl dosud u tumorů CNS prokázán v porovnání s moderními metodami fotonového záření její klinický benefit.
Protonová terapie je doprovázena mnoha nejasnostmi, které mohou vyústit v neočekávané komplikace, např. radionekrózu na okraji ozařovaného objemu.
Při průchodu protonového záření heterogenními tkáněmi může dojít k negativnímu ovlivnění konformity dávkové distribuce.
Po protonové léčbě v oblasti CNS je patrný trend vyšší incidence radionekrózy, radionekróza vzniká dříve a je těžších stupňů.
U anatomicky specifických případů může přítomnost operatéra při tvorbě ozařovacího plánu přispět k jeho optimalizaci.
Práce byla částečně podpořena výzkumným záměrem MZ ČR – RVO (Fakultní nemocnice Plzeň – FNPl, 00669806).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
doc. MUDr. Jan Mraček, Ph.D.
Neurochirurgická klinika
LF UK a FN Plzeň
alej Svobody 80
323 00 Plzeň
e-mail: mracek@fnplzen.cz
Obdrženo: 29. 6. 2017
Přijato: 25. 7. 2017
Zdroje
1. Cage TA, Clark AJ, Aranda D et al. A systematic review of treatment outcomes in pediatric patients with intracranial ependymomas. J Neurosurg Pediatr 2013; 11 (6): 673–681. doi: 10.3171/2013.2.PEDS12345.
2. Wright KD, Gajjar A. Current treatment options for pediatric and adult patients with ependymoma. Curr Treat Options Oncol 2012; 13 (4): 465–477. doi: 10.1007/s11864-012-0205-5.
3. Plimpton SR, Stence N, Hemenway M et al. Cerebral radiation necrosis in pediatric patients. Pediatr Hematol Oncol 2015; 32 (1): 78–83. doi: 10.3109/08880018.2013.791738.
4. Merchant TE, Farr JB. Proton beam therapy: a fad or a new standard of care. Curr Opin Pediatr 2014; 26 (1): 3–8. doi: 10.1097/MOP.0000000000000048.
5. Combs SE. Does Proton Therapy Have a Future in CNS Tumors? Curr Treat Options Neurol 2017; 19 (3): 12. doi: 10.1007/s11940-017-0447-4.
6. Mohan R, Grosshans D. Proton therapy – present and future. Adv Drug Deliv Rev 2017; 109 : 26–44. doi: 10.1016/j.addr.2016.11.006.
7. Armoogum KS, Thorp N. Dosimetric Comparison and Potential for Improved Clinical Outcomes of Paediatric CNS Patients Treated with Protons or IMRT. Cancers (Basel) 2015; 7 (2): 706–722. doi: 10.3390/cancers7020706.
8. Fink J, Born D, Chamberlain MC. Radiation necrosis: relevance with respect to treatment of primary and secondary brain tumors. Curr Neurol Neurosci Rep 2012; 12 (3): 276–285. doi: 10.1007/s11910-012-0258-7.
9. Freund D, Zhang R, Sanders M et al. Predictive Risk of Radiation Induced Cerebral Necrosis in Pediatric Brain Cancer Patients after VMAT Versus Proton Therapy. Cancers (Basel) 2015; 7 (2): 617–630. doi: 10.3390/cancers7020617.
10. Parvez K, Parvez A, Zadeh G. The diagnosis and treatment of pseudoprogression, radiation necrosis and brain tumor recurrence. Int J Mol Sci 2014; 15 (7): 11832–11846. doi: 10.3390/ijms150711832.
11. Hygino da Cruz LC Jr, Rodriguez I, Domingues RC et al. Pseudoprogression and pseudoresponse: imaging challenges in the assessment of posttreatment glioma. AJNR Am J Neuroradiol 2011; 32 (11): 1978–1985. doi: 10.3174/ajnr.A2397.
12. Greene-Schloesser D, Robbins ME, Peiffer AM et al. Radiation-induced brain injury: a review. Front Oncol 2012; 2 : 73. doi: 10.3389/fonc.2012.00073.
13. Drezner N, Hardy KK, Wells E et al. Treatment of pediatric cerebral radiation necrosis: a systematic review. J Neurooncol 2016; 130 (1): 141–148.
14. MacDonald SM, Laack NN, Terezakis S. Humbling Advances in Technology: Protons, Brainstem Necrosis, and the Self-Driving Car. Int J Radiat Oncol Biol Phys 2017; 97 (2): 216–219. doi: 10.1016/j.ijrobp.2016.08.001.
15. Ruben JD, Dally M, Bailey M et al. Cerebral radiation necrosis: incidence, outcomes, and risk factors with emphasis on radiation parameters and chemotherapy. Int J Radiat Oncol Biol Phys 2006; 65 (2): 499–508.
16. Anand AK, Chaudhory AR, Aggarwal HN et al. Survival outcome and neurotoxicity in patients of high-grade gliomas treated with conformal radiation and temozolamide. J Cancer Res Ther 2012; 8 (1): 50–56. doi: 10.4103/0973-1482.95174.
17. Jakacki RI, Burger PC, Zhou T et al. Outcome of children with metastatic medulloblastoma treated with carboplatin during craniospinal radiotherapy: a Children‘s Oncology Group Phase I/II study. J Clin Oncol 2012; 30 (21): 2648–2653. doi: 10.1200/JCO.2011.40.2792.
18. Sabin ND, Merchant TE, Harreld JH et al. Imaging changes in very young children with brain tumors treated with proton therapy and chemotherapy. AJNR Am J Neuroradiol 2013; 34 (2): 446–450. doi: 10.3174/ajnr.A3219.
19. Indelicato DJ, Flampouri S, Rotondo RL et al. Incidence and dosimetric parameters of pediatric brainstem toxicity following proton therapy. Acta Oncol 2014; 53 (10): 1298–1304. doi: 10.3109/0284186X.2014.957414.
20. Gunther JR, Sato M, Chintagumpala M et al. Imaging Changes in Pediatric Intracranial Ependymoma Patients Treated With Proton Beam Radiation Therapy Com-pared to Intensity Modulated Radiation Therapy. Int J Radiat Oncol Biol Phys 2015; 93 (1): 54–63. doi: 10.1016/j.ijrobp.2015.05.018.
21. Giantsoudi D, Sethi RV, Yeap BY et al. Incidence of CNS Injury for a Cohort of 111 Patients Treated With Proton Therapy for Medulloblastoma: LET and RBE Associations for Areas of Injury. Int J Radiat Oncol Biol Phys 2016; 95 (1): 287–296. doi: 10.1016/j.ijrobp.2015.09.015.
22. Kralik SF, Ho CY, Finke W et al. Radiation Necrosis in Pediatric Patients with Brain Tumors Treated with Proton Radiotherapy. AJNR Am J Neuroradiol 2015; 36 (8): 1572–1578. doi: 10.3174/ajnr.A4333.
23. McDonald MW, Linton OR, Calley CS. Dose-volume relationships associated with temporal lobe radiation necrosis after skull base proton beam therapy. Int J Radiat Oncol Biol Phys 2015; 91 (2): 261–267. doi: 10.1016/j.ijrobp.2014.10.011.
24. Murphy ES, Merchant TE, Wu S et al. Necrosis after craniospinal irradiation: results from a prospective series of children with central nervous system embryonal tumors. Int J Radiat Oncol Biol Phys 2012; 83 (5): e655–e660. doi: 10.1016/j.ijrobp.2012.01.061.
25. Merchant TE, Li C, Xiong X et al. Conformal radiotherapy after surgery for paediatric ependymoma: a prospective study. Lancet Oncol 2009; 10 (3): 258–266.
26. Paganetti H, Niemierko A, Ancukiewicz M et al. Relative biological effectiveness (RBE) values for proton beam therapy. Int J Radiat Oncol Biol Phys 2002; 53 (2): 407–421.
27. Paganetti H, van Luijk P. Biological considerations when comparing proton therapy with photon therapy. Semin Radiat Oncol 2013; 23 (2): 77–87. doi: 10.1016/j.semradonc.2012.11.002.
28. Paganetti H. Range uncertainties in proton therapy and the role of Monte Carlo simulations. Phys Med Biol 2012; 57 (11): R99–R117. doi: 10.1088/0031-9155/57/11/R99.
29. Grassberger C, Trofimov A, Lomax A et al. Variations in linear energy transfer within clinical proton therapy fields and the potential for biological treatment planning. Int J Radiat Oncol Biol Phys 2011; 80 (5): 1559–1566. doi: 10.1016/j.ijrobp.2010.10.027.
30. Paganetti H, Athar BS, Moteabbed M et al. Assessment of radiation-induced second cancer risks in proton therapy and IMRT for organs inside the primary radiation field. Phys Med Biol 2012; 57 (19): 6047–6061. doi: 10.1088/0031-9155/57/19/6047.
31. Farr JB, Dessy F, De Wilde O et al. Fundamental radiological and geometric performance of two types of proton beam modulated discrete scanning systems. Med Phys 2013; 40 (7): 072101. doi: 10.1118/1.4807643.
32. Noel G, Gondi V. Proton therapy for tumors of the base of the skull. Chin Clin Oncol 2016; 5 (4): 51. doi: 10.21037/cco.2016.07.05.
33. Barragán AM, Differding S, Janssens G et al. Feasibility and robustness of dose painting by numbers in proton therapy with contour-driven plan optimization. Med Phys 2015; 42 (4): 2006–2017. doi: 10.1118/1.4915082.
34. Leroy R, Benahmed N, Hulstaert F et al. Proton Therapy in Children: A Systematic Review of Clinical Effectiveness in 15 Pediatric Cancers. Int J Radiat Oncol Biol Phys 2016; 95 (1): 267–278. doi: 10.1016/j.ijrobp.2015.10.025.
35. Jones B, Wilson P, Nagano A et al. Dilemmas concerning dose distribution and the influence of relative biological effect in proton beam therapy of medulloblastoma. Br J Radiol 2012; 85 (1018): e912–e918. doi: 10.1259/bjr/24498486.
36. Newhauser WD, Durante M. Assessing the risk of second malignancies after modern radiotherapy. Nat Rev Cancer 2011; 11 (6): 438–448. doi: 10.1038/nrc3069.
37. Laprie A, Hu Y, Alapetite C et al. Paediatric brain tumours: a review of radiotherapy, state of the art and challenges for the future regarding protontherapy and carbontherapy. Cancer Radiother 2015; 19 (8): 775–789. doi: 10.1016/j.canrad.2015.05.028.
38. Pehlivan B, Ares C, Lomax AJ et al. Temporal lobe toxicity analysis after proton radiation therapy for skull base tumors. Int J Radiat Oncol Biol Phys 2012; 83 (5): 1432–1440. doi: 10.1016/j.ijrobp.2011.10.042.
39. Verma V, Mishra MV, Mehta MP. A systematic review of the cost and cost-effectiveness studies of proton radiotherapy. Cancer 2016; 122 (10): 1483–1501. doi: 10.1002/cncr.29882.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2017 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Zasedání Organizace evropských onkologických ústavů v Brně
- Soutěž o nejlepší práci
- Nové poznatky o patogenezi folikulárního lymfomu a koncepty cílené léčby
- Konfokální laserová mikroskopie v diagnostice onkologických onemocnění gastrointestinálního traktu
- Radionekróza horní krční míchy po protonovém ozáření u nemocné po radikální resekci ependymomu IV. komory mozkové
- Metastatické postižení hypofýzy
- Informace z České onkologické společnosti
- Hyperfrakcionovaná akcelerovaná radioterapie s modulovanou intenzitou u pokročilých nádorů hlavy a krku – prediktivní faktory celkového přežití
- Sekvence docetaxel–kabazitaxel–enzalutamid ve srovnání se sekvencí docetaxel–enzalutamid u pacientů s metastatickým kastračně rezistentním karcinomem prostaty
- Reaktivní lymfoidní hyperplazie jater
- Nádor hrudnej steny ako zriedkavý klinický prejav metastázy hepatocelulárneho karcinómu
- Radioterapie nádorů s plicní lokalizací u idiopatické plicní fibrózy
- Exprese antigenu CD20 na povrchu buňky maligního B lymfomu
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Metastatické postižení hypofýzy
- Reaktivní lymfoidní hyperplazie jater
- Radioterapie nádorů s plicní lokalizací u idiopatické plicní fibrózy
- Radionekróza horní krční míchy po protonovém ozáření u nemocné po radikální resekci ependymomu IV. komory mozkové
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



