-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Konfokální laserová mikroskopie v diagnostice onkologických onemocnění gastrointestinálního traktu
Confocal Laser Endomicroscopy in the Diagnostics of Malignancy of the Gastrointestinal Tract
In confocal laser endomicroscopy (CLE), a type of optical microscope that uses a laser beam as its light source and processes the acquired image by processor unit is used. Although the principle behind the device has been known since 1957, its use in clinical practice has only recently been enabled by technical developments, and it is therefore a relatively new modality in differential diagnosis. CLE enables real-time microscopic imaging of the tissue under investigation and in fact non-invasive in vivo biopsy. First experiences with CLE have primarily been obtained in the field of endoscopy, in particular in the pathology of the esophagus, stomach, bile duct, pancreas, and colon. Further to its use in endoscopy, CLE was recently developed for perioperative use, with the most experience gained in neurological, breast, and prostate surgery. Numerous prospective randomized trials have confirmed the benefits of CLE in tumor screening, differential diagnosis of tumors or inflammatory diseases, earlier diagnostics of diseases, and reducing the number of required endoscopic examinations. In addition, CLE is associated with minimal side effects. A known possible side effect is allergy to the fluorescein used to stain tissues during the examination. Extending of endoscopic examination or surgery is minimal in the hands of trained personnel. Current limiting factors of CLE include insufficient clinical experience, the price of the CLE device and probes, and the subjectivity inherent in the evaluation of microscopic images by the endoscopist or surgeon. This article summarizes published studies of CLE in the diagnostics of oncological diseases of the gastrointestinal tract.
Key words:
confocal microscopy – gastrointestinal tract – neoplasms
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.Submitted:
9. 2. 2017Accepted:
26. 2. 2017
Autoři: P. Moravčík 1; J. Hlavsa 1; L. Kunovsky 1,2; Z. Kala 1
; I. Penka 1
; M. Dastych 2
Působiště autorů: Chirurgická klinika LF MU a FN Brno 1; Interní gastroenterologická klinika LF MU a FN Brno 2
Vyšlo v časopise: Klin Onkol 2017; 30(4): 258-263
Kategorie: Přehled
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amko2017258Souhrn
Při konfokální laserové mikroskopii (confocal laser endomicroscopy – CLE) se užívá druh optického mikroskopu, který využívá jako zdroj světla laserový paprsek a zpracovává získaný obraz pomocí procesorové jednotky. Princip přístroje je znám již od roku 1957, nicméně až technický rozvoj v poslední době umožnil jeho reálné využití v klinické praxi. V rámci diferenciální diagnostiky je tak CLE relativně novou modalitou umožňující mikroskopické zobrazení vyšetřované tkáně v reálném čase, a tím de facto provádění neinvazivní in vivo biopsie. První zkušenosti s CLE byly získány především na poli endoskopickém, a to především v oblasti patologie jícnu, žaludku, žlučových cest, pankreatu a tlustého střeva. V posledních letech se taktéž rozvíjí neendoskopické peroperační použití, kde nejvíce zkušeností bylo prozatím získáno v oblasti neurochirurgie, chirurgie mammární a chirurgie prostaty. V rámci četných prospektivních randomizovaných studií byl potvrzen přínos CLE při sledování premalignit, v diferenciální diagnostice nádorových či zánětlivých onemocnění, ve zrychlení diagnostiky a ve snížení počtu endoskopických vyšetření. Použití CLE je navíc zatíženo pouze minimálním množstvím potenciálních nežádoucích účinků. Rizikem je možná alergie na fluorescein, který je během vyšetření užíván k barvení tkání. Prodloužení endoskopického vyšetření či operace je v rukou zaškoleného personálu minimální. Limitujícími faktory CLE jsou prozatím nedostatečné klinické zkušenosti, cena přístroje a používaných sond, subjektivní složka při hodnocení mikroskopického obrazu endoskopistou či chirurgem. Cílem této přehledové práce je shrnutí dosud publikovaných studií o užití CLE v diagnostice onkologických onemocnění gastrointestinálního traktu.
Klíčová slova:
konfokální mikroskopie – gastrointestinální trakt – nádoryÚvod
Idea konfokální laserové mikroskopie (confocal laser endomicroscopy – CLE) je známa již téměř 60 let. V roce 1957 byla patentována americkým matematikem Marvinem L. Minskym, který ale plně funkční mikroskop v době podání patentu nebyl schopen sestrojit pro absenci dostatečně silného zdroje světla [1]. Rovněž čeští vědci se podíleli na jejím rozvoji. Petráň a Hadravský z Lékařské fakulty UK v Plzni patentovali konfokální mikroskop (Tandem Scanning Confocal Microscope), se kterým byly historicky poprvé získány kvalitní optické řezy silným preparátem – mozkovou tkání [2,3]. Přes tyto dílčí úspěchy nebyla CLE příliš využívána, především pro složitost zpracování získaného obrazu. K jejímu rozvoji došlo v 80. letech minulého století s pokrokem výpočetní techniky. Využití v klinické praxi je reálně možné od roku 2004, kdy byl firmou Pentax vyvinut endoskop s konfokálním laserovým mikroskopem. Širší zavedení do praxe poté umožnila konstrukce CLE sond firmy Manua Kea technologies.
Princip fungování CLE
Konfokální laserový mikroskop je druh optického mikroskopu, který jako zdroj světla užívá monochromatický nízkoenergetický laserový paprsek. Ten je směřován soustavou clon, zrcadel a objektivem na vyšetřovanou tkáň. Po ní je posouván bod po bodu pomocí rastrovacího zařízení. Odražené paprsky jsou pak dichromatickým zrcadlem směřovány na bodovou clonu, která odfiltruje světlo odražené z jiných vrstev sledovaného preparátu. Snímaný obraz tak pochází pouze z jedné roviny vyšetřované tkáně a všechny body výsledného obrazu jsou tedy konfokální – mají společné ohnisko. Definitivní obraz je složen pomocí procesorové jednotky. K adekvátnímu zobrazení tkání je nutné užití barviva, které zvyšuje fluorescenční schopnost lidské tkáně [4,5].
Přístroje k provádění CLE
V praxi jsou nyní používány dva typy přístrojů umožňující CLE – endoskop firmy Pentax (endoscope based CLE – eCLE) a přístroj Cellvizio firmy Manua Kea technologies s CLE sondami (probe based CLE – pCLE) [6,7].
eCLE užívá mikroskop zabudovaný v běžném endoskopu průměru 12,8 mm, jehož koncová část je vzhledem k vestavěnému CLE rigidní a je prodloužena o 5 cm. Tento typ CLE lze užít k vyšetření horních i dolních partií gastrointestinálního traktu. Vzhledem k velikosti je nevhodný pro vyšetřování pankreatobiliárních struktur. Výhodou je možnost opakovaného užití.
pCLE využívá ke snímání mikroskopického obrazu sondy velikostně kompatibilní s pracovním kanálem běžných endoskopů. K dispozici je několik typů sond, pomocí kterých lze vyšetřovat trávicí trakt, dýchací cesty či urotrakt. Průměr a délka sond se liší v závislosti na způsobu užití. Nevýhodou sond je jejich životnost limitovaná počtem použití – 10× (AQ-Flex, Cholangioflex) a 20× (Colo/ /GastroFlex). Ač se v praxi nadále užívají oba typy CLE, komerčně dostupným nyní zůstal pouze přístroj Cellvizio (obr. 1). Další část článku bude tedy pojednávat o klinických zkušenostech s pCLE.
Praktické užití
Provádění pCLE je uživatelsky nenáročné. Spuštění a kalibrace přístroje trvá přibližně 3 min a je plně intuitivní. Průběh mikroskopického vyšetření poté závisí na zkušenostech endoskopisty či chirurga, který jej provádí. Při dostatečném zaškolení a standardizaci vyšetřovacího procesu prodlužuje výkon přibližně o 5–10 min. Před prováděním mikroskopie je nutné pacientovi aplikovat barvivo zvyšující fluorescenční schopnosti tkání. Nejčastěji užívaným a výrobcem doporučeným barvivem je fluorescein (Flurescite® inj. sol 100 mg/ml) podávaný intravenózně v dávce 2,5–5 ml. Jeho výhodou je, že není toxický, rychle se distribuuje do tkání a dobře zobrazuje cévní struktury. Jiná speciální příprava pacienta není nutná. Samotné pCLE vyšetření je neinvazivní a nezvyšuje tak riziko již prováděné endoskopie či operace. Potenciálním rizikem je možná alergie na fluorescein. Většina zaznamenaných reakcí po intravenózním podání jsou však reakce méně závažného typu a zahrnují nauzeu, přechodnou hypotenzi, erytém v místě žilního vstupu či vyrážku. Bylo zaznamenáno i několik vzácných případů závažných reakcí ve smyslu anafylaxe, infarktu myokardu či šoku. Studie zaměřená na bezpečnost intravenózního užití fluoresceinu prováděná na 2 272 pacientech potvrdila výskyt středně závažné reakce u 1,4 % pacientů a nezaznamenala žádný případ závažné reakce [8]. Vedlejším efektem podání fluresceinu je žluté zbarvení sliznic a kůže, které odezní do 12 hod po aplikaci, a výrazně žluté zbarvení moči odeznívá do cca 36 hod [9].
Vlastní mikroskopické vyšetření je prováděno přiložením sondy na povrch vyšetřované tkáně. Dle typu sondy je snímán obraz průměru 240–325 μm s rozlišením 1–3,5 μm. Přehrávání obrazu probíhá okamžitě na připojeném monitoru. Zaznamenávat je možno celé vyšetření či pouze jeho požadované části, a to buď ve formě videa, či fotografií. Ty lze přímo vytisknout na připojené tiskárně či ukládat v digitální formě v běžně užívaných PAC systémech (picture archiving and communicating system – PACS), s kterými je přístroj plně kompatibilní.
Hodnocení získaného mikroskopického obrazu vyžaduje od vyšetřujícího lékaře nabytí postupných zkušeností s tímto zobrazením tkání a taktéž se standardními histologickými obrazy [10]. Možné je rovněž porovnání získaného mikroskopického obrazu s již vytvořenou databází jednotlivých patologií dostupnou jak v přístroji, tak on-line na www.cellvizio.net. Vzhledem k možnosti archivace v PACS lze výsledky hodnotit taktéž zpětně či lékařem jiné odbornosti – např. histopatologem.
Endoskopické zkušenosti s pCLE
Barretův jícen
Standardem při gastroskopickém vyšetření je používání endoskopu s kvalitním obrazem (high resolution endoscopy) a zobrazením pomocí bílého světla (white light endoscopy – WLE). Dále je využívána virtuální chromoendoskopie (VCE), např. NBI (narrow band imaging) od firmy Olympus či FICE (Fuji inteligent color enhancement) od firmy Fujifilm [11]. Při chromoendoskopii je obraz modifikován pomocí optického filtru nebo digitálního postprocessingu, s cílem objevení nativně neviditelných lézí či rozlišení benigní léze od neoplastické [12]. Při vyšetření Barretova jícnu je odebírána systematicky biopsie z postižené oblasti jícnu, a to vždy po 2 cm ze čtyř kvadrantů a cíleně z každé suspektní makroskopické abnormality [13,14]. Nevýhodou při odběru četných biopsií bývá krvácení, které ztěžuje přesný odběr dalších vzorků. Limitujícím faktorem pro stanovení diagnózy malignity je také nízký diagnostický výnos z celkového počtu odebraných biopsií, který se pohybuje kolem 6 % [15]. Multicentrická studie DONT BIOPCE z roku 2011 prokázala na souboru 101 pacientů, že rozpoznání intestinální metaplazie při kombinovaném vyšetření WLE a pCLE dosahuje senzitivity až 68 vs. 34 % při samotné WLE. Při použití WLE, pCLE a NBI je pak senzitivita až 76 % [16].
Pankreatické cysty
Za nejpřínosnější diagnostickou modalitu při diferenciální diagnostice cystických lézí pankreatu je v současné době považována endoskopická ultrasonografie (EUS) v kombinaci s tenkojehlovou biopsií (fine needle aspiration biopsy – FNAB) [17]. Přesnost samostatné EUS v diferenciální diagnostice mucinózních (maligních či potenciálně maligních) a non-mucinózních cyst pankreatu je přibližně 50 %, v kombinaci s FNAB pak až 80 % [18]. Vzhledem k rozměrům sondy AQ-Flex je možno její užití přes bioptickou jehlu velikosti 19 G (gauge). V literatuře je toto vyšetření označováno jako needle confocal laser endomicroscopy (nCLE). Prospektivními studiemi Contact, Inspect a Detect byla stanovena charakteristická kritéria pCLE obrazu některých cystických lézí pankreatu. Studie INSPECT z roku 2012 (65 pacientů) popsala typický obraz vilózních epiteliálních struktur charakteristický pro intraduktální papilární mucinózní neoplazii (IPMN) (obr. 2), vyšetření prokázalo vysokou specificitu – 100 %, limitem však byla nižší senzitivita – 59 % [19]. Studie CONTACT z roku 2014 na 31 pacientech stanovila charakteristický obraz serózního cystadenomu se zobrazenou povrchovou sítí vlásečnic, nevyskytující se u ostatních cystických lézí (obr. 3). Senzitivita vyšetření dosáhla 69 %, specificita pak byla 100 % [20]. Ve studii DETECT z roku 2015 (30 pacientů) bylo prováděno vyšetření cystických lézí pankreatu pomocí nCLE a EUS navigované cystoskopie – senzitivita při rozlišení maligních cyst byla u EUS – cystoskopie 90 %, u nCLE 80 %, kombinované vyšetření pak poskytovalo 100% senzitivitu [21].
Obr. 2. pCLE obraz – intraduktální papilární mucinózní neoplazie. 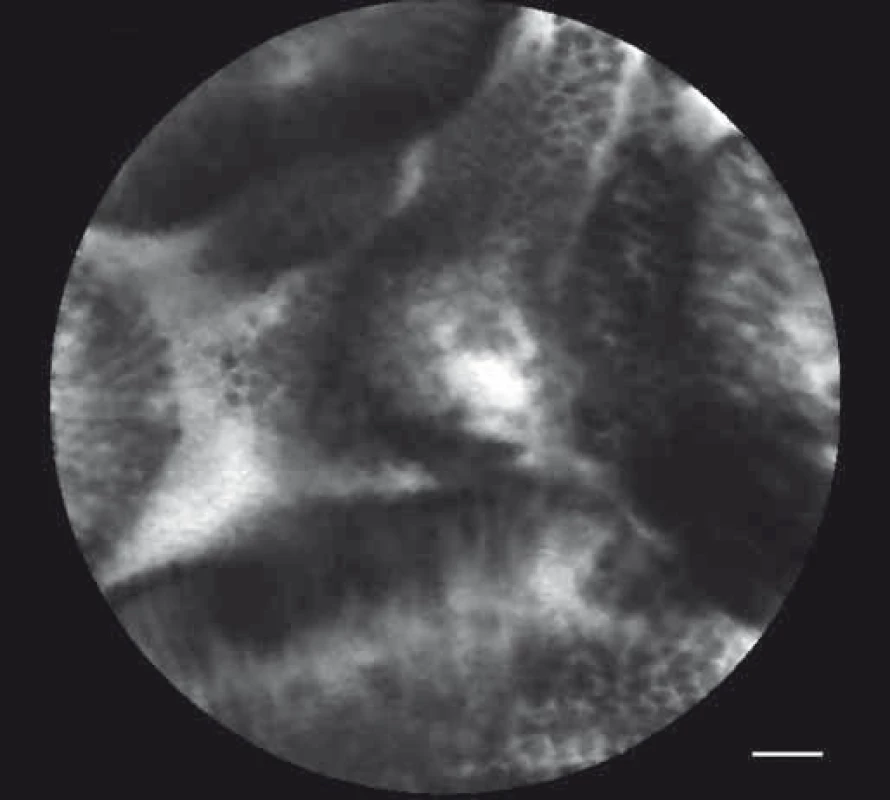
Obr. 3. pCLE obraz – serózní cystadenom, síť povrchových cév (červená šipka). 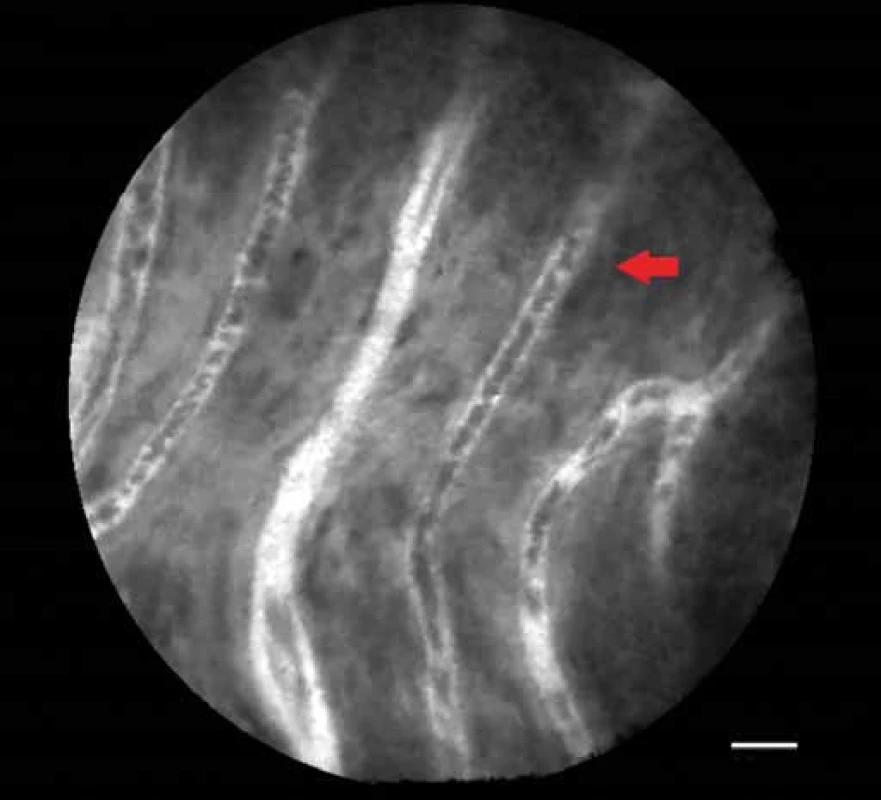
Stenózy žlučových cest
Pacienti s podezřením na maligní stenózu žlučových cest jsou standardně došetřováni pomocí endoskopické retrográdní cholangiopankreatikografie (ERCP) s odběrem cytologie (brushing) a biopsie z oblasti stenózy. Senzitivita cytologického vyšetření je nízká a pohybuje se v rozmezí 18–60 % [22,23]. V případě diagnostické nejistoty jsou třeba opakované ERCP s rebiopsií. Pokud tyto nejsou úspěšné a podezření na maligní stenózu na podkladě klinických a paraklinických vyšetření trvá, pacienti jsou indikováni k resekčnímu výkonu. U pacientů operovaných pro podezření na maligní stenózu je až v 15 % malignita definitivní histologií vyloučena [24]. V prvním případě jsou tedy pacienti zatíženi opakovaným invazivním endoskopickým vyšetřením a rizikem prodlení s možností generalizace nádorového onemocnění, ve druhém naopak riziky spojenými s často rozsáhlým operačním výkonem. Prospektivní multicentrická studie FOCUS z roku 2015 hodnotila, zda se změní senzitivita, specificita či přesnost v případě kombinace ERCP s biopsií a pCLE. Hodnoceno bylo 112 pacientů v šesti centrech. Porovnávány byly výsledky ERCP, ERCP + pCLE, ERCP + biopsie + pCLE. Senzitivita samostatné biopsie byla pouze 56 %, specificita 100 % a přesnost 72 %. V případě stanovení diagnózy na podkladě obrazu ERCP a pCLE byla pak senzitivita 89 %, specificita 71 % a přesnost 82 %. Použití pCLE tedy přispívá ke zpřesnění diferenciální diagnostiky biliárních stenóz, zvyšuje pravděpodobnost rozpoznání malignity [25].
Kolorektální karcinom, prekancerózy kolorekta
Standardním ošetřením prekanceróz a časných karcinomů oblasti kolorekta je endoskopická mukózní resekce (EMR), při které se drobnější léze do průměru 20 mm odstraňují en bloc, větší jsou resekovány po částech (piecemeal, tedy metodou označovanou EPMR). Léze podezřelé z povrchové submukózní invaze je možné odstranit endoskopickou submukózní disekcí (ESD) [26]. Předpokladem úspěšné EMR či ESD je predikce hloubky nádorové invaze. K tomuto účelu je využívána NICE (NBI International Colorectal Endoscopic) klasifikace [27]. Ta na základě NBI hodnotí barvu, strukturu cév a povrch neoplazie (obr. 4A, B). Následně je dle typu NICE klasifikace možné předurčit histologii dané léze [28].
Ačkoli cílem EMR je úplné odstranění patologické léze, reziduální nádorová tkáň se nachází až u 23 % pacientů [29]. Prospektivní studie z roku 2012 se zaměřila na využití pCLE při sledování reziduálního tumoru po endoskopické mukózní resekci. Do studie bylo zařazeno 92 pacientů, kteří podstoupili kontrolní kolonoskopické vyšetření po provedené EMR. Bylo vyšetřeno 129 jizev po EMR, přičemž reziduální neoplazie byla potvrzena ve 29 případech (22 %). Senzitivita pCLE v kombinaci s HRE-VCE (high resolution endoscopy with virtual chromoendoscopy) byla 100 vs. 72 % u samostatného HRE-VCE [30].
Obr. 4. Tubulovilozní adenom LGD v kolon sigmoideum, NICE typ 2. A – bílé světlo, B – NBI 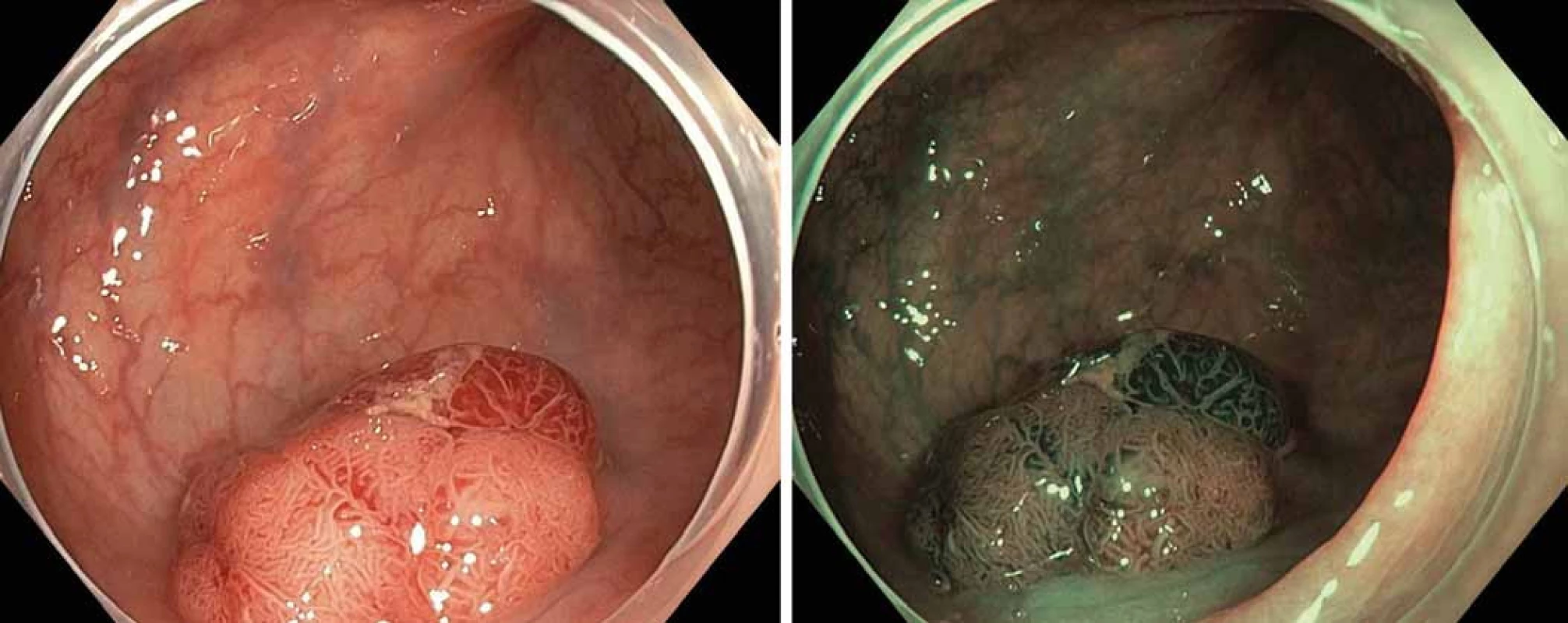
Chirurgické zkušenosti s pCLE
Neendoskopické peroperační vyšetření tkání pomocí endoskopu Pentax bylo z technického hlediska velmi obtížné až nereálné. Konstrukce sond mikroskopu Cellvizio však nově umožňuje jejich vcelku komfortní užití i bez endoskopu během operace. Je tak možno vyšetřit tkáně nedostupné endoskopem. Při nasycení tkání podaným fluoresceinem či topickém obarvení indocyaninovou zelení je taktéž možno provést ex vivo vyšetření na resekátu [31]. Chirurgové si teoreticky možný přínos pCLE v posledních letech uvědomili a hledají cestu k jeho využití. Nejvíce zkušeností je prozatím v oblasti mammární chirurgie [32,33], neurochirurgie [34,35] a chirurgie prostaty [36]. První zkušenosti jsou získávány i na českých pracovištích. Na chirurgickém pracovišti FN Brno je pCLE využívána v pankreatobiliární chirurgii. Již byly prezentovány retrospektivně hodnocené výsledky z pCLE vyšetření pacientů, kteří podstoupili resekční výkon na slinivce břišní pro tumor a byl stanoven charakteristický obraz patologicky změněné a zdravé tkáně pankreatu a žlučovodu (obr. 5, 6) [37].
Obr. 5. pCLE obrazy – zdravý choledochus (A, B), patologicky změněný choledochus (C, D). 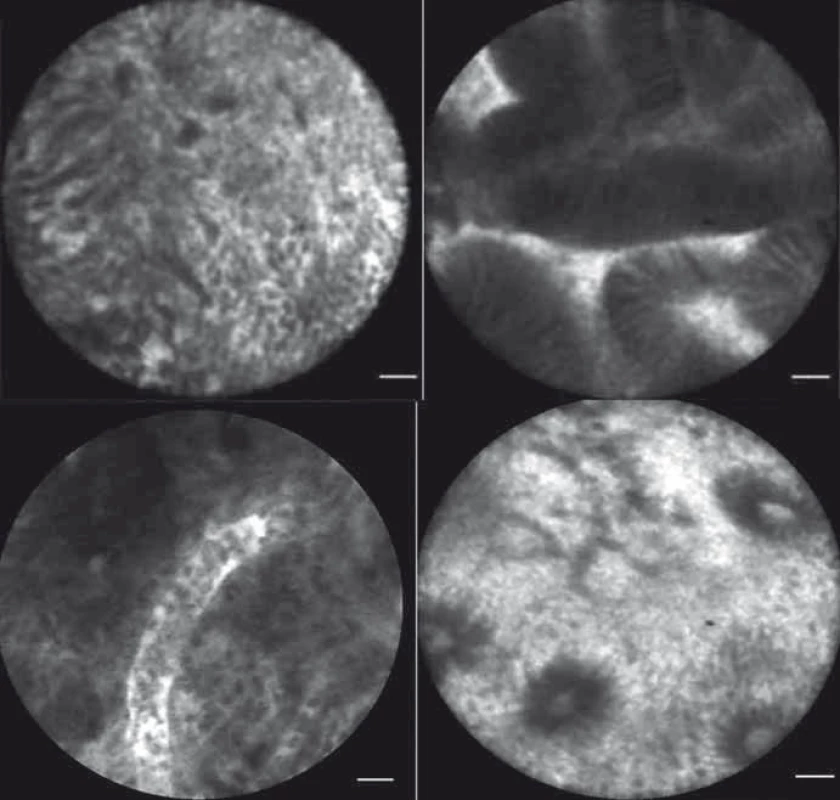
Obr. 6. pCLE obrazy – zdravý pankreas (A, B), patologicky změněný pankreas (C, D). 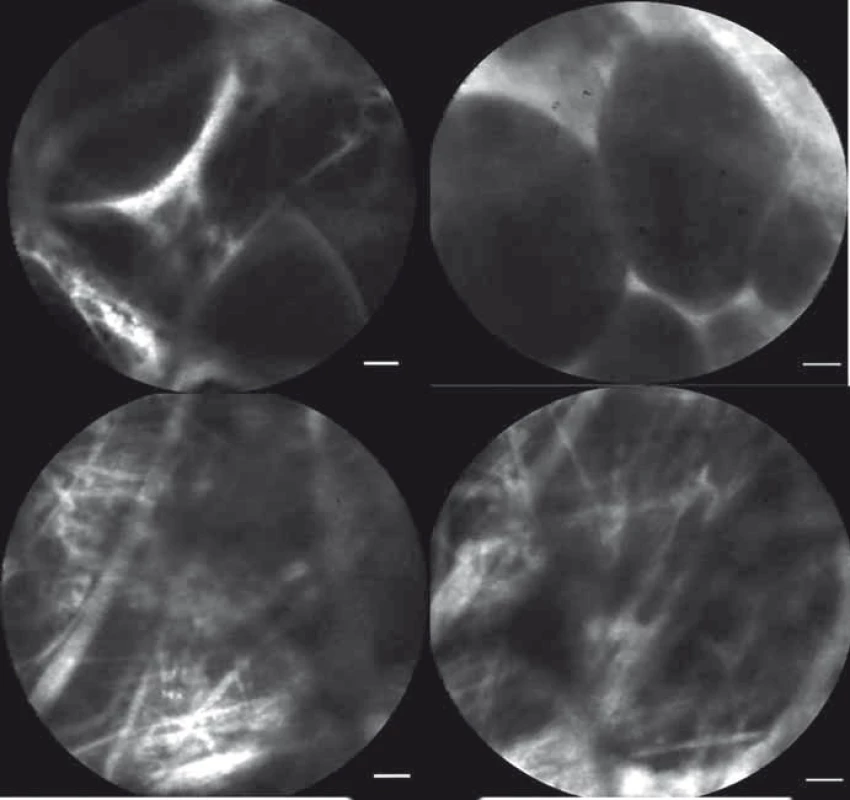
Závěr
Získání mikroskopického obrazu vyšetřované tkáně v reálném čase neinvazivním způsobem je cesta, která nabízí potenciální zrychlení diagnostiky prekanceróz či maligních onemocnění gastrointestinálního traktu, snížení počtu prováděných endoskopií a biop-sií, menší psychickou i fyzickou zátěž pacientů. Četné studie potvrdily přínos pCLE v oblasti endoskopické, a to především v kombinaci s již běžně užívanými vyšetřovacími modalitami. Slibným se zdá též využití peroperační neendoskopické. Taktéž naše zkušenosti s tímto přístrojem v oblasti pankreatobiliární chirurgie potvrzují, že jeho užitím lze získat validní informace o mikroskopické struktuře tkání. V podstatě okamžité rozlišení zdravé či patologické tkáně může doplnit běžně peroperačně odebíranou kryobiopsii a být tak dalším z vodítek pro indikaci či odmítnutí radikální chirurgické léčby.
Limitujícími faktory pCLE jsou nedostatečné rozšíření v klinické praxi, cena přístroje a používaných sond, subjektivní složka při hodnocení mikroskopického obrazu endoskopistou či chirurgem. I přes tyto faktory celkový počet užívaných přístrojů i prováděných pCLE vyšetření postupně narůstá, zdá se tedy, že přínos pCLE převažuje nad těmito dílčími nevýhodami. Příslibem k jeho dalšímu rozšíření jsou navíc nové směry užití pCLE a nové možnosti zpracování získaných mikroskopických obrazů pomocí výpočetní techniky.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Lumír Kunovský
Chirurgická klinika
LF MU a FN Brno
Jihlavská 20625 00 Brno
e-mail: Kunovsky.Lumir@fnbrno.cz
Obdrženo: 9. 2. 2017
Přijato: 26. 2. 2017
Zdroje
1. Minsky M. Memoir on inventing the confocal scanning microscope. Scanning 1988; 10 (4): 128–138. doi: 10.1002/sca.4950100403.
2. Petráň M, Hadravský M, Boyde A. The tandem scanning reflected light microscope. Scanning 1985; 7 (2): 97–108. doi: 10.1002/sca.4950070205.
3. Petráň M, Hadravský M, Beneš J et al. In Vivo Microscopy Using the Tandem Scanning Microscope. Annals of the New York Academy of Sciences 1986; 483 (1): 440–447. doi: 10.1111/j.1749-6632.1986.tb34554.x.
4. Fellers T, Davidson M (eds). Introduction to Confocal Microscopy [online]. Olympus Microscopy Resource Center | Confocal Microscopy – Introduction [cited 2017 Jan 9]. Available from: http://www.olympusmicro.com/primer/techniques/confocal/confocalintro.html.
5. Paddock SW. Principles and practices of laser scanning confocal microscopy. Mol Biotechnol 2000; 16 (2): 127–149. doi: 10.1385/MB: 16 : 2: 127.
6. Lagali N (ed.). Confocal Laser Microscopy – Principles and Applications in Medicine, Biology, and the Food Sciences [online]. Rijeka: InTech; 2013 [cited 2016 Nov 8]. Available from: http: //www.intechopen.com/books/confocal-laser-microscopy-principles-and-applications-in-medicine-biology-and-the-food-sciences/confocal-endomicroscopy.
7. Chauhan S, Dayyeh B, Bhat YM et al. Confocal laser endomicroscopy. Gastrointest Endosc 2014; 80 (6): 928–938. doi: 10.1016/j.gie.2014.06.021.
8. Wallace MB, Meining A, Canto MI et al. The safety of intravenous fluorescein for confocal laser endomicroscopy in the gastrointestinal tract. Aliment Pharm Therap 2010; 31 (5): 548–552. doi: 10.1111/j.1365-2036.2009.04207.x.
9. Černoch J (ed.). Prekancerózy v trávicím traktu. 1. vyd. Praha: Grada 2012.
10. Buchner AM, Gomez V, Heckman MG et al. The learning curve of in vivo probe-based confocal laser endomicroscopy for prediction of colorectal neoplasia. Gastrointest Endosc 2011; 73 (3): 556–560. doi: 10.1016/j.gie.2011.01.002.
11. Martínek J, Zavoral M. Barrettův jícen – jak sledovat a jak léčit. Postgrad Med 2009; 11 (6): 674–682.
12. Neumann H, Fujishiro M, Wilcox CM et al. Present and future perspectives of virtual chromoendoscopy with i-scan and optical enhancement technology. Dig Endosc 2014; 26 (Suppl 1): 43–51. doi: 10.1111/den.12190.
13. Sharma P, Mcquaid K, Dent J et al. A critical review of the diagnosis and management of Barrett’s esophagus: the AGA Chicago Workshop. Gastroenterology 2004; 127 (1): 310–330. doi: 10.1053/j.gastro.2004.04.010.
14. Spechler SJ, Sharma P, Souza RF et al. American Gastroenterological Association technical review on the management of Barrett’s esophagus. Gastroenterology 2011; 140 (3): 18–52. doi: 10.1053/j.gastro.2011.01.031.
15. Canto MI, Anandasabapathy S, Brugge W et al. In vivo endomicroscopy improves detection of Barrett’s esophagus-related neoplasia: a multicenter international randomized controlled trial (with video). Gastrointest Endosc 2014; 79 (2): 211–221. doi: 10.1016/j.gie.2013.09.020.
16. Sharma P, Meining AR, Coron E et al. Real-time increased detection of neoplastic tissue in Barrett’s esophagus with probe-based confocal laser endomicroscopy: final results of an international multicenter, prospective, randomized, controlled trial. Gastrointest Endosc 2011; 74 (3): 465–472. doi: 10.1016/j.gie.2011.04.004.
17. Rejchrt S. Diagnostika cystických tumorů pankreatu [online]. [citováno 9. ledna 2017]. Dostupné z: http://www.hpb.cz/index.php?pId=07-1-10.
18. Brugge WR, Lewandrowski K, Lee-Lewandrowski E et al. Diagnosis of pancreatic cystic neoplasms: a report of the cooperative pancreatic cyst study. Gastroenterology 2004; 126 (5): 1330–1336. doi: 10.1053/j.gastro.2004.02.013.
19. Konda VJ, Meining A, Jamil LH et al. Mo1204 An International, Multi-Center Trial on Needle-Based Confocal Laser Endomicroscopy (nCLE): Results From the In Vivo CLE Study in the Pancreas With Endosonography of Cystic Tumors (INSPECT). Gastroenterology 2012; 142 (5 Suppl 1): S620–S621. doi: 10.1016/S0016-5085 (12) 62384-1.
20. Napoléon B, Lemaistre AI, Pujol B et al. A novel approach to the diagnosis of pancreatic serous cystadenoma: needle-based confocal laser endomicroscopy. Endoscopy 2015; 47 (1): 26–32. doi: 10.1055/s-0034-1390693.
21. Nakai Y, Iwashita T, Park DH et al. Diagnosis of pancreatic cysts: EUS-guided, through-the-needle confocal laser-induced endomicroscopy and cystoscopy trial: DETECT study. Gastrointest Endosc 2015; 81 (5): 1204–1214. doi: 10.1016/j.gie.2014.10.025.
22. Fogel EL, Debellis M, Mchenry L et al. Effectiveness of a new long cytology brush in the evaluation of malignant biliary obstruction: a prospective study. Gastrointest Endosc 2006; 63 (1): 71–77. doi: 10.1016/j.gie.2005.08.039.
23. De Bellis M, Sherman S, Fogel EL et al. Tissue sampling at ERCP in suspected malignant biliary strictures (Part 1). Gastrointest Endosc 2002; 56 (4): 552–561. doi: 10.1016/S0016-5107 (02) 70442-2.
24. Gerhards MF, Vos P, van Gulik TM et al. Incidence of benign lesions in patients resected for suspicious hilar obstruction. Br J Surg 2001; 88 (1): 48–51. doi: 10.1046/j. 1365-2168.2001.01607.x.
25. Slivka A, Gan I, Jamidar P et al. Validation of the diag-nostic accuracy of probe-based confocal laser endomicroscopy for the characterization of indeterminate biliary strictures: results of a prospective multicenter international study. Gastrointest Endosc 2015; 81 (2): 282–290. doi: 10.1016/j.gie.2014.10.009.
26. Tanaka S, Oka S, Chayama K. Colorectal endoscopic submucosal dissection: present status and future perspective, including its differentiation from endoscopic mucosal resection. J Gastroenterol 2008; 43 (9): 641–651. doi: 10.1007/s00535-008-2223-4.
27. Tanaka S, Sano Y. Aim to unify the narrow band imaging (NBI) magnifying classification for colorectal tumors: current status in Japan from a summary of the consensus symposium in the 79th annual meeting of the Japan gastroenterological endoscopy society: NBI magnification for colorectal tumor. Dig Endosc 2011; 23 (Suppl 1): 131–139. doi: 10.1111/j.1443-1661.2011.01106.x.
28. Hewett DG, Kaltenbach T, Sano Y et al. Validation of a simple classification system for endoscopic diagnosis of small colorectal polyps using narrow-band imaging. Gastroenterology 2012; 143 (3): 599–607. doi: 10.1053/j.gastro.2012.05.006.
29. Khashab M, Eid E, Rusche M et al. Incidence and predictors of “late” recurrences after endoscopic piecemeal resection of large sessile adenomas. Gastrointest Endosc 2009; 70 (2): 344–349. doi: 10.1016/j.gie.2008.10. 037.
30. Shahid MW, Buchner AM, Coron E et al. Diagnostic accuracy of probe-based confocal laser endomicroscopy in detecting residual colorectal neoplasia after EMR: a prospective study. Gastrointest Endosc 2012; 75 (3): 525–533. doi: 10.1016/j.gie.2011.08.024.
31. Pierangelo A, Fuks D, Benali A et al. Diagnostic accuracy of confocal laser endomicroscopy for the ex vivo characterization of peritoneal nodules during laparoscopic surgery. Surg Endosc 2017; 31 (4): 1974. doi: 10.1007/s00464-016-5172-7.
32. Chang TP, Leff DR, Shousha S et al. Imaging breast cancer morphology using probe-based confocal laser endomicroscopy: towards a real-time intraoperative imaging tool for cavity scanning. Breast Cancer Res Treat 2015; 153 (2): 299–310. doi: 10.1007/s10549-015-3543-8.
33. De Palma GD, Esposito D, Luglio G et al. Confocal laser endomicroscopy in breast surgery: a pilot study. BMC Cancer 2015; 15 : 252. doi: 10.1186/s12885-015-1245-6.
34. Charalampaki P, Javed M, Daali S et al. Confocal laser endomicroscopy for real-time histomorphological diagnosis: our clinical experience with 150 brain and spinal tumor cases. Neurosurgery 2015; 62 (Suppl 1): 171–176. doi: 10.1227/NEU.0000000000000805.
35. Mooney MA, Zehri AH, Georges JF et al. Laser scanning confocal endomicroscopy in the neurosurgical operating room: a review and discussion of future applications. Neurosurg Focus 2014; 36 (2): E9. doi: 10.3171/2013.11.FOCUS13484.
36. Lopez A, Zlatev DV, Mach KE et al. Intraoperative optical biopsy during robotic assisted radical prostatectomy using confocal endomicroscopy. J Urol 2016; 195 (4): 1110–1117. doi: 10.1016/j.juro.2015.10.182.
37. Moravčík P, Hlavsa J. Konfokální mikroskopie při operacích karcinomu pankreatu. Sborník abstrakt XL. brněnských onkologických dnů a XXX. konference pro nelékařské zdravotnické pracovníky. Klin Onkol 2016; 29 (Suppl 2): 2S91.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článek Soutěž o nejlepší práci
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2017 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Zasedání Organizace evropských onkologických ústavů v Brně
- Soutěž o nejlepší práci
- Nové poznatky o patogenezi folikulárního lymfomu a koncepty cílené léčby
- Konfokální laserová mikroskopie v diagnostice onkologických onemocnění gastrointestinálního traktu
- Radionekróza horní krční míchy po protonovém ozáření u nemocné po radikální resekci ependymomu IV. komory mozkové
- Metastatické postižení hypofýzy
- Informace z České onkologické společnosti
- Hyperfrakcionovaná akcelerovaná radioterapie s modulovanou intenzitou u pokročilých nádorů hlavy a krku – prediktivní faktory celkového přežití
- Sekvence docetaxel–kabazitaxel–enzalutamid ve srovnání se sekvencí docetaxel–enzalutamid u pacientů s metastatickým kastračně rezistentním karcinomem prostaty
- Reaktivní lymfoidní hyperplazie jater
- Nádor hrudnej steny ako zriedkavý klinický prejav metastázy hepatocelulárneho karcinómu
- Radioterapie nádorů s plicní lokalizací u idiopatické plicní fibrózy
- Exprese antigenu CD20 na povrchu buňky maligního B lymfomu
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Metastatické postižení hypofýzy
- Reaktivní lymfoidní hyperplazie jater
- Radioterapie nádorů s plicní lokalizací u idiopatické plicní fibrózy
- Radionekróza horní krční míchy po protonovém ozáření u nemocné po radikální resekci ependymomu IV. komory mozkové
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy