-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Trastuzumab v neoadjuvantní léčbě HER2+ karcinomu prsu – 5leté zkušenosti z onkologické kliniky 1. LF UK a VFNTrastuzumab v neoadjuvantní léčbě HER2+ karcinomu prsu – 5leté zkušenosti z onkologické kliniky 1. LF UK a VFN
Use of Trastuzumab for Neoadjuvant Therapy of HER2+ Breast Cancer – 5-Years of Experience in a Single Clinic
Background:
Trastuzumab (Herceptin® – H) has been the standard-of-care for patients with HER2+ breast cancer (BC) since 2009 in the Czech Republic. Neoadjuvant application of H increases the number of patients who achieve pathological complete remission (pCR) and improves patients’ outcomes. Aim: This study aimed to assess the effect of neoadjuvant therapy (NAT) with H in patients with early HER2+ BC and to correlate the therapeutic outcome with overall survival (OS). We defined pCR as no invasive carcinoma (ypT0) or in situ residual carcinoma (ypTis) in breast tissue and no invasive carcinoma in axillary lymphatic nodes (ypN0). To correlate pCR with the hormone dependency of BC, we compared the number of patients who achieved pCR between those with hormone-dependent (estrogen receptor (ER) +) BC and those with hormone-negative (ER–) BC.Results:
We evaluated data from 148 patients with HER2+ BC, most of whom were at stage II. Of these, 50.7% were premenopausal women and 45.9% had ER – BC. Most patients were treated with anthracyclines followed by taxanes and H. pCR was reported in 50% of patients (74/148). ER+ BC regressed more often to ypTis stage (24/35), ER – BC to ypT0ypN0 stage (26/39). The 1-year OS rate of patients who achieved pCR was significantly higher than that of patients who did not (100.0% vs. 95.3%, p = 0.009). Median OS was not achieved in pCR patients group.Conclusion:
Patients who achieved pCR had a better prognosis than patients who did not.Key words:
neoadjuvant therapy – trastuzumab – early breast cancer – pathological complete remission – prognosisThe authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Submitted: 14. 9. 2017
Accepted: 15. 2. 2018
Autori: Bielčiková Zuazana 1; Petruželka Luboš 1; Chloupková Renata 2
Pôsobisko autorov: Onkologická klinika 1. LF UK a VFN v Praze 1; Institut biostatistiky a analýz, LF MU, Brno 2
Vyšlo v časopise: Klin Onkol 2018; 31(3): 191-199
Kategória: Původní práce
doi: https://doi.org/10.14735/amko2018191Súhrn
Úvod:
Trastuzumab (Herceptin® – H) je v České republice léčebným standardem HER2 dependentního (HER2+) karcinomu prsu (breast cancer – BC) od roku 2009. Neoadjuvantní aplikace H pomáhá zvýšit počet patologických kompletních remisí (pathologic complete remission – pCR) a má tak vliv na prognózu nemocných. Cíl: Cílem naší práce bylo zhodnocení efektu neoadjuvantní terapie (NAT) s H u pacientek s časným HER2+ BC a korelace léčebného výsledku s přežíváním (overall survival – OS) nemocných. pCR jsme definovali jako absenci invazivního karcinomu v tkáni prsní žlázy (ypT0) při možné přítomnosti reziduální nemoci ve formě neinvazivního karcinomu (ypTis) a absenci nádorových buněk v axilárních lymfatických uzlinách (ypN0). Počet pCR jsme korelovali s hormonální dependencí nádoru, srovnali jsme počet dosažených pCR u nemocných s hormonálně pozitivním (estrogenní receptor – ER+) a hormonálně negativním (ER–) onemocněním.Výsledky:
Do hodnocení bylo zapojeno 148 žen s HER2+ BC, predominantně ve stadiu II. Celkem 50,7 % z nich bylo v době diagnózy premenopauzálních, 45,9 % mělo ER – onemocnění. Většina pacientek byla léčena sekvenčně antracyklinem a poté taxanem a H. pCR byla zaznamenána u 50 % nemocných (74/148), ER+ nádory regredovaly častěji do stadia ypTis (24/35), ER – nádory do stadia ypT0ypN0 (26/39). OS 1 rok u pacientek, které dosáhly pCR, bylo signifikantně lepší ve srovnání se skupinou pacientek, které na NAT nezareagovaly (100,0 vs. 95,3 %; p = 0,009), medián OS nebyl u pacientek s pCR dosažen.Závěr:
Pacientky, které dosáhly pCR, měly lepší prognózu ve srovnání se ženami, u kterých pCR nebylo dosaženo.Klíčová slova:
neoadjuvantní terapie – trastuzumab – časný karcinom prsu – patologická kompletní remise – prognózaÚvod
HER2+ karcinom prsu (breast cancer – BC) patří mezi prognosticky méně příznivé varianty BC [1]. Chování nádoru ovlivněného amplifikací HER2 je příčinou poměrně častého postižení spádového lymfatického systému a pokročilosti primární nemoci. Terapie časného nebo lokálně pokročilého HER2+ BC je proto často směřována k primární systémové terapii. Cílem neoadjuvantní terapie (NAT) je časný zásah do procesu nádorové diseminace a/nebo zmenšení objemu primární nemoci [2–4] a její efekt je posuzován velikostí reziduální nemoci.
Vztah patologické kompletní remise (pathologic complete remission – pCR) a prognózy pacientů léčených NAT byl sledován jak u BC, tak u jiných diagnóz [5,6]. Základním předpokladem pro vyhodnocení prognostického významu pCR bylo zakotvení jednotné definice při různorodosti patologického hodnocení reziduální nemoci [7–8]. pCR koreluje s průběhem zejména triple negativního (TN) a HER2+ BC [9–11], u kterých dosahuje zároveň nejvyšší četnosti.
Ve studii TECHNO (Taxol Epirubicin Cyclophosphamid Herceptin Neoadjuvant) byla pCR jediným prognostickým faktorem [12]. Ženy léčené kombinovanou chemoterapií a trastuzumabem (Herceptinem® – H) měly v případě dosažení pCR lepší prognózu a 3leté celkové přežívání (overall survival – OS) 96,3 % ve srovnání s pacientkami, které pCR nedosáhly (3leté OS 85,0 %). pCR byla zaznamenána u 38,7 % žen, její definice zahrnovala ypT0/ypTisypN0 nálezy. Klinické studie s H v neoadjuvantní indikaci a pCR jako primárním cílem potvrdily efekt cílené terapie ve smyslu zvýšení podílu pCR ve srovnání s chemoterapií samotnou [13–20]. V metaanalýze studií s H bylo dosaženo dvojnásobné četnosti pCR u pacientek léčených chemoterapií a H oproti režimům bez anti-HER2 léčby [21]. Jedním z předpokládaných mechanizmů efektivity H je jeho působení nejen na progenitorové buňky, ale také na kmenové buňky [22–23], a tedy zásah přímo do kancerogeneze nemoci.
Další zvýšení počtu pCR přinesla duální anti-HER2 blokáda kombinovaná se systémovou chemoterapií. Ve studii NeoALTTO (Neoadjuvant Lapatinib and/or Trastuzumab Treatment Optimisation) [24] počet pCR při léčbě H a Lapatinibem překonal hranici 50 %, ve studii NeoSphere (A Study of Pertuzumab in Combination With Herceptin in Patients With HER2 Positive Breast Cancer) [25] u pacientek s hormonálně negativním karcinomem (s negativními estrogenovými receptory (ER–) hranici 60 %, ve studii Tryphaena [26] počet pCR dosáhl 57–66 %. Ve všech studiích měla skupina pacientek, která na NAT reagovala dosažením pCR, lepší prognózu ve srovnání se skupinou žen s reziduální nemocí po ukončení NAT. V metaanalýze 36 studií s anti-HER2 léčbou byl poměr rizik (hazard ratio – HR) pro přežití bez události (event-free survival – EFS) pro pacienty s dosaženou pCR vs. non-pCR 0,29 pro ER – a 0,52 pro ER+ skupinu [27].
Bezpečnost H byla hodnocena v mnoha studiích. Vyšší podíl očekávané kardiotoxicity byl zaznamenán při konkomitantním podání H a antracyklinů [28–29]. Kardiální rizikové faktory jako hypertenze či diabetes zůstávají ve vztahu k H podmíněnému riziku kardiotoxicity v ne zcela jasném vztahu. Dle Seidemana et al [30] byl v multifaktoriálním hodnocení potenciálních rizikových faktorů (věk, hypertenze, radioterapie hrudní stěny, pokles ejekční frakce levé komory srdeční (EF LK), kumulativní dávka antracyklinů) vyhodnocen pouze věk jako signifikantně pozitivně asociovaný s rizikem kardiální toxicity H. V jiné studii [31] se toto pozorování nepotvrdilo, jako rizikový faktor pro vznik kardiotoxicity se prokázal pokles EF LK. Podle studie NSABP-B31 [32] jsou třemi základními rizikovými faktory pro kardiotoxicitu asociovanou s H věk, pokles EF LK a antihypertenzní komedikace. Režimy bez antracyklinů vč. dvoukombinace anti-HER2 léčiv jsou stran kardiotoxicity bezpečnou modalitou léčby. Ve studii NSABP-B31 byla při sledování až 7 let zaznamenána kardiální událost u 4 % pacientek léčených H ve srovnání s 1,3 % pacientek léčených chemoterapií bez H [32]. Symptomatické kardiální postižení bylo ve studii NOAH zaznamenáno při 3letém sledování u 2 % pacientek léčených H [29].
V níže uvedeném souboru popisujeme pacientky s časným HER2+ BC léčené neoadjuvantně systémovou chemoterapií a H na Onkologické klinice 1. LF UK a VFN v Praze v letech 2009–2016. Cílem práce je zejména zhodnocení léčebných výsledků měřených počtem dosažených pCR a přežíváním nemocných v odstupu 1, 3 a 5 let po ukončení NAT.
Soubor pacientů
Do studie bylo zařazeno 148 žen s mediánem věku 51 let. Věková distribuce pacientek je znázorněna na grafu 1, mladé ženy do 40 let tvořily 30,5 % hodnocené skupiny. Pacientky do 35 let tvořily 12,9 %, 50,7 % pacientek bylo premenopauzálních (tab. 1). Většina nemocných byla léčena pro BC stadia II (64,2 %) a III (28,4 %) (tab. 1).
Graf 1. Věk pacientek v době zahájení neoadjuvantní léčby Herceptinem. 
Tab. 1. Charakteristiky pacientek. 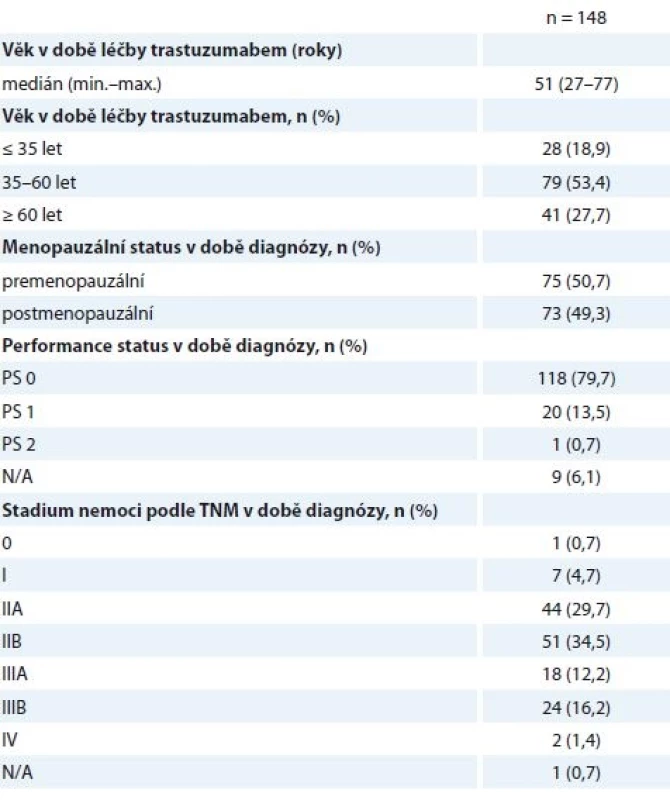
N/A – neuvedeno v registru Histologické parametry jsou specifikovány níže (tab. 2) – v 87,2 % se jednalo o invazivní duktální karcinom (invasive ductal carcinoma – IDC), v 62,8 % o nádor s nízkou diferenciací (G3), 53,4 % nádorů bylo ER+ (95/148 nádorů vykazovalo pozitivitu estrogenového a/nebo progesteronového receptoru), pouze jedna pacientka měla HER2 (receptor pro epidermální růstový faktor typu 2) negativní onemocnění podle definitivní histologie, na podkladě HER2+ bioptického nálezu byla ale neoadjuvantně léčena H (tab. 2). Vysoké procento neznámého proliferačního stavu nádoru (Ki67) přisuzujeme nedostatečnému přepisu těchto dat do registru, ačkoli je toto vyšetření standardní součástí histologického záznamu.
Tab. 2. Histologické nálezy z předoperační biopsie. 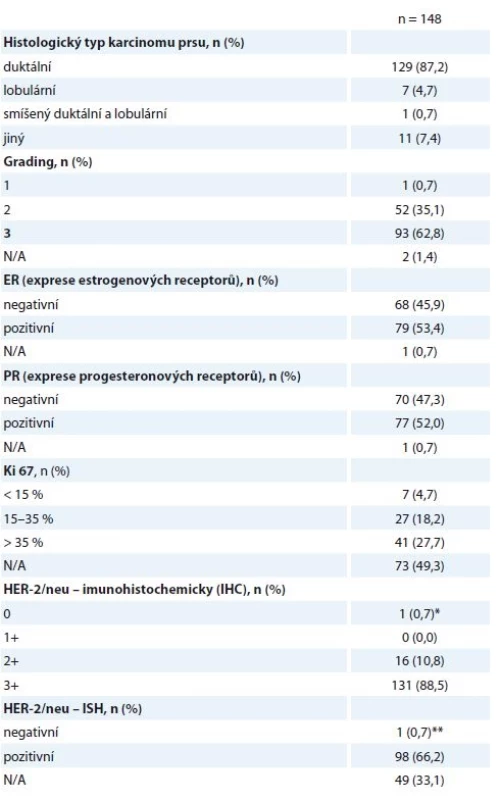
N/A – v registru neuvedeno, * ISH pozitivní, ** IHC2+, léčena H neoadjuvantně, adjuvantně léčba Herceptinem ukončena (v pooperační histologii nádor HER2 negativní) Hodnocené pacientky byly neoadjuvantně léčeny nejčastěji sekvencí antracyklinů a taxanů v kombinaci s H. Standardně používanými režimy na naší klinice jsou – z antracyklinů 4 × AC (doxorubicin 60 mg/m2 + cyklofosfamid 600 mg/m2 à 21 dnů) nebo 3 × FEC 100 (fluorouracil 500 mg/m2 + epirubicin 100 mg/m2 + cyklofosfamid 500 mg/m2 à 21 dnů), z taxanů 9–12 × T (paklitaxel 80 mg/m2 týdně) nebo 3–4 × D (docetaxel 100 mg/m2 à 21 dnů podávaný s růstovým faktorem G-CSF), H byl podán venózně v dávce 2 mg/kg týdně nebo 6 mg/kg à 21 dnů (nasycovací dávky 4, resp. 8 mg/kg) nebo subkutánně v jednotné dávce 600 mg à 21 dnů. Celkem 140/148 žen řádně NAT ukončilo, další důvody ukončení léčby jsou uvedeny v tabulce (tab. 3). Obvykle ultrazvukové přešetření prsu a spádových lymfatik podstupují pacientky na našem pracovišti minimálně 2×, první zpravidla po 2–4 cyklech antracyklinů (tato data do registru zavedena nebyla).
Tab. 3. Charakteristiky neoadjuvantní léčby. 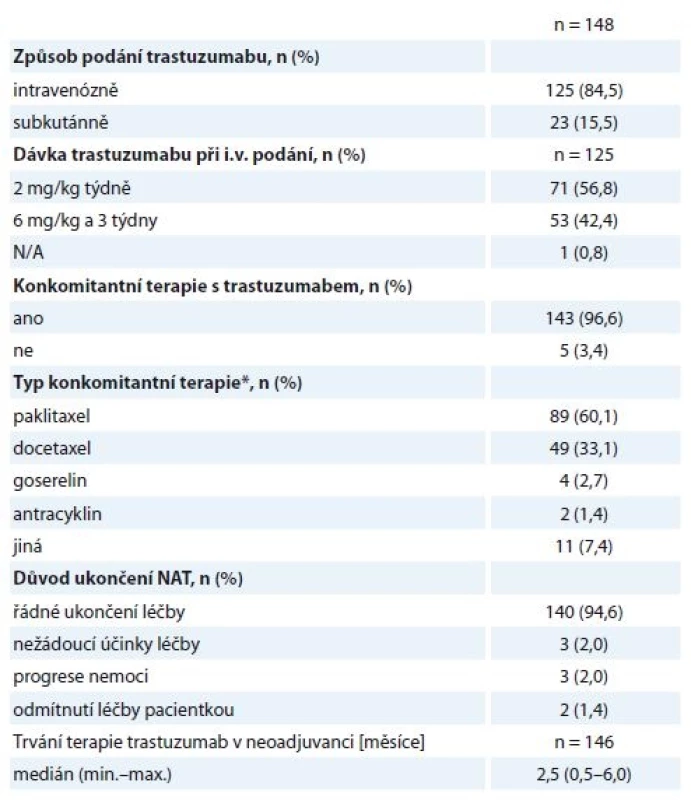
N/A neuvedeno v registru, NAT – neoadjuvantni terapie * může byt použito vice modalit lečby, např. chemoterapie a hormonalni terapie Metodika
Zdrojem dat byl registr BREAST, z kterého byly extrahovány údaje o nemocných léčených na našem pracovišti v letech 2009–2016. Pacientky ukončily terapii před 10. říjnem 2016. Cílem analýzy bylo zhodnocení efektu NAT a H a stanovení počtu dosažených pCR. pCR jsme definovali jako absenci invazivního karcinomu v tkáni prsní žlázy (ypT0) při možné přítomnosti reziduální nemoci ve formě neinvazivního karcinomu (ypTis) a absenci nádorových buněk v axilárních lymfatických uzlinách (ypN0). Počet pCR jsme korelovali s hormonální dependencí nádoru, srovnali jsme tedy počet dosažených pCR u nemocných s ER+ a ER – onemocněním. Dalším cílem byla analýza OS pacientek a korelace léčebného výsledku (pCR) s OS. OS bylo definováno jako čas od zahájení léčby H v neoadjuvanci do smrti pacientky. Čas bez známek nemoci (disease-free survival – DFS) definovaný jako období od zahájení léčby H v neoadjuvanci do recidivy nemoci nebo úmrtí byl sekundárním cílem hodnocení. V případě, že k sledované události nedošlo, byla pacientka cenzorována k datu poslední aktualizace záznamu v registru. Cílem sledování bylo také zhodnocení výskytu nežádoucích účinků léčby (NÚ).
Pro popis souboru pacientů byly využity základní statistické metody – absolutní četnosti, procentuální vyjádření a medián pro spojité proměnné. Analýza přežití byla vypočítána pomocí metodiky Kaplana-Meiera. Pro srovnání OS a DFS v podskupinách byl použit log-rank test. Všechny statistické testy byly kalkulovány na hladině významnosti α = 0,05.
Výsledky
Klinický benefit léčby (stabilizace nemoci nebo regrese nemoci) byl zaznamenán u 98,6 % pacientek, hodnocení bylo provedeno na základě radiologického vyšetření před plánováním chirurgického výkonu. Pouze 2 pacientky progredovaly, 143/148 žen podstoupilo po ukončení NAT operaci, 93/143 (65,0 %) ablaci, 48/143 (33,6 %) prs záchovný výkon. Typ výkonu na axile byl v registru specifikován pouze u 41,3 % žen, při suspekci na postižení spádových lymfatik dle vstupního radiologického vyšetření ale standardně indikujeme exenteraci axily. V opačném případě (klinicky N0) provádíme mapování sentinelové uzliny (sentinel lymph node – SLN) a k exenteraci axily přistupujeme až v druhé době při pozitivitě SLN potvrzené histologickým vyšetřením.
pCR jsme zaznamenali u 50,0 % žen (74/148), v 26,4 % (39/148) se jednalo o histologický nález ypT0ypN0, v 23,6 % (35/148) o nález ypTisypN0. Detaily pooperačních histologických nálezů jsou uvedeny v tab. 4. Srovnání stavu ER/progesteronového receptoru (PR) bylo provedeno u nálezů, které nebyly hodnoceny jako pCR (74/148). Pooperačně došlo k poklesu exprese ER/PR, za klinicky relevantní jsme považovali expresi ER/PR > 10 % nádorových buněk. Efekt NAT byl zaznamenán v poklesu proliferační aktivity nádoru (Ki67) a špatné diferenciace nádoru. Vyšší podíl nezhodnocených nálezů (N/A) je dán limity vyšetření reziduální nemoci, s kterými se v praxi běžně setkáváme.
Tab. 4. Pooperační histologické nálezy. 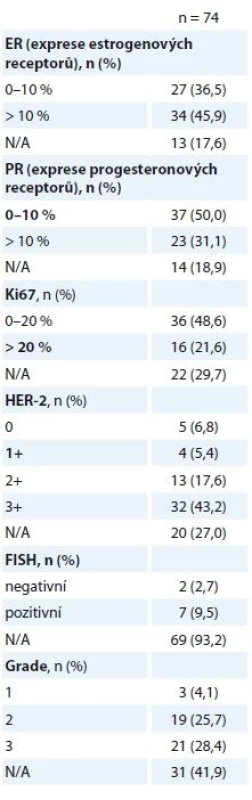
N/A – neuvedeno v registru pCR bylo v 50 % (37/74) dosaženo u nádorů ER+ a v 50 % u ER – podle imunohistochemického hodnocení ze vstupní biopsie. Po odlišení ypT0 a ypTis nálezů byla zjištěna vyšší míra odpovědi (ypT0) u nádorů ER–, naopak ER+ nádory zůstaly častěji reziduální nemocí (ypTis) – 24/35 (69 %) ER+ a 11/35 (31 %) ER – nádorů bylo po léčbě hodnoceno jako ypTis, naopak 13/39 (33 %) ER+ a 26/39 (67 %) ER – nádorů bylo po léčbě kompletně vyléčeno (ypT0). Celkový počet pCR mezi léčenými pacientkami (n = 148) dosáhl 23,6 a 26,4 % při hodnocení ypTis a ypT0ypN0 (graf 2).
Graf 2. Podíl pCR u ER pozitivních a ER negativních nádorů. 
ER+/– hormonálně pozitivní/negativní onemocnění Celkem 137/148 pacientek pokračovalo po ukončení NAT adjuvantní systémovou terapií – 131/137 pacientek pokračovalo v terapii H, 71/137 pacientek bylo léčeno hormonální léčbou, 1 pa-cientka chemoterapií. Celkem 3 pacientky, u kterých byla zaznamenána progrese, byly dále léčeny paliativně. NÚ H v rámci NAT byly v registru zaznamenány pouze u 5 nemocných, v 1 případě se jednalo o výskyt kardiotoxicity, v 1 případě o výskyt plicní toxicity a ve 3 případech o kožní toxicitu NAT (není vyloučeno, že se jednalo o přetrvávající NÚ taxanů).
K datu poslední aktualizace záznamů bylo v hodnocené skupině žen evidováno pouze 10 úmrtí. Medián OS ani medián DFS nebyl dosažen. Po době sledování 12 měsíců (1leté OS, 95% CI) přežívalo 97,6 % (94,9–99,9) žen, po 3 letech (3leté OS, 95% CI) 90,2 % (83,4–96,9) a po 5 letech (5leté OS, 95% CI) 87,8 % (79,9–95,8) pacientek (tab. 5).
Tab. 5. Přežívání u pCR a non-pCR skupiny nemocných 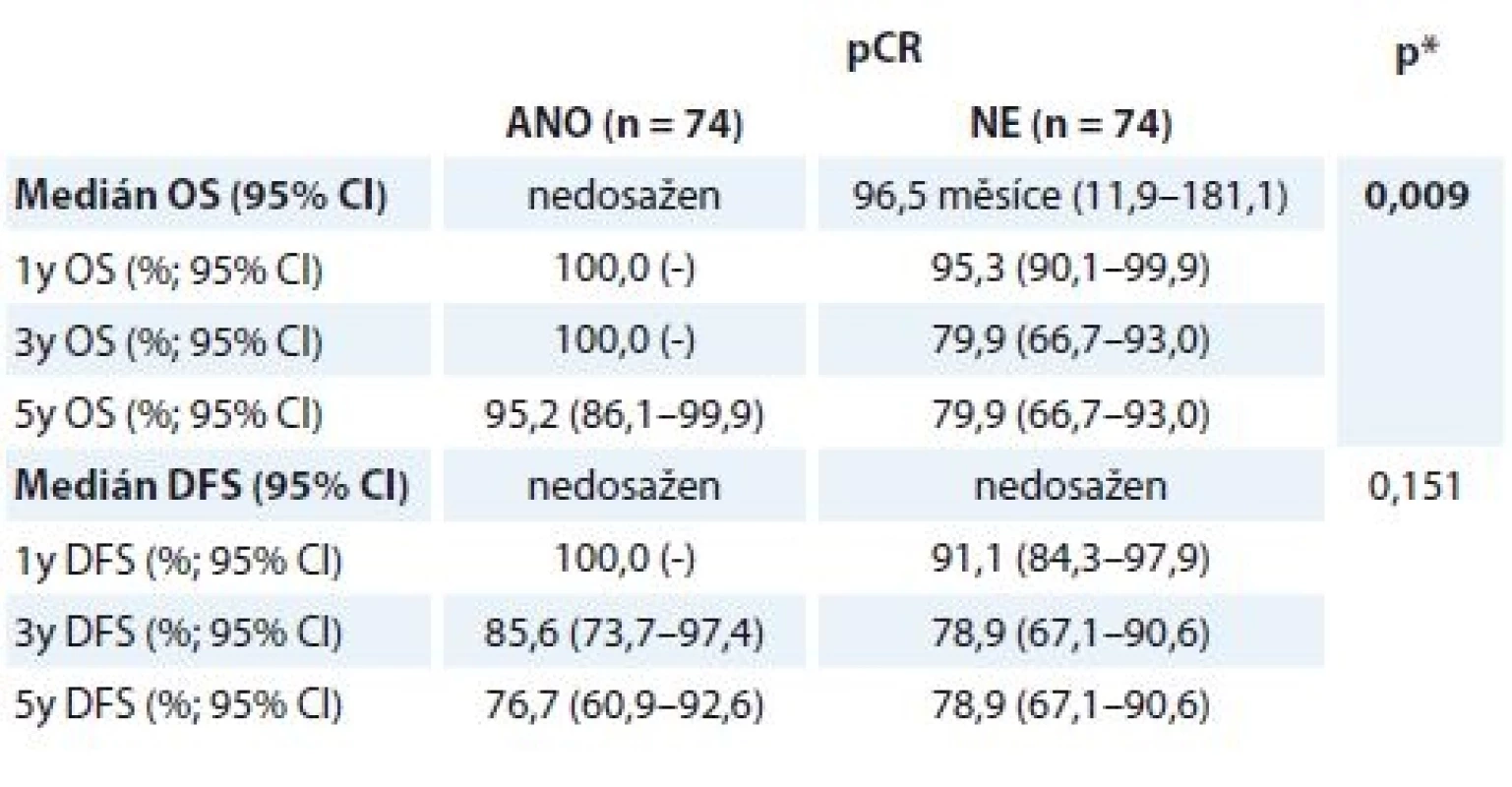
OS – celkove přeživani, DFS – čas bez znamek nemoci, pCR – patologicka kompletni remise * log-rank test, tučně – signifikantni nalez Při srovnání pCR a non-pCR skupiny byl medián OS signifikantně delší u žen, které dosáhly pCR (graf 3). Medián OS pro pCR skupinu žen nebyl dosažen, u non-pCR skupiny dosáhl 96,5 měsíce (95% IS 11,9–181,1). Jednoho roku a 3 let se dožilo 100,0 % žen (pCR) vs. 95,3 % (non-pCR, 1leté OS) a 79,9 % (non-pCR, 3leté OS), 5 let se dožilo 95,2 % žen v pCR skupině vs. 79,9 % žen v non-pCR skupině.
Graf 3. Hodnocení OS (A) a DFS (B) podle léčebného efektu NAT. 
OS – celkové přežití, DFS – přežití bez nemoci, pCR – patologická kompletní remise, NAT – neoadjuvantní terapie Výsledky OS/DFS v korelaci se stavem receptorů u pCR skupiny nebyly signifikantní, trend pro lepší prognózu nemocných je vidět u ER – nádorů (tab. 6). Další hodnocení kohorty pacientek vyžaduje její delší sledování.
Tab. 6. Hodnocení OS a DFS u pCR skupiny žen v korelaci se stavem ER ze vstupní biopsie. 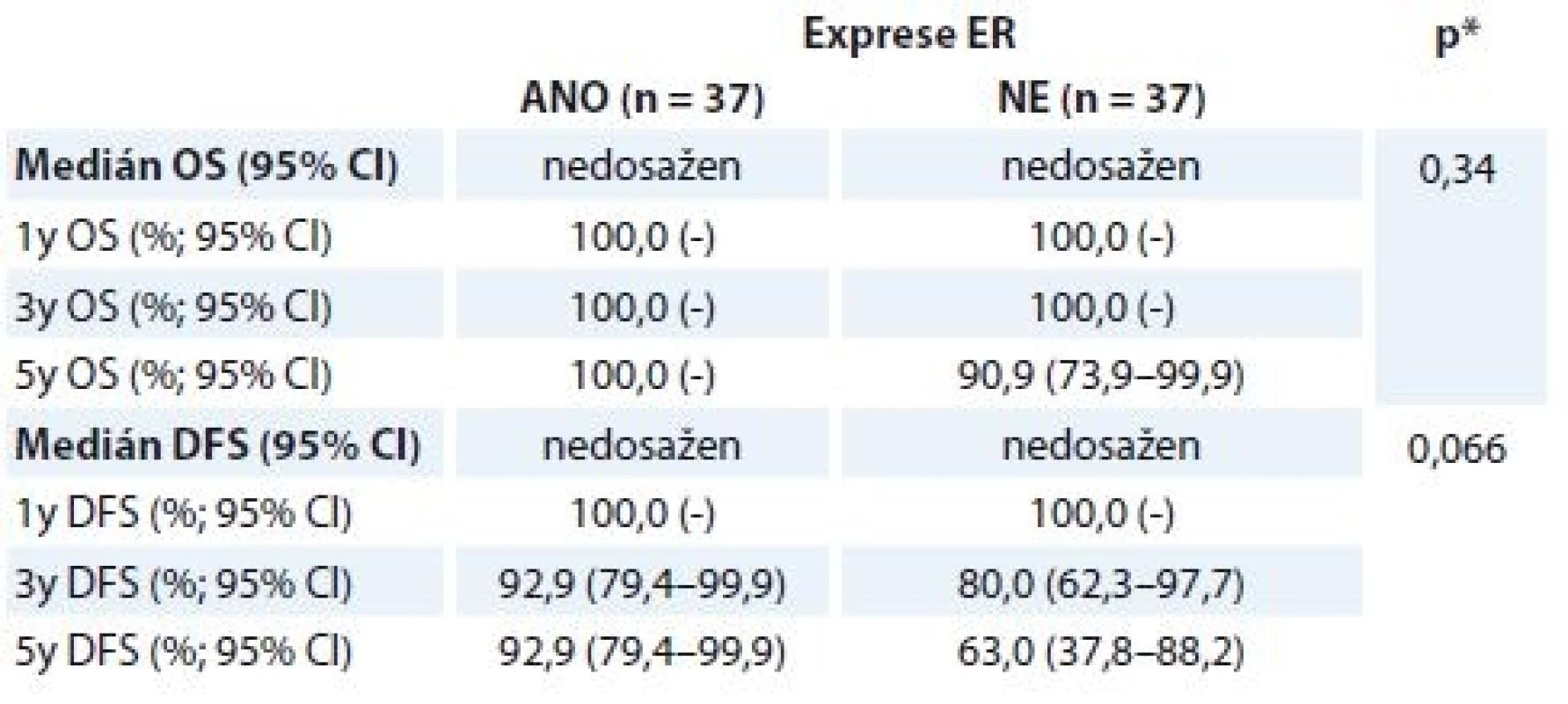
OS – celkové přežití, DFS – doba přežití bez nemoci, pCR – patologická kompletní remise, ER – astrogenní receptor
*log-rank testSouhrn
Celkem 148 pacientek s HER2+ časným nebo lokálně pokročilým BC bylo neoadjuvantně léčeno chemoterapií a H. Nejčastěji voleným režimem byl 4 × AC – 12 × TH (data z registru nemáme, v praxi indikujeme režim AC – TH téměř vždy, obvykle s výjimkou stadia I nemoci). Délka trvání NAT nevybočovala ze standardů (vycházíme z údaje v registru, že 94,6 % žen ukončilo NAT řádně). Medián věku nemocných byl 51 let, téměř 1/3 nemocných tvořily mladé pacientky do 40 let, 12,9 % pacientek bylo ve věku do 35 let. Kromě HER2 pozitivity přispíval k agresivitě nemoci zejména vysoký grade (62,8 % pacientek) a ER negativita (45,9 % pacientek). pCR dosáhlo 50,0 % žen, v 26,4 % případů patolog nenalezl reziduální nemoc (ypT0ypN0), v 23,6 % případů v prsní tkáni detekoval in situ zbytkový karcinom (ypTisypN0). Vyšší podíl ypT0 nálezů byl spojen s ER – primárními karcinomy, naopak ER pozitivita vedla častěji k menší odpovědi (ypTis). OS analýza ukázala, že nemocné, které dosáhly pCR, měly v následujícím období lepší prognózu – 1leté OS 100,0 vs. 95,3 %, 5leté OS 95,2 vs. 79,9 %; p = 0,009.
Diskuze
pCR je významným prognostickým faktoremu HER2+ a TNBC [9–11, 33]. Četnost pCR se při monoterapii H a chemoterapii pohybuje kolem 25–30 %, při duální anti-HER2 blokádě a chemoterapii až kolem 50–60 %. V naší kohortě pacientek byla pCR zaznamenána u 1/2 z nich (74/148). Při srovnání je nutno mít na mysli, že hodnocení pCR může být v různých pracích různé. pCR bez známek reziduální nemoci (ypT0ypN0) bylo v naší skupině dosaženo u 26,4 % pacientek, zbylých 23,6 % nemocných dosáhlo téměř kompletní odpovědi v podobě in situ reziduální nemoci.
Polovina nádorů, které na NAT zareagovaly pCR, byla ER+ (37/74), polovina ER – (37/74). Ze studií víme, že lepší odpovědi bývá dosaženo u ER – nádorů [27]. Ve studii NeoSphere byl počet pCR v rameni s docetaxelem a H 20,0 % u ER+ vs. 36,8 % u ER – nádorů, v rameni s H, pertuzumabem a docetaxelem byl rozdíl velmi zřetelný, 26,0 vs. 63,2 %. Rozdíl v četnosti kompletních odpovědí vidíme v naší skupině pouze po rozdělení pCR nálezů na ypT0ypN0 vs. ypTisypN0 skupiny – 66,7 % ER – nádorů zareagovalo absolutně vs. 68,6 % ER+ nádorů částečně. Příčinou absence lepší odpovědi u ER – nádorů v pCR skupině jako celku mohl být malý počet pacientek (pouze 74).
Dosažení pCR u vyššího procenta nemocných brání nádorová heterogenita, a to i u podskupin, u kterých bychom pCR očekávali. Víme, že u triple pozitivních nádorů je prognostický význam pCR méně spolehlivý, což vychází z odlišné nádorové biologie HER2+ nádorů s a bez hormonální dependence. Prediktory pro dosažení pCR chybí, i když se objevují první práce přestavující molekulární markery nebo nomogramy [34–37].
Odpovědi chybí i na další otázky – 1. Mohla by napomoci dosažení pCR přídatná terapie v podobě systémové léčby indikované nad rámec standardně trvající léčby? 2. Mohou ženy, u kterých pCR nebylo dosaženo, profitovat z duální anti-HER2 léčby? 3. A naopak, mohou některé ženy profitovat ze samotné anti-HER2 léčby a taxanů s vynecháním antracyklinů nebo ze samotné cílené terapie? 4. Mohly by některé pacientky, u kterých bylo dosaženo pCR, bezpečně ukončit systémovou terapii neoadjuvantně s vynecháním pooperačního H?
Medián trvání léčby H v neoadjuvantní části byl 2,5 měsíce, 94,6 % žen ukončilo NAT řádně. V adjuvantním H pokračovalo 131/137 žen, prakticky všechny ženy s ER+ nádory (71/79) pokračovaly také adjuvantní hormonální léčbou.
K relapsu a generalizaci nemoci po ukončení NAT a operaci došlo u 12 pacientek. U dalších 3 nemocných došlo k progresi nemoci a přechodu léčby do paliativní v průběhu nebo po ukončení NAT. Tyto 3 pacientky neabsolvovaly chirurgický výkon. Lokalizace metastáz byla následovná – játra (3/12), kosti (2/12), CNS (2/12), plíce (2/12), kůže/měkké tkáně (2/12), jiné lokality (3/12). U některých pacientek bylo zaznamenáno postižení více orgánových systémů.
Z operovaných žen (143/148) 65,0 % (93/143) podstoupilo ablaci, 33,6 % prs záchovný výkon (48/143), u 2 pacientek nebyl typ výkonu v registru specifikován. Důvodů pro vyšší podíl ablačních výkonů může být několik – 1. převaha agresivních histotypů, zejména vysoký podíl G3 nádorů; 2. pokročilost nemoci, tedy pacientky ve stadiu IIIA/IIIB (28,4 %) a/nebo nádory nad 5 cm, tedy část nádorů ve stadiu IIB (celkem ve stadiu IIB 34,5 % pacientek); 3. vyšší podíl mladých pacientek zvažujících rekonstrukční výkony (kompletní data o podílu nosiček hereditárních syndromů nemáme). Ze studií víme, že podíl prs záchovných výkonů nemusí být ovlivněn přidáním cílené anti-HER2 léčby a počtem pCR [38].
NÚ při neoadjuvantní léčbě H jsme zaznamenali pouze u 5 pacientek, zcela jistě se jednalo o klinicky relevantní NÚ, naopak NÚ bez klinické signifikance mohly být opomenuty a do registru nezaneseny.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Zuzana Bielčiková, Ph.D.
Onkologická klinika 1. LF UK a VFN v Praze
U Nemocnice 499/2 128 08 Praha 2
e-mail: zuzana.bielcikova@vfn.cz
Obdrženo: 14. 9. 2017
Přijato: 15. 2. 2018
Zdroje
1. Haque R, Ahmed SA, Inzhakova G et al. Impact of breast cancer subtypes and treatment on survival: an analysis spanning two decades. Cancer Epidemiol Biomarkers Prev 2012; 21 (10): 1848–1855. doi: 10.1158/1055-9965.EPI-12-0474.
2. Rastogi P, Anderson SJ, Bear HD et al. Preoperative chemotherapy: updates of National surgical adjuvant breast and bowel project protocols B-18 and B-27. J Clin Oncol 2008; 26 (5): 778–785. doi: 10.1200/JCO.2007. 15.0235.
3. Gralow JR, Burstein HJ, Wood W et al. Preoperative therapy in invasive breast cancer: pathologic assessment and systemic therapy issues in operable disease. J Clin Oncol 2008; 26 (5): 814–819. doi: 10.1200/JCO.2007.15.3510.
4. Killelea BK, Yang VQ, Mougalian S et al. Neoadjuvant chemotherapy for breast cancer increases the rate of breast conservation: results from the National cancer database. J Am Coll Surg 2015; 220 (6): 1063–1069. doi: 10.1016/j.jamcollsurg.2015.02.011.
5. Bonadonna G, Valagussa P, Brambilla C et al. Primary chemotherapy in operable breast cancer: eight-year experience at the Milan Cancer Institute. J Clin Oncol 1998; 16 (1): 93–100. doi: 10.1200/JCO.1998.16.1.93.
6. Vecchio FM, Valentini V, Minsky BD et al. The relationship of pathologic tumor regression grade (TRG) and outcomes after preoperative therapy in rectal cancer. Int J Radiat Oncol Biol Phys 2005; 62 (3): 752–760. doi: 10.1016/j.ijrobp.2004.11.017.
7. Kuroi K, Toi M, Tsuda H et al. Unargued issues on the pathological assessment of response in primary systemic therapy for breast cancer. Biomed Pharmacother 2005; 59 (Suppl 2): 387–392.
8. Ogston KN, Miller ID, Payne S et al. A new histological grading system to assess response of breast cancers to primary chemotherapy: prognostic significance and survival. Breast 2003; 12 (5): 320–327.
9. Liedtke C, Mazouni C, Hess KR et al. Response to neoadjuvant therapy and long-term survival in patients with triple-negative breast cancer. J Clin Oncol 2008; 26 (8): 1275–1281. doi: 10.1200/JCO.2007.14.4147.
10. Cortazar P, Zhang L, Untch M et al. Pathological complete response and long-term clinical benefit in breast cancer: the CTNeoBC pooled analysis. Lancet 2014; 384 (9938): 164–172. doi: 10.1016/S0140-6736 (13) 624 22-8.
11. von Minckwitz G, Untch M, Blohmer JU et al. Definition and impact of pathologic complete response on prognosis after neoadjuvant chemotherapy in various intrinsic breast cancer subtypes. J Clin Oncol 2012; 30 (15): 1796–1804. doi: 10.1200/JCO.2011.38.8595.
12. Untch M, Fasching PA, Konecny GE et al. Pathologic complete response after neoadjuvant chemotherapy plus trastuzumab predicts favorable survival in human epidermal growth factor receptor 2 – overexpressing breast cancer: results from the TECHNO trial of the AGO and GBG study groups. J Clin Oncol 2011; 29 (25): 3351–3357. doi: 10.1200/JCO.2010.31.4930.
13. Ahluwalia MS, Daw HA. Neoadjuvant therapy with trastuzumab, paclitaxel and epirubicin for HER-2-positive operable breast cancer. J Clin Oncol 2005; 23 (30): 7760–7761. doi: 10.1200/JCO.2005.03.0213.
14. Dawood S, Gonzalez-Angulo AM, Peintinger F et al. Efficacy and safety of neoadjuvant trastuzumab combined with paclitaxel and epirubicin: A retrospective review of the M. D. Anderson experience. Cancer 2007; 110 (6): 1195–1200. doi: 10.1002/cncr.22895.
15. Coudert BP, Largillier R, Arnould L et al. Multicenter phase II trial of neo-adjuvant therapy with trastuzumab, docetaxel, and carboplatin for human epidermal growth factor receptor-2-overexpressing stage II or III breast cancer: Results of the GETN (A) -1 trial. J Clin Oncol 2007; 25 (19): 2678–2684. doi: 10.1200/JCO.2006.09.9994.
16. Limentani SA, Brufsky AM, Erban JK et al. Phase II study of neoadjuvant docetaxel, vinorelbine, and trastuzumab followed by surgery and adjuvant doxorubicin plus cyclophosphamide in women with human epidermal growth factor receptor 2-overexpressing locally advanced breast cancer. J Clin Oncol 2007; 25 (10): 1232–1238. doi: 10.1200/JCO.2005.05.3306.
17. Buzdar AU, Valero V, Ibrahim NK et al. Neoadjuvant therapy with paclitaxel followed by 5-fluorouracil, epirubicin, and cyclophosphamide chemotherapy and concurrent trastuzumab in human epidermal growth factor receptor 2-positive operable breast cancer: An update of the initial randomized study population and data of additional patients treated with the same regimen. Clin Cancer Res 2007; 13 (1): 228–233. doi: 10.1158/1078-0432.CCR-06-1345.
18. Lazaridis G, Pentheroudakis G, Pavlidis N. Integrating trastuzumab in the neoadjuvant treatment of primary breast cancer: Accumulating evidence of efficacy, synergy and safety. Crit Rev Oncol Hematol 2008; 66 (1): 31–41. doi: 10.1016/j.critrevonc.2007.07.002.
19. Gianni L, Semiglazov V, Manikhas GM et al. Neoadjuvant trastuzumab in locally advanced breast cancer (NOAH): Antitumour and safety analysis. J Clin Oncol 2007; 25 : 532–539. doi: 10.1200/JCO.2006.08.9987.
20. Peintinger F, Buzdar AU, Kuerer HM et al. Hormone receptor status and pathologic response of HER2-positive breast cancer treated with neoadjuvant chemotherapy and trastuzumab. Ann Oncol 2009; 19 (12): 2020–2025. doi: 10.1093/annonc/mdn427.
21. Petrelli F, Fausto K, Borgonovo M et al. Neoadjuvant chemotherapy and concomitant trastuzumab in breast cancer: a pooled analysis of two randomized trials. Anticancer Drugs 2011; 22 (2): 128–135.
22. Kakarala M, Wicha MS. Implications of the cancer stem-cell hypothesis for breast cancer prevention and therapy. J Clin Oncol 2008; 26 (17): 2813–2820. doi: 10.1200/JCO.2008.16.3931.
23. Korkaya H, Paulson A, Iovino F et al. HER2 regulates the mammary stem/progenitor cell population driving tumorigenesis and invasion. Oncogene 2008; 27 (47): 6120–6130. doi: 10.1038/onc.2008.207.
24. de Azambuja E, Holmes AP, Piccart-Gebhart M et al. Lapatinib with trastuzumab for HER2-positive early breast cancer (NeoALTTO): survival outcomes of a randomised, open-label, multicentre, phase 3 trial and their association with pathological complete response. Lancet Oncol 2014; 15 (10): 1137–1146. doi: 10.1016/S1470-2045 (14) 70 320-1.
25. Gianni L, Pienkowski T, Im YH et al. Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, inflammatory, or early HER2-positive breast cancer (NeoSphere): a randomised multicentre, open-label, phase 2 trial. Lancet Oncol 2012; 13 (1): 25–32. doi: 10.1016/S1470-2045 (11) 70336-9.
26. Schneeweiss A, Chia S, Hickish T et al. Pertuzumab plus trastuzumab in combination with standard neoadjuvant anthracycline-containing and anthracycline-free chemotherapy regimens in patients with HER2-positive early breast cancer: a randomized phase II cardiac safety study (TRYPHAENA). Ann Oncol 2013; 24 (9): 2278–2284. doi: 10.1093/annonc/mdt182.
27. Broglio KR, Quintana M, Foster M, et al. Association of pathologic complete response to neoadjuvant therapy in HER2-positive breast cancer with long-term outcomes: A meta-analysis. JAMA Oncol 2016; 2 (6): 751–760. doi: 10.1001/jamaoncol.2015.6113.
28. Buzdar AU, Ibrahim NK, Francis D et al. Significantly higher pathologic complete remission rate after neoadjuvant therapy with trastuzumab, paclitaxel, and epirubicin chemotherapy: results of a randomized trial in human epidermal growth factor receptor 2-positive operable breast cancer. J Clin Oncol 2005; 23 (16): 3676–3685. doi: 10.1200/JCO.2005.07.032.
29. Gianni L, Eiermann W, Semiglazov V et al. Neoadjuvant chemotherapy with trastuzumab followed by adjuvant trastuzumab versus neoadjuvant chemotherapy alone, in patients with HER2-positive locally advanced breast cancer (the NOAH trial): a randomised controlled superiority trial with a parallel HER2-negative cohort. Lancet 2010; 375 (9712): 377–384. doi: 10.1016/S0140-6736 (09) 61 964-4.
30. Seidman A, Hudis C, Pierri MK et al. Cardiac dysfunction in the trastuzumab clinical trials experience. J Clin Oncol 2002; 20 (5): 1215–1221. doi: 10.1200/JCO.2002.20.5. 1215.
31. Guarneri V, Lenihan DJ, Valero V et al. Long-term cardiac tolerability of trastuzumab in metastatic breast cancer: the M.D. Anderson cancer center experience. J Clin Oncol 2006; 24 (25): 4107–4115. doi: 10.1200/JCO.2005.04. 9551.
32. Romond EH, Jeong JH, Rastogi P et al. Seven-year follow-up assessment of cardiac function in NSABP B-31, a randomized trial comparing doxorubicin and cyclophosphamide followed by paclitaxel (ACP) with ACP plus trastuzumab as adjuvant therapy for patients with node-positive, human epidermal growth factor receptor 2–positive breast cancer. J Clin Oncol 2012; 30 (31): 3792–3799. doi: 10.1200/JCO.2011.40.0010.
33. Cortayer P, Zhang L, Untch M et al. Pathological complete response and long-term clinical benefit in breast cancer: the CTNeoBC pooled analysis. Lancet 2014; 384 (9938): 163–172. doi: 10.1016/S0140-6736 (13) 624 22-8.
34. Fujii S, Yamashita S, Yamaguchi T et al. Pathological complete response of HER2-positive breast cancer to trastuzumab and chemotherapy can be predicted by HSD17B4 methylation. Oncotarget 2017; 8 (12): 19039–19048. doi: 10.18632/oncotarget.15118.
35. Fujii T, Kogawa T, Wu J et al. Nomogram to predict pathologic complete response in HER2-positive breast cancer treated with neoadjuvant systemic therapy. Br J Cancer 2017; 116 (4): 509–514. doi: 10.1038/bjc.2016.444.
36. Guiu S, Mouret Reynier MA, Toure M et al. Predictive factors of response in HER2-positive breast cancer treated by neoadjuvant therapy. J Oncol 2013; 854121. doi: 10.1155/2013/854121.
37. Cudós AG, Morales S, Alvarez AN et al. Pathological complete response in HER2 positive breast cancer treated with trastuzumab and chemotherapy: Predictive factors report. J Clin Oncol 2017; 35 (Suppl 15): e12133. doi: 10.1200/JCO.2017.35.15_suppl.e12 133.
38. Valachis A, Mauri D, Polyzos NP et al. Trastuzumab combined to neoadjuvant chemotherapy in patients with HER2-positive breast cancer: a systematic review and meta-analysis. Breast 2011; 20 (6): 485–490. doi: 10.1016/j.breast.2011.06.009.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2018 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Nejasný stín na plicích – kazuistika
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Monoclonal gammopathy of undetermined significance
- Neuroendokrinné neoplázie gastrointestinálneho traktu z pohľadu histopatológie
- Možná úloha ľudských herpetických vírusov podčeľade Alphaherpesvirinae pri vzniku niektorých nádorových ochorení
- Potenciál flavonoidu quercetinu v prevenci a léčbě nádorů – současný stav výzkumu
- Trastuzumab v neoadjuvantní léčbě HER2+ karcinomu prsu – 5leté zkušenosti z onkologické kliniky 1. LF UK a VFNTrastuzumab v neoadjuvantní léčbě HER2+ karcinomu prsu – 5leté zkušenosti z onkologické kliniky 1. LF UK a VFN
- Detekcia mutácií v géne FLT3 u pacientov východoslovenského regiónu
- Výsledky léčby krizotinibem v léčbě nemalobuněčného ALK pozitivního karcinomu plic v České republice
- Vybrané genetické polymorfizmy asociované s hypoxií a multilékovou rezistencí u pacientů s monoklonálními gamapatiemi
- Resekce sarkomu dutiny břišní, pánve a retroperitonea
- Aktuality z odborného tisku
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Potenciál flavonoidu quercetinu v prevenci a léčbě nádorů – současný stav výzkumu
- Neuroendokrinné neoplázie gastrointestinálneho traktu z pohľadu histopatológie
- Resekce sarkomu dutiny břišní, pánve a retroperitonea
- Detekcia mutácií v géne FLT3 u pacientov východoslovenského regiónu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



