-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Výsledky léčby krizotinibem v léčbě nemalobuněčného ALK pozitivního karcinomu plic v České republice
Effects of Treatment with Crizotinib on Non-small Cell Lung Carcinoma with ALK Translocation in the Czech Republic
Background:
Patients with advanced anaplastic lymphoma kinase (ALK) -positive non-small cell lung cancer (NSCLC) may gain significant benefit from treatment with the first-generation ALK inhibitor crizotinib. This study investigated the effects of crizotinib in advanced ALK-positive NSCLC patients via analyzing data submitted to the TULUNG registry by pneumo-oncology centers in the Czech Republic.Patients and methods:
We analyzed the data of 60 NSCLC patients submitted to the TULUNG registry by pneumo-oncology centers who had ALK translocation confirmed by fluorescence in situ hybridization and complete data records from 2011 to 2017.Results:
The median age of patients was 58 years. A total of 53% of patients were men, 90% had adenocarcinomas, 61.7% were smokers or ex-smokers, and 65% had a performance status of 0. Upon initiation of crizotinib therapy, most patients were at stage IV (88.3%) and the remainder were at stage IIIA or IIIB. Crizotinib was the second-line therapy in 71.7% of patients. A total of 20% of patients suffered side effects, while 11.7% suffered grade 3 and 4 adverse effects. A total of, 6.7, 25, 21.7, and 25% of patients displayed a complete response, a partial response, stable disease, and progressive disease, resp. Progression-free survival (PFS) was 5.8 months. Overall survival (OS) was 27.9 months from the initiation of the first-line therapy and 12.6 from the initiation of crizotinib therapy. PFS and OS were longer among nonsmokers and ex-smokers than among smokers (PFS, 9.7 vs. 5.8 vs. 3.8 months, p = 0.029; OS, 26.8 vs. 15.3 vs. 7.0 months, p = 0.015).Conclusion:
Targeted crizotinib therapy is well tolerated and has significant benefit in patients with advanced ALK-positive NSCLC. Although international guidelines recommend that crizotinib is only used as a first-line therapy, it is used as a second-line and higher-line therapy in the Czech Republic. Clinical studies provide evidence that targeted therapy elicits better effects and less toxicity than routine chemotherapy.Key words:
ALK translocation – crizotinib – targeted biological therapy – tyrosine kinase inhibitorsThis work was supported by AZV grant No. 17 - 30748A.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Submitted: 17. 1. 2018
Accepted: 20. 2. 2018
Autoři: Pešek Miloš 1; Skřičková Jana 2; Kolek Vítězslav 3; Šatánková Monika 2; Koubková Leona 4; Roubec Jaromír 5; Chloupková Renata 6; Černovská Markéta 7; Benejová Andrea 2; Kultan Juraj 3; Hrnčiarik Michal 8; Zemanová Milada 9; Konečný Marek 6; Čoupková Helena 10; Svatoň Martin 1
Působiště autorů: Klinika pneumologie a ftizeologie, LF UK a FN Plzeň 1; Klinika nemocí plicních a tuberkulózy LF MU a FN Brno 2; Klinika nemocí plicních a tuberkulózy LF UP a FN Olomouc 3; Pneumologická klinika 2. LF UK a FN Motol, Praha 4; Klinika plicních nemocí a tuberkulózy LF OU a FN Ostrava 5; Institut biostatistiky a analýz, LF MU, Brno 6; Pneumologická klinika 1. LF UK a Thomayerova nemocnice, Praha 7; Plicní klinika LF UK a FN Hradec Králové 8; Onkologická klinika 1. LF UK a VFN v Praze 9; Klinika komplexní onkologické péče, MOU, Brno 10
Vyšlo v časopise: Klin Onkol 2018; 31(3): 207-212
Kategorie: Původní práce
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amko2018207Souhrn
Úvod:
Nemocní s pokročilými ALK (anaplastic lymphoma kinase) pozitivními nemalobuněčnými karcinomy plic (non small cell lung cancer – NSCLC) mohou významně profitovat z léčby ALK inhibitorem 1. generace – krizotinibem. Referujeme o výsledcích této léčby podle údajů zadaných v registru TULUNG, které poskytla jednotlivá pneumoonkologická centra v České republice.Soubor pacientů a metody:
Analyzovali jsme soubor nemocných s NSCLC z pneumoonkologických center zapojených v registru TULUNG, u kterých byla prokázána metodou FISH ALK translokace a měly plný záznam v registru z let 2011–2017. Tomuto požadavku odpovídalo celkem 60 pacientů.Výsledky:
Medián věku nemocných činil 58 let. V souboru převažovali muži (53 %), adenokarcinomy (90 %), kuřáci s exkuřáky (61,7 %) a pacienti se stavem výkonnosti 0 (65 %). V době zahájení léčby krizotinibem převažovalo onemocnění stadia IV (88,3 %), u ostatních nemocných pak stadia IIIA, resp. B. Vzhledem k úhradovým podmínkám převládala indikace ve 2. linii léčby (u 71,7 % nemocných). Nežádoucí příhody se vyskytly u 20,0 % léčených pacientů, nežádoucí účinky grade 3 a vyšší u 11,7 % nemocných. Kompletní remise, parciální remise, stabilizace onemocnění a progrese nemocných byly dosaženy u 6,7, 25, 21,7 a 25 % nemocných. Medián doby do progrese (progresson-free survival – PFS) činil 5,8 měsíce, celkové přežití (overall survival – OS) nemocných bylo 12,6 měsíce. Celková doba přežití nemocných od zahájení léčby 1. linie byla 27,9 měsíce. Významně delší čas do PFS i OS se prokázal u nekuřáků a bývalých kuřáků v porovnání s kuřáky (PFS 9,7 vs. 5,8 vs. 3,8 měsíce; p = 0,029; OS 26,8 vs. 15,3 vs. 7,0 měsíce, p = 0,015).Závěr:
Cílená léčba krizotinibem u nemocných s pokročilými ALK pozitivními NSCLC je dobře snášena a přináší prokazatelný benefit. Zatímco mezinárodní doporučení odborných společností navrhují tuto léčbu podávat již v 1. linii, v České republice je ještě stále hrazena ve 2. a vyšších liniích, třebaže je dle výsledku klinických studií účinnější i méně toxická než obvyklá chemoterapie.Klíčová slova:
translokace genu ALK – krizotinib – cílená léčba – tyrozinkinázové inhibitoryÚvod
Nemalobuněčné karcinomy plic (non small cell lung cancer – NSCLC) jsou nejen u nás, ale i celosvětově nejčastějším zhoubným nádorem zapříčiňujícím úmrtí pacientů. I přes velký pokrok v oblasti systémové terapie je mortalita stále vysoká. Jedním z hlavních diagnostických úkolů posledních let je snaha o zlepšení záchytu NSCLC pacientů vhodných pro specifickou biologickou léčbu nízkomolekulárními inhibitory proteinových tyrozinkináz, které selektivně snižují proliferaci plicních nádorových buněk a tím zastavují růst nádoru. Zároveň mohou aktivovat nádorovým růstem potlačenou apoptózu nádorových buněk.
Molekulárně genetické vyšetřovací metody umožňují nacházet řídicí mutace v nádorové tkáni nemocných s NSCLC. V současnosti jsou běžně vyšetřovány neskvamózní typy karcinomů, především adenokarcinomy a nemalobuněčné blíže nespecifikovatelné karcinomy [1–3]. Cílená terapie specifickými inhibitory tyrozinkináz přichází v úvahu u nemocných s nádory nesoucími některé mutace genu EGFR a v poslední době i u nádorů s translokacemi genu EML-4 ALK a jeho variant. Tzv. ALK (anaplastic lymphoma kinase) pozitivní karcinomy plic jsou citlivé k léčbě ALK cílenými inhibitory, proto je jejich diagnostika velmi důležitá. V našem sdělení hodnotíme výsledky léčby v ČR dle dat uložených v registru TULUNG v letech 2011–2017.
Soubor pacientů a metody
Analyzovali jsme soubor nemocných s NSCLC s ALK translokacemi pneumoonkologických center zapojených v registru TULUNG. Nemocné jsme hodnotili podle běžných klinických dat (věk při zahájení léčby krizotinibem, pohlaví, kuřácká anamnéza, histologie a stadium nádoru, stav výkonnosti v době zahájení cílené terapie a linie léčby). Dále jsme hodnotili nejlepší dosaženou odpověď předchozí chemoterapie i cílené léčby, délku cílené léčby vč. mediánu doby po progrese (progression-free survival – PFS) a celkového přežití (overall survival – OS) pacientů, nežádoucí účinky (NÚ) krizotinibu a důvody jeho případného ukončení u cílené léčby. Statistické vyhodnocení bylo provedeno ve spolupráci s IBA Brno. Pro metody induktivní statistiky byl užíván log-rank test na zvyklé hladině významnosti p = 0,05.
Výsledky
Bylo vyhodnoceno celkem 60 kompletních záznamů nemocných z celkem 9 pracovišť, 2 další nebyly analyzovány z důvodu neúplných údajů. Medián věku našeho souboru při zahájení léčby byl 60 let (5–95 % ve věku 37–73 let), mladších 65 let bylo 65 %.
Z celkového počtu 60 pacientů bylo 28 žen (46,7 %) a 32 mužů (53,3 %). Z toho nekuřáků 23 (38,3 %), bývalých kuřáků (přestali kouřit 1 rok a více před diagnózou) bylo 23 (38,3 %) a kuřáků 14 (23,3 %). Adenokarcinomy bez specifikace byly u 42 pacientů, adenokarcinom nemucinózní u 10, adenokarcinom mucinózní u 2, nespecifikovaný NSCLC u 3, epidermoidní karcinom u 1, adenoskvamózní karcinom také u 1 a jiný blíže nespecifikovaný karcinom u 1 pacienta. Klinické stadium v době zahájení léčby krizotinibem – stadium I a II neměl žádný pacient, stadium IIIA 1 nemocný, stadium IIIB 6 nemocných a stadium IV 53 nemocných. Stav výkonnosti při zahájení léčby – PS 0 bylo u 12 pacientů (20,0 %), PS 1 u 39 (65,0 %) a PS 2 u 9 (15,0 %). Léčbu v 1. linii měl 1 pacient (1,7 %), ve 2. linii 43 pacientů (71,7 %), ve 3. linii 12 (20,0 %) a ve 4. a vyšší linii 4 nemocní (6,7 %). ALK translokace byla prokázána u všech 60 pacientů léčených krizotinibem. Výsledek FISH – % buněk s pozitivními signály – průměr 46, medián 40, min. a max. hodnota 18–100, CI 5–95% – 18–92.
Léčba platinovým doubletem (u 8 pacientů též spolu s bevacizumabem) byla před terapií krizotnibem podána u 57 nemocných (u 3 pacientů není léčba před krizotinibem blíže specifikována). Nejčastější kombinaci tvořil doublet cisplatina + pemetrexed u (20 pacientů). V 1. linii léčby kompletní remise (complete remission – CR) nedosáhl žádný nemocný, parciální odpovědi (partial response – PR) 8 pacientů (14 %), stabilizace onemocnění (stable diasease – SD) 21 (36,8 %) pacientů a progrese onemocnění (progression disease – PD) byla popsána u 14 (24,6 %) pacientů, u zbylých nemocných není v registru odpověď na 1. linii chemoterapie známa.
Co se týče terapie krizotinibem, byla zdokumentována následující procenta nejlepší dosažené léčebné odpovědi – CR 6,7 %, PR 25 %, SD 21,7 %, PD 25,0 % a nehodnoceno u 21,7 % z celkem 60 nemocných.
Medián doby léčby krizotinibem dosáhl dosáhl u 46 pacientů s dokončenou léčby hodnoty 7,8 měsíce (min.–max. 0,2–47,8 měsíce), kdy důvodem pro ukončení léčbou byla u většiny nemocných (78,7 %) progrese onemocnění, jako další příčiny byly uvedeny úmrtí pacienta (10,6 %), nežádoucí účinek léčby (6,4 %) a zhoršení stavu bez progrese onemocnění (2,1 %), u 2,1 % nebyl důvod ukončení léčby uveden. Popis nežádoucích účinků léčby je uveden v tab. 1.
Tab. 1. Výskyt nežádoucích příhod. 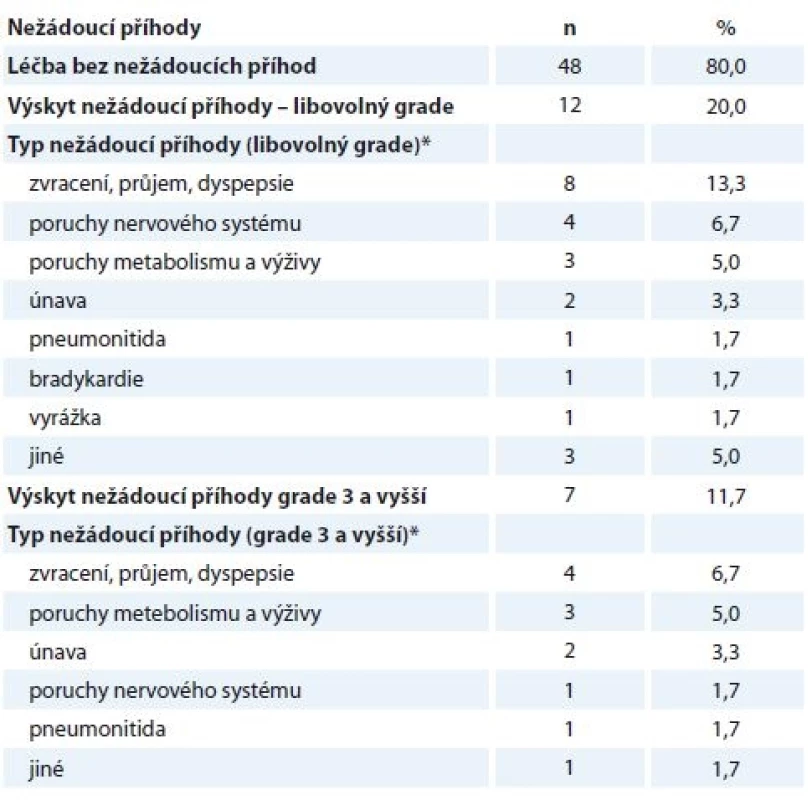
Medián PFS léčby krizotinibem činil 5,8 měsíce, medián OS pak 12,6 měsíce (obr. 1 (graf A+ B) a tab. 2.). Medián OS od zahájení 1. linie léčby pak dosáhl 27,9 měsíce (95% IS 18,5–37,2 měsíce).
Tab. 2. Celkové přežití a přežití bez známek progrese od data zahájení léčby krizotinibem pro vybrané skupiny pacientů. 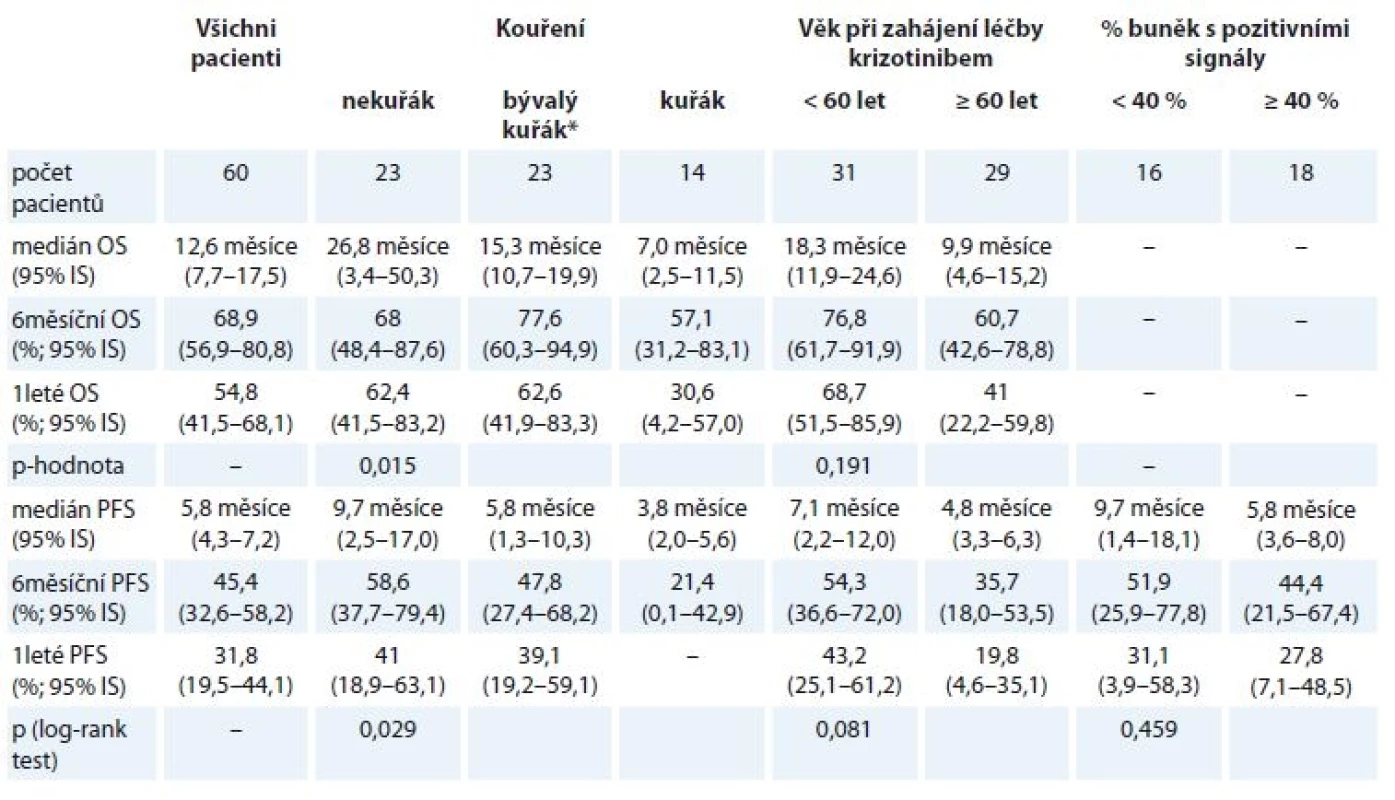
* pacient přestal kouřit rok a více před diagnózou Analýza časů do progrese nemoci a nejlepší léčebné odpovědi ve vztahu k počtu procent barevných signálů v nádorových buňkách jednotlivých pacientů neprokázala statisticky významné rozdíly.
Následně jsme vyhodnotili parametry účinnosti léčby krizotinibem ve vztahu ke kuřácké anamnéze nemocných a k jejich věku. Výsledky jsou zachyceny na obr. 1 (graf D–F) a v tab. 1.
Obr. 1. Celkové přežití (A, C, E) a přežití bez známek progrese (B, D, F) od data zahájení léčby krizotinibem pro vybrané skupiny pacientů (A + B celá kohorta, C + D dle kouření, E + F dle věku při zahájení léčby krizotinibem) 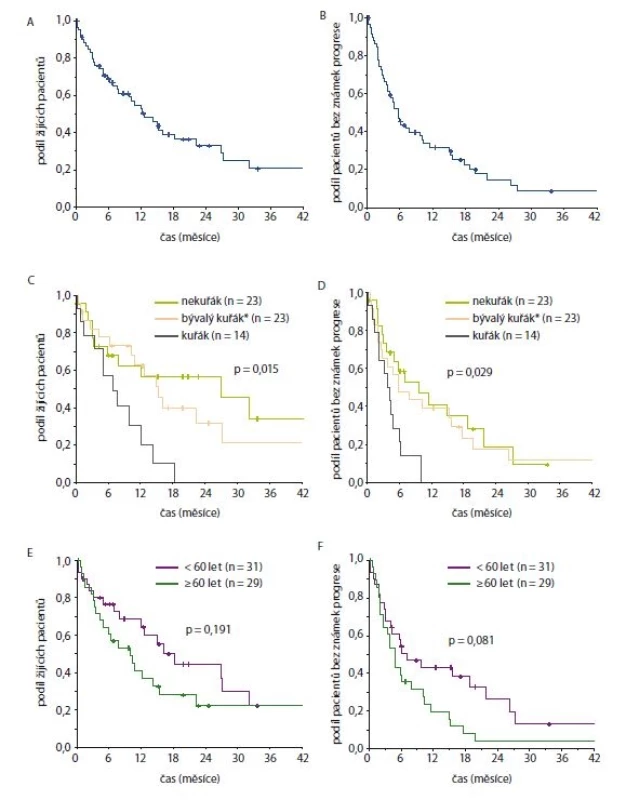
Diskuze
Biologicky cílená léčba s použitím tyrozinkinázových inhibitorů významně zlepšuje kvalitu života nemocných s nejčastějšími mutacemi EGFR, translokaci genu EML-4 ALK a ROS1 [4–8]. A to i přesto, že tyto skupiny nemocných jsou zejména v kaukazoidní populaci minoritní, v souhrnu se jejich společný podíl na celkové populaci nemocných s adenokarcinomy a blíže nespecifikovanými karcinomy plic udává kolem 15 % a více.
Zatímco na začátku tohoto století se střední doba života nemocných léčených chemoterapií 1. linie blížila 12 měsícům, údaje z konsorcia mutací karcinomu plic udávají výsledky výrazně lepší [9]. U nemocných, jejichž nádory obsahují řídicí mutace, je střední doba života, pokud jsou léčeni cílenou terapií, až kolem 3,5 roku od stanovení diagnózy. Společnými rysy, které má cílená léčba inhibitory tyrozinkinázy specifickými pro dané typy řídicích mutací, je relativně vysoká frekvence léčebných odpovědí, rychlé dosažení léčebné odpovědi spojené s ústupem klinické symptomatologie, ale bohužel i vývoj rezistentních forem nádorů po předchozí klinické remisi. Indikace cílených léků se v mezinárodních doporučeních posunuly většinou do 1. linie léčby. Postupné poznávání mechanizmů získané rezistence takto léčených nádorů vede k vývoji cílených léků vyšších generací, které přinášejí nemocným naději na dosažení dalších, někdy též dlouhodobých remisí nádorových onemocnění. Soubor našich nemocných s ALK pozitivní translokací je, podobně jako uvádějí jiné literární údaje [10], mladší, než odpovídá věkové struktuře pacientů s NSCLC ve stadiích III a IV podle dat Národního onkologického registru (NOR). Převažují zde nekuřáci a bývalí kuřáci, nejčastějšími morfologickými typy nádorů jsou adenokarcinomy bez specifikace a adenokarcinomy nemucinózní. V době zahájení léčby krizotinibem šlo téměř vždy o stadium IV, léčba byla podávána nejčastěji ve 2. linii za převažujícího stavu výkonnosti PS 0 a 1. Frekvence léčebných odpovědí na předchozí chemoterapii byla nízká – pouhých 14,0 % a k přechodné stabilizaci onemocnění došlo u < 1/3 nemocných. Je známo, že ALK pozitivní NSCLC mají nižší frekvenci léčebných odpovědí na pemetrexed než na ALK inhibitor, odpověď na erlotinib nebyla literárně doložena. Léčba našich nemocných byla celkem dobře tolerována, NÚ se vyskytly u 20 % léčených, z toho závažné jen u 11,7 % všech léčených, nejčastěji se vyskytovaly zvracení, průjem a dyspepsie, poruchy nervového systému a poruchy metabolizmu a výživy. Léčba krizotinibem byla nejčastěji ukončena při progresi onemocnění, medián délky léčby našeho souboru nemocných činil 3,9 měsíce. Frekvence léčebných odpovědí na krizotinib byla 31,7 %, frekvence kontroly 53,4 %, u 21,7 % souboru není údaj k dispozici – léčba probíhá, nebo léčebná odpověď nebyla hodnocena/uvedena v registru. OS nemocných od zahájení léčby 1. linie činí 27,9 měsíce, 3leté přežití od zahájení léčby je prokazatelné u 32,2 % souboru. Medián PFS při léčbě krizotinibem činil 5,8 měsíce, déle než 1 rok bez progrese bylo 31,8 % souboru. Medián OS od zahájení léčby krizotinibem činil 12,6 měsíce, 1 rok při léčbě krizotinibem přežilo 54,8 % nemocných.
Frekvence léčebných odpovědí v našem souboru, stejně jako frekvence kontroly nemoci, jsou nižší, než uvádějí studie fáze III PROFILE 1007 [11] a PROFILE 1014 [12] i slovenští autoři (65–75 %) [4], v porovnání s našimi 31,7 %. Podobně nižší byly i časy do progrese i přežití od začátku léčby krizotinibem. V souboru Beržince et al byl PFS 14 měsíců, ve studiích PROFILE 1007 a 1014 pak 7,7 a 10,9 měsíce. Medián PFS našich nemocných byl pouze 5,8 měsíce. V našem souboru je však poměrně vysoký podíl současných a bývalých kuřáků (23,3 a 38,3 %). Medián věku našich nemocných byl podobný, jako uvádějí slovenští autoři (60 vs. 56 let).
Nemocní s NSCLC s ovlivnitelnými řídicími mutacemi prokazatelně profitují z léčby molekulárně cílenými preparáty. Zatímco střední doba života nemocných léčených samotnou chemoterapií činila ještě v roce 2000 necelý 1 rok a určitý posun přinesla až histologií orientovaná biologická léčba a chemoterapie s použitím bevacizumabu nebo pemetrexedu, OS nemocných s mutacemi genu EGFR dosáhlo od stanovení diagnózy až 27 měsíců [2,8,9] i více. Většina studií však uvádí ve svých výsledcích pouze přežití nemocných od zahájení cílené terapie.
Možnosti léčby 2. linie po selhání 1. linie léčby u NSCLC, zaměříme-li se na adenokarcinomy, které jsou mezi nádory s translokacemi genu ALK zastoupeny nejčastěji, jsou v našich podmínkách aktuálně pouze dvě. Pemetrexed v monoterapii, nebyl-li již podán v 1. linii, v úvahu přichází také docetaxel, erlotinib bývá dle současného konsenzu rezervován obvykle pro 3. linii, po selhání dvou linií systémové chemoterapie. Úhradu nemají v současnosti nintedanib v kombinaci s docetaxelem a ani imunoterapeutické preparáty nivolumab a pembrolizumab. Ty by však zřejmě přicházely v úvahu, pokud by se podařilo získat jejich úhradu od plátců, jen u nemocných s nádory s vysokou expresí PD-L1 [13]. Pemetrexed podávaný ve 2. linii má dle dat registru TULUNG čas do progrese, medián OS i pravděpodobnost 2letého přežití horší, než vycházejí naše výsledky s krizotinibem, podobně jako erlotinib.
Léčebné účinky pemetrexedu závisejí dle Fialy et al [14] mimo jiné na průkazu exprese TTF1 (thyroid transcription factor 1) v nádorové tkáni, u TTF negativních adenokarcinomů je účinnost pemetrexedu významně horší než u nádorů TTF pozitivních. Efekt kombinace docetaxel + nintedanib bude zřejmě výraznější u nemocných s rychlou progresí nemoci po podání chemoterapie 1. linie [15]. Nemocní s ALK pozitivními NSCLC mohou profitovat z léčby krizotinibem v 1. i v dalších liniích léčby [11,12]. Pokud dojde k selhání léčby krizotinibem jako ALK inhibitorem 1. generace, lze s dobrou vyhlídkou na úspěch podat kromě klasické chemoterapie zejména ALK inhibitory 2. generace – ceritinib a alektinib [16–19].
Důvody menší účinnosti cílené léčby krizotinibem v našem souboru nemocných nejsou zcela zřejmé. Tolerance léčby byla podobná jako v citovaných souborech, stav výkonnosti nemocných byl v době zahájení léčby převážně velmi dobrý. Analyzovali jsme možné vlivy kuřáckých zvyklostí a věkových rozdílů nemocných. Kuřáctví by dle Aisnera et al [20] nemělo významně nepříznivě ovlivnit výsledky cílené léčby. Nicméně analýza našeho souboru nemocných, ve kterém bylo > 50 % kuřáků a kuřáků bývalých, ukázala statisticky významné rozdíly v OS i v časech do progrese ve prospěch nekuřáků a hraniční rozdíly ve frekvenci léčebných odpovědí. Nemocní s negativní kuřáckou anamnézou mají přijatelnou frekvenci léčebných odpovědí, čas do progrese nemoci 9,7 měsíce a medián OS od zahájení cílené léčby 26,8 měsíce, což odpovídá údajům publikovaným např. slovenskými autory. Vyšší frekvence léčebných odpovědí na krizotinib u nekuřáků ve srovnání s bývalými kuřáky udávají i jiní autoři [21]. Naproti tomu věk nemocných nemá statisticky doložitelné vztahy k účinnosti léčby krizotinibem. Příčinou rozdílů mezi kuřáky a nekuřáky by mohly být další řídicí mutace v nádorech našich pacientů, které se běžně nevyšetřují, ale jejich četnost dle prací, které vycházejí z výsledků vyšetřování nádorového genomu pomocí sekvenování nové generace (new generation sequencing – NGS), je relativně nízká, a tudíž by výsledky léčby podobných souborů patrně neovlivnily. Otázkou by mohly být současně se vyskytující dysruptivní mutace TP 53 [20], které jsou časté u kuřáků a které efekt cílené léčby prokazatelně snižují a zatím se u kandidátů cílené terapie běžně nevyšetřují. Je otázkou, zdali u nemocných s pokročilými ALK pozitivními karcinomy plic, kteří jsou zároveň kuřáky, nezvažovat jako možnou alternativu ve 2. linii léčbu imunoonkologickou.
Závěr
Naše výsledky prokázaly benefit léčby krizotinibem u nemocných s ALK pozitivními pokročilými NSCLC. Léčba ve 2. a vyšších liniích byla dobře tolerována, střední doba přežití od zahájení léčby 1. linie činila 27,9 měsíce, déle než 3 roky žilo > 30 % nemocných. Třebaže frekvence léčebných odpovědí, čas do progrese i střední doba přežití nemocných od zahájení cílené léčby krizotinibem celého našeho souboru byly nižší než v cílových studiích, je tato léčba nepochybně i za těchto okolností přínosem pro nemocné s touto v naší populaci relativně vzácnou řídicí mutací, zejména jde-li o nekuřáky nebo o bývalé kuřáky. Pokládáme proto za důležité včasné a podrobné genetické vyšetření nádorové tkáně nemocných s pokročilými adenokarcinomy, karcinomy blíže nespecifikovanými a u nemocných s průkazem léčebně ovlivnitelných řídicích mutací indikovat biologicky cílenou terapii. V budoucnosti by mohly zlepšit výsledky cílené léčby ještě podrobnější a současně prováděná genetická vyšetření s eventuálním záchytem dalších řídicích mutací s negativním prognostickým významem, ale především zavedení inhibitorů tyrozinkináz vyšších generací.
Práce byla podpořena grantem AZV 17-30748A.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Martin Svatoň, Ph.D.
Klinika pneumologie a ftizeologie LF UK a FN Plzeň
alej Svobody 80 304 60 Plzeň
e-mail: svatonm@gmail.com
Obdrženo: 17. 1. 2018
Přijato: 20. 2. 2018
Zdroje
1. Barlesi F, Mazieres J, Merlio JP et al. Routine molecular profiling of patients with advanced non-small-cell lung cancer: results of a 1-year nationwide programme of the French Cooperative Thoracic Intergroup (IFCT). Lancet 2016; 387 (10026): 1415–1426. doi: 10.1016/S0140-6736 (16) 00004-0.
2. Lindeman NI, Cagle PT, Beasley MB et al. Molecular testing guideline for selection of lung cancer patients for EGFR and ALK tyrosine kinase inhibitors: guideline from the College of American Pathologists, International Association for the Study of Lung Cancer, and Association for Molecular Pathology. J Thorac Oncol 2013; 8 (7): 823–859. doi: 10.1097/JTO.0b013e318290868f.
3. Vidal J, Clavé S, de Muga S et al. Assessment of ALK status by FISH on 1000 Spanish non-small cell lung cancer patients. J Thorac Oncol 2014; 9 (12): 1816–1820. doi: 10.1097/JTO.0000000000000361.
4. Beržinec P, Kasan P, Plank L et al. Krizotinib v liečbe nemalobunkového karcinómu pľúc v Slovenskej republike. Studia pneumologica et phtiseologica 2017; 77 (4): 155–159.
5. Camidge DR, Bang YJ, Kwak EL et al. Activity and safety of crizotinib in patients with ALK-positive non-small-cell lung cancer: updated results from a phase 1 study. Lancet Oncol 2012; 13 (10): 1011–1019. doi: 10.1016/S1470-2045 (12) 70344-3.
6. Novello S, Barlesi F, Califano R et al. Metastatic non-small-cell lung cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2016; 27 (suppl 5): v1–v27. doi: 10.1093/annonc/mdw326.
7. Park K, Tan EH, O’Byrne K et al. Afatinib versus gefitinib as first-line treeatment of patients with EGFR mutation-positive non-small-cell lung cancer (LUX-Lung 7): a phase 2B, open-label, randomised controlled trial. Lancet Oncol 2016; 17 (5): 577–589. doi: 10.1016/S1470-2045 (16) 300 33-X.
8. Rosell R, Moran T, Queralt C et al. Screening for epidermal growth factor receptor mutations in lung cancer. N Engl J Med 2009; 361 (10): 958–967. doi: 10.1056/ NEJMoa0904554.
9. Johnson BE, Kris MG, Berry LD et al. A multicenter effort to identify driver mutations and employ targeted therapy in patients with lung adenocarcinomas: The Lung Cancer Mutation Consortium (LCMC). J Clin Oncol 2013; 31 (15 suppl): 8019. doi: 10.1200/jco.2013.31.15_suppl.8019.
10. Scarpinoa S, Rampioni Vinciguerra GL, Di Napoli A et al. High prevalence of ALK+/ROS1+ cases in pulmonary adenocarcinoma of adoloscents and young adults. Lung Cancer 2016; 97 : 95–98. doi: 10.1016/j.lungcan.2016.04.022.
11. Shaw AT, Kim DW, Nakagawa K et al. Crizotinib versus chemotherapy in advanced ALK-positive lung cancer. N Engl J Med 2013; 368 (25): 2385–2394. doi: 10.1056/ NEJMoa1214886.
12. Solomon BJ, Mok T, Kim DW et al. First-line crizotinib versus chemotherapy in ALK-positive lung cancer. N Engl J Med 2014; 371 (23): 2167–2177. doi: 10.1056/ NEJMoa1408440.
13. Borghaei H, Paz-Ares L, Horn L et al. Nivolumab versus docetaxel in advanced nonsquamous non-small-cell lung cancer. N Engl J Med 2015; 373 (17): 1627–1639. doi: 10.1056/NEJMoa1507643.
14. Fiala O, Pesek M, Skrickova J et al. Thyroid transcription factor 1 expression is associated with outcome of patients with non-squamous non-small cell lung cancer treated with pemetrexed-based chemotherapy. Tumour Biol 2017; 39 (2): 1010428317691186. doi: 10.1177/1010428317691186.
15. Reck M, Kaiser R, Mellemgaard A et al. Docetaxel plus nintedanib versus docetaxel plus placebo in patients with previously treated non-small-cell lung cancer (LUME-Lung 1): a phase 3, double-blind, randomised controlled trial. Lancet Oncol 2014; 15 (2): 143–155. doi: 10.1016/S1470-2045 (13) 70586-2.
16. Kim DW, Mehra R, Tan DS et al. Activity and safety of ceritinib in patients with ALK-rearranged non-small-cell lung cancer (ASCEND-1): updated results from the multicentre, open-label, phase 1 trial. Lancet Oncol 2016; 17 (4): 452–463. doi: 10.1016/S1470-2045 (15) 00614-2.
17. Peters S, Camidge DR, Shaw AT et al. Alectinib versus crizotinib in untreated ALK-positive non-small-cell lung cancer. N Engl J Med 2017; 377 (9): 829–838. doi: 10.1056/NEJMoa1704795.
18. Shaw AT, Gandhi L, Gadgeel S et al. Alectinib in ALK-positive, crizotinib-resistant, non-small-cell lung cancer: a single-group, multicentre, phase 2 trial. Lancet Oncol 2016; 17 (2): 234–242. doi: 10.1016/S1470-2045 (15) 004 88-X.
19. Shaw AT, Kim DW, Mehra R, Tan DS et al. Ceritinib in ALK-rearranged non-small-cell lung cancer. N Engl J Med 2014; 370 (13): 1189–1197. doi: 10.1056/NEJMoa1311 107.
20. Aisner DL, Sholl LM, Berry L et al. The impact of smoking and TP53 mutations in lung adenocarcinoma patients with targetable mutations – the lung cancer mutation consortium (LCMC2). Clin Cancer Res 2017; 24 (5): 1038–1047. doi: 10.1158/1078-0432.CCR-17-2289.
21. Yang JCH, Ignatius SH, De Petris L et al. Pooled systemic efficacy and safety data from the Pivotal Phase II Studies (NP28673 and NP28761) of alectinib in ALK-positive non-small cell lung cancer. J Thorac Oncol 2017; 12 (10): 1552–1560. doi: 10.1016/j.jtho.2017.06.070.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článek Aktuality z odborného tisku
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2018 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Monoclonal gammopathy of undetermined significance
- Neuroendokrinné neoplázie gastrointestinálneho traktu z pohľadu histopatológie
- Možná úloha ľudských herpetických vírusov podčeľade Alphaherpesvirinae pri vzniku niektorých nádorových ochorení
- Potenciál flavonoidu quercetinu v prevenci a léčbě nádorů – současný stav výzkumu
- Trastuzumab v neoadjuvantní léčbě HER2+ karcinomu prsu – 5leté zkušenosti z onkologické kliniky 1. LF UK a VFNTrastuzumab v neoadjuvantní léčbě HER2+ karcinomu prsu – 5leté zkušenosti z onkologické kliniky 1. LF UK a VFN
- Detekcia mutácií v géne FLT3 u pacientov východoslovenského regiónu
- Výsledky léčby krizotinibem v léčbě nemalobuněčného ALK pozitivního karcinomu plic v České republice
- Vybrané genetické polymorfizmy asociované s hypoxií a multilékovou rezistencí u pacientů s monoklonálními gamapatiemi
- Resekce sarkomu dutiny břišní, pánve a retroperitonea
- Aktuality z odborného tisku
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Potenciál flavonoidu quercetinu v prevenci a léčbě nádorů – současný stav výzkumu
- Neuroendokrinné neoplázie gastrointestinálneho traktu z pohľadu histopatológie
- Resekce sarkomu dutiny břišní, pánve a retroperitonea
- Detekcia mutácií v géne FLT3 u pacientov východoslovenského regiónu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



