-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Léčba relabující/refrakterní akutní lymfoblastické leukemie dnes a zítra
Therapy of Relapsed/Refractory Acute Lymphoblastic Leukemia Today and Tomorrow
Background:
New diagnostics and treatments, including the use of new drugs, have advanced considerably the treatment of acute lymphoplastic leukemia (ALL) in the past few years. Monoclonal antibodies and immunoconjugates targeting antigens CD19 and CD22 show greater efficacy and more favourable toxicity profiles than standard salvage chemotherapeutic protocols. Two of these drugs – blinatumomab and inotuzumab ozogamicin – have already made their way into clinical practice. Ponatinib and other new generation tyrosine kinase inhibitors allow dose reduction of intensive cytostatic regimens in Ph-positive ALL patients and slowly start to overshadow the importance of allogeneic hematopoietic cell transplants. For the time being, their use is reserved for relapsed/refractory ALL, but they are already available as a first line therapy in clinical trials. An entirely new group of living drugs is emerging for the treatment of ALL – chimeric antigen receptor T-cells produced by genetic modification of native human cells. Chimeric antigen receptor T-cells can be looked upon as in vitro trained professional blast killers. They show an efficacy never seen before for the treatment of relapsed/refractory ALL. On the other hand, this treatment still presents significant risks, mainly due to cytokine release syndrome. Ruxolitinib, mTOR inhibitors, bortezomib, and other drugs for targeted treatment of ALL are currently being evaluated in clinical trials.
Purpose:
The article focuses on current options and news in the field of relapsed and refractory ALL treatment.
This work was created at Masaryk University as part of the project “New Approaches in Research, Diagnostics and Therapy of Hematological Malignancies VI”, number MUNI/A/1105/2018, supported by Czech Ministry of Education, Youth and Sports in 2019.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Submitted: 28. 8. 2018
Accepted: 10. 1. 2019
Keywords:
acute lymphoblastic leukemia – relapse – monoclonal antibodies – CAR T-cells – tyrosine kinase inhibitors – nelarabine
Autoři: Š. Hrabovský 1; F. Folber 1; M. Doubek 1,2
Působiště autorů: Interní hematologická a onkologická klinika LF MU a FN Brno 1; CEITEC – Středoevropský technologický institut, Masarykova univerzita, Brno 2
Vyšlo v časopise: Klin Onkol 2019; 32(2): 90-96
Kategorie: Přehled
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amko201990Souhrn
Východiska:
V posledních letech dochází k řadě pokroků v diagnostice a léčbě relabující a refrakterní akutní lymfoblastické leukemie (ALL), objevu nových léků a jejich postupnému zavádění do denní praxe. Nové monoklonální protilátky a imunokonjugáty proti antigenům CD19 a CD22 vykazují v porovnání se standardními cytostatiky vysokou účinnost a výhodu nižší toxicity. Do klinického používání v indikaci relabované/refrakterní ALL se již dostaly dva léky z této skupiny – blanitumomab a inotuzumab ozogamicin. Díky ponatinibu a dalším tyrozinkinázovým inhibitorům vyšších generací je možné u Ph-pozitivní ALL redukovat dávky cytostatik intenzivních chemoterapeutických režimů, dokonce svojí účinností začínají pomalu zastiňovat význam alogenní transplantace hematopoetických buněk. Zatím je jejich indikace stále omezena na relabovanou/refrakterní ALL, v rámci klinických studií je však lze použít i v primoléčbě. Do klinického užití se dostává zcela nová skupina „živých“ léků v podobě T lymfocytů s chimérickým receptorem vytvořených genetickou manipulací nativních lidských buněk. Tyto lymfocyty jsou v podstatě in vitro trénovanými zabijáky leukemických blastů. Jejich účinnost je na poli léčby relabované/refrakterní ALL sice dosud nevídaná, zato ale vykoupená značnou toxicitou, především syndromem z uvolnění cytokinů. Ruxolitinib, mTOR inhibitory, bortezomib a další léky pro tzv. cílenou terapii ALL jsou ve fázi klinického hodnocení.
Cíl:
Tento článek přináší souhrn novinek v léčbě relabující a refrakterní ALL.
Klíčová slova:
akutní lymfoblastická leukemie – relaps – monoklonální protilátky – CAR T lymfocyty – tyrozinkinázové inhibitory – nelarabin
Úvod
Akutní lymfoblastická leukemie (ALL) je maligní klonální onemocnění krvetvorby vycházející z prekurzorových buněk B lymfoidní (B-ALL) nebo T lymfoidní (T-ALL) řady, B-ALL je přitom asi 3× častější než T-ALL. Jedná se o nejčastější onkologické onemocnění v dětském věku s incidencí 3–4/100 000 dětí ročně a maximem výskytu ve věku 2–5 let. U dospělých se toto onemocnění řadí mezi vzácné malignity, ve věkové skupině > 18 let postihne asi 1,0–1,6/100 000 obyvatel ročně [1,2].
Výsledky současné léčby dětských pacientů s ALL se řadí mezi největší úspěchy na poli onkologie vůbec. Za posledních 50 let se tak z prakticky infaustního onemocnění postupně stala jedna z nejlépe léčitelných dětských malignit. Současnou indukční terapií dosahuje kompletní hematologické remise (complete remission – CR) 99 % pediatrických pacientů a jejich celkové dlouhodobé přežití (overall survival – OS) je 85–90 % [3,4].
Léčba ALL dospělých je oproti tomu mnohem svízelnější. Se zavedením moderních léčebných protokolů inspirovaných pediatrickými režimy sice prognóza dospělých pacientů zaznamenala výrazné zlepšení, výsledky jsou však i přesto stále neuspokojivé. Z pacientů ve věku 18–55 let dosáhne po indukci CR asi 90 %, ale jen 55 % se dožívá 5 let od stanovení diagnózy. Nemocní ve věkové skupině 55–70 let dosahují při léčbě klasickou chemoterapií (CHT) 3letého OS ve 20 % a pacienti léčení paliativně mají velmi špatnou prognózu s OS v řádu týdnů až několika málo měsíců [5–7].
Léčba relapsu ALL
Relaps ALL je hlavní příčinou rozdílu mezi relativně vysokým procentem iniciálně dosažených CR a nízkým procentem dlouhodobě přežívajících dospělých pacientů. Relaps postihne ve věkové skupině > 18 let až polovinu nemocných, onemocnění primárně refrakterní na indukční léčbu má asi 5 % pacientů [5–7].
Jedinou léčebnou možností pro tyto pacienty byl až do nedávna jeden ze záchranných chemoterapeutických režimů následovaný u mladších nemocných < 65 let věku alogenní transplantací krvetvorných buněk (allogeneic hematopoietic cell transplantation – allo-HCT). Ta je v případě relapsu ALL dospělých stále považována za jedinou léčebnou modalitu s kurativním potenciálem. Podmínkou účinné transplantace je ale předchozí navození druhé CR nemoci. Klasické záchranné režimy však mají značnou toxicitu a část pacientů umírá na komplikace této léčby. Seniorům a některým starším dospělým lze pak ze standardní CHT nabídnout jen paliativní režimy.
Východiskem v této situaci může být tzv. cílená terapie (targeted therapy) monoklonálními protilátkami a jejich konjugáty, inhibitory kináz či zcela novými postupy adoptivní imunity založenými na genetické manipulaci pacientových T lymfocytů (schéma 1). Na povrchu lymfoblastů je několik antigenů, které lze dobře využít jako cíle monoklonálních protilátek (tab. 1). Léčba monoklonálními protilátkami má navíc oproti léčbě standardními cytostatiky zpravidla nižší toxicitu.
Schéma 1. Principy imunoterapie B-ALL. 
B-ALL – akutní lymfoblastická leukemie vycházející z prekurzorových buněk B lymfoidní řady, ADCC – na protilátkách závislá buněčná cytotoxicita, FcR – fludarabin, cyklofosfamid, rituximab, TCR – T buněčný receptor, CAR – chimerický antigenní receptor Tab. 1. Povrchové antigeny blastů B-ALL využitelné pro cílenou terapii. Exprese Funkce 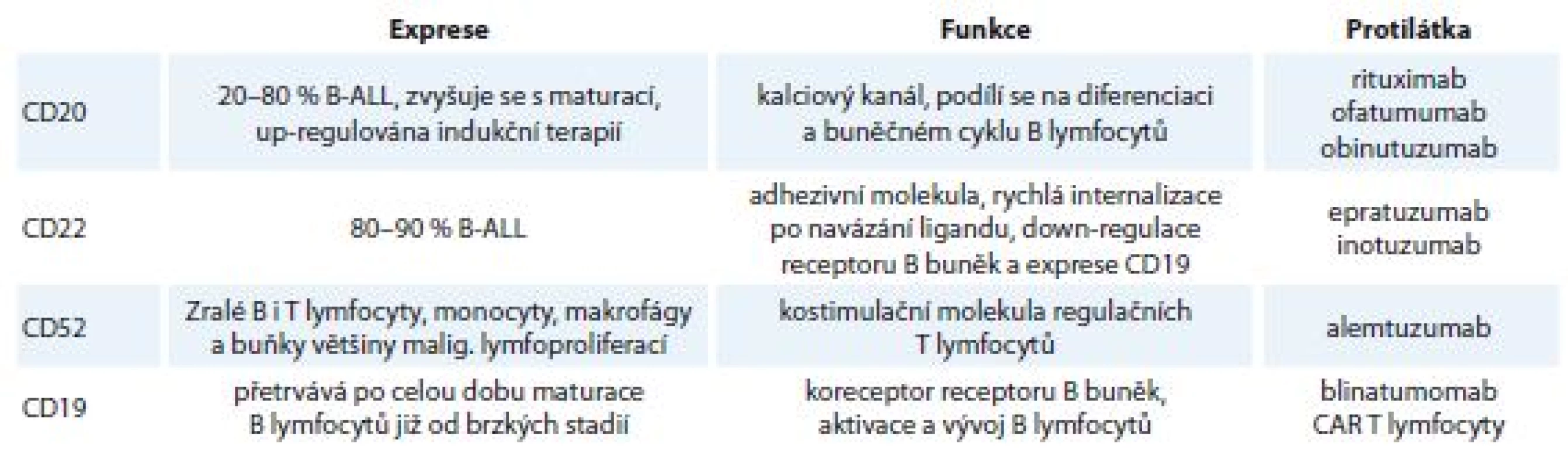
B-ALL – akutní lymfoblastická leukemie vycházející z prekurzorových buněk B lymfoidní řady, CAR – chimerický antigenní receptor Monoklonální protilátky
Jedním z nových léků pro ALL je bispecifický monoklonální protilátkový konstrukt blinatumomab. Tato molekula se jedním epitopem váže na antigen CD19 leukemické buňky a druhým na CD3 (koreceptor T buněčného receptoru) T lymfocytu. T lymfocyt poté spustí proces apoptózy cílené buňky. Jeden takto aktivovaný T lymfocyt může zničit postupně i několik leukemických blastů. Navíc lék navozuje proliferaci a aktivaci dalších CD4+ i CD8+ T lymfocytů [8].
Registrační studie fáze III srovnávala monoterapii blinatumomabem oproti standardní CHT u pacientů s Ph-negativní R/R ALL. CR bylo dosaženo ve 44 vs. 25 % a medián OS byl 7,7 vs. 4,0 měsíce. Velká část těchto pacientů dosáhla i eradikace minimální zbytkové choroby (minimal residual disease – MRD) (76 vs. 48 %) [9]. MRD je přitom u ALL hlavním prediktorem prognózy konkrétního pacienta. Byla provedena i jednoramenná studie fáze II s Ph-pozitivními pacienty rezistentními na alespoň 2 linie tyrozinkinázových inhibitorů (TKI), blinatumomab dosáhl podobných výsledků jako u pacientů Ph-negativních (38 % CR a medián OS 7,1 měsíce) [10].
Blinatumomab je v ČR dostupný od roku 2016, jeho indikací je léčba dospělých pacientů s Ph-negativní a CD19-pozitivní R/R ALL. Specifickými nežádoucími účinky léku jsou syndrom z uvolnění cytokinů (4,9 %), reverzibilní neurotoxicita s nejrůznějšími lokálními i celkovými projevy (9,4 %) a deplece zdravých B lymfocytů s nutností substituce imunoglobulinů. Infekční komplikace jsou méně časté než při CHT (34 vs. 52 %) [9].
V současnosti probíhají i studie fáze II a III hodnotící účinnost blinatumomabu v léčbě 1. linie jak u dospělých, tak pediatrických pacientů.
Epratuzumab je humanizovanou monoklonální protilátkou anti-CD22. Ve studii fáze II s dětskými ALL pacienty sice nezvýšil počet dosažených CR, ale zvýšilo se procento eradikace MRD [11]. Ve studii fáze II s relabovanými dospělými pacienty prokázalo přidání epratuzumabu k CHT zvýšení počtu CR oproti historické kontrole (52 vs. 17 %) [12]. V současnosti probíhá s tímto lékem randomizovaná studie fáze III mezinárodní skupiny IntReALL s nově diagnostikovanými pediatrickými pacienty [13].
Další bispecifické anti-CD19/anti-CD3 monoklonální protilátky testované u ALL v nižších fázích klinického hodnocení jsou např. duvortuxizumab a AFM-11.
Imunokonjugáty
Inotuzumab ozogamicin je imunokonjugát humanizované monoklonální protilátky anti-CD22 a cytostatika kalicheamicinu. Po navázání této molekuly na antigen dojde k internalizaci celého komplexu a jinak velmi toxické cytostatikum po uvolnění vazby s protilátkou působí jen uvnitř cílové buňky.
Randomizovaná studie fáze III srovnávající monoterapii tímto lékem se standardní záchrannou CHT přinesla u dospělých pacientů s Ph-negativní i Ph-pozitivní R/R ALL povzbuzující výsledky. Mezi pacienty, kteří dosáhli CR (81 vs. 29 %), bylo i vysoké procento dosažené MRD negativity (78 vs. 28 %). Rozdíl 2letého OS byl sice dle vytyčených cílů studie statisticky nesignifikantní, ale počet dlouhodobě přeživších pacientů byl v rameni s inotuzumabem ozogamicinem oproti rameni s CHT více než dvojnásobný (23 vs. 10 %, p = 0,02) [14]. Přidání nízce intenzivní CHT k inotuzumabu ozogamicinu ještě dále zvýšilo počet dosažených CR [15].
Probíhá i hodnocení efektu inotuzumabu ozogamicinu v primoléčbě ALL. Studie fáze II testovala kombinaci inotuzumabu ozogamicinu s redukovanou CHT u pacientů s věkem > 65 let. Pacienti dosáhli 3letého OS v 56 %, což je výsledek v této věkové skupině dosud nezaznamenaný [16]. Nedávno zahájená studie fáze III má za cíl zhodnotit účinnost přidání inotuzumabu ozogamicinu k intenzivní CHT u nově diagnostikovaných mladých dospělých.
Inotuzumab ozogamicin je v ČR dostupný od roku 2017. Dle indikačních kritérií jej lze použít k léčbě Ph-negativní i Ph-pozitivní R/R ALL dospělých. Mezi specifické nežádoucí účinky této léčby patří elevace bilirubinu (15 %), jaterních transamináz (20 %) a venózní okluzivní choroba jater (11 %) [14].
Další z imunokonjugátů pro léčbu ALL hodnocených v klinických studiích nižších fází jsou např. moxetumomab pasudotox (imunokonjugát anti-CD22 s navázaným fragmentem exotoxinu A bakte-rie Pseudomonas aeruginosa), denintuzu-mab mafodotin (imunokonjugát anti-CD19 s mikrotubulovým toxinem monometyl auristatinem F), Combotox (směs imunokonjugátů anti-CD19 a anti-CD22 s deglykosylovaným ricinem A) a ADCT-402 (imunokonjugát anti-CD19 s navázaným cytostatikem pyrolobenzodiazepinem).
Adoptivní imunoterapie
Novým krokem tzv. „T-cell engaging“ strategie v léčbě nejen ALL, ale i jiných malignit, jsou T lymfocyty s chimérickým receptorem (chimeric antigen receptor – CAR). Jedná se o lymfocyty odebrané z periferní krve pacienta, do kterých je in vitro (nejčastěji pomocí virového vektoru) vpraven gen pro chimérický T buněčný receptor se specificitou proti definovanému povrchovému antigenu nádorové buňky, u B-ALL většinou CD19. Po kultivaci jsou takto modifikované CAR T lymfocyty infuzí aplikovány nemocnému. V těle pacienta dojde k proliferaci CAR T lymfocytů a imunitní reakci namířené proti nádorové buněčné populaci. Testovány jsou i metodiky výroby alogenních CAR T lymfocytů z buněk odebraných od zdravého dárce [13].
Jednotlivé pracovní skupiny již vyvinuly několik postupů výroby těchto modifikovaných T lymfocytů, ty se liší jak stavbou samotného chimérického receptoru a jeho kostimulačních domén, tak způsobem přenosu kódujícího genu do T lymfocytů. Vektorem přenosu genu je nejčastěji gamaretrovirus a lentivirus, zkoušeny jsou i alternativní postupy jako přenesení CAR genu syntetickým transpozonem (technologie Sleeping Beauty) nebo přímá elektroporace RNA do T lymfocytů [17,18].
Druhá generace CAR T lymfocytů disponuje kostimulační doménou CD28 nebo 4-1BB, třetí generace kombinací více kostimulačních domén s efektem zvýšení protinádorové aktivity [19]. Čtvrtá generace, tzv. TRUCK (T-cell Redirected Universal Cytokine Killing), dokáže pomocí sekrece vlastních transgenních cytokinů (např. IL-12) ovlivňovat nádorové stroma a zvýšit migraci jiných naivních imunitních buněk do oblasti nádoru [20]. Pro léčbu malignit jsou zkoumány i možnosti zapojení in vitro modifikovaných NK (natural killer) buněk [21].
Mezi hlavní projevy toxicity léčby CAR T lymfocyty patří podobně jako u blinatumomabu syndrom z uvolnění cytokinů, zde ale obecně s těžším průběhem nezřídka vyúsťujícím v multiorgánové selhání. Dalšími komplikacemi jsou neurotoxicita, deplece zdravých B lymfocytů s hypogamaglobulinemií a infekční komplikace. Výsledky léčby jsou ale i přes vysokou toxicitu motivující, již několik na sobě nezávislých studií fáze I a II prokázalo > 90 % navozených CR u dětských i dospělých pacientů s R/R ALL [22–24].
Tato léčebná metoda zaznamenává dobré výsledky i u chronické lymfocytární leukemie a agresivních B lymfomů [25–28]. CAR T lymfocyty jsou také testovány u nehematologických malignit, např. neuroblastomu, ovariálního karcinomu, renálního karcinomu nebo hepatocelulárního karcinomu. U solidních nádorů situaci komplikuje nádorové stroma a jeho mikroprostředí, které omezuje průnik CAR T lymfocytů do tumoru a znesnadňuje zde jejich přežívání i samotnou vazbu na nádorové buňky [29].
V roce 2017 byl americkým Úřadem pro kontrolu potravin a léčiv (U. S. Food and Drug Administration – FDA) schválen první komerčně vyráběný preparát CAR T lymfocytů – tisagenlecleucel. Jeho indikací je léčba R/R ALL u dětí a mladých dospělých < 25 let a relabovaného/refrakterního difuzního velkobuněčného B lymfomu (R/R difuzního velkobuněčného B lymfomu) dospělých. Další preparát, axicabtagene ciloleucel, byl nedlouho poté schválen pro léčbu R/R difuzního velkobuněčného B lymfomu dospělých. Oba léky jsou v zemích EU dostupné od srpna 2018.
Tyrozinkinázové inhibitory
Filadelfský chromozom (Ph chromozom) dávající podklad fúznímu genu BCR-ABL1 je přítomen u 20–25 % dospělých a 3 % dětských pacientů s ALL. Vyskytuje se téměř výhradně u B-prekurzorové linie ALL. Dříve byla Ph-pozitivní ALL (Ph+ ALL) variantou onemocnění s nejhorší prognózou. Tato situace se ale se zavedením TKI do léčebných režimů v roce 2001 zásadně změnila [30]. V současnosti jsou v ČR pro léčbu Ph+ ALL schváleny tři různé TKI (schéma 2).
Schéma 2. Tyrozinkinázové inhibitory v léčbě Ph+ akutní lymfoblastické leukemie. 
V našich podmínkách je standardem primoléčby mladších pacientů s Ph+ ALL přidání imatinibu k intenzivní CHT a po dosažení CR provedení allo-HCT. Přidání imatinibu k CHT zvýšilo u nemocných podstupujících allo-HCT počet dosažených CR na > 90 % a 5leté přežití bez progrese z 28–40 % na 43–63 % [31–33]. U starších nemocných je imatinib v rámci paliativní léčby podáván s redukovanou CHT nebo jen s pulzy kortikoidů. I tento typ léčby ale dokáže navodit poměrně dlouhé remise s mediánem OS až 20 měsíců [34].
Hlavním problémem dlouhodobé léčby imatinibem je klonální evoluce blastů a vznik nových mutací ve fúzním genu BCR-ABL1. Takto vzniklá populace blastů je pak na imatinib rezistentní a dává vznik relapsu choroby. Preparáty TKI druhé generace dokážou překonat velkou část mutací BCR-ABL1. Navíc inhibují i SRC kinázy, které rovněž hrají roli v patogenezi Ph+ ALL [35]. Další výhodou těchto léků je jejich schopnost překročit hematoencefalickou bariéru, a tím účinněji bránit relapsu v centrálním nervovém systému [36]. V ČR je z těchto preparátů v indikaci léčby R/R Ph+ ALL dostupný dasatinib. I v léčbě nově diagnostikovaných pacientů se zdá být účinnější než imatinib, CR byla dosažena u > 90 % pacientů, četnost eradikace MRD byla taktéž téměř 90 % [37–39]. Další dva zástupci TKI druhé generace nilotinib a bosutinib jsou používány spíše v léčbě chronické myeloidní leukemie. Oba tyto léky nemají v ČR schválenou indikaci k léčbě Ph+ ALL.
Častou mutací ABL1 domény je mutace T315I, která je rezistentní na léčbu imatinibem i všemi TKI druhé generace. Jediným účinným lékem je v této situaci ponatinib, zástupce třetí generace TKI. Ve studii fáze II dosáhli CR všichni nově diagnostikovaní pacienti léčení kombinací ponatinibu a intenzivní CHT, 78 % z nich bylo i MRD negativních a 3leté OS bylo 79 %. Nebyl statisticky významný rozdíl v OS mezi skupinou pacientů, kteří podstoupili allo-HCT s následnou udržovací léčbou ponatinibem, a kteří měli jen udržovací léčbu bez transplantace [40]. Výsledky této a následně i další podobné studie nasvědčují tomu, že by v budoucnu možná vůbec nebylo nutné při léčbě Ph+ ALL pomocí TKI vyšších generací provádění allo-HCT [41,42]. Tato lákavá domněnka však ještě vyžaduje potvrzení na větších souborech pacientů. Ponatinib je v ČR pro léčbu Ph+ ALL indikován ve 3. linii léčby při rezistenci nebo intoleranci dasatinibu nebo kdykoliv v průběhu léčby při průkazu mutace T315I.
V současnosti probíhá několik klinických studií fáze II a III hodnotících léčbu Ph+ ALL ponatinibem v kombinaci s intenzivní nebo redukovanou CHT, dále jsou testovány kombinace TKI s blinatumomabem, kombinace ponatinibu s venetoclaxem či zcela nové molekuly TKI/aurora inhibitorů s účinností proti mutaci T315I tozasertib, danusertib a HG-7-85-01 [43–47].
Zvláštním novým lékem z této skupiny je asciminib. Váže se na jiné místo BCR-ABL1 než ostatní TKI a má tak jiný profil účinnosti stran mutací této kinázy. Vykazuje vysokou specificitu proti mutaci T315I, avšak není účinný u některých jiných „běžných“ mutací [48].
Další inhibitory buněčných signálních drah
Recentně identifikovanou podskupinou B-ALL s nepříznivou prognózou a podobným profilem genové exprese jako Ph+ ALL je Ph-like ALL. Tyto leukemie se vyznačují defekty genů kináz signálních drah ABL1 a JAK/STAT (janus kinase / signal transducers and activators of transcription). Nejčastější aberace u Ph-like ALL jsou v genu CRLF2 a JAK2 [49]. U těchto případů se předpokládá účinnost JAK2 inhibitorů (ruxolitinib) používaných především u Ph-negativních chronických myeloproliferací. V současnosti probíhá studie fáze II s přidáním ruxolitinibu ke standardní CHT u nově diagnostikovaných pacientů.
Další potenciálně využitelnou skupinou léků zasahující do signálních buněčných drah jsou PI3K/mTOR inhibitory (fosfatidylinositol 3-kináza, mammalian target of rapamycin). Tyto kinázové dráhy jsou konstitutivně aktivovány až u 75 % případů T-ALL [50]. Preklinická data naznačují, že by léky z této skupiny mohly být u T-ALL účinné, obzvláště pak v kombinaci s cytostatiky. U R/R T-ALL probíhá několik klinických studií časných fází pro sirolimus, temsirolimus, everolimus, sapanisertib nebo BEZ235.
Jinou lékovou skupinou zkoušenou u ALL jsou inhibitory proteazomu (bortezomib) používané v léčbě mnohočetného myelomu. Díky schopnosti inhibovat signální dráhy NF-B (nuclear factor B) a Notch1, které jsou často aktivované u T-ALL, by tyto léky mohly najít léčebné uplatnění. V současnosti probíhají s bortezomibem u T-ALL studie fáze II a III.
Purinová analoga
Příchod nových monoklonálních protilátek s anti-CD19 a anti-CD22 aktivitou a CAR T lymfocytů výrazně zlepšil výsledky léčby R/R B-ALL. Buňky T lymfocytární linie však tyto antigeny neexprimují. Zatímco primoléčba je u obou linií ALL v podstatě stejná, nových léků využitelných při relapsu T-ALL je stále pomálu.
Již v roce 2007 byl pro léčbu R/R T-ALL schválen purinový analog nelarabin. V klinických studiích fáze II navodil CR u 31–36 % relabovaných pacientů, což bylo oproti historickým kontrolám s klasickou záchrannou CHT určité zlepšení [51,52]. Nelarabin byl testován i v kombinaci s dalšími cytostatiky, avšak cenou za vyšší účinnost bylo zvýraznění toxicity [53]. V ČR je nelarabin indikován k léčbě R/R T-ALL až po selhání standardní záchranné CHT.
Závěr
V posledních letech se portfolio léků pro ALL rozšířilo o několik nadějných kandidátů, z nichž některé je už dnes možno podávat pacientům nejen s R/R ALL, ale v rámci klinických studií i nově diagnostikovaným. Každý rok vstupují do klinického hodnocení další nové molekuly monoklonálních protilátek, imunokonjugátů a kinázových inhibitorů. Zcela novou skupinou léků jsou CAR T lymfocyty, které možná v nejbližších letech způsobí revoluci nejen v hematoonkologii, ale i v celé onkologii vůbec. S nadějí lze říci, že v léčbě R/R ALL se blýská na lepší časy.
Tato práce vznikla na Masarykově univerzitě v rámci projektu „Nové přístupy ve výzkumu, diagnostice a terapii hematologických malignit VI“, číslo MUNI/A/1105/2018 podpořeného z prostředků účelové podpory na specifický vysokoškolský výzkum, kterou poskytlo MŠMT v roce 2019.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Štěpán Hrabovský
Interní hematologická a onkologická klinika LF MU a FN Brno
Jihlavská 20 625 00 Brno
e-mail: hrabovsky.stepan@fnbrno.cz
Obdrženo: 28. 8. 2018
Přijato: 10. 1. 2019
Zdroje
1. Bassan R, Hoelzer D. Modern therapy of acute lymphoblastic leukemia. J Clin Oncol 2011; 29 (5): 532–543. doi: 10.1200/JCO.2010.30.
2. Ustwani OA, Gupta N, Bakhribah H et al. Clinical updates in adult acute lymphoblastic leukemia. Crit Rev Oncol Hematol 2016; 99 : 189–199. doi: 10.1016/j.critrevonc.2015.12.007.
3. Cole, CH. Lessons from 50 years of curing childhood leukaemia. J Paediatr Child Health 2015; 51 (1): 78–81. doi: 10.1111/jpc.12803.
4. Šálek C, Šponerová D, Soukupová et al. Akutní lymfoblastová leukemie: historie a současnost. Vnitr Lek 2012; 58 (Suppl 2): 20–26.
5. Faderl S, O’Brien S, Pui CH et al. Adult acute lymphoblastic leukemia: concepts and strategies. Cancer 2010; 116 (5): 1165–1176. doi: 10.1002/cncr.24862.
6. O’Brien S, Thomas DA, Ravandi F et al. Results of the hyperfractionated cyclophosphamide, vincristine, doxorubicin, and dexamethasone regimen in elderly patients with acute lymphocytic leukemia. Cancer 2008; 113 (8): 2097–2101. doi: 10.1002/cncr.23819.
7. Folber F, Hadrabová M, Hrabovský Š et al. Acute lymphoblastic leukemia in the elderly: a tough one. Haematologica 2013; 98 (Suppl 1): 498–499.
8. Klinger M, Brandl C, Zugmaier G et al. Immunopharmacologic response of patients with B-lineage acute lymphoblastic leukemia to continuous infusion of T-cell-engaging CD19/CD3-bispecific BiTE antibody blinatumomab. Blood 2012; 119 (26): 6226–6233. doi: 10.1182/blood-2012-01-400515.
9. Kantarjian H, Stein A, Gökbuget N et al. Blinatumomab versus chemotherapy for advanced acute lymphoblastic leukemia. N Engl J Med 2017; 376 (9): 836–847. doi: 10.1056/NEJMoa1609783.
10. Martinelli G, Boissel N, Chevallier P et al. Complete hematologic and molecular response in adult patients with relapsed/refractory philadelphia chromosome-positive B-precursor acute lymphoblastic leukemia following treatment with blinatumomab: results from a phase II, single-arm, multicenter study. J Clin Oncol 2017; 35 (16): 1795–1802. doi: 10.1200/JCO.2016.69.3531.
11. Raetz EA, Cairo MS, Borowitz MJ et al. Re-induction chemoimmunotherapy with epratuzumab in relapsed acute lymphoblastic leukemia (ALL): phase II results from Children’s Oncology Group (COG) study ADVL04P2. Pediatr Blood Cancer 2015; 62 (7): 1171–1175. doi: 10.1002/pbc.25454.
12. Advani AS, McDonough S, Coutre S et al. SWOG S0910: a phase 2 trial of clofarabine/cytarabine/epratuzumab for relapsed/refractory acute lymphocytic leukaemia. Br J Haematol 2014; 165 (4): 504–509. doi: 10.1111/bjh.12 778.
13. Poirot L, Philip B, Schiffer-Mannioui C et al. Multiplex genome-edited T-cell manufacturing platform for „off-the-shelf“ adoptive T-cell immunotherapies. Cancer Res 2015; 75 (18): 3853–3864. doi: 10.1158/0008-5472.CAN-14-3321.
14. Kantarjian HM, DeAngelo DJ, Stelljes M et al. Inotuzumab ozogamicin versus standard therapy for acute lymphoblastic leukemia. N Engl J Med 2016; 375 (8): 740–753. doi: 10.1056/NEJMoa1509277.
15. Jabbour E, Sasaki K, Ravandi F et al. Chemoimmunotherapy with inotuzumab ozogamicin combined with mini-hyper-CVD, with or without blinatumomab, is highly effective in patients with Philadelphia chromosome-negative acute lymphoblastic leukemia in first salvage. Cancer 2018; 124 (20): 4044–4055. doi: 10.1002/cncr.31 720.
16. Kantarjian H, Ravandi F, Short NJ et al. Inotuzumab ozogamicin in combination with low-intensity chemotherapy for older patients with Philadelphia chromosome-negative acute lymphoblastic leukaemia: a single-arm, phase 2 study. Lancet Oncol 2018; 19 (2): 240–248. doi: 10.1016/S1470-2045 (18) 30011-1.
17. Monjezi R, Miskey C, Gogishvili T et al. Enhanced CAR T-cell engineering using non-viral Sleeping Beauty transposition from minicircle vectors. Leukemia 2017; 31 (1): 186–194. doi: 10.1038/leu.2016.180.
18. Zhao Y, Moon E, Carpenito C et al. Multiple injections of electroporated autologous T-cells expressing a chimeric antigen receptor mediate regression of human disseminated tumor. Cancer Res 2010; 70 (22): 9053–9061. doi: 10.1158/0008-5472.CAN-10-2880.
19. Park JH, Geyer MB, Brentjens RJ. CD19-targeted CAR T-cell therapeutics for hematologic malignancies: interpreting clinical outcomes to date. Blood 2016; 127 (26): 3312–3320. doi: 10.1182/blood-2016-02-629063.
20. Chmielewski M, Hombach AA, Abken H. Of CARs and TRUCKs: chimeric antigen receptor (CAR) T-cells engineered with an inducible cytokine to modulate the tumor stroma. Immunol Rev 2014; 257 (1): 83–90. doi: 10.1111/imr.12125.
21. Kellner C, Günther A, Humpe A et al. Enhancing natural killer cell-mediated lysis of lymphoma cells by combining therapeutic antibodies with CD20-specific immunoligands engaging NKG2D or NKp30. Oncoimmunology 2015; 5 (1): e1058459. doi: 10.1080/2162402X.2015.1058459.
22. Maude SL, Frey N, Shaw PA et al. Chimeric antigen receptor T-cells for sustained remissions in leukemia. N Engl J Med 2014; 371 (16): 1507–1517. doi: 10.1056/NEJMoa1407222.
23. Davila ML, Riviere I, Wang X et al. Efficacy and toxicity management of 19-28z CAR T-cell therapy in B-cell acute lymphoblastic leukemia. Sci Transl Med 2014; 6 (224): 224ra25. doi: 10.1126/scitranslmed.3008226.
24. Luskin MR, DeAngelo DJ. Chimeric antigen receptor therapy in acute lymphoblastic leukemia clinical practice. Curr Hematol Malig Rep 2017; 12 (4): 370–379. doi: 10.1007/s11899-017-0394-x.
25. Porter DL, Levine BL, Kalos M et al. Chimeric antigen receptor-modified T-cells in chronic lymphoid leukemia. N Engl J Med 2011; 365 (8): 725–733. doi: 10.1056/NEJMoa1103849.
26. Porter DL, Hwang WT, Frey NV et al. Chimeric antigen receptor T-cells persist and induce sustained remissions in relapsed refractory chronic lymphocytic leukemia. Sci Transl Med 2015; 7 (303): 303ra139. doi: 10.1126/scitranslmed.aac5415.
27. Neelapu SS, Locke FL, Bartlett NL et al. Axicabtagene ciloleucel CAR T-cell therapy in refractory large B-cell lymphoma. N Engl J Med 2017; 377 (26): 2531–2544. doi: 10.1056/NEJMoa1707447.
28. Schuster SJ, Svoboda J, Chong EA et al. Chimeric antigen receptor T-cells in refractory B-cell lymphomas. N Engl J Med 2017; 377 (26): 2545–2554. doi: 10.1056/NEJMoa1708566.
29. Long KB, Young RM, Boesteanu AC et al. CAR T-cell therapy of non-hematopoietic malignancies: detours on the road to clinical success. Front Immunol 2018; 9 : 2740. doi: 10.3389/fimmu.2018.02740.
30. Short NJ, Kantarjian H, Jabbour E et al. Which tyrosine kinase inhibitor should we use to treat Philadelphia chromosome-positive acute lymphoblastic leukemia? Best Pract Res Clin Haematol 2017; 30 (3): 193–200. doi: 10.1016/j.beha.2017.05.001.
31. Fielding AK, Rowe JM, Richards SM et al. Prospective outcome data on 267 unselected adult patients with Philadelphia chromosome-positive acute lymphoblastic leukemia confirms superiority of allogeneic transplantation over chemotherapy in the pre-imatinib era: results from the International ALL Trial MRC UKALLXII/ECOG2993. Blood 2009; 113 (19): 4489–4496. doi: 10.1182/blood-2009-01-199380.
32. Daver N, Thomas D, Ravandi F et al. Final report of a phase II study of imatinib mesylate with hyper-CVAD for the front-line treatment of adult patients with Philadelphia chromosome-positive acute lymphoblastic leukemia. Haematologica 2015; 100 (5): 653–661. doi: 10.3324/haematol.2014.118588.
33. Jabbour E, Pui CH, Kantarjian H. Progress and innovations in the management of adult acute lymphoblastic leukemia. JAMA Oncol 2018; 4 (10): 1413–1420. doi: 10.1001/jamaoncol.2018.1915.
34. Vignetti M, Fazi P, Cimino G et al. Imatinib plus steroids induces complete remissions and prolonged survival in elderly Philadelphia chromosome-positive patients with acute lymphoblastic leukemia without additional chemotherapy: results of the Gruppo Italiano Malattie Ematologiche dell’Adulto (GIMEMA) LAL0201-B protocol. Blood 2007; 109 (9): 3676–3678. doi: 10.1182/blood-2006-10-052746.
35. Hu Y, Liu Y, Pelletier S et al. Requirement of Src kinases Lyn, Hck and Fgr for BCR-ABL1-induced B-lymphoblastic leukemia but not chronic myeloid leukemia. Nat Genet 2004; 36 (5): 453–461. doi: 10.1038/ng1343.
36. Porkka K, Koskenvesa P, Lundan T et al. Dasatinib crosses the blood-brain barrier and is an efficient therapy for central nervous system Philadelphia chromosome-positive leukemia. Blood 2008; 112 (4): 1005–1012. doi: 10.1182/blood-2008-02-140665.
37. Ravandi F, Othus M, O’Brien SM et al. US Intergroup study of chemotherapy plus dasatinib and allogeneic stem cell transplant in Philadelphia chromosome positive ALL. Blood Adv 2016; 1 (3): 250–259. doi: 10.1182/bloodadvances.2016001495.
38. Ravandi F, O’Brien SM, Cortes JE et al. Long-term follow-up of a phase 2 study of chemotherapy plus dasatinib for the initial treatment of patients with Philadelphia chromosome-positive acute lymphoblastic leukemia. Cancer 2015; 121 (23): 4158–4164. doi: 10.1002/cncr.29646.
39. Slayton WB, Schultz KR, Kairalla JA et al. Dasatinib plus intensive chemotherapy in children, adolescents, and young adults with Philadelphia chromosome-positive acute lymphoblastic leukemia: results of Children’s Oncology Group trial AALL0622. J Clin Oncol 2018; 36 (22): 2306–2314. doi: 10.1200/JCO.2017.76.7228.
40. Jabbour E, Kantarjian H, Ravandi F et al. Combination of hyper-CVAD with ponatinib as first-line therapy for patients with Philadelphia chromosome-positive acute lymphoblastic leukaemia: a single-centre, phase 2 study. Lancet Oncol 2015; 16 (15): 1547–1555. doi: 10.1016/S1470-2045 (15) 00207-7.
41. Nicolini FE, Basak GW, Kim DW et al. Overall survival with ponatinib versus allogeneic stem cell transplantation in Philadelphia chromosome-positive leukemias with the T315I mutation. Cancer 2017; 123 (15): 2875–2880. doi: 10.1002/cncr.30558.
42. Jabbour E, DerSarkissian M, Duh MS et al. Efficacy of ponatinib versus earlier generation tyrosine kinase inhibitors for front-line treatment of newly diagnosed Philadelphia-positive acute lymphoblastic leukemia. Clin Lymphoma Myeloma Leuk 2018; 18 (4): 257–265. doi: 10.1016/j.clml.2018.02.010.
43. Assi R, Kantarjian H, Short NJ et al. Safety and efficacy of blinatumomab in combination with a tyrosine kinase inhibitor for the treatment of relapsed Philadelphia chromosome-positive leukemia. Clin Lymphoma Myeloma Leuk 2017; 17 (12): 897–901. doi: 10.1016/j.clml.2017.08.101.
44. Giles FJ, Swords RT, Nagler A et al. MK-0457, an Aurora kinase and BCR-ABL inhibitor, is active in patients with BCR-ABL T315I leukemia. Leukemia 2013; 27 (1): 113–117. doi: 10.1038/leu.2012.186.
45. Borthakur G, Dombret H, Schafhausen P et al. A phase I study of danusertib (PHA-739358) in adult patients with accelerated or blastic phase chronic myeloid leukemia and Philadelphia chromosome-positive acute lymphoblastic leukemia resistant or intolerant to imatinib and/or other second generation c-ABL therapy. Haematologica 2015; 100 (7): 898–904. doi: 10.3324/haematol.2014.115279.
46. Weisberg E, Choi HG, Ray A et al. Discovery of a small-molecule type II inhibitor of wild-type and gatekeeper mutants of BCR-ABL, PDGFRalpha, Kit, and Src kinases: novel type II inhibitor of gatekeeper mutants. Blood 2010; 115 (21): 4206–4216. doi: 10.1182/blood-2009-11-251751.
47. Rossari F, Minutolo F, Orciuolo E. Past, present, and future of Bcr-Abl inhibitors: from chemical development to clinical efficacy. J Hematol Oncol 2018; 11 (1): 84. doi: 10.1186/s13045-018-0624-2.
48. Wylie AA, Schoepfer J, Jahnke W et al. The allosteric inhibitor ABL001 enables dual targeting of BCR-ABL1. Nature 2017; 543 (7647): 733–737. doi: 10.1038/nature21702.
49. Roberts KG, Morin RD, Zhang J et al. Genetic alterations activating kinase and cytokine receptor signaling in high-risk acute lymphoblastic leukemia. Cancer Cell 2012; 22 (2): 153–166. doi: 10.1016/j.ccr.2012.06.005.
50. Zhao WL. Targeted therapy in T-cell malignancies: dysregulation of the cellular signaling pathways. Leukemia 2010; 24 : 13–21. doi: 10.1038/leu.2009.223.
51. DeAngelo DJ, Yu D, Johnson JL et al. Nelarabine induces complete remissions in adults with relapsed or refractory T-lineage acute lymphoblastic leukemia or lymphoblastic lymphoma: Cancer and Leukemia Group B study 19801. Blood 2007; 109 (12): 5136–5142. doi: 10.1182/blood-2006-11-056754.
52. Gökbuget N, Basara N, Baurmann H et al. High single-drug activity of nelarabine in relapsed T-lymphoblastic leukemia/lymphoma offers curative option with subsequent stem cell transplantation. Blood 2011; 118 (13): 3504–3511. doi: 10.1182/blood-2011-01-329441.
53. Commander LA, Seif AE, Insogna IG et al. Salvage therapy with nelarabine etoposide, and cyclophosphamide in relapsed/refractory paediatric T-cell lymphoblastic leukaemia and lymphoma. Br J Haematol 2010; 150 (3): 345–351. doi: 10.1111/j.1365-2141.2010.08236.x.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2019 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
-
Všetky články tohto čísla
- Chromotripse – rozsáhlé chromozomové přestavby a jejich význam u onkologických onemocnění
- Vysoká hladina cirkulujících mikropartikulí u pacientů s BCR/ABL negativními myeloproliferativními chorobami – pilotní studie
- Gastrointestinální stromální tumory rekta – hodnocení dat národního registru s ohledem na využití v klinické praxi
- Gorlinov-Goltzov syndróm
- Extrémny prípad syndrómu rastúceho teratómu retroperitonea testikulárneho pôvodu – klinický management a efekt liečby
- Postižení jater po jedné dávce nivolumabu – kazuistika a přehled literatury
- Leptomeningeálne metastázy karcinómu prsníka liečené dvoma líniami intratekálnej chemoterapie – kazuistika
- IgG4 sklerozující cholangitida – zánět imitující nádor hlavy pankreatu a cholangiokarcinom
- Aktuality z odborného tisku
- Mezinárodní klasifikace nemocí pro onkologii integrovaná s histogenetickým modelem melanomu
- Přizpůsobení nutričních intervencí molekulární patofyziologii nádorové kachexie – jak vyřešit dlouhodobý problém
- Onkologie v obrazech
- Když pomáháme imunitnímu systému
- Léčba relabující/refrakterní akutní lymfoblastické leukemie dnes a zítra
- Oligometastatický karcinom prostaty
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Chromotripse – rozsáhlé chromozomové přestavby a jejich význam u onkologických onemocnění
- Gorlinov-Goltzov syndróm
- Oligometastatický karcinom prostaty
- Postižení jater po jedné dávce nivolumabu – kazuistika a přehled literatury
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



