-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Prevalence symptomů úzkosti a deprese a jejich vliv na kvalitu života u pacientů v paliativní onkologické léčbě – projekt PALINT
Prevalence of Anxiety and Depression and Their Impact on the Quality of Life of Cancer Patients Treated with Palliative Antineoplasic Therapy – Results of the PALINT Trial
Background: Anxiety, depression, and psychological distress are common syndromes of advanced cancer; all have a negative impact on overall quality of life. However, these symptoms are not monitored explicitly and they are managed only by pharmacotherapy. Given the complex etiology of these symptoms, this biomedical approach is inadequate and inefficient.
Materials and methods: Here, we present the results of a longitudinal assessment of distress, anxiety, and depression in a sample of 126 patients treated with palliative systemic therapy for advanced cancer in the PALINT trial. Symptoms and quality of life were assessed regularly using the Hospital Anxiety and Depression Scale (HADS) and The European Organisation for Research and Treatment of Cancer Quality of Life Questionnaire (EORTC QLQ-C30), respectively.
Results: The baseline prevalence of significant distress, anxiety, and depression was 32,6; 35,9; and 56,5%, respectively. A decreasing trend in the prevalence of distress and anxiety occurred after 2 and months – distress (19.4 and 16.3%), anxiety (20.9 and 16.3%), and depression (46.3 and 46.9%). However, these changes did not reach statistical significance. The presence of anxiety and depression correlated negatively with overall quality of life.
Conclusion: High rates of distress, anxiety, and depression are a strong argument for implementation of systematic screening for psychological distress, and for comprehensive psychosocial support for all patients with advanced cancer throughout the disease trajectory. The HADS questionnaire is a suitable tool for this type of screening.
This work was supported by the grant of Ministry of Health AZV 15-33590A.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Submitted: 3. 12. 2018
Accepted: 24. 3. 2019
Keywords:
palliative therapy – anxiety – depression
Autoři: L. Světláková 1; O. Sláma 1; M. Světlák 2; L. Pochop 1; J. Šedo 1; R. Alexandrová 1; O. Bílek 1; R. Vyzula 1
Působiště autorů: Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno 1; Ústav psychologie a psychosomatiky, LF MU, Brno 2
Vyšlo v časopise: Klin Onkol 2019; 32(3): 201-207
Kategorie: Původní práce
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amko2019201Souhrn
Východiska: Úzkost, deprese a psychologický distres jsou časté syndromy u pacientů v pokročilých stadiích nádorových nemocí. V kontrastu s tím však tyto symptomy explicitně nemonitorujeme a jejich management je většinou jen na úrovni farmakoterapie. Vzhledem ke komplexitě etiologie těchto symptomů je pouze biomedicínský přístup nedostatečný a neefektivní.
Materiál a metody: Prezentujeme výsledky longitudinálního hodnocení symptomů psychického distresu, úzkosti, deprese a pocitu kvality života vzešlé ze souboru 126 pacientů léčených paliativní protinádorovou léčbou v rámci studie PALINT. Psychické symptomy byly hodnoceny v pravidelných intervalech pomocí dotazníků Hospital Anxiety and Depression Scale (HADS); kvalita života byla hodnocena pomoci dotazníků The European Organisation for Research and Treatment of Cancer Quality of Life Questionnaire (EORTC QLQ-C30).
Výsledky: Na začátku paliativní onkologické léčby byly klinicky významné hodnoty psychického distresu zjištěny u 32,6 %, úzkost u 35,9 % a deprese u 56,5 % pacientů. Po 2 a 4 měsících lze sledovat trend v podobě poklesu prevalence distresu (19,4 a 16,3 %), úzkosti (20,9 a 16,3 %) a deprese (46,3 a 46,9 %). Tento rozdíl ale nedosáhl statistické významnosti. Přítomnost symptomů úzkosti a deprese signifikantně negativně korelovala s celkovým pocitem zdraví dle dotazníku kvality života.
Závěr: Vysoká prevalence úzkosti, deprese a distresu představuje silný argument pro zavedení plošného screeningu psychického distresu a systematické psychologické a psychosociální podpory pacientů v celém průběhu onkologické léčby. Dotazník HADS se pro účely screeningu jeví jako vhodný nástroj.
Klíčová slova:
paliativní léčba – úzkost – deprese
Úvod
Úzkost a deprese představují nejčastější psychiatrické symptomy u pacientů s onkologickým onemocněním. Studie, které využívaly strukturovaných psychiatrických interview, dokládají, že prevalence velké depresivní poruchy je u pacientů s pokročilým nádorovým onemocněním přibližně 15 % [1]. Studie, které využívaly sebeposuzovací škály, dokládají prevalenci příznaků stresu (např. úzkost, deprese, somatické obtíže jako nespavost, nervozita atd.) u 30–40 % pacientů v různém stupni vývoje nádorového onemocnění [2,3]. Klinická zkušenost a stejně tak citované studie v této oblasti jednoznačně dokládají, že neléčená úzkost a deprese nejen zhoršují celkovou kvalitu života [4], ale mají významný vliv na bolest [5] a další tělesné symptomy. Bylo také opakovaně navrženo a nepřímo prokázáno, že přetrvávající aktivace osy hypotalamus – hypofýza – kůra nadledvin (HPA osa) v reakci na chronický stres a také u deprese oslabuje imunitní odpověď a může přispívat k vývoji a progresi určitých typů nádorů [6]. Jestliže úzkost a deprese představují důležitý psychiatrický příznak, je monitorování, kontrola a léčba těchto příznaků zcela zásadní v celém průběhu onkologické léčby.
Paliativní péče (palliative care – PC) je v onkologii tradičně chápána jako přístup, který je indikován v pozdních stadiích nemoci po ukončení protinádorové terapie. V posledním desetiletí však vzrůstá evidence o pozitivním vlivu časného zahájení PC (early integration of palliative care – EPC) současně se standardní onkologickou léčbou [7]. V tomto kontextu začíná být PC chápána jako důsledná prevence a léčba všech symptomů ovlivňujících kvalitu života a utrpení, a to po celou dobu života s nevyléčitelnou nemocí, v průběhu protinádorové léčby i po jejím ukončení [8]. Výsledky četných studií opakovaně prokázaly, že EPC vede ke zlepšení kvality života, lepší kontrole symptomů, racionálnějšímu čerpání zdravotní péče a prodloužení života v lepší kvalitě [9,10]. EPC má pozitivní vliv i na pacientovy blízké a pečující. V kontrastu s tím z některých studií vyplývá, že léčba bolesti a ostatních symptomů není i přes současné možnosti dostatečná a velká část onkologických pacientů ve standardním módu onkologické péče zbytečně trpí [11,12]. Pro psychické symptomy platí podobné zásady jako pro symptomy tělesné. Adekvátní léčba všech symptomů a složek utrpení vyžaduje správné hodnocení, dostatek času a zkušeností. Zásadně důležitým faktorem pro stanovení plánu PC je pacientovo správné pochopení vlastního zdravotního stavu, tedy diagnózy, předpokládané prognózy a možného přínosu a rizik protinádorové léčby [5]. Řada studií naznačuje, že onkologové v rutinní praxi své pacienty o předpokládané prognóze neinformují nebo odhad délky přežití a přínosu protinádorové léčby výrazně nadhodnocují [13–17]. V tomto kontextu je stále aktuální otázka, do jaké míry má EPC vliv na kvalitu života pacientů a do jaké míry je tedy integrace EPC smysluplná a racionální.
Abychom mohli odpovědět na tuto stále aktuální otázku, byla realizována randomizovaná kontrolovaná studie s cílem ověřit, jaký vliv má integrace EPC formou pravidelné konzultace s lékařem specialistou na paliativní medicínu při standardní onkologické léčbě na kvalitu života pacientů a jejich příznaky úzkosti a deprese ve srovnání s pacienty, kteří podstupují standardní onkologickou léčbu. Předpokládáme, že pacienti, kteří podstupují EPC, budou mít vyšší kvalitu života a nižší úroveň celkového distresu ve srovnání s pacienty, kteří podstupují standardní onkologickou léčbu.
Soubor a metodika
Struktura studie
Do studie byli zařazeni dospělí pacienti s nově diagnostikovaným pokročilým nádorem plic, slinivky, žaludku, hlavy a krku a také pacienti, u kterých byla zahájena 1. linie nekurativní systémové protinádorové léčby, a dále také pacienti s kolorektálním karcinomem předléčení 2 liniemi systémové léčby s předpokládanou prognózou celkového přežití 12 měsíců. Všichni pacienti byli do studie zařazeni max. do 6 týdnů od zahájení paliativní systémové léčby. Možnost účasti ve studii byla pacientům nabídnuta jejich primárním ošetřujícím onkologem. V případě pacientova zájmu o účast ve studii byl pacient následně kontaktován koordinátorkou studie anebo jedním z lékařů paliativního týmu, kteří pacientovi podrobně vysvětlili účel a obsah studie. Pokud pacient s účastí souhlasil, byl následně randomizován v poměru 1 : 1 (počítačem generované zařazení) do intervenčního ramene (systematická PC + standardní onkologická péče) nebo do kontrolního ramene studie (standardní onkologická péče). Interval plánovaných konzultací s paliatrem v rámci intervenčního ramene studie byl 6–8 týdnů. Kromě tohoto plánovaného setkání zahrnovala péče v intervenčním rameni studie také možnost paliativního konzilia na žádost ošetřujícího onkologa nebo v případě potřeby na žádost pacienta či jeho blízkých. Obsahem konzultace s lékařem specialistou na paliativní medicínu byl kromě standardní léčby symptomů spojených s pokročilým nádorovým onemocněním také rozhovor o psychosociálních souvislostech pacientova onemocnění, o tom, jak nemoc zvládá, jaké jsou zdroje jeho sociální a spirituální podpory a také co snižuje pacientovu kvalitu života kromě zmíněných medicínských příznaků. První konzultace s lékařem specialistou na paliativní péči trvala v průměru 45 min, následné konzultace pak v průměru 20 min. V případě potřeby byla upravena farmakoterapie symptomů a někdy také doporučena konzultace s dalšími členy paliativního týmu (psycholog, kaplan, sociální pracovník). Primárním cílem studie bylo hodnocení kvality života a míry příznaků úzkosti a deprese u pacientů v obou ramenech studie, a to na začátku studie a pak po 2 a 4 měsících od randomizace. Sekundárními výstupy studie byly kvantitativní a kvalitativní hodnocení samotné protinádorové léčby v posledních 30 dnech života (farmakoterapie), doba přežití, frekvence využití hospicové péče a místo úmrtí. V době přípravy primárních výstupů pokračují někteří pacienti v léčbě v obou ramenech studie. Sekundární výstupy studie nejsou tedy ještě aktuálně dostupné.
Soubor
V období od 1. září 2015 do 31. prosince 2017 byla účast ve studii PALINT nabídnuta 156 pacientům, kteří splňovali zařazovací kritéria. S účastí ve studii souhlasilo 126 pacientů. Celkem 60 pacientů bylo zařazeno do intervenčního ramene, 66 pacientů do kontrolního ramene. Obě ramena byla srovnatelná z hlediska sociodemografických charakteristik a zastoupení jednotlivých diagnóz (tab. 1). Soubor dotazníků byl pacientům administrován v opakovaných intervalech po 6–8 týdnech. Dotazníky vyplňovali pacienti při hospitalizaci nebo po ambulantním ošetření za přítomnosti vyškolené zdravotní sestry, které se mohli zeptat na cokoli v případě nejasností při vyplňování. Vyplnění baterie trvalo přibližně 20 min.
Tab. 1. Popisná statistika výběrového souboru. 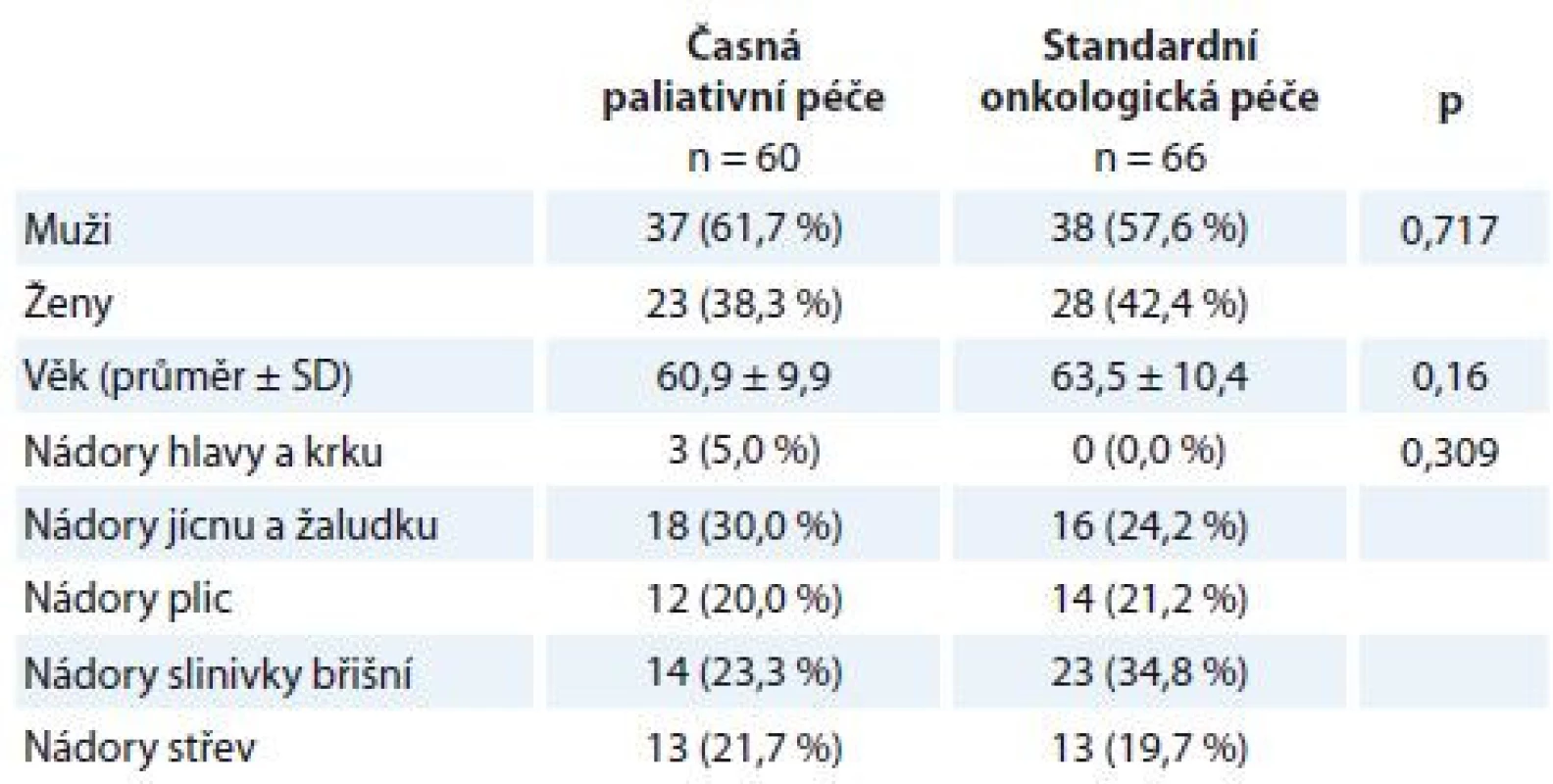
Kategoriální data jsou popsána jako absolutní a relativní frekvence. Věk je popsán jako průměr a směrodatná odchylka. Statistická významnost rozdílů mezi skupinami byla testována Fisherovým exaktním testem a párovým t-testem pro věk. SD – směrodatná odchylka Použité metody
Škála nemocniční úzkosti a deprese HADS
Škála HADS (Hospital Anxiety and Depression Scale) [18] sestává ze dvou subškál. Každá subškála má sedm položek. Subškála HADS-A (anxiety) měří příznaky úzkosti a subškála HADS-D (depression) pak příznaky deprese. Někdy se také používá celková škála HADS-T (total). HADS-T odráží také celkovou míru distresu [19]. Původně šlo o škálu, která měla kvantifikovat míru úzkosti a deprese u pacientů. Ukázalo se však, že její spolehlivost coby diagnostického nástroje je diskutabilní. Nejspolehlivěji funguje jako screeningová metoda a takto se také v medicínském prostředí používá nejčastěji. Nedávná metaanalýza Mitchella et al [19] dokládá, že HADS představuje spolehlivý screeningový nástroj s uspokojivou mírou specifity a senzitivity škály. Subškála deprese se zaměřuje na anhedonii bez přímého dotazování se na pokleslou náladu a dále se dotazuje na ztrátu zájmu a potěšení. Bodové normy jsou pro obě kategorie nejčastěji uváděny následovně: 0–7 bodů norma, 8–10 bodů hraničně abnormální pásmo, 11–21 bodů abnormální pásmo. Nejčastěji uváděné cut-off point pro jednotlivé subškály [19] jsou následující: HADS-T 15 bodů, HADS-D 8 bodů, HADS-A 8 bodů.
Dotazník kvality života EORTC QLQ-C30
Dotazník The European Organisation for Research and Treatment of Cancer Quality of life Questionnaire (EORTC QLQ-C30) [20] je třicetipoložkový sebeposuzovací dotazník, který se skládá z devíti subškál a šesti samostatných položek. Prvních pět subškál se zaměřuje na hodnocení úrovně fungování v oblasti fyzické, vztahové nebo rolové, emoční, kognitivní a sociální. Tři subškály se zaměřují na symptomy jako únava, bolest a nevolnost/zvracení. Poslední je pak dvoupoložková subškála celkového zdraví. Na ní pacient posuzuje svůj celkový stav pomocí sedmibodové škály, kde 1 znamená velmi špatné a 7 pak výborné. Každá položka je hodnocena na čtyřbodové škále: 1 vůbec ne, 2 trochu, 3 dost a 4 velmi hodně. Jednopoložkové subškály se pak dotazují na dušnost, nespavost, chuť k jídlu, zácpu, průjem, finanční potíže. Čím vyššího skóre pacient na škále dosáhne, tím horší jsou jeho příznaky a tím nižší je kvalita jeho života.
Statistická analýza dat
Statistická analýza získaných dat byla provedena v programu IBM SPSS verze 21. Kategoriální data byla popsána jako absolutní a relativní frekvence. Věk pacientů je popsán průměrem a směrodatnou odchylkou. Rozdíly mezi skupinami v četnosti pohlaví a diagnóz byly testovány Fisherovým exaktním testem, rozdíly ve věku byly testovány párovým t-testem a rozdíly ve škále celkového zdraví byly testovány Mann-Whitneyho U testem. Pro srovnání sledovaných proměnných v čase byl použit Wilcoxonův test. Abychom se vyhnuli riziku získání falešně pozitivních výsledků v důsledku problému násobného testování hypotéz, byla hladina významnosti stanovena na p = 0,008 (0,05/počet měření 6) dle Bonferroniho korekce. Hodnoty jsou popsány jako mediány a v závorkách jsou uvedeny minimální a maximální dosažené hodnoty. Rozdíly v míře úzkosti, deprese a celkového distresu jsou hodnoceny podle počtu pacientů, jejichž dosažené skóre bylo vyšší nebo rovno cut-off hranici škály. Vztah mezi skóre škály HADS a QLQ-C30 je vyjádřen Spearmanovou korelací.
Výsledky
Dynamika úzkosti a deprese
Statistické srovnání intenzity příznaků úzkosti a deprese měřené škálou HADS a pocitu celkového zdraví měřeného škálou EORTC QLQ-C30 mezi pacienty v časné paliativní péči a pacienty podstupujícími standardní onkologickou léčbu neprokázalo významné rozdíly mezi oběma skupinami (tab. 2 a 3). Významný rozdíl nebyl nalezen v žádném z opakovaných měření. Vzhledem k tomu, že se pacienti v obou ramenech studie od sebe neliší, další srovnání a korelační analýza byla provedena souhrnně pro všechny pacienty.
Tab. 2. Prevalence symptomů úzkosti a deprese dle HADS v intervenční a kontrolní skupině. 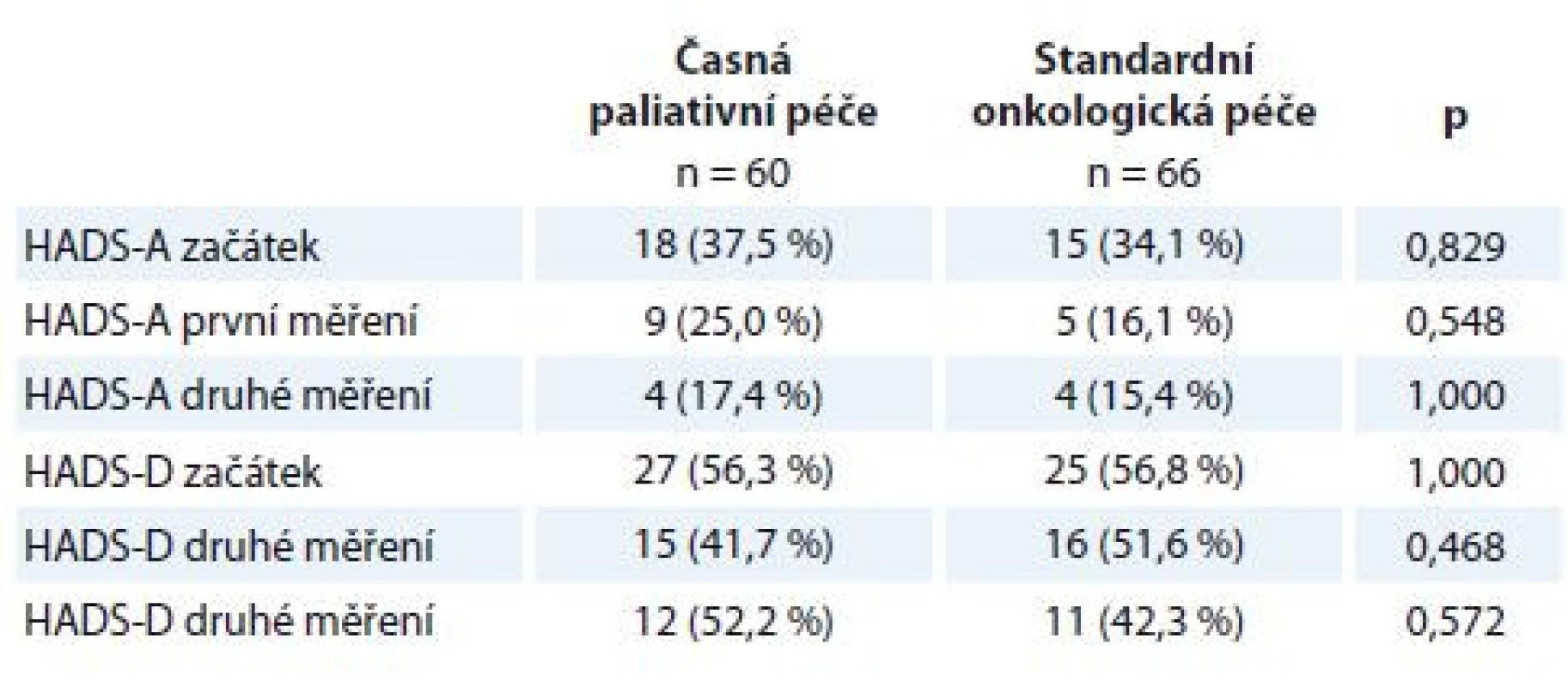
HADS-T (celkový skór; distres) cut-off 15 bodů, HADS-D (deprese) cut-off 8 bodů, HADS-A (úzkost) cut-off 8 bodů. Kategoriální data jsou popsána jako absolutní a relativní frekvence. Statistická významnost rozdílů mezi skupinami byla testována Fisherovým exaktním testem.
HADS – Hospital Anxiety and Depression ScaleTab. 3. Rozdíl mezi rameny studie v úrovni subjektivně hodnoceného celkového zdraví škálou EORTC QLQ-C30. 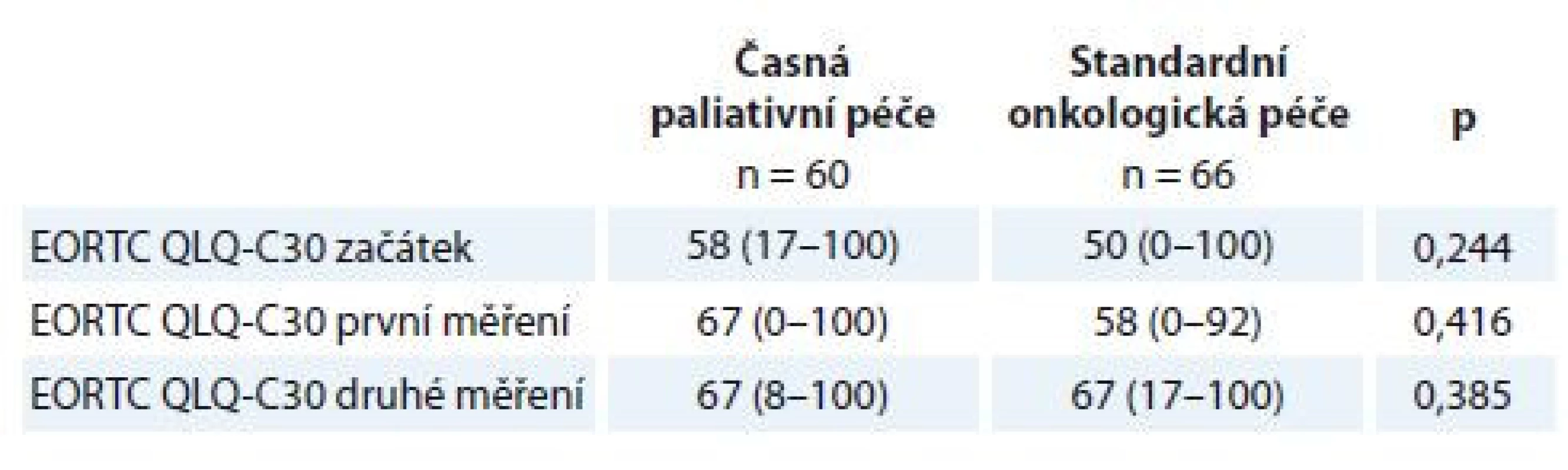
Proměnné jsou popsány mediánem a rozmezím naměřených výsledků (min. a max.). Statistická významnost rozdílů mezi skupinami byla testována Mann-Whitneho U testem.
EORTC QLQ-C30 – The European Organisation for Research and Treatment of Cancer Quality of Life QuestionnaireStatistické srovnání opakovaných měření škálou HADS u všech pacientů ve studii nedoložilo významné rozdíly ve střední hodnotě (medián) intenzity příznaků deprese, úzkosti a celkového distresu (tab. 4). Rovněž nebyly nalezeny žádné významné rozdíly v subjektivním hodnocení celkového zdraví měřené dotazníkem EORTC QLQ-C30 při opakovaných měřeních.
Tab. 4. Rozdíly v míře úzkosti a deprese při opakovaných měřeních. 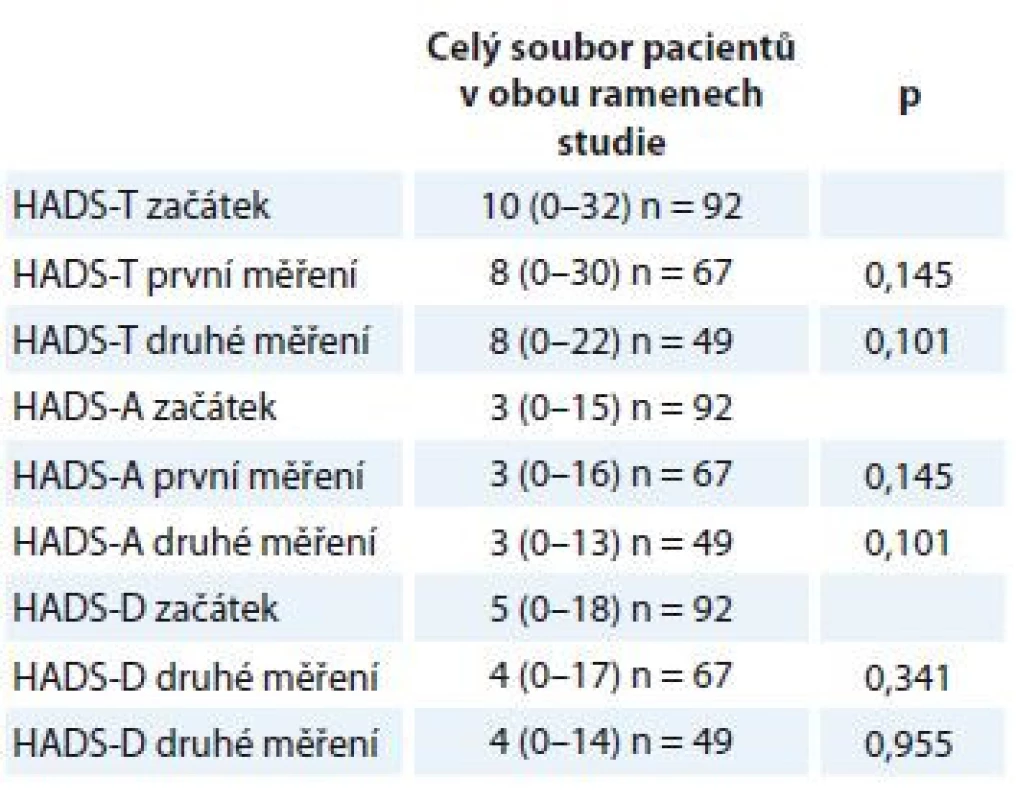
HADS-T (celkový skór; distres) cut-off 15 bodů, HADS-D (deprese) cut-off 8 bodů, HADS-A (úzkost) cut-off 8 bodů. Proměnné jsou popsány mediánem a rozmezím naměřených výsledků (min. a max.). Statistická významnost rozdílů mezi skupinami byla testována Wilcoxonovým párovým testem. HADS – Hospital Anxiety and Depression Scale Přestože střední hodnoty distresu, úzkosti a deprese zůstávaly pro celý soubor pacientů při opakovaných měřeních stejné, porovnání počtu pacientů, kteří dosáhli nebo překročili klinicky významné hodnoty (cut-off) na škále celkového distresu a subškálách pro úzkost a depresi, naznačuje rozdíly v jejich prevalenci v průběhu času (tab. 5). Na úrovni trendu lze pozorovat, že se počet osob s významnými příznaky distresu, úzkosti a deprese snižuje.
Tab. 5. HADS – Rozdíl v počtu pacientů v jednotlivých měřeních, kteří dosáhli nebo překročili cut-off škály, a subškál. 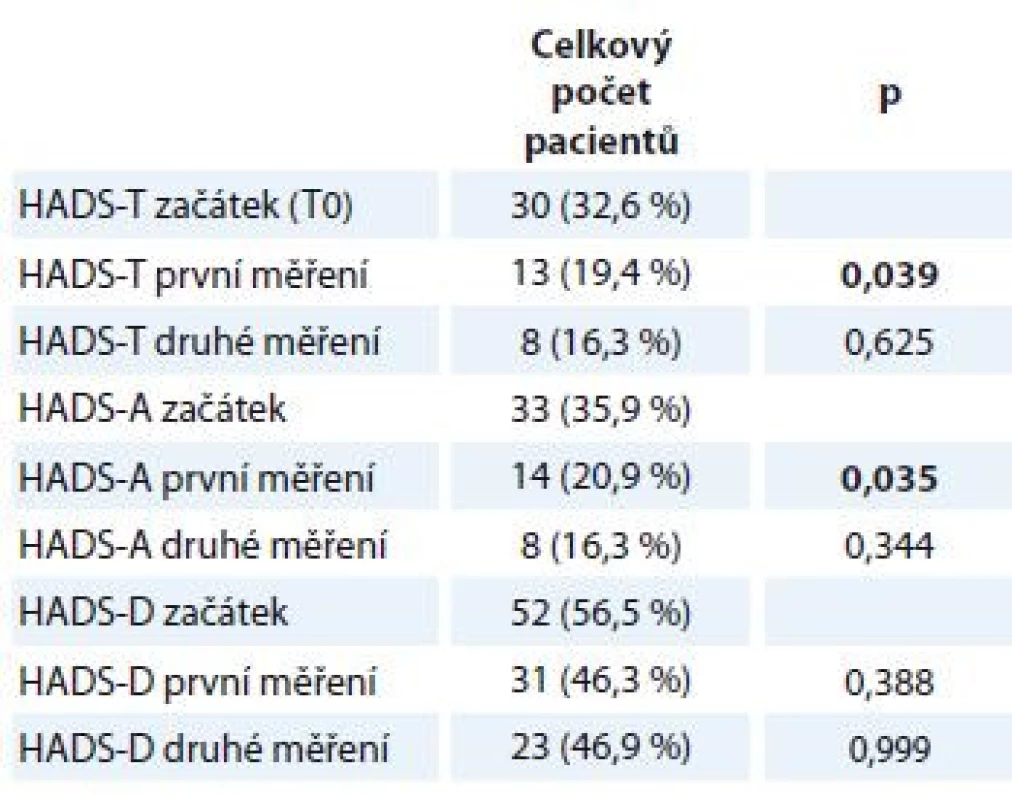
HADS-T (celkový skór; distres) cut-off 15 bodů, HADS-D (deprese) cut-off 8 bodů, HADS-A (úzkost) cut-off 8 bodů. Kategoriální data jsou popsána jako absolutní a relativní frekvence. Statistická významnost rozdílů mezi skupinami byla testována McNemarovým testem. HADS – Hospital Anxiety and Depression Scale Vztah úzkosti a deprese a celkové kvality života
Korelační analýza doložila významný vztah mezi mírou deprese a úzkosti měřených škálou HADS a celkovou úrovní subjektivně hodnoceného zdravotního stavu pacientů měřenou škálou EORTC QLQ-C30 (tab. 6). Výsledky dokládají, že čím více pacienti zažívají příznaky úzkosti a deprese, tím hůře hodnotí svůj celkový pocit fyzického zdraví.
Tab. 6. Korelace subškál HADS a QLQ-C30. 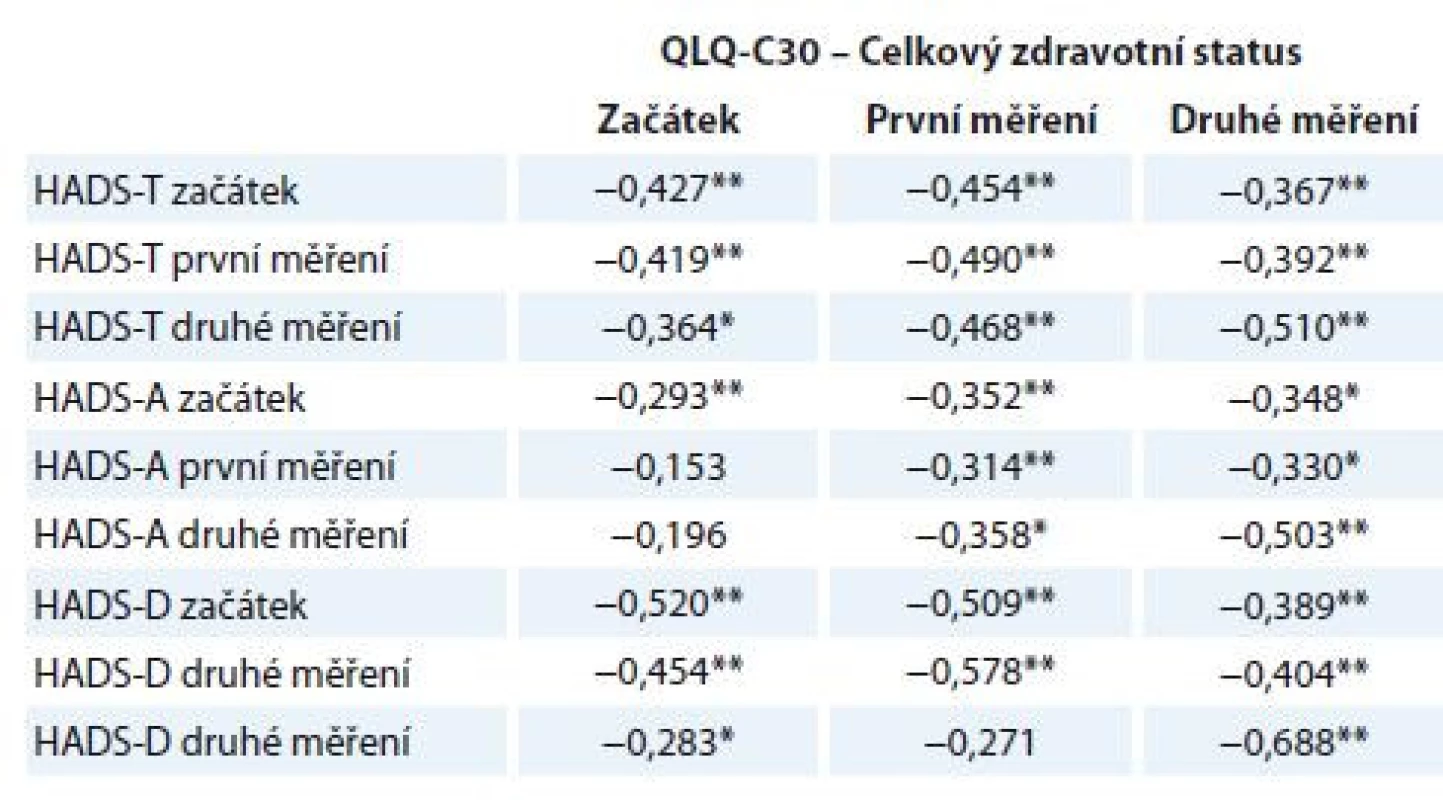
*p < 0,05; **p < 0,01. Korelace vypočítána jako Spearmanův korelační koefi cient. HADS – Hospital Anxiety and Depression Scale, EORTC QLQ-C30 – The European Organisation for Research and Treatment of Cancer Quality of Life Questionnaire, HADS-T – celkový skór; distres, HADS-D – deprese, HADS-A – úzkost Diskuze
Výsledky naší randomizované kontrolované studie neprokázaly předpokládaný významný rozdíl v míře příznaků úzkosti, deprese, celkového distresu a pocitu celkového zdraví mezi pacienty, u nichž byla integrována EPC jako součást standardní onkologické léčby, a těmi, kteří podstoupili standardní onkologickou léčbu. Nepodařilo se rovněž prokázat významné rozdíly ve sledovaných proměnných při opakovaných měřeních ve dvouměsíčních intervalech, tedy ne v mezích stanovené statistické významnosti. Přesto však výsledky stávající studie přinášejí důležité informace o prevalenci příznaků úzkosti, deprese a celkového distresu ve vybrané populaci pacientů s onkologickým onemocněním. Ukazuje se, že více než 30 % pacientů dosahuje na začátku léčby úrovně zvýšeného rizika pro rozvoj nebo přítomnost úzkostné nebo depresivní poruchy (distres 32,6 %, úzkost 35,9 %, deprese 56,5 %). V případě depresivních příznaků je to dokonce více než 50 % pacientů. Nalezen byl rovněž nenáhodný vztah mezi příznaky deprese, úzkosti a celkového distresu se subjektivně hodnocenou kvalitou života, resp. s hodnocením celkové úrovně zdraví.
Výsledky četných studií opakovaně dokládají, že EPC vede ke zlepšení kvality života, lepší kontrole symptomů, racionálnějšímu čerpání zdravotní péče a prodloužení života v lepší kvalitě a že má pozitivní vliv i na pacientovy blízké a pečující [9,10,12]. Tato zjištění jsou také v souhlasu s naší klinickou zkušeností. To, že naše výsledky neodpovídají zmíněným pozorováním, může odrážet fakt, že námi použité škály HADS a subškála celkového zdraví EORTC QLQ-C30 nejsou dostatečně senzitivní ke změnám, které jsme původně předpokládali. Lze očekávat, že rozdíly mezi jednotlivými rameny studie budou patrné až při srovnání samotné protinádorové léčby v posledních 30 dnech života (farmakoterapie), doby přežití, frekvence využití hospicové péče a místa úmrtí. Tyto další výstupy však nejsou vzhledem k pokračování studie aktuálně dostupné. Důležitým limitem studie je absence operacionalizované definice obsahu EPC provedené v paliativním rameni. PC v tomto rameni byla vymezena počtem konzultací, časem jejich trvání a tím, že rozhovor vedl specialista, paliatr. Nebylo však sledováno, co bylo obsahem těchto konzultací a zdali se lišily oproti konzultacím s onkology v rámci standardní onkologické léčby na odděleních a v ambulancích. Nevíme také, jak moc se pacienti odlišovali v míře znalostí o onemocnění a jeho prognóze. Nelze tedy v tuto chvíli jednoznačně posoudit, v čem se intervence z hlediska jejich obsahu přesně lišily.
Výsledky týkající se prevalence příznaků úzkosti, deprese a distresu ve vybrané populaci pacientů s onkologickým onemocněním odpovídají zjištěním i jiných autorů v této oblasti. Studie, které používaly sebeposuzovací škály, dokládají prevalenci příznaků stresu (např. úzkost, deprese, somatické obtíže jako nespavost, nervozita atd.) u 30 % pacientů v různé fázi nádorového onemocnění [2] a u 40 % a více pacientů pak uvádějí obtěžující psychické obtíže [3]. Zjištění, že příznaky deprese zůstávají na stejné úrovni, dokládají, že protrahovaný smutek, tak jak je definovaný škálou HADS, přetrvává u pacientů bez ohledu na léčbu a čas. Procento pacientů se zvýšenou intenzitou příznaků deprese, a tudíž zvýšeným rizikem pro rozvoj depresivní poruchy, je z našeho pohledu alarmující (téměř 50 % osob). Lze si představit, že adaptace se projevuje zejména jako pokles úzkosti a celkového distresu (pacienti vědí, co je čeká, mají větší kontrolu nad léčbou), zatímco příznaky deprese vyjadřují ztrátu životní jistoty a neřešitelnost situace. Výsledek z našeho pohledu jednoznačně dokládá, že management psychiatrických příznaků a zejména příznaků deprese představuje základní pilíř PC. Zjištění, že se subjektivně hodnocené příznaky úzkosti a deprese u některých pacientů při opakovaných měřeních nemění, odpovídá zjištěním, že i když dojde u pacientů k remisi onemocnění, referují o přetrvávající negativní emotivitě spojené se strachem z relapsu, popisují příznaky, které lze označit za posttraumatický stres, a dále pak také úzkost a depresi [21]. Tyto výsledky jen dokládají, jak významná je u vybraných pacientů psychoterapeutická a psychosociální podpora v průběhu celé léčby. Je také zřejmé, že opakovaný screening těchto příznaků by měl být nedílnou součástí každé kontroly u onkologa nebo paliatra.
Důležitost sledování příznaků deprese a úzkosti také podtrhuje další zjištění naší studie, a sice že míra úzkosti, deprese a distresu významně souvisí se subjektivně hodnocenou kvalitou života, resp. s hodnocením celkové úrovně zdraví. Korelační analýza samozřejmě nevysvětluje směr vztahu. Úzkost a deprese mohou zhoršovat celkový subjektivní pocit zdraví, ale může to být také naopak, tedy že dobrý management příznaků povede k poklesu úzkosti a deprese a distresu. Nejpravděpodobněji je tento vztah cirkulárně kauzální, tedy všechny příznaky se navzájem ovlivňují. Léčba jakéhokoli symptomu pak povede k ovlivnění ostatních symptomů.
Naše práce nepřímo dokládá, že screeningová metoda HADS představuje dostupný, jednoduchý, spolehlivý, pacienty nezatěžující a snadno vyhodnotitelný nástroj. Vzhledem k míře a frekvenci příznaků distresu u onkologických pacientů, které byly zjištěny v naší i jiných studiích, se nabízí otázka, zdali by použití screeningu úzkosti a deprese nemělo být standardní součástí kontroly u onkologa nebo paliatra, a to u všech pacientů a v různých fázích a modech léčby. Cílem není pacienty psychiatrizovat, nicméně se ukazuje, že klinické pozorování není vždy zcela spolehlivé. Například ve studii Söllnera et al [22] se ukázalo, že onkologové byli schopní rozpoznat závažný stres jen u 11 pacientů z 30, u kterých byl významný stres předem diagnostikován. Doporučení onkologů ohledně dalšího podpůrného poradenství nebo psychoterapie nekorelovalo se závažností prožívaného stresu pacientů, ale spíše s progresí onemocnění a větší otevřeností pacientů. Výsledky studie jen dokládají, jak je důležitá edukace onkologů v této oblasti, ale také skutečnost, že na klinický úsudek se v této oblasti nelze zcela spolehnout. O to častěji by mělo být indikováno psychologické nebo psychiatrické konzilium. To je ovšem ekonomicky a časově nemožné, a proto je třeba využívat standardizovaných sebeposuzovacích škál určených právě ke screeningu příznaků úzkosti a deprese. Ideální je takový nástroj, který je dostatečně senzitivní ke zmíněným příznakům, je snadno vyhodnotitelný samotným lékařem nebo zdravotní sestrou a zároveň příliš nezatíží pacienta.
Práce byla podpořena grantem MZ ČR AZV 15-33590A.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Obdrženo: 3. 12. 2018
Přijato: 24. 3. 2019
MUDr. Lucie Světláková
Klinika komplexní onkologické péče
Masarykův onkologický ústav
Žlutý kopec 7
65 653 Brno
e-mail: lucie.svetlakova@mou.cz
Zdroje
. Vodermaier A, Linden W, Siu C. Response: Screening for emotional distress in cancer patients: A systematic review of assessment instruments. J Natl Cancer Inst 2010; 102 (7): 508. doi: 10.1093/jnci/djq047.
2. Carlson LE, Angen M, Cullum J et al. High levels of untreated distress and fatigue in cancer patients. Br J Cancer 2004; 90 (12): 2297–2304. doi: 10.1038/sj.bjc.6601 887.
3. Grassi L, Sabato S, Rossi E et al. Use of the diagnostic criteria for psychosomatic research in oncology. Psychother Psychosom 2005; 74 (2): 100–107. doi: 10.1159/000083 168.
4. Anderkova L, Elfmarkova N, Sverak T et al. Change in quality of life measured over time in Czech women with breast cancer. Klin Onkol 2016; 29 (2): 113–121. doi: 10.14735/amko2016113.
5. Sochor M, Sláma O. Management of chronic and acute pain in patients with cancer diseases. Klin Onkol 2015; 28 (2): 94–98. doi: 10.14735/amko201594.
6. Reiche EMV, Nunes SOV, Morimoto HK. Stress, depression, the immune system, and cancer. Lancet Oncol 2004; 5 (10): 617–625. doi: 10.1016/S1470-2045 (04) 01 597-9.
7. Gaertner J, Wolf J, Voltz R. Early palliative care for patients with metastatic cancer. Curr Opin Oncol 2012; 24 (4): 357–362. doi: 10.1097/CCO.0b013e328352ea20.
8. Sochor M, Slama O, Loucka M. Early integration of palliative care into standard oncology care – benefits, limitations, barriers and types of palliative care. Klin Oncol 2015; 28 (3): 171–176. doi: 10.14735/amko2015171.
9. Parikh RB, Kirch RA, Smith TJ et al. Early specialty palliative care – translating data in oncology practice. N Engl J Med 2013; 369 (24): 2347–2351. doi: 10.1056/ NEJMsb1305469.
10. Šmíd D, Skalický T, Fichtl J et al. The influence of palliative chemotherapy on the quality of life of patients with gastric cancer. Klin Onkol 2016; 29 (4): 279–286. doi: 10.14735/amko2016279.
11. Von Roenn JH, Cleeland CS, Gonin R et al. Physician attitudes and practice in cancer pain management. A survey from the Eastern Cooperative Oncology Group. Ann Intern Med 1993; 119 (2): 121–126.
12. Breuer B, Fleishman SB, Cruciani SA et al. Medical oncologists’attitudes and practice in cancer pain management: a national survey. J Clin Oncol 2011; 29 (36): 4769–4775. doi: 13.1200/ JCO.2011.35.0561.
14. Mack JW, Wolfe J, Cook EF et al. Hope and prognostic disclosure. J Clin Oncol 2007; 25 (35): 5636–5642. doi: 10.1200/JCO.2007.12.6110.
15. Wright AA, Zhang B, Ray A et al. Associations between end-of-life discussions: patient mental health, medical care near death, and caregiver bereavement adjustments. JAMA 2008; 300 (14): 1665–1673. doi: 10.1001/ jama.300.14.1665.
16. Weeks JC, Catalano PJ, Cronin A et al. Patients’ expectations about eff ects of chemotherapy for advanced cancer. N Engl J Med 2012; 367 (17): 1616–1625. doi: 10.1056/ NEJMoa1204410.
17. Mack JW, Weeks JC, Wright AA et al. End-of-life discussions, goal attainment, and distress at the end of life: predictors and outcomes of receipt of care constistent with preferences. J Clin Oncol 2010; 28 (7): 1203–1208. doi: 10.1200/ JCO.2009.25.4672.
18. Zigmond AS, Snaith RP. The hospital anxiety and depression scale. Acta Psychiatr Scand 1983; 67 (6): 361–370. doi: 10.1111/j.1600-0447.1983.tb09716.x.
19. Mitchell AJ, Meader N, Symonds P. Diagnostic validity of the hospital anxiety and depression scale (HADS) in cancer and palliative settings: A meta-analysis. J Affect Disord 201; 126 (3): 335–348. doi: 10.1016/j.jad.2010.01. 067.
20. Aaronson NK, Ahmedzai S, Bergman B et al. The european organization for research and treatment of cancer QLQ-C30: A quality-of-life instrument for use in international clinical trials in oncology. J Natl Cancer Inst 1993; 85 (5): 365–376. doi: 10.1093/jnci/85.5. 365.
21. Yi JC, Syrjala KL. Anxiety and depression in cancer survivors. Med Clin North Am 2017; 101 (6): 1099–1113. doi: 10.1016/j.mcna.2017.06.005.
22. Söllner W, DeVries A, Steixner E et al. How successful are oncologists in identifying patient distress, perceived social support, and need for psychosocial counselling? Br J Cancer 2001; 84 (2): 179–185. doi: 10.1054/ bjoc.2000.1545.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2019 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Izolovaná hypertermická perfuze končetiny
- Asociace TNF-α -308G>A polymorfizmu s citlivostí na karcinom děložního čípku a prsu – systematický přehled a metaanalýza
- MikroRNA v mozkomíšním moku jako biomarkery u pacientů s nádory mozku
- Sledování prognózy HPV pozitivních a negativních orofaryngeálních karcinomů v závislosti na léčebné modalitě
- Nanočásticemi modifikovaný apoferritinový nanotransportér pro cílený transport cytostatik
- Prevalence symptomů úzkosti a deprese a jejich vliv na kvalitu života u pacientů v paliativní onkologické léčbě – projekt PALINT
- Rhabdomyosarkom gluteus maximus – kazuistika, přehled literatury a terapeutické cíle
- Neoadjuvantní užití hypertermické izolované perfuze končetiny v léčbě nediferencovaného vřetenobuněčného sarkomu dolní končetiny s dosažením kompletní patologické odpovědi
- Primární intrakraniální sarkomy, myxoidní meningeální sarkom – kazuistika a přehled literatury
- Osamelosť pacientov v predterminálnom a terminálnom štádiu nádorovej choroby, sociálny rozmer zomierania
- Současný FIGO staging karcinomu děložního hrdla a léčba jednotlivých stadií
- Kazuistika pacientky s prognosticky nepříznivým metastatickým kolorektálním karcinomem léčené trifluridin/tipiracilem – příklad úspěšné multioborové spolupráce
- Aktuality z odborného tisku
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Současný FIGO staging karcinomu děložního hrdla a léčba jednotlivých stadií
- Rhabdomyosarkom gluteus maximus – kazuistika, přehled literatury a terapeutické cíle
- Prevalence symptomů úzkosti a deprese a jejich vliv na kvalitu života u pacientů v paliativní onkologické léčbě – projekt PALINT
- Osamelosť pacientov v predterminálnom a terminálnom štádiu nádorovej choroby, sociálny rozmer zomierania
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



