-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Lymfo/plazmocytární infiltrace chemoterapií neovlivněných triple negativních karcinomů prsu – koreláty s morfologickými a klinicko-patologickými parametry
Tumor-Infiltrating Lymphocytes/Plasmocytes in Chemotherapeutically Non-Influenced Triple-Negative Breast Cancers – Correlation with Morphological and Clinico-Pathological Parameters
Background: Triple-negative breast cancers (TNBCs) are considered a morphologically heterogeneous group of breast carcinomas characterized by the absence or low protein expression of hormone receptors and HER2/neu/ERBB2 with a specific biological behavior and therapeutic response. This study aimed to evaluate correlations of the density of tumor-infiltrating lymphocytes/plasmocytes (TILs) in the tumor parenchyma, stroma, and invasive margins with tumor morphology, the proliferation rate, Bcl-2 expression, and selected clinical and pathological parameters in early breast cancer patients prior to mastectomy who had not received initial chemotherapy.
Materials and methods: Samples of 3,544 breast cancer patients investigated in our department between 2007 and 2017 were re-examined. In total, 413 (11.65%) patients were diagnosed with TNBC. Only 61 cases did not undergo neoadjuvant therapy prior to mastectomy. Correlations between the density of TILs and tumor morphology, Bcl-2 expression, proliferative activity measured by Ki-67, patient age at diagnosis, tumor grade, and metastases were investigated.
Results: The samples were predominantly relatively well-localized invasive carcinomas of no special type with medullary features (80.32%) that measured on average 13.4 mm (range 5–20 mm, median 15 mm) and exhibited central necrosis or fibrosis, a tendency to undergo spindle cell and/or apocrine-like differentiation, and intensive infiltration of TILs. There were significant positive correlations between TILs and premenopausal status (p=0.003), Ki-67 expression (p=0.015), and tumor grade (p=0.002), a marginal positive correlation between TILs and tumor size (p=0.065), and a significant negative correlation between TILs and Bcl-2 expression (p=0.035). In younger patients (< 50 years) with tumor size less than or equal to 20 mm (pT1a–pT1c) we recorded a lower number of women with metastatic lymph node involvement (p=0.001).
Conclusion: The density and location of TILs in non-therapeutically influenced TNBCs, evaluated in the context of morphological changes and other clinicopathological parameters, may have prognostic significance and assist effective therapy planning.
Keywords:
triple-negative breast neoplasms – malignant neoplasm of breast – Mastectomy – tumor morphology – tumor infiltrating lymphocytes – Bcl-2 – clinico-pathological parameters
Autoři: Markéta Kolečková 1; Zdeněk Kolář 1,2; Jiří Ehrmann 1; Gabriela Kořínková 1; Nora Zlámalová 3; Bohuslav Melichar 4; Radek Trojanec 2
Působiště autorů: Ústav klinické a molekulární patologie, LF UP a FN Olomouc 1; Ústav molekulární a translační medicíny, LF UP a FN Olomouc 2; I. chirurgická klinika LF UP a FN Olomouc 4 Onkologická klinika LF UP a FN Olomouc 3
Vyšlo v časopise: Klin Onkol 2019; 32(5): 380-387
Kategorie: Původní práce
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amko2019380Souhrn
Východiska: Triple negativní karcinomy prsu (triple-negative breast cancer – TNBC) jsou považovány za morfologicky a geneticky heterogenní skupinu karcinomů prsu charakterizovanou nízkou či nulovou expresí estrogenových i progesteronových receptorů, HER2/neu/ERBB2 proteinu, specifickým biologickým chováním a odpovědí na léčbu. Cílem naší práce bylo hodnocení intenzity lymfo/plazmocytární infiltrace (tumor-infiltrating lymphocytes/plasmocytes – TILs) v nádorovém parenchymu, jeho stromatu a v okolí invazivní fronty u časného karcinomu prsu bez předchozí chemoterapie a její korelace s morfologií nádoru, proliferační aktivitou, expresí Bcl-2 a dalšími vybranými klinicko-patologickými parametry.
Materiál a metody: Z celkového počtu 3 544 karcinomů prsu diagnostikovaných na našem pracovišti mezi lety 2007 a 2017 bylo 413 TNBC (11,65 %). Z toho jsme získali pouze 61 případů, které byly primárně léčeny chirurgicky a které neměly morfologii poškozenou chemoterapií. U nich jsme korelovali intenzitu infiltrace TILs s morfologií, expresí Bcl-2 proteinu, proliferační aktivitou měřenou expresí Ki-67, věkem pacientek, stupněm diferenciace (grade) a výskytem metastáz.
Výsledky: V našem souboru TNBC dominovaly invazivní karcinomy NST (no special type) s medulárními rysy (80,32 %), které formovaly poměrně dobře ohraničené léze průměrné velikosti 13,4 mm (rozmezí od 5 do 20 mm, medián 15 mm) s centrální nekrózou či fibrózou, často s vřetenobuněčnou transformací a/nebo alespoň v malém úseku s ložisky podobnými apokrinní diferenciaci a variabilně intenzivním TILs. V souboru se však vyskytly i nádory, jejichž morfologie není typická pro TNBC. Prokázali jsme statisticky významnou pozitivní korelaci infiltrace TILs s premenopauzálním stavem (p = 0,003), expresí Ki-67 (p = 0,015), gradem (p = 0,002), hraniční pozitivní korelaci s velikostí nádorů (p = 0,065) a statisticky významnou negativní korelaci s expresí proteinu Bcl-2 (p = 0,035). U mladších žen (do 50 let) s velikostí nádorů do 20 mm (pT1a–pT1c) jsme zaznamenali nižší počet případů s metastatickým postižením lymfatických uzlin (p = 0,001).
Závěr: Intenzita a lokalizace TILs infiltrace vyhodnocovaná v kontextu morfologických změn a dalších klinicko-patologických znaků u terapií neovlivněných TNBC může mít prognostický význam a poskytnout podklad pro plánování efektivnější terapie.
Klíčová slova:
triple negativní karcinomy prsu – zhoubný novotvar mléčné žlázy – mastektomie – morfologie nádoru – nádor infiltrující lymfocyty – Bcl-2 – klinicko-patologické parametry
Východiska
„Triple“ negativní karcinomy prsu (triple-negative breast cancer – TNBC) jsou považovány za morfologicky a geneticky heterogenní skupinu karcinomů charakterizovanou nízkou či nulovou expresí steroidních receptorů (estrogenový a progesteronový receptor) a HER2/neu/ERBB2 proteinu nebo absencí amplifikace HER2/neu/ERBB2 genu, se specifickým biologickým chováním [1]. Přestože jsou TNBC obecně považovány za chemosenzitivní nádory, setkáváme se u nich s odlišnou odpovědí na léčbu či dokonce primární a sekundární rezistencí [2]. TNBC reprezentují 10–20 % všech karcinomů prsu, jsou častější u žen před menopauzou, u žen s mutací genu BRCA 1/2 a relaps u nich zpravidla nastává v období kratším 5 let [3]. V minulosti bylo podle expresního profilu navrženo několik způsobů klasifikace TNBC. V roce 2010 bylo publikováno rozdělení na „basal-like“ variantu s expresí cytokeratinu 5/6 (CK 5/6) a receptoru pro epidermální růstový faktor (epidermal growth factor receptor – EGFR), variantu exprimující androgenové receptory (AR) a „claudin-low“ variantu s pozitivní expresí CD44 a negativitou antigenu CD24 [4]. O rok později Lehmann et al na základě genetického profilu rozsáhlého souboru TNBC, kromě skupiny s pozitivitou AR (LAR), dále rozčlenili „basal-like“ TNBC na typ 1 (BL1) a 2 (BL2) lišící se zvýšenou expresí Ki-67 u BL1 a p63 a CD10 u BL2. Následně rozšířil TNBC o podtyp mezenchymový, regulovaný signální dráhou zahrnující Rho, Wnt, ALK a TGF-, podtyp z multipotentních mezenchymových kmenových buněk asociovaný s epitelovo-mezenchymovou tranzicí, signální dráhou ERK1/2, inositol fosfátovým metabolizmem, expresí EGFR, destičkového a růstového faktoru a imunomodulační podtyp s významným podílem imunokompetentních buněk (pomocné CD4+ T lymfocyty, NK buňky, B lymfocyty, dentritické buňky) s produkcí interleukinů IL-12 a IL-7 [5]. Jedna z nejznámějších a nejjednodušších klasifikací potom dělí TNBC na skupiny „basal-like“ (BL) a „normal breast-like“ (NBL) podle zvýšené exprese CK 5/6 a EGFR ve skupině BL [6,7]. V porovnání s NBL bývá skupina BL charakterizována vyšší mitotickou aktivitou, nižším stupněm diferenciace, a tím i horší prognózou související s časným metastazováním do plic a centrálního nervového systému.
V současné době je chemoterapie považována za standardní systémovou léčebnou modalitu TNBC. Novým trendem však je získat a uvést do rutinní praxe nové terapeutické postupy založené na cíleném ovlivnění v patogenezi se uplatňujících molekul, jako jsou AR [8,9], EGFR [8,10], poly (ADP-ribóza) polymeráza (PARP) [8,11], vaskulární endotelový růstový faktor [8,12], různé mikroRNA [13] a příp. i dlouhé nekódující řetězce RNA [14]. Na významu rovněž nabývá i určení morfologie TNBC zejména ve spojitosti s expresí transmembránového glykoproteinu regulujícího programovanou buněčnou smrt 1 (PD-1), jeho ligandem PD-L1, antiapoptotickým proteinem Bcl-2 a intenzitou lymfocytárního infiltrátu [15]. V minulosti bylo prokázáno, že exprese Bcl-2 proteinu je u TNBC nezávislým prognostickým faktorem [16]. Přestože TNBC nejsou hormonálně dependentní nádory, exprese Bcl-2 proteinu může stratifikovat pacientky do různých prognostických skupin.
Cílem naší práce bylo proto zjistit, zda intenzita lymfocytárního infiltrátu může korelovat s morfologií, expresí Bcl-2, proliferační aktivitou hodnocenou na podkladě exprese Ki-67 a některými klinicko-patologickými parametry.
Materiál a metody
Z celkového počtu 3 544 karcinomů prsu diagnostikovaných v Ústavu klinické a molekulární patologie LF UP a FN Olomouc mezi lety 2007 a 2017 jsme vybrali 413 karcinomů prsu hodnocených jako TNBC (11,65 %). S ohledem na zachování kompletní morfologie nádorů jsme k detailní analýze zastoupených nádorových morfologií a lymfo/plazmocytárního infiltrátu (tumor-infiltrating lymphocytes/plasmocytes – TILs) v nádorovém parenchymu/stromatu a v okolí invazivních částí nádoru vybrali pouze případy TNBC získané z resekátů mléčné žlázy (kvadrantektomie, totální/subkutánní/kůži šetřící mastektomie). Z našeho souboru TNBC byly tedy vyřazeny nádory, u nichž jsme měli k dispozici pouze punkční vzorky, evidentní adenoidně cystické karcinomy, u kterých je negativita hormonálních receptorů a HER2/neu/ERBB2 popisována, a dále nádory, jejichž morfologie by mohla být pozměněná neoadjuvantní chemoterapií. Získali jsme tak 61 případů TNBC léčených primárně chirurgickým přístupem, tedy velikosti do 20 mm (pT1c). Soubor pacientek jsme rozdělili podle věku v době stanovení diagnózy, a to hranicí 50 let, na skupinu pacientek s velkou pravděpodobností premenopauzálních (< 50 let) a postmenopauzálních (≥ 50 let). U všech případů invazivních karcinomů prsu jsme revidovali histologický typ nádorů podle klasifikace Světové zdravotnické organizace (World Health Organization – WHO) [17], zaznamenávali přítomnost centrální nekrózy/fibrózy, ložiska podobná apokrinní diferenciaci (hodnoceno podle typické morfologie – objemnější eozinofilní nebo světlá granulární cytoplazma nádorových buněk) nebo vřetenobuněčné transformace, velikost nádoru v mm, věk pacientek v době diagnózy, grade, rozsah onemocnění (stage, pTNM klasifikace) a případný relaps onemocnění. Stupeň intenzity TILs v nádorovém parenchymu/stromatu a okolí invazivních partií jsme hodnotili škálou 1–4 (1 – TILs v méně než 10 % plochy uvnitř hranic nádoru a podél obvodu ložiska; 2 – TILs v 10–29 % plochy uvnitř hranic nádoru a podél obvodu ložiska; 3 – TILs v 30–60 % plochy uvnitř hranic nádoru a podél obvodu ložiska; 4 – TILs ve více než 60 % plochy uvnitř hranic nádoru a podél obvodu ložiska nádoru (modifikovaného podle dříve publikovaného doporučeného postupu) [15].
Expresi proteinu Bcl-2 jsme hodnotili ve čtyřech stupních: nádory s kompletní negativitou, nádory s nízkou (1–5 %), střední (6–60 %) či vysokou (> 60 %) expresí. Hodnota proliferačního indexu Ki-67 byla stanovena na základě procentuálního zastoupení pozitivních jader ve vzorku a posléze rozdělena na případy s nižší (do 30 %), střední (31–70 %) a vysokou jadernou expresí (> 70 %). Imunohistochemickým (IHC) vyšetřením byla stanovena exprese estrogenových a progesteronových receptorů, HER2/neu/ERBB2 proteinu, ukazatele proliferační aktivity (Ki-67) a Bcl-2 antigenu. Vybrány byly pouze vzorky s negativitou hormonálních receptorů, negativní expresí HER2/neu/ERBB2 proteinu (0, 1+) potvrzenou v případě hraničních výsledků fluorescenční in situ hybridizací (FISH).
IHC vyšetření byla provedena na formalínem fixovaných a do parafínu zalitých (FFPE) tkáních mléčné žlázy. Řezy o síle 5 µm byly deparafinizovány, antigenicita byla obnovena působením tepla 120 °C v mikrovlnné troubě po dobu 5 min v citrátovém pufru (pH 6,0). Aktivita endogenní peroxidázy byla blokována inkubací s blokovacím roztokem po dobu 10 min. Protilátky byly ředěny a inkubovány s tkáněmi způsobem uvedeným v tab. 1. Primární protilátky jsme vizualizovali podle protokolu výrobce s použitím sekundární protilátky Dako EnVision + Dual Link System HRP (Agilent Technologies, Inc., Santa Clara, CA, USA) a 3,3‘-diaminobenzidinu Liquid DAB + (Agilent Technologies, Inc., Santa Clara, CA, USA) pro manuální zpracování. Tkáňové řezy byly obarveny hematoxylinem, dehydratovány a montovány.
Tab. 1. Přehled imunohistochemického vyšetření – typ protilátky, výrobce, užité ředění. 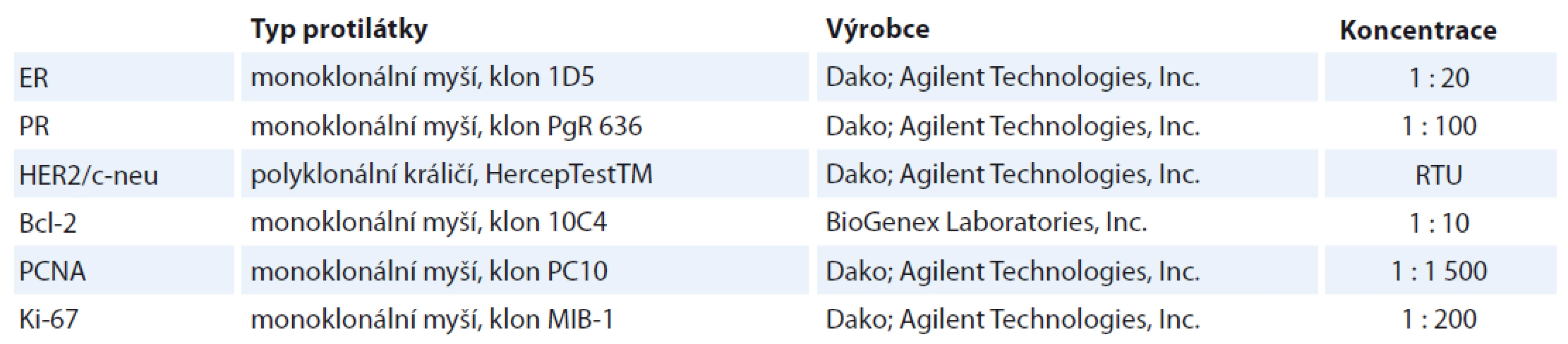
ER – estrogenový receptor, PR – progesteronový receptor, HER2 – humánní epidermální receptor 2, Bcl-2 – B-cell lymphoma 2, PCNA, Ki-67 – znaky proliferační aktivity, RTU – předředěná protilátka Počet kopií genu HER2/neu/ERBB2 a centromery chromozomu 17 byl detekován metodou FISH na opracovaných FFPE tkáních s použitím lokusově specifické sondy LSI HER2/neu/ERBB2 (Spectrum Orange™) a alfa-satelitní (centromerické) sondy CEP17 (Spectrum Green™; IntellMed, Ltd., Olomouc, ČR). Jako pozitivní výsledek byl podle doporučení ASCO/CAP (American Society of Clinical Oncology/College of American Pathologists) z roku 2007 považován průměrný počet kopií genu HER2/neu/ERBB2 > 6,0 a/nebo poměr HER2/chromozom 17 > 2,2. Karcinomy prsu s průměrem 4,0–6,0 a/nebo poměrem 1,8–2,2 byly hodnoceny jako hraničně pozitivní (nesplňují-li některou předchozí podmínku). Od roku 2013 jsou za pozitivní považovány pacientky s průměrným počtem kopií genu HER2/neu/ERBB2 > 6,0 a/nebo poměrem HER2/chromozom 17 > 2,0. Hraniční jsou případy s poměrem < 2,0 a průměrem 4,0–6,0. Při hodnocení bylo odečteno nejméně 100 nepřekrývajících se jader.
Korelace morfologických typů TNBC s intenzitou TILs v nádorovém parenchymu/stromatu a v okolí invazivních částí, expresí Bcl-2, Ki-67 a dalšími vybranými klinicko-patologickými znaky byla zpracována statistickým systémem IBM SPSS Statistics version 23.0 (IBM SPSS, Armonk, NY, USA). Korelace mezi dvěma ordinálními veličinami byla ověřena výpočtem Spearmanova korelačního koeficientu (r). Rozdíly mezi dvěma skupinami v ordinálních veličinách, které měly alespoň 4 stupně, byly ověřeny Mann-Whitneyovým U-testem. Rozdíly mezi dvěma skupinami v kvalitativních nominálních veličinách byly ověřeny Fisherovým přesným testem. Za statisticky významné výsledky jsme považovali hodnoty signifikance (p-value) < 0,05.
Výsledky
Charakteristika analyzovaného souboru
Průměrný věk pacientek v našem souboru TNBC byl 55,8 roku (rozmezí 28–82 let, medián 55 let). Metastatické postižení regionálních axilárních lymfatických uzlin bylo zaznamenáno u 11 případů (18,03 %), nádorová multifokalita potom u 7 případů (11,50 %). Velikost ložisek nádorů byla od 5 do 20 mm, průměrné velikosti 13,4 mm (medián 15 mm). Podle nejnovějšího vydání WHO klasifikace [17] byla většina TNBC definována jako invazivní karcinom NST (no special type) s medulárními rysy (49/61; 80,32 %) (obr. 1). V menším počtu byly nádory zastoupeny metaplastickým (7/61; 11,48 %) či medulárním karcinomem (2/61; 3,28 %), dále invazivním malobuněčným (1/61; 1,64 %) a překvapivě i ojediněle zastoupeným kribriformním (1/61; 1,64 %) a tubulárním (1/61; 1,64 %) karcinomem, jež jsou obvykle asociovány s expresí hormonálních receptorů a příznivější prognózou. Většina TNBC byla s centrální nekrózou či fibrózou (60/61; 98,36 %), u části potom okrsky s tendencí k vřetenobuněčné transformaci (29/61; 47,54 %) a apokrinní diferenciaci podobným ložiskům (32/61; 52,46 %). U 31,15 % (19/61) případů byla vřetenobuněčná transformace a apokrinní diferenciaci podobná ložiska přítomna současně. Jiný typ diferenciace, a to skvamózní či chondrogenní, jsme pozorovali u 8,20 % případů (5/61). U všech nádorů jsme mimo jiné pozorovali variabilně intenzivní kulatobuněčnou infiltraci, a to jak uvnitř nádoru vč. vazivového stromatu (obr. 2), tak i v okolí invazivních front (obr. 3). Tyto znaky byly porovnány s morfologií TNBC, menopauzálním stavem, věkem pacientek v době diagnózy, stupněm diferenciace (grade), velikostí nádoru, proliferační aktivitou měřenou pomocí Ki-67 a expresí Bcl-2.
Obr. 1. Ukázka typické morfologie karcinomů prsu našeho souboru. Barveno hematoxylinem a eozinem. 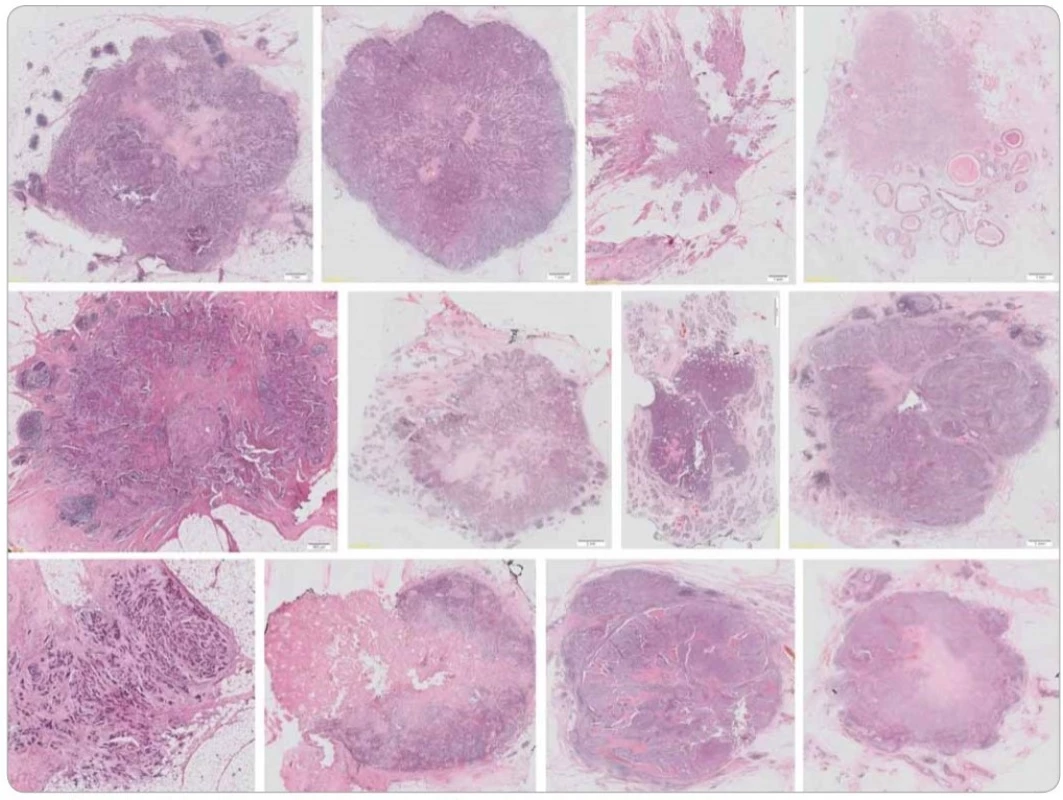
Obr. 2. Intratumorální lymfo/plazmocytární infi ltrace uvnitř hranic tumoru při okraji centrální fibrózy. Barveno hematoxylinem a eozinem. 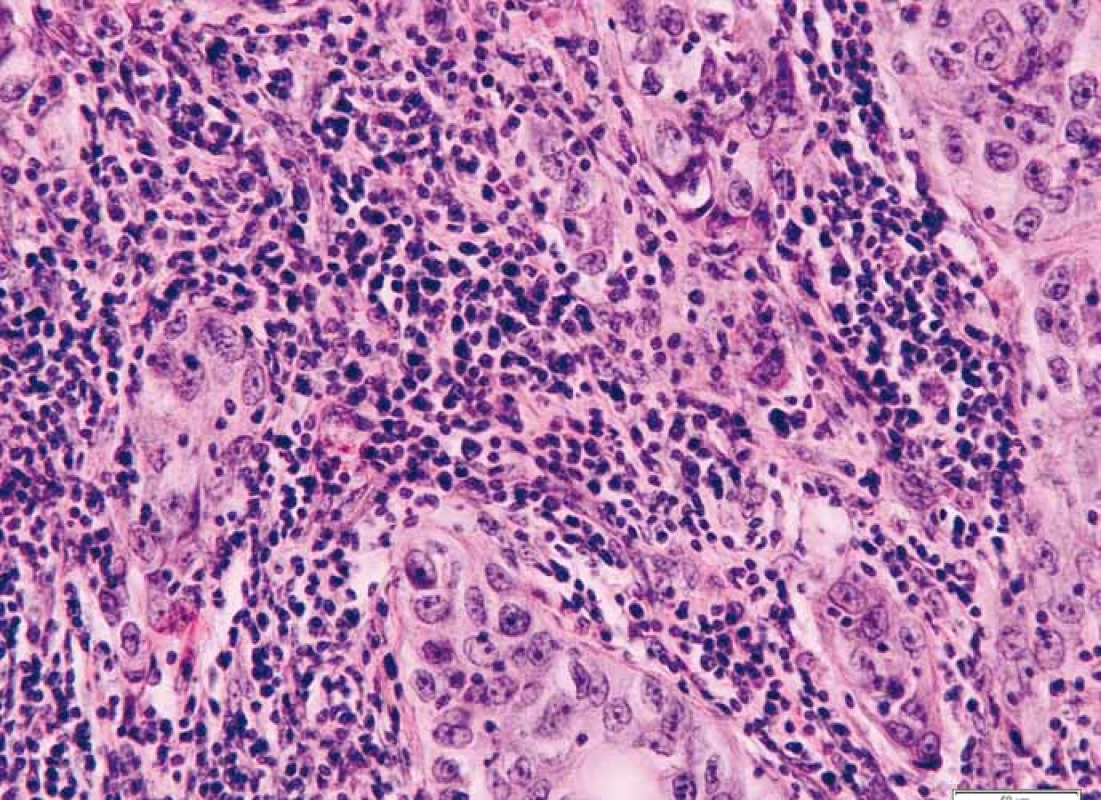
Obr. 3. Intenzivní lymfo/plazmocytární infiltrace v okolí invazivní fronty tumoru. Barveno hematoxylinem a eozinem. 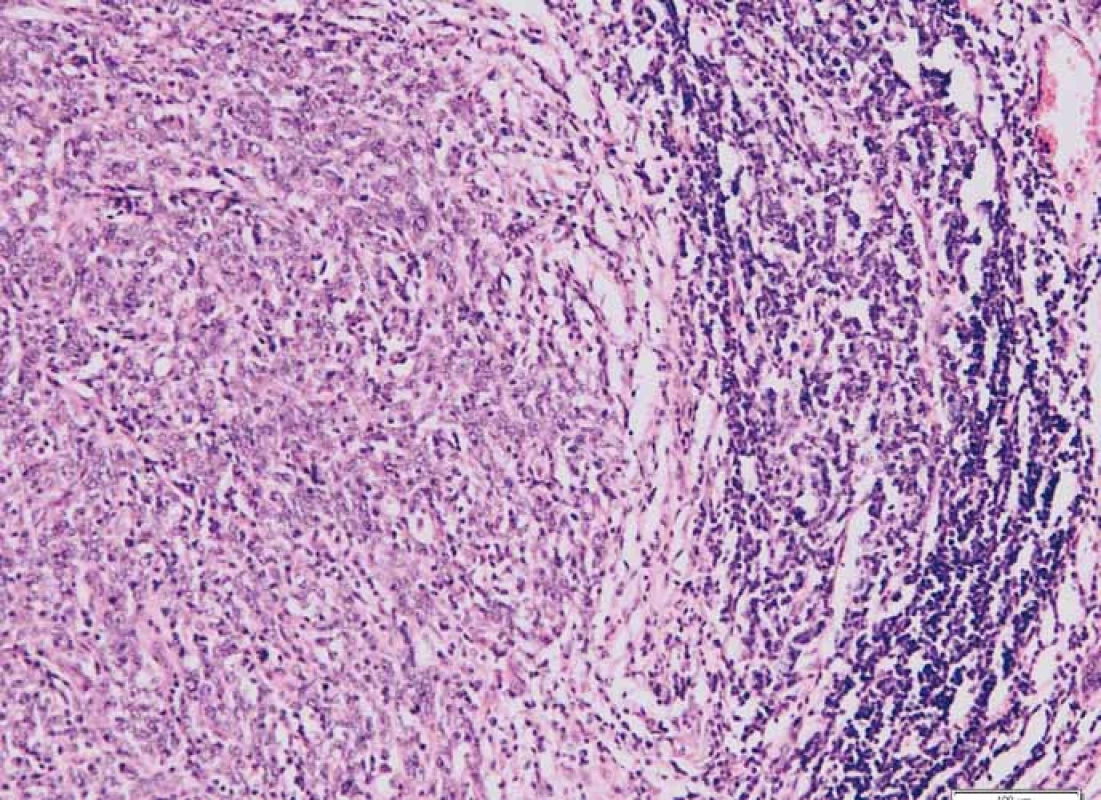
Vztah intenzity TILs k menopauzálnímu stavu, věku pacientek v době diagnózy a metastatickému potenciálu
U premenopauzálních žen mladších 50 let, kterých bylo v našem souboru 20 (32,8 %) jsme zaznamenali signifikantně vyšší intenzitu intratumorálního i frontálního TILs v porovnání s pacientkami staršími 50 let (p = 0,003). Mladší věk v době diagnózy byl rovněž asociován s nižším stupněm diferenciace (grade) a vysokou proliferační aktivitou měřenou expresí Ki-67. U mladších žen (< 50 let) s velikostí nádorů do 20 mm (pT1c) jsme zaznamenali signifikantně nižší počet případů s metastatickým postižením regionálních lymfatických uzlin (p = 0,001) v porovnání se skupinou žen postmenopauzálních.
Vztah intenzity TILs a stupně diferenciace nádoru
V naší populaci TNBC dominovaly převážně nádory s nízkým a středním stupněm diferenciace (grade 3, grade 2; 63,9 %, 26,2 %). Dobře diferencované nádory (grade 1) byly přítomny u 9,9 % případů. Statistickým zhodnocením jsme prokázali signifikantní pozitivní vztah mezi stupněm diferenciace (grade) a stupněm lymfo/plazmocytární celulizace (p = 0,002).
Vztah intenzity TILs a velikosti nádorů
Velikost nádorů v mm změřená v průběhu makroskopického popisu a zpracování vzorků byla verifikována na mikroskopické úrovni. Průměrná velikost nádorů v našem souboru TNBC byla 13,4 mm, s rozmezím od 5 do 20 mm. Pozorovali jsme tendenci k nárůstu intenzity lymfo/plazmocytární celulizace se zvyšující se velikostí nádoru (p = 0,065).
Vztah intenzity TILs a exprese Bcl-2
Kompletní negativita zjištěna u 57,40 %, nízká exprese u 3,30 %, střední u 16,40 % a vysoká u 22,90 % pacientek. Vysoká exprese Bcl-2 negativně korelovala s množstvím intratumorální i frontální TILs (p = 0,035).
Vztah intenzity TILs a proliferační aktivity Ki-67
Nižší proliferační aktivita byla zjištěna u 32,80 %, střední u 18,00 % a vysoká u 49,20 % pacientek. V našem souboru jsme prokázali pozitivní, statisticky významnou korelaci s množstvím TILs jak uvnitř nádoru, tak i v okolí jeho invazivní fronty (p = 0,015).
Vztah intenzity TILs a morfologie TNBC
TNBC se současně přítomnou ložiskovou vřetenobuněčnou a apokrinní transformací byly spojeny s intenzivnější infiltrací nádorového parenchymu/stromatu i invazivní fronty lymfo/plazmocyty (p = 0,005). Statisticky významné rozdíly v intenzitě lymfocytární infitrace nádoru mezi nádory se samotnou vřetenobuněčnou transformací či ložisky podobnými apokrinní diferenciaci prokázány nebyly (p = 0,413). Případy hodnocené jako metaplastické karcinomy se vyznačovaly nízkou intenzitou intratumorové infiltrace lymfo/plazmocyty a středně vysokou intenzitou infiltrace kolem frontálních struktur.
Diskuze
Dosud byla identifikována řada prognostických a prediktivních biomarkerů [8] vč. infiltrace TILs, které pomáhají stratifikovat pacientky s TNBC z hlediska různé odpovědi na terapii. Málo je však známo o intenzitě infiltrace nádoru lymfo/plazmocyty u neoadjuvantně neléčených TNBC. Je dokumentováno, že vyšší intenzita nádor infiltrujících lymfocytů a plazmocytů je asociována s přibližně 4krát silnější kompletní patologickou odpovědí [18]. S ohledem na věk, velikost a histologický typ nádoru, grade, expresi hormonálních receptorů, postižení lymfatických uzlin a použitou terapeutickou modalitu jsou nádor infiltrující lymfo/plazmocyty považovány za nezávislý prognostický ukazatel. V závislosti na distribuci populace lymfo/plazmocytů lze infiltrát v nádorech prsu rozdělit na intratumorální, tedy infiltrát v těsném kontaktu s vlastními nádorovými buňkami, dále infiltrát stromální a infiltrát v okolí invazivní fronty nádoru. Některé práce popisují, že pro pacientky mají prognosticky největší význam infiltrace stromatu a invazivní fronty nádoru [15]. Protože však v praxi je velmi těžké kvantifikovat počet buněk v přímém kontaktu s nádorovými buňkami odděleně od počtu buněk infiltrujících stroma nádoru, modifikovali jsme doporučený postup tak, že nerozlišujeme tyto dvě skupiny a kvantitativně hodnotíme počet lymfo/plazmocytů nacházejících se uvnitř hranic nádoru, zatímco infiltrace podél invazivní fronty leží mimo hranice nádoru. Existuje řada prací, které se zabývaly hodnocením TILs v karcinomech prsu ve vztahu k terapeutické odezvě i praktickým aspektům jejich objektivního vyhodnocení. Výsledkem je návrh standardizace těchto postupů [18,19]. Náš mírně modifikovaný a zjednodušující postup je v souladu s tímto návrhem, a navíc je rozšířen o hodnocení infiltrátu v okolí nádoru podle doporučení uvedeného v práci Polónia et al [20].
V našem souboru TNBC byl dominantně zastoupen invazivní karcinom NST s medulárními rysy řazený podle nejnovější WHO klasifikace [17] spolu s medulárním karcinomem a atypickým medulárním karcinomem do skupiny karcinomů s medulárními rysy, které jsou zpravidla asociovány s „triple“ negativním imunofenotypem. Oproti klasickému medulárnímu karcinomu, diagnostikovanému v méně než 1 % případů, nesplňuje invazivní karcinom NST s medulárními rysy všechna přesně definovaná kritéria (dobré ohraničení s expanzivním způsobem růstu, syncyciální morfologií ve více než 75 % plochy nádoru a velkým množstvím TILs nebo výrazný stupeň jaderné pleomorfie s četnými mitotickými figurami) a je v současnosti považován rovněž za prognosticky málo příznivou entitu. Morfologie invazivních karcinomů NST s medulárními rysy byla u našeho souboru pacientek s TNBC poměrně uniformní. Jednalo se vždy o relativně dobře ohraničené léze s centrální nekrózou či fibrózou, variabilní vřetenobuněčnou transformací nádorových buněk a/nebo ložisky podobnými apokrinní transformaci s poměrně intenzivní TILs. Popsaná morfologie globálně korelovala se střední až vysokou expresí Ki-67 a nižší expresí Bcl-2. Z literatury je však známo, že naopak vysoká exprese Bcl-2 je spolu s velikostí nádoru a postižením lymfatických uzlin nezávislým prediktorem kratšího období bez relapsu onemocnění, kratší doby přežívání specifického pro karcinom prsu i celkového přežívání [16].
I přes svou heterogenitu jsou TNBC všeobecně považovány za nádory s nepříznivou prognózou, s vysokým zastoupením nízce diferencovaných tumorů. V našem souboru jsme přesto zaznamenali a revizí potvrdili v šesti případech TNBC grade 1. K poměru našeho souboru TNBC nádorů se toto číslo jeví jako vysoké, musíme si však uvědomit jeho některá specifika. Za prvé, nejde o procento ze všech konsekutivně vyšetřovaných TNBC, kterých bylo 413, ale jen o ty nádory, které splnily naše podmínky, tj. byly dostatečně malé nebo ohraničené a mohly být léčeny primárně chirurgickým přístupem bez předchozí neoadjuvantní léčby. Už tato skutečnost selektuje případy s příznivým biologickým potenciálem, což se patrně odráží i ve vyšší diferenciaci (nižším gradem). Dalším faktorem, který ovlivnil náš výsledek, je zastoupení nádorů s klasickou medulární morfologií, o kterých je známo, že většinou neexprimují hormonální receptory ani HER2. Na tyto specifické nádory v našem souboru však můžeme nahlížet i z hlediska platné klasifikace gradingu založené na podílu tubulární komponenty, mitotickém indexu a jaderné anizomorfii jako na grade 1 nádory. Je nutné si uvědomit, že současný nottinghamský gradingový systém byl konstruován pro invazivní duktální karcinomy, nyní invazivní karcinomy NST, a pro některé speciální typy se vlastně nehodí. Asociací s nízkým gradingem můžeme vysvětlit i nízkou proliferační aktivitu stanovenou pomocí IHC vyšetření Ki-67. Nelze ani vyloučit, že se na výsledcích interpretovaných jako nižší proliferační aktivita malou částí mohly podílet i rozdíly v použitých protilátkách, příp. jejich koncentracích, které mohou spadat do mezilaboratorní variability. Rozhodně se však nejednalo o metodickou chybu, o čemž svědčí fakt, že naše laboratoř se účastní pravidelného testování kvality imunohistochemických vyšetření. Výsledky proliferační aktivity se rovněž liší v různých studiích zabývajících se touto problematikou [21–24].
Výše uvedeným výběrem se nám tedy podařilo sestavit poměrně početnou skupinu morfologicky dobře popsaných případů s celým objemem tumoru, které podstoupily primární chirurgickou léčbu, bez předchozí neoadjuvantní chemoterapie. Tímto je náš soubor specifický. V souboru se vyskytly i dva případy s morfologií kribriformního a tubulárního karcinomu a dva případy jednoznačně medulárního karcinomu, které byly zařazeny mezi TNBC. Přitom jejich dobrá prognóza je ověřená empirií i četnými studiemi a v případě medulárního karcinomu se připouští i možnost negativity estrogenových receptorů, progesteronových receptorů i proteinu HER2/neu/ERBB2 [25]. Vyvstává otázka, zda měly být z této skupiny vyřazeny jen na základě morfologické typizace, i když neexprimovaly hormonální receptory ani HER2/neu/ERBB2, nebo zda měly být podrobeny další IHC specifikaci. Přikláníme se k druhé možnosti. Důvody, proč tyto nádory neexprimovaly hlavní znaky pro zařazení do molekulárního subtypu, mohly ležet na úrovni fixačního artefaktu (i když exprese dalších IHC znaků u nich byla zachována), nebo bychom mohli spekulovat i o specifické hormonální regulaci receptorů pro steroidní hormony, vlivu věku, fáze menstruačního cyklu, správnosti prahu negativity estrogenových receptorů < 1 % apod. Metodickou nebo fixační chybu musíme vyloučit, protože jsme IHC vyšetření opakovali se stejným výsledkem, přestože imunopozitivita jiných markerů (AR, Ki-67 apod.) zůstala zachována.
Naše výsledky dokazují význam přesné histologické typizace a popisu morfologické heterogenity uvnitř každého z nádorů. Tyto údaje mohou následně klinikům podat validní informaci o možném dalším vývoji léze a naplánovat specifický terapeutický přístup. V současné době jsou ke genetickému vyšetření BRCA1/2 mutace indikovány i pacientky s diagnózou TNBC do 60 let věku. Na základě genetické analýzy TNBC klasifikovaných jako karcinomy s medulárními rysy je však speciálně u tohoto histologického typu doporučováno zavedení rutinního vyšetření přítomnosti mutace BRCA1/2 s cílem identifikovat potenciální skupinu BRCA1 nosiček, u kterých je rovněž prokázána korelace s námi popsanou morfologií [26].
Nepočetnou skupinu v našem souboru TNBC tvořily metaplastické karcinomy. Ve všech případech metaplastických karcinomů jsme se setkali s nízkou intenzitou intratumorálního i frontálního TILs. Proliferační aktivita metaplastických karcinomů byla ve srovnání s ostatními morfologickými typy podstatně nižší, exprese Bcl-2 byla středně vysoká.
Signifikantně vyšší intenzitu intratumorálního i frontálního TILs, ale zároveň i pokročilé patologické stadium, nižší stupeň diferenciace a vyšší proliferační aktivitu jsme prokázali u premenopauzálních žen (< 50 let věku). Přes vysoké hodnoty indexu Ki-67, nízkou až kompletně negativní expresi proteinu Bcl-2 a větší velikost nádorů jsme v této skupině zaznamenali méně případů s metastatickým postižením lymfatických uzlin. Tento jev dáváme spolu s nekrózou a fibrózou do souvislosti s vystupňovanou imunitní reakcí. Naše výsledky ukazují, že exprese proteinu Bcl-2 je v souladu s dřívějšími studiemi nezávislým prognostickým faktorem. Recentní studie zabývající se vztahem nádor infiltrující populace lymfo/plazmocytů k efektivitě neoadjuvantní chemoterapie potvrzují, že vyšší intenzita infiltrace může znamenat vyšší pravděpodobnost kompletní patologické odpovědi, která je považována za nejsignifikantnější ukazatel celkového přežití a období bez progrese nádorového onemocnění [26,27–31]. Ve snaze o identifikaci dosud neúplně jasné patogeneze kompletní patologické odpovědi se někteří autoři pokusili analyzovat spektrum lymfocytárních subpopulací v nádorovém infiltrátu TNBC. U pacientek, které nepodstoupily neoadjuvaní léčbu, byl prokázán statisticky významně vyšší podíl CD3+, CD8+ a FOXP3 pozitivních T lymfocytů [26,31]. Podáním chemoterapie došlo k rapidnímu snížení počtu FOXP3 pozitivních T lymfocytů a zvýšení zastoupení populace cytotoxických CD8 pozitivních buněk a granzym pozitivních B buněk. Detailní analýzu lymfocytárních subpopulací u našeho souboru případů plánujeme.
Závěr
Závěrem lze říci, že neoadjuvantní terapií neovlivněné TNBC mají své specifické histopatologické znaky, které samy o sobě vypovídají o prognóze pacientek a mohou posloužit k jejich stratifikaci do dalších prognostických skupin. Z tohoto důvodu by měl vždy histopatolog věnovat pozornost detailnímu popisu morfologické heterogenity uvnitř nádoru a klinik by jeho nález měl umět inkorporovat do návrhu co nejefektivnější terapie.
Práce byla podpořena grantem AZV ČR 16-31997A. Autoři děkují paní Mgr. Kateřině Langové, Ph.D., (Ústav lékařské biofyziky, LF UP v Olomouci) za statistické zpracování souboru, Ing. Mgr. Ivu Überallovi, Ph.D., (Ústav klinické a molekulární patologie, LF UP v Olomouci) za spolupráci při fotodokumentaci případů.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato/Accepted: 4. 9. 2019
prof. MUDr. Zdeněk Kolář, CSc.
Ústav klinické a molekulární patologie LF UP a FN Olomouc
Hněvotínská 3
775 15 Olomouc
e-mail: kolarz@tunw.upol.cz
Zdroje
1. Lebert JM, Lester R, Powell E et al. Advances in the systemic treatment of triple-negative breast cancer. Curr Oncol 2018; 25 (Suppl 1): S142–S150. doi: 10.3747/co.25.3954.
2. Svoboda M, Navrátil J, Fabián P et al. Triple negativní karcinom prsu: analýza souboru pacientek diagnostikovaných a/nebo léčených v Masarykově onkologickém ústavu v letech 2004 až 2009. Klinická onkologie 2012; 25 (3): 188–198. doi: 10.14735/amko2012188.
3. Morris GJ, Naidu S, Topham AK et al. Differences in breast carcinoma characteristics in newly diagnosed African-American and Caucasian patients: a single-institution compilation compared with the National Cancer Institute’s Surveillance, Epidemiology, and End Results database. Cancer 2007; 110 (4): 876–884. doi: 10.1002/cncr.22836.
4. Ma CX, Luo J, Ellis MJ. Molecular profiling of triple negative breast cancer. Breast Dis 2010; 31 (1–2): 73–84. doi: 10.3233/BD-2010-0309.
5. Lehmann BD, Bauer JA, Chen X et al. Identification of human triple-negative breast cancer subtypes and preclinical models for selection of targeted therapies. J Clin Invest 2011; 121 (7): 2750–2767. doi: 10.1172/JCI45014.
6. Zeng Z, Hou CHJ, Hu QH et al. Mammograhy and ultrasound effective features in differentiating basal-like and normal-like subtypes of triple-negative breast cancer. Oncotarget 2017; 8 (45): 79670–79679. doi: 10.18632/oncotarget.19053.
7. Rakha EA, Reis-Filho JS, Ellis IO. Basal-like breast cancer: a critical review. J Clin Oncol 2008; 26 (15): 2568–2581. doi: 10.1200/JCO.2007.13.1748.
8. Yadav BS, Chanana P, Jhamb S. Biomarkers in triple negative breast cancer: a review. World J Clin Oncol 2015; 6 (6): 252–263. doi: 10.5306/wjco.v6.i6.252.
9. Rampurwala M, Wisinski KB, O’Regan R. Role of the androgen receptor in triple-negative breast cancer. Clin Adv Hematol Oncol 2016; 14 (3): 186–193.
10. Liu D, He J, Yuan Z et al. EGFR expression correlates with decreased disease-free survival in triple-negative breast cancer: a retrospective analysis based on a tissue microarray. Med Oncol 2012; 29 (2): 401–405. doi: 10.1007/s12032-011-9827-x.
11. Domagala P, Huzarski T, Lubinski J et al. PARP-1 expression in breast cancer including BRCA1-associated, triple negative and basal-like tumors: possible implications for PARP-1 inhibitor therapy. Breast Cancer Res Treat 2011; 127 (3): 861–869. doi: 10.1007/s10549-011-1441-2.
12. Ferrara N. Pathways mediating VEGF-independent tumor angiogenesis. Cytokine Growth Factor Rev 2010; 21 (1): 21–26. doi: 10.1016/j.cytogfr.2009.11.003.
13. Luo J, Zhao Q, Zhang W et al. A novel panel of microRNAs provides a sensitive and specific tool for the diagnosis of breast cancer. Mol Med Rep 2014; 10 (2): 785–791. doi: 10.3892/mmr.2014.2274.
14. Lin A, Li C, Xing Z et al. The LINK-A lncRNA activates normoxic HIF1 signalling in triple-negative breast cancer. Nat Cell Biol 2016; 18 (2): 213–224. doi: 10.1038/ncb3295.
15. García-Teijido P, Luque Cabal M, Peláez Ferandéz I et al. Tumor-infiltrating lymhocytes in triple negative breast cancer: the future of immune targeting. Clinical Medicine Insights Oncology 2016; 10 (Suppl 1): 31–39. doi: 10.4137/CMO.S34540.
16. Bouchalova K, Svoboda M, Kharaishvili G et al. BCL2 is an independent predictor of outcome in basal-like triple-negative breast cancers treated with adjuvant anthracycline-based chemotherapy. Tumour Biol 2015; 36 (6): 4243–4252. doi: 10.1007/s13277-015-3061-7.
17. Lakhani SR, Ellis IO, Schnitt SJ et al. WHO classification of tumours of the breast. WHO Classification of Tumours. 4th ed. Lyon, IARC Press 2012.
18. Denkert C, Wienert S, Poterie A et al. Standardized evaluation of tumor-infiltrating lymphocytes in breast cancer: results of the ring studies of the international immuno-oncology biomarker working group. Mod Pathol 2016; 29 (10): 1155–1164. doi: 10.1038/modpathol.2016.109.
19. Salgado R, Denkert C, Demaria S et al. The evaluation of tumor-infiltrating lymphocytes (TILs) in breast cancer: recommendations by an International TILs Working Group 2014. Ann Oncol 2015; 26 (2): 259–271. doi: 10.1093/annonc/mdu450.
20. Polónia A, Pinto R, Cameselle-Teijeiro JF et al. Prognostic value of stromal tumour infiltrating lymphocytes and programmed cell death-ligand 1 expression in breast cancer. J Clin Pathol 2017; 70 (10): 860–867. doi: 10.1136/jclinpath-2016-203990.
21. Penault-Llorca F, Radosevic-Robin N. Ki67 assessment in breast cancer: an update. Pathology 2017; 49 (2): 166–171. doi: 10.1016/j.pathol.2016.11.006.
22. Ilie SM, Bacinschi XE, Botnariuc I. Potential clinically useful prognostic biomarkers in triple-negative breast cancer: preliminary results of a retrospective analysis. Breast Cancer (Dove Med Press) 2018; 10 : 177–194. doi: 10.2147/BCTT.S175556.
23. Zenzola V, Cabezas-Quintario MA, Arguelles M et al. Prognostic value of Ki-67 according to age in patients with triple-negative breast cancer. Clin Transl Oncol 2018; 20 (11): 1448–1454. doi: 10.1007/s12094-018-18 77-5.
24. Dowsett M, Nielsen TO, A’Hern R et al. Assessment of Ki67 in breast cancer: recommendations from the International Ki67 in Breast Cancer working group. J Natl Cancer Inst 2011; 103 (22): 1656–1664. doi: 10.1093/jnci/djr393.
25. Mao Y, Qu Q, Zhang Y et al. The value of tumor infiltrating lymphocytes (TILs) for predicting response to neoadjuvant chemotherapy in breast cancer: a systematic review and meta-analysis. PLoS One 2014; 9 (12): e115103. doi: 10.1371/journal.pone.0115103.
26. Rechsteiner M, Dedes K, Fink D et al. Somatic BRCA1 mutations in clinically sporadic breast cancer with medullary histological features. J Cancer Res Clin Oncol 2018; 144 (5): 865–874. doi: 10.1007/s00432-018-2609-5.
27. Zhao S, Ma D, Xiao Y et al. Clinicopathologic features and prognoses of different histologic types of triple-negative breast cancer: a large population-based analysis. Eur J Surg Oncol 2018; 44 (4): 420–428. doi: 10.1016/ j.ejso.2017.11.027.
28. Denkert C, Loibl S, Noske A et al. Tumor-associated lymphocytes as an independent predictor of response to neoadjuvant chemotherapy in breast cancer. J Clin Oncol 2010; 28 (1): 105–113. doi: 10.1200/JCO.2009.23.7370.
29. Ono M, Tsuda H, Shimizu C et al. Tumor-infiltrating lymphocytes are correlated with response to neoadjuvant chemotherapy in triple-negative breast cancer. Breast Cancer Res Treat 2012; 132 (3): 793–805. doi: 10.1007/s10549-011-1554-7.
30. Yamaguchi R, Tanaka M, Yano A et al. Tumor-infiltrating lymphocytes are important pathologic predictors for neoadjuvant chemotherapy in patients with breast cancer. Human Pathol 2012; 43 (10): 1688–1694. doi: 10.1016/j.humpath.2011.12.013.
31. Ladoire S, Arnould L, Apetoh L et al. Pathologic complete response to neoadjuvant chemotherapy of breast carcinoma is associated with the disappearance of tumor-infiltrating foxp3+ regulatory T cells. Clin Cancer Res 2008; 14 (8): 2413–2420. doi: 10.1158/1078-0432.CCR-07-4491.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článek Peritoneální nádoryČlánek Pseudomyxom peritoneaČlánek LymfangioleiomyomatózaČlánek Aktuality z odborného tiskuČlánek Onkologie v obrazech
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2019 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Peritoneální nádory
- Maligní nádory peritonea – úvod do problematiky
- Pseudomyxom peritonea
- Maligní peritoneální mezoteliom a jeho léčba
- Léčba a profylaxe peritoneálních metastáz kolorektálního karcinomu
- Možnosti léčby peritoneální karcinomatózy u karcinomu žaludku
- Peritoneální karcinomatóza ovariálních nádorů – současný pohled na efekt cytoredukční chirurgie a intraperitoneální hypertermické chemoterapie
- Alopecie a poškození vlasů indukované onkologickou terapií
- Má amygdalin své místo v integrativní protinádorové léčbě?
- Lymfangioleiomyomatóza
- Asociace polymorfizmů MTHFR 677C>T, 1298A>C a MTR 2756A>G s rizikem rozvoje retinoblastomu
- Lymfo/plazmocytární infiltrace chemoterapií neovlivněných triple negativních karcinomů prsu – koreláty s morfologickými a klinicko-patologickými parametry
- Použití regorafenibu a SBRT při léčbě plicních metastáz kolorektálního karcinomu
- 68Ga-DOTA-TOC PET/CT vyšetření u pacienta s gastroenteropankreatickým neuroendokrinním nádorem – první vyšetření v České republice
- Aktuality z odborného tisku
- Onkologie v obrazech
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Alopecie a poškození vlasů indukované onkologickou terapií
- Pseudomyxom peritonea
- Maligní peritoneální mezoteliom a jeho léčba
- Maligní nádory peritonea – úvod do problematiky
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



