-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Pseudomyxom peritonea
Pseudomyxoma Peritonei
Background: Pseudomyxoma peritonei is a rare tumorous disease with various grades of malignancy and is characterized by production of mucinous and gelatinous masses. Development of pseudomyxoma peritonei is usually associated with rupture of appendiceal mucinous tumors and other mucinous tumors of the gastrointestinal tract or ovaries. Pseudomyxoma peritonei is usually divided into three types: low-grade, high-grade, and high-grade with signet ring cells. Staging of the disease is determined by the peritoneal cancer index. Clinical findings are highly variable depending on disease staging. The typical finding of “jelly belly” syndrome worsens with disease progression. The diagnosis is based on the pre-operative cure by imaging methods, especially computed tomography.
Methods: The Sugarbaker method involves maximal removal of tumorous masses, so-called cytoreductive surgery, and perioperative intraabdominal application of hot cytostatics (hyperthermic intraperitoneal chemotherapy) with the aim of achieving maximal liquidation of tumorous processes.
Results: Our results are comparable with previous published data and confirm high effectivness of this method. The results show statistically very significant extention of overall survival, disease free interval with acceptable lethality 0–12 % and morbidity 27–56%. These results promote this method as the gold standard of treatment of pseudomyxoma peritonei in selected patients.
Keywords:
cytoreductive surgery – pseudomyxoma peritonei – PCI – hypertermic intraperitoneal chemotherapy – HIPEC
Autori: Petr Bartoška 1; František Antoš 1; Pavel Vítek 2; Josef Marx 1; Jiří Kopic 1; Petra Holečková 3
Pôsobisko autorov: Chirurgická klinika 1. LF UK a Nemocnice Na Bulovce, Praha 1; Protonové centrum, Praha 2; Ústav radiační onkologie, 1. LF UK a Nemocnice Na Bulovce, Praha 3
Vyšlo v časopise: Klin Onkol 2019; 32(5): 329-332
Kategória: Přehled
doi: https://doi.org/10.14735/amko2019329Súhrn
Východiska: Pseudomyxom peritonea je vzácné nádorové onemocnění charakterizované různým stupněm malignity, produkcí mucinu a gelatinózních hmot. Jeho rozvoj je velmi často spojován s rupturou mucinózních nádorů apendixu a ostatních mucinózních nádorů trávicího traktu a ovaria. Pseudomyxom peritonea je obvykle dělen do tří skupin – low-grade, high-grade a high-grade s výskytem buněk pečetního prstene. Rozsah onemocnění je určován pomocí skórovacího systému PCI (peritoneal carcinoma index). Klinický obraz je značně variabilní, závisí na rozsahu onemocnění. S progresí vývoje nádorových hmot se postupně rozvíjí typický nález „jelly belly“ – „syndrom rosolovitého břicha“. Diagnostika je založena na stanovení předoperačního PCI pomocí zobrazovacích metod, zejména pak výpočetní tomografie.
Metody: Od 90. let 20. století se uplatňuje metoda Paula H. Sugarbakera založená na maximálním možném odstranění nádorových hmot, tzv. cytoredukční chirurgii, a následné peroperační aplikaci horkého cytostatika do dutiny břišní, tzv. hypertermické intraperitoneální chemoterapii, s cílem dosažení co nejefektivnější likvidace nádorového procesu.
Výsledky: Literární i naše výsledky jsou srovnatelné, potvrzují vysokou efektivitu zmíněné metody. Uvádějí statisticky velmi významné prodloužení celkového přežití, intervalu bez známek onemocnění s akceptabilní letalitou 0–12 % i morbiditou 27–56 %. Tyto výsledky u vybraných pacientů potvrzují použití metody jako zlatého standardu pro léčbu pseudomyxomu peritonea.
Klíčová slova:
pseudomyxom peritonea – PCI – cytoredukční chirurgie – hypertermická intraperitoneální chemoterapie – HIPEC
Úvod
Chorobu lze definovat jako nádorové onemocnění s různým stupněm maligního potenciálu charakterizované produkcí mucinu a gelatinózních hmot v peritoneální dutině. Tyto hmoty se vyskytují v dutině břišní volně, nebo vázané na viscerální či parietální peritoneum. Postižení peritonea (peritoneální karcinomatóza) je přítomné vždy. Velmi často bývá postiženou oblastí omentum – tzv. omental cake (obr. 1). Ostatní predilekční oblasti, jako parakolické prostory, malá pánev a oba podbrániční prostory, odpovídají cirkulačním cestám peritoneální tekutiny [1]. Onemocnění vychází z MUC2 pozitivních pohárkových buněk, při imunohistochemickém vyšetření se prokazuje vysoký výskyt hlenu MUC2, bývá pozitivní cytokeratin 20 a negativní cytokeratin 7 [2,3].
Obr. 1. Karcinomatóza omenta – „omental cake“. 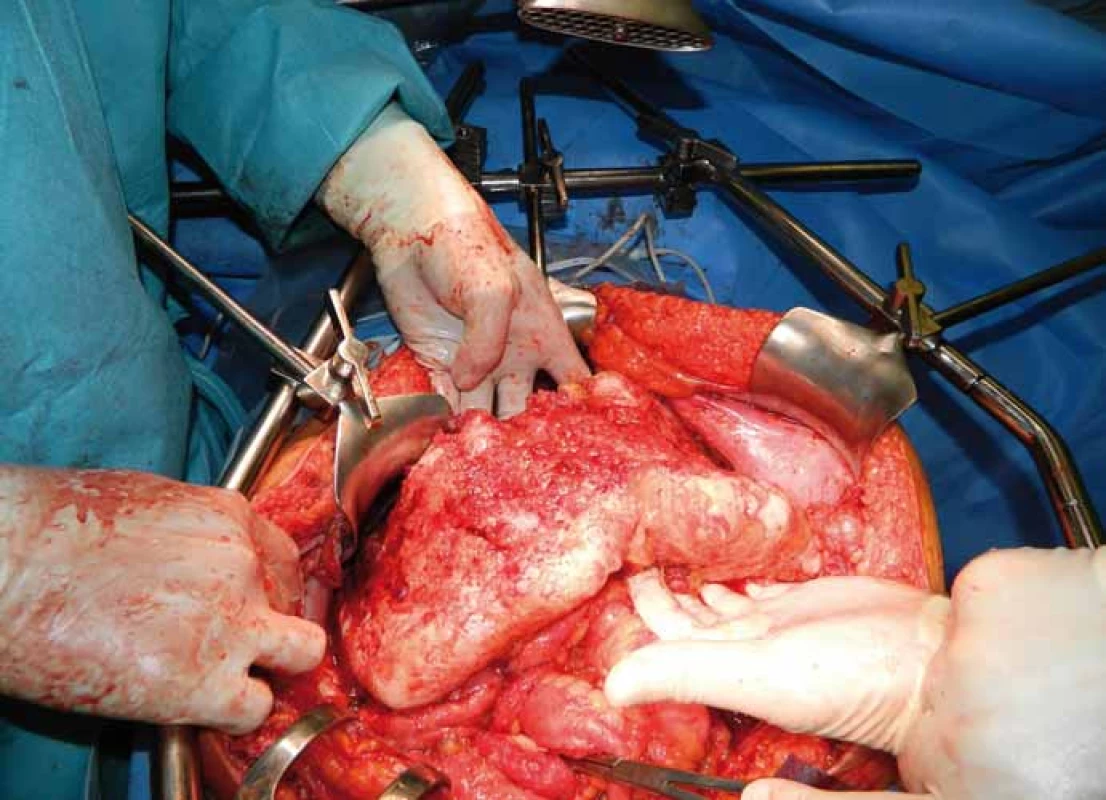
Epidemiologie
Jde o poměrně vzácné onemocnění s výskytem přibližně 1 pacienta na 1 milion obyvatel za rok. Nejčastěji se objevuje jako komplikace nezhoubných mukokél apendixu, hlenotvorných neoplazií apendixu (70–80 %), střeva a hlenotvorných ovariálních nádorů (2–5 %). Sporadický výskyt lze nalézt i u cystických nádorů pankreatu, nádorů žaludku, žlučových cest a močového měchýře. Příčinou vzniku onemocnění je nezřídka bezpříznaková nebo peroperační ruptura hlenotvorných nádorů.
Dělení a klasifikace
- Dle Ronnetta se pseudomyxom peritonea (PMP) dělí do tří histologických typů: 1) diseminovaná peritoneální adenomucinóza (DPAM); 2) intermediate/discordant-přechodný podtyp (PMCA/ID); 3) peritoneální mucinózní karcinomatóza (PMCA). V praxi je však spíše používáno histopatologické dělení jen do dvou skupin – DPAM a PMCA.
- Vodítkem pro rozdělení do těchto skupin je přítomnost vzhledu epitelové složky, přítomnost buněk typu pečetního prstene a známky kribriformně tubulárního uspořádání nádoru.
- DPAM-diseminovaná peritoneální adenomucinóza je velmi často recidivujícím typem nádoru majícím oproti PMCA lepší prognózu, je zde obvykle prokázán vztah s benigním hlenotvorným nádorem apendixu. Pětileté přežití u tohoto typu nádoru je v literatuře udáváno 80–81 %. Vzácněji se vyskytující skupinou je PMCA-peritoneální mucinózní karcinomatóza, která je v podstatě považována za projev generalizace maligního tumoru gastrointestinálního traktu s masivní produkcí hlenu. Prognóza i přežití pacientů s tímto typem nádoru je udávána okolo 50–59 %.
- Klasifikace Světové zdravotnické organizace dělí PMP na low-grade a high-grade. Low-grade PMP je charakterizován pomalou progresí a lepší prognózou, nádor nemá schopnost destrukce střevní stěny. Není pro něj typický invazivní růst a tvorba metastáz. Je spojován s mucinózním tumorem apendixu. Naproti tomu pro biologické chování high-grade PMP je typická invazivita, agresivita a destrukce. Může tvořit hematogenní i lymfogenní metastázy, je spojován s high-grade mucinózním adenokarcinomem. Jako další histologický podtyp high-grade PMP je popisován tumor charakterizovaný přítomností buněk pečetního prstene (signet ring cells), jehož chování je velmi invazivní a agresivní [4].
- Konsenzus Mezinárodní skupiny léčby malignit peritoneálního povrchu (The Peritoneal Surface Oncology Group International – PSOGI) z roku 2016 definuje PMP jako intraperitoneální akumulaci hlenu způsobenou hlenotvorným nádorem charakterizovaným redistribučním fenoménem. Dělí se do tří kategorií: low-grade, high-grade a high-grade s výskytem buněk typu pečetního prstene. Low-grade odpovídá již citovanému DPAM a high-grade PMP, PMCA. Tato klasifikace byla všeobecně přijata a měla by být používána jednotlivými centry z důvodu dosažení jednotné terminologie [5].
U PMP lze provést kompletní odstranění nádoru i při PCI (peritoneal carcinoma index) skóre okolo 28, inkompletní pak i u vyšších hodnot PCI [6,7].
Specifická diagnostika
Opírá se o anamnézu a klinický nález, které se zpravidla různí v závislosti na rozsahu onemocnění. Na jedné straně nalézáme pacienty asymptomatické, s minimálním klinickým nálezem, na druhé straně pak pacienty s různě rozvinutou neprůchodností střevní, ascitem či tumorózními rezistencemi, tzv. jelly belly syndromem („rosolovité břicho“) (obr. 2). Základním úkolem je verifikace procesu a jeho histologická klasifikace, což vyžaduje odběr dostatečného množství nádorového materiálu k histopatologickému zpracování. Vzhledem ke vzácnému výskytu onemocnění je někdy k potvrzení diagnózy nutné i opakované čtení zkušeným centrovým patologem [8,9].
Obr. 2. Rosolovité břicho – „jelly belly“. 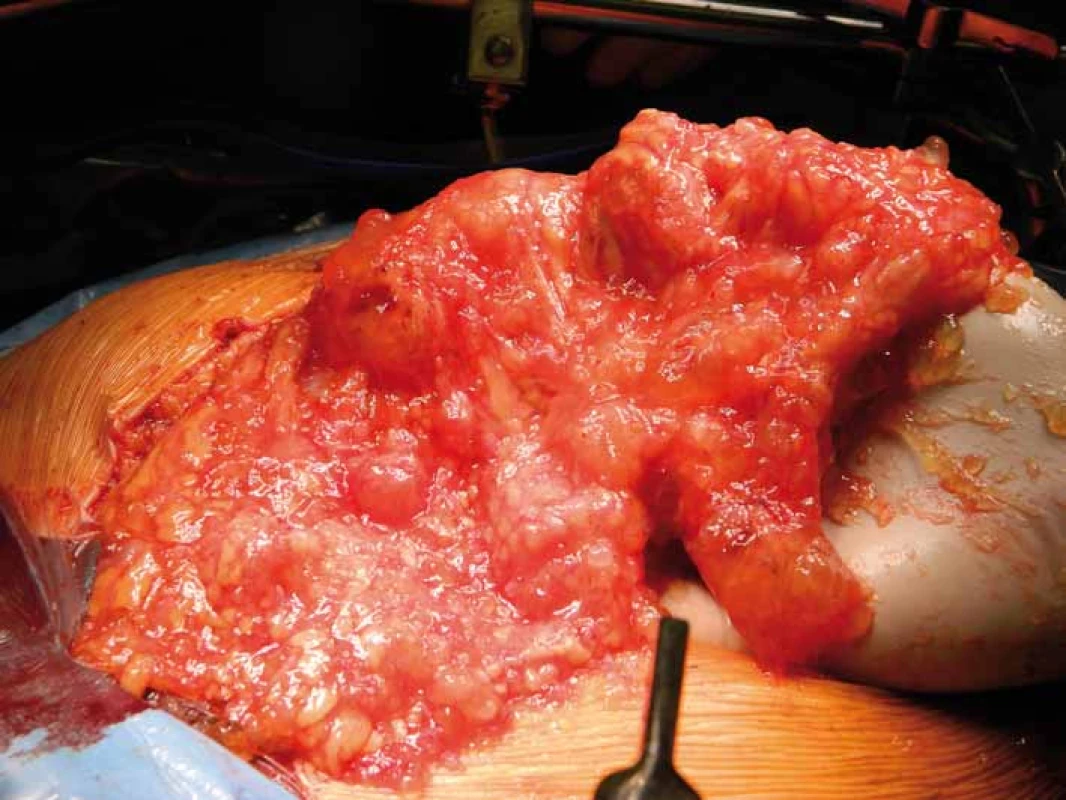
Z laboratorních vyšetření je kromě běžných vyšetření nutných k posouzení stavu pacienta a únosnosti chirurgického výkonu doporučováno provádět i odběry CEA, Ca 19-9 a Ca 125. Hladina těchto onkologických markerů může být dalším faktorem predikce rozsahu postižení dutiny břišní PMP, event. operability, celkového přežití (overall survival – OS) i přežití bez progrese onemocnění (progression-free survival – PFS) [10,11].
Terapie
Cytoredukce dle Sugarbakera je v případě pokročilého pseudomyxomu peritonea prováděna v několika krocích závislých na rozsahu nádorové infiltrace:
- Totální odstranění velkého omenta a pravostranná parietální peritonektomie s/bez resekce pravé poloviny kolon.
- Pánevní peritonektomie s/bez resekce sigmatu, hysterektomie a oboustranná adnexektomie.
- Omentektomie malé předstěry a disekce oblasti lig. hepatoduodenale s/bez antrektomie či cholecystektomie.
- Peritonektomie horního pravého kvadrantu a odstranění Glissonova pouzdra jater.
- Peritonektomie levého horního kvadrantu a levostranná parietální peritonektomie s/bez splenektomie.
- Ostatní střevní a jiné resekce břišních nádorových mas [12].
I v případě inoperabilního nálezu je u PMP žádoucí zvážit debulking s hypertermickou intraperitoneální chemoterapií (HIPEC). Cílem tohoto postupu je redukce nádorových mas a snížení tvorby ascitu, což výrazně zlepší kvalitu dalšího života. Konstrukce anastomóz i stomií se obvykle provádí až po aplikaci HIPEC. Okluze stomií u těchto pacientů je zvažována obyčejně po 3–6 měsících od primární operace, přičemž může jít i o součást tzv. second look operace či re-do chirurgie (revize cytoredukční chirurgií – cytoreductive surgery (CRS) a HIPEC). Četnost obnovení kontinuity po CRS a HIPEC je srovnatelná s jinými kolorektálními operacemi, udává se okolo 50 % [13].
Indikace k CRS a HIPEC u PMP:
- histologická verifikace PMP;
- performance status 0–2, Karnofského index > 70;
- klasifikace dle Americké společnosti anesteziologů (ASA) ≤ II;
- přítomnost maligních buněk ve výpotku;
- přítomnost peritoneálních metastáz i u pacientů s PCI ≥ 20 (u ostatních nádorů ≤ 20) – pacienti s vysokým rizikem peritoneální diseminace (ileus, perforace, prorůstání tumorů do ostatních orgánů).
Kontraindikace k CRS a HIPEC u PMP
- celkové: performance status ≥ 3, Karnofského index < 70, ASA ≥ III;
- další komorbidity – obvyklé interní kontraindikace identické s ostatními břišními operacemi;
- generalizace procesu (extraperitoneální manifestace onemocnění);
- přítomnost chirurgicky neřešitelných vzdálených metastáz (mozek, plíce, kosti);
- přítomnost maligního pleurálního výpotku;
- lokální nález břišní – invazivní růst do retroperitonea, postižení retroperitoneálních lymfatických uzlin – těžké postižení mezenteria s jeho retrakcí;
- těžké postižení (separace a četné stenózy) tenkého střeva, při jehož resekci by hrozil vznik syndromu krátkého střeva, obstrukce žlučových cest a hydronefróza [14–21].
Výsledky
Výsledky CRS a HIPEC u PMP udávané v literatuře naší i cizojazyčné jsou relativně příznivé. Dvouleté přežití se pohybuje okolo 90 %, 3leté 60–90 %, 5 a 10leté přežití po kompletní CRS a HIPEC se udává přes 80–85 %, resp. 60–68 % u CRS inkompletní; 15leté přežití pak okolo 55–60 %. Retrospektivní analýza registru pacientů s PMP (všech histologických typů), kteří podstoupili CRS a HIPEC, udává medián PFS 98 měsíců a medián OS 196 měsíců. Dvacetileté přežití pacientů s CRS a HIPEC pro low-grade PMP vznikajícího na základě nádorového onemocnění apendixu při srovnání s užitím pouze systémové chemoterapie je 70 vs. 0 %.
Recidiva onemocnění se objevuje u PMP po kompletní CRS a HIPEC obvykle ve 25–30 %, cca 22–30 měsíců od primárního výkonu, s časovým mediánem okolo 26 měsíců.
U 25–30 % pacientů postižených recidivou PMP lze provést re-do chirurgii, u 50–60 % z nich je pak možná i kompletní CRS. Perioperativní morbidita 15–76 %, mortalita 0–17 % [22–24].
Re-do chirurgie
Je doporučována u recidiv PMP. Opakovaný chirurgický zákrok (CRS a HIPEC) pacientovi přináší statisticky podstatně vyšší OS. Tříleté přežití je udáváno až ve 100 % a 5leté v 90 %. Mortalita u opakovaných výkonů je srovnatelná s operacemi primárními. Morbidita se pohybuje mezi 15–76 % [25].
Závěr
CRS a HIPEC je metodou volby u vybraných pacientů s onemocněním (syndromem) PMP. Pacienti vhodní pro tuto metodu by měli být diskutováni předem ve specializovaných multidisciplinárních týmech jednotlivých CRS a HIPEC center. Vzhledem k vysoké morbiditě, náročnosti operace a pooperační péče by tato metoda měla být prováděna výhradně a jen v těchto centrech (doporučení PSOGI z roku 2015). V léčbě PMP je CRS a HIPEC vysoce efektivní při zachování velmi nízké mortality, výrazně prodlužuje PFS i OS.
Ze strany pacientů je CRS a HIPEC chirurgie hodnocena velmi pozitivně, 80 % pacientů, kteří podstoupili CRS a HIPEC, byli spokojeni a uváděli, že zmíněná léčba neměla negativní dopad na kvalitu jejich následného života [26].
Podpořeno MZ ČR – RVO (NNB, 00064211).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato/Accepted: 5. 8. 2019
MUDr. Petr Bartoška
Chirurgická klinika Nemocnice Na Bulovce
Budínova 67/2
180 81 Praha 8
e-mail: bartoska.petr@centrum.cz
Zdroje
1. Antoš F, Petr Dytrych P. Peritoneální nádory. Chirurgická onkologie. Praha: Grada publishing 2014 : 601–613.
2. Baratti D, Kusamura S, Nonaka D et al. Pseudomyxoma peritonei: clinical pathological and biological prognostic factors in patients treated with cytoreductive surgery and hyperthermic intraperitoneal chemotherapy (HIPEC). Ann Surg Oncol 2008; 15 (2): 526–534. doi: 10.1245/s10434-007-9691-2.
3. Kocián R. Pseudomyxoma peritonei. Actual Gyn 2013; 5 : 10–13.
4. AJCC Cancer staging manual. 8th ed. New York: Springer 2017 : 237–239.
5. Carr NJ, Cecil TD, Mohamed F et al. Consensus for classification and pathologic reporting of pseudomyxoma peritonei and associated appendiceal neoplasia: the results of the Peritoneal Surface Oncology Group International (PSOGI) modified delphi process. Am J Surg Pathol 2016; 40 (1): 14–26. doi: 10.1097/PAS.0000000000000535.
6. Antoš F. Léčení diseminovaných nádorů dutiny břišní pomocí peritonektomie a peroperační hypertermické chemoterapie s možností profylaktického užití u kolorektálních karcinomů – závěrečná zpráva grantového projektu. IGA MZ ČR NR 8414/5.
7. Antoš F, Vítek P, Kopic J et al. Cytoreduktivní chirurgie a hypertermická peroperativní chemoterapie (HIPEC) v léčbě malignit peritoneálních povrchů. Onkologická Revue 2018; 5 (2): 62–67.
8. Dineen SP, Royal RE, Hughes MS et al. A simplified preoperative assessment predicts complete cytoreduction and outcomes in patients with low-grade mutinous adenocarcinoma of the appendix. Ann Surg Oncol 2015; 22 (11): 3640–3646. doi: 10.1245/s10434-015-4446-y.
9. Flicek K, Ashfaq A, Johnson CD. Correlation of radiologic with surgical peritoneal cancer index scores in patients with pseudomyxoma peritonei and peritoneal carcinomatosis: how well can we predict resectability? J Gastrointest Surg 2016; 20 (2): 307–312. doi: 10.1007/s11605-015-2880-6.
10. Canbay E, Ishibashi H, Sako S et al. Preoperative carcinoembryonic antigen level predicts prognosis in patients with pseudomyxoma peritonei treated with cytoreductive surgery and hyperthermic intraperitoneal chemotherapy. World J Surg 2013; 37 (6): 1271–1276. doi: 10.1007/s00268-013-1988-7.
11. Kusamura S, Baratti D, Hutanu I et al. The role of baseline inflammatory-based scores and serum tumor markers to risk stratify pseudomyxoma peritonei patients treated with cytoreduction (CRS) and hyperthermic intraperitoneal chemotherapy (HIPEC). Eur J Surg Oncol 2015; 41 (8): 1097–1105. doi: 10.1016/j.ejso.2015.04. 005.
12. Sugarbaker PH. Peritonectomy procedure. Ann Surg 1995; 221 (1): 29–42. doi: 10.1097/00000658-199501000-00004.
13. Riss S, Chandrakumaran K, Dayal S et al. Risk of definitive stoma after surgery for peritoneal malignancy in 958 patients: comparative study between complete cytoreductive surgery and maximal tumor debulking. Eur J Surg Oncol 2015; 41 (3): 392–395. doi: 10.1016/ j.ejso.2014.09.002.
14. Spiliotis J, Halkia E, de Bree E. Treatment of peritoneal surface malignancies with hyperthermic intraperitoneal chemotherapy – current perspectives. Curr Oncol 2016; 23 (3): 266–275. doi: 10.3747/co.23.2831.
15. Lansom J, Alzahrani N, Liauw W et al. Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy for pseudomyxoma peritonei and appendix tumours. Indian J Surg Oncol 2016; 7 (2): 166–176. doi: 10.1007/s13193-015-0478-9.
16. Qu ZB, Liu LX. Management of pseudomyxoma peritonea. World J Gastroenterol 2006; 12 (38): 6124–6127. doi: 10.3748/wjg.v12.i38.6124.
17. Shaligram A. Management of peritoneal surface malignancies in laparoscopic era: a concise review. Int J Surg Oncol (NY) 2016; 1 (2): e05. doi: 10.1097/IJ9.000 0000000000005.
18. Moran B, Baratti D, Yan TD et al. Consensus statement on the loco-regional treatment of appendiceal mucinous neoplasm with peritoneal dissemination (pseudomyxoma peritonei). J Surg Oncol 2008; 98 (4): 277–282. doi: 10.1002/jso.21054.
19. MacArthur KM, Nicholl MB. Principles and innovations in peritoneal surface malignancy treatment. World J Oncol 2013; 4 (3): 129–136. doi: 10.4021/wjon 660w.
20. Kulu Y, Muller-Stich B, Büchler MW et al. Surgical treatment of peritoneal carcinomatosis: current treatment modalities. Langenbecks Arch Surg 2014; 399 (1): 41–53. doi: 10.1007/s00423-013-1144-8.
21. Halkia E, Gavriel S, Spilioti J. Management of peritoneal surface malignancy: a review of the recent literature. JBUON 2014; 19 (3): 618–626.
22. Saxon A, Yan TD, Chua TC et al. Critical assessment of risk factors for complications after cytoreductive surgery and perioperative intraperitoneal chemotherapy for pseudomyxoma peritonei. Ann Surg Oncol 2010; 17 (5): 1291–1301. doi: 10.1245/s10434-009-0875-9.
23. Iversen LH, Rasmussen PC, Hagemann-Madsen R et al. Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy for peritoneal carcinomatosis: the Danish experience. Colorectal Dis 2013; 15 (7): 365–372. doi: 10.1111/codi.12185.
24. Chua TC, Moran BJ, Sugarbaker PH et al. Early-and long-term outcome data of patients with pseudomyxoma peritonei from appendiceal origin treated by a strategy of cytoreductive surgery and hyperthermic intraperitoneal chemotherapy. J Clin Oncol 2012; 30 (20): 2449–2456. doi: 10.1200/JCO.2011.39. 7166.
25. Delhorme JB, Honoré C, Benhaim L et al. Long-term survival after aggressive treatment of relapsed serial or distant pseudomyxoma peritonei. Eur J Surg Oncol 2017; 43 (1): 159–167. doi: 10.1016/j.ejso.2016.08.021.
26. Kirby R, Liauw W, Zhao J et al. Quality of life study following cytoreductive surgery and intraperitoneal chemotherapy for pseudomyxoma peritonei including redo procedures. Int J Surg Oncol 2013; 2013 : 461041. doi: 10.1155/2013/461041.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článek Peritoneální nádoryČlánek LymfangioleiomyomatózaČlánek Aktuality z odborného tiskuČlánek Onkologie v obrazech
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2019 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Peritoneální nádory
- Maligní nádory peritonea – úvod do problematiky
- Pseudomyxom peritonea
- Maligní peritoneální mezoteliom a jeho léčba
- Léčba a profylaxe peritoneálních metastáz kolorektálního karcinomu
- Možnosti léčby peritoneální karcinomatózy u karcinomu žaludku
- Peritoneální karcinomatóza ovariálních nádorů – současný pohled na efekt cytoredukční chirurgie a intraperitoneální hypertermické chemoterapie
- Alopecie a poškození vlasů indukované onkologickou terapií
- Má amygdalin své místo v integrativní protinádorové léčbě?
- Lymfangioleiomyomatóza
- Asociace polymorfizmů MTHFR 677C>T, 1298A>C a MTR 2756A>G s rizikem rozvoje retinoblastomu
- Lymfo/plazmocytární infiltrace chemoterapií neovlivněných triple negativních karcinomů prsu – koreláty s morfologickými a klinicko-patologickými parametry
- Použití regorafenibu a SBRT při léčbě plicních metastáz kolorektálního karcinomu
- 68Ga-DOTA-TOC PET/CT vyšetření u pacienta s gastroenteropankreatickým neuroendokrinním nádorem – první vyšetření v České republice
- Aktuality z odborného tisku
- Onkologie v obrazech
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Alopecie a poškození vlasů indukované onkologickou terapií
- Pseudomyxom peritonea
- Maligní peritoneální mezoteliom a jeho léčba
- Maligní nádory peritonea – úvod do problematiky
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




