-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Artefakty u perfuzní scintigrafie myokardu
1. část
Artifacts in myocardial perfusion scintigraphy
1st partMyocardial perfusion scintigraphy is one of the most frequent and, at the same time, the most technically complete nuclear medicine examination. Different types of artefacts can arise at any phase of examination and can cause erroneous interpretation. Artefacts are mostly divided into those related to patients (motion, attenuation, extracardiac radioactivity, gating and patient features), related to procedure (radiopharmaceutical injection, position during acquisition, gamma camera filed of view), related to processing (filtering, myocardial axis rotation, region of interest, quantification, endocardium, color scale, image registration) and related to gamma camera (homogenity, center of rotation). This text is a review of the most frequent artefacts. It explains briefly their causes, patterns and methods for their elimination or minimalization.
It is neccessary for physicians and technologists to be aware of possible sources of artefacts, to employ all available ways to prevent them and to choose appropriate tools for their repair and to enclose their infulence into the study interpretation despite they appear.
Artefact elimination increases specificity and sensitivity of the procedure and maintains its significant role in the examination of patients with cardiovascular diseases.Key Words:
myocardial perfusion scintigraphy, artefacts, source, recognition, prevention
Autoři: Ivana Kuníková 1; Otto Lang 1,2
Působiště autorů: Klinika nukleární medicíny, 3. LF UK a FNKV Praha 10, ČR 1; Oddělení nukleární medicíny, Oblastní nemocnice Příbram a. s., ČR 2
Vyšlo v časopise: NuklMed 2016;5:44-54
Kategorie: Přehledová práce
Souhrn
Perfuzní scintigrafie myokardu je jedno z nejčastějších a současně i jedno z technicky nejnáročnějších nukleárně medicínských vyšetření. Různé artefakty mohou vzniknout v kterékoli fázi vyšetření a mohou vést k chybné interpretaci. Často se artefakty rozdělují na související s pacientem (pohyb při snímání, zeslabení záření, extrakardiální akumulace radiofarmaka, synchronizace s EKG křivkou a zvláštnosti pacienta), související s pracovním postupem (aplikace radiofarmaka, poloha při snímání a zorné pole), související se zpracováním dat (filtrování, geometrie osy levé komory, oblast zájmu, kvantitativní hodnocení, povrch endokardu, barevná škála a registrace obrazů) a související s přístrojem (homogenita zorného pole a centrum rotace). Toto sdělení je přehledem běžnějších artefaktů. Stručně vysvětluje jejich příčiny, způsob zobrazení a metody pro jejich odstranění nebo minimalizaci.
Je nezbytné, aby lékař i radiologický asistent nebo sestra si byli vědomi potenciálních zdrojů artefaktů, aby používali všechny dostupné metody a prostředky k jejich prevenci a pokud se přesto vytvoří, musí zvolit vhodná opatření k jejich nápravě a začlenit jejich vliv do interpretace studie. Eliminace artefaktů zlepšuje specificitu i senzitivitu vyšetření a napomáhá mu tak zachovat si důležitou roli při vyšetřování pacientů s kardiovaskulárním onemocněním.Klíčová slova:
perfuzní scintigrafie myokardu, artefakty, vznik, rozpoznání, prevenceÚVOD
Artefakty, úskalí, nástrahy, pasti, chyby – těmito slovy můžeme označit jednotlivé situace, děje, jevy, faktory, které jsou ve své podstatě nežádoucí a mohou více či méně ovlivnit výsledek vyšetření. Je jich celá řada a souvisí se všemi částmi vyšetření – mohou se vyskytnout kdykoli v jeho průběhu. Pro zjednodušení budeme dále používat pouze označení artefakt.
Některé typy artefaktů jsou společné pro všechna scintigrafická vyšetření, s některými se setkáme jen u jednoho konkrétního. Kdybychom chtěli zaznamenat všechny možnosti, měli byste v rukou poměrně silnou knihu a ne jen časopis. V tomto sdělení se budeme věnovat pouze artefaktům při perfuzní scintigrafii myokardu prováděné pomocí SPECT nebo SPECT/CT a v ČR běžně dostupných radiofarmak (RF). Jde o jedno z nejčastějších nukleárně medicínských vyšetření, v ČR bylo v roce 2012 provedeno 19 798 SPECT vyšetření myokardu. 1 Zároveň jde o jedno z technicky nejnáročnějších vyšetření – riziko výskytu některého z artefaktů je proto nemalé a stojí za to si je připomenout. Stručně uvedeme jejich příčiny a nastíníme možnosti, jak artefaktům předcházet, jak je poznat a jak jejich vliv odstranit nebo alespoň zmírnit. Artefakty se projeví většinou jako defekty perfuze, vedou tedy převážně k falešně pozitivním výsledkům s negativním dopadem na hodnocení efektivity metody klinickými lékaři.
Ve většině publikací se artefakty rozdělují do čtyř základních skupin: související s pacientem, související s pracovním postupem, související se zpracováním dat a související s přístrojem – budeme se ho držet i my.
ARTEFAKTY SOUVISEJÍCÍ S PACIENTEM
Pohyb pacienta nebo orgánu
Pohyb pacienta v průběhu snímkování je častou příčinou artefaktů. Kromě pohybu pacienta se můžeme také setkat jen s pohybem srdce, kdy se mění jeho poloha v hrudníku. Četností výskytu se zabývá řada publikací, jejich výsledky se různí. Wheat udává vizuálně detekovatelný pohyb u 36 % vyšetření – 40,5 % zátěžových a 31,5 % klidových, často ve více projekcích (použita 99mTc značená radiofarmaka). 2 Ve studii publikované Germanem pohyb pacienta ovlivňuje 10–20 % vyšetření (bez specifikace aplikovaného radiofarmaka a podmínek snímání). 3 Podobnou hodnotu uvádí i Friedman (pohyb u 17 % ze 48 pacientů), ale v tomto případě bylo použito pouze 201Tl a snímkování bylo provedeno brzy po ukončení zátěžového testu (viz dále). 4 Rovněž v Botvinickově studii bylo aplikováno 201Tl – pohyb byl detekován u 25 % vyšetření, ale pouze v 5 % byl příčinou viditelného poškození obrazu. 5 Rozdílné výsledky lze nejspíše vysvětlit použitím rozdílné metodiky.
Pohyb může být horizontální, vertikální nebo v obou směrech, přičemž významnější defekty vznikají nejčastěji při pohybu ve svislém (axiálním) směru. (Obr. 1, Obr. 2) Zásadnější vliv na rozsah defektu má spíše náhlý (rychlý, skákavý) pohyb, než pohyb pomalý, postupný. Významnější je také pohyb uprostřed akvizice než na jejím začátku či konci. Velikost defektu je závislá rovněž na rozsahu pohybu – posunutí o 2 a více pixelů způsobuje detekovatelný, klinicky významný (v 5 %) defekt (0,5 pixel – bez defektu, 1 pixel – zjistitelný, ale klinicky nevýznamný). 6 Větší defekt perfuze způsobí pohyb pacienta také tehdy, pokud se snímá dvoudetektorovou kamerou s detektory v konfiguraci 90° (L mode), protože ovlivní dva současně snímané obrazy. Větší odolnost vůči artefaktům vykazuje snímání při 360° rotaci detektorů. 3 Podle studie, kterou publikoval Kenichi, se vznik arteficiálního defektu perfuze způsobeného pohybem minimalizuje při snímání třídetektorovou gamakamerou s rotací 360°; o málo horší jsou výsledky, pokud se snímá dvoudetektorovou kamerou s detektory v konfiguraci 180° (H mode) a s rotací 360°. 7
Obr. 1. Nadzdvihnutí pacienta na lůžku v průběhu snímání v poloze na břiše – dva po sobě jdoucí snímky tomografického záznamu (A – před pohybem, B – po pohybu). Pohyb pacienta v průběhu snímání vede k arteficiálním defektům perfuze – zobrazení na polární mapě (C) a vybraných tomografických řezech (horní řady E – SA (short axis – v krátké ose), F – VLA (vertical long axis – ve vertikální dlouhé ose), G – HLA (horizontal long axis – v horizontální dlouhé ose)). U opakované studie, již bez pohybu pacienta, jsou defekty perfuze výrazně menší – zobrazení na polární mapě (D) a vybraných tomografických řezech (dolní řady E – SA, F – VLA, G – HLA). 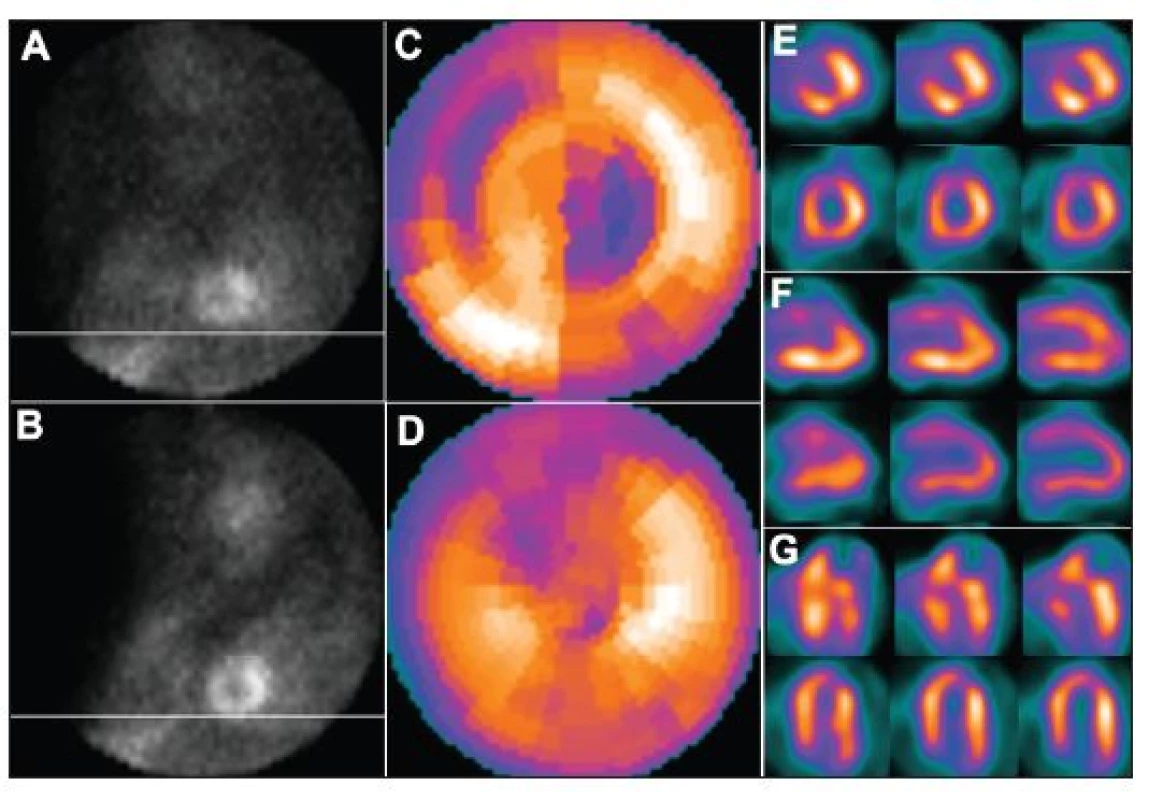
Obr. 2. Vertikální pohyb srdce v průběhu snímání – dva po sobě jdou snímky tomografického záznamu (A – před pohybem, B – po pohybu), žlutá čára vyznačuje rozsah pohybu. Pohyb pacienta v průběhu snímání vede k arteficiálním defektům perfuze – zobrazení na polární mapě (C) a vybraných tomografických řezech (horní řady E – SA, F – VLA, G – HLA). U opakované studie, již bez pohybu pacienta, jsou defekty perfuze výrazně menší – zobrazení na polární mapě (D) a vybraných tomografických řezech (dolní řady E – SA, F – VLA, G – HLA). 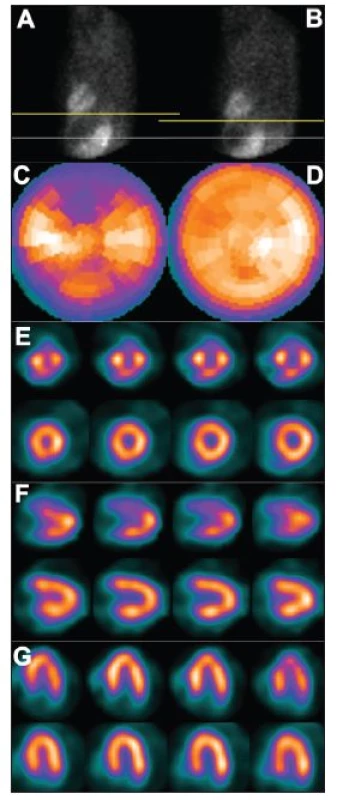
Nejčastější příčinou pohybu pacienta při snímání je diskomfort nemocného, kašel nebo hluboké dýchání (časté u klidově dušných pacientů). Na omezení pohodlí pacienta se podílí zejména požadavek udržet alespoň levou ruku nad hlavou a poměrně dlouhé ležení na zádech.
S posunem srdce směrem nahoru v průběhu snímání (upward creep) se setkáme při snímkování krátce po ukončení zátěžového testu (5–10 minut). Posun srdce je způsoben postupným návratem bránice do klidové polohy – při zátěži ji rozšířené plíce vytlačily směrem do břicha. K obdobné situaci může dojít i bez zátěžového testu. Silně stresovaní pacienti zhluboka dýchají; v průběhu snímání se pak uklidní, dýchání se u nich zpomalí a srdce se posouvá nahoru. 3,8 Častější výskyt tohoto artefaktu je proto možné předpokládat při použití 201Tl, kdy se snímkuje ihned po skončení zátěžového testu, ale vzácně se vyskytuje i při použití 99mTc značených radiofarmak. 2
Základním předpokladem pro snížení rizika pohybu je věnovat pozornost uložení pacienta na vyšetřovací lůžko – zajistit mu maximální možné pohodlí (použít např. podložení kolen, podložení nebo držák na ruce, deku na přikrytí aj.). K snížení rizika pohybu pacienta pomůže také zkrácení akvizičního času. Z tohoto pohledu je výhodnější snímání dvěma detektory v L mode. Krátká je doba snímání také při použití nových typů speciálních kardiologických gamakamer (citlivější CZT detektory, multidetektorové systémy, speciální programy na zpracování dat).
Pro identifikaci tohoto artefaktu je důležité prohlédnout nasnímaná data v cine formátu a sinogram.
Pohyb v průběhu snímání způsobí na výsledném obrazu defekt perfuze, který se neobjevuje v jiné studii (stress x rest x prone). Někdy je možné vidět na některých řezech i jakési „odskočení“ části řezu nebo „ocas“ radioaktivity šířící se od srdce (hurricane sign). 8 (Obr. 3)
Obr. 3. Vybrané SA řezy ze studie, během níž došlo k vertikálnímu pohybu srdce; šipky ukazují „ocas“ radioaktivity šířící se od srdce (hurricane sign). 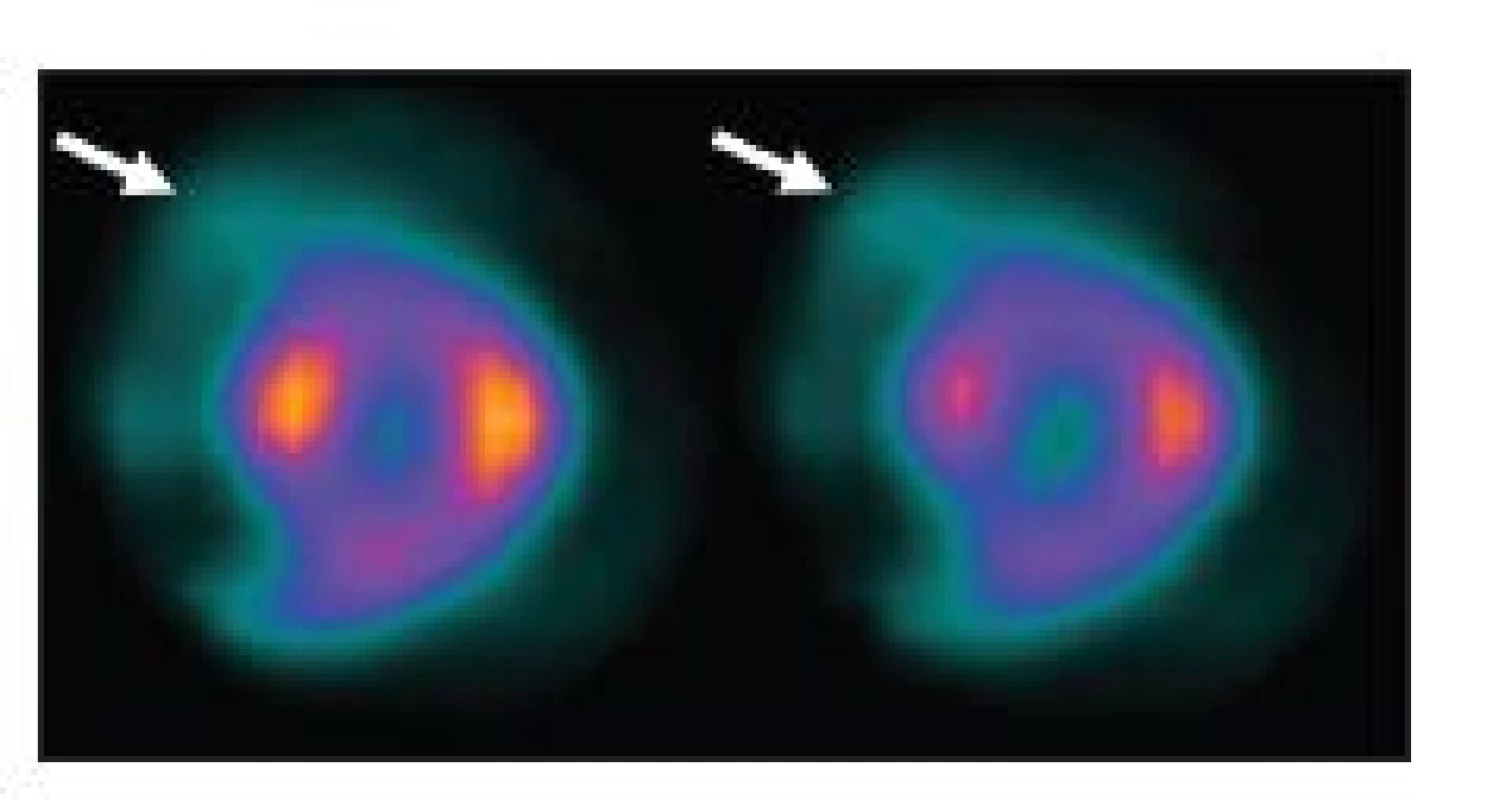
Minimální pohyb pacienta v průběhu vyšetření může být při hodnocení ignorován. V některých situacích je možno pohyb zkorigovat pomocí k tomu určenému softwaru, zejména při menším posunu srdce. Vždy je ale nutné výsledek dobře zkontrolovat, protože korekce může být chybná – příčinou bývá extrakardiální ložisko radioaktivity, velký perfuzní defekt nebo komplikovaný pohyb pacienta. 9
Někdy je ale jediným správným řešením opakování záznamu. Pokud lze podle stavu pacienta předpokládat (ideálně před aplikací radiofarmaka), že záznam bude z důvodu pohybu pacienta nekvalitní, je nutno zvážit úpravu podmínek (odsunutí termínu vyšetření, podání antitusika, zkrácení doby snímání při vyšší dávce radiofarmaka atd.).
Zeslabení záření
Zeslabení emitovaného záření patří rovněž k častým artefaktům. Závažnost se odvíjí od velikosti, tvaru, hustoty a uložení struktury, která zeslabení způsobuje. Tato struktura může být vně i uvnitř těla pacienta. 10
Nejběžnějšími příčinami zeslabení záření uloženými mimo tělo pacienta jsou různé přívěšky, náhrdelníky nebo elektrody EKG. (Obr. 4) Vzhledem k velikosti zpravidla nezpůsobují problém při hodnocení. Dalším, významnějším zdrojem zeslabení, jsou epitézy. Chceme-li se vyhnout tomuto typu artefaktů, musíme všechny pacienty před začátkem snímkování důsledně kontrolovat. Samozřejmostí musí být odložení podprsenky u žen – některé pacientky epitézy nerady přiznávají.
Obr. 4. Vybraný snímek tomografické studie, při níž pacient ležel na břiše. Odstínění záření v horní části obrázku (šipky) je způsobeno šrouby, kterými byla k vyšetřovacímu lůžku gamakamery připevněna deska prodlužující lůžko. Pacient měl být uložen tak, aby toto místo bylo mimo zorné pole. 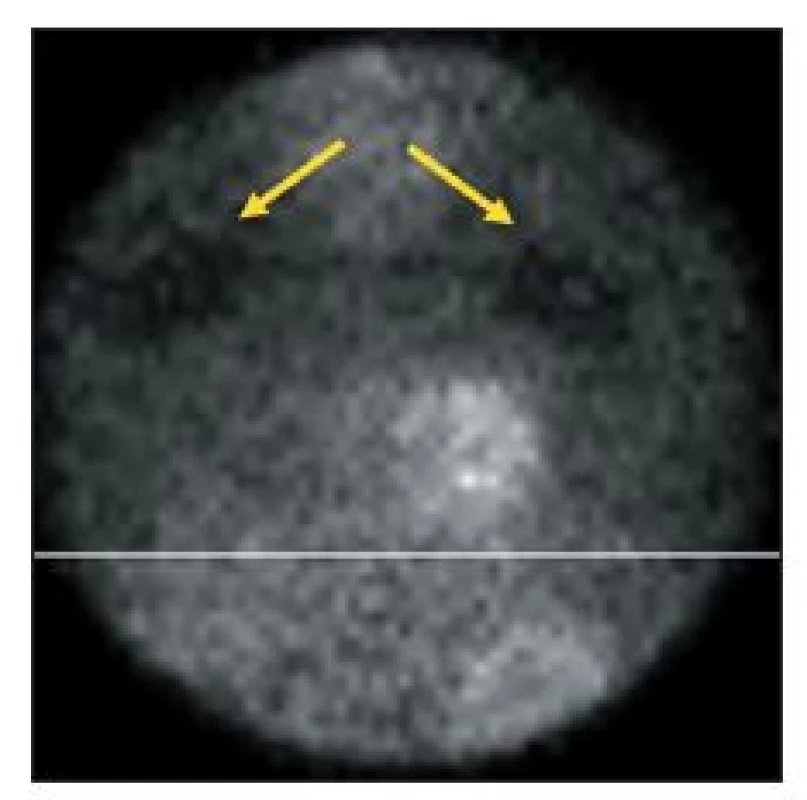
Závažnější problémy při interpretaci vyšetření způsobuje zeslabení záření tělesnými strukturami pacienta. U žen bývají příčinou zeslabení záření objemnější prsy nebo prsní implantáty. Způsobené artefakty mohou být velmi různé. Nejčastější jsou fixní defekty perfuze na anterolaterální stěně, případně na přední stěně nebo anteroseptálně, výjimečně i na boční či spodní stěně. Pokud mají prsy při každé studii jinou polohu, zobrazí se arteficiální defekt perfuze jako reverzibilní. Pro minimalizaci vzniku těchto artefaktů je důležité snímat ženy bez podprsenky – prsní tkáň se tak rozprostře stejnoměrněji. K tomuto účelu lze použít také stahovací pás. Pokud se tkáň prsu nepodaří rozprostřít, měli bychom se snažit jí vysunout kraniálním směrem, aby nepřekrývala při snímání myokard. Důležité také je zachovat v obou studiích shodnou polohu (artefakt v podobě fixního defektu se snáze identifikuje). Toho lze spíše docílit, pokud obě studie provádí stejný pracovník. 8,10 (Obr. 5, Obr. 6)
Obr. 5. Vyšetření u pacientky s prsními implantáty. Na vybraném snímku z tomografického záznamu (A) je zřetelné zeslabení záření implantátem (šipky), které způsobuje arteficiální defekt perfuze na přední stěně – zobrazeno na polární mapě (B) a vybraných tomografických řezech (C – SA, D – VLA, E – HLA). 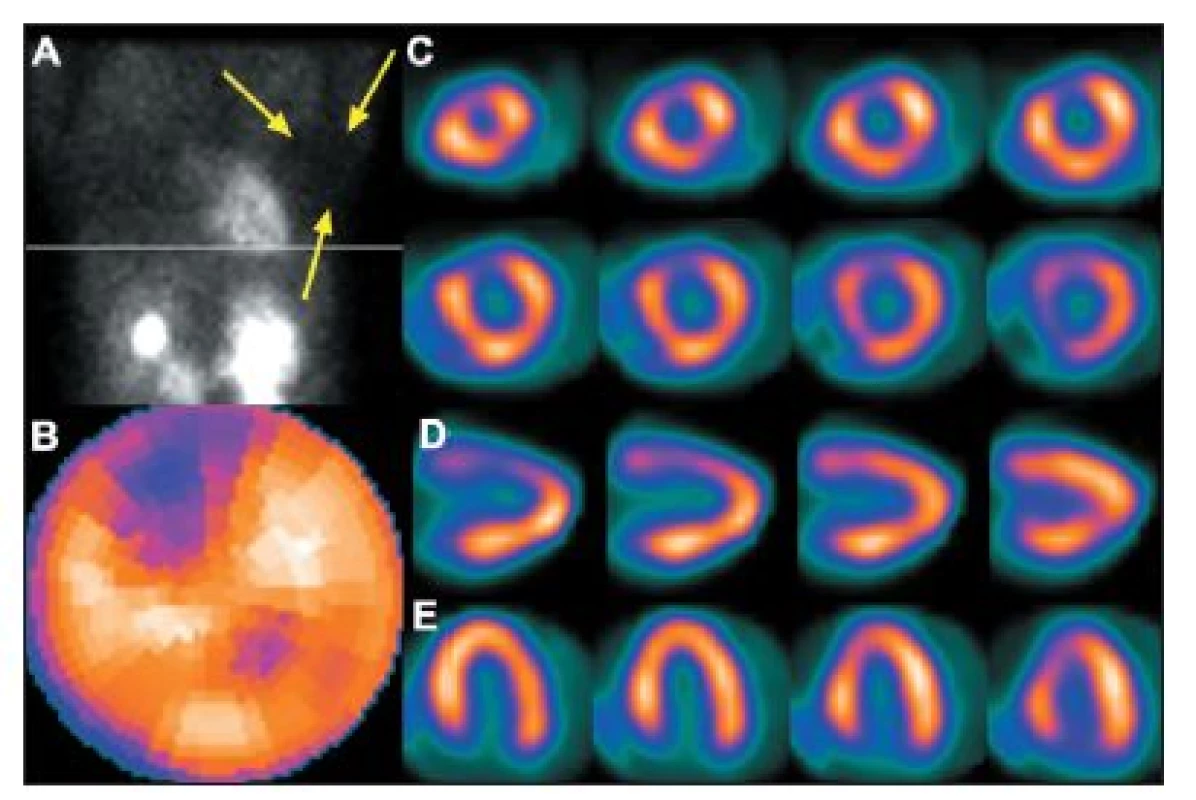
Obr. 6. Vyšetření u pacientky s objemnými prsy. Na vybraném snímku tomografického záznamu (A) je vidět zeslabení záření levým prsem (šipky), které způsobuje arteficiální defekt perfuze na přední stěně – zobrazeno na polární mapě (B) a vybraných tomografických řezech (horní řada D – SA a E – VLA). Po stejnoměrném rozprostření tkáně prsu se perfuzní defekt již nezobrazuje – polární mapa (C) a vybrané tomografické řezy (dolní řada D – SA a E – VLA). 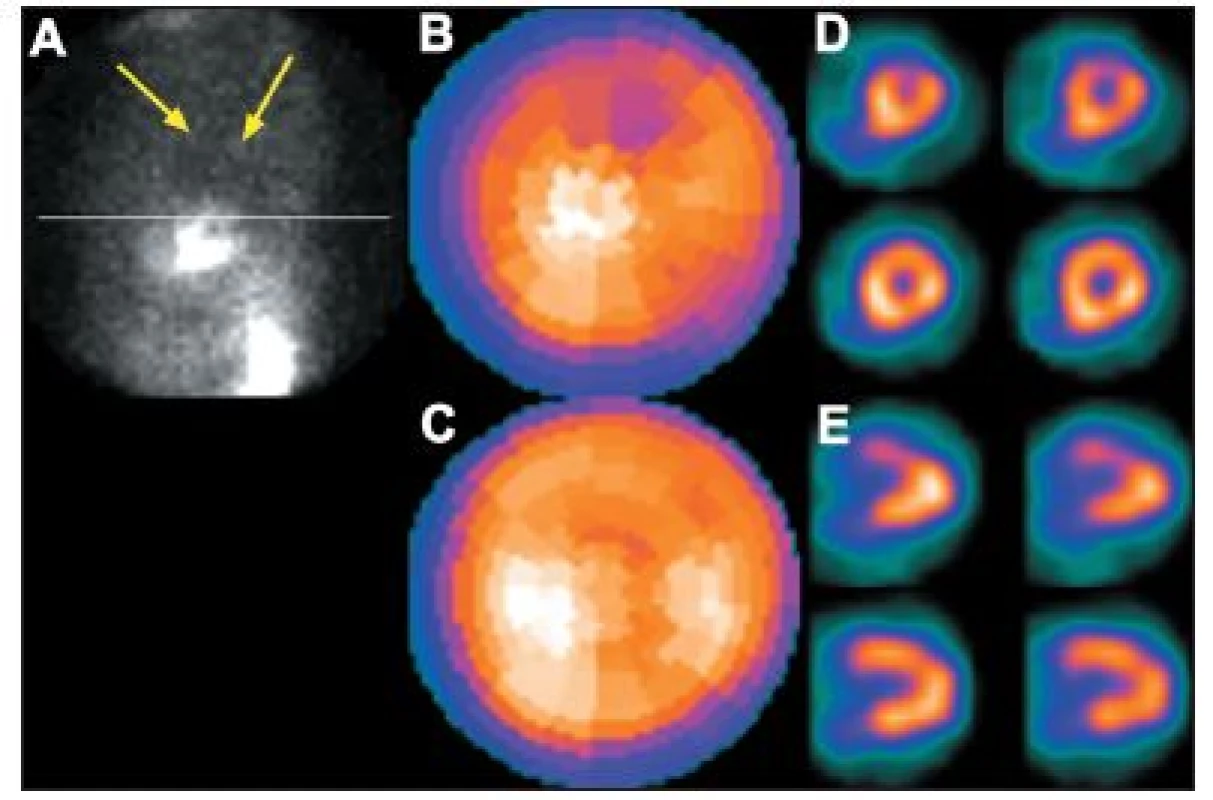
Především u mužů, zejména u mohutnějších nebo obézních, bývá nejčastějším artefaktem snížená akumulace radioaktivity na spodní stěně myokardu. Je způsobena interferencí břišních orgánů (hlavně vyšším stavem bránice a/nebo tlustým střevem). (Obr. 7) Častý je tento artefakt také u pacientů, kteří mají vyšší stav bránice z důvodu pulmonálních změn (se ztrátou objemu plic – např. u atelektázy) nebo v důsledku plného dilatovaného žaludku (např. spolykaným vzduchem u stresovaných úzkostlivých pacientů).
Obr. 7. Porucha prokrvení na spodní stěně myokardu způsobená interferencí břišních orgánů – zobrazeno na vybraných tomografických řezech (horní řada A – SA a B – VLA) a polární mapě (C). Při snímání v poloze na břiše se perfuzní defekt již nezobrazuje – zobrazeno na vybraných tomografických řezech (dolní řada A – SA a B – VLA) a polární mapě (D). 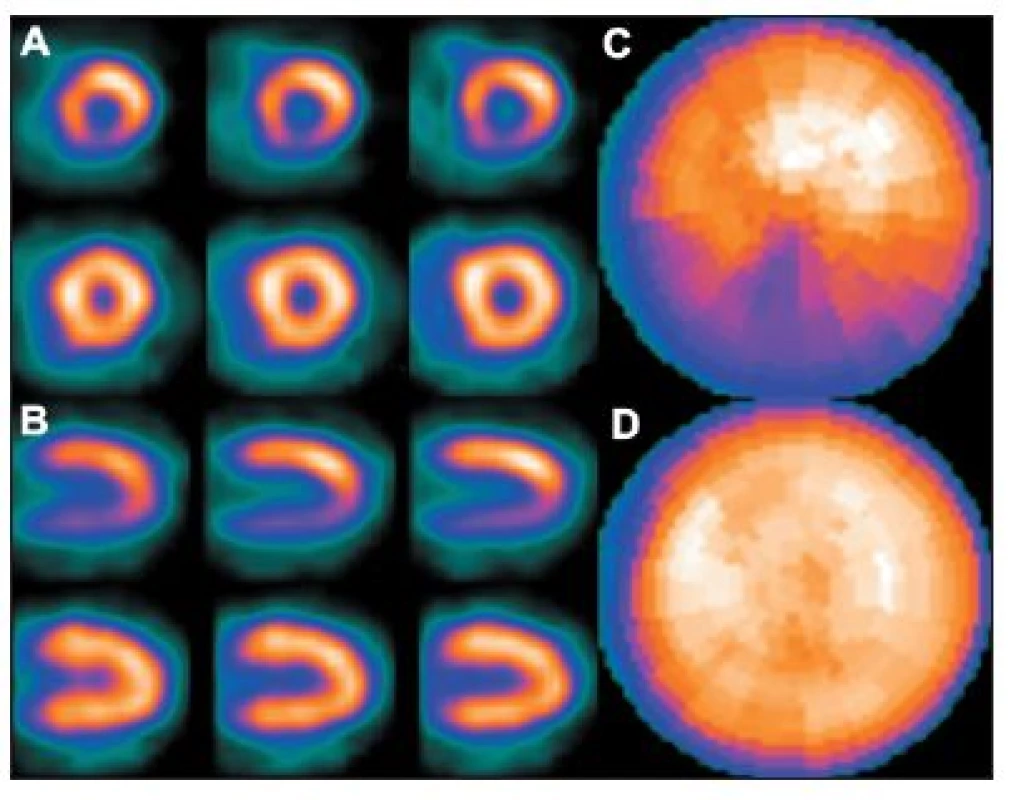
Překrývat spodní stěnu levé komory a tím zeslabovat záření může také ascites nahromaděný pod levou polovinou bránice nebo střevo plné baryové kontrastní látky po předchozím rtg vyšetření (často v rámci komplexního vyšetření pro bolesti na hrudi). 11
Jedná se zpravidla o fixní defekt perfuze na spodní stěně (reverzibilní při náplni žaludku – mění se v čase). Při zastínění slezinným ohbím tračníku nebo ascitem může být defekt perfuze i inferolaterálně. 12 Možností, jak odlišit tento artefakt, je opakované snímání, při němž pacient leží na břiše. Uložení břišních orgánů se změní a defekt perfuze způsobený zeslabením se nezobrazí. 8,10,11,13
U obézních pacientů obou pohlaví bývá vrstva tuku uložená i na boční straně hrudníku. Je rozložená rovnoměrně a zeslabuje obvykle záření z celé boční stěny myokardu. Tento artefakt se zobrazuje jako fixní defekt perfuze. 8,10
Jedná-li se o některý z výše uvedených artefaktů, bývá obvykle v místě fixního defektu normální kinetika srdeční stěny (pohyb i ztluštění). U skutečných jizev je kinetika porušená. Výjimkou jsou netransmurální jizvy, u nichž zůstává kinetika neporušená. 8,10
Pro identifikaci tohoto typu artefaktu je důležité vždy dobře prohlédnout nasnímaná data (v cine formátu) – obvykle na nich lze identifikovat možné artefakty způsobené zeslabením. Nesmí se zapomínat ani na anamnézu, z níž můžeme získat řadu důležitých informací, např. informaci o mastektomii, prsních implantátech, onemocněních plic nebo rtg vyšetřeních. Pomůckou pro odlišení artefaktů může být i kvantitativní hodnocení, kdy se nasnímaná data porovnávají s normálovou databází. Ta je jiná pro ženy i pro muže a zohledňuje typické zeslabovací artefakty. Normálová databáze je vytvořená z průměrné populace – u pacientů s atypickou postavou může tedy při porovnávání vzniknout artificiální defekt perfuze. Klasickým příkladem jsou ženy po ablaci levého prsu. U nich je proto doporučováno srovnání s mužskou normálovou databází. 8,10 Naopak u mužů s gynekomastií je vhodnější porovnání s ženskou normálovou databází. 11
Možností, jak odstranit artefakty tohoto typu, je, kromě již zmíněného snímání v poloze na břiše, korekce na zeslabení pomocí externího transmisního zdroje nebo CT. Jejich použití má své klady i zápory. Více je uvedeno v odstavci Registrace obrazů.
Extrakardiální akumulace radiofarmaka
Většina artefaktů z této skupiny souvisí se způsobem vylučování radiofarmak značených 99mTc – z těla se vylučují převážně hepatobiliárním systémem. Proto se současně s myokardem zobrazí také játra a postupně i různé části střeva. Pokud má pacient duodenogastrický reflux (DGR), zobrazí se i obsah žaludku. Nenavázaný 99mTc-pertechnetát vede k zobrazení žaludeční sliznice. Vzácné jsou případy, kdy se takto zobrazí i hiátová hernie. 8,13,14
Některé z těchto struktur mohou v určitých pohledech překrývat část myokardu, především jeho spodní stěnu, vzácně i boční stěnu. Vznikají tak dvě v důsledku opačné situace. Překrytím stěny myokardu jinou (akumulující) strukturou může být „zamaskována“ oblast se sníženou perfuzí, což vede k falešně negativnímu závěru vyšetření. 8 (Obr. 8) Opačný výsledek, tj. arteficiální defekt, pak má tzv. ramp-filter artefakt – při zpracování obrazů pomocí filtrované zpětné projekce (FBP – filtered back projection) se zobrazuje okolí ložiska s vysokou radioaktivitou jako místo s nižší radioaktivitou, než je reálný stav. Jestliže je ložiskem vysoké radioaktivity část jater nebo střeva překrývající stěnu myokardu, přiléhající část srdeční stěny se jeví jako málo prokrvená. 9,15 (Obr. 9)
Obr. 8. Příklad studie, u níž se část střeva nachází v těsné blízkosti spodní stěny myokardu – viz vybraný snímek tomografického záznamu (A). V tomto případě je překrytím stěny myokardu střevem „zamaskována“ oblast se sníženou perfuzí myokardu – polární mapa (C). Na opakovaném záznamu po odsunutí radioaktivity do nižších partií zažívacího traktu střevní peristaltikou – viz vybraný snímek tomografického záznamu (B) – se uvedený artefakt již nezobrazuje – polární mapa (D). 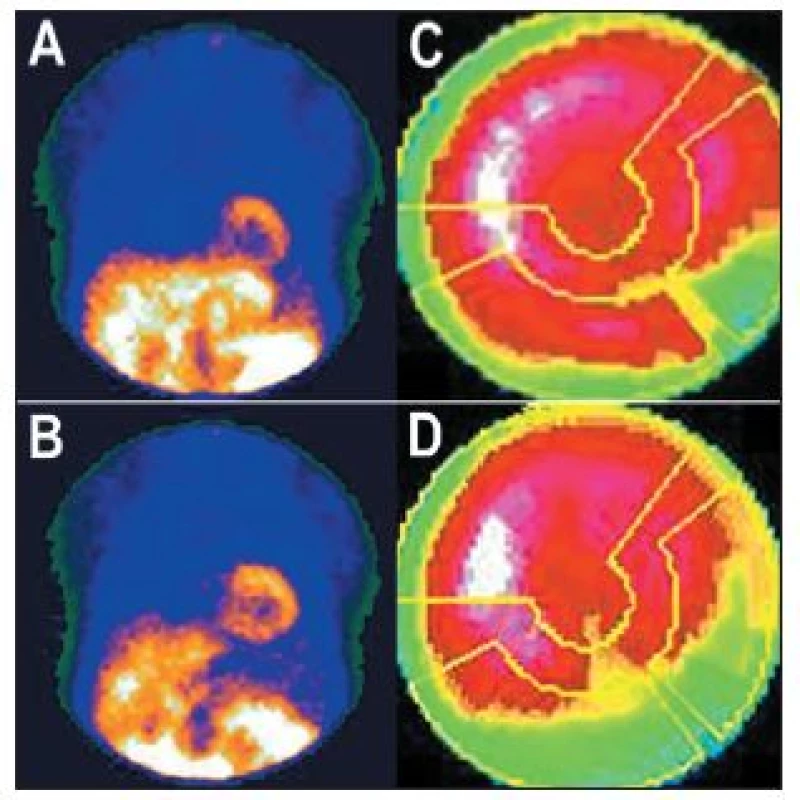
Obr. 9. Příklad studie (použita FBP), u níž se část střeva nachází v těsné blízkosti spodní stěny myokardu – viz vybrané tomografické řezy (A). Na polární mapě (C) se zobrazuje tzv. ramp-filter artefakt – okolí ložiska s vysokou radioaktivitou (= část střeva) (modrá šipka) se zobrazuje jako místo s nižší radioaktivitou, než je reálný stav (černá šipka). Je-li při zpracování dat pečlivě odříznuta radioaktivita ve střevě – viz tomografické řezy (B), uvedený artefakt se na polární mapě nezobrazí (D). 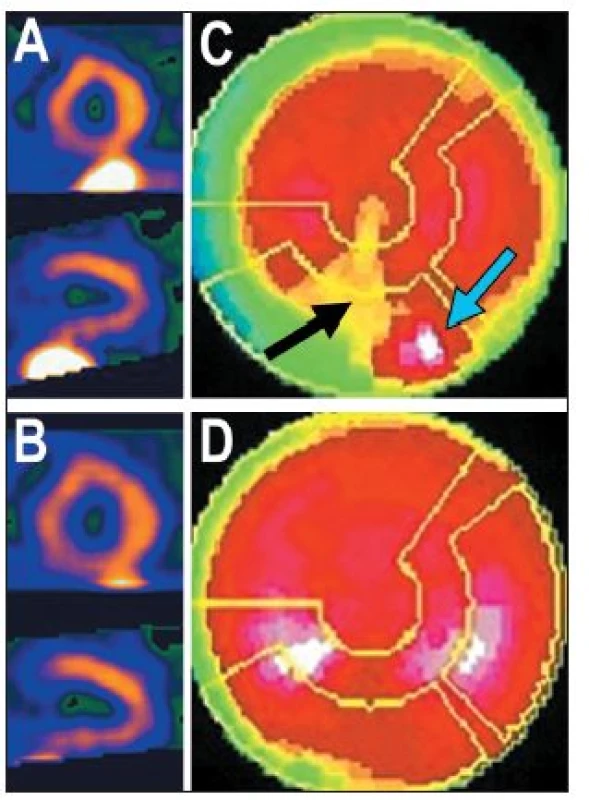
K podobnému efektu dochází i při kvantitativní analýze: sumací radioaktivity v játrech či střevu s radioaktivitou v myokardu vzniká oblast s vysokou radioaktivitou. K ní je normována ostatní část myokardu, která se proto jeví na polární mapě jako oblast se sníženou perfuzí. 10
Nejlepším řešením by bylo radioaktivitu z trávicího traktu zcela eliminovat, to je ale v praxi nedosažitelné. Lze však její množství snížit a do určité míry i ovlivnit lokalizaci. K snížení množství radioaktivity v játrech i dalších orgánech přispívá fyzická aktivita pacienta: tělesné cvičení stimuluje vyplavování radiofarmaka z jater a díky zvýšení průtoku krve v pracujícím kosterním svalstvu se sníží průtok krve a tím i množství radiofarmaka v útrobách. Proto je vhodné i k farmakologickému zátěžovému testu přidat alespoň mírnou tělesnou zátěž. 8,15 Uvedené tvrzení podporují například dvě studie publikované Thomasem a Vitolou, v nichž se hodnotí poměr radioaktivity srdce/játra u pacientů, u nichž byla farmakologická zátěž doplněna fyzickou aktivitou oproti pacientům, kteří absolvovali pouze farmakologický test. V obou případech došlo ke zvýšení tohoto poměru: z 1,05 na 1,21 16, respektive ze 1,3 na 1,6. 17 K eliminaci („vypláchnutí“) radioaktivity ze žaludku (při DGR) je dostačující, vypije-li pacient před snímkováním sklenici vody. Současně tak dochází i k vyvolání gastrokolického reflexu a tím k posunutí radioaktivity v trávicím traktu, což může pomoci, pokud je myokard překrýván částí střeva. Na druhé straně to však může vést k posunutí střevního obsahu do slezinného ohbí tlustého střeva s následným artefaktem. K snížení radioaktivity v játrech se v dříve publikovaných studiích také doporučovalo po podání radiofarmaka pít mléko. 18 K tomuto účelu a rovněž k eliminaci radioaktivity ze žlučníku se v praxi více osvědčilo podání několika soust tučného jídla (např. čokolády). 13,19 Radioaktivita v játrech se s časem postupně snižuje, zatímco v myokardu k redistribuci nedochází. Proto je potřeba provádět snímkování v určitém odstupu po aplikaci radiofarmaka. Ten se liší podle konkrétního použitého preparátu a je vždy uveden v SPC (summary of product characteristics). Někdy je vhodné provést i opakované snímkování s delším časovým odstupem od aplikace radiofarmaka. 8
Částečně lze vliv extrakardiální akumulace radiofarmaka na výsledné hodnocení (kvantitativní analýzu, výpočet ejekční frakce (EF) a objemu levé komory (LK)) zmírnit precizním postupem při počítačovém zpracování nasnímaných dat – snažit se nezahrnout do oblasti zájmu pro další zpracování místo s extrakardiální akumulací RF. 8 Vliv extrakardiální radioaktivity na kvalitu obrazů redukuje také použití iterativní rekonstrukce. 3 (Obr. 10)
Obr. 10. Tatáž studie jako na Obr. 9, ale zpracovaná pomocí iterativní rekonstrukce. Vybrané tomografické řezy (A) a polární mapa (C), pokud do oblasti zájmu pro další zpracování bylo zahrnuto i místo s extrakardiální akumulací radiofarmaka (RF) – při kvantitativní analýze/na polární mapě je defekt na spodní stěně méně výrazný než při použití FBP (viz Obr. 9); pro srovnání vybrané tomografické řezy (B) a polární mapa (D), pokud do oblasti zájmu pro další zpracování nebylo zahrnuto místo s extrakardiální akumulací RF. 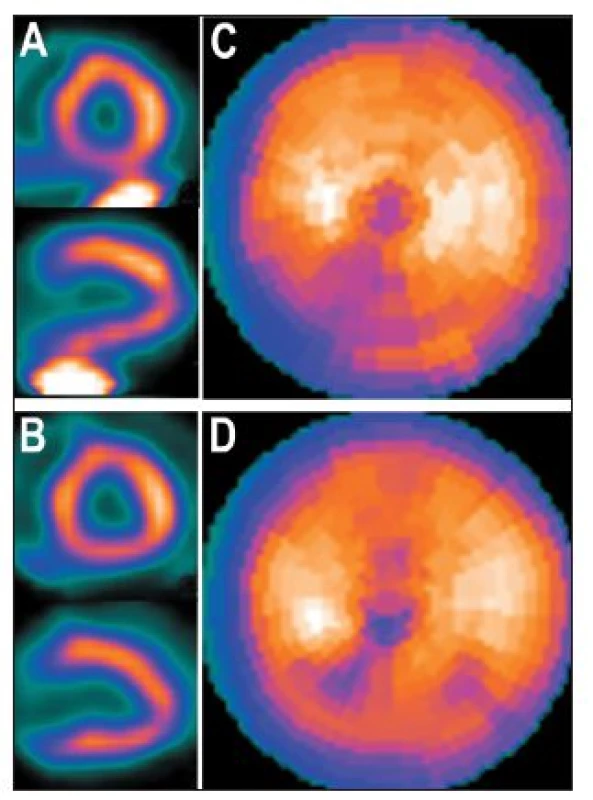
Artefakty způsobené extrakardiální akumulací RF se mohou projevit jako fixní i jako reverzibilní defekty. Pro přítomnost artefaktu jednoznačně hovoří horší stav perfuze v klidu než při zátěži. 8 Zásadní je vždy dobře prohlédnout nasnímaná data (v cine formátu) – obvykle na nich lze možné artefakty odlišit. Napovědět může i porovnání stavu perfuze a funkce.
Synchronizace (hradlování, gating, fázování) tomografického záznamu s EKG křivkou
Příčiny artefaktů souvisejících se synchronizací je třeba hledat ve tvaru EKG křivky. Jako synchronizační signál se standardně používá R-kmit. Pokud je nevýrazný, obtížně rozpoznatelný, nepravidelný nebo zaměnitelný s jinou částí křivky, záznam dat neprobíhá správně a hodnoty získané zpracováním takových dat jsou zkreslené. Nečistoty na kůži, ochlupení pacienta, špatně nalepené nebo nekvalitní elektrody jsou možné příčiny zvýšeného odporu mezi elektrodami a kůží 8 a tím i nekvalitní křivky EKG. K podobnému výsledku vede i nalomený kabel mezi pacientem a EKG přístrojem nebo pohyb pacienta.
Jako synchronizační impulz bývá zaregistrována i jiná část EKG křivky, která je podobná R kmitu (vysoká vlna T, extrasystola, impulz z kardiostimulátoru). Důsledkem je, že se do stejného fázového obrazu ukládají data z různých částí srdečního cyklu a nasnímané údaje pak neodpovídají realitě. 10
Velkým problémem synchronizace jsou arytmie. V důsledku různé délky jednotlivých srdečních cyklů nejsou data uložená do jednotlivých fázových obrazů vždy z přesně stejné části srdečního cyklu. Nemusí být tudíž přesně určena end systola a end diastola a výpočet funkčních parametrů levé komory je pak nepřesný. 8,9,13,15 (Obr. 11) Více náchylné k chybám, jak dokládají například studie Nicholsna 20,21, je ale zobrazení pohybu (motion) a ztluštění (thickening) srdeční stěny.
Obr. 11. A – studie, u níž došlo k rozsáhlé chybě při synchronizaci – místo 8 sérií byla data zaznamenávána jen do čtyř. Objemová křivka má atypický tvar. B – opakovaná studie u téhož pacienta již bez poruchy synchronizace. Objemová křivka má obvyklý tvar. Je zřejmý rozdíl ve výpočtu funkčních parametrů mezi oběma studiemi. 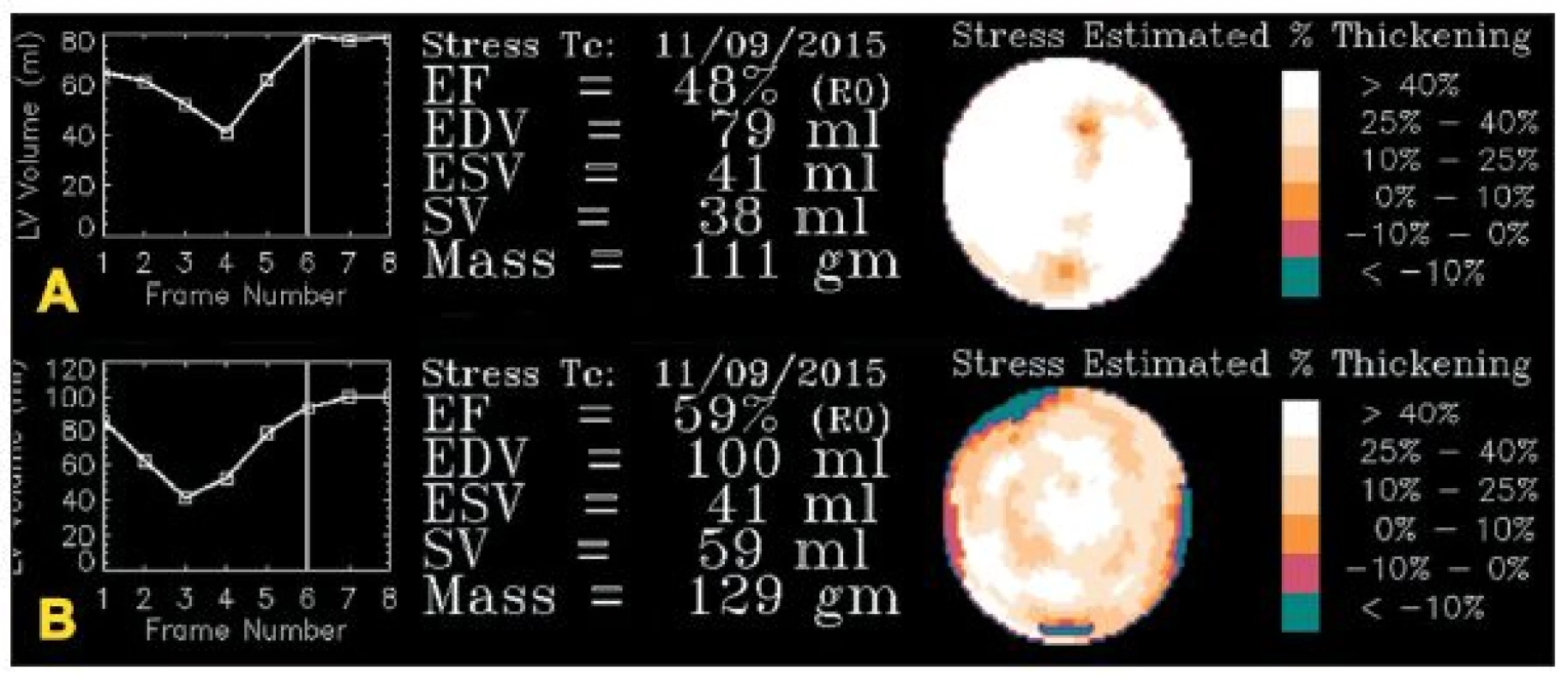
Důsledkem výše uvedených situací je také malý počet impulzů v obrazech z některých fází srdečního cyklu – při prohlížení nasnímaných dat v cine formátu se projeví jako „problikávání“. 8,9 (Obr. 12) Při dalším zpracování dat se proto zpravidla provádí (softwarová) korekce počtu impulzů odvozená od počtu cyklů, které přispěly do jednotlivých fázových obrazů. 22 K menšímu zkreslení záznamu přispěje rozdělení srdečního cyklu na větší počet fázových obrazů (zpravidla 16 oproti běžnějším 8). 13 Také použití iterativní rekonstrukce při zpracování nasnímaných obrazů (oproti filtrované zpětné projekci) znamená menší riziko vzniku artefaktů a tím ovlivnění klinické interpretace vyšetření, jak uvádí například Hatton. 23
Obr. 12. Vybraný snímek tomografické studie s „problikáváním“. Objevuje se při prohlížení nasnímaných dat v cine formátu u synchronizovaného záznamu, pokud je v některých fázových obrazech zaznamenán malý počet impulzů. 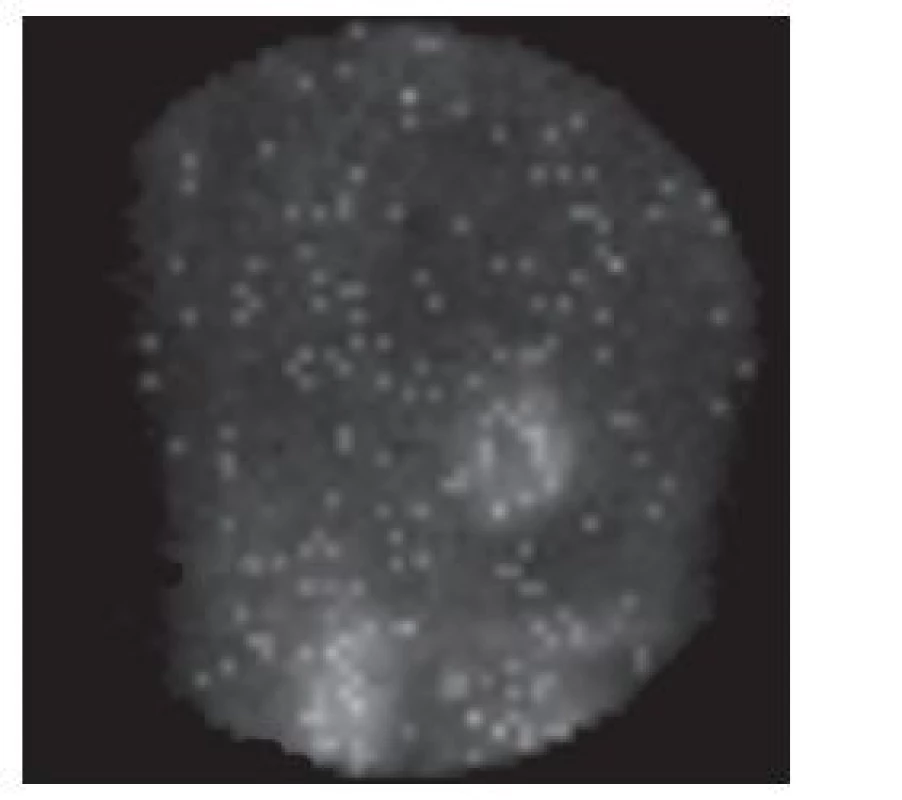
Řešením je zaznamenávat pouze data ze srdečních cyklů, jejichž délka se příliš neliší od průměrného cyklu. Meze pro výběr zaznamenávaných cyklů se obvykle volí ± 10 %. Srdeční cykly, jejichž doba trvání je jiná než u průměrných cyklů, se nezaznamenají. Každý z kroků tomografického záznamu je limitovaný počtem zaznamenaných cyklů, což zajišťuje dostatečný počet impulzů v jednotlivých fázových obrazech. Tento postup má ale i svou negativní stránku: prodlužuje se celková doba snímání, snižuje se komfort pacienta a zvyšuje se riziko pohybu. 24 Ideální je proto volit parametry záznamu dat individuálně, podle stavu konkrétního pacienta (meze pro výběr zaznamenávaných cyklů, délka záznamu v jednom kroku tomografie na čas nebo na počet přijatých cyklů).
Alternativním synchronizačním signálem nezávislým na EKG křivce je pulsová vlna snímaná pletysmografem. Bylo prokázáno, že se hodnoty funkčních parametrů při synchronizaci pomocí EKG křivky neliší od hodnot získaných při synchronizaci pulsovou vlnou. Tento způsob synchronizace se nabízí jako řešení např. v situacích, kdy je na EKG křivce úsek podobný R kmitu, R kmit je zdvojený (u pacientů s kardiostimulátorem) nebo je R kmit nevýrazný. 25
Nepřesná synchronizace může být za určitých okolností také příčinou artefaktů při posuzování perfuze. 8 Zejména při používání starších záznamových nebo vyhodnocovacích systémů je stav perfuze hodnocen z obrazů vytvořených sumací synchronizovaného záznamu. Jsou-li velké rozdíly v délce jednotlivých srdečních cyklů, okno pro výběr zaznamenávaných cyklů je úzké a krok tomografického záznamu je limitovaný časem, bude málo zaznamenaných impulzů v jednotlivých krocích tomografického záznamu a hodnocené obrazy budou nekvalitní. V literatuře je proto doporučováno u pacientů se závažnými arytmiemi volit raději nesynchronizovaný způsob záznamu dat. 8,13 U novějších systémů už není limitováno množství ukládaných dat – pro hodnocení perfuze proto mohou být zvlášť ukládána data ze všech cyklů a pro hodnocení funkce se použijí pouze data vybraná při synchronizaci. K výše uvedené situaci tím pádem nedochází.
Artefakty související se synchronizací lze identifikovat při pečlivém prohlížení nasnímaných dat včetně cine formátu, ale zejména ze sinogramu, nápovědou může být i tvar objemové křivky. (Obr. 13) Výhodnější je samozřejmě jim v rámci možností předcházet – dobře očistit kůži, pečlivě nalepit elektrody, kontrolovat stav kabelů a zajistit pohodlí pacienta. Důležité je také během snímkování sledovat podobu EKG křivky, případné problémy odstranit a záznam opakovat. 13
Obr. 13. Objemová křivka s dvěma vrcholy – synchronizace u této studie neproběhla správně. 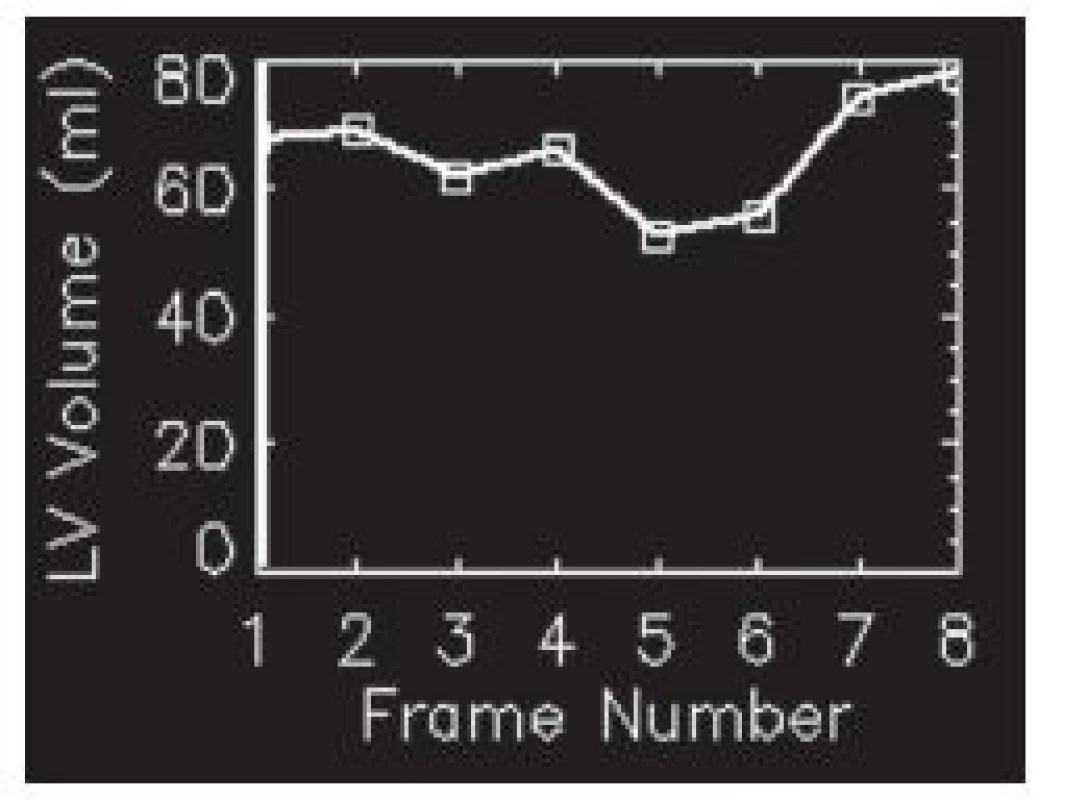
Zvláštnosti pacienta
Blokáda levého raménka Tawarova
Při blokádě levého raménka Tawarova (LBBB – left bundle branch block) se poměrně často zobrazuje arteficiální defekt perfuze (tj. bez anatomické stenózy v povodí sestupného raménka levé věnčité tepny) s maximálním vyjádřením v oblasti mezikomorového septa. (Obr. 14)
Obr. 14. Studie pacienta s LBBB – zobrazuje se arteficiální defekt perfuze v oblasti septa na vybraných tomografických řezech (A – SA, B – VLA, C – HLA) a polární mapě (D). 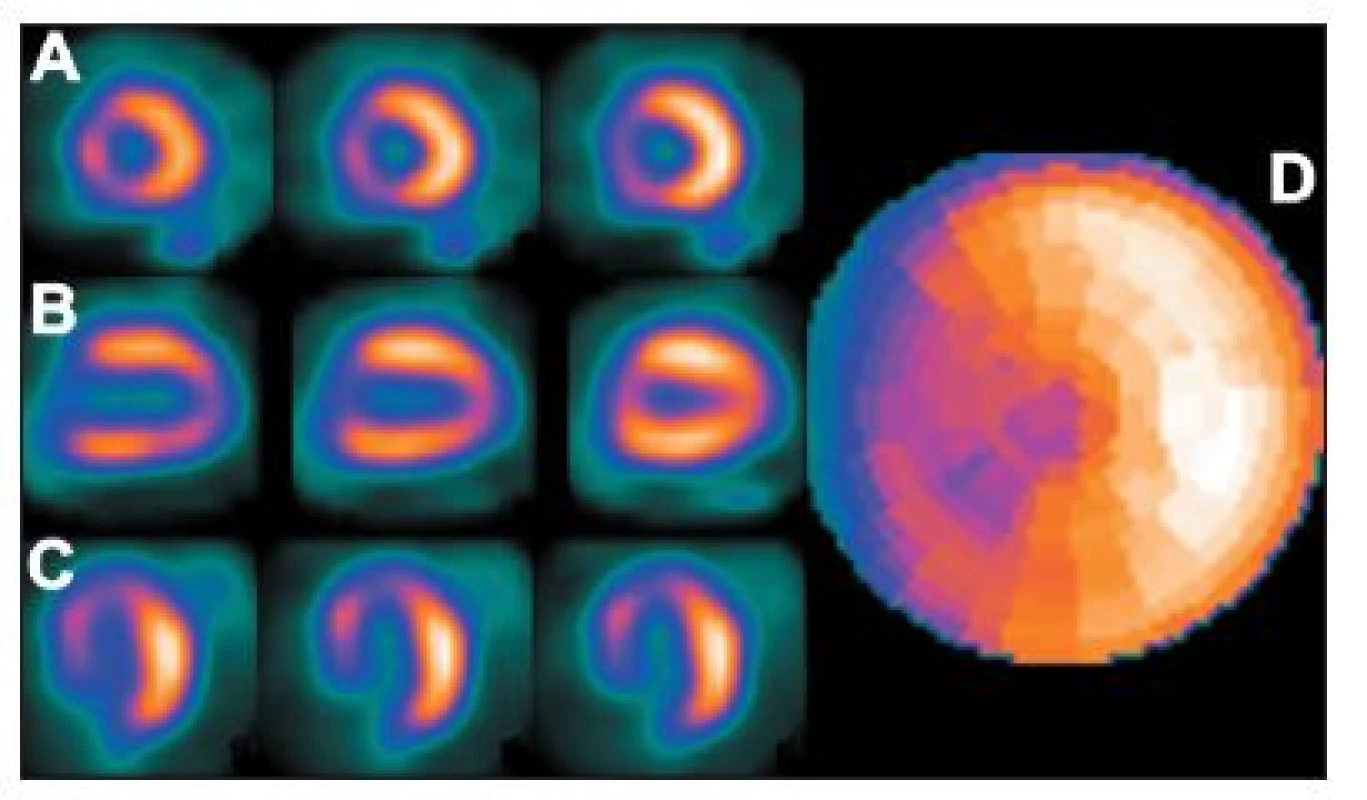
Četnost výskytu je udávána v rozpětí 30–90 % podle toho, zda se obraz hodnotí vizuálně nebo kvantitativně. 11 U těchto pacientů vzruch přechází (v důsledku blokády) na levou komoru z pravé komory – je proto zpožděný a zpožděná je tím i kontrakce septa levé komory. Důsledkem je pak snížené prokrvení septa (funkční hypoperfuze). Problém se zvýrazňuje při zvýšení tepové frekvence, kdy se zkracuje délka diastoly a průtok krve v septu dále klesá. Z tohoto důvodu jsou pacienti s LBBB indikováni k farmakologické zátěži pomocí dipyridamolu, adenosinu nebo regadenosonu, kdy se tepová frekvence zvyšuje jen minimálně. 8 Například Lebtahi uvádí 30–40 % falešně pozitivních nálezů při použití fyzické zátěže oproti 2–5 % u zátěže pomocí dipyridamolu. 26 Zobrazený defekt perfuze může být fixní i reverzibilní. Při blokádě pravého raménka Tawarova (RBBB – right bundle branch block) nebyl podobný artefakt prokázán. 11
Změna polohy srdce
Také abnormální uložení či poloha srdce v hrudníku mohou mít v některých případech za následek vznik artefaktu. Mění se vzájemná poloha jednotlivých částí srdce a detektoru (např. vzdálenost, sklon) a tím se zdánlivě mění množství radioaktivity v jednotlivých částech myokardu. Získání kvalitních obrazů proto vyžaduje nestandardní postup při snímání – doporučuje se buď snímat s rotací 360° nebo snímat s rotací 180°, ale zvolit oblouk rotace tak, aby nejlepší septální (LAO - levý přední šikmý) pohled byl ve středu oblouku rotace. 11 Při interpretaci pak musí být samozřejmě změněná poloha jednotlivých částí srdce brána v úvahu. Skutečnosti neodpovídají ani výsledky kvantitativní analýzy – při srovnání s normálovou databází nejsou porovnávány adekvátní údaje (např. při dextrokardii je porovnávána boční stěna LK pacienta se septem v normálové databázi a naopak). 8
- Dextrokardie – uložení srdce v pravé části hrudníku. 27 (Obr. 15, Obr. 16)
Obr. 15. Vybrané tomografické řezy (A – SA, B – VLA, C – HLA) a polární mapa (D) pacienta s dextrokardií (snímáno přes pravý bok) – zřetelné je změněné rozložení radioaktivity, jiná poloha boční stěny a septa. Rovněž kvantitativní analýza neodpovídá realitě – tato studie je porovnávána s běžnou normálovou databází. 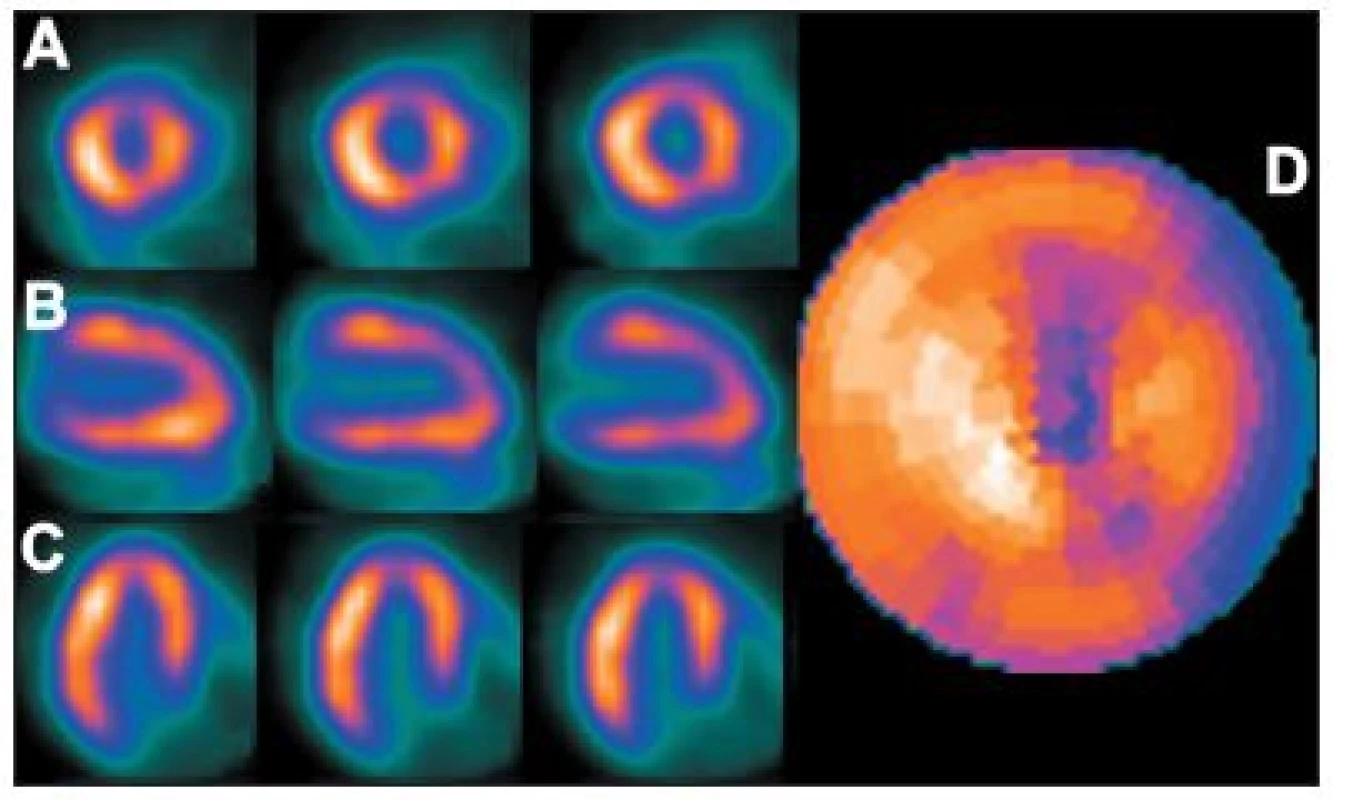
Obr. 16. Studie pacienta s dextrokardií – vybrané snímky tomografické studie (orbita 180°) a polární mapy: standardní snímání, tj. přes levý bok (A + B) a vhodnější snímání přes pravý bok (C + D). 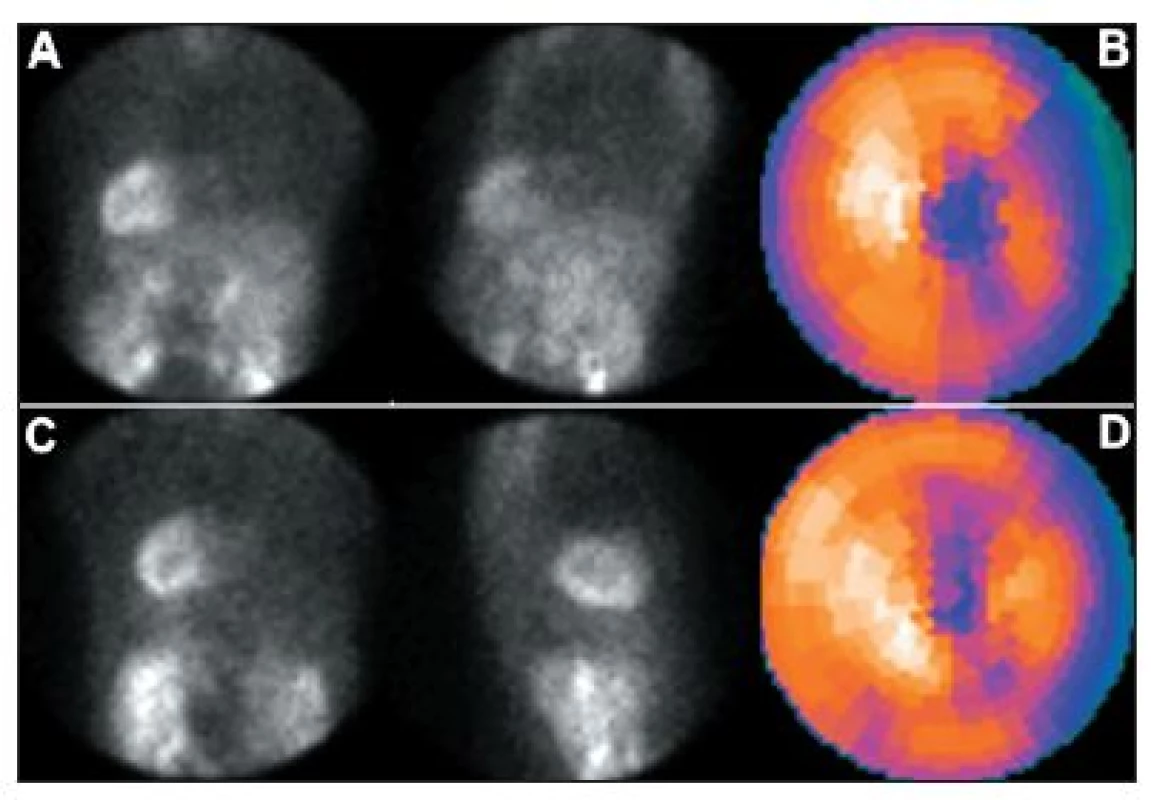
- Dextrorotace a levorotace – abnormální rotace srdce podél dlouhé osy doprava nebo doleva. U dextrorotace leží septum blíže detektoru v pravé přední šikmé a přední projekci a boční stěna je dále od detektoru v boční a levé zadní šikmé projekci, což se zobrazuje jako relativní zvýšení radioaktivity na septu a relativní snížení radioaktivity na boční stěně. Naopak u levorotace je boční stěna blíže detektoru při boční a levé zadní šikmé projekci a septum je dále od detektoru v přední a pravé přední šikmé projekci. Stav se zobrazuje jako relativní snížení radioaktivity na septu. 28
- Dextroverze – srdce je uloženo v levé části hrudníku, ale srdeční hrot směřuje vpravo. 27
- Inverze komor u korigované transpozice velkých cév – stav, kdy anatomická pravá komora zastává roli komory levé a naopak. 27,29
Apikální jamka
Vrchol srdečního hrotu se u některých osob zobrazí jako místo se sníženým množstvím radioaktivity. Jedná se o fyziologické ztenčení myokardu, které se označuje jako apikální jamka. Stav je dobře patrný na řezech ve vertikální dlouhé ose. Pokud není v těchto případech pro tvorbu polárních map správně vymezena hranice mezi komorou a hrotem (není na okraji komory, ale ve stěně hrotu), je část apikální jamky programem zahrnuta k boční stěně nebo k septu. Toto místo se pak zobrazí na polární mapě jako oblast s (arteficiálně) sníženou perfuzí. 28 (Obr. 17)
Obr. 17. Snížené množství radioaktivity na vrcholu srdečního hrotu (apikální jamka). Hranice mezi komorou a hrotem není určena na okraji komory, ale ve stěně hrotu (C) – na polární mapě se toto zobrazuje jako arteficiální snížení perfuze v oblasti hrotu (D). 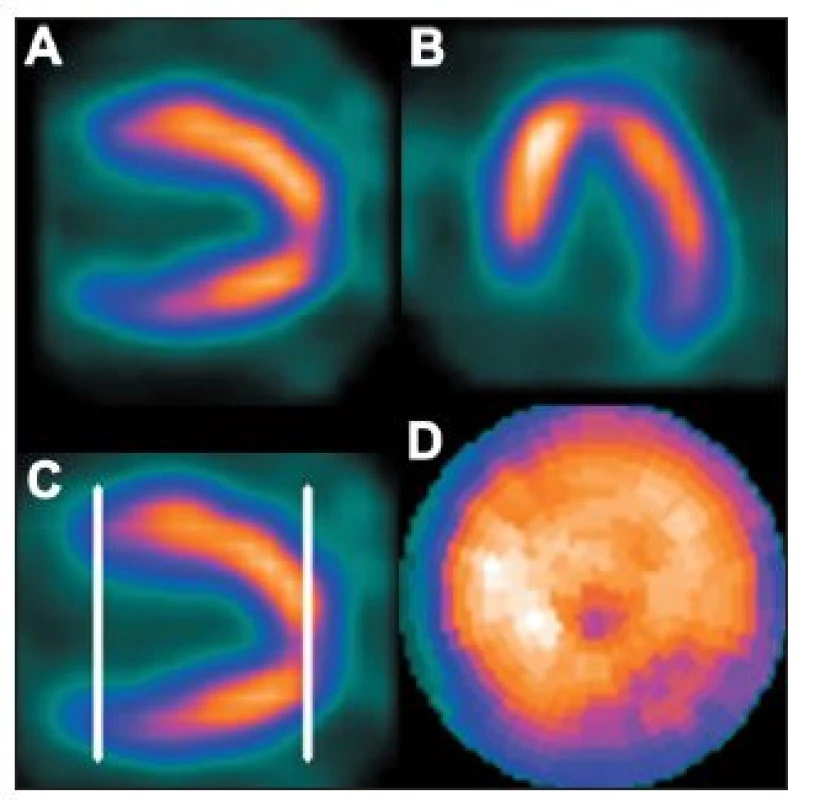
Perikardiální výpotek
Proužek s nižším množstvím radioaktivity kolem srdce bývá označován jako „haló efekt“. Příčinou je výpotek v dutině osrdečníku, který odstíní radioaktivitu z tkáňového pozadí. Při následném zpracování obrazů často vzniká problém s automatickým určením kontury levé komory a tím i s výpočtem ejekční frakce a dalších funkčních parametrů. 13
Hypertrofie myokardu
Dalším zdrojem artefaktů vedoucích k chybné interpretaci vyšetření je ložiskové zvýšení radioaktivity, jehož příčinou je lokalizovaná hypertrofie myokardu. Obvykle se označuje termínem „hot spot“. Při kvantitativní analýze je obraz normován k maximu – tedy k „hot spot“ ložisku. Zbylá část myokardu se proto pak jeví jako málo prokrvená. Kromě toho při zpracování obrazů pomocí filtrované zpětné projekce se zobrazuje okolí ložiska s vysokou radioaktivitou (tj. okolí hypertrofického ložiska) jako místo s nižší radioaktivitou, než je reálný stav (tzv. ramp-filter artefakt).
Ložiskové zvýšení radioaktivity anterolaterálně bývá nejčastěji při hypertrofii předních a/nebo zadních papilárních svalů mitrální chlopně – výraznější je u pacientů s hypertrofií levé komory. Ložiskové zvýšení radioaktivity se vyskytuje rovněž u hypertrofické kardiomyopatie (zejména na septu), s menší závažností se může objevit také u hypertenze nebo stenózy mitrální chlopně, občas se může objevit i na hrotě nebo v jiných oblastech. Popsaný artefakt se může zobrazit po zátěži nebo i při klidové studii. 8,9,10,13,15,28 (Obr. 18)
Obr. 18. Obraz ložiskového zvýšení radioaktivity označovaný termínem „hot spot“ – v tomto případě v oblasti septa (hypertrofická kardiomyopatie) (A – SA, B – VLA, C – HLA). Při kvantitativní analýze (na polární mapě – D) se zbylá část myokardu jeví jako méně prokrvená (zde zejména inferolaterálně). 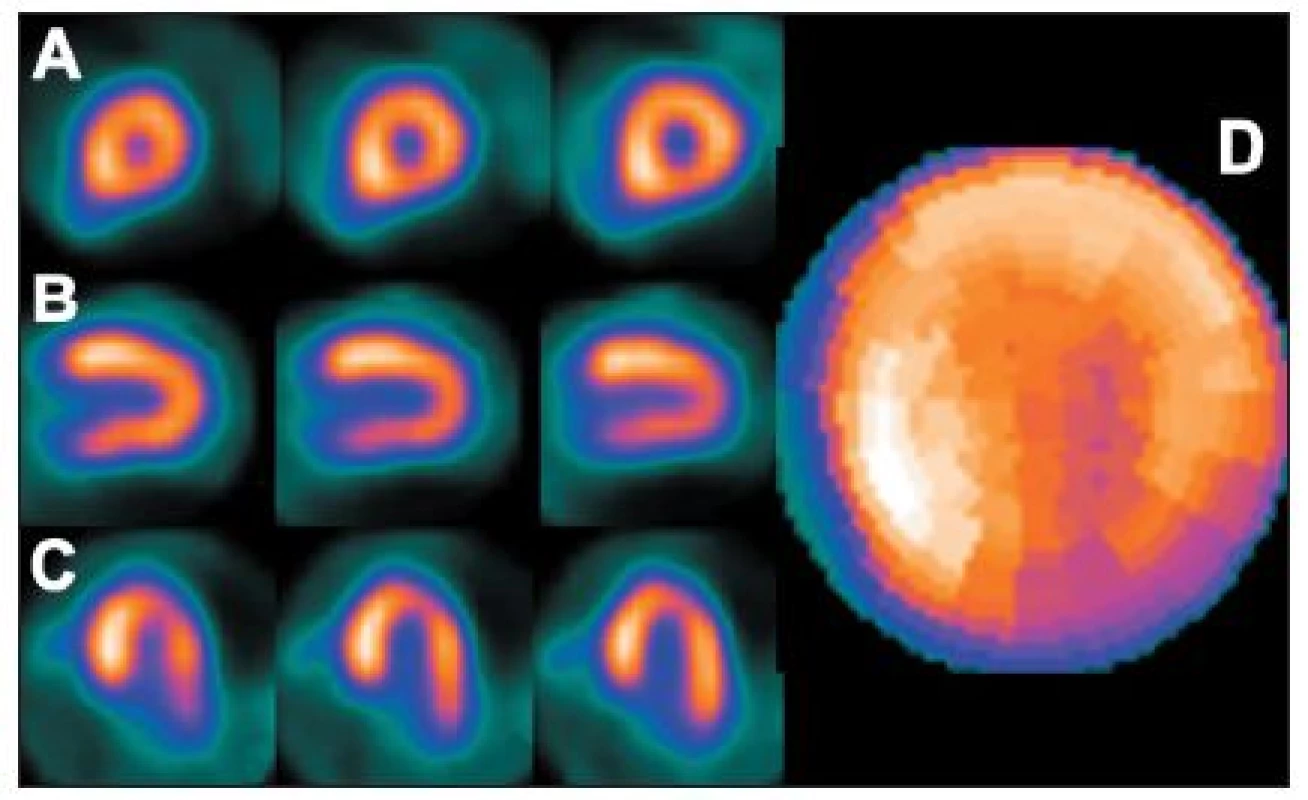
Z uvedeného lze vyvodit, že k minimalizaci rizika chybné interpretace je vhodné zpracovávat obrazy pomocí iterativní rekonstrukce. „Hot spot“ ložisko je nejsnáze rozpoznatelné na tomografických řezech. 28
ARTEFAKTY SOUVISEJÍCÍ S PRACOVNÍM POSTUPEM
Radiofarmakum
K situacím, které také mohou vést ke vzniku artefaktů, dochází i v souvislosti s aplikací radiofarmaka.
- Nízká radioaktivita RF u druhé fáze jednodenního vyšetřovacího protokolu způsobí, že není zřejmý rozdíl mezi obrazy zátěžovými a klidovými. Podle pořadí tak může být nález interpretován jako falešně pozitivní (u stress-rest protokolu – ireverzibilní defekt perfuze namísto reverzibilního) nebo falešně negativní (u rest-stress protokolu – bez defektu namísto reverzibilního defektu). 13 Dostatečný rozdíl mezi obrazy je zajištěn, pokud je radioaktivita druhé aplikace třikrát vyšší než radioaktivita první – druhá aplikace by měla vydávat třikrát více impulzů než zbývající část z první aplikace. 30
- Paravenózní aplikace radiofarmaka vede nejen k nekvalitním „zašuměným“ obrazům – nízké radioaktivitě v myokardu a vysoké v okolních tkáních, ale mění se i distribuce radiofarmaka, které se dostává například do lymfatických cest. Zobrazení radioaktivity v mízní uzlině může vyvolat podezření na přítomnost zhoubného nádoru (s důsledkem na psychiku pacienta, s nutností dalšího vyšetřování atd.). Paravenózní druhá aplikace u jednodenního protokolu má stejné následky jako podání nízké radioaktivity radiofarmaka (viz výše). 8,13 (Obr. 19)
Obr. 19. Příčinou nekvalitního záznamu (A) je částečně paravenózní aplikace radiofarmaka. Důsledkem jsou arteficiální změny perfuze – zobrazeno na vybraných tomografických řezech (horní řada C – SA, D – VLA, E - HLA) a polární mapě (F). U opakované studie, kdy byl prodloužen čas záznamu jednotlivých snímků tomografie, jsou nasnímané obrazy dostatečně kvalitní (B) a perfuze myokardu je normální (dolní řada C – SA, D – VLA, E - HLA, G). Známkou paravenózní aplikace je i zobrazení lymfatických uzlin v pravé axile (A – šipka). 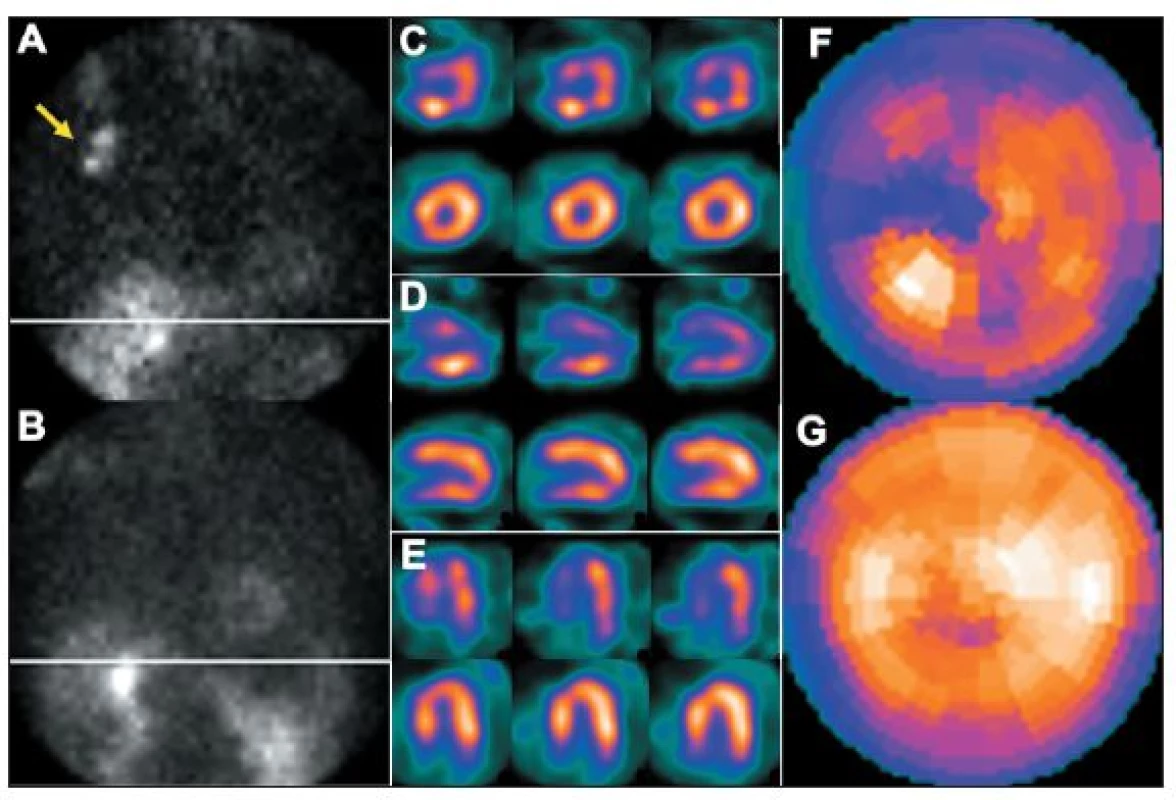
- Nahromadění radiofarmaka v rezervoáru i. v. portu může (v závislosti na lokalizaci) působit potíže při následném počítačovém zpracování, podobně jako extrakardiální akumulace radiofarmaka (viz příslušný odstavec). Může rovněž vyvolávat podezření na přítomnost maligního procesu. Při nahromadění významné části aplikované radioaktivity (např. pokud má podávané radiofarmakum vysokou měrnou radioaktivitu) je efekt stejný jako při podání nízké radioaktivity. 8
- Podezření na přítomnost maligního procesu může vzniknout také při kontaminaci oděvu nebo kůže pacienta radiofarmakem. 8
Pro minimalizaci uvedených rizik je vhodné radiofarmakum opatrně aplikovat do i. v. kanyly, kterou následně důkladně propláchneme fyziologickým roztokem. Samozřejmostí by mělo být důkladné prohlédnutí nasnímaných dat a případný záznam kontrolních snímků (po očištění kontaminovaného místa, k ověření paravenózní aplikace apod.). Varovným signálem možné paravenózní aplikace je zejména velké množství radioaktivity v tkáňovém pozadí. 8
Poloha při snímání
Na většině našich pracovišť je stále ještě standardem provádět vyšetření na konvenčních dvoudetektorových gamakamerách s polohou pacienta vleže na zádech a pokud není provedena korekce na zeslabení záření pomocí CT, je doplněna (při chabějším zobrazení spodní stěny) snímáním vleže na břiše (viz odstavec Zeslabení záření). 31 Na některých nových typech specializovaných kardiologických gamakamer ale probíhá snímání vsedě nebo v polosedě. Publikované názory na srovnatelnost obou způsobů snímání se liší. Například Verger ve své publikaci porovnává data získaná na běžné dvoudetektorové gamakameře (pacient leží) a data snímaná D-SPECTem (pacient pololeží v úhlu 55°, CZT detektor); závěrem je dobrá shoda mezi oběma výsledky s výjimkou obézních pacientů. 32 Naopak porovnání dat nasnímaných na gamakameře Spirit DHV (pacient leží) a na kameře CardioDesk (pacient sedí, NaI(Tl) detektor) publikované Langem ukazuje na statisticky významný rozdíl. 33 U relativně delšího snímání vsedě je pravděpodobný vliv pohybu pacienta – dostává se postupně do pro něj pohodlnější polohy s méně napřímenými zády. Výhodnější bude proto poloha v polosedě/v pololeže, k snížení rizika pohybu pacienta určitě pomůže také krátký akviziční čas (citlivější CZT detektory, multidetektorové systémy, apod.). I při snímání na specializovaných kardiologických gamakamerách je ale nutné k vyloučení arteficiálního defektu perfuze na spodní stěně, není-li použita korekce pomocí CT, provést snímání ve změněné poloze (GE Discovery 530c – vleže na zádech a na břiše; D-SPECT – vleže a v polosedě).
Dříve komplikovala interpretaci vyšetření na speciálních kardiologických gamakamerách nedostupnost normálových databází a programů na korekci pohybu. U nových hodnotících programů (pro GE Discovery 530c i pro D-SPECT) byl již tento problém odstraněn. Uvádí se také, že vsedě či polosedě se do určité míry mění tvar srdce. 9
Zorné pole
S artefakty souvisejícími s velikostí zorného pole detektoru se setkáváme zpravidla u velmi obézních pacientů. V některých krocích tomografického záznamu se u nich srdce zobrazuje těsně při okraji zorného pole nebo může dojít až k “odříznutí“ (truncation) části myokardu – hrotu a/nebo distální třetiny levé komory. Příkladem jsou publikace Matsumota (pacient s BMI 34,2) 34 nebo Wosnitzera (pacient s BMI 57). 35 Zejména na hrotě by artefakt mohl být interpretován jako porucha perfuze. Příčinou je kombinace velikosti zorného pole, centra rotace detektoru a tělesných proporcí pacienta.
Na přítomnost uvedeného artefaktu je nutno pomýšlet, pokud na nasnímaných datech (v cine formátu) není vidět na obou bocích obrys těla a na transverzálních řezech není eliptická kontura těla. Také nasnímaná data a zrekonstruované obrazy jsou méně kvalitní. Výskytu je možné předejít pečlivou kontrolou polohy pacienta a detektorů před začátkem snímání – pokud ke vzniku už došlo, je nutné snímání za upravených podmínek zopakovat. Nezbytné je i posouzení kvality nasnímaných dat po ukončení snímání.
Pokračování v příštím čísle.
ivana.kunikova@fnkv.cz
Zdroje
1. Činnost společných vyšetřovacích a léčebných složek 2012 [online]. 2012. [cit. 2016-01-14]. Dostupné na: http://www.uzis.cz/category/tematicke-rady/zdravotnicka-statistika/nuklearni-medicina
2. Wheat JM, Currie GM. Incidence and Characterization of Patient Motion in Myocardial Perfusion SPECT: Part 1. J Nucl Med Technol 2004;32 : 60–65
3. Germano G. Technical Aspects of Myocardial SPECT Imaging. J Nucl Med 2001; 42 : 1499–1507
4. Friedman J, Berman DS, Van Train K, et al. Patient motion in thallium-201 myocardial SPECT imaging. An easily identified frequent source of artifactual defect. Clin Nucl Med. 1988;13 : 321-324
5. Botvinick EH, Zhu YY, O‘Connell WJ, et al. A Quantitative Assessment of Patient Motion and Its Effect on Myocardial Perfusion SPECT Images. J NucI Med 1993;34 : 303-310
6. Cooper JA, Neumann PH, McCandless BK. Effect of Patient Motion on Tomographic Myocardial Perfusion Imaging. J NucI Med 1992;33 : 1566-1571
7. Nakajima K, Taki J, Michigishi T, et al. Superiority of triple-detector single-photon emission tomography over single - and dual-detector systems in the minimization of motion artefacts. Eur J Nucl Med 1998;25 : 1545–1551
8. Burrell S, MacDonald A. Artifacts and Pitfalls in Myocardial Perfusion Imaging. J Nucl Med Technol 2006; 34 : 193–211
9. Case JA, Bateman TM. Taking the perfect nuclear image: Quality control, acquisition, and processing techniques for cardiac SPECT, PET, and hybrid imaging. J Nucl Cardiol. 2013;20 : 891–907
10. Lang O, Kamínek M, Trojanová H. Nukleární kardiologie. Praha, Galén, 2008, 130p
11. DePuey EG, Garcia EV, Berman DS. Cardiac SPECT Imaging – second edition. Philadelphia, Lippincott Williams □Wilkins, 2001, 354 p
12. Wheat J, Currie G. Recognising and dealing with artifact in myocardial perfusion SPECT. The Internet Journal of Cardiovascular Research 2006;4(1)
13. Ryder H, Testanera G, Veloso Jerónimo V, Vidovič B (eds.) Myocardial perfusion imaging, A Technologist´s Guide – revised edition. Vienna, EANM, 2014, 126 p
14. Zoghbi GJ, Heo J, Iskandrian AE. Hiatal hernia detected by Tc-99m tetrofosmin SPECT. J Nucl Cardiol 2003;10 : 712-713
15. Heller GV, Hendel RC. Nuclear Cardiology: Practical Applications – sekond edition. Columbus, McGraw-Hill, 2011, 402 p
16. Thomas GS, Prill NV, Majmundar H et al. Treadmill exercise during adenosine infusion is safe, results in fewer adverse reactions, and improves myocardial perfusion image quality. J Nucl Cardiol. 2000;7 : 439-446
17. Vitola JV, Brambatti JC, Caligaris F et al. Exercise supplementation to dipyridamole prevents hypotension, improves electrocardiogram sensitivity, and increases heart-to-liver activity ratio on Tc-99m sestamibi imaging. J Nucl Cardiol. 2001;8 : 652-659
18. Van Dongen AJ, Van Rijk PP. Minimizing Liver, Bowel, and Gastric Activity in Myocardial Perfusion SPECT. J Nucl Med 2000; 41 : 1315-1317
19. Píchová R, Lang O, Kleisner I, et al. Vliv podání cholekinetika a časové prodlevy po aplikaci na kvalitu obrazu u zátěžové perfuzní scintigrafie myokardu. In Abstrakta XXXVI. Dny nukleární medicíny. Ostrava, Dům techniky Ostrava, 1999, 92 p
20. Nichols K, Yao SS, Kamran M et al. Clinical impact of arrhythmias on gated SPECT cardiac myocardial perfusion and function assessment. J Nucl Cardiol. 2001;8 : 19-30
21. Nichols K, Dorbala S, DePuey EG et al. Influence of Arrhythmias on Gated SPECT Myocardial Perfusion and Function Quantification. J Nucl Med 1999;40 : 924-934
22. AstroNuklFyzika[online]. [cit. 2016-01-14]. Dostupné na: http://astronuklfyzika.cz/
23. Hatton RL, Hutton BF, Angelides S, et al. Improved tolerance to missing data in myocardial perfusion SPET using OSEM reconstruction. Eur J Nucl Med Mol Imaging 2004;31 : 857–861
24. Asit KP, Hani AN. Gated Myocardial Perfusion SPECT: Basic Principles, Technical Aspects, and Clinical Applications. J Nucl Med Technol 2004;32 : 179–187
25. Lang O, Trojanova H, Balon HR, et al. Pulse wave as an alternate signal for data synchronization during gated myocardial perfusion SPECT imaging. Clin Nucl Med. 2011;36 : 762-766
26. Lebtahi NE, Stauffer JC, Delaloye AB. Left bundle branch block and coronary artery disease: accuracy of dipyri¬damole thallium-201 single-photon emission comput¬ed tomography in patients with exercise anteroseptal perfusion defects. J Nucl Cardiol 1997;4 : 266–273
27. Velký lékařský slovník [online]. 2016. [cit. 2016-01-14]. Dostupné na: http://lekarske.slovniky.cz/
28. DePuey EG, Garcia EV. Optimal Specificity of Thallium-201 SPECT Through Recognition of Imaging Artifacts. J Nucl Med 1989;30 : 441-449
29. Al-faham Z, Jolepalem P, Wong CY. The Appearance of Congenitally Corrected Transposition of the Great Arteries on Myocardial Perfusion Imaging. J Nucl Med Technol 2015;43 : 68-69
30. Verberne HJ, Acampa W, Anagnostopoulos C, et al. EANM procedural guidelines for radionuclide myocardial perfusion imaging with SPECT and SPECT/CT. Eur J Nucl Med Mol Imaging 2015;42 : 1929-1940
31. Národní radiologické standardy: diagnostické a léčebné metody nukleární medicíny [online]. 2011. [cit. 2015-12-12]. Dostupné na: http://www.mzcr.cz/dokumenty/nuklearni-medicina_8773_3050_3.html
32. Verger A, Djaballah W, Fourquet N, et al. Comparison between stress myocardial perfusion SPECT recorded with cadmium-zinc-telluride and Anger cameras in various study protocols. Eur J Nucl Med Mol Imaging 2013;40 : 331–340
33. Lang O, Komorousová I. Snímání perfuzní scintigrafie myokardu vsedě – srovnání se záznamem vleže. In Abstrakta XLV. Dny nukleární medicíny. Havlíčkův Brod, Hotel Slunce HB s.r.o. v koedici s Českou společností nukleární medicíny ČLS JEP, 2008, 126 p
34. Matsumoto N, Suzuki Y, Yoda S, et al. The truncation artefact in patients with a high body mass index on myocardial perfusion SPECT. BMJ Case Rep. 2014;15 pii: bcr2014205407. doi: 10.1136/bcr-2014-205407
Štítky
Nukleárna medicína Rádiodiagnostika Rádioterapia
Článok vyšiel v časopiseNukleární medicína

2016 Číslo 3-
Všetky články tohto čísla
- História slovenskej nukleárnej medicíny
- Vybraná abstrakta 53. Dnů nukleární medicíny Luhačovice 21. – 23. 9. 2016
- Komentář k článku „Artefakty u perfuzní scintigrafie myokardu“
-
Artefakty u perfuzní scintigrafie myokardu
1. část - Role 18F-FDG PET/CT při stážování a hodnocení léčebné odpovědi u agresivních forem maligních lymfomů
- Nukleární medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- História slovenskej nukleárnej medicíny
-
Artefakty u perfuzní scintigrafie myokardu
1. část - Role 18F-FDG PET/CT při stážování a hodnocení léčebné odpovědi u agresivních forem maligních lymfomů
- Komentář k článku „Artefakty u perfuzní scintigrafie myokardu“
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



