-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Subsegmentární embolie do plicnice – diagnostika a klinický význam
Subsegmental pulmonary embolism – diagnosis and clinical significance
Pulmonary embolism (PE) remains a frequent and potentially fatal diagnosis that is easily missed. Multidetector computed tomographic pulmonary angiography (CTPA) has rapidly become the sine qua non for the workup of PE. In the USA, use of CT pulmonary angiography rose 14-fold while VQ scanning decreased by 52% from 2001 to 2008. The high resolution of CT pulmonary angiography makes it possible to detect filling defects in subsegmental arteries. However, there is evidence that some small clots do not need treatment. The significant increase in isolated subsegmental pulmonary embolism diagnosis by CTPA represented probably a subset of more benign disease, or accurate detection of a natural, benign “clearing” process of the lung vasculature. On the other hand, the risk of major bleeding from anticoagulation was 5.3 % but the risk of recurrent venous thromboembolism was only 0.7 %. Another risks of CTPA are nephrotoxic contrast and carcinogenic radiation. To avoid these problems is not simply to do less testing but to test (and subsequently treat) more selectively and to consider alternative tests such as VQ scanning and ultrasonography when appropriate. Clinicians should reserve CT pulmonary angiography for patients at intermediate to high risk of pulmonary embolism based on algorithms that combine clinical probability and D-dimer test results. Implementing policies to use pulmonary scintigraphy as the first line test for pulmonary embolism in stable patients with a normal x ray appearance can reduce use of CT pulmonary angiography and decrease detection of subsegmental pulmonary embolism without increasing deaths from pulmonary embolism.
Keywords:
subsegmental pulmonary embolism – CTPA – lung scintigraphy – diagnosis – Prognosis – treatment
Autori: Otto Lang
Pôsobisko autorov: Klinika nukleární medicíny, 3. LF UK a FN Královské Vinohrady, Praha 10, ČR
Vyšlo v časopise: NuklMed 2021;10:31-37
Kategória: Přehledová práce
Súhrn
Embolie do plicnice (EP) stále zůstává relativně častou a potenciálně smrtící diagnózou, která může být snadno opomenuta. Plicní angiografie víceřadou výpočetní tomografií (CTPA) se rychle stala nepostradatelnou metodou při jejím vyšetřování. V USA vzrostl počet provedených CTPA mezi lety 2001 a 2008 14krát, zatímco počet plicních scintigrafií klesl na polovinu. Vysoké polohové rozlišení CTPA umožňuje detekci defektů v náplni kontrastní látkou i na úrovni subsegmentárních větví. Existují však data, že takto malé emboly nevyžadují léčbu. Významný nárůst detekce izolovaných subsegmentárních embolů pomocí CTPA představuje pravděpodobně podskupinu benigních změn nebo jen přesnější detekci přirozeného „čistícího“ procesu plicních cév. Na druhé straně je riziko závažného krvácení při antikoagulační léčbě 5,3 %, zatímco riziko opakované EP jen 0,7 %. Dalšími riziky CTPA je nefrotoxická kontrastní látka a kancerogenní záření. Řešením tohoto problému není jednoduše snížit počet vyšetření, ale vyšetřovat (a následně léčit) více selektivně a zvažovat alternativní metody, jako je plicní scintigrafie a sonografie, jsou-li relevantní. CTPA by měla být vyhrazena pro pacienty se střední a vysokou pravděpodobností EP určené na základě klinického vyšetření a stanovení D-dimerů (potvrzení EP). Plicní scintigrafie by naopak měla být metodou volby u stabilních pacientů s normálním skiagramem hrudníku tak, aby se snížila detekce subsegmentárních embolů, aniž by přitom došlo ke zvýšení úmrtnosti na EP (vyloučení EP).
Klíčová slova:
subsegmentární embolie do plicnice – CTPA – plicní scintigrafie – diagnóza – prognóza – léčba
Úvod
Embolie do plicnice (EP) je třetí nejčastější příčinou smrti v oblasti kardiovaskulárních chorob, následuje po ischemické chorobě srdeční a cévní mozkové příhodě. Je spojena s řadou rizikových faktorů, častěji se vyskytuje ve vyšším věku. 1 Embolie do plicnice je definována jako uzávěr tepenné části plicního řečiště, který může být různého rozsahu. Nejčastěji bývá způsobena vmetením krevního trombu z žilního řečiště, zejména při hluboké žilní trombóze (HŽT), ale může to také být tukovou tkání, vzduchem, plodovou vodou, nádorovými a trombotickými hmotami i cizím tělesem. 2 Největším zdrojem plicních embolizací jsou žíly dolních končetin a pánevního řečiště. Z nich jsou nejvýznamnějším zdrojem (ve > 85 až 90 %) proximální hluboké žíly končetiny (podkolenní a stehenní žíly) a pánevní žíly, méně často jsou to samotné bércové žíly (ty bývají zdrojem spíše pro paradoxní embolizace) a velká saféna, zvláště při insuficienci safénofemorálního spojení. Dalšími zdroji plicní embolizace mohou být obě duté žíly, podklíčkové a jugulární žíly a žíly horních končetin.
Přesný výskyt EP lze jen obtížně zjistit pro nesnadnou klinickou diagnostiku, vysoký podíl asymptomatických nemocných a nestejně používanou metodiku sledování. Podle novějších údajů bývá uváděna incidence tromboembolické nemoci (TEN) 1–2 osoby/1 000 obyvatel za rok, z toho asi 1/3 probíhá jako klinicky manifestní plicní embolie, zbytek jako hluboká žilní trombóza. 3,4 Průřezové (prevalenční) studie ukazují, že incidence TEN je u osob ve věku ≥ 80 let téměř osmkrát vyšší než v páté dekádě života. 5 Studie z roku 2004 vycházející z dat 6 evropských zemí zahrnujících populaci přes 300 milionů obyvatel ukázala 370 tisíc úmrtí na PE. Z těchto úmrtí bylo 7 % při léčené EP, 34 % zahrnovalo náhlou fatální EP a 59 % bylo způsobeno EP, která byla komplikací nediagnostikované HŽT. 6
Rozsah uzávěru plicního řečiště
Určení rozsahu EP má význam zejména pro stanovení správné léčebné strategie a také pro určení prognózy pacienta. 5 Z klinického pohledu dělíme riziko časného úmrtí na vysoké, střední a nízké. Vysoké riziko časné smrti je definováno především přítomností hemodynamické nestability, to znamená hypotenzí se systolickým krevním tlakem pod 90 mm Hg, poruchou vědomí, studenou vlhkou kůží a oligurií, jsou přítomny známky dysfunkce pravé komory srdeční na echokardiografii, případně zvýšená hladina srdečních troponinů. Nízké riziko je na druhé straně charakterizované absencí těchto příznaků, tedy pacienti jsou hemodynamicky stabilní a nemají známky zatížení pravé komory srdeční. 7 K posouzení rizika celkové mortality a časné prognózy pacientů s EP je nezbytná také znalost základních anamnestických údajů a komorbidit, které by mohly dále zhoršovat prognózu. Z dostupných klinických skórovacích systémů integrujících závažnost EP s komorbiditami je dosud nejdůkladněji validován tzv. index závažnosti EP – PESI (Pulmonary Embolism Severity Index). Vzhledem ke složitosti původního skóre PESI byla vyvinuta a ověřena simplifikovaná verze (sPESI – simplified PESI). Stejně jako u původní verze PESI spočívá hlavní význam stanovování sPESI ve spolehlivé identifikaci pacientů s nízkým rizikem 30denní mortality.
Z patologického hlediska dělíme EP na masivní a submasivní, i když tyto termíny používá American Heart Association také pro klinické dělení pacientů. 8 Jako masivní je označována embolie, která obturuje více než 50 % plicního řečiště. 9 Emboly do větví plicní tepny jsou obvykle mnohočetné, častěji jsou postižené dolní laloky a obě plíce. 10 Velké emboly obvykle obturují současně oba hlavní kmeny plicní tepny, tvoří tzv. sedlový trombus (Obr. 1) a jejich kardiovaskulární následky jsou zničující. 11 V důsledku blokády plicního řečiště a hypoxické vazokonstrikce dochází k vzestupu plicní arteriální rezistence. Ta pak vede k dysfunkci pravé komory srdeční ev. ke vzniku bloku pravého raménka Tawarova. Důsledkem je pokles srdečního výdeje, hypotenze a výše zmiňovaná hemodynamická nestabilita. Naštěstí výskyt masivní EP není častý, ve studii Cambron a kol., která zahrnovala více než tisíc pacientů, byla přítomna ve 2,6 %. 12 Na druhé straně, malé emboly blokující periferní větve plicnice mohou vést ke vzniku plicního infarktu, který je charakterizován krvácením do alveolů. Plicní infarkty se vyskytují asi u 10 % pacientů s EP. Třetí skupinu tvoří drobné periferní emboly velikosti několika milimetrů, které obturují subsegmentární nebo menší větve plicní tepny. (Obr. 2) Jejich výskyt není vzácný, detekují se u 6–30 % pacientů s dokumentovanou EP. Izolovaná subsegmentární embolie do plicnice je definovaná jako jeden nebo více defektů v náplni kontrastní látky na úrovni subsegmentárních větví při angiografii plicní tepny víceřadou výpočetní tomografií (MDCTPA) bez přítomnosti defektů v proximálnějších větvích plicní tepny. 1 Ani její výskyt není vzácný, např. v kohortě více než 1000 pacientů se vyskytovala s frekvencí 21,5 %. 12
Obr. 1. Sedlový trombus. CTPA u pacienta s oboustrannou EP. Uprostřed je patrný sedlový embolus, který obturuje rozvětvení plicní tepny (šipka). Case courtesy of Dr Ian Bickle, Radiopaedia.org, rID: 27993. 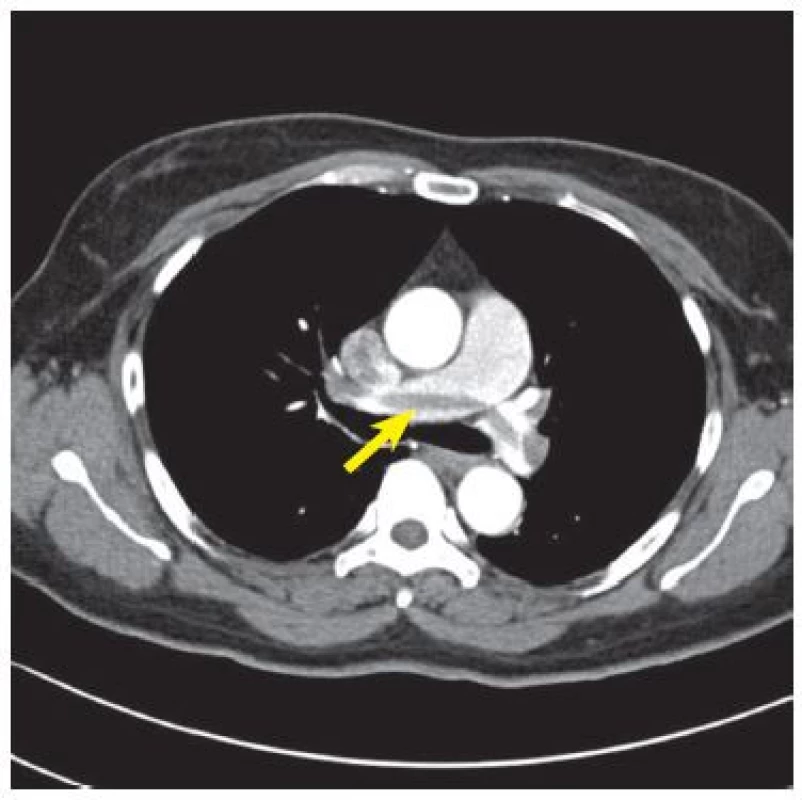
Obr. 2. Subsegmentární emboly velikosti několika mm. Větve plicní tepny vyššího řádu. Case courtesy of Dr Andrew Dixon, Radiopaedia.org, rID: 36509. 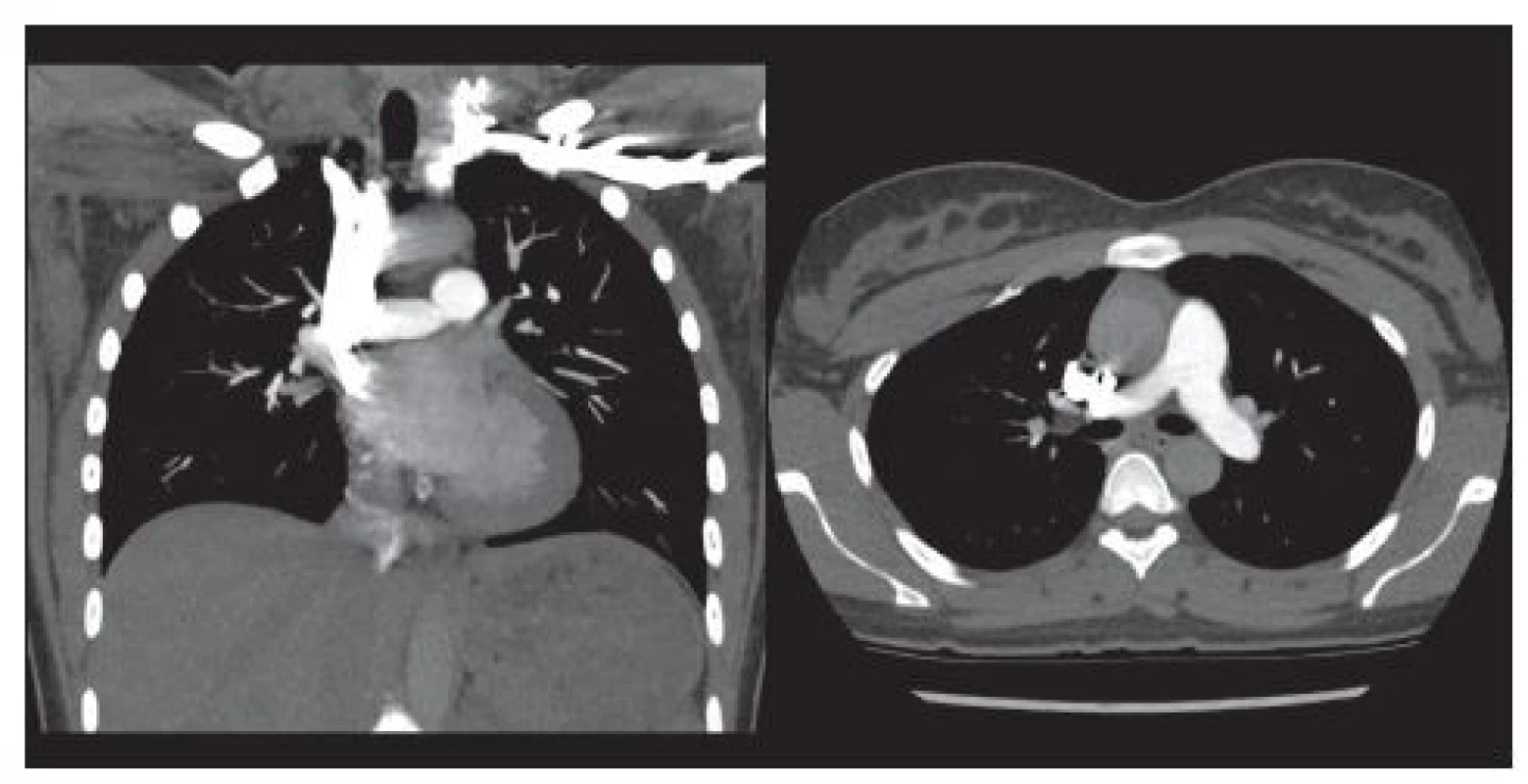
Diagnostika
Diagnostika embolie do plicnice bývá často nesnadná. Chybí vyhraněný klinický obraz s jasnými diagnostickými kritérii. 13 Předpokládá se, že klinicky významných je pouze 2–5 % všech příhod plicní embolizace. 2 Klinická manifestace se pohybuje v širokém rozmezí příznaků od mírné dušnosti až po hypotenzi a šok vedoucí k náhlému úmrtí při akutním selhání pravé srdeční komory. Někdy bývá EP asymptomatická, pak je většinou diagnostikovaná náhodně při zobrazovacím vyšetření indikovaném z jiných příčin. 1
Diagnostika obvykle postupuje od klinického vyšetření přes laboratorní testy a echokardiografické vyšetření k zobrazovacím metodám. Vzhledem k tomu, že klinický úsudek nelze standardizovat, bylo vytvořeno několik explicitních skórovacích systémů ke stanovení klinické pravděpodobnosti EP. Z nich jsou nejčastěji používány revidované ženevské skóre a Wellsovo skóre. 5 Tyto jednoduché dotazníky umožňují rychle stanovit pravděpodobnost embolie na základě klinických příznaků. 14
Hlavním laboratorním testem užívaným na odděleních akutního příjmu je stanovení D-dimerů jakožto součásti fibrin degradačních produktů, bílkovinných fragmentů rozpuštěného fibrinu z krevní sraženiny. Hlavní výhodou D-dimerů je vysoká negativní prediktivní hodnota přesahující 90 %, takže v případě negativity je možné EP vyloučit. 15 Podobně je možné EP vyloučit použitím kritérií PERC (Pulmonary Embolism Rule-out Criteria). 5 V době čekání na výsledek hodnoty D-dimerů je pacientovi obvykle zaznamenáno EKG a proveden skiagram hrudníku. Obvyklými známkami EP na EKG jsou změny konzistentní s přetížením pravé komory srdeční, jako jsou negativní vlny T v hrudních svodech, blok pravého raménka Tawarova, klasický obraz S1, Q3 a negativní T3 nebo Qr ve svodu V1. EKG však může být i u masivní EP zcela normální. 16 Skiagram hrudníku je u akutní EP normální, nejběžnější změnou bývá kardiomegalie.
Ze zobrazovacích metod se dnes v diagnostice EP nejvíce používá angiografie plicních tepen pomocí výpočetní tomografie (CTPA) a plicní scintigrafie. Selektivní angiografie plicních tepen byla po mnoho let považovaná za zlatý standard, dnes se však téměř nepoužívá. Důvodem je především nezanedbatelné riziko invazivní procedury s udávanou morbiditou 3,5–6 % a mortalitou 0,2–0,5 %. 16 Plicní scintigrafie, dlouhá léta užívaná jako metoda volby u pacientů s podezřením na EP, je dnes používaná výrazně méně často, především u pacientů, u nichž je CTPA kontraindikovaná, a u mladých žen. Např. v USA došlo k poklesu počtu provedených plicních scintigrafií mezi lety 2001 a 2008 o 52 %, na našem pracovišti poklesl počet provedených plicních scintigrafií po zavedení víceřadého CT 4,6krát. 17,18 Hlavní výtkou plicní scintigrafii byl vysoký podíl neurčitých nediagnostických závěrů (až 73 %). To se dnes díky emisní tomografii (SPECT) a hybridnímu zobrazení (SPECT/CT) (Obr. 3) značně zlepšilo, takže počet neurčitých nálezů poklesl na úroveň 1–4 %. 6 Plicní scintigrafie je funkční test, který diagnostikuje EP nepřímo na základě efektu uzávěru větve plicní tepny na prokrvení plicní tkáně. (Obr. 4) To je rozdíl proti strukturálním zobrazovacím metodám, které umožňují přímou vizualizaci embolu jako defektu v náplni cévy kontrastní látkou eventuálně dalších hrudních patologií. 16
Obr. 3. SPECT/CT plicní perfuze. Horní řada vlevo obraz LDCT, střední řada SPECT perfuze a dolní řada fúze obou obrazů. Vpravo nahoře topogram, dole 3D obraz perfuze. Z vyšetření je patrné, že perfuzní defekt je způsoben emfyzematózní bulou, nikoli embolií do plicnice. 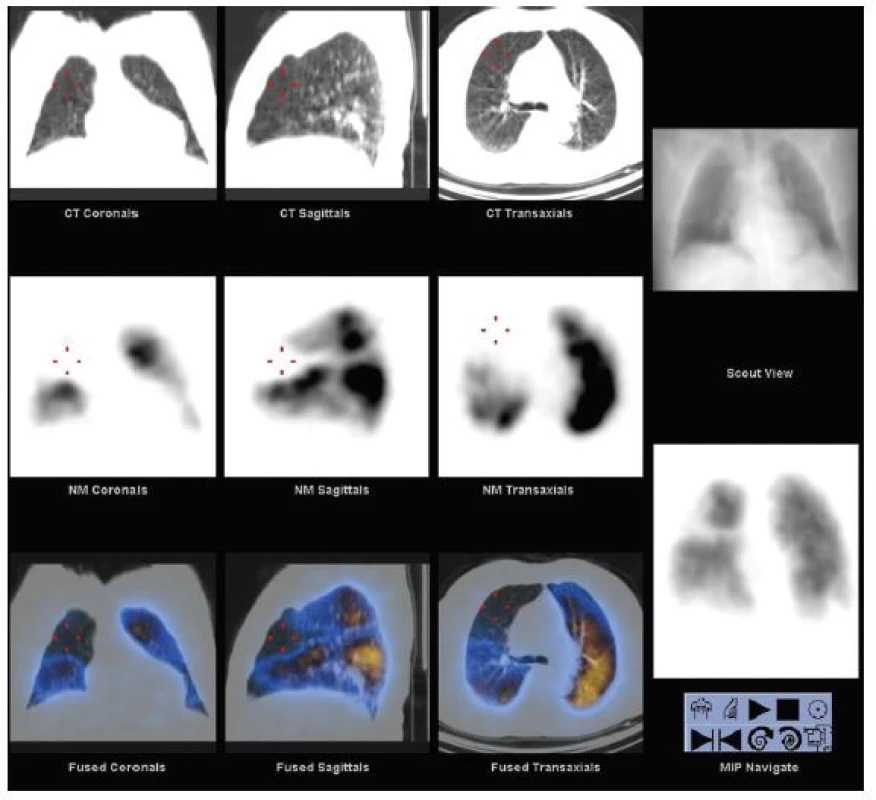
Obr. 4. Perfuzně-ventilační plicní scintigrafie ukazuje efekt uzávěru větví plicní tepny na prokrvení plicní tkáně. Distribuce ventilace je normální. 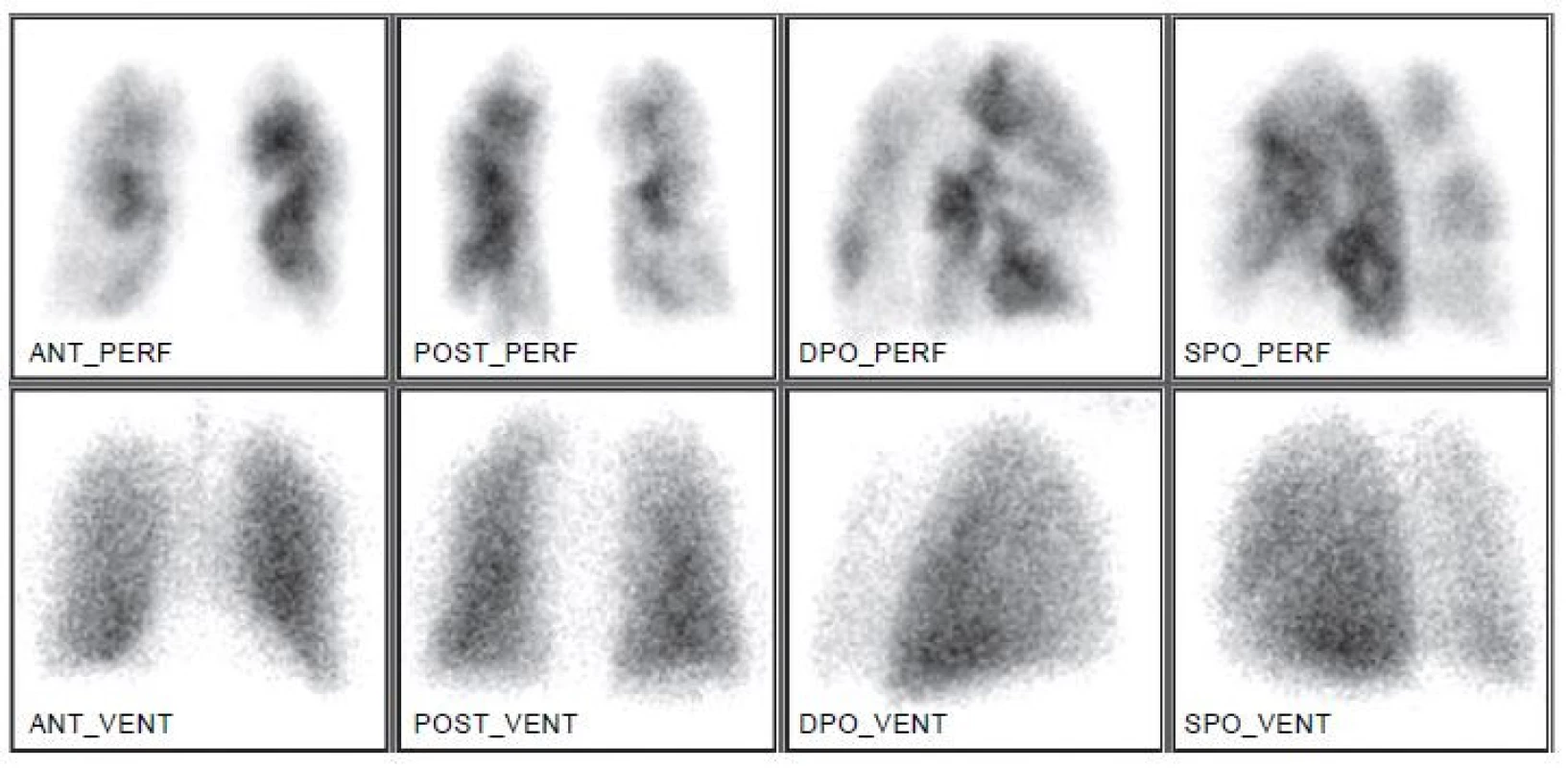
Zavedení víceřadých CT přístrojů (MDCT) vedlo k jejich využití jako metody první volby v diagnostice EP. 17,19 Není divu. Jednominutový test, schopnost přímo zobrazit embolus v plicní tepně, vysoká citlivost, všeobecná dostupnost 24 hodin denně. Tak např. v USA narostlo použití CTPA v diagnostice EP mezi lety 2001 a 2008 14krát. Druhý pohled na tuto metodu však nemusí být tak přímočarý. Hall a kol. analyzuje ve své práci výsledky CTPA indikované u pacientů s podezřením na EP. 20 Z 589 vyšetřených byla EP prokázaná u 9 %, u třetiny pacientů byla nalezena jiná možná příčina jejich potíží (výpotek, infiltrát, atelektáza či perikarditida), o které se však u více než poloviny již vědělo, a u čtvrtiny byla nalezena nová patologie (nejčastěji plicní uzel nebo adenopatie), která vyžadovala další vyšetření.
Studie PIOPED II prokázala, že CTPA není lepší než plicní scintigrafie. 21 U 824 pacientů s potvrzenou nebo vyloučenou EP na základě kombinovaného standardu (zahrnoval mimo jiné Wellsova kritéria a ultrazvukové vyšetření žil dolních končetin) byla senzitivita CTPA 83 % (tedy 17 % falešně negativních nálezů), specificita 96 % a negativní předpovědní hodnota (NPV) 95 %. 22 Tyto parametry jsou srovnatelné s plicní scintigrafií, kdy pozitivní nález je spojen s vysokou pravděpodobností EP (> 85 %) a negativní nález s pravděpodobností nízkou (< 20 %). Nejdůležitější poselství studií PIOPED je však to, že výsledek zobrazovací metody výrazně ztrácí svoji hodnotu, je-li v rozporu se závěrem klinického vyšetření. Tak např. pozitivní předpovědní hodnota (PPV) pozitivního nálezu na CTPA byla pouze 58 %, pokud byla klinická pravděpodobnost EP nízká. To bylo prakticky stejné jako u plicní scintigrafie, kde PPV byla ve stejném scénáři 56 %. Z toho pak plyne doporučení, že je nezbytné další vyšetření, je-li výsledek klinického vyšetření v rozporu s výsledkem zobrazovacího testu. 5,6,21
Klinický význam
Klinický význam SSEP při izolovaném výskytu (bez přítomnosti centrálních embolů) je nejasný. Předpokládá se, že jednou z významných úloh plicního řečiště je filtrace krve, aby se zabránilo průniku embolů do tepenného řečiště, kde mohou mít devastující účinky (cévní mozková příhoda). Filtrační schopnost plicního řečiště v tomto smyslu je obdivuhodná, vždyť k vzestupu tlaku v plicnici vede teprve obstrukce více než 30 % celkového průsvitu! Drobné tromby vedoucí k SSEP mohou z principu udržení rovnováhy mezi tekutostí krve a hemostázou vznikat i u zcela zdravých jedinců, zejména v žilách dolních končetin. 16,17,23 Takto vznikající emboly jsou pak fyziologickými procesy v plicním řečišti rozpuštěny i bez léčby a nemají žádný klinický efekt. Cévní řečiště v plicích má totiž vysokou fibrinolytickou schopnost. 6 Tento předpoklad je podpořen řadou pozorování přítomnosti SSEP jako náhodného nálezu při CTPA provedené z jiné indikace nebo při pitvě: v 16 % u mechanicky ventilovaných pacientů, v 17 % u hospitalizovaných pacientů starších 80 let, u 20 % pacientů po úrazu a dokonce u 50–60 % pitvaných zemřelých. 17 Rovněž v novějších studiích byla izolovaná SSEP diagnostikovaná převážně náhodně při stážování nádorových onemocnění, klinicky probíhala bez příznaků. 12
Vynikající polohové rozlišení MDCT umožňuje detekci SSEP při velikosti embolů 1–3 mm. Výskyt SSEP byl při pozitivní scintigrafii plic detekován jen u 1 % pacientů, u 1řadého CT u 4,7 % pacientů, u 4řadého CT u 7,1 % a u 64řadého CT u 15 % pacientů. 17,24,25 S počtem řad detektorů tedy narůstá procento detekovaných SSEP. Přitom incidence EP, která byla po dobu 5 let před zavedením MDCTPA stabilní, narostla po jejím zavedení o 80 % ze 62 na 112 na 100 tisíc obyvatel. Přesto však úmrtnost na plicní embolii ve stejném časovém období spíše mírně poklesla z 12 na 11 na 100 tisíc obyvatel. Navíc hospitalizační případová mortalita na EP poklesla ve stejném období o třetinu (z 12 % na 8 %). Ve studii Andersona a kol. randomizovali 1417 pacientů se střední a vysokou pravděpodobností EP k vyšetření CTPA nebo plicní scintigrafií. 26 Ačkoli CTPA diagnostikovala EP u více pacientů (19,2 % vs. 14,2 %), nebyl v průběhu 3měsíčního sledování nalezen žádný rozdíl v úmrtnosti (0,3 % vs. 0,3 %). Všechna tato pozorování svědčí pro to, že zavedení MDCTPA vedlo k nadhodnocení diagnózy EP (overdiagnosis – jsou detekovány i emboly, které by dříve nebyly diagnostikovány), což má za následek nadměrné používání antikoagulační léčby se všemi riziky.
Antikoagulační léčba je přitom hlavní příčinou iatrogenních úmrtí spojených s použitím léků. 27 Při nadhodnocení diagnózy izolované SSEP se tedy dostáváme do situace, kdy léčba je horší než samotná nemoc. Podle studie Donato a kol. zahrnující 93 pacientů bylo riziko masivního krvácení 5,3 %, zatímco riziko opakované tromboembolie pouze 0,3 %. 28 Tyto výsledky korespondují s výsledky dalších studií. Z 209 pacientů se SSEP bylo 65 bez léčby a 127 bylo léčeno standardní antikoagulací. V neléčené skupině se v průběhu následujících 3 měsíců nevyskytla žádná rekurentní tromboembolie, zatímco v léčené skupině byla zaznamenána jedna opakovaná EP. Prognóza pacientů se SSEP je tedy výrazně lepší ve srovnání s větší EP, kdy se uvádí rekurence 39 % a mortalita 26 %, pokud není léčená, a 8 % respektive 1,7 % u antikoagulovaných pacientů. 29 Přitom tříměsíční antikoagulační léčba představuje 2–3% riziko velkého a 0,4% riziko smrtelného krvácení. K podobným závěrům dospěla také studie, která zjistila nárůst krvácivých komplikací u pacientů léčených v nemocnicích v USA pro embolii do plicnice mezi lety 1998–2006 z 3,1 na 5,3/100 tisíc pacientů. 30 I v novějších studiích, kde se užívají nová antikoagulancia včetně nízkomolekulárního heparinu, je riziko krvácení nezanedbatelné, i když smrtelné komplikace se již nevyskytují. Cambron a kol. uvádí u SSEP riziko velkého krvácení 1,4 % a klinicky významného 2,7 %. 12
Dalším nezanedbatelným rizikem spojeným s MDCTPA je zdravotní riziko ionizujícího záření ve formě indukce maligního nádorového onemocnění, nefrotoxicita jodové kontrastní látky a vysoké procento falešně pozitivních nálezů. Průměrná efektivní dávka z CTPA je 10–15 mSv, zatímco u plicní scintigrafie je to 2–2,5 mSv a u plicní angiografie 5 mSv. 31 Riziko ionizujícího záření je vysoké zejména u mladých žen v důsledku ozáření mléčné žlázy, kdy dávka v prsech dosahuje několika desítek mSv. 22,32 Předpokládá se, že u 3 z jednoho tisíce 20letých žen, které podstoupily vyšetření CTPA, se rozvine rakovina. 33 Jiné práce uvádějí riziko rakoviny prsu, jejíž příčinou je CTPA, u 1 ze 143 pacientek vyšetřených ve věku 20 let a u 1 z 284 pacientek vyšetřených ve věku 40 let. 34 Riziko nefropatie je zvýšené zejména u starších polymorbidních pacientů. Ve studii PIOPED II bylo CTPA z důvodu renální insuficience, alergie na jod nebo možného těhotenství kontraindikováno u 25 % pacientů. 19, 21 Nemenším problémem jsou nálezy náhodných patologií, tzv. incidentalomů, jak bylo zmíněno v předchozím odstavci. 20 Tento problém však provází i jiná CT vyšetření. 19 Např. u CT koronárních angiografií jsou náhodné nálezy detekovány až v 67 %, u CT vyšetření pro hematurii cca v 75 % a u CT kolonoskopie ve 40 %. Takovýto náhodný nález většinou znamená další vyšetřování, což zvyšuje náklady zdravotní péče, vede k opakovanému použití ionizujícího záření i kontrastní látky, mnohdy znamená použití invazivních postupů a v neposlední řadě zvyšuje obavy pacienta. Pravdivě pozitivní nález však v těchto případech bývá velmi vzácný. 35 Např. z 63 pacientů sledovaných pro plicní uzel po dobou 2 let se u nikoho nevyvinul maligní proces, u 22 pacientů (35 %) nebyl původní nález na kontrolním CT potvrzen, u 39 pacientů (62 %) se původní uzel zmenšil nebo zůstal stabilní a pouze u 2 pacientů (3 %) se zvětšil.
Prognóza pacientů se SSEP je většinou dobrá, závisí na základním onemocnění. 36 Ve studii 93 pacientů byla 3měsíční prognóza lepší než prognóza antikoagulovaných pacientů s typickou EP. 28 Opakovaná EP byla u SSEP 1,05% a úmrtnost 0, zatímco u typické EP byla rekurence v 8 % a úmrtnost 1,7 %. Rovněž metaanalýza, která zahrnovala 209 pacientů se SSEP, získala podobné výsledky. Opakovaná EP byla detekována u 1/192 pacientů (0,5 %) s nulovou úmrtností. Podobné výsledky byly nalezeny v metaanalýze studií, které sledovaly 3měsíční prognózu pacientů s negativním výsledkem na CTPA. 37 Studie zkoumala prognózu pacientů s podezřením na EP, kteří měli negativní CTPA a nebyli léčeni antikoagulancii. Zahrnula celkem přes 4500 pacientů. Zde byla opakovaná EP detekována u 1,4 % pacientů a úmrtnost byla 0,51 %. Hlavním rizikem úmrtí pacientů se SSEP je vlastní příčina embolie, zejména rakovina a další komorbidity, nikoli embolie samotná. 38
Problém SSEP tkví podle mého názoru ve slovním vyjádření nálezu zobrazovací metody. Jakmile má klinický lékař na výsledku vyšetření napsaná slova embolie do plicnice, je povinen pacienta léčit. Diskutoval jsem s jedním primářem interního oddělení o tom, že antikoagulační léčba SSEP představuje pro pacienta mnohem vyšší riziko (7,6 krát!), než ho neléčit. Namítl mi ale, že pokud pacienta léčit nebude a ten zemře, bude obviněn, zatímco pokud pacient zemře na krvácení do mozku při léčbě, je vše v pořádku, protože se jedná o komplikaci léčby. Jakmile radiolog vidí na CTPA defekt v náplni cévního plicního řečiště kontrastní látkou, napíše do nálezu embolii do plicnice. Nenašel jsem žádné doporučení ani žádný radiologický guideline, jak nálezy takovýchto defektů v drobných subsegmentárních větvích interpretovat. Naproti tomu guideline EANM jasně stanoví, že nález na plicní scintigrafii je třeba interpretovat jako embolii do plicnice, pouze pokud detekujeme defekt perfuze ve více než jednom segmentu nebo dvou subsegmentech při normální ventilaci ve stejné lokalizaci. 6
Klinický lékař je tedy při detekci SSEP postaven do nepříjemné situace, kdy musí volit případnou neléčbu pacienta s nálezem pozitivním pro EP (bez ohledu na její rozsah). 28 Přitom bylo prokázáno, že u neléčených pacientů s dobrou kardiovaskulární rezervou a nerozhodným nálezem na plicní scintigrafii má strategie dalšího postupu zahrnující opakované vyšetření žil DK ultrazvukem akceptovatelnou frekvenci opakovaných EP 1,9 %. 39 K podobným výsledkům dospěli také Wells a kol., kteří zjistili v 3měsíčním sledování opakovanou EP u 0,5 % pacientů s nízkou klinickou pravděpodobností, nerozhodným nálezem na plicní scintigrafii a opakovaně negativním ultrazvukovým vyšetřením žil DK. 40 Zdá se tedy, že tyto nerozhodné nálezy na plicní scintigrafii představují ekvivalent dnešní SSEP. 41 Podobně souhrnná analýza 787 pacientů, u nichž byl nález na plicní scintigrafii interpretován jako nízká pravděpodobnost EP, ukázala, že se komplikace v 6měsíčním a delším sledování vyskytly pouze v <1 %. 22 K podobným závěrům dospěli také Le Roux a kol. 42 Analyzovali soubor 262 pacientů s negativním nálezem na plicní scintigrafii (tedy méně než 1 segmentární nebo 2 subsegmentární defekty perfuze), kteří nebyli léčeni antikoagulancii. Opakovaná EP se objevila pouze u 1 pacienta (0,38 %). Zdá se tedy, že je lepší psát do závěru našeho nálezu formulaci „neprokazujeme EP“ místo „nízká pravděpodobnost EP“. Léčebná strategie pacientů se SSEP, kteří nemají vysokou klinickou pravděpodobnost EP (typicky náhodné nálezy) a nemají hlubokou žilní trombózu, ale mají dobrou kardiovaskulární rezervu a zejména mají vyšší riziko krvácivých komplikací, spočívající v opakovaném ultrazvukovém vyšetření žil DK je bezpečnější, než standardní antikoagulace. 28
Závěr
Embolie do plicnice představuje jednoznačně důležitou potenciální příčinu smrti a rychlá diagnóza a efektivní léčba může být život zachraňující. Kliničtí lékaři jsou po mnoho desetiletí učeni, že embolie do plicnice je závažný stav, který vyžaduje léčbu, neboť nediagnostikovaná EP může být smrtící. Klinické příznaky EP, jako je dušnost, pleuritická bolest na hrudníku, tachykardie nebo známky zatížení pravé komory srdeční, však mají nízkou senzitivitu i specificitu. Proto bylo vypracováno několik skórovacích kritérií, která mají klinickým lékařům pomoci vybrat pacienty k dalšímu, zejména zobrazovacímu vyšetření. Mnoho kliniků si však situaci i s ohledem na právní prostředí euroatlantické civilizace (defenzivní medicína) zjednodušuje a pošle pacienta rovnou na zobrazovací vyšetření. Bohužel však diagnostický zápal a technologický pokrok jsou dvojsečnou zbraní. Naše klinické uvažování často za technologickým pokrokem zaostává a nejinak je tomu i u embolie do plicnice.
Od 60. let 20. století, tedy více než 40 let, byla zobrazovací metodou volby u pacientů s podezřením na EP plicní scintigrafie. Hlavním důvodem bylo to, že ve srovnání s plicní angiografií to byla metoda neinvazivní. Po celou tuto dobu přitom byla incidence i mortalita EP více méně stabilní podobně jako komplikace antikoagulační léčby. Zdá se tedy, že plicní scintigrafie je schopná diagnostikovat klinicky relevantní EP. Díky technologickému pokroku došlo k zavedení víceřadých CT přístrojů, které nám umožňují vidět věci dříve nevídané, v případě EP pak drobné větve plicní tepny až do 6. a vyšších řádů větvení. Vzhledem k definici EP je pak řada klinických lékařů přesvědčena, že zachycení i milimetrové subsegmentární EP může pacientovi zachránit život. Bohužel však došlo k tomu, že po zavedení CTPA do klinické praxe incidence EP výrazně vzrostla (téměř na dvojnásobek), zatímco úmrtnost se mírně snížila, případová úmrtnost dokonce klesla na třetinu. To znamená, že je diagnostikováno mnoho drobným embolů, které mají sporný klinický význam (snižuje se případová, nikoli celková úmrtnost). Na druhé straně však významně vzrostl počet krvácivých komplikací (také téměř na dvojnásobek).
Řešení není snadné a rozhodně by nemělo dojít ke zvýšení prahu pro diagnostiku EP. Vhodné je však vybírat diagnostické testy selektivně a zvažovat také alternativní metody, pokud jsou relevantní. CTPA by měla být vyhrazena pro pacienty se střední a vysokou klinickou pravděpodobností a pozitivními D-dimery (potvrzení EP). Plicní scintigrafie by na druhé straně měla být indikována u hemodynamicky stabilních pacientů s normálním skiagramem hrudníku, zejména u mladých žen (vyloučení EP). Její základní a vlastně jedinou nevýhodou v evropském prostoru je nedostupnost 24 hodin denně, 7 dnů v týdnu. Otázka léčby či neléčby SSEP závisí vždy na rozhodnutí ošetřujícího lékaře. V případě, že se rozhodne neléčit, měl by být pacient sledován s ohledem na nově vznikající dýchací potíže a po dobu 3–6 měsíců pravidelně sonograficky vyšetřován pro možnou hlubokou žilní trombózu.
Zdroje
- Yoo HHB, Marin FL. Isolated subsegmental pulmonary embolism: current therapeutic challenges. Pol Arch Intern Med. 2020 Nov 30;130 : 986-991. doi: 10.20452/pamw.15372.
- Hofírek I. Plicní embolizace. Kardiol Rev Int Med 2009, 11 : 170-173
- Riedel M. Plicní embolie. in: Aschermann M. Kardiologie. Praha: Galén, 2004
- Widimský J, Malý J. Akutní plicní embolie a žilní trombóza. Praha: Triton, 2005
- Rokyta R, Hutyra M, Jansa P. Doporučené postupy Evropské kardiologické společnosti (ESC) pro diagnostiku a léčbu akutní plicní embolie, verze 2019. Stručný přehled vypracovaný Českou kardiologickou společností. Cor Vasa 2020;62 : 154–182
- Bajc M, Schümichen C, Grüning T et al. EANM guideline for ventilation/perfusion single-photon emission computed tomography (SPECT) for diagnosis of pulmonary embolism and beyond. Eur J Nucl Med Mol Imaging 2019 : 46, 2429–2451. https://doi.org/10.1007/s00259-019-04450-0
- Cuomo JR, Arora V, Wilkins T. Management of Acute Pulmonary Embolism With a Pulmonary Embolism Response Team. J Am Board Fam Med. 2021;34 : 402-408. doi:10.3122/jabfm.2021.02.200308
- Moore K, Kunin J, Alnijoumi M et al. Current Endovascular Treatment Options in Acute Pulmonary Embolism. J Clin Imaging Sci. 2021;11 : 5. doi:10.25259/JCIS_229_2020
- Račkauskienė J, Gedvilaitė V, Matačiūnas M et al. Prognostic value of Mastora obstruction score in acute pulmonary embolism. Acta Med Litu. 2019;26 : 191-198. doi:10.6001/actamedica.v26i4.4203
- Moser KM. Venous thromboembolism. Am Rev Respir Dis. 1990;141 : 235-249
- Vyas V, Goyal A. Acute Pulmonary Embolism. In: StatPearls. Treasure Island (FL): StatPearls Publishing; August 10, 2020
- Cambron JC, Saba ES, McBane RD et al. Adverse Events and Mortality in Anticoagulated Patients with Different Categories of Pulmonary Embolism. Mayo Clin Proc Inn Qual Out 2020;4 : 249-258. https://doi.org/10.1016/j.mayocpiqo.2020.02.002
- Mrózek J, Srp V, Novobílský K. Výskyt, diagnostika a léčba plicní embolie na interním oddělení. Část 1. Výskyt a diagnostika. Cor Vasa 2006;48 : 433–440
- Wells PS, Anderson DR, Rodger M, et al. Derivation of a simple clinical model to categorize patients probability of pulmonary embolism: increasing the models utility with the SimpliRED D-dimer. Thromb Haemost. 2000;83 : 416–420
- Dunn KL, Wolf JP, Dorfman DM, et al. Normal D-dimer levels in emergency department patients suspected of acute pulmonary embolism. J Am Coll Cardiol. 2002;40 : 1475–1478
- Schoeps UJ, Goldhaber SZ, Costello P. Spiral Computed Tomography for Acute Pulmonary Embolism. Circulation. 2004;109 : 2160-2167
- Wiener RS, Schwartz LM, Woloshin S. When a test is too good: how CT pulmonary angiograms find pulmonary emboli that do not need to be found. BMJ 2013;347:f3368 doi: 10.1136/bmj.f3368
- Lang O, Kunikova I. Change of collective effective dose of patients examined for suspective pulmonary embolism after introduction of multislice CT (MDCT) into a diagnostic process - single center experience. Eur J Nucl Med Mol Imaging 2016;43(S1):S527
- Schattner A. Computed tomographic pulmonary angiography to diagnose acute pulmonary embolism: the good, the bad, and the ugly: comment on „The prevalence of clinically relevant incidental findings on chest computed tomographic angiograms ordered to diagnose pulmonary embolism“. Arch Intern Med. 2009;169 : 1966-1968. doi:10.1001/archinternmed.2009.400
- Hall WB, Truitt SG, Scheunemann LP, et al. The prevalence of clinically relevant incidental findings on chest computed tomographic angiograms ordered to diagnose pulmonary embolism. Arch Intern Med. 2009;169 : 1961-1965. doi:10.1001/archinternmed.2009.360
- Stein PD, Fowler SE, Goodman LR, et al; PIOPED II Investigators. Multidetector computed tomography for acute pulmonary embolism. N Engl J Med. 2006;354 : 2317-2327
- Freeman LM. Don‘t Bury the V/Q Scan: It‘s as Good as Multidetector CT Angiograms with a Lot Less Radiation Exposure. J Nucl Med 2008;49 : 5-8. doi: 10.2967/jnumed.107.048066
- Tetalman MR, Hoffer PB, Heck LL, et al. Perfusion lung scan in normal volunteers. Radiology. 1973;106 : 593–594
- Carrier M, Righini M, Wells PS, et al. Subsegmental pulmonary embolism diagnosed by computed tomography: incidence and clinical implications. A systematic review and meta-analysis of the management outcome studies. J Thromb Haemost 2010; 8 : 1716–1722
- Raskob GE. Importance of subsegmental pulmonary embolism. Blood 2013;122 : 1094-1095
- Anderson DR, Kahn SR, Rodger MA et al. Computed tomographic pulmonary angiography vs ventilation-perfusion lung scanning in patients with suspected pulmonary embolism: a randomized controlled trial. JAMA 2007;298 : 2743-2753
- Wysowski DK, Nourjah P, Swartz L. Bleeding complications with warfarin use: a prevalent adverse effect resulting in regulatory action. Arch Intern Med 2007;167 : 1414-1419
- Donato AA, Khoche S, Santora J, Wagner B. Clinical outcomes in patients with isolated subsegmental pulmonary emboli diagnosed by multidetector CT pulmonary angiography. Thromb Res 2010;126:e266-270
- Kelly J, Hunt BJ. Do anticoagulants improve survival in patients presenting with venous thromboembolism? J Intern Med Dec 2003;254 : 527–539
- Wiener RS, Schwartz LM, Woloshin S. Time trends in pulmonary embolism in the United States: evidence of overdiagnosis. Arch Intern Med 2011;171 : 831-837
- Mettler FA Jr, Huda W, Yoshizumi TT et al. Effective doses in radiology and diagnostic nuclear medicine: a catalog. Radiology 2008;248 : 254-263
- Lang O. Radionuklidové metody v diagnostice plicní embolie. Kardiol prax 2006;4 : 168-172
- Smith-Bindman R, Lipson J, Marcus R et al. Radiation dose associated with common computed tomography examinations and the associated lifetime attributable risk of cancer. Arch Intern Med 2009;169 : 2078-2086
- Einstein AJ, Henzlova MJ, Rajagopolan S. Estimating risk of cancer associated with radiation exposure from 64-slice computed tomography coronary angiography. JAMA 2007;298 : 317–323
- Iribarren C, Hlatky MA, Chandra M, et al. Incidental pulmonary nodules on cardiac computed tomography: prognosis and use. Am J Med. 2008;121 : 989-996. doi:10.1016/j.amjmed.2008.05.040
- Gómez-Sánchez MA. What is the clinical significance of isolated subsegmental pulmonary embolism? Rev Port Pneumol 2014;20 : 179---180
- Moores LK, Jackson WL, Shorr AF et al. Meta-analysis: outcomes in patients with suspected pulmonary embolism managed with computed tomographic pulmonary angiography. Ann Intern Med 2004;141 : 866–874
- García-Sanz MT, Pena-Álvarez C, López-Landeiro P et al. Symptoms, location and prognosis of pulmonary embolism. Revista Portuguesa de Pneumologia 2014;20 : 194-199
- Hull RD, Raskob GE, Ginsberg JS et al. A noninvasive strategy for the treatment of patients with suspected pulmonary embolism. Arch Intern Med 1994;154 : 289–297
- Wells PS, Ginsberg JS, Anderson DR et al. Use of a clinical model for safe management of patients with suspected pulmonary embolism. Ann Intern Med 1998;129 : 997–1005.
- Goodman LR. Small pulmonary emboli: what do we know? Radiology 2005;234 : 654–658
- Le Roux PY, Palard X, Robin P et al. Safety of ventilation/perfusion single photon emission computed tomography for pulmonary embolism diagnosis. Eur J Nucl Med Mol Imaging 2014;41 : 1957–1964. DOI 10.1007/s00259-014-2763-1
Štítky
Nukleárna medicína Rádiodiagnostika Rádioterapia
Článok vyšiel v časopiseNukleární medicína

2021 Číslo 2
Najčítanejšie v tomto čísle- Subsegmentární embolie do plicnice – diagnostika a klinický význam
- Optimalizace radiační ochrany zdravotnického personálu na PET/CT pracovištích
- Přechodná FDG pozitivita uzlin po vakcinaci proti COVID-19
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



