-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Ototoxicita indukovaná cisplatinou - klinické sledování a stanovení individuální senzitivity
Ototoxicity Induced by Cisplatin – Clinical Observation and Determination of Individual Sensitivity
The clinical manifestation of ciplatin (CDDP) induced ototoxicity comprises unilateral or bilateral sensorial hearing loss (reversible or permanent) and tinnitus. The ototoxicity was shown to depend more on the individual sensitivity than on the total dose applied. The aim of the pilot study was to test (A) the effect of variable doses of CDDP and (B) efficiency of various diagnostic methods using three groups of patients. Otoacoustic emissions exhibited better predictive potential for final ototoxicity severity than classical tone audiometry. Presence of tinnitus did not predict degree of hearing loss. Based on the pilot study patients with the testicular and extragonadal germline tumors treated with CDDP were selected as an optimal study group for subsequent larger scale study. Apart from disease and treatment related parameters individual sensitivity will be assessed using genotyping of selected genetic markers in candidate genes related to oxidative/antioxidative balance.
Key words:
ototoxicity, cisplatin, otoacoustic emissions, tone audiometry, sensory-neural hearing loss.
Autori: T. Talach 1; R. Kostřica 1; J. Rottenberg 1; Michal Jurajda 2
; I. Kocák 3; R. Lakomý 3
Pôsobisko autorov: Klinika ORL a chirurgie hlavy a krku LF MU a FN U sv. Anny, Brno, přednosta prof. MUDr. R. Kostřica, CSc. 1, Ústav patologické fyziologie LF MU, Brno2, KKOP MOÚ a LF MU, Brno 3
Vyšlo v časopise: Otorinolaryngol Foniatr, 59, 2010, No. 4, pp. 175-179.
Kategória: Původní práce
Súhrn
Klinický obraz ototoxicity cisplatiny zahrnuje jednostrannou či oboustrannou percepční nedoslýchavost (reverzibilní nebo trvalou) a tinnitus. Tato ototoxicita je vysoce závislá na individuální senzitivitě; často více než na celkové podané dávce. Byla provedena pilotní studie sledující projevy ototoxicity indukované terapeutickými dávkami cisplatiny u tří skupin pacientů. Byla ověřena vyšší senzitivita měření otoakustických emisí než klasického tónového audiogramu vůči konečnému ototoxickému efektu a jejich prediktivní význam v klinickém sledování. Nebyl prokázán význam výskytu tinnitu jako prediktivního faktoru pro poškození prahu sluchu. Výstupem pilotní studie bylo i zvolení pacientů s extragonadálními germinativními nádory a s testikulárními nádory léčenými cisplatinou, jako nejvhodnějších pro následný výzkumný záměr. Kromě klinických vyšetření určujících individuální senzitivitu bude u nich provedena genotypizace vybraných genových markerů systému oxidativně/antioxidativní rovnováhy.
Klíčová slova:
ototoxicita, cisplatina, otoakustické emise, tónová audiometrie, percepční nedoslýchavost.ÚVOD
Ototoxicita je významným a častým nežádoucím účinkem řady léčiv. Proti minulosti, kdy šlo zejména o komplikace použití aminoglykosidů, je dnes těžiště těchto případů posunuto směrem k onkologické léčbě. Hlavním představitelem ototoxického chemoterapeutika je cisplatina (cisplatinum, cis-diamminedichloroplatinum, CDDP). Klíčovým mechanismem antineoplastického působení CDDP je inhibice syntézy DNA, ale má i imunosupresivní, radiosenzitizační a antimikrobiální vlastnosti. Indikacemi jsou testikulární karcinomy, karcinom vaječníku, děložního čípku, močového měchýře, spinocelulární karcinomy hlavy a krku a karcinom plic. Přes četné nežádoucí účinky (nefrotoxicita, ototoxicita, neurotoxicita, nauzea, vomitus, leukopenie a další) je pro svou vysokou účinnost hojně používána. U některých diagnóz nemá plnohodnotný ekvivalent a je lékem první volby. Po aplikaci se CDDP široce distribuuje prakticky ve všech tkáních a tělních tekutinách a rychle, rozsáhle a v zásadě ireverzibilně se váže na tkáňové a plazmatické bílkoviny, což vede k výraznému kumulativnímu efektu. Pokusy o její odstranění hemodialýzou jsou téměř bez výsledku a neexistuje žádné účinné antidotum. CDDP podléhá neenzymatické konverzi na inaktivní metabolit a primárně se vylučuje močí, kterou je vyloučeno 27 % až 43 % dávky během prvních 5 dnů.
Ototoxicita CDDP byla a je předmětem řady vědeckých prací. Je prokázáno, že po jejím podání dochází v hlemýždi k biochemickým změnám, které vedou k definovanému morfologickému poškození a současně ke specifickému poškození sluchu. Z dosud publikovaných vědeckých prací vyplývá, že interindividuální variabilita ototoxických projevů po podání CDDP je značně závislá na dosud blíže nespecifikovaných vlastnostech podmiňujících individuální senzitivitu pacienta (2, 12, 20). Jelikož je prokázáno, že hlavním obranným mechanismem proti ototoxickému účinku CDDP je působení antioxidativních enzymů, jsme oprávněni přepokládat, že variabilita genetického pozadí těchto enzymů může statisticky signifikantně ovlivňovat ototoxické projevy cisplatiny. Abychom tuto teorii ověřili, rozhodli jsme se provést rozsáhlou prospektivní studii sledující projevy ototoxicity indukované terapeutickými dávkami CDDP současně se stanovením genotypů genů kódujících vybrané antioxidativní enzymy, u nichž je prokázáno, že jejich polymorfismy a delece významně ovlivňují individuální senzitivitu ke zvýšenému oxidativnímu stresu. V první řadě byla provedena pilotní studie (Talach, Kocák) za cílem identifikace nejvhodnější skupiny pacientů z hlediska terapeutického schématu podání CDDP, výběru vhodných audiologických vyšetřovacích metod a nalezení nejvhodnější metodiky pro následný projekt. Prioritou v ní tedy bylo vyšetření pečlivě vybraných subjektů a nikoliv dosažení velkého statistického souboru. Později jsme za podpory Interní grantové agentury MZ ČR zahájili podstatně větší výzkumný záměr „Genetické aspekty ototoxicity indukované cisplatinou - prospektivní asociační studie“, na kterém nyní pracujeme. Účelem tohoto sdělení je představit výsledky zmíněné pilotní studie a některé dílčí výsledky probíhajícího výzkumného záměru.
MATERIÁL A METODIKA
Dávkovací schémata CDDP jsou značně odlišná, protože CDDP je v onkologii univerzálním lékem a používá se v řadě diagnóz. V uvedené pilotní studii jsme si stanovili následující zařazovací kritéria: věk 18-55 let, negativní otologická anamnéza (ve smyslu ušních operací, chronických otitid nebo tinnitu), negativní profesionální hluková anamnéza a vyloučení působení hluku během sledování, normální otoskopické vyšetření, normacuse nebo čistě percepční nedoslýchavost do 35 dB prahu sluchu (HTL) v klasickém tónovém audiogramu a výbavné transientní otoakustické emise (TEOAE). Každý pacient byl vyšetřen na audiologickém pracovišti před podáním CDDP, a to 4. až 6. den po ukončení každé série chemoterapie, za 1 měsíc a za 3 měsíce po terapii. Při každé návštěvě jsme prováděli otoskopické vyšetření, TEOAE, klasickou tónovou audiometrii a sledování tinnitu. Ze studie byli vyloučeni pacienti, kteří nebyli vyšetřeni ve všech stanovených termínech. Důležitým cílem pilotní studie bylo porovnat tři nejčastější skupiny pacientů léčených CDDP.
Do první skupiny jsme řadili subjekty s obvyklým kurativním podáním CDDP pro karcinomy v oblasti varlat, ORL, jícnu, močového měchýře a karcinomy plic. V této indikaci je nejčastěji CDDP podávána v sériích 1x za 3 týdny, kdy se v rámci každé série aplikuje celkově 80-100 mg/m2 CDDP (samotné nebo spolu s fluorouracilem) a délka série je 1 až 4 dny. Pro velice výrazný kumulativní efekt CDDP jsme v pilotní studii nepovažovali za nutné dělit pacienty na podskupiny podle doby trvání aplikace CDDP v rámci jedné série (D1-4). Počet aplikovaných sérií se u jednotlivých pacientů liší, zejména dle efektu onkologické léčby. Obvykle je jich 3-6, ale výjimečně i více. Do této první skupiny jsme zařadili 22 pacientů, dalších 45 muselo být odmítnuto, nejčastěji pro nevýbavnost TEOAE.
Ve druhé skupině jsme sledovali ototoxicitu vyvolanou CDDP v rámci neoadjuvantní léčby před operací karcinomů v ORL oblasti a karcinomů plic. Také zde se aplikuje CDDP v dávce 80-100 mg/m2 pro jednu sérii, ale v rámci neoadjuvance se podávají obvykle 2-3 série, takže celková kumulativní dávka CDDP je nižší. Navíc se zde CDDP častěji kombinuje s jinými chemoterapeutiky. V této druhé skupině pacientů bylo zařazeno 10 subjektů, kterým byly shodně podány 2 série CDDP, kritéria nesplnilo 25, zejména pro obtížné provádění post-treatment kontrol v pooperačním období.
Třetí skupinu jsme definovali jako pacienty s aplikací CDDP v konkomitantní chemoaktinoterapii, užívané v léčbě ORL nádorů a karcinomů děložního čípku v režimu 1x týdně v dávce 35-40 mg/m2, celkem obvykle 6x (po běžnou dobu 6 týdnů radioterapie). Celková kumulativní dávka zde nepřesahuje 240 mg/m2, ale je zcela odlišné časové schéma podání. Odmítnuto bylo 32 pacientů, nejčastěji pro poruchy sluchu nebo pro blízkost ozařovacího pole a spánkové kosti. Všechna kritéria splnilo pouze 5 pacientů.
Z dosavadních výstupů projektu „Genetické aspekty ototoxicity indukované cisplatinou - prospektivní asociační studie“ uvádíme souhrnné výsledky audiologického sledování vybraných dvaceti subjektů jako homogenního souboru mladých pacientů léčených pro germinativní nádory varlat (neseminomy i seminomy), velmi vhodného s ohledem na maximální výtěžnost klinických vyšetření. CDDP u nich byla podána kurativně, opět v sériích 1x za 3 týdny, s aplikací 80-100 mg/m2 CDDP na jednu sérii v délce aplikace 2-4 dny. Zde již sledujeme zejména vysokofrekvenční audiometrii a stanovení distorzního produktu otoakustických emisí (DPOAE).
VÝSLEDKY
První skupina s kurativním podáním CDDP zahrnovala jedince s různým počtem aplikovaných sérií. Výsledky jejich sledování jednak uvádíme v souhrnné tabulce a pro názornost také graficky pro procentuální výskyt tinnitu, snížení TEOAE a percepční nedoslýchavosti po jednotlivých sériích CDDP. Výskyt tinnitu nekoreloval s poklesem TEOAE ani HTL. Oproti tomu poklesu HTL pravidelně předcházelo snížení TEOAE (tab. 1, grafy 1–3).
Tab. 1. Sledování ototoxicity u skupiny pacientů s kurativním podáním CDDP. 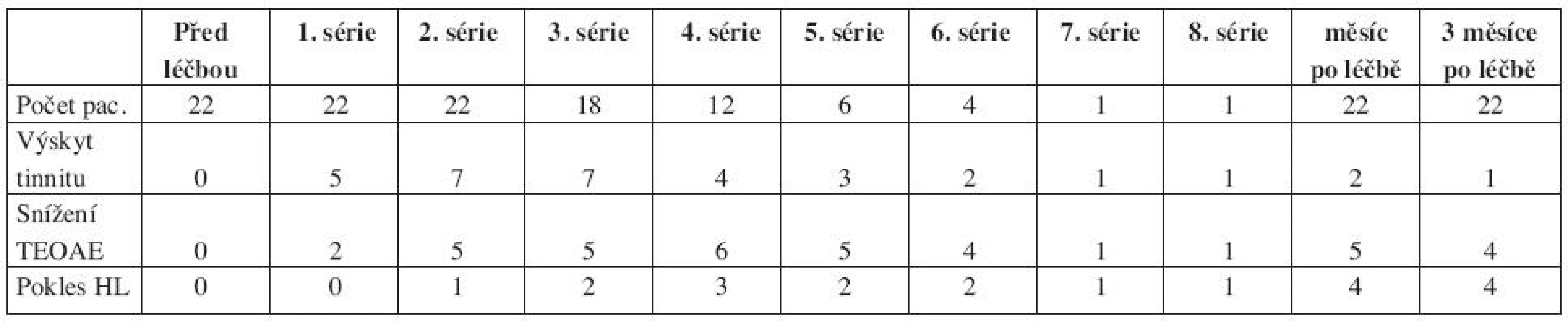
Pacienti ve druhé skupině, kterým byla aplikována neoadjuvantní chemoterapie, měli prakticky shodnou celkovou kumulativní dávku CDDP (vůči povrchu těla). Z těchto deseti subjektů jsme pozorovali po první sérii pouze vysokofrekvenční subjektivní oboustranný tinnitus u tří z nich. Byl vždy přechodný, doba jeho trvání nepřesáhla dva dny a nebyl provázen jinými audiologickými změnami. Teprve po podání druhé série CDDP jsme prokázali u dvou z těchto deseti signifikantní snížení výbavnosti TEOAE, ovšem bez poklesu HL v tónové audiometrii. Při kontrolních vyšetřeních, jeden a tři měsíce po léčbě CDDP, u všech sledovaných subjektů vidíme plnou restituci otoakustických emisí a není přítomen ani pokles sluchu, ani tinnitus.
Graf 1. Procentuální výskyt tinnitu po jednotlivých sériích chemoterapie u skupiny pacientů s kurativním podáním CDDP. 
Pacienti léčení CDDP v rámci konkomitantní chemoaktinoterapie vykazovali častější audiologické změny. Již během aplikace CDDP se u 3 z 5 rozvinul oboustranný tinnitus, který však po ukončení léčby vymizel. Při kontrole 4.-6. den po aplikaci CDDP jsme prokázali významné snížení výbavnosti TEOAE u 4 z 5 pacientů a u jednoho z nich současně i jednostrannou basokochleární percepční nedoslýchavost, která se stala trvalou i v dalších kontrolách. Oproti tomu pokles TEOAE, pozorovaný po léčbě, byl měsíc po terapii prokazatelný pouze u dvou pacientů a při závěrečném vyšetření již byly TEOAE opět výbavné u všech subjektů.
Graf 2. Procentuální výskyt snížení TEOAE po jednotlivých sériích chemoterapie u skupiny pacientů s kurativním podáním CDDP. 
U dvaceti vybraných pacientů, zařazených do probíhajícího výzkumného projektu „Genetické aspekty ototoxicity indukované cisplatinou - prospektivní asociační studie“, léčených CDDP pro germinativní nádory varlat, nacházíme během jejich léčby tinnitus u 80 % z nich a u 35 % se stává trvalým, bez korelace s poškozením prahu sluchu. Měřitelné snížení výbavnosti DPOAE během terapie jsme prokázali v 60 % a trvalé změny DPOAE u 20 %. Přechodný pokles HTL v tónové audiometrii, včetně vysokofrekvenčního měření, jsme během terapie pozorovali u 40 % a trvalé ireverzibilní změny v prahovém audiogramu byly přítomny u 20 % pacientů.
Graf 3. Procento pacientů s percepční nedoslýchavostí po jednotlivých sériích chemoterapie u skupiny pacientů s kurativním podáním CDDP. 
DISKUSE
Všeobecně se nyní soudí, že podkladem ototoxicity CDDP na biochemické úrovni je oxidativní stres způsobený dysbalancí mezi produkcí a odstraňováním reaktivních metabolitů kyslíku (ROS). Za fyziologických podmínek jsou jejich nežádoucí účinky blokovány systémem antioxidativních enzymů. Stochastický účinek ROS spočívá v poškozování buněčných struktur a makromolekul jako jsou lipidy, proteiny a DNA radikálovými reakcemi, což při určité koncentraci, kdy antioxidativní systém již nestačí neutralizovat jejich škodlivý vliv, vede k buněčné smrti. Dle dostupné literatury jsou uvedené biochemické změny v buňkách hlemýždě od 4. až 6. dne po podání CDDP následovány apoptózou (26), selektivně postihující vnější vláskové buňky (OHC) (6, 19) a podle některých autorů současně i myelinové pochvy neuronů ganglion spirale (24), podpůrné buňky Cortiho orgánu (16, 17) a dle jedné práce, v rozporu s ostatními, také vnitřní vláskové buňky (IHC) (1). Toto morfologické poškození je vždy z počátku patrné v bazálním závitu hlemýždě a se stoupající kumulativní dávkou CDDP pak v jeho střední a nejpozději v apikální části. Nebyl pozorován ani endolymfatický hydrops ani poškození stria vascularis (24). Klinický obraz ototoxicity, vyvolané u člověka podáním terapeutických dávek CDDP, zahrnuje jednostrannou či oboustrannou percepční nedoslýchavost a tinnitus. Dle literatury se pokles HTL, jak reverzibilní, tak i trvalý, může objevit nejdříve od 3. dne po zahájení aplikace CDDP (9); zpočátku je vždy vysokofrekvenční (nad 12 kHz) a s narůstající celkovou kumulativní dávkou postupně zasahuje nižší frekvence a zvyšuje svou intenzitu. Existuje několik prací popisujících výskyt a tíži těchto změn, avšak při velké variabilitě dávkovacích schémat, počtu cyklů, věku pacientů, načasování měření a jiných rozdílů jsou jejich výsledky jen obtížně srovnatelné. Pokles HTL je popisován v rozmezí od 7 do 50 % (3, 7, 15, 23, 25), při velmi vysokých dávkách CDDP do 75 % (15) a u dětí až 86 % (12). Prokazatelně trvalé změny HTL jsou uvedeny u 7 – 37 % (3, 8). Tinnitus je součástí symptomatologie ve více než 50 % případů a bývá často reverzibilní (4, 11).
Vůči těmto literárním údajům pozorujeme u našich pacientů s kurativním podáním CDDP během obvyklé doby terapie pokles HTL až u 50 % z nich a tento pokles v 18 % sledovaných subjektů již zůstává ireverzibilní. Proto se tato skupina pacientů zdála být vhodnější pro návazné podrobnější sledování, než při podávání CDDP jako neoadjuvantní chemoterapie, v rámci které by bylo dosti obtížné vyprofilovat jedince senzitivní vůči ototoxicitě. Rovněž pacienti léčení CDDP v rámci konkomitantní chemoaktinoterapie nejsou pro další výzkum vhodní, zejména pro malé procento subjektů, schopných splnit vstupní kritéria a obtíže s účastí v celé době sledování. Poznatky pilotní studie tedy umožnily správnou volbu profilu pacientů pro současný výzkumný projekt, ve kterém se soustředíme zejména na mladé jedince s intaktním sluchem, léčené CDDP pro germinativní nádory varlat. Uvedené předběžné výsledky tohoto našeho sledování jsou v souladu s literárními prameny a poskytují záruku dosažení homogenního souboru pacientů, ideálního k selekci jedinců zvýšeně senzitivních vůči ototoxicitě CDDP a stanovení jejich genotypů genů kódujících vybrané antioxidativní enzymy, u nichž je prokázáno, že jejich polymorfismy a delece významně ovlivňují individuální senzitivitu ke zvýšenému oxidativnímu stresu.
V literatuře je diskutována i výpovědní hodnota stanovení otoakustických emisí (OAE) (13, 18, 22), zvlášť s ohledem na senzitivitu a možnosti interpretace naměřených hodnot (21). Ve všech skupinách sledovaných pacientů jsme prokázali podstatně vyšší senzitivitu měření otoakustických emisí vůči tónovému audiogramu, spolehlivou vazbu mezi změnami obou a dobrou korelaci mezi schopností restituce OAE a HTL. Oproti tomu nebyla zjištěna závislost mezi výskytem tinnitu a snížením otoakustických emisí nebo poškozením prahu sluchu. Z jeho časného výskytu nijak nelze odhadnout pravděpodobnost trvalých změn sluchu a tinnitus samotný je zde obvykle reverzibilní.
ZÁVĚR
Hlavními cíli pilotní práce bylo ověřit a upřesnit literární údaje o klinických projevech ototoxicity cisplatiny v našich podmínkách, vyprofilovat skupinu pacientů vhodnou k co nejlepší diferenciaci dostatečného počtu subjektů se zvýšenou senzitivitou vůči ototoxicitě cisplatiny od zbytku populace a ověřit metodiku jejich audiologického sledování. Těchto cílů bylo plně dosaženo, jak prokazují uvedené výsledky části pacientů probíhajícího výzkumného záměru „Genetické aspekty ototoxicity indukované cisplatinou - prospektivní asociační studie“. V něm se nyní nejčastěji soustřeďujeme na pacienty s kurativním podáním CDDP pro germinativní nádory varlat. Data zjištěná pilotní studií nás vedla k rozšíření jejich audiologického sledování o vysokofrekvenční audiometrii a DPOAE. Otoakustické emise nyní považujeme za ideální screeningovou metodu k monitorování ototoxicity v běžné praxi. TEOAE a částečně i DPOAE jsou však limitovány horší možností kvantifikace zjištěných změn. Význam tinnitu u ototoxicity nyní považujeme za zcela okrajový. Výsledky stanovení závislosti ototoxických projevů při podávání CDDP na genotypu v rámci jednotlivých variant genů pro enzymy antioxidativního systému uveřejníme po uzavření databáze v samostatném článku.
Publikace je vázána na výzkumný záměr Interní grantové agentury MZ ČR 10400-3 „Genetické aspekty ototoxicity indukované cisplatinou - prospektivní asociační studie“ (2008-2011, MZ).
MUDr. Tomáš Talach
Klinika ORL LF MU a FN U sv. Anny
Pekařská 53
656 91 Brno
Zdroje
1. Bauer, C. A., Brozoski, T. J.: Cochlear structure and function after round window application of ototoxins. Hear Res., 201, 2005, 1-2, s. 121-31.
2. Berg, A. L., Spitzer, J. B., Gardin, J. H.: Ototoxic impact of cisplatin in pediatric oncology patients. Laryngoskope, 109, 1999, s. 1806-1814.
3. Bertolini, P., Lassalle, M., Mercier, G., Raquin, M. A., Izzi, G., Corradini, N., Hartmann, O.: Platinum compound-related ototoxicity in children: long-term follow-up reveals continuous worsening of hearing loss. J. Pediatr. Hematom. Oncol., 26, 2004, 10, s. 649-655.
4. Domenech, J., Carulla, M., Traserra, J.: Tinnitus in the diagnosis and prognosis of ototoxicity. Acta Otorrinolaringol Esp., 41, 1990, 1, s. 7-9.
5. Dreschler, W. A., Hulst, R. J., Tange, R. A., Urbanu, N. A.: The role of high-frequency audiometry in early detection of ototoxicity. Audiology, 24, 1985, 6, s. 387-395.
6. Fetoni, A. R., Sergi, B., Ferraresi, A., Paludetti, G., Trojanu, D.: Protective effects of alpha-tocopherol and tiopronin against cisplatin-induced ototoxicity. Acta Otolaryngol, 124, 2004, 4, s. 421-426.
7. Ilveskoski, I., Saarinen, U. M., Wiklund, T., Perkkio, M., Salmi, T. T., Panniny, M., Makipernaa, A., Pihko, H.: Ototoxicity in children with malignant brain tumors treated with the “8 in 1” chemotherapy protocol. Med. Pediatr. Oncol., 27, 1996, 1, s. 26-31.
8. Langer, T., Stohr, W., Bielack, S., Paulussen, M., Treuner, J., Beck, J. D.; German Late Effects Working Group in the German Society of Pediatric Oncology and Hematology: Late effects surveillance system for sarcoma patients. Pediatr. Blood Cancer, 42, 2004, 4, s. 373-379.
9. Laurell, G., Engstrom, B., Hirsch, A., Bagger-Sjoback, D.: Ototoxicity of cisplatin. Int. J. Androl., 10, 1987, 1, s. 359-362.
10. Li, Y., Womer, R. B., Silber, J. H.: Predicting cisplatin ototoxicity in children: the influence of age and the cumulative dose. Eur J. Cancor,40, 2004, 16, s. 2445-2451.
11. Melamed, L. B., Selim, M. A., Schuchman, D.: Cisplatin ototoxicity in gynecologic cancer patients. A Preliminary Report. Cancer, 55, 1985, 1 s. 41-43.
12. Montaguti, M., Brandolini, C., Ferri, G. G., Hatzopoulos, S., Prete, A., Pension, A.: Cisplatin and carboplatin-induced ototoxicity in children: clinical aspects and perspectives for prevention. Acta Otorhinolaryngol Ital., 22, 2002, 1, s. 14-18.
13. Orts Alborch, M., Garcia Callejo, J., Morant Ventura, A., Ferrer Baixauli, F., Esparcia Navarro, M., Marco Algarra, J.: Clinical study on the ototoxicity of cisplatin with distortion products. Acta Otorrinolaringol Esp., 51, 2000, 6, s. 469-477.
14. Park, K. R.: The utility of acoustic reflex thresholds and other conventional audiologic tests for monitoring cisplatin ototoxicity in the pediatric population. Ear Hear, 17, 1996, 2, s. 107-115.
15. Pollera, C. F., Marolla. P., Nardi, M., Ameglio, F., Cozzo, L., Bevere, F.: Very high-dose cisplatin-induced ototoxicity: a preliminary report on early and long-term effects. Cancer Chemother. Pharmacol., 21, 1988, 1, s. 61-64.
16. Ramirez-Camacho, R., Garcia-Berrocal, J. R., Bujan, J., Martin-Marero, A., Trinidad, A.: Supporting cells as a target of cisplatin-induced inner ear damage: therapeutic implications. Laryngoskope, 114, 2004, 3, s. 533-537.
17. Ramirez-Camacho, R., Garcia-Berrocal, J. R., Trinidad, A., Martin-Marero, A., Bujan, J.: Cochlear cytotoxic activity of cisplatin in experimentation animals. A study using scanning electron microscopy. Acta Otorrinolaringol Esp., 53, 2002, 8, s. 538-542.
18. Ress, B. D., Sridhar, K. S., Balkany, T. J., Axman, G. M., Stagner, B. B., Lonsbury-Martin, B. L.: Effects of cis-platinum chemotherapy on otoacoustic emissions: the development of an objective screening protocol. Third place-Resident Clinical Science Award 1998. Otolaryngol Head Neck Surg., 121, 1999, 6, 693-701.
19. Sergi, B., Ferraresi, A., Trojanu, D., Paludetti, G., Fetoni, A. R.: Cisplatin ototoxicity in the guinea pig: vestibular and cochlear damage. Hear Res., 182, 2003, 1-2, s. 56-64.
20. Sockalingam, R., Filippech, L., Charles, B., Mudroch, B.: Cisplatin-induced ototoxicity and pharmacokinetics: preliminary findings in a dog model. Ann. Otol. Rhinol. Laryngol., 111, 2002, 8, s. 745-750.
21. Stavroulaki, P., Apostolopoulos, N., Pegas, J., Tsakanikos, M., Adamopoulos, G.: Evoked otoacoustic emissions—an approach for monitoring cisplatin induced ototoxicity in children. Int. J. Pediatr. Otorhinolaryngol, 59, 2001, 1, s. 47-57.
22. Toral-Martinon, R., Shkurovich-Bialik, P., Collado-Corona, M. A., Mora-Magana, I., Goldgrub-Listopad, S., Shkurovich-Zaslavsky, M.: Distortion product otoacoustic emissions test is useful in children undergoing cisplatin treatment. Arch. Med. Res., 34, 2003, 3, s. 205-208.
23. van der Hulst, R. J., Dreschler, W. A., Urbanu, N. A.: High frequency audiometry in prospective clinical research of ototoxicity due to platinum derivatives. Ann. Otol. Rhinol. Laryngol., 97, 1988, 2, Pt 1, s. 133-137.
24. van Ruijven, M. W, de Groot, J. C., Smoorenburg, G. F.: Time sequence of degeneration pattern in the guinea pig cochlea during cisplatin administration. A quantitative histological study. Hear Res., 197, 2004, 1-2, s. 44-54.
25. Vodvarka, P., Foukalova, J., Mrazek, J., Philippova, J.: Ototoxicity of cis-diamminedichloroplatinum. Neoplasma, 32, 1985, 2, s. 229-238.
26. Watanabe, K., Jinnouchi, K., Žati, T.: Detection of single-stranded DNA (ssDNA) in the vestibule of guinea pigs after the application of cisplatinum (CDDP). Anticancer Res., 21, 2001, 2A, s. 1135-1138.
Štítky
Audiológia a foniatria Detská otorinolaryngológia Otorinolaryngológia
Článok vyšiel v časopiseOtorinolaryngologie a foniatrie
Najčítanejšie tento týždeň
2010 Číslo 4- Subkutánne vs. intravenózne imunoglobulíny u pacientov s CLL
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
-
Všetky články tohto čísla
- Ototoxicita indukovaná cisplatinou - klinické sledování a stanovení individuální senzitivity
-
Obstrukční spánková apnoe – význam septoplastiky a turbinoplastiky
Část I (teoretická část) -
Obstrukční spánková apnoe – význam septoplastiky a turbinoplastiky
Část II (praktická část) - Hodnocení kvality závěru glottis
- PFAPA syndrom v ORL oblasti a jeho indikace k tonzilektomii
- Kawasakiho syndrom – možná příčina krční lymfonoditidy u dětí
- Vestibulárne evokované myogénne potenciály – VEMP: štandardizácia metódy
- Přehled metodických postupů subjektivního popisu vlastností hlasových projevů v oblasti poruch, patologie a terapie hlasu
- Endoskopická autofluorescencia v diagnostike nádorov hrtana
- Kostný vibrátor ukotvený do lebky (BAHA) - naše skúsenosti
- Současné možnosti léčby recidivující papilomatózy hrtanu
- Prof. MUDr. Jiří Hubáček, DrSc., osmdesátníkem
-
9. česko-německé ORL dny
(SRN, Bad Salzungen, 8. – 9. října 2010) -
Sympozium poruch polykání
(Pardubice, 22. – 23. října 2010) -
4. kurz fonochirurgie a rekonstrukční chirurgie hrtanu
(SRN, Würzburg, 14. – 17. července 2010) - Autorský a věcný rejstřík
- Otorinolaryngologie a foniatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- PFAPA syndrom v ORL oblasti a jeho indikace k tonzilektomii
- Kawasakiho syndrom – možná příčina krční lymfonoditidy u dětí
- Vestibulárne evokované myogénne potenciály – VEMP: štandardizácia metódy
-
Obstrukční spánková apnoe – význam septoplastiky a turbinoplastiky
Část II (praktická část)
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



