-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Vrodená cytomegalovírusová infekcia z pohľadu otorinolaryngológa
Congenital cytomegalovirus infection from the viewpoint of otorhinolaryngologist
Congenital cytomegalovirus infection (cCMV) is the most common non-genetic cause of congenital sensorineural hearing loss (SNHL) and one of the most prevalent inborn infections. Its symptoms are variable, from thrombocytopenia to neurodevelopmental defects. Long-term consequences, including SNHL, occur in about 15% of newborns. However, they are often born asymptomatic and the SNHL develops later in childhood, leading to a high number of undiagnosed cases. Available diagnostic methods vary in their reliability and require correct indication and subsequent interpretation of the results. A different approach represents the implementation of full-scale cCMV screening into the current neonatal screening programs. The goal of our review article is to summarize the currently available data about congenital CMV infection associated with hearing loss with particular emphasis on recent diagnostic strategies.
Keywords:
hearing loss – screening – newborn – cytomegalovirus
Autori: Ugorová D. 1; Polakovičová Z. 2; Dobišová I. 2; Pejhovská L. 2; Chovancová D. 2; Profant M. 1; Varga L. 1
Pôsobisko autorov: Klinika otorinolaryngológie a chirurgie hlavy a krku LF UK a UN Bratislava 1; Novorodenecká klinika M. Rusnáka SZU a UN Bratislava 2
Vyšlo v časopise: Otorinolaryngol Foniatr, 71, 2022, No. 4, pp. 210-217.
Kategória:
doi: https://doi.org/10.48095/ccorl2022210Súhrn
Kongenitálna cytomegalovírusová infekcia (cCMV) je najčastejšou negenetickou príčinou vrodenej senzorineurálnej poruchy sluchu (SNHL) a jednou z najprevalentnejších kongenitálnych infekcií. Jej príznaky sú variabilné, od trombocytopénie až po poruchy neurologického vývinu. Dlhodobé následky vrátane SNHL sa vyskytujú zhruba u 15 % novorodencov s cCMV. Novorodenci sú avšak často pri narodení asymptomatickí a klinický obraz sa rozvinie neskôr v detstve, čo vedie k vysokému počtu nediagnostikovaných prípadov. Dostupné diagnostické metódy vykazujú rôznu mieru spoľahlivosti a vyžadujú si správnu indikáciu a následnú interpretáciu výsledkov. Iný prístup predstavuje implementácia plošného skríningu cCMV do existujúcich programov univerzálneho neonatálneho skríningu. Cieľom našej prehľadovej práce je sumarizácia najnovších poznatkov o kongenitálnej CMV infekcii v spojení s poruchou sluchu, s osobitným zameraním na súčasné možnosti jej diagnostiky.
Klíčová slova:
skríning – novorodenec – porucha sluchu – cytomegalovirus
Úvod
Ľudský cytomegalovírus je DNA vírus patriaci do skupiny herpesvírusov. Z globálneho pohľadu sa jeho séroepidemiológia líši medzi jednotlivými krajinami [1]. Je dobre známy jeho význam pri morbidite a mortalite imunokompromitovaných pacientov [2]. V prípade komplikácií kongenitálnej CMV infekcie (cCMV) a jej úlohe pri vzniku vrodenej poruchy sluchu a neurovývinového deficitu sú populačné dáta skôr odhadované alebo pochádzajú z menšieho počtu lokálnych štúdií. Infekcia cCMV má až v 15 % dlhodobé následky vrátane SNHL, no väčšina z nich je po pôrode asymptomatická a porucha sluchu sa rozvinie až v predškolskom veku [3]. Podobným spôsobom sa môžu manifestovať aj ostatné prejavy cCMV infekcie. Retrospektívne pátranie po CMV etiológii je náročné a jeho výstupy sú nepresné. Preto sa v posledných rokoch začalo uvažovať o univerzálnom skríningu cCMV, ktorý by umožnil včasnú diagnostiku a intervenciu, dôležitú počas kritického obdobia vývinu reči u detí [4–6]. Naším cieľom je poskytnúť aktuálny prehľad zameraný na súčasné možnosti a trendy v diagnostike cCMV infekcie a jej následného manažmentu, s dôrazom na riziká vzniku permanentnej poruchy sluchu.
Epidemiológia
Prevalencia cCMV infekcie u živonarodených detí v rozvinutých krajinách sa pohybuje v intervale 0,2–2,0 % (priemer 0,65 %) [7]. V rámci európskych krajín sú dostupné údaje napr. z Rakúska (0,21 %) [8] alebo Talianska (0,18 %) [9]; spomedzi iných rozvinutých krajín z Japonska (0,31 %) [10] alebo Izraela (1 %) [11]. Incidencia in utero CMV infekcie závisí od prevalencie v populácii a pozitívne koreluje s maternálnou séroprevalenciou [1]. Hypotéza, že premorenie populácie ľudským cytomegalovírusom prispeje k tvorbe imunity proti CMV u matiek a k následnému zníženiu prenosu na plod, sa nepotvrdila. Pri každom náraste maternálnej séroprevalencie o 10 % je výstup prevalencie cCMV 0,26 % [12]. Ukazuje sa, že tieto dáta korelujú so socioekonomickým statusom, úrovňou vzdelania, ale aj etnikom. V rozvinutých krajinách sa séroprevalencia u matiek pohybuje okolo 50–60 % (USA, Veľká Británia a väčšina ostatných európskych krajín), zatiaľ čo v menej rozvinutých regiónoch dosahuje viac ako 90 % (Brazília, Južná Afrika, India) [1, 7]. V rozvojových krajinách s vysokou séropozitivitou sa preto prevalencia cCMV pohybuje medzi 1 a 6 % [13].
Prenos
Po infekcii cytomegalovírusom vzniká celoživotné nosičstvo a vírus sa môže preniesť prakticky všetkými telesnými tekutinami (sliny, moč, materské mlieko, pohlavné tekutiny alebo krv) [14]. K jeho vylučovaniu vo vysokom množstve dochádza hlavne u detí vo veku do dvoch rokov a trvá mesiace až roky [15]. Najčastejším miestom šírenia medzi deťmi sú predškolské zariadenia. Tehotné ženy s deťmi v predškolskom veku sú preto rizikovou skupinou.
Ženy môžu mať počas tehotenstva infekciu primárnu, s rizikom vertikálneho prenosu 30–40 %, alebo sekundárnu (reaktivácia latentnej CMV infekcie alebo infekcia novým typom CMV), s rizikom prenosu na plod 0,2–2,0 % [16]. Pravdepodobnosť vertikálneho prenosu z matky na plod je najvyššia v neskorom gestačnom období, no s nižšou pravdepodobnosťou závažnej infekcie. Naopak, pravdepodobnosť prenosu je najnižšia v prvom trimestri, ale dopad na plod je závažnejší [17–19]. Napriek vyššiemu riziku prenosu CMV infekcie na plod u matky s primoinfekciou, je vyššia prevalencia cCMV u novorodencov matiek so sekundárnou infekciou, kvôli vysokej celkovej prevalencii CMV infekcie v populácii [20].
Príznaky
Kongenitálna CMV infekcia je v 90 % prípadov pri narodení asymptomatická, z nich sa však ešte približne 10–15 % prejaví neskôr v detstve [21]. Najčastejším príznakom u detí s cCMV sú petéchie (72 %) a trombocytopénia (70 %), ďalej žltačka pri hyperbilirubinémii, hepatosplenomegália, chorioretinitída, neurologické záchvaty, mikrocefália, senzorineurálna porucha sluchu a iné. Medzi známe intrakraniálne komplikácie patria kalcifikácie (59 %), dilatácia komorového systému (55 %) a lézie bielej hmoty (27 %). Strata objemu mozgu bola opisovaná u 69 % novorodencov [22]. Doteraz nebol zistený kauzálny vzťah medzi funkčným renálnym postihnutím a cCMV napriek tomu, že vírus tkanivo obličiek infikuje a aktívne sa replikuje v epiteli tubulárnych buniek [23].
Infekcia cCMV sa rozdeľuje do niekoľkých kategórií podľa klinických prejavov. Za stredne ťažkú až ťažkú symptomatickú cCMV infekciu sa považuje kombinácia viacerých vyššie uvedených príznakov alebo postihnutie CNS. Ľahká symptomatická cCMV infekcia je v prípade jedného alebo dvoch izolovaných príznakov. Ďalej sa samostatne opisuje asymptomatická cCMV infekcia s izolovanou poruchou sluchu a asymptomatická infekcia s dobrým sluchom [6].
Permanentné následky infekcie sa vyskytujú zhruba u 40–58 % novorodencov so symptomatickým priebehom cCMV, pričom toto číslo je nižšie u novorodencov asymptomatických pri narodení [21]. Výskyt úmrtí u symptomatických novorodencov sa opisuje v 7–30 % prípadov [21, 22].
Incidencia senzorineurálnej poruchy sluchu pri cCMV sa udáva okolo 12,6 %, čo je asi 0,5 na 1 000 detí. SNHL sa vyskytuje v 32,8 % u symptomatických a v 9,9 % u predtým asymptomatických detí. Formy sluchového postihnutia a ich proporčné zastúpenie pri symptomatickej a asymptomatickej cCMV uvádzame v tab. 1 [13]. Ukazuje sa, že SNHL u novorodencov sa vyskytuje častejšie u matiek s prenosom CMV infekcie v prvom trimestri [24]. Údaje o rozdieloch v incidencii SNHL pri primoinfekcii a sekundárnej infekcii matiek sú však rôzne. Signifikantná predilekcia k obojstrannej či jednostrannej SNHL medzi skupinou detí matiek s primárnou a sekundárnou cCMV infekciou sa ale nenašla. Progresia SNHL je signifikantne vyššia u primoinfekcií (63 %), ako u matiek s latentnou infekciou/reinfekciou (15 %) a rovnaký vzťah platí aj pri porovnaní primárne asymptomatických a symptomatických infekcií u detí [13, 25].
Tab. 1. Formy sluchového postihnutia pri symptomatickej a asymptomatickej cCMV infekcii [13].
Tab. 1. Forms of hearing loss in symptomatic and asymptomatic cCMV infection [13].![Formy sluchového postihnutia pri symptomatickej a asymptomatickej
cCMV infekcii [13].<br>
Tab. 1. Forms of hearing loss in symptomatic and asymptomatic cCMV infection
[13].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/e81d27b5d7ed4525dbcdb047de568275.jpg)
Patogenéza SNHL pri cCMV infekcii nie je dodnes úplne vysvetlená. Schuknecht v roku 1993 pri disekcii spánkovej kosti novorodencov s ťažkou kongenitálnou CMV infekciou zistil virálne inklúzie CMV nachádzajúce sa difúzne v ligamentum spirale, membrana vestibularis (Reissneri) a v niektorých častiach membrana basilaris a ganglion cochleovestibulare. Takisto potvrdil degeneráciu alebo stratu vonkajších a vnútorných vláskových buniek Cortiho orgánu [26]. Navyše, v roku 1988 Fukuda et al. po inokulácii CMV vírusu do srdcového svalu morčiat zistili prítomnosť vírusu v ganglion spirale, na základe čoho predpokladali vstup vírusu do vnútorného ucha cez cievne zásobenie modiolu a následne do buniek ganglion spirale [27]. Pri patogenéze SNHL môžu zohrávať rolu proteíny vírusu zodpovedné za aktiváciu cytotoxických T lymfocytov a natural killer (NK) buniek a za zasahovanie do procesu prezentácie antigénov. Experimenty na zvieratách ukazujú, že cytopatický efekt virálnych génových produktov, ako aj imunitná reakcia, prispievajú k labyrintitíde a degeneratívnym zmenám labyrintu a kochleárnej vaskulatúry [28, 29].
Vzhľadom na blízky vzťah sluchového a vestibulárneho orgánu nie je prekvapením, že pri cCMV sa vyskytujú aj poruchy rovnovážnej funkcie. Závažnosť vestibulárnej dysfunkcie pri cCMV je variabilná. cCMV infekcia postihuje funkciu otolitov aj polkruhových kanálikov a býva prítomná aj pri neporušenom sluchu [30].
Diagnostika
Prenatálna diagnostika
Štandard prenatálnej diagnostiky primárnej CMV infekcie u matiek je detekcia CMV IgG sérokonverzie. Avšak na správne vyhodnotenie tohto údaja je nutné poznať sérologický status pred začiatkom tehotenstva. Vyšetrenie CMV IgM takisto nie je pri senzitivite 20–25 % spoľahlivým markerom, vzhľadom k dlhodobej produkcii (6–9 mesiacov) po primárnej infekcii [31]. Preto je dôležité vyšetrenie IgG avidity v kombinácii s IgM protilátkami. Protilátky tvorené v čase primárnej infekcie majú nižšiu aviditu ako tie počas reinfekcie alebo reaktivácie latentnej infekcie. Avidita protilátok sa časom zvyšuje. Nízka avidita IgG spolu s pozitivitou IgM protilátok teda potvrdzuje začiatok infekcie počas predchádzajúcich troch mesiacov a napomáha presnejšej diagnostike primárnej infekcie počas alebo tesne pred počatím [31, 32].
Pri pátraní po potenciálnych prenatálnych biomarkeroch cCMV sa zistilo, že pozitívny PCR záchyt CMV DNA z cervikálneho sekrétu tehotných žien a USG detekcia fetálnych abnormalít sú signifikantnými prediktormi kongenitálnej CMV infekcie u CMV IgM pozitívnych matiek. Naopak, detekcia CMV DNA z moču alebo séra tehotných žien sa neukázala ako spoľahlivá metóda na prenatálnu diagnostiku CMV infekcie [33].
Amniocentéza u žien s vysokým rizikom CMV infekcie (t. j. pri detekcii CMV IgG sérokonverzie) má vysokú senzitivitu (72,7–80 %) aj špecificitu (100 %) [32, 34]. CMV sa do amnionovej tekutiny dostane močom plodu a jeho hladina je detekovateľná od 6.–9. týždňa po infekcii matky. Na predídenie falošne negatívnych výsledkov je preto potrebné počkať 6 týždňov po infekcii a do 21. gestačného týždňa. Zákrok je invazívny a nemožno ho uplatniť ako skríningovú metódu [35].
Postnatálna diagnostika
Postnatálne vyšetrenie kongenitálnej CMV infekcie je možné zo slín, krvi, moču alebo suchej (Guthrieho) kvapky krvi novorodenca. Moč a sliny sú veľmi spoľahlivým materiálom na skríning cCMV pomocou PCR metódy [36]. Vyšetrenie sa odporúča uskutočniť čo najskôr po narodení, najneskôr do 21. dňa života, aby výsledky neboli skreslené postnatálnou CMV infekciou. Odber slín by mal byť aspoň hodinu po dojčení kvôli možnej kontaminácii slín vírusom z materského mlieka, ktorá vedie k falošnej pozitivite výsledkov. Preto je v prípade pozitivity testu zo slín potrebné v rovnakom časovom intervale (t. j. do 21 dní od narodenia) uskutočniť kontrolné vyšetrenie CMV DNA pomocou PCR z moču [6, 37]. Ako optimálna kombinácia diagnostických metód skríningu cCMV sa ukazuje skríning slín a moču s následným konfirmačným vyšetrením slín a moču, pri ktorých bola dosiahnutá najvyššia senzitivita (100 %) aj špecificita (100 %). Vzhľadom na zložitejší odber moču u novorodencov ako vhodná metóda pre skríningovú prax vychádza skríningové vyšetrenie slín a konfirmačné vyšetrenie slín a moču, ktoré majú stále dostatočne vysokú senzitivitu (85,7 %) a špecificitu (100 %) [38].
Vyšetrenie pomocou PCR z krvi je spomínané hlavne v kontexte konfirmačných vyšetrení alebo cielených vyšetrení suspektných novorodencov kvôli relatívnej invazivite odberu materiálu. Kvantitatívna PCR (qPCR) analýza hladiny virémie pozitívne koreluje so závažnosťou ochorenia, t. j. čím vyššia je virálna dávka, tým závažnejšia je symptomatika [39]. Korelácia sa ukázala hlavne pri neurologickom postihnutí, trombocytopénii a zvýšení transamináz. Spojenie medzi hladinou virálnej dávky a SNHL sa však nedokázalo, a nie je preto dobrým prognostickým faktorom poruchy sluchu [40]. Takisto nedokáže rozlíšiť medzi symptomatickým a asymptomatickým priebehom infekcie [39].
Vyšetrenie zo suchej kvapky sa pre potreby skríningu neosvedčilo kvôli nízkej senzitivite. Je však nápomocné pri spätnom pátraní po možnej cCMV infekcii. Jeho pozitivita potvrdzuje cCMV, ale jeho negativita ju nevylučuje [41]. Jednotlivé metódy prenatálnej a postnatálnej diagnostiky cCMV prehľadne uvádzame v tab. 2 [34, 42–45] a praktické odporúčania pre skríning cCMV u novorodencov navrhnuté NHS East of England v roku 2019 sú uvedené v tab. 3 [3]. Z nich vyplýva, že vyšetrovanie protilátok u novorodenca má oproti PCR metóde podstatne nižšiu výpovednú hodnotu.
Tab. 2. Porovnanie jednotlivých metód prenatálnej a postnatálnej diagnostiky cCMV infekcie.
Tab. 2. Comparison of prenatal and postnatal diagnostic methods of cCMV infection.
IgM – imunoglobulín M, IgG – imunoglobulín G, PCR – polymerázová reťazová reakcia Tab. 3. Možnosti skríningových vyšetrení cCMV.
Tab. 3. Screening methods of cCMV.
CMV – cytomegalovírus, PCR polymerázová reťazová reakcia, EDTA – kyselina etyléndiamíntetraoctová Univerzálny skríning cCMV bol aktuálne zahrnutý medzi rutinné skríningové vyšetrenia len v jednom štáte, a to v Minnesote v USA (február 2022) [46]. Skríning cCMV sa aktuálne realizuje cielene po nesplnení kritérií pri novorodeneckom skríningu sluchu (nevýbavné otoakustické emisie) napríklad v niektorých štátoch USA (Connecticut, Texas, Utah a iné) [47]. Aktuálny konsenzus Medzinárodnej skupiny pre cytomegalovírusovú infekciu z roku 2017 [6] však odporúča zváženie zavedenia univerzálneho skríningu za účelom skorej diagnostiky a intervencie vrodenej senzorineurálnej poruchy sluchu a oneskoreného neurologického vývinu.
Sledovanie novorodencov
Dlhodobé sledovanie detí s cCMV je z ORL hľadiska potrebné kvôli možnému oneskoreniu manifestácie a fluktuujúcemu charakteru poruchy sluchu. Podľa britských odporúčaní NHS z roku 2019 [3] a Konsenzu Medzinárodnej skupiny pre cytomegalovírusovú infekciu z roku 2017 [6], by deti s cCMV mali absolvovať audiologické vyšetrenie (otoakustické emisie – OAE, sluchové kmeňové evokované potenciály – ABR) každých 3–6 mesiacov počas prvých 3 rokov života a následne každý rok. Dĺžka odporúčanej dispenzarizácie sa pohybuje medzi 6 a 19 rokmi života [6, 48].
Neurologické vyšetrenie je odporúčané v 1.–2. roku života za účelom zhodnotenia neurologického vývoja najmä u detí so symptomatickým ochorením a malo by sa posudzovať od prípadu k prípadu. Ďalšie klinické odporúčania sú zhrnuté v tab. 4 [3, 6].
Tab. 4. Doplňujúce vyšetrenia pri cCMV.
Tab. 4. Additional examinations in cCMV.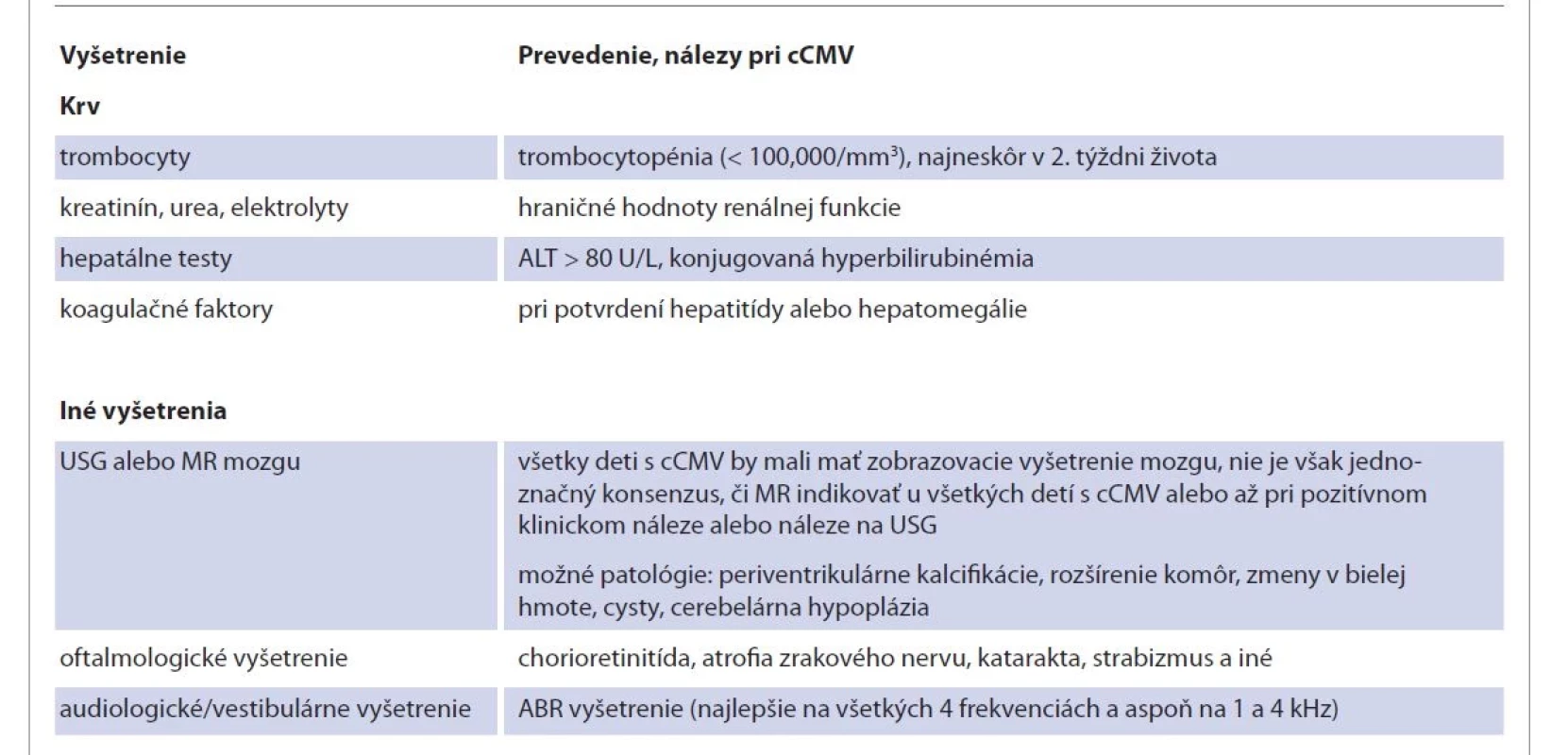
cCMV – kongenitálny cytomegalovírus, ALT – alanínaminotransferáza, USG – ultrasonografi a, MR – magnetická rezonancia, ABR – sluchové kmeňové evokované potenciály Liečba
Liečba novorodencov s kongenitálnou CMV infekciou musí zohľadňovať riziká/benefit vzhľadom na významnú toxicitu antivirotík. Vedľajšie účinky zahŕňajú neutropéniu (časté), gonadálnu dysgenézu a karcinogenicitu (možné). Medzi momentálne dostupné antivirotiká patrí intravenózny ganciklovir a orálny valganciklovir. Pozitívny vplyv liečby i. v. ganciklovirom v trvaní 6 týždňov ako prevencie deteriorácie sluchu u novorodencov s neurologickými symptómami cCMV bol dokázaný už v roku 2003 [49]. Ako alternatíva s nižším rizikom nežiaducich účinkov sa neskôr ukázala liečba orálnym valganciklovirom, rovnako po dobu 6 týždňov [50], ktorá je v súčasnosti preferovaná. Dĺžka liečby antivirotikami je dôležitá pre zlepšenie sluchu a neurologický vývoj detí najmä z dlhodobého hľadiska. Aplikácia orálneho valgancikloviru v trvaní 6 mesiacov nemala signifikantný efekt v čase ukončenia liečby, no následná starostlivosť ukázala významný vplyv po 12 a 24 mesiacoch [51]. Pravdepodobnosť zlepšenia poruchy sluchu pri liečbe antivirotikami je nepriamo úmerná závažnosti poruchy sluchu, t. j. čím ľahšia je porucha sluchu, tým je vyššia pravdepodobnosť jej zlepšenia [52, 53]. Aktuálny konsenzus Medzinárodnej skupiny pre cytomegalovírusovú infekciu z roku 2017 odporúča liečbu valganciklovirom v trvaní 6 mesiacov u novorodencov s cCMV so stredne ťažkou až ťažkou symptomatológiou. Kvôli monitorovaniu nežiaducich účinkov liečby je dôležité pravidelné vyšetrenie krvného obrazu v týždňových intervaloch do 6. týždňa, v 8. týždni a následne každý mesiac po dobu trvania liečby. Vyšetrenie hepatálnych enzýmov by malo byť realizované každý mesiac [6, 46]. Odpoveď na liečbu koreluje s virálnou dávkou v krvi a môže byť týmto spôsobom sledovaná [3]. Monitoring hladiny gancikloviru v krvi znižuje riziko pod - alebo predávkovania, a tým aj zníženie výskytu rezistencie na liečbu alebo nežiaducich účinkov [6, 46]. Hladinu valgancikloviru v krvi podľa najnovších postupov nie je potrebné monitorovať [3]. Asymptomatickí novorodenci a novorodenci s izolovanou SNHL by nemali byť liečení antivirotikami, hoci minimálne druhý prípad je predmetom ďalších prebiehajúcich štúdií, a preto je vývoj problematiky potrebné naďalej pozorne sledovať. Rovnako novorodencom s miernymi príznakmi by nemali byť rutinne podávané antivirotiká. Rozhodovanie o liečbe od prípadu k prípadu je takisto možné. Je dôležité však aby výsledky boli starostlivo zaznamenávané a prispeli k celkovému porozumeniu bezpečnosti liečby v týchto prípadoch [6]. Všetky deti so symptomatickou cCMV infekciou alebo asymptomatickou infekciou s izolovanou SNHL by mali byť odoslané na infektologické vyšetrenie [54].
Prevencia
V prevencii cCMV je dôležitý vývoj efektívnej CMV vakcíny. Tento proces je komplikovaný zložitosťou maternálnej imunity a rizikom reinfekcie novým variantom. Najnovšie štúdie s rekombinantnou živou atenuovanou CMV vakcínou ukazujú sľubné výsledky na zvieracích modeloch v zmysle zníženia transplacentálneho prenosu infekcie a mortality plodu [55]. Ďalším typom sú subjednotkové vakcíny, založené hlavne na povrchovom glykoproteíne B. V 2. fáze klinickej štúdie rekombinantnej subjednotkovej vakcíny glykoproteínu B a adjuvantu MF59 u séronegatívnych matiek postpartum sa dokázala približne 50 % účinnosť vakcíny [56].
V súčasnosti je však dôležitá hlavne prevencia CMV infekcie matky počas gravidity. Všetky ženy, ktoré sú tehotné alebo sa pokúšajú otehotnieť, by mali byť poučené o praktikách prevencie CMV. Medzi tie patrí hygiena rúk pri kontakte s močom, stolicou alebo slinami dieťaťa, obmedzenie kontaktu so slinami pri bozkávaní dieťaťa a vyhýbanie sa zdieľaniu jedla, pitia, príborov a zubných kefiek [57].
Záver
Kongenitálna CMV infekcia je dôležitým etiologickým faktorom vývinu senzorineurálnej poruchy sluchu a neurologických porúch u novorodencov a detí. Priebeh infekcie môže byť od asymptomatického až po ťažké multiorgánové zlyhávanie. Pretože až 90 % novorodencov je pri narodení bezpríznakových, cCMV infekcia zostáva väčšinou nediagnostikovaná a skríning sluchu novorodencov (na Slovensku povinný od roku 2006) takúto poruchu sluchu nemusí zachytiť. Identifikácia novorodencov s cCMV je dôležitá pre skorý manažment poruchy sluchu, oneskoreného neurologického vývinu a oftalmologických ťažkostí. Prenatálne vyšetrenie CMV je odporúčané sporadicky a hlavne len u matiek s vysokým rizikom infekcie (napr. s prejavmi infekcie), a nezachytí teda všetky prípady cCMV. Cielený skríning cCMV pomocou PCR zo slín novorodencov je neinvazívny, dostupný, opakovateľný a spoľahlivý a v súčasnosti zavádzaný do praxe vo viacerých rozvinutých krajinách. Univerzálny skríning bol zatiaľ uvedený do praxe len v USA, Minnesote. Aktuálny konsenzus Medzinárodnej skupiny pre cytomegalovírusovú infekciu z roku 2017 však odporúča zváženie zavedenia univerzálneho skríningu za účelom skorej diagnostiky a intervencie vrodenej senzorineurálnej poruchy sluchu a oneskoreného neurologického vývinu. Preto naša práca súčasne predstavuje aj teoretickú prípravu na pilotnú štúdiu skríningu cCMV novorodencov na Novorodeneckej klinike M. Rusnáka SZU a UN v Bratislave, ktorý sme zaviedli v roku 2019.
Prehlásenie o konflikte záujmov
Autorka práce prehlasuje, že v súvislosti s témou, vznikom a publikovaním tohto článku nie je v žiadnom konflikte záujmov. Vznik a publikácia článku neboli podporované žiadnou farmaceutickou firmou. Prehlásenie platí aj pre všetkých spoluautorov.
ORCID autora
L. Varga ORCID 0000-0001-9141-3596.
Prijato k recenzii: 6. 6. 2022
Prijato do tlače: 28. 8. 2022
MUDr. RNDr. Lukáš Varga, Ph.D.
Klinika otorinolaryngológie a chirurgie hlavy a krku
LF UK a UN Bratislava
Antolská 11
851 07 Bratislava
Zdroje
1. Manicklal S, Emery VC, Lazzarotto T et al. The “silent” global burden of congenital cytomegalovirus. Clin Microbiol Rev 2013; 26 (1): 86–102. Doi: 10.1128/CMR.00062-12.
2. Boeckh M, Geballe AP. Cytomegalovirus: pathogen, paradigm, and puzzle. J Clin Invest 2011; 121 (5): 1673–1680. Doi: 10.1172/JCI45 449.
3. Balmer E. NHSGGC Guidelines: cytomegalovirus (CMV) – congenital infection. 2022 [online]. Dostupné z URL: https: //www.clinicalguidelines.scot.nhs.uk/nhsggc-guidelines/nhsggc-guidelines/neonatology/cytomegalovirus-cmv-congenital-infection/.
4. Gantt S, Dionne F, Kozak FK et al. Cost-effectiveness of universal and targeted newborn screening for congenital cytomegalovirus infection. JAMA Pediatr 2016; 170 (12): 1173–80. Doi: 10.1001/jamapediatrics.2016.2016.
5. Rawlinson WD, Palasanthiran P, Hall B et al. Neonates with congenital cytomegalovirus and hearing loss identified via the universal newborn hearing screening program. J Clin Virol 2018; 102 : 110–15. Doi: 10.1016/j.jcv.2018.03. 006.
6. Rawlinson WD, Boppana SB, Fowler KB et al. Congenital cytomegalovirus infection in pregnancy and the neonate: consensus recommendations for prevention, diagnosis, and therapy. Lancet Infect Dis 2017; 17 (6): 177–188. Doi: 10.1016/S1473-3099 (17) 30143-3.
7. Lanzieri TM, Kruszon-Moran D, Gambhir M et al. Influence of parity and sexual history on cytomegalovirus seroprevalence among women aged 20–49 years in the USA. Suppl Int J Gynecol Obstet 2016; 135 (1): 82–85. Doi: 10.1016/j.ijgo.2016.03.032.
8. Halwachs-Baumann G, Genser B, Danda M et al. Screening and diagnosis of congenital cytomegalovirus infection: a 5-y study. Scand J Infect Dis 2000; 32 : 137–142. Doi: 10.1080/003655400750045222.
9. Barbi M, Binda S, Caroppo S et al. Multicity Italian study of congenital cytomegalovirus infection. Pediatr Infect Dis J. 2006; 25 (2): 156–159. Doi: 10.1097/01.inf.0000199261.98769.29.
10. Numazaki K, Fujikama T. Chronological changes of incidence and prognosis of children with asymptomatic congenital cytomegalovirus infection in Sapporo, Japan. BMC Infect Dis 2004; 4 (1): 1–5. Doi: 10.1186/1471-2334 - -4-22.
11. Yinon Y, Yagel S, Tepperberg-Dikawa M et al. Prenatal diagnosis and outcome of congenital cytomegalovirus infection in twin pregnancies. BJOG 2006; 113 (3): 295–300. Doi: 10.1111/j.1471-0528.2006.00854.x.
12. Kenneson A, Cannon MJ. Review and meta-analysis of the epidemiology of congenital cytomegalovirus (CMV) infection. Rev Med Virol 2007; 17 (4): 253–276. Doi: 10.1002/rmv. 535.
13. Goderis J, Leenheer E de, Smets K et al. Hearing loss and congenital CMV infection: A systematic review. Pediatrics 2014; 134 (5): 972–982. Doi: 10.1542/peds.2014-1173.
14. Gantt S, Bitnun A, Renaud C et al. Diagnosis and management of infants with congenital cytomegalovirus infection. Paediatr Child Health 2017; 22 (2): 72–74. Doi: 10.1093/pch/pxx 002.
15. Zheng QY, Huynh KT, Zuylen WJ et al. Cytomegalovirus infection in day care centres: A systematic review and meta-analysis of prevalence of infection in children. Rev Med Virol 2019; 29 (1): 2011. Doi: 10.1002/rmv.2011.
16. Dobbie AM. Evaluation and management of cytomegalovirus-associated congenital hearing loss. Curr Opin Otolaryngol Head Neck Surg 2017; 25 (5): 390–395. Doi: 10.1097/MOO.0000 000000000401.
17. Enders G, Daiminger A, Bäder U et al. Intrauterine transmission and clinical outcome of 248 pregnancies with primary cytomegalovirus infection in relation to gestational age. J Clin Virol 2011; 52 (3): 244–46. Doi: 10.1016/j.jcv.2011.07.005.
18. Bodéus M, Benoit KM, Zech F et al. Human cytomegalovirus in utero transmission: follow-up of 524 maternal seroconversions. J Clin Virol 2010; 47 (2): 201–202. Doi: 10.1016/j.jcv.2009.11.009.
19. Bodéus M, Hubinont C, Goubau P. Increased risk of cytomegalovirus transmission in utero during late gestation. Obstet Gynecol 1999; 93 (5 Pt 1): 658–660. Doi: 10.1016/S0029 - 7844 (98) 00538-9.
20. Wang C, Zhang X, Bialek S et al. Attribution of congenital cytomegalovirus infection to primary versus non-primary maternal infection. Clin Infect Dis 2011; 52 (2): 11–13. Doi: 10.1093/cid/ciq085.
21. Dollard SC, Grosse SD, Ross DS. New estimates of the prevalence of neurological and sensory sequelae and mortality associated with congenital cytomegalovirus infection. Rev in Med Virol 2007; 17 (5): 355–363. Doi: 10.1002/r mv.544.
22. Lanzieri TM, Leung J, Caviness AC et al. Long--term outcomes of children with symptomatic congenital cytomegalovirus disease. J Perinatol 2017; 37 (7): 875–880. Doi: 10.1038/jp.2017.41.
23. Ríos-Barnés M, Fortuny C, Alarcón A et al. Renal involvement in congenital cytomegalovirus infection: a systematic review. Microorganisms 2021; 9 (6): 1304. Doi: 10.3390/microorganisms9061304.
24. Foulon I, Naessens A, Foulon W et al. Hearing loss in children with congenital cytomegalovirus infection in relation to the maternal trimester in which the maternal primary infection occurred. Pediatrics 2008; 122 (6): 1123–1127. Doi: 10.1542/peds.2008-0770.
25. Ross SA, Fowler KB, Ashrith G et al. Hearing loss in children with congenital cytomegalovirus infection born to mothers with preexisting immunity. J Pediatr 2006; 148 (3): 332–336. Doi: 10.1016/j.jpeds.2005.09.003.
26. Schuknecht HF. Pathology of the ear. In: Merchant SN, Nadol JB, Schuknecht HF. Pathology of the Inner Ear. 2nd ed. CT: People‘s Medical Pub. House-USA 1993 : 687.
27. Fukuda S, Keithley EM, Harris JP. Experimental cytomegalovirus infection: viremic spread to the inner ear. Am J Otolaryngol 1988; 9 (3): 135–141. Doi: 10.1016/s0196-0709 (88) 80 019-x.
28. Carraro M, Almishaal A, Hillas E et al. Cytomegalovirus (CMV) infection causes degeneration of cochlear vasculature and hearing loss in a mouse model. J Assoc Res Otolaryngol 2017; 18 (2): 263–273. Doi: 10.1007/s10162-016 - 0606-4.
29. Keithley EM, Woolf NK, Harris JP. Development of morphological and physiological changes in the cochlea induced by cytomegalovirus. Laryngoscope 1989; 99 (4): 409–414. Doi: 10.1288/00005537-198904000-00 010.
30. Corazzi V, Hatzopoulos S, Bianchini C et al. Vestibular and postural impairment in congenital cytomegalovirus infection. Int J Pediatr Otorhinolaryngol 2022; 152 : 111005. Doi: 10.1016/j.ijporl.2021.111005.
31. Tanimura K, Yamada H. Potential biomarkers for predicting congenital cytomegalovirus infection. Int J Mol Sci 2018; 19 (12): 3760. Doi: 10.3390/ijms19123760.
32. Hughes BL, Gyamfi-Bannerman C. Diagnosis and antenatal management of congenital cytomegalovirus infection. Am J Obstet Gynecol 2016; 214 (6): B5–B11. Doi: 10.1016/j.ajog.2016.02.042.
33. Tanimura K, Tairaku S, Morioka I et al. Universal screening with use of immunoglobulin G avidity for congenital cytomegalovirus infection. Clin Infect Dis 2017; 65 (10): 1652–1658. Doi: 10.1093/cid/cix621.
34. Liesnard C, Donner C, Brancart F et al. Prenatal diagnosis of congenital cytomegalovirus infection: prospective study of 237 pregnancies at risk. Obstet and Gynecol 2000; 95 (6): 881–888. Doi: 10.1016/s0029-7844 (99) 00657-2.
35. Yinon Y, Farine D, Yudin MH et al. Cytomegalovirus infection in pregnancy. J Obstet Gynaecol 2010; 32 (4): 348–354. Doi: 10.1016/S1701-2163 (16) 34480-2.
36. Tanimura K, Tairaku S, Morioka I et al. Universal screening with use of immunoglobulin G avidity for congenital cytomegalovirus infection. Clin Infect Dis 2017; 65 (10): 1652–1658. Doi: 10.1093/cid/cix621.
37. Ohyama S, Fujioka K, Fukushima S et al. Diagnostic value of cytomegalovirus IgM antibodies at birth in PCR-Confirmed congenital cytomegalovirus infection. Int J Mol 2019; 20 (13): 3239. Doi: 10.3390/ijms20133239.
38. Vries JJC, Eijk AA, Wolthers KC et al. Real-time PCR versus viral culture on urine as a gold standard in the diagnosis of congenital cytomegalovirus infection. J Clin Virol 2012; 53 (2): 167–170. Doi: 10.1016/j.jcv.2011.11.006.
39. Smiljkovic M, Le Meur JB, Malette B et al. Blood Viral Load in the Diagnostic Workup of Congenital Cytomegalovirus Infection, J Clin Virol 2019; 122 : 104231. Doi: 10.1016/j.jcv.2019. 104231.
40. Marsico C, Aban I, Kuo H et al. Blood Viral Load in Symptomatic Congenital Cytomegalovirus Infection. J Infect Dis 2019; 219 (9): 1398–1406. Doi: 10.1093/infdis/jiy695.
41. Boppana SB, Ross SA, Shimamura M et al. Saliva polymerase-chain-reaction assay for cytomegalovirus screening in newborns. N Engl J Med 2011; 364 (22): 2111–2118. Doi: 10.1056/ NEJMoa1006561.
42. Yamamoto AY, Mussi-Pinhata MM, Marin LJ et al. Is saliva as reliable as urine for detection of cytomegalovirus DNA for neonatal screening of congenital CMV infection? J Clin Virol 2006; 36 (3): 228–230. Doi: 10.1016/j.jcv.2006.03. 011
43. Luck SE, Wieringa JW, Blázquez-Gamero D et al. Congenital cytomegalovirus a European expert consensus statement on diagnosis and management. Pediatr Infect Dis J 2017; 36 (12): 1205–1213. Doi: 10.1097/INF.0000000000001 763.
44. Huang Y, Wang H, Li T et al. Comparison of detection strategies for screening and confirming congenital cytomegalovirus infection in newborns in a highly seroprevalent population: a mother-child cohort study. Lancet Reg Health West Pac 2021; 12 : 100182. Doi: 10.1016/j.lanwpc.2021.100182
45. Boppana SB, Ross SA, Novak Z et al. Dried blood spot real-time polymerase chain reaction assays to screen newborns for congenital cytomegalovirus infection. JAMA 2010; 303 (14): 1375–1382. Doi: 10.1001/jama.2010.423.
46. Minnesota Department of Health. News release: Congenital cytomegalovirus approved for addition to newborn screening panel. 2022 [online]. Dostupné z: https: //www.health.state.mn.us/news/pressrel/2022/newborn020222.html.
47. Yassine BB, Hulkower R, Dollard S et al. A Legal Mapping Assessment of Cytomegalovirus-Related Laws in the United States. J Public Health Manag Pract 2022; 28 (2): E624–629. Doi: 10.1097/PHH.0000000000001401.
48. Children’s Health Quensland Hospital and Health Service. Treatment Guideline for Infants with Congenital CMV Disease (cCMV). 2022 [online]. Dostupné z: https: //www.childrens.health.qld.gov.au/wp-content/uploads/PDF/ams/gdl-01005.pdf.
49. Kimberlin DW, Lin CY, Sánchez PJ et al. Effect of ganciclovir therapy on hearing in symptomatic congenital cytomegalovirus disease involving the central nervous system: a randomized, controlled trial. J Ped 2003; 143 (1): 16–25. Doi: 10.1016/s0022-3476 (03) 00192-6.
50. Kimberlin DW, Acosta EP, Sánchez PJ et al. Pharmacokinetic and pharmacodynamic assessment of oral valganciclovir in the treatment of symptomatic congenital cytomegalovirus disease. J Infect Dis 2008; 197 (6): 836–845. Doi: 10.1086/528376.
51. Kimberlin DW, Jester PM, Sánchez PJ et al. Valganciclovir for symptomatic congenital cytomegalovirus disease. N Engl J Med 2015; 372 (10): 933–943. Doi: 10.1056/NEJMoa1404 599.
52. Bilavsky E, Shahar-Nissan K, Pardo J et al. Hearing outcome of infants with congenital cytomegalovirus and hearing impairment. Arch Dis Child 2016; 101 (5): 433–438. Doi: 10.1136/archdischild-2015-309154.
53. Jenks CM, Mithal LB, Hoff SR. Early identification and management of congenital cytomegalovirus. Otolaryngol Clin North Am 2021; 54 (6): 1117–1127. Doi: 10.1016/j.otc.2021.06. 006.
54. Barton M, Forrester MA, Jane M. Update on congenital cytomegalovirus infection: Prenatal prevention, newborn diagnosis, and management. 2020 [online]. Paediatr Child Health 2020; 25 (6): 395. Dostupné z: https: //cps.ca/documents/position/update-on-congenital-cytomegalovirus-infection-prenatal-prevention-newborn-diagnosis-and-management.
55. Schleiss MR, Bierle CJ, Swanson EC et al. Vaccination with a live attenuated cytomegalovirus devoid of a protein kinase R inhibitory gene results in reduced maternal viremia and improved pregnancy outcome in a guinea pig congenital infection model. J Virol 2015; 89 (19): 9727–9738. Doi: 10.1128/JVI.01419-15.
56. Pass RF, Zhang C, Evans A et al. Vaccine prevention of maternal cytomegalovirus infection. N Engl J Med 2009; 360 (12): 1191–1199. Doi: 10.1056/NEJMoa0804749.
57. Pesch MH, Saunders NA, Abdelnabi S. Cytomegalovirus Infection in Pregnancy: Prevention, Presentation, Management and Neonatal Outcomes. J Midwifery Womens Health 2021; 66 (3): 397–402. Doi: 10.1111/jmwh.13228.
Štítky
Audiológia a foniatria Detská otorinolaryngológia Otorinolaryngológia
Článok vyšiel v časopiseOtorinolaryngologie a foniatrie
Najčítanejšie tento týždeň
2022 Číslo 4- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Sekundárna imunodeficiencia z pohľadu hematoonkológa
-
Všetky články tohto čísla
- Editorial
- Úloha FEES a dysfagiologického týmu v péči o pacienty po CMP v Nemocnici České Budějovice
- Kompartmentová chirurgia jazyka
- Vrodená cytomegalovírusová infekcia z pohľadu otorinolaryngológa
- Chronické rinosinusitidy odontogenní etiologie
- Orofaryngeální forma tularemie s kožními projevy: Sweetův syndrom
- Ochrnutie hrtana spôsobené generalizovanou infekciou vírusom varicela zoster – kazuistika
- Poděkování recenzentům
- Neobvyklý případ dvojité fistulizace branchiogenní cysty
- Monografie – Respirační papilomatóza
- Erratum
- 20. Česko-německé ORL dny, 15.–17. září 2022 v Plzni
- 6th Congress of European ORL-HNS
- 61. Otologický den v Hradci Králové
- Otorinolaryngologie a foniatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Chronické rinosinusitidy odontogenní etiologie
- Kompartmentová chirurgia jazyka
- Vrodená cytomegalovírusová infekcia z pohľadu otorinolaryngológa
- Úloha FEES a dysfagiologického týmu v péči o pacienty po CMP v Nemocnici České Budějovice
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



